1.公开了药物组合物、用于治疗产生可移动粘菌素耐药蛋白抑制剂的细菌感染的方法、用于调节可移动粘菌素耐药蛋白抑制剂活性的方法和制备药物组合物的方法。
背景技术:
2.自20世纪40年代在临床上引入青霉素以来,抗微生物耐药性(amr)一直是世界性的危机。近年来,粘菌素,一种多粘菌素e家族抗生素,被视为针对广泛耐药(xdr)的革兰氏阴性细菌感染的最后一线抗生素。尽管细菌中的磷酸乙醇胺(petn)转移酶可以催化磷酸乙醇胺加成到脂质a并且随后通过削弱带正电的粘菌素和带负电的细胞膜之间的静电相互作用来诱导粘菌素耐药性,但由于染色体介导,其基因传播速度受限。在2015年,被称为可移动粘菌素耐药基因(mobile colistin resistance gene,mcr)的petn转移酶基因首次被鉴定为质粒介导,导致对粘菌素的高传播性耐药性。第一种mcr基因编码的跨膜petn转移酶被标示为mcr-1,并且由于其结构相似性,可以归属于碱性磷酸酶(ap)金属酶超家族的一员。结晶学研究揭示,辅因子zn
2
与glu
246
、asp
465
、his
466
和磷酸化thr
285
以四面体几何形状相互作用,因此,根据eucast,有助于细菌病原体从粘菌素敏感性(粘菌素最小抑制浓度(mic):0.25-1μg ml-1
)脱敏为粘菌素耐药性(粘菌素mic:4-32μg ml-1
)。其快速传播使mcr-1能够与超级细菌中的其他耐药基因共存。更严重的是,最近的报告发现了在人类、动物和其他环境样品中发现的各种细菌品种之间的mcr基因的分子进化。随着新型抗微生物剂的开发受限,mcr及其变体的产生进一步加剧了危机,迫使我们提出替代策略。
3.包含可用抗生素和非抗生素伙伴的联合疗法已被视为多种抗生素疗法和开发新抗生素单一疗法的更经济和有效的替代方案。联合疗法现在频繁用于临床治疗方案,其代表是用(头孢他啶和阿维巴坦联用)治疗产生丝氨酸-β-内酰胺酶(sbl)的超级细菌引起的感染。
技术实现要素:
4.以下阐述了本发明的简要概括以提供对本发明一些方面的基本理解。该概括并非是对发明的广泛综述。其既不旨在标识发明的关键或重要要素,也不旨在描绘发明的范围。其唯一目的是以简要形式介绍一些概念,作为稍后阐述的更详细描述的序言。
5.本文公开了药物组合物,包含:(a)多粘菌素抗生素和(b)可移动粘菌素耐药蛋白(mcr)抑制剂。在一个实施方式中,抑制剂涉及银/金化合物或其药学上可接受的盐。还提供了用于预防或治疗产生mcr的细菌感染的方法。本公开还提供了制备包含多粘菌素抗生素和mcr抑制剂的组合物的方法。本公开还涉及通过银/金化合物调节mcr活性。mcr抑制剂经由多种机理调节mcr活性,包括金属置换、干扰底物结合和增强几种重要氨基酸的刚性。在某些实施方式中,所公开的组合物包含如下化合物:其是用于治疗表面(topical)细菌感染、局部(local)细菌感染和/或全身细菌感染的广谱抗菌剂。在某些实施方式中,所公开的化合物用于治疗由产生mcr的细菌性病原体引起的感染。
6.为实现以上和相关目的,本发明包括在下文中详细描述和在权利要求中特别指出的特征。以下说明和附图详细阐述了本发明的某些说明性方面和实施方案。然而,这些仅表示可以采用本发明原理的各种方式中的一些。当结合附图考虑时,本发明的其他目的、优点和新特征将从本发明的以下详细描述中变得显而易见。
附图说明
7.图1显示了示例性银/金化合物的化学结构,包括磺胺嘧啶银、醋硫葡金、氯(三乙基膦)金(i)(au(pet3)cl)、金硫葡糖、硫代硫酸金和硫代苹果酸金。
8.图2(a)显示了(a)mcr-1-s酶的活性位点囊中的四核银簇的结构。ag(i)显示为在窄囊中通过共价键(红色实线)或氢键(红色虚线)桥接的麦色球,和(b)au-mcr-1-s(pdb id:6li6)的活性位点结构,au离子的异常密度峰显示为紫色球,au的异常密度峰以品红色网格显示。
9.图3显示了分别与载脂蛋白-mcr-1-s结合的(a)ag(i)(作为agno3)、(b)au(i)(作为aucl)和(c)zn(ii)(作为醋酸锌(ii))的等温热滴定(itc)分析。
10.图4显示了通过4-(2-吡啶偶氮基)间苯二酚(par)分析揭示的通过(a)ag(i)(作为agno3)和(b)au(i)(作为aucl)从zn-mcr-1释放zn(ii)。
11.图5(a-b)显示了通过icp-ms测定的通过(a)agno3、(b)auc来取代mcr-1中的zn(ii)。(c-d)显示无论是(c)ag(i)-mcr-1-s还是(d)au(i)mcr-1-s的活性均不能通过添加zn(ii)来恢复。
12.图6显示(a)agno3和(b)醋硫葡金和au(pet3)cl分别对nbd-甘油-3-pea的zn-mcr-1裂解试验的抑制作用。在这里显示了tlc板的代表性图像。
13.图7通过细胞热位移分析显示(a)agno3和(b)醋硫葡金与细菌细胞中的mcr-1结合。
14.图8显示了当分别用(a)agno3和(b)醋硫葡金或au(pet3)cl治疗mcr-1阳性和mcr-1阴性弗氏志贺菌(s.flexneri)时的膜电位变化,其通过绿色荧光信号与红色荧光信号之比测定。
15.图9(a-b)显示了粘菌素和(a)硝酸银或(b)醋硫葡金针对产生mcr-1的细菌的临床分离株的棋盘mic分析的热图。(c-d)显示了在不存在或存在(c)agno3、agnps或(d)aucl的情况下针对mcr阳性或mcr阴性大肠杆菌(e.coli)的粘菌素mic。(e-f)显示了粘菌素和(c)agno3和(d)aucl之间的联合疗法针对产生mcr-1的细菌菌株的均等兴奋(isobolic)曲线。
16.图10显示了在用(a)媒介物、粘菌素、agno3或其组合和(b)媒介物、粘菌素、醋硫葡金或其组合来治疗至多24小时之后对mcr-1阳性大肠杆菌的对数期时间杀伤曲线。
17.图11揭示了分别与(a)agno3和(b)醋硫葡金联用时,产生mcr-1变体和mcr同源物的大肠杆菌j53的col mic的降低。
18.图12(a-b)显示了在(a)agno3和(b)醋硫葡金存在下粘菌素对产生mcr-1的大肠杆菌的防突变浓度。(c-d)显示了在产生mcr-1的大肠杆菌的连续传代期间,分别在相同浓度的(c)agno3和(d)醋硫葡金下使用亚抑制浓度的粘菌素或其组合的耐药性获得曲线。插图显示了连续传代之后mcr-1的标准化表达水平。
19.图13(a)-(h)显示了在细胞侵入模型中,在暴露于与(a-b)agno3或(c-h)不同尺寸
的agnps联用的粘菌素之后的细菌密度和细胞活力。
20.图14(a-b)显示了受亚致死剂量的肺炎克雷伯菌(k.pneumoniae)9607(mcr-1
)感染的balb/c小鼠的肝脏和脾脏中的细菌负荷。感染小鼠组分别接受(a)媒介物、agno3、粘菌素或其组合和(c-d)媒介物、醋硫葡金、粘菌素或其组合的单剂量腹膜内施用。
具体实施方式
21.本文公开了药物组合物,包含:(a)多粘菌素抗生素和(b)可移动粘菌素耐药蛋白(mcr)抑制剂。在一个实施方式中,抑制剂涉及银/金化合物或其药学上可接受的盐。还提供了用于预防或治疗产生mcr的细菌感染的方法。本公开还提供了制备包含多粘菌素抗生素和mcr抑制剂的组合物的方法。本公开还涉及通过银/金化合物调节mcr活性。mcr抑制剂经由多种机理调节mcr活性,包括金属置换、干扰底物结合和增强几种重要氨基酸的刚性。在某些实施方式中,所公开的组合物包含如下化合物:其显示抗耐药性能力以减缓产生mcr的细菌中mcr耐药性的发展。在某些实施方式中,所公开的组合物包含如下化合物:其是用于治疗局部和/或全身细菌感染的广谱抗菌剂。在某些实施方式中,所公开的化合物用于治疗由产生mcr的细菌性病原体引起的感染。
22.本文提供了组合物,包含:(a)多粘菌素抗生素和(b)mcr抑制剂。抑制剂涉及银/金化合物或其药学上可接受的盐。mcr抑制剂用于经由多种机理调节mcr活性。此外,mcr抑制剂为用于治疗产生mcr的细菌性病原体引起的感染的有效的多粘菌素抗生素伙伴。
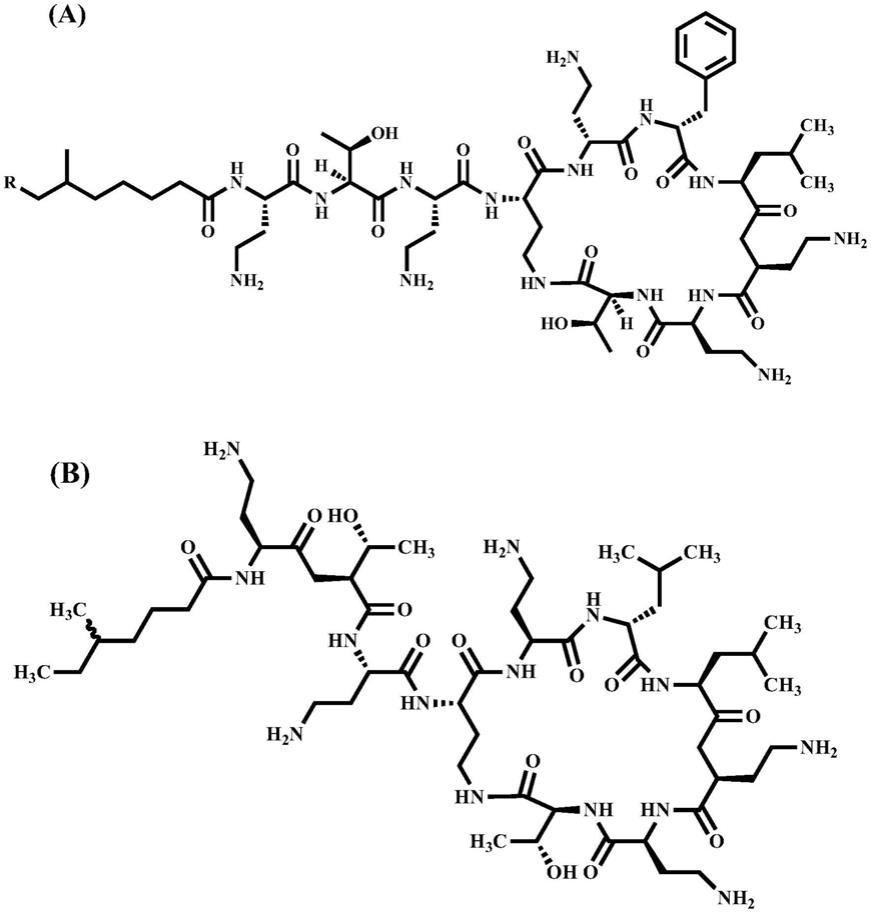
23.在某些实施方式中,通过所公开的组合物治疗的感染由对多粘菌素抗生素耐药的细菌引起。多粘菌素或多粘菌素抗生素是多肽抗生素。多粘菌素的示例包括但不限于多粘菌素b(如多粘菌素b1、多粘菌素b2)和多粘菌素e(如粘菌素a和粘菌素b)。在某些实施方式中,多粘菌素抗生素具有以下结构:
[0024][0025]
多粘菌素结构:(a)多粘菌素b:r=h为多粘菌素b1;r=ch3为多粘菌素b2;(b)多粘菌素e(粘菌素)。
[0026]
在某些实施方式中,细菌为革兰氏阴性的,包括但不限于鼠伤寒沙门氏菌(salmonella typhimurium)、弗氏志贺菌(shigella flexneri)、肺炎克雷伯菌(klebsiella pneumoniae)、大肠杆菌(escherichia coli)、产气肠杆菌(enterobacter aerogenes)、阿斯肠杆菌(enterobacter asburiae)、神户肠杆菌(enterobacter kobei)。在某些实施方式中,这些革兰氏阴性细菌产生mcr。在某些实施方式中,mcr-1变体包括mcr-1.1、mcr-1.5、mcr-1.6、mcr-1.7、mcr-1.9和mcr-1.10。在某些实施方式中,mcr变体包括mcr-2.1、mcr-3.1、mcr-4.1、mcr-5.1、mcr-6.1、mcr-7.1。
[0027]
本文提供了包含银/金化合物或其药学上可接受的盐的组合物。在某些实施方式中,银化合物为(a)银(i)化合物或(b)银纳米颗粒。在某些实施方式中,银(i)复合物包括但不限于硝酸银(agno3)和磺胺嘧啶银。在某些实施方式中,银纳米颗粒包括商品化的具有不同纳米尺寸(10nm、40nm、100nm)的银纳米颗粒(agnps)。在某些实施方式中,金化合物包括(a)金(i)化合物或(b)金纳米颗粒。在某些实施方式中,金(i)化合物包括但不限于醋硫葡
金、氯化金(i)(aucl)、金硫葡糖、硫代硫酸金、氯(三乙基膦)金(i)(au(pet)3cl)和硫代苹果酸金。在某些实施方式中,金纳米颗粒包括商品化的具有不同纳米尺寸(20nm、40nm、100nm)的纳米金颗粒。
[0028]
在另一实施方式中,银纳米颗粒和/或金纳米颗粒具有在3nm至250nm范围的各种尺寸。在仍然另一实施方式中,银纳米颗粒和/或金纳米颗粒具有在5nm至200nm范围的各种尺寸。
[0029]
本文还提供了使用银/金化合物调节mcr活性的方法。在某些实施方式中,mcr抑制剂经由多种机理调节mcr活性,包括金属置换、干扰底物结合和增强几种重要氨基酸的刚性。本文提供了治疗细菌感染的方法。本文提供了药物组合物,包含:(a)多粘菌素抗生素和(b)mcr抑制剂,作为用于治疗产生mcr的细菌感染的药物。本文所述的组合物还显示抗耐药性能力以减缓产生mcr的细菌中mcr耐药性的发展。
[0030]
定义
[0031]
本文中的术语“抗生素”是指杀死细菌或抑制细菌生长的化合物,本文中的术语“抗微生物剂”是指杀死微生物(包括病毒)或抑制微生物(包括病毒)生长的化合物。术语“耐药性”和“发展耐药性”是指化合物减少细菌生长或阻止细菌生长有任何增加的能力损失。本文中的术语“抗微生物耐药性(amr)”或“抗生素耐药性”是指微生物或细菌抵抗这些化合物的能力,这些化合物曾经能成功地单独治疗由这些微生物或细菌引起的感染。
[0032]
本文中的“粘菌素(colistin)”属于多粘菌素e家族抗生素,其具有对抗很多种革兰氏阴性细菌的扩大广谱的抗菌活性,并且被表征为最后一线抗生素。其包含很多氨基基团,因此在特定ph环境中转为带正电荷。其可以通过静电相互作用与lps结合,随后通过增加膜通透性释放关键细胞成分,并且因渗透不稳定或自溶作用导致细菌死亡。在该实施方式中,粘菌素的结构由下式表示:
[0033]
本文中的术语“mcr-1”是指一种磷酸乙醇胺(petn)转移酶,由细菌产生,使其能催化磷酸乙醇胺转移到脂质a,然后削弱成员正电荷以抵抗多粘菌素e家族抗生素粘菌素。本文中的术语“mcr-1”是指其dna基因,其可以被转移到mrna中,随后翻译到mcr-1蛋白质中。本文中的术语“mcr-1变体”是指来源于mcr-1单个基因或mcr-1基因家族的一组高度相似的蛋白质的成员。本文中的术语“其他mcr”是指来源于mcr单个基因或mcr基因家族的一组高度相似的蛋白质的成员。术语“产生mcr的细菌”、“产生mcr-1的细菌”或“携带mcr基因的细菌”是指天然或通过分子生物学试剂(如异丙基b-d-1-硫代半乳糖苷(iptg))诱导产生mcr-1或mcr家族蛋白质的细菌。
[0034]
术语“联合疗法”是指使用多于一种药物或方式的疗法,通常,这些术语是指使用多种疗法来治疗单一疾病,并且通常所有疗法都是药物疗法。相应地,术语“单一疗法”是指任何仅使用一种药物的疗法。
[0035]
本文所述的术语“抑制剂”是指能与酶结合并且阻止该酶进行催化反应的分子。本文所述的术语“增效剂”是指能增强指定抗生素(如粘菌素)杀死细菌感染中的细菌或抑制其生长的作用的药物、草药或化学品。
[0036]
术语“银/金化合物”是指(1)银化合物,包括但不限于agno3和磺胺嘧啶银或具有不同尺寸的agnp,(2)金化合物,包括但不限于醋硫葡金、aucl、金硫葡糖、硫代硫酸金、au(pet)3cl和硫代苹果酸金或具有不同尺寸的aunp,以及其药学上可接受的盐、酸盐、酯或水
合物。
[0037]
术语“协同作用”是指当联用作用大于单个组分作用之和时两种或更多种化合物或化学品之间的相互作用。
[0038]
术语“体外”是指使用微生物、细胞和生物分子在其正常生物背景之外进行的实验。术语“体内”是指使用完整的、活的生物体而不是部分或死亡的生物体进行的实验,其主要以动物研究和临床试验为代表。
[0039]
术语”减少细菌生长”包括干扰细菌细胞生长或过程,其可以通过细胞数量减少、细胞分裂减少来确定。
[0040]
术语“细胞毒性”是指对细胞有毒的性质。
[0041]
术语“恢复活性”是指无效或低效抗生素再次成为有效或高效抗生素的过程。
[0042]
术语“潜在的活性囊”或“活性位点”是指发生关键的酶催化反应的区域。术语“底物”涉及生物化学领域,这表示底物是酶所作用的物质。术语“底物结合位点”是指底物可与酶相互作用的区域。
[0043]
术语“生物化学方法”是指那些在生物化学领域中使用的惯常实验技术,在本文中包括分子克隆、蛋白质表达和纯化、以及蛋白质表征。术语“分子克隆”是指将所需dna片段工程改造为载体的一般方法,其可以保持和保存该片段并且指导其在宿主细胞中的自我复制。术语“蛋白质表达和纯化”涉及宿主细胞受到一些小分子刺激或者未受刺激来产生足够的实验所需蛋白质,以及将其与细胞中存在的其他不想要的分子分离以提高其均匀性。术语“过表达系统”或“原生系统”各自指的是使用刺激剂的情况或不使用刺激剂的情况。
[0044]
术语“蛋白质表征”或“生物物理特性”是指通过各种物理和生物化学技术获知的这些蛋白质性质,包括纯化蛋白质的结构和功能。
[0045]
术语“金属含量或金属比率”是指金属离子与蛋白质之比。术语“时间依赖性吸光度”和“剂量依赖性吸光度”各自指的是通过呈现时间或者添加剂量的变量值来确定化合物的吸光度的现象。
[0046]
术语“临床相关敏感范围”是指基于可获得的药物、测试化合物和临床试验的血清浓度,被认为生物体敏感的抑制区或mic区。术语“药学上可接受的盐”是指本文提供的化合物的保留了生物性质并且对药物用途无毒和理想的任何盐。此类盐可以来源于本领域众所周知的各种有机和无机抗衡离子。
[0047]
术语“受试者”和“患者”在本文中可互换使用。术语“受试者(subject和subjects)”是指动物,如哺乳动物,包括非灵长类动物(例如,牛、猪、马、猫、狗、大鼠和小鼠)和灵长类动物(例如,猴子(如食蟹猴)、黑猩猩和人类)。
[0048]
术语“需要其的受试者”是指具有细菌感染的受试者,或者处于发展细菌感染的风险的受试者。受试者可以被诊断为具有本文所述的此类细菌感染或使用本领域技术人员已知的标准药物技术。可替代地,受试者可以显示出细菌感染的一种或多种症状。
[0049]
术语“治疗剂(therapeutic agent和therapeutic agents)”是指可用于治疗或预防感染的任何试剂。在某些实施方式中,术语“治疗剂”包括本文提供的化合物。在一个实施方式中,治疗剂是被认为可用于治疗或预防感染的试剂或者已经或正在被用于治疗或预防感染的试剂。术语“化合物”、“试剂”和“药物”可互换。
[0050]
术语“治疗有效量”包括在施用给受试者以治疗感染时足以影响此类治疗的化合
物或组合物的量。“治疗有效量”可以根据化合物,感染及其严重程度,以及所治疗受试者的年龄、体重等而不同。
[0051]
在一个实施方式中,术语“治疗(treating或treatment”)任何感染是指改善受试者中存在的感染。在另一实施方式中,“治疗(treating或treatment”)包括改善至少一种物理参数,该参数可能是受试者不能辨识的。其旨在包括预防、改善、治愈、减少细菌生长或阻止任何细菌生长增加。
[0052]
术语“耐药”、“耐药性”和“发展耐药性”是指细菌或细菌感染对以前能有效减少细菌生长或阻止任何细菌生长增加的化合物或药物不再有应答。
[0053]
术语“约”是指数值的
±
0.5,或者其他值/术语的至多10%。
[0054]
术语“药物组合物”是指适合施用给受试者(如哺乳动物,尤其是人类)的组合物。通常,“药物组合物”是无菌的,优选不含能引起受试者的不理想反应的污染物(例如,药物组合物中的化合物是药品级的)。药物组合物可以设计为经由多种不同施用途径施用给需要其的受试者或患者,包括口服、静脉内、口腔、直肠、肠胃外、腹膜内、皮内、气管内、肌内、皮下、吸入等。
[0055]
术语“药学上可接受的载剂”、“药学上可接受的赋形剂”、“药学上可接受的稀释剂”或“药学上可接受的助剂”表示通常安全、无毒、在生理学和其他方面均无不理想的可用于制备药物组合物的赋形剂、稀释剂、载剂和/或助剂,包括对于兽医学用途和/或人类药学用途来说可接受的赋形剂、稀释剂、载剂和助剂。
[0056]
术语“药学上可接受的盐”是指可以通过制备其酸盐或碱盐来修饰的本公开的化合物。药学上可接受的盐是指保留了游离碱的生物有效性和任选的其他性质的那些盐,其可通过与例如盐酸、氢溴酸、硫酸、硝酸、磷酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸、苹果酸、马来酸、琥珀酸、酒石酸、柠檬酸等的无机或有机酸反应而获得。药学上可接受的盐的示例包括但不限于碱性残基(如胺)的无机酸盐或有机酸盐;以及酸性残基(如羧酸)的碱盐或有机盐。
[0057]
本文所用的术语“有效量”和“治疗有效量”是指所施用的组合物或药物制剂的实施方式的量将在一定程度上减轻所治疗的感染的一种或多种症状,和/或该量将在一定程度上预防接受治疗的受试者所具有或处于发展风险的感染的一种或多种症状。
[0058]“施用”表示将本公开的实施方式导入受试者中。施用可以包括多种途径,例如但不限于,可以使用静脉内、口服、局部、皮下、腹膜内、动脉内、吸入、阴道、直肠、经鼻、导入脑脊髓液中或灌注到体腔内。优选途径是口服施用。
[0059]
粘菌素和及其增效剂
[0060]
本文提供了一种新型广谱mcr抑制剂、银/金化合物或其药学上可接受的盐。抑制剂经由多种机理调节mcr活性,包括金属置换、干扰底物结合和增强几种重要氨基酸的刚性。
[0061]
本文提供了组合物,包含银/金化合物或其药学上可接受的盐。在某些实施方式中,银/金化合物或其药学上可接受的盐包括:(1)银化合物,包括但不限于agno3和磺胺嘧啶银或具有不同尺寸的agnp,(2)金化合物,包括但不限于醋硫葡金、aucl、金硫葡糖、硫代硫酸金、au(pet)3cl和硫代苹果酸金或具有不同尺寸的aunp。在一个实施方式中,多粘菌素抗生素与mcr抑制剂的摩尔比在基于重量(w/w)的1:100至100:1范围内。在另一实施方式
中,多粘菌素抗生素与mcr抑制剂的摩尔比在基于重量的16:1至64:1范围内。在仍然另一实施方式中,多粘菌素抗生素与mcr抑制剂的摩尔比在基于重量的25:1至50:1范围内。
[0062]
在一个实施方式中,本文中的药物组合物包含0.1wt%至99wt%的至少一种多粘菌素抗生素、0.01wt%至25wt%的至少一种mcr抑制剂和任选地0wt%至99.9wt%的至少一种药学上可接受的载剂。在另一实施方式中,本文中的药物组合物包含1wt%至95wt%的至少一种多粘菌素抗生素、0.1wt%至20wt%的至少一种mcr抑制剂和任选地0wt%至99wt%的至少一种药学上可接受的载剂。在仍然另一实施方式中,本文中的药物组合物包含1wt%至90wt%的至少一种多粘菌素抗生素、0.5wt%至15wt%的至少一种mcr抑制剂和任选地0wt%至90wt%的至少一种药学上可接受的载剂。
[0063]
在一个实施方式中,多粘菌素抗生素为具有对抗很多种细菌的扩展广谱的抗菌活性。其包含很多氨基基团,因此在某些ph环境中转为带正电荷。其可以通过静电相互作用与lps结合,随后通过增加膜通透性释放关键细胞成分,并且因渗透不稳定或自溶作用导致细菌死亡。粘菌素的结构由下式表示:
[0064][0065]
通过x射线晶体学揭示银化合物的作用机理。将mcr-1蛋白质晶体用agno3浸泡,显示(a)十个ag
离子与mcr-1结合,一个ag
置换了潜在活性囊中的一个zn
2
辅因子。(b)观察到重要的his
395
因与银结合而旋转约了60
°
,这可能会干扰乙醇胺(eta)或petn与潜在活性囊的底物结合。(c)银结合加重了重要氨基酸(包括his
390
、asp
465
和glu
246
)的刚性。类似地,在用醋硫葡金或aucl浸泡过之后,在mcr-1晶体的活性囊中观察到一个au
离子。
[0066]
联合疗法
[0067]
在一些实施方式中,当用银/金化合物治疗之后,产生mcr的细菌显示了良好恢复的粘菌素敏感性。在某些实施方式中,粘菌素可以在临床相关的敏感范围内预防细菌生长或杀死它们。在一个实施方式中,粘菌素和银/金化合物联用产生了协同作用。在一个实施方式中,相比于没有本文所述的银/金化合物或其药学上可接受的盐的抗生素,粘菌素的抗菌功效增加了2-256倍。在另一实施方式中,相比于没有本文所述的银/金化合物或其药学上可接受的盐的抗生素,粘菌素的抗菌功效增加了4-128倍。在仍然另一实施方式中,相比于没有本文所述的银/金化合物或其药学上可接受的盐的抗生素,粘菌素的抗菌功效增加
nacl)中渗析过夜。将蛋白质重新加载到另一根ni(ii)-nta柱上以收集流过(flow-through)级份。必须使用q-hp柱(ge)进行进一步纯化,在这里使用五倍柱体积的具有梯度量nacl(10-500mm)的裂解缓冲液来洗脱蛋白质样品。将这些目标样品级份加载到用运行缓冲液(20mm hepes,ph=7.4,50mm nh4no3)平衡的superdex 75(ge healthcare(通用电气医疗集团))上。将高纯度目标蛋白质浓缩(10kd,millipore)到7mg ml-1
以备进一步使用。
[0077]
将新鲜纯化的mcr-1-s和载脂蛋白-mcr-1-s在速率为0.5ml min-1
的运行缓冲液(20mm hepes,ph=7.4,50mm nh4no3)中加载到superdex 75柱(ge healthcare(通用电气医疗集团))上。将mcr-1-s在运行缓冲液中分别与zn(ac)2、agno3、aucl或其他相关化合物一起温育。通过38kda(单体)或76kda(二聚体)处的fplc峰来探索其不同构型。所有测定均一式三份进行,重复三次。
[0078]
蛋白质结晶和数据分析
[0079]
将纯化蛋白质于4℃与50-100分子比的edta一起温育3小时,随后浓缩至1mg ml-1
,成为载脂蛋白-mcr-1-s。在使用存储缓冲液(20mm hepes,50mm nh4no3,ph 7.4)渗析之后,将样品分离为等份试样以在-80℃下长期存储。通过将等体积蛋白质与储液(100mm kscn,30-32%peg 3350,100mm tris-hno3,ph 8.0)混合进行晶体筛选(静滴)。在两周后,于18℃出现天然mcr-1-s的晶体。它们通常以约的分辨率衍射。将晶体转移到具有32%peg 3350、100mm tris-hno3(ph 8.0)、25%甘油和10mm edta的新孔中1小时。接着,将这些晶体在低温保护剂溶液(32%peg 3350,ph 8.0,25%甘油和100mm tri-hno3(ph 8.0))中清洗三次,并在浸泡缓冲液(32%peg 3350,ph 8.0,25%甘油,100mm tri-hno3(ph 8.0)和5mm agno3(5mm aucl或5mm醋硫葡金)中避光浸泡3小时(1-3个月)。拾取晶体,随后速冻到液氮中。14种晶体通常的衍射分辨率为在上海同步辐射设施(ssrf)20的bl17u1上在的波长下收集了18个数据。在ssrf用hkl2000处理衍射数据。
[0080]
使用ccp4套件中的phaser66程序和zn
2
结合截短mcr-1(pdb代码:5grr)作为检索模型进行分子置换。独立使用refmac67和coot68对异常数据进行细化和手动重建。在后期基于原子b因子细化了ag(i)和au(i)的占有率。较高的ag
占有率(≥0.8)和au
占有率(≥0.45)证实在浸泡后置换了zn
2
。将tls细化加入后期细化过程中。在coot中自动添加溶剂,随后手动检查和修改。最终模型用molprobity69分析。对应的ag-mcr-1-s和au-mcr-1-s晶体如图2(a)和(b)中所示。
[0081]
实施例2:酶抑制的体外机理研究
[0082]
itc测定法
[0083]
将没有任何标签的载脂蛋白-mcr-1-s稀释到适合用于itc测定法的浓度。(1)将1mm zn(ac)2添加到30μm载脂蛋白-mcr-1-s中;(2)将1.1mm agno3添加到7μm载脂蛋白-mcr-1-s中;(3)将1.1mm aucl添加到30μm载脂蛋白-mcr-1-s中;(4)将1mm其他化合物添加到30μm载脂蛋白-mcr-1-s中。根据具体情况,阴性组在含有或不含1%dmso的渗析缓冲液中进行。通过用合适的方程拟合数据获得金属结合的化学计量学和结合亲和性,这些检测一式三份进行。如图3中所示,mcr-1-s与agno3、aucl和zn(ac)2的结合的解离常数(kd)分别被测定为约0.2μm、0.8μm和2.45μm。相应数据如图3所示。
[0084]
par检测
[0085]
通过varian(瓦里安)cary 50分光光度计,以360nm/min的速率,使用1cm-1
的石英
比色杯,收集紫外-可见光光谱。4-(2-吡啶偶氮基)间苯二酚(par),一种zn(ii)螯合剂,可以牢固地螯合游离zn
2
以形成zn(par)2复合物,导致最大吸收峰从约420nm显著迁移到约500nm。在本文中,我们将载脂蛋白-mcr-1-s与10倍zn
2
在渗析缓冲液(20mm hepes,ph=7.4,50mm nh4no3)中一起温育。在12小时温育之后,将zn(ii)-mcr-1-s分离为等分试样,随后以不同分子比与ag(i)、au(i)或者甚至它们的化合物混合。将渗析缓冲液代替这些金属化合物添加到zn(ii)-mcr-1-s溶液中作为阴性对照物。对于阳性对照物,将10倍的zn(ii)与载脂蛋白-mcr-1-s混合。通过比较不同组之间的峰强度,可以计算释放的zn(ii)的量。在温育后至少30分钟,在220-600nm范围内记录紫外-可见光光谱。如图4所示,在滴定ag(i)和au(i)时,zn(ii)可以从mcr-1-s完全释放。相应数据如图4所示。
[0086]
通过icp-ms进行金属含量测量和锌置换分析
[0087]
为监控zn
2
、au
和ag
与蛋白质的结合比,将纯化样品(天然mcr-1-s和载脂蛋白-mcr-1-s)与等量的zn
2
、au
或ag
一起温育,随后用65%hno3(sigma-aldrich(西格玛奥德里奇公司),美国)于60℃酸化过夜。将这些酸化样品用含有
115
in(5ppb)作为相应金属离子内标物的1%hno3溶液稀释,随后使其通过icp-ms(agilent(安捷伦)7500a,agilent technologies(安捷伦科技公司),加州,美国)进行分析。使用90243号、51844号和金标准物(fluka,sigma-aldrich(西格玛奥德里奇公司),美国)作为icp标准物样品。还测量了
34
s含量以进一步确定蛋白质浓度。使用平衡渗析来监测准确的结合过程。将载脂蛋白-mcr-1-s置于渗析膜的内侧,在外侧添加不同摩尔比的au
、ag
或zn
2
。通过将等量的au
和ag
加入到膜的外侧中来进行zn
2
置换分析。发现,当从样品各自的金属含量测定时,约3摩尔当量的zn(ii)分别被16当量和2.25当量的ag(i)和au(i)置换(图5a-b),而与蛋白质结合的ag(i)和au(i)不能被外部的zn(ii)置换(图5c-d)。
[0088]
tlc板检测
[0089]
在全长蛋白质上通过薄层色谱(tlc)板检测进一步评估agno3或醋硫葡金对mcr-1的抑制。将全长mcr-1分别用或不用10摩尔当量的agno3、aucl和au(pet3)cl进行预处理,随后与荧光底物nbd-甘油-3-pea(avanti lipids公司,美国)在检测缓冲液中于25℃混合过夜。使用tlc板在移动相[乙酸乙酯:甲醇:水,7:2:1(体积/体积)]中分离nbd-甘油与mcr-1反应混合物。通过将tlc板暴露于紫外光(455
–
485nm)并使用凝胶成像系统将荧光信号可视化来分析反应产物。如图6所示,天然mcr-1使pea基团从nbd-甘油-3-pea上裂解下来,导致nbd-甘油更快迁移。相比之下,agno3、aucl或au(pet3)cl治疗组均未显示可观察到的迁移,表示抑制了ag(i)和au(i)对mcr-1的裂解活性。
[0090]
细胞热位移检测
[0091]
考虑到mcr-1为跨膜蛋白质,我们构建了具有可溶性截短mcr-1片段(200-541aa)但没有任何标签的质粒,随后将其转移到大肠杆菌bl21(de3)中。根据一般标准方法进行细胞热位移检测。将对数期的细菌培养物分别暴露于1μg ml-1
agno3、1μg ml-1
和15μg ml-1
醋硫葡金过夜。收获细菌团粒并用pbs清洗三次。将细胞悬浮液等分到pcr管中,在指定温度下在96孔热循环仪中进行3分钟热处理。立即将管于25℃冷却,重复三个循环的热处理。对于细胞溶解,将样品在液氮中冷冻-解冻,将热循环仪设为25℃。在每次循环后,使样品平缓涡旋,并于20,000
×
g下离心以获得上清液。将所有样品进行sds-page凝胶并且电转移到pvdf膜(hybond-p,ge healthcare(通用电气医疗集团))。使用pageruler预染色蛋白梯#26616
(thermo(美国热电公司))作为标准标记物。在标准印迹程序之后应用稀释的蛋白质一抗(mcr-1多克隆抗体(csb-pa745804la01enl,cusabio technology llc(华美生物技术有限公司))和二抗(抗兔igg,hrp-连接抗体,#7074,cell signaling technology,inc.(细胞信号技术公司))。用特定比率的包含硝基蓝四氮唑/5-溴-4-氯-3-吲哚磷酸盐(nbt/bcip)的底物使蛋白质条带色度法显色15分钟。对每个条带的信号定量以进行分析。如图7所示,过夜暴露于agno3和醋硫葡金治疗使mcr-1在细胞中的细胞热稳定性分别降低δtm=5.4℃和5.2℃,表明在完整细胞中agno3或醋硫葡金与mcr-1的结合。
[0092]
膜电位检测
[0093]
mcr-1被规划为两个结构域,包括n末端内膜结合结构域和可溶性的、周质结构域,该结构域配有zn-依赖性催化核心和两个(假定的)底物结合囊。该酶能在对应的囊中结合pea和脂质a,并且在其跨膜结构域的帮助下发起pea到脂质a的zn-依赖性转移。根据生产商说明书,基于改进方法进行膜电位检测。简言之,将约106cfu的中对数期细菌团粒(弗氏志贺菌(s.flexneri)(mcr-1
)或弗氏志贺菌(s.flexneri)(mcr-1-))分别用agno3(10μm)、醋硫葡金(3μm)、au(pet3)cl(3μm)或cccp(5μm)预温育,随后用pbs清洗三次。随后将细菌团粒再悬浮在添加dioc2(30μm)的pbs中,于37℃染色30分钟。随后将染色细菌在流式细胞仪中检测,收集来自fitc-a(488nm,绿色门)和pi-a(633nm,红色门)的信号,随后进行分析。未处理的弗氏志贺菌(s.flexneri)用作对照物。如图8所示,绿色/红色荧光比从6.1降低至4.1,表明与mcr-1阴性菌株相比,mcr-1阳性的弗氏志贺菌(s.flexneri)的膜负电荷显著减少。用agno3、醋硫葡金或au(pet3)cl治疗mcr-1阳性的弗氏志贺菌(s.flexneri)分别导致荧光比显著恢复到5.8、6.1、6.1和7.1,这是在阴性对照物中发现的水平。这证明了ag(i)和au(i)有效地阻止了mcr-1诱导的细胞内负电荷的损失。
[0094]
实施例3:体外抗微生物活性评估
[0095]
检验银/金针对产生mcr的细菌菌株的抗微生物活性。方法涉及基于细胞的最小抑制浓度检测、时间杀伤检测和体外细胞感染检测。
[0096]
细菌
[0097]
采用的细菌涉及大肠杆菌j53、大肠杆菌dh5a、大肠杆菌bl-21、大肠杆菌临床分离株1493、肠道沙门氏菌(salmonella enterica)临床分离株、鼠伤寒沙门氏菌(salmonella typhimurium)、肺炎克雷伯菌(klebsiella pneumoniae)、弗氏志贺菌(shigella flexneri)、产气肠杆菌(enterobacter aerogenes)、阿斯肠杆菌(enterobacter asburiae)、神户肠杆菌(enterobacter kobei)。
[0098]
微量稀释mic检测
[0099]
首先通过标准肉汤微量稀释法(clinical and laboratory standards institute(临床和实验室标准研究所)(clsi)m100-s20,2010)测定抗生素或bi(iii)化合物的mic值。简言之,将细菌细胞在37℃、250rpm下在lb肉汤中培养过夜,使用微量滴定板读取器在600nm(od
600
)测量光密度。将细菌密度调整至约1
×
106cfu ml-1
,然后通过cfu计数在琼脂铺板上检查。将测试化合物一式三份添加到平底96孔板的各个孔中,并进行两倍连续稀释,随后添加制备的细菌接种物。然后将板在37℃下温育过夜。未添加抗生素或铋化合物的行(lanes)作为阳性对照物,未添加细菌的行(lanes)作为阴性对照。通过目测读数和od
600
测量来测定mic,其是能够抑制微生物生长的化合物最低浓度。
[0100]
对于药物联用测试,将抗生素和bi(iii)化合物以比仅测试化合物的mic高至多8倍的浓度共同施用。其他程序和mic检查严格保持不变。根据以下方程式确定fici:
[0101]
fici=fica ficb=ca/mica cb/micb[0102]
其中mica和micb是化合物a和化合物b在单独发挥作用时的mic值,ca和cb是化合物a和化合物b在有效联用时的浓度。协同作用被定义为fici≤0.5,无差别定义为fici》0.5并且《4,拮抗作用定义为fici≥4。所有测定至少在不同日期进行至少一式三份。
[0103]
使用如上所述的方法,评估示例性银/金化合物与粘菌素联用时杀死产生mcr的细菌或抑制产生mcr的细菌的生长的能力。图9a-d显示了粘菌素和agno3联用对产生mcr的大肠杆菌的棋盘mic热图。当单独使用时,粘菌素具有相对高的mic值,经常大于4μg ml-1
,这超出了肠杆菌科细菌的经验敏感水平(2μg ml-1
)。当agno3浓度增加时,粘菌素的mic逐渐降低到0.0625μg ml-1
,fic指数计算为0.125,表明了它们之间的协同作用。类似地,醋硫葡金能将粘菌素mic减少到0.25μg ml-1
,并且fici为0.375。相比之下,当使用mcr-1阴性的大肠杆菌菌株时未观察到抑制。对于其他示例性银/金化合物针对产生mcr-1的细菌菌株也发现了此类协同作用(图9e-f)。当与测试银/金化合物联用时,粘菌素mic显著降低,针对产生mcr的细菌通常降低2-64倍。在mcr-1变体或其他mcr变体中也能观察到类似的协同模式(图9)。
[0104]
时间杀伤检测
[0105]
使用时间杀伤检测进一步探索mcr和银/金化合物(在本文中由agno3和醋硫葡金代表)之间的协同作用。在典型检测中,该实验中的化合物浓度如以下所示:2μg ml-1
粘菌素、10μg ml-1
agno3或6μg ml-1
醋硫葡金。将产生mcr的大肠杆菌于37℃培养过夜,以1:250稀释到lb肉汤中并保持3小时,从而达到对数期。根据标准曲线,将初始细菌浓度调节至~107cfu ml-1
。在50ml试管中,将单独或组合的测试化合物添加至20ml新鲜制备的细菌溶液,并于37℃温育。不含任何化合物的lb肉汤用作阳性对照物。在不同时间间隔(0、1、2、4、6、8和24小时)之后取出100ml悬浮液的等分试样。通过在磷酸盐缓冲盐水(pbs)中连续稀释和在lb琼脂上铺板来从菌落数估算细菌浓度。所有检测一式三份并且在不同日期进行三次。将三次独立实验的数据取平均值,并且绘制为24小时内每个点的log
10
cfu ml-1
对时间(h)的关系图,如图10所示。
[0106]
相比于单一组分,在检测终点时,当暴露于粘菌素与agno3或醋硫葡金的化合物组合时,细菌密度显著降低了10000倍以上。根据nccls,这表明在粘菌素和agno3或醋硫葡金之间有显著的协同作用,也在化合物组合上观察到杀菌作用。
[0107]
耐药性研究
[0108]
考虑到mic的概念,所有敏感细菌细胞都会被高于mic的剂量抑制或杀死。然而,细菌群体经常是庞大的;感染有可能会包含具有较低敏感性的第一步突变体。处于mic水平的化合物剂量会不利地扩增那些较不敏感的突变体的群体。因此,引入防突变浓度(mpc)和防突变指数(mpi=mpc/mic)来估计示例性化合物组合的防突变能力,其中,mpc被定义为在大量敏感细菌群体中抑制第一步耐药突变体生长的化合物浓度。对于典型测试,将1-2
×
10
10
cfu的产生mcr-1的大肠杆菌细胞铺到lb琼脂上,该琼脂包含粘菌素与相同浓度的agno3或醋硫葡金的组合。所有的板均于37℃温育。在温育48小时之后,从具有可观察到的菌落的任何板上挑取至多4个菌落并再培养,随后测量其mic值。高于初始值(4μg ml-1
)的任何粘菌素mic被确定为突变体菌落。限制突变体菌落生长的浓度被确定为mpc。如柱状图所示(图
12a),甚至在仅应用高剂量(16
×
mic)的粘菌素时,仍然能观察到突变体菌落。相比之下,随着agno3或醋硫葡金的增加,突变频率显著下降。当分别应用≥30μg ml-1
agno3或醋硫葡金时,粘菌素mpi降低至0.5,且未观察到突变体菌落。
[0109]
还进行了体外传代检测以评价组合的抗微生物持久性。在典型实验中,将产生mcr的大肠杆菌的过夜培养物在lb肉汤中稀释至107cfu ml-1
。将这样稀释的细菌悬浮液添加到96孔板的每个孔中,其中分别添加0.5倍、0.75倍、1倍、1.25倍、1.5倍、1.75倍、2倍、3倍和4倍mic的药物。在10次细菌传代之后,用于体外选择的药物浓度分别增加至mic的2倍、4倍、6倍、8倍、16倍、24倍和32倍。所有的板均在37℃温育,并且以24小时间隔检查培养物的生长。将允许生长的第二高浓度的培养物以1:1000的稀释度稀释到添加相同浓度药物的新鲜培养基中。对于粘菌素,mic的1倍设定为4μg ml-1
。体外传代重复20天。每四次传代测定mer的mic。在16次连续传代之后,仅粘菌素组的mic提高了16倍,而agno3或醋硫葡金的联用减缓了耐药性的发展,mic增加4倍(图12b)。
[0110]
体外细胞感染试验
[0111]
在添加胎牛血清(fbs,10%)的杜尔贝科(dulbecco)改良伊格尔(eagle)培养基(dmem)中培养hepg2细胞,并于37℃在增湿的5%co2气氛中培养三天。然后将细胞用磷酸盐缓冲盐水(pbs)溶液清洗三次,用胰蛋白酶edta(0.25%)释放,并用培养基再悬浮。将约500μl的再悬浮细胞(约5.0
×
104个)接种在96孔板中,并如上所述温育48小时以确保其融汇。将新鲜的对数期的产生mcr-1的弗氏志贺菌(shigella flexneri)用pbs清洗三次,并再悬浮在mem/10%fbs中。将密度调节至1.0
×
107cfu ml-1
。随后将25μl细菌悬浮液添加至每个孔中,并且替换先前的细胞培养基。将板以800g离心10min,随后于37℃在5%co2中温育6小时,以5的感染复数(moi)执行细菌侵袭。在这里我们随后使用细胞相关的细菌感染模型,其中细胞相关的细菌定义为附着到、刺入或胞吞到hepg2细胞中的细菌。在感染之后,将细胞用pbs清洗六次以去除未结合的细菌。随后将感染的hepg2细胞在相同的细胞培养条件下暴露于粘菌素或agno3/agnps化合物或其组合过夜。没有药物的细胞用作对照物。在pbs中用1%triton x-100溶解hepg2细胞并且连续稀释产生的溶解物以通过琼脂铺板计数细菌菌落,从而检查细菌负载量。使用那些仅在培养基下生长的细胞作为阴性对照物。在固定温育持续期间之后,将50μl xtt标记混合物添加至每个孔,将细胞在增湿的5%co2气氛下于37℃温育2小时。通过光谱法于490nm下检测仅通过代谢活性细胞产生的甲臜染料的形成。如前文所述对存活细胞进行计数。检测一式三份进行,重复三次,结果以平均值
±
sd表达。图13显示,联用组的细菌负载量与仅用粘菌素相比减少100倍以上,或者与对照组相比减少1000倍以上。通过xtt检测法评价hepg2细胞存活率,甚至在最高剂量下,硝酸银对hepg2细胞也未表现出细胞毒性或仅显示极低的细胞毒性。以上研究证实了粘菌素和agno3联用针对产生mcr-1的细菌的体外效力,同时显示了对哺乳动物细胞的低细胞毒性。
[0112]
体内鼠科动物感染模型
[0113]
通过局部或全身感染模型进一步检验粘菌素和agno3或醋硫葡金联用的体内抗微生物功效。对于局部感染实验,在lb肉汤中以1:250稀释度进行肺炎克雷伯菌(k.pneumoniae)9607(mcr-1
)的过夜培养,并且在37℃和250rpm下重新生长至od
600 0.5。收集细菌团粒并通过pbs缓冲液清洗三次以备进一步使用。用在pbs中的2
×
106cfu细菌的剂量对小鼠进行腹膜内(i.p.)感染。在感染后1小时,对四组小鼠腹膜内施用以单剂量的媒
介物、粘菌素(2mg kg-1
)、醋硫葡金(0.5mg kg-1
)、agno3(1.5mg kg-1
)或其联合疗法。在全身感染之后48小时将所有小鼠处死,通过琼脂铺板检验肝脏和脾脏中的细菌负载量。对于存活检测,所有感染操作都是相似的,不同之处在于通过在2%粘蛋白存在下用每只小鼠5
×
106cfu的大肠杆菌cke诱导感染,并且在感染后0.5小时对感染小鼠腹膜内注射单剂量的媒介物、粘菌素(1mg
·
kg-1
)、agno3(0.75mg kg-1
)、醋硫葡金(0.25mg
·
kg-1
)或其组合。监测体重和小鼠存活率,直到试验终点。如图14a-b所示,与用粘菌素、agno3或醋硫葡金单一疗法治疗的小鼠的肝脏和脾脏二者中的cfu(在105cfu ml-1
g-1
水平)相比,在基于agno3或醋硫葡金的联合疗法中观察到cfu显著减少》20倍。在全身感染模型,我们的结果(图14c-d)显示,agno3或醋硫葡金单一疗法不能保护任何小鼠免于在72小时内死亡,粘菌素单一疗法导致在检验期内仅有30%小鼠存活。然而,基于agno3的联合疗法有效地延缓了小鼠死亡并且导致半数小鼠获救(6只小鼠中的3只),基于醋硫葡金的疗法发挥作用保护所有感染小鼠免于死亡。总之,我们证明了agno3和粘菌素联合疗法的体外抗微生物功效能够被良好转化为体内功效。
[0114]
针对指定特征的任何附图或数值范围,可将来自一个范围的附图或参数与来自针对同一特征的不同范围的另一附图或参数组合以产生数值范围。
[0115]
除了工作实施例中或另有说明时之外,说明书和权利要求书中所用的所有涉及成分量、反应条件等的数字、值和/或表述应理解为在所有情况中均被术语“约”修饰。
[0116]
尽管针对某些实施方式来解释发明,但应理解,当阅读说明书时,其各种修改对于本领域技术人员将变得显而易见。因此,应理解本文公开的发明旨在覆盖落入所附权利要求范围内的此类修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
