一种raav载体核心质粒及其应用
技术领域
1.本发明属于病毒载体技术领域,更具体地,涉及一种快速检测raav生物活性的raav载体及其应用。
背景技术:
2.重组腺相关病毒载体(raav)是由野生型腺相关病毒(aav)改造而来,raav基因组仅包含aav两端的末端重复序列(itr),所含外源基因完全替代了病毒自身编码基因。通过在包装细胞系中反式补偿aav的复制基因rep、结构基因cap和包装辅助基因可制备获得raav。由于它具有安全性高、免疫原性低、宿主范围广、病毒血清型种类多、可感染分裂和非分裂细胞、能介导外源基因在动物体内长期稳定表达等特点,在生物医学研究领域是一种广泛用于携载外源基因表达的重要病毒工具,在疾病基因治疗领域是非常重要病毒载体(wang det al.,nat rev drug discov.2019;18(5):358-378)。迄今,已经有3种基因raav的基因治疗药物上市。
3.目前,从自然界中分离的aav主要有13种血清型以及100多种突变亚型。不同血清型aav病毒衣壳蛋白(cap)的多样性决定了aav感染性差异。这些感染特性涉及aav感染细胞的吸附与进入,细胞内转运,细胞核内的病毒脱衣壳,以及转基因表达。已经发现了一些细胞表面的aav特异性受体,如:硫酸乙酰肝素蛋白多糖(hspg)、整合素等。不同血清型aav的衣壳蛋白及其细胞表面受体存在差异,表现出了多种不同的感染效率、组织或细胞类型的趋向性和免疫特性。通过对aav衣壳蛋白cap基因进行突变改造,可以获得一些具有优良新特性的raav载体。例如:在肝脏中转导活性显著提高的aav-dj型,能够高效穿越小鼠大脑血脑屏障的aav9-php.eb型等。
4.测定不同血清型raav的感染活性及其对不同组织细胞感染效率的差异,对于更好的应用raav非常重要。由于包装与纯化方法工艺、生产批次、储存条件等的差异能够对raav病毒类载体的感染活性造成很大的影响,而raav载体的总颗粒数受存储条件等的影响较小。目前,广泛采用的raav的物理滴度(病毒颗粒浓度)通常是利用荧光实时定量pcr的方法(q-pcr)来测定,raav病毒颗粒只含有单个拷贝的基因组dna,因此raav的物理滴度可定义为每毫升raav病毒基因组的拷贝数,即(vector genome per ml,vg/ml)。raav的感染活性常用转导滴度(transducing titer,单位是tu/ml)或感染滴度(infectious titer,iu/ml)表示。raav2标准品的感染活性测定方法是在5型腺病毒(adv5)的辅助感染下,利用梯度稀释的raav样品感染整合了aav2的cap和rep基因的hela rc32细胞系,通过观察荧光蛋白报告基因的表达或定量pcr获得aav基因组拷贝数计算tcid50的方法来测量(参考lock m et al.,2010human gene therapy,21(10):1273-85)。该方法需要特殊的hela rc32细胞系以及有一定安全性风险的5型腺病毒的辅助感染,难以普通推广。近年来,也有一些研究者利用在raav基因组中携带荧光素酶(luciferase,luc)测定raav的感染活性,但往往局限于少数几种血清型raav活性的检测,通用性不高、获得的数据缺乏可比性。
5.因此,开发适合于各种血清型的,多参数、具有可比性的快速灵活的检测raav的感
染活性的新方法,对于raav制品的质量控制以及raav在基因治疗基础与临床研究中都具有重要的应用价值。
技术实现要素:
6.针对现有技术的上述缺陷或改进需求,本发明提供的一种新的raav载体核心质粒含有荧光蛋白基因和荧光素酶基因的双报告融合基因以及特定aav血清型cap基因所对应的性dna序列,通过检测荧光蛋白基因或荧光素酶报告基因的表达,可用于快速测定多种不同血清型raav感染活性,还可以同时评价多种不同血清型raav的感染效率差异。
7.为了实现上述目的,本发明采用以下技术方案:
8.一种raav载体核心质粒,所述raav载体核心质粒表达元件依次整合cmv启动子,荧光蛋白基因和荧光素酶基因的双报告融合基因,转录后调控序列wpre,人生长激素polya元件,以及插入在wpre和人生长激素polya元件之间的特定aav血清型衣壳蛋白cap基因所对应的识别性dna序列。所述raav载体核心质粒通过广谱强启动子cmv高效表达含有荧光蛋白基因和荧光素酶基因的双报告融合基因。nanoluc是近年来开发新型的萤光素酶,相比其他的荧光素酶,它发光更亮、分子量更小(仅含171个氨基酸,分子量为19.1kda),是目前性能最优良的生物发光报告基因之一,我们将nanoluc基因通过连接序列连接绿色荧光蛋白(egfp)基因的c端,获得了兼具两者优点的egfp-nanoluc双报告融合基因,既可以通过荧光显微镜观察egfp的表达,又可以通过荧光素酶检测仪定量检测nanoluc的表达,既适用于体外培养的组织细胞,也适用于动物活体检测。利用转录后调控序列wpre,人生长激素polya(hghpa)元件进一步提高双报告融合基因的表达水平。特别是在wpre和hghpa元件之间通过多克隆酶切位点(mcs)可以灵活引入特定aav血清型cap基因对应的识别性dna序列。
9.优选地,所述的特定aav血清型衣壳蛋白cap基因所对应的识别性dna序列具体为:以特定aav血清型的衣壳蛋白cap基因的第1760位碱基(约为cap基因编码的cap衣壳蛋白第587位氨基酸附近)为中心位点,向该中心位点的3
′
末端和5
′
末端各延伸250-400bp,基本上处于cap基因序列的主要可变区。具体地,aav2血清型cap基因的识别性dna序列如seq id no.3所示的序列;aav9血清型cap基因的识别性dna序列如seq id no.4所示的序列;aav13血清型cap基因的识别性dna序列如seq id no.5所示的序列。
10.优选地,以pfast.bac.dual穿梭质粒作为载体骨架。既可以直接通过质粒转染hek293细胞的方法包装制备出raav,也可以通过构建到重组杆状病毒(bev),利用bev感染昆虫sf9细胞的方法制备出raav。
11.上述raav载体核心质粒在检测不同血清型raav的感染活性中的应用,包括以下步骤:
12.(1)利用上述的raav载体核心质粒制备获得与其携带识别性dna序列相对应的特定血清型的raav;
13.(2)将步骤(1)中制备得到的特定血清型raav病毒,按照一定的比例梯度稀释后感染96孔板中培养的细胞;
14.(3)感染2天后,通过观察荧光蛋白报告基因的表达,或检测荧光素酶报告基因的表达,测定raav的感染活性。
15.上述raav载体核心质粒在同时检测和分析多种不同血清型raav的感染效率差异
中的应用,包括以下步骤:
16.(1)利用上述的raav载体核心质粒制备获得与其携带识别性dna序列相对应的特定血清型的raav;
17.(2)将步骤(1)中制备获得的若干种不同血清型raav病毒等比例混合,感染96孔板中培养的细胞;
18.(3)感染2天后,通过对感染细胞中的特定aav血清型cap基因所对应的识别性dna序列或其转录产物进行检测和丰度分析,可以同时评价多种不同血清型raav的感染效率差异。
19.与现有技术相比,本发明具有以下优点及有益效果:
20.本发明公开的一种raav载体核心质粒,通过基因设计和优化,利用一种新颖的raav载体核心质粒提供了荧光蛋白基因和荧光素酶基因的双报告融合基因的高效表达框,以及特定aav血清型cap基因所对应的识别性dna序列,能够利用多种raav制备方法包装出几乎所有不同血清型的raav,适用于多种不同血清型raav病毒在体外组织细胞培养水平和动物活体水平感染活性的快速灵活检测,能够同时评价多种不同血清型raav的感染效率差异,可以方便的从多种不同血清型aav病毒库中,筛选出对特定组织细胞感染效率最佳的aav血清型。
附图说明
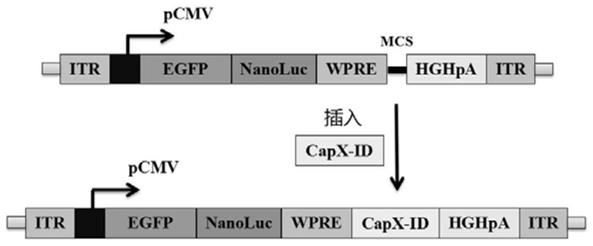
21.图1.raav核心载体质粒pfd/itr-cmv-egfp-nanoluc-wpre-(capx-id)
[0022]-hghpa的构建示意图。
[0023]
图2.利用raav核心载体质粒包装纯化得到的3种血清型raav病毒的纯度与感染活性分析,3种raav病毒分别为:raav2-cmv-egfp-nanoluc-wpre-(cap2-id)-hghpa,raav9-cmv-egfp-nanoluc-wpre-(cap9-id)-hghpa和raav13-cmv-egfp-nanoluc-wpre-(cap13-id)-hghpa。a.3种raav病毒银染图;b.3种raav病毒感染hek293t细胞2天后,荧光素酶(nanoluc)活性检测;c.3种raav病毒感染hek293t细胞2天后,绿色荧光蛋白(egfp)荧光显微镜观察。
[0024]
图3.利用3种血清型raav病毒梯度稀释感染hek293t细胞的病毒活性检测。raav2-cmv-egfp-nanoluc-wpre-(cap2-id)-hghpa病毒5倍梯度稀释感染hek293t细胞2天后,绿色荧光蛋白(egfp)荧光显微镜观察(a),荧光素酶(nanoluc)活性检测(b);raav9-cmv-egfp-nanoluc-wpre-(cap9-id)-hghpa病毒5倍梯度稀释感染hek293t细胞2天后,绿色荧光蛋白(egfp)荧光显微镜观察(c),荧光素酶(nanoluc)活性检测(d);
[0025]
raav13-cmv-egfp-nanoluc-wpre-(cap13-id)-hghpa病毒5倍梯度稀释感染hek293t细胞2天后,绿色荧光蛋白(egfp)荧光显微镜观察(e),荧光素酶(nanoluc)活性检测(f)。
具体实施方式
[0026]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0027]
实施例1:raav核心载体质粒pfd/cmv-egfp-nanoluc-wpre-(capx-id)-hghpa的构建
[0028]
首先,我们利用了昆虫表达系统bac to bac中的pfast.bac.dual(pfd)穿梭载体为骨架。实施例中itr通过5’端连接核酸片段和3’端连接核酸片段与pfd载体骨架相连,选用2型aav的itr核酸序列,如seq id no.1所示的序列,采用广谱强启动子cmv控制egfp-nanoluc双报告融合基因的表达,接着是转录后调控序列wpre,由bamh1、xba1、afe1、xho1酶切位点构成的多克隆酶切位点序列(mcs),接着是人生长激素polya(hghpa)元件。为了保持egfp和nanoluc基因各种的功能不受影响,两者之间的连接序列采用一段编码柔性多肽(asp-ile-ser-gly-gly)的序列。我们采用基因片段人工合成、pcr扩增、酶切连接等分子克隆常规操作方法,成功构建获得了pfd/itr-cmv-egfp-nanoluc-wpre-(mcs)-hghpa载体质粒,如图1。经过核酸测序验证结果正确,如seq id no.2所示的序列。
[0029]
对于特定aav血清型cap基因所对应的识别性dna序列,考虑到不同血清型raav的cap基因序列差异多存在于暴露在衣壳蛋白表面的可变区,特别是常用于表面插入多肽展示获得多种性能优异aav突变体(如:aav9-php.eb,aav2-retro型等)的衣壳蛋白cap的第587个氨基酸附件区域。因此,我们优选特定aav血清型衣壳蛋白基因cap的第1760位碱基为中心位点,向该中心位点的3
′
末端和5
′
末端各延伸250-400bp,以此作为特定aav血清型cap基因所对应的识别性dna序列。在本实施例中,我们选择3种常规自然血清型raav2、raav9、raav13进行技术验证。其中aav2血清型cap基因的识别性dna序列cap2-id,优选为seq id no.3所示的序列;aav9血清型cap基因的识别性dna序列cap9-id,优选为seq id no.4所示的序列;aav13血清型cap基因的识别性dna序列cap13-id,优选为seq id no.5所示的序列。我们以含有cap2、cap9和cap13基因的质粒为模板,利用pcr扩增获得识别性dna序列片段,然后通过酶切连接插入到wpre和hghpa之间的多克隆位点(mcs)中,如图1。最终,获得了相应的pfd/itr-cmv-egfp-nanoluc-wpre-(cap2-id)-hghpa,pfd/itr-cmv-egfp-nanoluc-wpre-(cap9-id)-hghpa和pfd/itr-cmv-egfp-nano luc-wpre-(cap13-id)-hghpa载体质粒。
[0030]
实施例2:raav病毒的包装纯化及其感染后报告基因表达的检测
[0031]
基于pfast.bac.dual骨架的raav核心载体质粒,既可以直接通过质粒转染hek293细胞的方法包装制备出raav;也可以通过构建到重组杆状病毒(bev),利用bev感染昆虫sf9细胞的方法制备出raav。因此,可以包装出较高滴度的各种血清型raav病毒。本实施例中我们利用本实验室已经建立的灵活通用的新型onebac系统的方法(参考wu y et al.,current gene therapy,2021.21(2):167-176.),以实施例1中构建获得的3种血清型pfd/itr-cmv-egfp-nanoluc-wpre-(cap2-id)-hghpa,pfd/itr-cmv-egfp-nanoluc-wpre-(cap9-id)-hghpa和pfd/itr-cmv-egfp-nanoluc-wpre-(cap13-id)-hghpa载体质粒为基础,进一步构建获得相应的bev,然后感染悬浮培养的sf9细胞包装出raav,再利用碘克沙醇超速离心纯等操作,制备获得相应的raav2,raav9,raav13病毒,滴度可达到1e 13vg/ml,银染检测可以清晰看到各自的对应的衣壳蛋白亚基(vp1、vp2、vp3)的3条电泳条带,且纯度较高,如图2a。
[0032]
然后,我们用高滴度的raav2、raav9、raav13分别感染96孔板中培养的hek293t细胞。感染2天后,我们在培养的hek293t的96孔板中加入荧光素酶底物,然后利用多功能酶标
仪检测到很强的底物催化产生的化学发光信号,如图2b,结果表明3种raav感染后都能有效表达荧光素酶(nanoluc)。感染2天后,我们利用荧光显微镜观察96孔板培养的hek293t细胞,均可以看到明显的绿色荧光,如图2c,结果表明3种raav感染后都能有效表达绿色荧光蛋白(egfp)。这表明3种raav所携带的egfp-nanoluc双报告融合基因能够有效的表达,具有功能活性。
[0033]
实施例3:raav感染活性测试以及同时检测多种不同血清型raav的感染效率差异
[0034]
我们对实施例2中制备获得的高滴度(1e 13vg/ml)的raav2、raav9、raav13在hek293t细胞上进行了感染活性的测试。我们将3种raav分别以不用的感染复数(moi)进行5倍梯度稀释感染96孔板中培养的hek293t细胞。感染2天后,分别检测egfp和nanoluc基因的表达。对于raav2、raav9、raav13实验组,我们可以看到egfp荧光随着梯度稀释呈一定比例的降低(图3a,3c,3e);nanoluc信号也随着梯度稀释呈一定比例的降低(图3b,3d,3f)。直至出现某一个稀释度的96孔板中只有少量几个表达egfp的hek293细胞,而下一个稀释度的96孔板中没有表达egfp的hek293细胞。我们可以通过统计某一个高稀释度的96孔板中只有少量几个表达egfp的hek293细胞数目,以及该96孔所对应的raav稀释倍数和起始感染raav的体积,综合计算出待测raav的滴度,以病毒的荧光灶单位(ffu/ml)来表示。通过这种随着raav梯度稀释感染moi相对应的egfp和nanoluc报告基因表达变化的检测,我们可以大致分析出raav病毒相对于hek293t细胞的感染活性。
[0035]
鉴于raav2、raav9、raav13基因组分别携带有各自相应血清型cap基因所对应的非编码识别性dna序列(cap2-id、cap9-id、cap13-id)。我们将实施例2中制备获得的高滴度(1e 13vg/ml)的raav2、raav9、raav13按相同的比例进行混合,然后将3种raav的混合病毒,以一定的moi感染96孔中培养的hek293t细胞。感染2天后,我们可以检测到egfp和nanoluc基因的表达。由于raav2、raav9、raav13感染hek293t细胞的活性存在差异,我们利用识别性dna序列(cap2-id、cap9-id、cap13-id)设计特异性引物,针对raav2的引物为cap2-id-f和cap2-id-r(序列如seq id no.6和seq id no.7所示);针对raav9的引物为cap9-id-f和cap9-id-r(序列如seq id no.8和seq id no.9所示);针对raav13的引物为cap13-id-f和cap13-id-r(序列如seq id no.10和seq id no.11所示)利用定量pcr的方法或者高通量测序的方法对hek293t细胞的核酸提取物进行检测和分析,可以计算获得感染后的hek293t细胞中raav2、raav9、raav13的的相对含量比例约为200:1:4。实现了同时检测多种不同血清型raav对hek293t细胞的感染效率差异。
[0036]
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
