1.本发明涉及液体酶制剂领域,更具体地,涉及一种应用于液体葡萄糖氧化酶的复合热稳定剂。
背景技术:
2.葡萄糖氧化酶(glucose oxidase,god)的系统命名为β-d-葡萄糖氧化还原酶(ec 1.1.3.4),能高效地催化葡萄糖与氧气反应,生成葡萄糖酸和过氧化氢.葡萄糖氧化酶的催化特性使其具有去葡萄糖、脱氧、杀菌等功能,且安全无毒副作用,所以在食品的加工保鲜、医学等方面都有广泛的应用。
3.近年来,葡萄糖氧化酶作为替代抗生素的新型饲料酶制剂,具有保护动物肠道,促进消化吸收,提高动物机体免疫力等多种功能。葡萄糖氧化酶在饲料应用方面,年需可达30万吨,据估计葡萄糖氧化酶的年总产值在100亿元以上,同时其需求量也以每年10%-30%的速度逐年递增。然而,液体葡萄糖氧化酶往往显示出较弱的热稳定性,在储藏与使用过程中容易失活变性,这极大的限制了葡萄糖氧化酶的应用和发展。因此,如果能有效地提高液体葡萄糖氧化酶的热稳定性,就可以较大程度地避免低温冷藏从而减少资源浪费,同时显著的延长葡萄糖氧化酶的作用时间。总而言之,提高液体葡萄糖氧化酶的热稳定性,在应用和研究中均具有重要的前景和意义。
4.目前,提高酶热稳定性的方法主要有:化学修饰、固定化、蛋白质工程技术、添加稳定剂等。现就具体案例对不同方法提升葡萄糖氧化酶热稳定性的效果进行如下分析比对:
5.kim等人利用壳聚糖、乙酸、三聚磷酸钠(tpp)、吐温20、戊二醛(ga)、硫酸铵、磁性纳米粒子等诸多材料对葡萄糖氧化酶进行了固定化,固定化后的葡萄糖氧化酶在室温下的储藏稳定性有了显著提升(储藏16d后,残留活力能保留90%以上);但另一方面,该方法使用了繁多的化学试剂(包括昂贵的磁性纳米粒子),制作过程复杂,难以大规模制备,实际应用价值受到极大的限制{yeon k m,you j,adhikari m d,et al.enzyme-immobilized chitosan nanoparticles as environmentally friendly and highly effective antimicrobial agents[j].biomacromolecules,2019,20(7).}。
[0006]
钱军民等人利用hec/sio2凝胶复合物包埋的方法对葡萄糖氧化酶进行了固定化,固定化葡萄糖氧化酶的最适反应温度较游离酶提高了4℃。但在固定化过程中,葡萄糖氧化酶酶活有近50%的丧失;同时,固定化葡萄糖氧化酶在50℃下恒温1h后,其相对活力仅为原始活力的65%左右,热稳定性依旧较差[钱军民,李旭祥.hec/sio2凝胶复合物包埋固定化葡萄糖氧化酶的研究[j].应用化学,2002,19(002):153-157.]。
[0007]
中国农业科学院饲料研究所的姚斌等人利用蛋白质工程的方法,对aspergillus niger来源的葡萄糖氧化酶进行了改造。经5轮突变后,突变体葡萄糖氧化酶-m5的活力较母本提升了66%,热稳定性也有所改善;但该突变体在70℃下处理10min后,活力仅为初始值的55%,依旧难以满足实际生产应用的需求{涂涛,蒋肖,黄火清,罗会颖,姚斌.基于体外分子进化技术提高aspergillus niger来源葡萄糖氧化酶的热稳定性和催化效率研究[c]}。
[0008]
江南大学的堵国成等人利用加装双亲自组装肽(self-assembling peptides,saps)的方法提升葡萄糖氧化酶的热稳定性,经蛋白质工程改造及对比筛选后,融合酶1热稳定性较母本有了显著提升(是相同热处理条件下初始酶的10.9倍);但该突变体在60℃下处理30min后,活力仅为初始值的67%,离实际生产应用需求尚有差距{任春慧,张娟,堵国成,陈坚.基于融合双亲短肽提高葡萄糖氧化酶的热稳定性[j].生物工程学报,2018,34(07):1106-1116.}。
[0009]
虽然目前并未有利用稳定剂提升液体葡萄糖氧化酶热稳定性的案例,但该方法在改善其他酶类的热稳定性方面有着良好的效果。殷佩琼通过向液体酶中添加β-环糊精、氯化钙、甘油等简单易得的稳定剂,极大的提升了碱性液体蛋白酶的储藏稳定性,添加稳定剂后的液体酶在27℃条件下储藏三个月后,仍保有96%以上的活力(对照组仅剩0.5%的活力),显示出稳定剂提升液体酶稳定性的巨大潜力。
[0010]
综上所述,在各种改善酶热稳定性的方法中,化学修饰与固定化方法操作复杂、成本高昂,容易引入有毒有害的化学物质,对酶的催化活性也有一定的损伤;蛋白质工程技术一般需要对酶分子结构进行大量的计算机设计,同时建立高效的高通量筛选方法,改造过程中需兼顾酶的热稳定性与活力,技术难度大,且对酶稳定性的提升效果有限;另一方面,液体酶制剂中加入热稳定剂提升其稳定性是一种最经济有效的办法,具有成本低廉、操作简单、无毒无害、效果显著等优点。
技术实现要素:
[0011]
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本技术的发明人优选能促进液体酶稳定存在的物质,按一定比例混合制成复合型酶稳定剂,加入到液体葡萄糖氧化酶中增强其热稳定性。
[0012]
根据本发明的实施例,所述应用于液体葡萄糖氧化酶的复合型热稳定剂具有以下技术特征:
[0013]
根据本发明的实施例,所述应用于液体葡萄糖氧化酶的复合型热稳定剂包含选自甘油、乳糖、山梨酸钾中的两种或三种,及水。
[0014]
根据本发明的实施例,所述应用于液体葡萄糖氧化酶的复合型热稳定剂包含甘油、乳糖及水,甘油和乳糖的重量比为2:1,水的重量为其他原料重量之和。
[0015]
根据本发明的实施例,所述应用于液体葡萄糖氧化酶的复合型热稳定剂包含甘油、山梨酸钾及水,甘油和山梨酸钾的重量比为5:1,水的重量为其他原料重量之和。
[0016]
根据本发明的实施例,所述应用于液体葡萄糖氧化酶的复合型热稳定剂包含乳糖、山梨酸钾及水,乳糖和山梨酸钾重量比为5:1,水的重量为其他原料重量之和。
[0017]
根据本发明的实施例,所述应用于液体葡萄糖氧化酶的复合型热稳定剂包含甘油、乳糖、山梨酸钾及水,甘油、乳糖和山梨酸钾的重量比为(15-25):(5-15):(1-3),水的重量为其他原料重量之和。
[0018]
根据本发明的实施例,所述应用于液体葡萄糖氧化酶的复合型热稳定剂包含甘油、乳糖、山梨酸钾及水,甘油、乳糖和山梨酸钾的重量比为10:5:1,水的重量为其他原料重量之和。
[0019]
根据本发明的实施例,所述包含复合型热稳定剂的液体葡萄糖氧化酶,其中液体
葡萄糖氧化酶与复合型热稳定剂的质量比为20:(1-5)。
[0020]
根据本发明的实施例,所述包含复合型热稳定剂的液体葡萄糖氧化酶,其中液体葡萄糖氧化酶与复合型热稳定剂的质量比为10:1。
[0021]
本发明人发现,复合型热稳定剂中的水与其他一种或两种组分以低浓度添加在液体葡萄糖氧化酶中对其热稳定性无明显提升或仅有小幅度提升,但是将各个组分以一定比例组合同样以低浓度添加在液体葡萄糖氧化酶时,其热稳性有大幅度提升,可使液体葡萄糖氧化酶在60℃下处理2h后仍保有98%的活力,30℃下保存6个月仍有91%的活力。本发明应用于液体葡萄糖氧化酶的复合型热稳定剂,制备简单、使用方便、添加量低、价格低廉,具有良好的生物相容性,不会对环境造成污染,可使葡萄糖氧化酶在使用过程遇到高温环境依然能保持较高的酶活,延长其作用时间,常温下保存能显著减小酶活损失,对于葡萄糖氧化酶液体制剂的产业化有重要作用。
具体实施方式
[0022]
为能清楚说明本方案的技术特点,下面通过具体实施方式,对本发明进行详细阐述。
[0023]
实施例1
[0024]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,1份;水,3份。
[0025]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0026]
实施例2
[0027]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,1份;水,2份。
[0028]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0029]
实施例3
[0030]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,1份;水,1份。
[0031]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0032]
实施例4
[0033]
生物酶稳定剂的制备,由以下组分混合均匀制成:乳糖,1份;水,10份。
[0034]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0035]
实施例5
[0036]
生物酶稳定剂的制备,由以下组分混合均匀制成:乳糖,1份;水,5份。
[0037]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0038]
实施例6
[0039]
生物酶稳定剂的制备,由以下组分混合均匀制成:乳糖,1份;水,3份。
[0040]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0041]
实施例7
[0042]
生物酶稳定剂的制备,由以下组分混合均匀制成:山梨酸钾,1份;水,10份。
[0043]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0044]
实施例8
[0045]
生物酶稳定剂的制备,由以下组分混合均匀制成:山梨酸钾,1份;水,30份。
[0046]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0047]
实施例9
[0048]
生物酶稳定剂的制备,由以下组分混合均匀制成:山梨酸钾,1份;水,50份。
[0049]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0050]
实施例10
[0051]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,10份;乳糖,5份;水,15份。
[0052]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0053]
实施例11
[0054]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,10份;山梨酸钾,1份;水,11份。
[0055]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0056]
实施例12
[0057]
生物酶稳定剂的制备,由以下组分混合均匀制成:乳糖,10份;山梨酸钾,2份;水,12份。
[0058]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0059]
实施例13
[0060]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,15份;乳糖,5份;山梨酸钾,1份;水,21份。热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0061]
实施例14
[0062]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,5份;山梨酸钾,1份;水,26份。热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0063]
实施例15
[0064]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,25份;乳糖,5份;山梨酸钾,1份;水,31份。热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0065]
实施例16
[0066]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,1份;水,31份。
[0067]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0068]
实施例17
[0069]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,15份;山梨酸钾,1份;水,36份。
[0070]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0071]
实施例18
[0072]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0073]
实施例19
[0074]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,3份;水,33份。
[0075]
热稳定性测试:取制备的生物酶稳定剂0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0076]
实施例20
[0077]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。
[0078]
热稳定性测试:取制备的生物酶稳定剂1g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0079]
实施例21
[0080]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。
[0081]
热稳定性测试:取制备的生物酶稳定剂1.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0082]
实施例22
[0083]
空白对照:取水0.5g,添加到10g液体葡萄糖氧化酶酶液中,在60℃保存2h,进行活力测定。
[0084]
实施例23
[0085]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。
[0086]
热稳定性测试:取制备的生物酶稳定剂1g,添加到10g液体葡萄糖氧化酶酶液中,置于30℃保存1个月,进行活力测定。
[0087]
实施例24
[0088]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。
[0089]
热稳定性测试:取制备的生物酶稳定剂1g,添加到10g液体葡萄糖氧化酶酶液中,置于30℃保存2个月,进行活力测定。
[0090]
实施例25
[0091]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。
[0092]
热稳定性测试:取制备的生物酶稳定剂1g,添加到10g液体葡萄糖氧化酶酶液中,置于30℃保存3个月,进行活力测定。
[0093]
实施例26
[0094]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。
[0095]
热稳定性测试:取制备的生物酶稳定剂1g,添加到10g液体葡萄糖氧化酶酶液中,置于30℃保存4个月,进行活力测定。
[0096]
实施例27
[0097]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。
[0098]
热稳定性测试:取制备的生物酶稳定剂1g,添加到10g液体葡萄糖氧化酶酶液中,置于30℃保存5个月,进行活力测定。
[0099]
实施例28
[0100]
生物酶稳定剂的制备,由以下组分混合均匀制成:甘油,20份;乳糖,10份;山梨酸钾,2份;水,32份。
[0101]
热稳定性测试:取制备的生物酶稳定剂1g,添加到10g液体葡萄糖氧化酶酶液中,置于30℃保存6个月,进行活力测定。
[0102]
在本发明中,葡萄糖氧化酶酶活力测定方法如下:
[0103]
先后加入2.5ml邻联茴香胺,0.3ml 18%葡萄糖,0.1ml辣根过氧化物酶,于37℃条件下预热5min,然后加入稀释后的酶液0.1ml,37℃条件下反应,准确计时3min后,用2mol/l的硫酸终止反应。
[0104]
其中酶活测定过程中所需各溶液的配置如下:
[0105]
1、磷酸盐缓冲液(ph=6.0):称取无水磷酸二氢钠10.524g,十二水合磷酸氢二钠4.4g,用磷酸二氢钠溶液或磷酸氢二钠溶液调节ph至6.0,抽滤,室温保存,有效期为一个月。
[0106]
2、1%邻联茴香胺溶液:称取0.1g邻联茴香胺至10ml容量瓶中,加入无水甲醇振荡溶解,定容后置于棕色瓶中,封口膜密封冷藏保存于冰箱中,有效期一个月。
[0107]
3、100u/ml辣根过氧化物酶溶液:根据购买的辣根过氧化物酶酶活,用水配制100ml酶活为100u/ml过氧化物酶溶液。分装至离心管中冷冻保存。
[0108]
4、2mol/l硫酸溶液:量取109ml浓硫酸于水中,稀释至1000ml。
[0109]
5、邻联茴香胺缓冲液:取100μl 1%邻联茴香胺溶液,加入至12ml磷酸盐缓冲液中混匀,避光保存。临用前现配。
[0110]
葡萄糖氧化酶酶活的定义:在37℃、ph为6.0条件下,每分钟催化葡萄糖氧化产生1μmol过氧化氢所需要的酶量为一个酶活力单位u。
[0111]
其中葡萄糖氧化酶酶活的计算方法如下:
[0112]
(1)葡萄糖氧化酶的酶活力xd,以u/ml计,按下式计算:
[0113][0114]
式中:
[0115]
xd为稀释酶液中葡萄糖氧化酶的活力,单位u/ml;
[0116]
a为酶反应液的吸光度;
[0117]
k为标准曲线的斜率;
[0118]
co为标准曲线的截距;
[0119]
t为酶解反应时间,单位min;
[0120]
34.01为过氧化氢的相对分子量。
[0121]
xd值应在0.45u/ml~0.65u/ml,如果不在此范围,应重新选择酶液稀释度,再进行分析测定。
[0122]
式中:
[0123]
x=xd
×
df
[0124]
x为试样葡萄糖氧化酶的活力,单位u/ml;
[0125]
xd为稀释酶液中葡萄糖氧化酶的活力,单位u/ml;
[0126]
df为试样的总稀释倍数。
[0127]
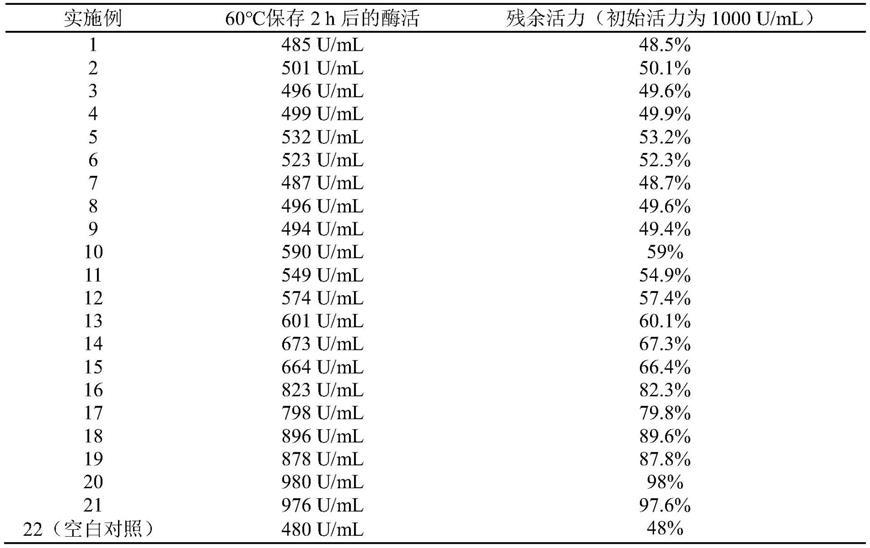
表1稳定剂筛选
[0128][0129]
表2稳定剂对葡萄糖氧化酶热稳定性的影响
[0130][0131]
从表1中不难看出,添加稳定剂后,液体葡萄糖氧化酶的热稳定性有了显著的提高,其中实施例20效果最佳
。
从表2中可以看出,在添加最优稳定剂配方的条件下,液体葡萄糖氧化酶在30℃储存6个月仍保持91.6%的活力。
[0132]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。