1.本发明涉及化工技术领域,具体涉及1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物、制备方法及用途。
背景技术:
2.杨梅素是一类广泛存在植物当中的天然黄酮类化合物。目前,药理研究表明杨梅素是一种黄酮类化合物,具有广泛的生物活性,例如,抗肿瘤,抗菌,抗病毒,降血糖活性和其他生物活性。天然产物中的化学成分种类繁多、结构新颖,在新药和先导化合物的发现中起着重要作用。黄酮类化合物杨梅素由于具有广泛的植物来源和生物活性等优点,已引起了广泛的关注和研究。
3.2014年,赵等(赵洪菊.杨梅素衍生物的合成与生物活性研究[d].贵州大学,2014)报道了一系列含杂环烷基类杨梅素衍生物,利用mtt法,测试了所合成化合物对乳腺癌细胞mda-mb-231的体外增殖抑制活性,其中,在浓度为1μmol/l时,部分化合物的抑制活性均高于对照药吉非替尼(9.73
±
8.04%)。
[0004]
2015年,xue等(xue,w.;song,b.a.;etal.eur.j.med.chem.,2015,97,155-163.)报道了一系列含酰腙类杨梅素衍生物。利用mtt法,对所合成的化合物进行了人类乳腺癌细胞mda-mb-231的体外增殖抑制活性测试,研究结果表明:杨梅素酰腙类衍生物对人类乳腺癌细胞mda-mb-231都表现较好的抑制率。
[0005]
2020年,tang等(tang,x.;zhang,c.;etal.newj.chem.2020,44,2374-2379.)合成了一系列的阿魏酸杨梅素衍生物,并采用半叶枯斑法对所合成的化合物进行了抗病毒活性(tmv)测试,结果表明:部分化合物在500μg/ml浓度下,对烟草花叶病毒的保护活性ec
50
值为196.1、425.3和386.7μg/ml,优于对照药剂宁南霉素(447.9μg/ml)。
[0006]
1,3,4-噁二唑硫醚是一种五元含氮杂环,具有广泛的应用前景。其在医药领域和有机合成领域都有着广泛的应用。由于1,3,4-噁二唑硫醚表现出抗癌,抑菌,抗病毒,抗真菌,杀虫等多种生物活性,因此得到了广泛的研究和开发。与此同时,磺酸酯或羧酸酯衍生物具有广谱生物活性,在农业领域受到越来越多的关注。它已被证明具有抗肿瘤、抗病毒、抗菌、抗真菌等生物活性。
[0007]
2015年wu等(wu,w.n.;chen,q.;etal.bioorg.med.chem.lett.2015,25,2243-2246.)采用活性基团拼接法,合成了一系列含2-取代甲硫基-5-(4-氨基-2-甲基嘧啶-5-基)-1,3,4-恶二唑硫醚衍生物。对合成的化合物进行了抗tmv活性测试,结果表明,该类化合物具有良好的抗病毒活性,其中化合物的半最大效应浓度ec
50
为246.48μg/ml优于对照药宁南霉素301.83μg/ml。
[0008]
2017年wang等(wang,p.y.;chen,l.;etal.j.saudichem.soc.2017,21,315-323.)合成了一系列含1,3,4-噁二唑硫醚基团的1-芳基-4-羟基-1h-吡咯-2(5h)-酮衍生物,且对合成的化合物进行了抑菌活性测定,结果表明,该类化合物具有良好的抑菌活性,部分化合物对水稻白叶枯病菌的ec
50
值分别为8.6μg/ml和7.3μg/ml,优于对照药叶枯唑(92.6μg/
ml)。
[0009]
2020年guo等(guo,t.;xia,r.j.;etal.phosphorus,sulfursiliconrelat.elem.2020,195,123-130.)合成了一系列含噻吩磺酸酯1,4-戊二烯-3-酮衍生物,且对合成的化合物进行了抑菌活性测定,结果表明,该类化合物具有良好的抑菌活性,部分化合物对柑橘溃疡病菌的ec
50
值分别为11.0μg/ml,优于对照药叶枯唑(51.6μg/ml)。
[0010]
综上所述,杨梅素、1,3,4-噁二唑硫醚和磺酸酯都具有一定的生物活性,但还未有将含1,3,4-噁二唑硫醚磺酸酯的活性基团引入杨梅素中合成含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物并进行医用活性测试的报道。
技术实现要素:
[0011]
本发明提供一种1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物、制备方法及用途,目的在于克服上述缺点,提供一种对癌细胞具有较好的抑制活性的含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物。
[0012]
为实现上述目的,本发明提出如下技术方案:
[0013]
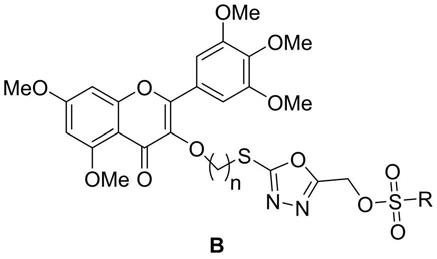
技术方案一:一种含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物,结构通式如下:
[0014][0015]
其中,r为取代苯基或芳杂环基;n为碳链中碳的个数,为2-6之间的任意整数。
[0016]
进一步地,所述取代苯基为苯环上邻、间、对位含有c1-6的烷基、c1-6的烷氧基、硝基、卤素原子或氢原子。
[0017]
进一步地,所述取代芳杂环基为取代芳杂环基上邻、间、对位含有c1-6的烷基、c1-6的烷氧基、硝基、卤素或氢。
[0018]
进一步地,所述芳杂环基包括噻吩基、呋喃基、吡咯基或吡啶基。
[0019]
技术方案二:一种含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物的制备方法,包括以下步骤:
[0020]
(1)以杨梅苷和碘甲烷为原料,以结晶碳酸钾为催化剂,酸性调节制备3-羟基-3’,4’,5’,5,7-五甲氧基杨梅素(中间体1):
[0021]
[0022]
(2)以中间体1和不同链长的二溴烷烃为原料,以碳酸钾为催化剂,以n,n-二甲基甲酰胺(dmf)为溶剂,制备3-溴-5,7-二甲氧基-2-(3,4,5-三甲氧基苯基)-4h-色烯-4-酮(中间体2):
[0023][0024]
(3)以乙醇酸乙酯和质量分数为80%的水合肼,以乙醇为溶剂,制备2-羟基乙酰肼(中间体3):
[0025][0026]
(4)以中间体3、氢氧化钾和二硫化碳为原料,以乙醇为溶剂,用质量分数为5%的稀盐酸调节ph至1-3,制备(5-巯基-1,3,4-噁二唑-2-基)甲醇(中间体4):
[0027][0028]
(5)以中间体2和中间体4为原料,以碳酸钾为催化剂,以n,n-二甲基甲酰胺为溶剂,制备含1,3,4-噁二唑硫醚的杨梅素衍生物(化合物a):
[0029][0030]
(6)以化合物a和取代磺酰氯化合物为原料,以氢化钠为缚酸剂,以二氯甲烷为溶剂,制备含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物(目标化合物b):
[0031][0032]
技术方案三:一种含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物在制备医用抑制癌细胞药物中的应用。
[0033]
与现有技术相比,本发明的有益效果为:
[0034]
本发明将具有活性的1,3,4-噁二唑硫醚和磺酸酯引入到杨梅素的结构中,合成了一系列含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物,与先导化合物杨梅素相比,该类化合物磺酸酯基团结构打开,可与细胞的dna内鸟嘌呤起烷化作用而破坏dna的结构与功能,并通过mtt法测试了对癌细胞的抑制活性,表明含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物对癌细胞具有较好的抑制活性。
具体实施方式
[0035]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
[0036]
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0037]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
[0038]
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
[0039]
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
[0040]
实施例1
[0041]
(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)苯磺酸甲酯(目标化合物b1)的制备方法,包括以下步骤:
[0042]
(1)3-羟基-3’,4’,5’,5,7-五甲氧基杨梅素(中间体1)的制备:
[0043]
在250ml圆底烧瓶中依次加入5.00g(10.77mmol)杨梅苷、19.34g(140mmol)结晶k2co3和80ml dmf,常温下搅拌0.5-1h后,缓慢滴加7.50ml(120mmol)碘甲烷,室温搅拌48h,tlc跟踪反应(甲醇:乙酸乙酯=1:4,v/v)。停止反应后,过滤沉淀,滤渣用二氯甲烷洗涤滤渣,合并滤液,用100ml水稀释,用二氯甲烷萃取三次,合并有机层,减压浓缩,然后将浓缩物溶于100ml无水乙醇中,升温至回流,待溶液澄清后,回流下加入10ml浓盐酸(市售的浓度为35-37%的浓盐酸),随后有黄色固体析出,继续反应2h,冷却至室温,过滤,得到粗产物3-羟基-3’,4’,5’,5,7-五甲氧基杨梅素(中间体1),产率:62%。
[0044]
(2)3-(3-溴丙氧基)-5,7-二甲氧基-2-(3,4,5-三甲氧基苯基)-4h-色烯-4-酮(中间体2)的制备:
[0045]
在100ml的单口圆底烧瓶中依次加入1.17g(3mmol)3-羟基-3’,4’,5’,5,7-五甲氧
基杨梅素(中间体1)、1.66gk2co3(12mmol)和30mldmf,常温搅拌0.5-1h后,加入2.42g 1,3-二溴丙烷(12mmol),在此温度下继续反应12h,tlc监测反应(乙酸乙酯)。反应停止后,反应液用50ml的水分散,乙酸乙酯萃取(3
×
25ml),得到的乙酸乙酯层依次用1mol/l的hcl,饱和nahco3,饱和nacl水溶液分别洗涤2次后,合并乙酸乙酯层,无水硫酸钠干燥、减压除去溶剂,减压柱层析分离提纯(石油醚:乙酸乙酯=2:1,v/v)得到白色固体(中间体2),产率:81.6%。
[0046]
(3)2-羟基乙酰肼(中间体3)的制备:
[0047]
在50ml三口烧瓶中依次加入1.04g(10mmol)乙醇酸乙酯和20ml乙醇,搅拌溶解后,向体系中滴加0.7ml(15mmol)80%水合肼,待滴加完毕后,回流搅拌约24h。待反应结束后,减压除去大部分溶剂,放入4℃冰箱中,析出白色固体,抽滤,产率89%。
[0048]
(4)(5-巯基-1,3,4-噁二唑-2-基)甲醇(中间体4)的制备:
[0049]
在50ml三口烧瓶中依次加入2-羟基乙酰肼(中间体3)0.18g(2mmol)、氢氧化钾0.17g(3mmol)和18ml乙醇,加拌均匀后,缓慢滴加二硫化碳0.18ml(3mmol),然后将混合液在80℃下回流5h,tlc跟踪反应(石油醚:乙酸乙酯=1:2,v/v)。反应停止后,减压除去溶剂,将残渣倒入50ml蒸馏水中,然后抽滤,将滤液调ph至1-3,用乙酸乙酯萃取(3
×
25ml),合并乙酸乙酯层,无水硫酸钠干燥、减压除去溶剂,得黄色油状物,冷却静置后形成黄色固体,产率85%。
[0050]
(5)3-(3-((5-(羟甲基)-1,3,4-噁二唑-2-基)硫代)丙氧基)-5,7-二甲氧基-2-(3,4,5-三甲氧基苯基)-4h-色烯-4-酮(化合物a1)的制备:
[0051]
在250ml三口烧瓶中依次加入(5-巯基-1,3,4-噁二唑-2-基)甲醇(中间体4)1.59g(12mmol)、k2co32.49g(18mmol)和100ml dmf,搅拌5min后,加入3-(3-溴丙氧基)-5,7-二甲氧基-2-(3,4,5-三甲氧基苯基)-4h-色烯-4-酮(中间体2)5.09g(10mmol),然后将混合液在80-90℃下反应5h,tlc跟踪反应(石油醚:乙酸乙酯=1:2,v/v)。反应停止后,将反应液倒入90ml蒸馏水中,有大量白色固体析出,然后抽滤,烘干,得粗产品,经柱层析(石油醚:乙酸乙酯=1:2,v/v)提纯得到化合物a1,产率:91%。
[0052]
(6)(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)苯磺酸甲酯(目标化合物b1)的制备:
[0053]
在50ml三口烧瓶中加入0.89g(1.6mmol)的3-(3-((5-(羟甲基)-1,3,4-噁二唑-2-基)硫代)丙氧基)-5,7-二甲氧基-2-(3,4,5-三甲氧基苯基)-4h-色烯-4-酮(化合物a1)和20mldcm(二氯甲烷),常温搅拌溶解后,加入nah 0.08g(2.0mmol),搅拌3-5min后,加入0.34g(1.9mmol)苯磺酰氯,然后室温反应3-5h。tlc跟踪反应(石油醚:乙酸乙酯=1:2,v/v)。当反应结束,停止反应,反应液用50ml的水分散,二氯甲烷萃取(3
×
25ml),合并有机层,用饱和碳酸氢钠水溶液洗涤(3
×
30ml)、无水硫酸钠干燥、减压除去溶剂,得粗产物,经柱层析(石油醚:乙酸乙酯=1:2,v/v)提纯得到目标化合物b1,产率:40%。
[0054]
实施例2
[0055]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为4-溴苯磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)4-溴苯磺酸甲酯(目标化合物b2),产率为52%。
[0056]
实施例3
[0057]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为4-硝基苯磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)4-硝基苯磺酸甲酯(目标化合物b3),产率为31%。
[0058]
实施例4
[0059]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为2-噻吩磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)甲基噻吩-2-磺酸酯(目标化合物b4),产率为36%。
[0060]
实施例5
[0061]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为2-溴苯磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)2-溴苯磺酸甲酯(目标化合物b5),产率为52%。
[0062]
实施例6
[0063]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为4-甲氧基苯磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)4-甲氧基苯磺酸甲酯(目标化合物b6),产率为45%。
[0064]
实施例7
[0065]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为4-甲基苯磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)4-甲基苯磺酸甲酯(目标化合物b7),产率为61%。
[0066]
实施例8
[0067]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为3-氟苯磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)3-氟苯磺酸甲酯(目标化合物b8),产率为56%。
[0068]
实施例9
[0069]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为4-氯苯磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)4-氯苯磺酸甲酯(目标化合物b9),产率为44%。
[0070]
实施例10
[0071]
同实施例1,区别在于,步骤(6)中,将苯磺酰氯替换为4-氰基苯磺酰氯。生成(5-((3-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丙基)硫基)-1,3,4-噁二唑-2-基)4-氰基苯磺酸甲酯(目标化合物b10),产率为41%。
[0072]
实施例11
[0073]
同实施例1,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)苯磺酸甲酯(目标化合物b11),产率为47%。
[0074]
实施例12
[0075]
同实施例2,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷,步骤(6)中,将苯磺酰氯替换为4-溴苯磺酰氯。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)4-溴苯磺酸甲酯(目
标化合物b12),产率为54%。
[0076]
实施例13
[0077]
同实施例3,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)4-硝基苯磺酸甲酯(目标化合物b13),产率为37%。
[0078]
实施例14
[0079]
同实施例4,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)甲基噻吩-2-磺酸酯(目标化合物b14),产率为38%。
[0080]
实施例15
[0081]
同实施例5,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)2-溴苯磺酸甲酯(目标化合物b15),产率为53%。
[0082]
实施例16
[0083]
同实施例6,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)4-甲氧基苯磺酸甲酯(目标化合物b16),产率为54%。
[0084]
实施例17
[0085]
同实施例7,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)4-甲基苯磺酸甲酯(目标化合物b17),产率为56%。
[0086]
实施例18
[0087]
同实施例8,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)3-氟苯磺酸甲酯(目标化合物b18),产率为64%。
[0088]
实施例19
[0089]
同实施例9,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)4-氯苯磺酸甲酯(目标化合物b19),产率为47%。
[0090]
实施例20
[0091]
同实施例10,区别在于,步骤(2)中,将1,3-二溴丙烷替换为1,4-二溴丁烷。生成(5-((4-((5,7-二甲氧基-4-氧代-2-(3,4,5-三甲氧基苯基)-4h-色烯-3-基)氧基)丁基)硫基)-1,3,4-噁二唑-2-基)4-氰基苯磺酸甲酯(目标化合物b20),产率为34%。
[0092]
实施例1-20合成的含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物的理化性质见表1,核磁共振氢谱(1hnmr),碳谱(
13
cnmr)和氟谱(
19
fnmr)数据见表2。
[0093]
表1实施例1-20制得的目标化合物理化性质
[0094][0095]
表2目标化合物核磁共振谱数据
[0096]
[0097]
[0098]
[0099]
[0100]
[0101][0102]
试验例1
[0103]
1测试方法
[0104]
1)细胞培养与药物作用
[0105]
用含10%胎牛血清的1640培养基在37℃、5%co2的饱和湿度培养箱中培养a2780细胞,每两天换一次培养液,3-4天传代一次。药物以dmso为溶剂,配成1mm、10mm的贮存液,使用时用培养基稀释成1μm和10μm的作用浓度,以dmso作为阴性对照组,顺铂作为阳性对照,作用于对数生长期的a2780细胞。
[0106]
2)mtt比色法
[0107]
取对数生长期细胞,用0.25%胰酶消化后,用含10%胎牛血清的1640培养基终止消化,离心后用含10%胎牛血清的1640培养基重悬。取96孔板,板四周每孔各加200μl的pbs封边,确保实验中饱和湿度。中间六行各加100μl的细胞悬液,细胞密度在2*103个/孔左右。最后一排为空白对照组,加相同体积的完全培养基。在37℃、5%co2的饱和湿度培养箱中培养24h,细胞完全贴壁,去除培养基,加入含不同药物的完全培养基,每孔100μl,dmso和顺铂分别作为阴性对照和阳性对照做相同处理,空白对照组加100μl的完全培养基。继续培养。24h后,在倒置显微镜下观察药物作用效果并拍照,48h后,同样在倒置显微镜下观察药物作用效果并拍照,然后每孔加入100μl0.5mg/ml的mtt溶液,上下左右晃动使mtt充分混匀。37℃继续培养4h后,每孔加入100μl dmso,37℃过夜培养,用酶标仪测定在490nm处的吸光值。每样本浓度重复3个孔,计算每孔的抑制率。
[0108][0109]
3)统计学方法
[0110]
实验结果利用spss statistics运用one-way anova方法分析,p《0.05表示数据间有显著性差异。
[0111]
2、抑制卵巢癌a2780细胞活性测试结果,如表3。
[0112]
表3实施例1-20制备的样品对卵巢癌a2780细胞作用48h的抑制率
[0113][0114]
注:不同药剂在设定浓度下对a2780细胞抑制率与阴性对照组相比*p<0.05。
[0115]
经过初步筛选,发现一些化合物无论在1μmol/l浓度时还是10μmol/l浓度时,具有明显的抗肿瘤活性的潜力,甚至明显高于阳性对照药顺铂,并且这些药物属于浓度依赖性:在1μmol/l时,表现出对卵巢癌a2780细胞能够起到抑制增殖;在10μmol/l时,表现出明显的的抑制活性,如b3、b6、b7、b16、b17;抑制活性明显高于阳性对照药顺铂。
[0116]
如上实验活性数据表明含1,3,4-噁二唑硫醚磺酸酯的杨梅素衍生物对卵巢癌a2780细胞具有一定的抑制作用,其中部分目标化合物对卵巢癌a2780细胞表现出优良的抑制活性,可作为潜在的抑卵巢癌a2780细胞药物,具有较好应用的前景。
[0117]
实验时所有的实验样本都要和阴性对照(dmso)相比,如果呈负值,且有显著性差异说明该化合物不但没有抑制活性,而且有促增殖作用;如果呈负值,没有显著性差异,说明该药物没有活性。
[0118]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。