a环并异噁唑环常春藤皂苷元c-23位含氮杂环衍生物及其制备方法
技术领域
1.本发明涉及有机合成和药物化学领域,具体涉及结构新颖的a环并异噁唑环常春藤皂苷元c-23位含氮杂环修饰衍生物及其制备方法。
技术背景
2.恶性肿瘤严重危害人类健康,根据国际癌症研究机构(iarc)最新癌症数据显示:2020年,全球新发癌症病例1929万人,死亡病例达995.8万人。多药耐药性(multidrug resistance,mdr)的出现,导致90%以上肿瘤患者化疗失败,化疗药物的疗效明显降低。因此,新型肿瘤耐药逆转剂的研发成为药物化学领域关注的重点内容。据报道,多种结构类型的天然产物及其衍生物已被证实具有肿瘤耐药逆转活性,天然产物成为肿瘤mdr逆转剂的重要来源之一。
3.常春藤皂苷元(hederagenin,h)源自五加科常春藤属植物中华常春藤,是齐墩果烷型五环三萜类化合物。本课题组前期研究发现h衍生物h6具有一定的体内外肿瘤mdr逆转活性,作用机制已初步阐明(参见yang yt,guan dk,lei l,et al.h6,a novel hederagenin derivative,reverses multidrug resistance in vitro and in vivo[j].toxicology&applied pharmacology,2018,341:98-105)。因此,对h进行化学修饰,丰富结构类型,对开发新型常春藤皂苷元结构的肿瘤mdr逆转剂是今后工作的重点。
技术实现要素:
[0004]
本发明的目的在于提供常春藤皂苷元c-23位含氮杂环衍生物及其制备方法。本发明要解决的技术问题是寻找结构新颖、肿瘤耐药逆转活性优良的化合物,并进一步提供与临床常用抗肿瘤药物合用治疗口腔上皮癌、胃癌、肺癌、宫颈癌、乳腺癌或结肠癌等的药物组合物。
[0005]
为解决上述技术问题,本发明提供如下技术方案:
[0006]
通式i所示a环并异噁唑环常春藤皂苷元c-23位含氮杂环衍生物及其医学上可接受的盐,
[0007][0008]
其中,
[0009]
通式i:x代表1-3个碳的非取代直链或支链烷基;
[0010]
r1代表n-甲基哌嗪、n-乙基哌嗪、吗啉、四氢吡咯。
[0011]
优选,本发明的部分化合物为:
[0012]
4-(23-氧基齐墩果-12-烯-28-酸苄酯并[2,3-d]异噁唑)-4-氧代-丁酰-(4-甲基)哌嗪胺;
[0013]
4-(23-氧基齐墩果-12-烯-28-酸苄酯并[2,3-d]异噁唑)-4-氧代-丁酰-(4-乙基)哌嗪胺;
[0014]
4-(23-氧基齐墩果-12-烯-28-酸苄酯并[2,3-d]异噁唑)-4-氧代-丁酰吗啉胺;
[0015]
4-(23-氧基齐墩果-12-烯-28-酸苄酯并[2,3-d]异噁唑)-4-氧代-丁酰吡咯烷胺。
[0016]
本发明提供的a环并异噁唑环常春藤皂苷元c-23含氮杂环衍生物的制备路线:
[0017]
通式ⅰ的a环并异噁唑环常春藤皂苷元c-23位含氮杂环衍生物按如下方法合成制备:
[0018]
a.以常春藤皂苷元为原料,在无机碱存在下,溴化苄保护羧基;
[0019]
b.叔丁基二甲基氯硅烷保护c-23位羟基;
[0020]
c.经tbs保护的中间产物用氯铬酸吡啶氧化c-3位羟基;
[0021]
d.在甲醇钠催化下,与甲酸乙酯反应;
[0022]
e.在无水乙醇回流条件下,与盐酸羟胺反应;
[0023]
f.在dmap和edci催化下,与丁二酸酐反应;
[0024]
g.在hatu和diea催化下,与n-甲基哌嗪、n-乙基哌嗪、吗啉、四氢吡咯反应得到粗产物;
[0025]
h.使用柱层析法对粗产物进行提纯,得到目标化合物。
[0026]
本发明的常春藤皂苷元c-23位含氮杂环衍生物具有肿瘤耐药逆转活性,能够作为制备肿瘤耐药逆转剂的应用。
[0027]
所述a环并异噁唑环常春藤皂苷元c-23位含氮杂环衍生物及其上述化合物的光学异构体或其药学上可接受的溶剂合物。
[0028]
有效量的通式i的化合物或其盐和可药用载体用于与临床常用抗肿瘤药物合用治疗口腔上皮癌、胃癌、肺癌、宫颈癌、乳腺癌或结肠癌等疾病或病症。
[0029]
本发明通式i的a环并异噁唑环常春藤皂苷元c-23位含氮杂环衍生物及其医学上可接受的盐用途,用于制备肿瘤耐药逆转剂和/或可药用载体用于治疗哺乳动物,优选治疗人类疾病或病症。
[0030]
有益效果
[0031]
药理试验表明,本发明将n-甲基哌嗪、n-乙基哌嗪、吗啉、四氢吡咯等含氮杂环结构利用丁二酸酐引入到a环并异噁唑的常春藤皂苷元衍生物制得的通式i的a环并异噁唑环常春藤皂苷元c-23位含氮杂环衍生物,具有与维拉帕米相当、甚至更优的肿瘤多药耐药逆转活性,可显著增加耐药kbv细胞对紫杉醇的敏感性。因此,本发明通式i的a环并异噁唑环常春藤皂苷元c-23位含氮杂环衍生物可与常用抗肿瘤药物合用,发挥良好的抗肿瘤活性。
具体实施方式
[0032]
下面通过实施例进一步详细描述本发明,但本发明不仅仅局限于以下实施例。
[0033]
实施例14-(23-氧基齐墩果-12-烯-28-酸苄酯并[2,3-d]异噁唑)-4-氧代-丁酰-(4-甲基)哌嗪胺(hyz-d-jp)
(4-乙基)哌嗪胺(hyz d yp)的合成和表征
[0042]
将hyz-d(95mg,0.1mmol)溶于无水dcm(10.0ml),加入hatu(76.0mg,0.2mmol)和diea(49.7μl,0.3mmol)室温搅拌0.5h,再加入n-乙基哌嗪(25.5μl,0.2mol),室温下搅拌反应约3h。反应结束后,加入二氯甲烷稀释,有机层依次用5%hcl溶液、饱和碳酸氢钠溶液洗一次,去离子水和饱和氯化钠溶液洗涤两次,无水硫酸钠干燥,过滤、浓缩,硅胶柱层析(v
石油醚
:v
乙酸乙酯
=10:1-3:1)得黄色固体hyz-d-yp(67.4mg,81.4%)。1h nmr(400mhz,chloroform-d)δ7.99(s,1h,h-isoxazole),7.36
–
7.31(m,5h,5
×
h-ar),5.34(t,j=3.7hz,1h,h-12),5.12
–
5.04(m,2h,ch2ar),4.24
–
4.10(m,2h,h-23),3.64(d,j=5.4hz,2h,n-ch
2-piperazine),3.51(d,j=5.4hz,2h,n-ch
2-piperazine),2.94(dd,j=13.7,4.4hz,1h,h-18),2.64
–
2.41(m,12h,2
×
ch
2-succinic anhydride,2
×
ch
2-piperazine,,ch
3-piperazine,h-13),1.96(dd,j=14.2,11.4hz,4h,ch2),1.77
–
1.45(m,12h,ch2),1.22(s,3h,ch3),1.15(s,3h,ch3),0.93(s,3h,ch3),0.91(s,3h,ch3),0.87(s,3h,ch3),0.66(s,3h,ch3).
[0043]
实施例34-(23-氧基齐墩果-12-烯-28-酸苄酯并[2,3-d]异噁唑)-4-氧代-丁酰吗啉胺(hyz d ml)的合成和表征
[0044]
将hyz-d(95mg,0.1mmol)溶于无水dcm(10.0ml),加入hatu(76.0mg,0.2mmol)和diea(49.7μl,0.3mmol)室温搅拌0.5h,再加入吗啡啉(17.4μl,0.2mol),室温下搅拌反应约3h。反应结束后,加入二氯甲烷稀释,有机层依次用5%hcl溶液、饱和碳酸氢钠溶液洗一次,去离子水和饱和氯化钠溶液洗涤两次,无水硫酸钠干燥,过滤、浓缩,硅胶柱层析(v
石油醚
:v
乙酸乙酯
=15:1-5:1)得黄色透明油状化合物hyz-d-ml(69.2mg,91.7%)。1h nmr(400mhz,chloroform-d)δ7.98(s,1h,h-isoxazole),7.33
–
7.28(m,5h,5
×
h-ar),5.34
–
5.31(m,1h,h-12),5.10
–
5.01(m,2h,ch2ar),4.16(q,j=11.0hz,2h,h-23),3.66
–
3.60(m,4h,ch
2-morpholine),3.56(q,j=4.8,3.6hz,2h,n-ch
2-morpholine),3.44(dd,j=6.0,3.8hz,2h,n-ch
2-morpholine),2.92(dd,j=13.9,4.5hz,1h,h-18),2.65
–
2.47(m,4h ch
2-succinic anhydride),2.41(d,j=15.2hz,1h,h-13),2.02
–
1.91(m,4h,ch2),1.76
–
1.42(m,12h,ch2),1.21(s,3h,ch3),1.13(s,3h,ch3),0.91(s,3h,ch3),0.89(s,3h,ch3),0.85(s,3h,ch3),0.64(s,3h,ch3).
[0045]
实施例44-(23-氧基齐墩果-12-烯-28-酸苄酯并[2,3-d]异噁唑)-4-氧代-丁酰吡咯烷胺(hyz d 4h)的合成和表征
[0046]
将hyz-d(95mg,0.1mmol)溶于无水dcm(10.0ml),加入hatu(76.0mg,0.2mmol)和diea(49.7μl,0.3mmol)室温搅拌0.5h,再加入四氢吡咯(16.8μl,0.2mol),室温下搅拌反应约3h。反应结束后,加入二氯甲烷稀释,有机层依次用5%hcl溶液、饱和碳酸氢钠溶液洗一次,去离子水和饱和氯化钠溶液洗涤两次,无水硫酸钠干燥,过滤、浓缩,硅胶柱层析(v
石油醚
:v
乙酸乙酯
=15:1-5:1)得黄色透明油状化合物hyz-d-4h(65.4mg,88.6%)。1hnmr(400mhz,chloroform-d)δ7.96(s,1h,h-isoxazole),7.32
–
7.27(m,5h,5
×
h-ar),5.30(t,j=3.6hz,1h,h-12),5.08
–
5.00(m,2h,ch2ar),4.20
–
4.08(m,2h,h-23),3.42
–
3.33(m,4h,n-ch
2-pyrrolidine),2.90(dd,j=14.0,4.8hz,1h h-18),2.71
–
2.42(m,4h,ch
2-succinic anhydride),2.39(m,1h,h-13),2.01
–
1.89(m,6h,ch2,ch
2-pyrrolidine),1.81(q,j=6.7hz,2h,ch
2-pyrrolidine),1.74
–
1.40(m,12h,ch2),1.18(s,3h,ch3),1.12(s,3h,ch3),
0.90(s,3h,ch3),0.87(s,3h,ch3),0.84(s,3h,ch3),0.62(s,3h,ch3).
[0047]
下面是本发明部分化合物的药理学试验及数据。
[0048]
1实验方法:实施例1-4对抗肿瘤药物紫杉醇在kbv耐药株细胞的存活率的检测
[0049]
将对数生长期的kbv细胞用0.25%胰酶消化后,配制成一定浓度的单细胞悬液。根据细胞生长速度的差异,按4000个/孔接种于96孔板,每孔加入细胞悬液100μl。24h后,加入不同浓度的化合物和100nm的紫杉醇及相应溶剂对照的完全培养基。每孔加100μl(dmso终浓度<0.1%),每组设3个平行孔,于37℃继续培养72h后,弃上清。每孔加入100μl含0.5mg/ml mtt的完全培养基,继续培养4h,弃上清后,每孔加入150μldmso溶解mtt甲瓒沉淀,微型振荡器振荡混匀后,酶标仪在参考波长450nm,检测波长570nm条件下测定光密度值(od)。以溶剂对照处理的肿瘤细胞为对照组,用以下公式计算每种化合物作用下的,不同肿瘤细胞的存活率;以溶剂对照处理的肿瘤细胞为对照组,用以下公式计算化合物对肿瘤细胞的抑制率,并按中效方程计算ic
50
。
[0050]
细胞存活率(%)=给药组平均od值/对照组平均od值
×
100%
[0051]
ic
50
=(对照组平均od值-给药组平均od值)/对照组平均od值
×
100%
[0052]
2实验结果:
[0053]
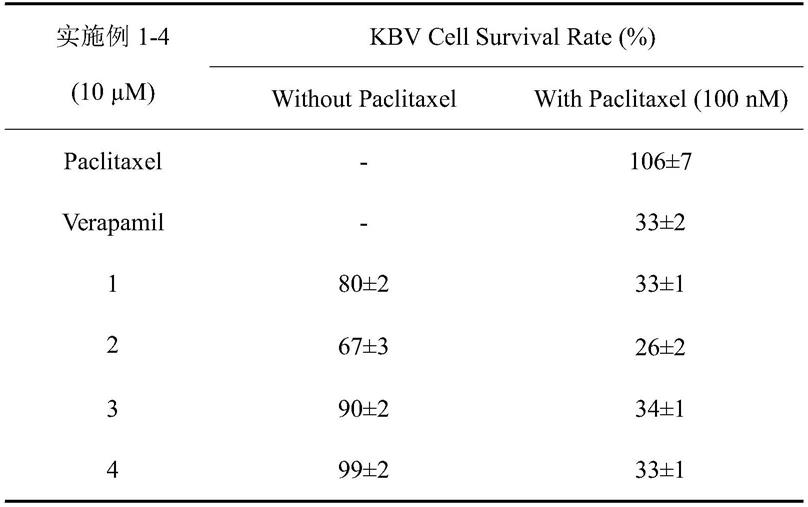
实施例1-4单独用药和联合用药时细胞存活率如表1所示。
[0054]
表1.实施例1-4单独用药和联合用药时细胞存活率
[0055][0056]
实施例1-4对抗肿瘤药物紫杉醇在kbv耐药株细胞的存活率分析。
[0057]
衍生物的kbv耐药株细胞的存活率评价结果显示,实施例1-4都具有较好的肿瘤耐药逆转活性,可显著增加耐药kbv细胞对紫杉醇的敏感性,其中,实施例2活性优于等剂量阳性对照药维拉帕米,实施例1、3、4均表现出与维拉帕米相当的肿瘤多药耐药逆转活性。
[0058]
以上实验表明,本发明将n-甲基哌嗪、n-乙基哌嗪、吗啉、四氢吡咯等含氮杂环结构利用丁二酸酐引入到a环并异噁唑的常春藤皂苷元衍生物中,获得新化学实体。而且,与常春藤皂苷元相比显著不同的是,本发明的结构修饰使常春藤皂苷元的直接抗肿瘤活性消失,表现出优于或等同于维拉帕米的肿瘤多药耐药逆转活性。因此,本发明通式i的a环并异
噁唑环常春藤皂苷元c-23位含氮杂环衍生物可与常用抗肿瘤药物合用,发挥良好的抗肿瘤活性。
[0059]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种等同变换,这些等同变换均属于本发明的保护范围。另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合。为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。