1.本发明属于类器官培养领域,具体涉及一种培养肾肿瘤类器官的方法。
背景技术:
2.泌尿系统肿瘤作为世界上最常见的恶性肿瘤之一,包括前列腺癌,膀胱癌和肾细胞癌。肾细胞癌(renal cell carcinoma,rcc)简称肾癌,在泌尿系统肿瘤中发病率居第三位,恶性程度最高。肾癌是源于肾实质泌尿小管上皮系统的恶性肿瘤,严重影响患者的肾功能,随着病情的加重,可向肾外转移。目前对于肾癌的发病与进展机制尚未完全清晰,多与遗传、环境、相关慢性病史和不良生活习惯相关。55%左右的肾癌患者早期无典型表现,多于健康体检时发现,有症状者则多见于腰痛、血尿,较少患者因腹部可触及肿块而就诊。目前,关于肾癌的治疗措施主要为手术、放化疗、靶向治疗在内的综合治疗。随着精准医学的发展,肿瘤治疗已进入个体化时代:一是利用高通量基因测序发现肿瘤相关突变,寻找药物靶点;二是利用肿瘤模型测试靶向药物的敏感性,实现个性化治疗。但肾癌被诊断出来时往往为时已晚,如何高效短时建立能够反映病人异质性的体外模型显得尤为重要。为了解决以上问题,研究者们将目光投向了类器官技术。
3.类器官技术是近十年来发展最为迅猛的一类体外培养技术,曾被誉为2013年度最为重要的科学进展之一。该项技术能借助来源于组织,胚胎干细胞及成体干细胞,在体外诱导分化成为拥有其来源器官基本特性的功能性细胞团,为模拟活体器官提供新的体外模型。在现代生物医学研究中,最常使用的细胞培养与动物模型都只能部分地模拟体内环境,无法充分展示研究目标在人体内的真实情况。因此,研究人员对3d培养技术给予了极大的关注,他们希望以此保留细胞微环境的物质结构基础,更好地模拟体内细胞,特别是肿瘤细胞生长的微环境。人源肿瘤类器官(patient-derived organoids,pdo)保留了个体肿瘤的异质性,通过pdo进行靶向药物的筛选,指导临床用药,在个性化治疗中体现了巨大的价值。肿瘤类器官作为药物筛选模型的稳定性和保真度可分为三个方面。第一,肿瘤类器官在长期的培养过程中,肿瘤类器官保留了原发肿瘤的异质性,其中不同代数的肿瘤类器官对于抗肿瘤药物筛选的结果基本一致。第二,肿瘤类器官进行药物筛选的结果与患者临床用药具有一致的结果,这表明肿瘤类器官对于精准治疗具有巨大的潜在价值。第三,肿瘤类器官在长期的培养过程中,可视作为一种“细胞系”,对同一肿瘤类器官细胞系进行药物筛选,具有一致的药物筛选结果。
4.肿瘤类器官可进行长时间传代,在传代培养过程中不丢失或改变遗传信息。保留了瘤内与瘤外的异质性。目前结直肠癌,非小细胞肺癌,乳腺癌以及胰腺癌肿瘤类器官模型已广泛应用于药物评价、生物标志物鉴定、生物学研究和个性化治疗。专利cn113186165a、cn111607495a等公开了肾肿瘤类器官的培养方法,主要是将肾癌细胞或者肾癌组织与基质胶混合,或者用基质胶包裹后放入特定培养基中培养而得。但是现有培养肾肿瘤类器官的方法存在操作繁琐、成本较高、规模小,类器官粒径不一、不在同一平面、不易分析观察等缺点,不能规模化批量生产及使用。同时,现有培养肾肿瘤类器官的方法培养周期长,可能会
造成患者病情延误。
5.因此,寻找一种快速、操作简便、成本低的方法,培养大小均一、生长在同一平面、便于分析观察的肾肿瘤类器官,实现肾肿瘤类器官快速规模化培养具有重要意义。
技术实现要素:
6.本发明的目的是提供一种培养肾肿瘤类器官的方法。
7.本发明提供了一种肾肿瘤类器官培养容器,它是内部底表面带有肾脏细胞外基质印迹块阵列的细胞培养容器;
8.所述底表面未覆盖肾脏细胞外基质的区域被封闭剂封闭;
9.所述肾脏细胞外基质印迹块阵列由直径为50~200μm的圆形阵点组成,每个圆形阵点间的间距为25~300μm。
10.进一步地,所述肾脏细胞外基质印迹块阵列由直径为100μm的圆形阵点组成,每个圆形阵点间的间距为50μm。
11.进一步地,所述肾脏细胞外基质印迹块阵列的面积为1~10cm2;
12.优选地,所述肾脏细胞外基质印迹块阵列的面积为4cm2。
13.进一步地,所述容器为培养皿、培养盒、培养板或培养瓶;
14.和/或,所述封闭剂为pluronic f-127;
15.优选地,所述pluronic f-127质量分数为1~5%。
16.进一步地,所述肾脏细胞外基质是猪的肾脏细胞外基质;
17.优选地,所述猪的肾脏细胞外基质的制备方法包括如下步骤:
18.(1)采用triton-sles-triton灌注法制备猪全肾脱细胞化支架;
19.(2)得到的脱细胞化肾支架冻干、粉碎后,采用胃蛋白酶酶解而得。
20.优选地,所述triton-sles-triton灌注法为取新鲜猪肾,肾动脉插管,去除血液后将肾冷冻并解冻,采用1%triton x-100灌注3小时、随后1%月桂基聚氧乙烯醚硫酸钠(sles)灌注6小时,再采用1%triton x-100灌注3小时,最后用pbs灌注2小时平衡脱细胞化肾,即得到脱细胞化肾支架。灌注时,全程流速为15ml/min。
21.优选地,所述酶解时,粉碎后得到的肾胞外基质浓度为10mg/ml;胃蛋白酶与胞外基质粉末的质量比为1∶10。此外,酶解时ph为2,温度为室温,酶解时间为72小时。
22.进一步地,所述肾脏细胞外基质的浓度为0.05~0.5mg/ml;
23.优选地,所述肾脏细胞外基质的浓度为0.1~0.5mg/ml。
24.上述肾肿瘤类器官培养容器采用pdms微图案印刷技术制备而成:先使用激光蚀刻出具有特定图案的硅片作为模板,倒模获得具有特定尺寸的外凸圆形微图案的微阵列pdms印章,在pdms印章表面涂布肾脏细胞外基质胶,印压于培养容器底表面,获得胞外基质微图案阵列,再将培养容器剩余部分使用封闭剂封闭,即得肾肿瘤类器官培养容器。
25.本发明还提供了一种肾肿瘤类器官培养方法,包括如下步骤:
26.将肾癌细胞接种于前述的培养容器中,培养4~6h后洗去未贴附细胞,再培养3~5天即得肾肿瘤类器官。
27.进一步地,所述肾癌细胞的接种密度为104~106个/培养容器;
28.和/或,所述肾癌细胞来源于人;
29.优选地,所述肾癌细胞的接种密度为105个/培养容器。
30.本发明还提供了一种肾肿瘤类器官,它是前述方法制备得到的肾肿瘤类器官。
31.本发明还提供了前述的肾肿瘤类器官在构建肾癌模型或药物筛选中的应用。
32.本发明提供了一种肾肿瘤类器官的培养方法,该方法采用特定阵点形状、尺寸、密度的肾ecm图案微阵列对肾癌细胞进行培养,制备肾肿瘤类器官,缩短了肾肿瘤类器官体外扩增培养时间,简化肾肿瘤类器官培养方式,有效改善了现有肿瘤类器官培养操作繁琐,成本较高,小规模,类器官粒径不一和不易分析观察等缺点。有效控制了肾肿瘤类器官的粒径大小与排列,提高了药物筛选的重复性与稳定性。肾脏脱细胞化ecm为肾肿瘤类器官培养提供了肿瘤微环境,有利于维持肿瘤的异质性,模拟体内肾癌组织。使用该肾肿瘤类器官进行药物筛选,具有更高效与安全性,同时pdo可进行个性化治疗,指导临床用药。
33.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
34.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
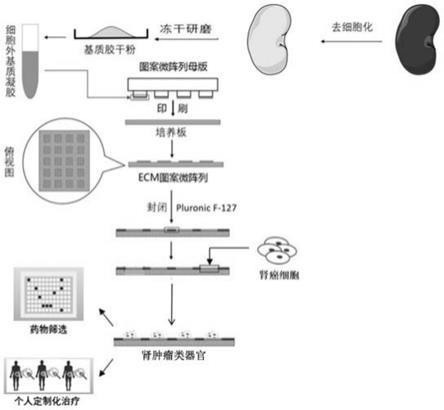
35.图1为本发明肾肿瘤类器官的培养路线。
36.图2为猪全肾脏脱细胞化后的结果:a为脱细胞化前后肾脏的大体观;b为脱细胞化前后的电镜图;c为脱细胞化前后的dna含量检测;d为脱细胞化前后的h&e染色;e为脱细胞化前后的i型胶原纤维染色;f为脱细胞化前后的iv型胶原纤维染色;g为脱细胞化前后的纤连蛋白染色;h为脱细胞化前后的层粘连蛋白染色;标尺=20μm;图中native为未脱细胞化,dlss为脱细胞化。
37.图3为肾脏脱细胞化ecm粉末(左)肾脏脱细胞化ecm凝胶(右)。
38.图4为各药物作用后肾肿瘤类器官死活染色检测结果。
39.图5为通过微图案印刷技术制备得到的脱细胞化肾胞外基质微图案阵列芯片以及培养得到的肾肿瘤类器官:a为pdms印章;b为胞外基质微图案阵列;标尺=100μm。
40.图6为培养3天后形成的肾肿瘤类器官。
具体实施方式
41.除了另有说明外,本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
42.本发明肾肿瘤类器官的培养路线如图1所示,包括如下步骤:
43.(1)肾脏脱细胞化ecm的制备:采用triton-sles-triton灌注法制备猪全肾脱细胞化支架。得到的脱细胞化肾支架(肾脏细胞外基质)进一步冻干,使用球磨仪粉碎后,采用胃蛋白酶酶解,获得肾脱细胞化细胞外基质(ecm)凝胶。
44.(2)采用pdms微图案印刷技术制备图案微阵列母版:使用激光蚀刻出具有特定图案的硅片作为模板,蚀刻精度达到1μm,蚀刻面积最大达到12英寸,倒模获得聚二甲基硅氧烷(polydimethylsiloxane,pdms)印章。将细胞外基质凝胶(称为胞外基质胶或基质胶)涂
布于印章表面,然后利用pdms微图案印刷技术,将胞外基质胶图案微阵列铺设在细胞非贴附处理的细胞培养皿的底部,pluronic f-127封闭剩余培养皿底部的空间,使加入的细胞只能贴附在胞外基质胶图案上生长。得到肾脱细胞化ecm图案微阵列芯片。
45.(3)肾肿瘤类器官的培养:采用肾脱细胞化ecm图案微阵列芯片培养肾肿瘤类器官,缩短其体外扩增培养时间,可有效控制其粒径大小与排列。
46.实施例1、本发明肾肿瘤类器官的培养方法
47.本发明肾肿瘤类器官的培养方法包括如下步骤:
48.(1)猪肾脏脱细胞化胞外基质胶的制备:取新鲜猪肾脏后,肾动脉插管,用pbs冲洗10分钟去血。然后将肾脏冷冻并解冻,采用1%triton x-100灌注3小时、随后1%月桂基聚氧乙烯醚硫酸钠(sles)灌注6小时,再用1%triton x-100灌注3小时,最后用pbs灌注2小时平衡脱细胞化肾脏,得到脱细胞肾支架(肾脏细胞外基质)。灌注时,全程流速为15ml/min。然后将脱细胞肾支架(dlss)切成1
×1×
1cm的立方体进行冻干。进一步经过球磨仪粉碎得肾脏胞外基质粉末,使用胃蛋白酶酶解肾脏胞外基质粉末,得到脱细胞化肾胞外基质胶。酶解时,胞外基质粉末溶解于水中,浓度为10mg/ml,胃蛋白酶与胞外基质粉末的质量比为1:10,酶解时ph为2,温度为室温,酶解时间为72小时。
49.猪肾脏去细胞化后呈白色透明状,通过免疫荧光、组化以及酶联免疫吸附剂测定后,发现胞外基质蛋白得到了很好的保留(图2),进一步通过粉碎,酶解得到了脱细胞化肾胞外基质胶(图3)。
50.(2)使用激光蚀刻出具有特定图案的硅片作为模板,倒模获得pdms印章,制备出具有外凸圆形阵点的图案微阵列(每个圆形阵点的直径为100μm,每个圆形阵点间的间距为50μm,微阵列大小为4cm2)pdms印章。
51.(3)使用pbs调整基质胶浓度,将1ml浓度为0.1mg/ml的猪肾脏脱细胞化胞外基质胶涂布于pdms印章表面,室温孵育20分钟后洗去多余的基质胶,37℃孵箱中干燥。
52.(4)使pdms印章印压于细胞非贴附培养皿内底表面,给予0.2牛顿力,持续10分钟,待图案在培养皿底表面形成后移去印章。
53.(5)加入质量分数1%pluronic f-127(普卢兰尼克f-127,一种聚丙二醇与环氧乙烷的加聚物(聚醚))室温孵育2小时,封闭剩余培养皿内底表面的空间,得到对细胞具有粘附作用的“胞外基质图案微阵列”。制作好的微阵列培养皿在使用前,先用pbs清洗3次,保证培养皿基底不能完全干燥,然后再接种细胞。
54.(6)在培养皿中接种人肾癌细胞(os-rc-2,接种量为1.5
×
105/皿),37℃培养6h后,洗去未贴附细胞,再经过3天培养,即可形成肉眼可见的肾肿瘤类器官。这些肾肿瘤类器官均在同一平面上,大小均一,数量可控。
55.人肾癌细胞被限定贴附在“胞外基质图案微阵列”内生长。本步骤所用到的培养基为1640培养基,含有10%的胎牛血清和1%双抗。
56.通过微图案印刷技术制备得到了脱细胞化肾胞外基质图案微阵列芯片,进而培养肾肿瘤细胞,经过3天培养即可形成肾肿瘤类器官。
57.以下通过具体试验例证明本发明的有益效果。
58.试验例1、本发明肾肿瘤类器官对药物进行筛选
59.实验方法
60.选择实施例1培养的直径为100μm的肾肿瘤类器官,用不同浓度(5μg/ml、10μg/ml、50μg/ml、100μg/ml)的舒尼替尼、西罗莫司和依维莫司分别进行药筛,孵育24h和48h。使用钙黄绿素与碘化丙啶荧光双染进行死活染色分析,使用共聚焦显微镜成像分析。
61.实验结果
62.根据图4的结果可知:利用本发明培养的肾肿瘤类器官可以有效筛选药物种类、药物剂量和药物作用时间对肾肿瘤的影响。结果表明肾肿瘤类器官的活性与药物种类、药物剂量以及培养时间相关。舒尼替尼对肾肿瘤类器官抑制活性最大,随着舒尼替尼浓度和培养时间增加,肾肿瘤类器官停止生长。西罗莫司和依维莫司对肾肿瘤类器官有一定抑制活性,但抑制活性弱于舒尼替尼。研究发现,将类器官大小控制以及排列后,可以更好的分析以及观察药物筛选的结果。本发明肾肿瘤类器官图案微阵列芯片应用于个性化治疗与抗肿瘤药物筛选的潜在价值。
63.试验例2、本发明肾肿瘤类器官培养方法的筛选
64.前期研究表明图案微阵列中,如果使用矩形阵点,制备肾肿瘤类器官效果不佳,甚至无法生成肾肿瘤类器官;而使用圆形阵点制备的肾肿瘤类器官明显优于矩形阵点。因此,采用实施例1所述方法制备胞外基质图案微阵列,改变图案微阵列中圆形阵点的尺寸(圆形阵点的直径分别为50μm、100μm、150μm、200μm),每个圆形阵点间的间距为50μm,微阵列大小为4cm2。各图案微阵列如图5所示。
65.按照实施例1所述方法采用上述胞外基质图案微阵列分别培养肾肿瘤类器官,图案微阵列在使用前,用pbs清洗1次,保证培养基底不能完全干燥,接种人肾癌细胞(os-rc-2,接种量为1.5
×
105/皿)。图案微阵列在细胞培养皿底上限制细胞的生长、粘附空间,使细胞被限定贴附在胞外基质胶图案微阵列中的阵点上生长,经过3天培养形成肾肿瘤类器官(图6)。
66.根据肾肿瘤类器官形态,死活功能选择微阵列中圆形阵点的最佳尺寸。研究发现:当圆形阵点直径太小(50μm)时,无法培养成肾肿瘤类器官;而随着圆形阵点直径增加,肾肿瘤类器官内部死细胞增多,功能活性变差,不利于作为模型评价。综合考虑,最终选择直径为100μm的圆形阵点为培养肾肿瘤类器官图案微阵列的最佳阵点,制备得到的肾肿瘤类器官形态、功能最佳。
67.综上,本发明提供了一种肾肿瘤类器官的培养方法,该方法采用特定阵点形状、尺寸、密度的肾ecm图案微阵列对肾癌细胞进行培养,制备肾肿瘤类器官,缩短了肾肿瘤类器官体外扩增培养时间,简化肾肿瘤类器官培养方式,有效改善了现有肿瘤类器官培养操作繁琐,成本较高,小规模,类器官粒径不一和不易分析观察等缺点。有效控制了肾肿瘤类器官的粒径大小与排列,提高了药物筛选的重复性与稳定性。肾脏脱细胞化ecm为肾肿瘤类器官培养提供了肿瘤微环境,有利于维持肿瘤的异质性,模拟体内肾癌组织。使用该肾肿瘤类器官进行药物筛选,具有更高效与安全性,同时pdo可进行个性化治疗,指导临床用药。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
