1.本发明属于类器官培养领域,具体涉及一种培养肺肿瘤类器官的方法。
背景技术:
2.肺癌是目前全世界发病率和死亡率最高的恶性肿瘤。根据世界癌症研究机构(iarc)的数据统计,2012年,全球肺癌新发病例约182.5万例,死亡病例约159.0万例,我国肺癌新发病例约65.3万例,死亡病例约59.7万例,是危害居民生命健康的最主要的恶性肿瘤。随着我国工业化、城市化进程的进一步加速所导致的空气污染以及吸烟率的居高不下,肺癌的危害将继续加剧。随着科学技术不断发展,肿瘤的精准治疗已进入个体化时代:一是利用高通量基因测序发现肿瘤相关突变,寻找药物靶点;二是利用肿瘤模型测试靶向药物的敏感性,验证药物靶点。但肺癌被诊断出来时往往为时已晚,如何高效短时建立能够反映病人异质性的体外模型显得尤为重要。为了解决以上问题,研究者们将目光投向了类器官技术。
3.近十年来,干细胞研究中的类器官领域得到发展。类器官属于属于三维(3d)细胞培养物,包含其代表器官的一些关键特性,可以作为多种疾病的体外模型,在干细胞与发育、再生医学、病因病理、药物开发等多个方面拥有广泛的应用前景。hans clevers最先提出肿瘤类器官概念,系统阐述了体外培养乳腺癌类器官的方法,并于2017年完成了规模宏大的乳腺癌类器官项目,建立全球首个乳腺癌类器官库。2018年2月伦敦癌症研究所george vlachogiannis团队,从71例转移性消化道癌患者的肿瘤组织取材,体外培养出肿瘤类器官进行化疗药敏测试用于指导临床用药。与患者实际疗效进行对比,类器官药敏结果获得了敏感性100%,特异性93%的惊艳数据。成功培养的肿瘤类器官在组织结构、基因组、转录组及功能上都与原始肿瘤组织高度相似,并且微观下具有自组装特性,能很好地保留了原发肿瘤的组织学和突变的特征,同时具有时效快、增殖能力强、可操纵性好等优点,且有较高的体外成活率,约为50%~80%。也正因为这样的优点,类器官可以用于精确预测实体瘤患者体内肿瘤的药物敏感性,可以用于临床指导患者体内肿瘤的精准治疗以及肺癌全程管理中的精确治疗方案选择。同时,肺癌类器官还可以构建肿瘤发生模型、研究肺癌的病因学机制、转移线索,并通过与其他细胞共培养研究肿瘤的微环境,最终会作为肺癌的个性化精确治疗的补充与现有的多组学精准医学决策体系相互补充。此外,肿瘤类器官还具有培养效率较高、可传代、冷冻保存、避免伦理争议和可进一步基因操作等优势,是肿瘤生物学研究、新药筛选和精准个体化治疗等临床前的高效转化研究手段。
4.肿瘤类器官可进行长时间传代,在传代培养过程中不丢失或改变遗传信息。保留了瘤内与瘤外的异质性。目前结直肠癌,非小细胞肺癌,乳腺癌以及胰腺癌肿瘤类器官模型已广泛应用于药物评价、生物标志物鉴定、生物学研究和个性化治疗。但是,目前肿瘤类器官的培养方法主要是与基质胶混合3d包裹式培养。这样的培养方式存在操作繁琐、成本较高、规模小、类器官粒径不一、不在同一平面、不易分析观察等缺点,不能规模化批量生产及使用。同时,现有培养肿瘤类器官的方法培养周期长,可能会造成患者病情延误。
5.因此,寻找一种快速、操作简便、成本低的方法,培养大小均一、生长在同一平面、便于分析观察的肺肿瘤类器官,实现肺肿瘤类器官快速规模化培养具有重要意义。
技术实现要素:
6.本发明的目的是提供一种培养肺肿瘤类器官的方法。
7.本发明提供了一种肺肿瘤类器官培养容器,它是内部底表面带有肺细胞外基质印迹块阵列的细胞培养容器;
8.所述底表面未覆盖肺细胞外基质的区域被封闭剂封闭;
9.所述肺细胞外基质印迹块阵列由直径为50~200μm的圆形阵点组成,每个圆形阵点间的间距为25~300μm。
10.进一步地,所述肺脏细胞外基质印迹块阵列由直径为100μm的圆形阵点组成,每个圆形阵点间的间距为50μm。
11.进一步地,所述肺细胞外基质印迹块阵列的面积为1~10cm2;
12.优选地,所述肺脏细胞外基质印迹块阵列的面积为4cm2。
13.进一步地,所述容器为培养皿、培养盒、培养板或培养瓶;
14.和/或,所述封闭剂为pluronic f-127;
15.优选地,所述pluronic f-127质量分数为1~5%。
16.进一步地,所述肺细胞外基质是猪的肺细胞外基质;
17.优选地,所述猪的肺细胞外基质的制备方法包括如下步骤:
18.(1)采用triton-sles-triton灌注法制备猪全肺脱细胞化支架;
19.(2)得到的脱细胞化肺支架冻干、粉碎后,采用胃蛋白酶酶解而得。
20.优选地,所述triton-sles-triton灌注法为取新猪肺,肺动脉插管,去除血液后将肺冷冻并解冻,采用1%triton x-100灌注3小时、随后1%月桂基聚氧乙烯醚硫酸钠(sles)灌注6小时,再采用1%triton x-100灌注3小时,最后用pbs灌注2小时平衡脱细胞化肺,即得到脱细胞化肺支架。灌注时,全程流速为100ml/min。
21.优选地,所述酶解时,粉碎后得到的肺胞外基质浓度为10mg/ml;胃蛋白酶与胞外基质粉末的质量比为1∶10。此外,酶解时ph为2,温度为室温,酶解时间为72小时。
22.进一步地,所述肺细胞外基质的浓度为0.05~0.5mg/ml;
23.优选地,所述肺细胞外基质的浓度为0.1~0.5mg/ml。
24.上述肺肿瘤类器官培养容器采用pdms微图案印刷技术制备而成:先使用激光蚀刻出具有特定图案的硅片作为模板,倒模获得具有特定尺寸的外凸圆形微图案的微阵列pdms印章,在pdms印章表面涂布肺细胞外基质胶,印压于培养容器底表面,获得胞外基质微图案阵列,再将培养容器剩余部分使用封闭剂封闭,即得肺肿瘤类器官培养容器。
25.本发明还提供了一种肺肿瘤类器官培养方法,包括如下步骤:
26.将肺癌细胞接种于前述的培养容器中,培养4~6h后洗去未贴附细胞,再培养3~5天即得肺肿瘤类器官。
27.进一步地,所述肺癌细胞的接种密度为10
4~
106个/培养容器;
28.和/或,所述肺癌细胞来源于人;
29.优选地,所述肺癌细胞的接种密度为105个/培养容器。
30.本发明还提供了一种肺肿瘤类器官,它是前述方法制备得到的肺肿瘤类器官。
31.本发明还提供了前述的肺肿瘤类器官在构建肺癌模型或药物筛选中的应用。
32.本发明提供了一种肺肿瘤类器官的培养方法,该方法采用特定阵点形状、尺寸、密度的肺脱细胞化ecm图案微阵列芯片对肺肿瘤细胞进行培养,制备肺肿瘤类器官,缩短了肺肿瘤类器官体外扩增培养时间,简化了肺肿瘤类器官培养方式,有效改善了操作繁琐,成本较高,小规模,粒径不一和不易分析观察等缺点,有效控制了肺肿瘤类器官的粒径大小与排列,提高了药物筛选的重复性与稳定性。肺脱细胞化ecm为肺肿瘤类器官培养提供了肿瘤微环境,有利于维持肿瘤的异质性,模拟体内肺癌组织。使用该肺肿瘤类器官进行药物筛选,具有更高效与安全性,同时pdo可进行个性化治疗,指导临床用药。
33.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
34.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
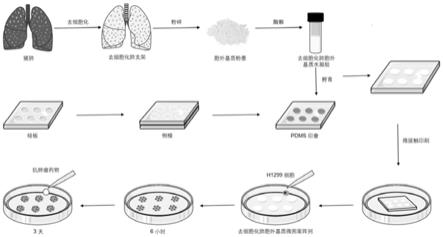
35.图1为本发明肺肿瘤类器官的培养路线。
36.图2为猪全肺脱细胞化后的结果:a为脱细胞化前后的大体观;b为脱细胞化前后的电镜图;c为脱细胞化前后的h&e染色;d为脱细胞化前后的三色胶原染色;e为脱细胞化前后的弹力纤维染色;f为脱细胞化前后的ⅳ型胶原纤维染色;g为脱细胞化前后的纤连蛋白染色;h为脱细胞化前后的层粘连蛋白染色;i为脱细胞化前后的dna含量检测结果;j为脱细胞化前后的葡萄糖胺聚糖(gag)含量检测结果;*表示p《0.05;标尺=50μm;图中native为未脱细胞,decellularized lung scaffold为脱细胞化。
37.图3为肺脱细胞化ecm粉末(a)以及肺脱细胞化ecm凝胶(b)。
38.图4为各药物作用后肺肿瘤类器官死活染色检测结果。
39.图5为通过微图案印刷技术制备得到的脱细胞化肺胞外基质图案微阵列芯片以及培养得到的肺肿瘤类器官:a为pdms印章;b为胞外基质图案微阵列;c为人肺癌细胞贴附6h的结果;d为培养3天后形成的肺肿瘤类器官;e为肺肿瘤类器官死活染色(标尺=100μm)。
具体实施方式
40.除另有说明外,本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
41.本发明肺肿瘤类器官的培养路线如图1所示,包括如下步骤:
42.(1)肺脱细胞化ecm的制备:采用triton-sles-triton灌注法制备猪全肺脱细胞化支架。得到的脱细胞化肺支架(肺细胞外基质)进一步冻干,使用球磨仪粉碎后,再用胃蛋白酶酶解,获得肺脱细胞化细胞外基质(ecm)凝胶。
43.(2)采用pdms微图案印刷技术制备图案微阵列母版:使用激光蚀刻出具有特定图案的硅片作为模板,蚀刻精度达到1μm,蚀刻面积最大达到12英寸,倒模获得聚二甲基硅氧烷(polydimethylsiloxane,pdms)印章。将细胞外基质凝胶(称为胞外基质胶或基质胶)涂
布于印章表面,然后利用pdms微图案印刷技术,将基质胶图案微阵列铺设在细胞非贴附处理的细胞培养皿的底部,pluronic f-127封闭剩余培养皿底部的空间,使加入的细胞只能贴附在基质胶图案上生长。得到肺脱细胞化ecm图案微阵列芯片。
44.(3)肺肿瘤类器官的培养:采用肺脱细胞化ecm图案微阵列芯片培养肺肿瘤类器官,缩短其体外扩增培养时间,可有效控制其粒径大小与排列。
45.实施例1、本发明肺肿瘤类器官的培养方法
46.本发明肺肿瘤类器官的培养方法包括如下步骤:
47.(1)猪肺脱细胞化胞外基质胶的制备:取新鲜猪肺后,肺动脉插管,用pbs冲洗10分钟去血。然后将肺冷冻并解冻,采用1%triton x-100灌注3小时、随后1%月桂基聚氧乙烯醚硫酸钠(sles)灌注6小时,再用1%triton x-100灌注3小时,最后用pbs灌注2小时平衡脱细胞化肺,得到脱细胞肺支架(肺细胞外基质)。灌注时,全程流速为100ml/min。然后将脱细胞肺支架(dlss)切成1
×1×
1cm的立方体进行冻干。进一步经过球磨仪粉碎得到肺脱细胞化细胞外基质粉末。采用胃蛋白酶酶解上述细胞外基质粉末,得到肺脱细胞化细胞外基质凝胶(胞外基质胶)。酶解时,细胞外基质粉末溶解于水中,浓度为10mg/ml,胃蛋白酶与细胞外基质粉末的质量比为1:10,酶解时ph为2,温度为室温,酶解时间为72小时。
48.猪肺脱细胞化后呈白色透明状,通过免疫荧光、组化以及酶联免疫吸附剂测定后,发现胞外基质蛋白得到了很好的保留(图2),进一步通过粉碎,酶解得到了脱细胞化肺胞外基质凝胶(图3)。
49.(2)使用激光蚀刻出具有特定图案的硅片作为模板,倒模获得pdms印章,制备出具有外凸圆形阵点的图案微阵列(每个圆形阵点的直径为100μm,每个圆形阵点间的间距为50μm,微阵列大小为4cm2)的pdms印章。
50.(3)使用pbs调整基质胶浓度,将1ml浓度为0.1mg/ml的猪肺脱细胞化胞外基质胶涂布于pdms印章表面,室温孵育20分钟后洗去多余的基质胶,37℃孵箱中干燥。
51.(4)使pdms印章印压于细胞非贴附培养皿内底表面,给予0.2牛顿力,持续10分钟,待图案在培养皿底表面形成后移去印章。
52.(5)加入质量分数1%pluronic f-127(普卢兰尼克f-127,一种聚丙二醇与环氧乙烷的加聚物(聚醚))室温孵育2小时,封闭剩余培养皿内底表面的空间,得到对细胞具有粘附作用的“胞外基质图案微阵列”。制作好的微阵列培养皿在使用前,先用pbs清洗3次,保证培养皿基底不能完全干燥,然后再接种细胞。
53.(6)在培养皿中接种人肺癌细胞(h1299,接种量为1.5
×
105/皿),37℃培养6h后,洗去未贴附细胞,再经过3天培养,即可形成肉眼可见的肺肿瘤类器官。这些肺肿瘤类器官均在同一平面上,大小均一,数量可控。
54.人肺癌细胞被限定贴附在“胞外基质图案微阵列”内生长。本步骤所用到的培养基为dmem高糖培养基,含有10%的胎牛血清和1%双抗。
55.通过微图案印刷技术制备得到脱细胞化肺胞外基质图案微阵列芯片,进而培养肺肿瘤细胞,经过3天培养即可形成肺肿瘤类器官。
56.以下通过具体试验例证明本发明的有益效果。
57.试验例1、本发明肺肿瘤类器官对药物进行筛选
58.实验方法
59.选择实施例1培养的直径为100μm的肺肿瘤类器官,用不同浓度(5μg/ml、10μg/ml、50μg/ml、100μg/ml)的紫杉醇、盐酸阿霉素和顺铂分别进行药筛,孵育24h和48h。使用钙黄绿素与碘化丙啶荧光双染进行死活染色分析,使用共聚焦显微镜成像分析。
60.实验结果
61.根据图4的结果可知:利用本发明培养的肺肿瘤类器官可以有效筛选药物种类、药物剂量和药物作用时间对肺肿瘤的影响。结果表明肺肿瘤类器官的活性与药物种类、药物剂量以及培养时间相关。阿霉素对肺肿瘤类器官抑制活性最好,随着阿霉素浓度和培养时间增加,肺肿瘤类器官停止生长。其次顺铂对肺肿瘤类器官抑制活性也较好,同样随浓度和培养时间增加,肺肿瘤类器官停止生长。紫杉醇对肺肿瘤类器官抑制活性相对较弱。研究发现,将类器官大小控制以及排列后,可以更好的分析以及观察药物筛选的结果。本发明肺肿瘤类器官图案微阵列芯片应用于个性化治疗与抗肿瘤药物筛选的潜在价值。
62.试验例2、本发明肺肿瘤类器官培养方法中图案微阵列的筛选
63.前期研究表明图案微阵列中,如果使用矩形阵点,制备肺肿瘤类器官效果不佳,甚至无法生成肺肿瘤类器官;而使用圆形阵点制备的肺肿瘤类器官明显优于矩形阵点。因此,采用实施例1所述方法制备胞外基质图案微阵列,改变图案微阵列中圆形阵点的尺寸(圆形阵点的直径分别为50μm、100μm、150μm、200μm),每个圆形阵点间的间距为50μm,微阵列大小为4cm2。各图案微阵列如图5a和5b所示。
64.按照实施例1所述方法采用上述胞外基质图案微阵列分别培养肺肿瘤类器官,图案微阵列在使用前,用pbs清洗1次,保证培养基底不能完全干燥,接种人肺癌细胞(h1299,接种量为1.5
×
105/皿)。图案微阵列在细胞培养皿底上限制细胞的生长、粘附空间,使细胞被限定贴附在胞外基质胶图案微阵列中的阵点上生长,经过3天培养形成肺肿瘤类器官(图5d)。
65.根据肺肿瘤类器官形态,死活功能选择微阵列中圆形阵点的最佳尺寸。研究发现:当圆形阵点直径太小(50μm)时,无法培养成肺肿瘤类器官;而随着圆形阵点直径的增加,肺肿瘤类器官内部死细胞增多,功能活性变差,不利于作为模型评价。综合考虑,最终选择直径为100μm的圆形阵点为培养肺肿瘤类器官图案微阵列的最佳阵点,制备得到的肺肿瘤类器官形态、功能最佳。
66.综上,本发明提供了一种肺肿瘤类器官的培养方法,该方法采用特定阵点形状、尺寸、密度的肺脱细胞化ecm图案微阵列芯片对肺肿瘤细胞进行培养,制备肺肿瘤类器官,缩短了肺肿瘤类器官体外扩增培养时间,简化了肺肿瘤类器官培养方式,有效改善了操作繁琐,成本较高,小规模,粒径不一和不易分析观察等缺点,有效控制了肺肿瘤类器官的粒径大小与排列,提高了药物筛选的重复性与稳定性。肺脱细胞化ecm为肺肿瘤类器官培养提供了肿瘤微环境,有利于维持肿瘤的异质性,模拟体内肺癌组织。使用该肺肿瘤类器官进行药物筛选,具有更高效与安全性,同时pdo可进行个性化治疗,指导临床用药。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
