1.本发明属于微生物技术领域,涉及一种极端嗜热微生物菌剂的制备方法及其在城市污泥堆肥中的应用。
背景技术:
2.活性污泥法是目前应用最广的城市污水处理技术,此法产生的大量的剩余污泥已成为污水处理厂亟待解决的一大难题。堆肥是城市污泥资源化和无害化处理手段中最为经济有效的途径之一,此法利用自然界广泛存在的微生物有控制性的促进固废中可生物降解的有机物转化为稳定且结构复杂的腐殖质,将有机物彻底分解利用、无中间产物生成,且无害化程度高。目前,好氧堆肥是大多数堆肥工艺系统的首选。尽管好氧堆肥工艺具有处理成本低、无害化程度高、腐熟产品适于农田利用等优点,但同时也存在初期微生物数量少繁殖慢、发酵周期长、升温速度慢、发酵最高温度普遍限制在50-70℃等问题。传统堆肥实践认为,堆肥问题最高不宜超过70℃,否则会导致功能微生物大量死亡,减缓发酵腐熟进程,而近年来已有研究表明,提高堆肥温度可以促进有机质腐熟,缩短发酵周期。
3.一些研究通过超高温预处理,即:在筑堆前通过外加热源使堆肥原材料温度迅速上升至80-85℃并维持一段时间,再进行常规堆肥,实现有机质的快速降解,缩短堆肥腐熟周期。曹云等将鸡粪稻秸超高温预处理4h后再堆肥,使得堆体提前升温,提高了堆体温度并将高温期延长了3天。然而若将此法进行工业应用,处理大体系堆肥,需消耗大量电力资源加热堆肥原材料,投资运行成本太高,不够经济环保。
技术实现要素:
4.为了解决城市污泥堆肥发酵周期长、升温速度慢、发酵最高温度受限的技术问题,本发明提供了一种极端嗜热微生物菌剂的制备方法,制得的极端嗜热微生物菌剂能够促进城市污泥堆肥升温,提高高温阶段温度至75℃以上,并有效延长堆肥高温阶段的持续时间。
5.本发明还提供了一种极端嗜热微生物菌剂在城市污泥堆肥中的应用。
6.本发明通过以下技术方案实现:
7.本技术提供一种极端嗜热微生物菌剂的制备方法,所述制备方法包括以下步骤:
8.将温度为75~85℃的热泉水接种于培养基,75℃下培养,获得微生物种子液;
9.向所述微生物种子液中加入保护剂,后按照固液比1:1.5加入载体粉末,75℃下搅拌2h,获得微生物混合液;
10.将所述微生物混合液浓缩后在75℃下进行烘干,获得极端嗜热微生物菌剂。
11.可选的,所述将温度为75~85℃的热泉水接种于培养基,75℃下培养,获得微生物种子液,具体包括:
12.将取自云南腾冲的温度为75~85℃的热泉水接种于培养基,75℃摇床,170rpm培养96h,获得微生物种子液;
13.所述培养基包括蛋白胨水培养基、酵母浸膏培养基、麦芽汁培养基、lb培养基、牛肉膏蛋白胨培养基、pdb培养基和nb培养基中的任意一种。
14.可选的,所述向所述微生物种子液中加入保护剂,后按照固液比1:1.5加入载体粉末,75℃下搅拌2h,获得微生物混合液,具体包括:
15.每100ml所述微生物种子液中加入1g保护剂,所述保护剂为脱脂乳,后按照固液比1:1.5加入过100目筛的载体粉末,75℃下搅拌2h,获得微生物混合液;
16.所述载体粉末包括高岭土、硅藻土、腐殖酸、淀粉和麦麸中的任意一种。
17.可选的,所述将所述微生物混合液浓缩后在75℃下进行烘干,获得极端嗜热微生物菌剂,具体包括:
18.将所述微生物混合液通过真空抽滤进行浓缩,后在75℃下烘干至恒重,烘干所得滤渣经磨碎后过100目筛,获得极端嗜热微生物菌剂。
19.基于同一发明构思,本技术还提供一种极端嗜热微生物菌剂在城市污泥堆肥中的应用,所述极端嗜热微生物菌剂通过上述一种极端嗜热微生物菌剂的制备方法制得。
20.基于同一发明构思,本技术还提供极端嗜热微生物,包括极端嗜热菌j5、j6、j7、cys2和j8中的至少一种,极端嗜热菌j5的16s rrna序列如seq id no.1所示,极端嗜热菌j6的16s rrna序列如seq id no.2所示,极端嗜热菌j7的16s rrna序列如seq id no.3所示,极端嗜热菌cys2的16s rrna序列如seq id no.4所示,极端嗜热菌j8的16s rrna序列如seq id no.5所示。
21.基于同一发明构思,本技术还提供极端嗜热微生物在制备极端噬热微生物菌剂中的应用。
22.本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
23.1.本发明极端嗜热微生物菌剂的制备方法,从云南腾冲热泉水样中富集极端嗜热微生物,75℃培养获得微生物种子液,并进一步将极端嗜热微生物菌剂制备成便于运输和储存的固体菌剂,制得的极端嗜热微生物菌剂经试验验证,能够促进城市污泥堆肥升温,提高高温阶段温度至75℃以上,并有效延长堆肥高温阶段的持续时间。
24.2.本发明一种极端嗜热微生物菌剂在城市污泥堆肥中的应用,将本发明极端嗜热微生物菌剂应用于城市污泥堆肥中,能够促进堆体快速升温,提升堆体的最高温度,极端嗜热微生物菌剂的施入促进了腐熟堆肥的含水率降低、明显提高有机物降解效率,进而提升城市污泥的减量化效率,具有低成本、高效率的技术优势和广泛的应用前景。
25.3.本发明极端嗜热微生物,取自云南腾冲热泉水,从极端嗜热微生物菌剂中分离获得,能够在75℃条件下生长,并且对污泥堆肥中的常见有机底物例如葡萄糖、淀粉、蛋白质和纤维素等具有不同程度的降解能力,应用在极端嗜热微生物菌剂中,能够促进城市污泥堆肥升温,高温阶段温度可达75℃以上,从而缩短城市污泥的降解周期。
附图说明
26.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
27.图1为不同培养基对嗜热微生物群落生长的影响图;
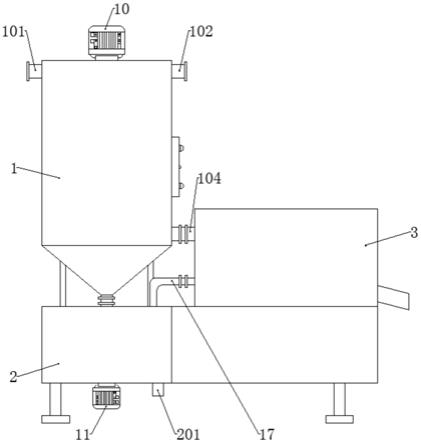
28.图2为堆肥体系示意图;
29.图3为堆肥过程中温度变化曲线图;
30.图4为堆肥过程中含水率和ph值变化曲线图;
31.图5为堆肥过程中电导率变化曲线图;
32.图6为堆肥过程中总有机碳和总氮变化曲线图;
33.图7为堆肥过程中碳氮比变化趋势图;
34.图8为堆肥过程中硝态氮和铵态氮含量变化曲线图;
35.图9为筛选出的嗜热微生物的形态特征图;
36.图10为六株单菌的生长曲线图;
37.图11为六株菌株的16s rrna基因pcr电泳图谱;
38.图12为嗜热微生物j1的系统发育树;
39.图13为嗜热微生物j5的系统发育树;
40.图14为嗜热微生物j6的系统发育树;
41.图15为嗜热微生物j7的系统发育树;
42.图16为嗜热微生物j8的系统发育树;
43.图17为嗜热微生物cys2的系统发育树。
具体实施方式
44.下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
45.下面将结合实施例及实验数据对本技术极端嗜热微生物菌剂的制备方法及其在城市污泥堆肥中的应用进行详细说明。
46.实施例1
47.极端嗜热微生物菌剂的制备方法
48.1.取云南腾冲刘家寨热泉水样,热泉温度80℃。利用无菌取样器吸取热泉水样于无菌水样采集袋中,置于干冰冰盒中低温保存并运送至实验室进行后续处理。
49.2.极端噬热微生物的富集
50.最适培养基的选择:
51.选择七种实验室常用的微生物富集培养基分别对云南腾冲热泉水样微生物进行富集。包括:
52.(1)蛋白胨水培养基:蛋白胨1.0g,k2hpo
4 0.2g,na2hpo
4 0.2g,nacl 0.5g,葡萄糖0.5g,加入去离子水定容至1000ml,ph调至7.8;(2)酵母浸膏培养基:酵母浸膏10.0g,加入去离子水定容至1000ml,ph自然;(3)麦芽汁培养基:麦芽膏粉130g,氯霉素0.1g,加入去离子水定容至1000ml,ph自然;(4)lb培养基:胰蛋白胨10.0g,酵母提取物5.0g,nacl 10.0g,加入去离子水定容至1000ml,ph调至7.0;(5)牛肉膏蛋白胨培养基:牛肉膏3.0g,蛋白胨10.0g,nacl 5.0g,加入去离子水定容至1000ml,ph调至7.5左右;(6)马铃薯葡萄糖水(pdb)培养基:马铃薯浸出粉6.0g,葡萄糖20.0g,加入去离子水定容至1000ml,ph自然;(7)营养肉
汤(nb)培养基:蛋白胨10.0g,牛肉浸粉3.0g,nacl 5.0g,加入去离子水定容至1000ml,ph自然。
53.将上述培养基分别配好后分装于150ml锥形瓶中,115℃高压蒸汽灭菌30min备用。将云南腾冲热泉水样多次摇匀后吸取10ml分别接种于上述7种培养基中,每种培养基设置3个重复,置于75℃高温摇床,170rpm培养96h,每隔24h取少量菌悬液用血球计数板在显微镜下进行微生物的计数,以时间(time)为横坐标,细菌浓度(bacterial concentration)为纵坐标绘制生长曲线,确定嗜热微生物群落的最适培养基,结果如图1所示。
54.使用上述7种培养基对云南腾冲热泉水样微生物进行发酵培养后,嗜热微生物菌剂的细菌浓度如图1(a)所示。7种培养基中嗜热微生物的生长速率在lb和nb培养基中明显高于其他培养基,在培养48h左右度过迟滞期进入对数生长期,第96h时,嗜热微生物在lb和nb培养基中的细菌浓度分别为6.56
×
108cfu/ml和2.56
×
108cfu/ml,其余培养基中的细菌浓度均低于5
×
107cfu/ml,因此选择lb和nb培养基进行传代实验,如图1(b),传代后lb和nb培养基中培养的嗜热微生物在第96h细菌浓度分别达到9.22
×
108cfu/ml和1.05
×
109cfu/ml,且均未达到平台期,nb培养基中的细菌浓度高于lb培养基,因此nb培养基作为嗜热微生物的优选发酵培养基。
55.3.固体菌剂的制备及其有效活菌数的检测
56.分别将高岭土、硅藻土、腐殖酸、淀粉和麦麸烘干后研磨过100目筛,制成载体粉末。将脱脂乳保护剂以1%(w/v)加入至极端嗜热微生物发酵液中搅拌,按固液比1:1.5分别加入上述五种载体粉末,摇匀后置于小试发酵装置中75℃搅拌2h混匀。真空抽滤,滤渣于75℃烘箱烘干、研磨后过100目筛,即得不同载体制备的极端嗜热微生物菌剂。
57.菌剂有效活菌数的测定参照国家标准农用微生物菌剂(gb 20287-2006)中所述平板计数法:分别称取1.0g固体菌剂至10ml去离子水中,静置20min后在旋转式摇床震荡制成菌悬液。吸取1ml菌悬液于9ml去离子水中,得到10-1
稀释度菌悬液,依次进行梯度稀释,得到10-1
、10-2
、10-3
……
10-9
稀释度的菌悬液,每种载体选取适宜的3个连续稀释度,吸取100μl菌悬液涂布于无菌nb固体平板上,每一稀释度做3个平行,并以去离子水作为空白对照,75℃恒温培养24-48h,通过观察菌落数量计算不同载体制备菌剂中的有效活菌数。具体计算公式为:
58.nm=(xkv1)/(m
0v2
)
×
10-8
59.式中:nm——质量有效活菌数,
×
108cfu/g;x——菌落平均数,个;k——稀释倍数;v1——基础液体积,ml;m0——样品质量,g;v2——菌悬液加入量,ml。
60.表1不同载体制备的极端嗜热微生物菌剂有效活菌数
61.62.对于微生物菌剂而言,适宜的载体可以优化微生物菌剂中的微生态环境,如吸收或分散日光紫外线的辐射、缓冲水分及空气的影响,以及吸收毒害菌体的化学物质等。如表1所示,不同载体制备的极端嗜热微生物菌剂中微生物存活率有所不同,在所用的五种载体中,高岭土制备的菌剂有效活菌数最高,为20.2
×
108cfu/g,将菌剂室温保存30天后,不同载体制备菌剂中的有效活菌数有小幅下降,但整体活菌数均保持在3
×
108cfu/g以上,符合农用微生物菌剂国家标准粉剂有效活菌数大于等于5
×
107cfu/g的技术指标。由此可见,高岭土为制备本研究所用复合极端嗜热微生物菌剂的最佳载体。
63.实施例2
64.极端噬热微生物菌剂的应用
65.1.试验材料
66.表2高温堆肥原料含水率
[0067][0068]
实验室规模污泥堆肥实验所用生污泥由长沙自来水公司三水厂提供,所用辅料包括稻壳、米糠、麸皮和锯木屑,各原料含水率及生污泥理化性质见表2和表3。
[0069]
表3生污泥理化性质
[0070][0071]
待确定各原料含水率后,将四种辅料按稻壳、米糠、麸皮和锯木屑0.5:1.5:1:1的比例混合,计算混合辅料和脱水污泥(即生污泥)的添加比例,将堆肥体系含水率控制在60%左右,再以生污泥:腐熟污泥为4:1的比例加入前期腐熟的返混污泥,最后加入1.5kg糖蜜作为起爆剂,堆肥体系总体积约为155kg。
[0072]
2试验方法
[0073]
试验设置实验组(ex)和对照组(ck)两个处理,两组原料均为:100kg生污泥 25kg腐熟污泥 30.25kg混合辅料 1.5kg糖蜜,其中,实验组和对照组的腐熟污泥为上一批次污泥高温堆肥实验组和对照组分别发酵后的腐熟产物。采用好氧静态堆肥法,将原料混匀后堆成圆锥形,底部直径约1.5m,高约1m,在距堆体底部约0.3m处等距离埋入曝气管,管末端连接曝气头,曝气量为4l/min;在堆体底部、中部、顶部等距离埋入无线温度传感器,设置温度监测时间间隔为5min,实时监测堆体温度。堆体筑好后顶部覆盖尼龙薄膜保温,膜上均匀剪出直径约3cm的通气孔。每天不定时记录堆体温度变化情况,待温度升至最高并在1h内保持不变时进行取样,在堆体不同位置测量堆温,并在最高温处附近取样,每次取样约300g,分为三部分:20g左右鲜样装入铝盒用于测含水率;10g鲜样储存于-20℃冰箱,用于测定微生物群落;剩余样品自然风干,用于测定ph值、电导率等理化性质。
[0074]
此次堆肥周期为25天,堆肥初期未接种微生物菌剂、未曝气,为自然堆肥时期,筑好堆后分别取实验组和对照组初始样品(记为ex0和ck0);27h后温度升至最高(ex65.1℃,ck66.5℃),此时在最高温处取样(记为ex1和ck1);待堆温回落至60℃时开始曝气,曝气后堆温上升,升至最高温处取样(ex67.1℃,ck64℃,记为ex2和ck2);取样后停止曝气,堆温回落,5h后在ex堆体周围等距离向堆中注入2l极端嗜热微生物菌剂,ck用同样方式注入2l富集培养基(可溶性淀粉2.68g,酸水解酪蛋白3.57g,酵母提取物5.15g,去离子水1000ml),加菌后开始曝气,待堆温升至最高时取样(ex63.1℃,ck62℃,记为ex3和ck3);随后堆温逐渐降低,待降至60℃左右时进行翻堆,期间在ex堆体中接种4l极端嗜热微生物菌剂,ck组加入4l富集培养基,分别混合均匀后重新筑成圆锥形,待其升至最高温时取样(ex70.2℃,ck64.1℃,记为ex4和ck4);后续堆肥过程中,每隔3d翻堆一次,确保物料充分混合均匀,直至堆肥腐熟,取腐熟样品(记为ex5和ck5)。
[0075]
3理化性质测定
[0076]
3.1含水率测定
[0077]
采用重量法。取10-15g新鲜堆肥样品装入铝盒(m0)中,记录盛放样品后的铝盒重量(m1),于105℃烘箱中8h,烘干至恒重(m2)。根据下列公式,计算堆肥样品含水率ω。
[0078][0079]
3.2ph值、电导率测定
[0080]
ph值测定参照国标(ny/t 1377-2007):自然风干的堆肥样品磨碎过2mm筛,取5.0g装入50ml离心管中,加入12.5ml无co2水,涡旋振荡5min,静置1-3h后测上清液ph值。
[0081]
电导率测定:称取风干过筛(100目)的堆肥样品,以水土比5:1加入蒸馏水,涡旋振荡5min后过滤,用梅特勒电导率仪(fe39-standard)测定滤液电导率。
[0082]
3.3碳氮含量测定
[0083]
总有机碳含量(toc):参照国标hj615-2011,采用重铬酸钾氧化-分光光度法。将堆肥样品风干过100目筛,称取1g样品于具塞玻璃消解管中,加入5ml重铬酸钾溶液[c(k2cr2o7)=0.27mol/l],随后缓慢加入7.5ml浓硫酸(分析纯),轻摇混匀。微波消解仪设置消解温度和时间为135℃、30min,待100℃时将玻璃消解管放入,结束后取出冷却至室温,缓慢加入50ml去离子水,冷却至室温后加入去离子水至100ml刻线,摇匀。吸取300μl于酶标板
中测定其在585nm波长处的吸光值。利用不同已知浓度的葡萄糖标准溶液绘制有机碳含量-吸光值标准曲线,根据不同堆肥样品的吸光值计算其有机碳含量。
[0084]
总氮含量:采用紫外分光光度法。称取0.5g风干过100目筛的堆肥样品于聚四氟乙烯消解管中,加入10ml 40mg/l碱性过硫酸钾溶液,125℃消解1h。样品冷却后转移至烧杯中,加入预先制备的无氨水稀释至500ml。过滤并将滤液ph调至7.0,吸取2.5ml滤液于容量瓶,加入无氨水稀释至25ml后,吸取两份300μl于酶标板中分别测定其在220nm和275nm波长处的吸光值。绘制含氮量-吸光值标准曲线,根据吸光值计算其含总氮含量;
[0085]
硝态氮和氨态氮含量:均采用氯化钾提取-分光光度法。取风干过100目筛的堆肥样品,以固液比1:5加入1mol/l氯化钾浸提液,25℃恒温摇床中振荡1h后以3000rpm离心10min,吸取两份300μl于酶标板中分别测定其在220nm和275nm波长处的吸光值,绘制硝氮含量-吸光值标准曲线,根据不同堆肥样品的吸光值计算其硝态氮含量;吸取10ml上述过程中离心后的上清液,加入40ml硝普酸钠-苯酚显色剂,振荡混匀后静置15min,加入1ml二氯异氰尿酸钠显色剂,振荡混匀后静置5h,测定其在630nm波长处的吸光值,绘制氨氮含量-吸光值标准曲线,根据不同堆肥样品的吸光值计算其氨态氮含量。
[0086]
4测定结果
[0087]
4.1堆肥过程中的温度变化
[0088]
图3显示了施加极端嗜热微生物菌剂(ex)和未施加菌剂(ck)的城市污泥堆肥温度变化情况,该过程包括快速升温、持续高温、降温和腐熟四个阶段。按照美国环境保护局的相关标准以及我国农业废弃物无害化处理标准(gb7959-87),堆肥温度在50℃以上保持5-7d或者在55℃保持3d以上是保证堆肥中有害微生物及虫卵等得以有效杀灭、保证高温堆肥卫生合格的重要条件。本次堆肥两处理在第一天即达到55℃以上并维持了一段时间,达到了上述无害化处理的标准。
[0089]
在堆肥初始阶段(0-30h),ex和ck堆体温度均迅速上升,上升幅度为每五分钟0.2-0.3℃,并在30h左右达到最高温:实验组65.1℃,对照组66.5℃。随后堆温开始缓慢下降(30-41h),待降至60℃左右时开始利用小型加氧泵进行曝气(如图2所示),曝气后堆温回升(42-47h)并在47h左右达到最高温:实验组67.1℃,对照组64℃。随后堆温缓慢下降(47-53h)。待堆温降至60℃左右时利用50ml注射器从堆体表面向内注射发酵好的极端嗜热微生物菌剂,实验组注射2l菌剂,对照组以同等方式注射2l用于发酵极端嗜热微生物的富集培养基,注射后堆温起初短暂下降,随后开始迅速上升,上升幅度为每五分钟0.2-0.5℃(53-61h),在63h左右达到最高温:实验组63.1℃,对照组62.0℃。此时菌剂施入没有明显效果,堆体最高温低于前期未加菌剂时的最高温,并且实验组和对照组差异不明显。考虑到利用注射器加菌此法存在一定的局限性,后续菌剂的施用改为翻堆时施加,保证菌剂和堆体原材料充分混合。待堆温缓慢下降至50℃左右时用铲子对实验组和对照组分别进行翻堆,翻堆时将堆肥原料摊平,实验组均匀淋洒4l极端嗜热微生物菌剂,对照组淋洒4l富集培养基,随后多次翻搅,使微生物菌剂和堆肥原材料充分接触、均匀混合后将堆体重新筑成圆锥形,堆温迅速上升(97-120h)并在120h左右达到最高温:实验组70.2℃,对照组64.1℃。此后未进一步施加菌剂,并在148h(第六天)和197h(第九天)时进行翻堆,两次翻堆后实验组最高温均在对照组以上,分别高于对照组2℃和8℃。在堆肥12d以后,随着堆肥原材料中可利用有机物的逐渐减少,两处理温度缓慢下降至趋于平稳。在此次高温好氧堆肥过程中,未施加
极端嗜热微生物菌剂时,两处理升温趋势接近一致并且实验组堆体温度比对照组较低,施加菌剂后,实验组较对照组堆体温度高、升温速度快,表明接种微生物菌剂提高了堆体中微生物的代谢活性,刺激了微生物的增殖,有利于堆肥中有机物质的利用以及虫卵和有害微生物的杀灭。
[0090]
4.2含水率、ph值和电导率变化情况
[0091]
堆肥体系中的含水率一方面可以调节堆体温度和粒径孔隙度,另一方面可以影响微生物的新陈代谢,是评价堆肥工艺的一项重要指标。如图4(a)所示,两个处理的初始含水率在65-70%,实验组(69.83%)略高于对照组(65.79%),在堆肥过程中,两处理的含水率均迅速下降,这是由于堆体温度迅速升高、水分以蒸汽的形式不断散失所致,曝气和翻堆也会在一定程度上加大水蒸气的挥发。堆肥过程中适当补充水分,将堆体含水率保持在60%左右。ex/ck3和ex/ck4分别为施加2l和4l微生物菌剂/富集培养基之后所取样品,因此含水率较之前有所上升,随后直至堆肥结束,两处理含水率均下降至40%左右。在整个堆肥周期中,实验组含水率从69.83%降至42.21%,对照组从65.79%降至41.27%,表明极端嗜热微生物菌剂的施入一定程度上促进了堆肥的含水率降低,提高了城市污泥的减量化效率。
[0092]
如图4(b)所示,实验组和对照组两处理堆肥过程中的ph值都呈现出先上升后缓慢下降的变化趋势。二者初始ph值均在6.2-6.3之间,分别上升至7.6和6.9左右。这是由于堆肥初始阶段在快速升温的过程中,一方面,污泥原材料中的大量微生物由于对高温的不耐受性,逐渐裂解死亡,其残体通过脱氨基作用产生了许多游离氨;另一方面,堆肥体系中嗜温微生物和嗜热微生物的逐渐活跃导致堆肥体系ph值上升,但同时堆肥过程中大量氨气随热量逸出,故ph值没有持续上升。后期随着堆肥过程不断进行,堆体中的大分子有机物不断分解产生小分子有机酸和各种无机物质,小分子有机酸积累导致ph值下降,实验组ph从7.6降至堆肥结束时6.9,对照组从6.9降至堆肥结束时6.4,施加了极端嗜热微生物菌剂后堆体ph值在堆肥全程中均高于对照组。
[0093]
电导率(ec)反映了堆肥体系浸出液中的离子总浓度,与堆肥底物矿化程度相关,若堆肥体系电导率过高,会对植物产生毒性和抑制作用,不但有害于植物生长,降低其生长速率和作物产量,还有可能发生烧苗现象。实验组初始电导率为4.7ms/cm,对照组为3.2ms/cm,据研究表明,堆肥电导率低于9.0ms/cm时,一般对植物种子没有毒性,不会抑制其发芽。如图5所示,实验组和对照组两处理堆体浸出液的电导率在堆肥初期均呈降低趋势,二者均降至1.3-1.5ms/cm之间,对照组电导率总体呈现先下降、再上升、后下降的趋势,实验组电导率总体变化趋势与对照组相似,在初始阶段下降一定程度后,后期小幅度上升之后再下降,其电导率一直保持在1.0-1.5ms/cm之间,总体变化幅度小于对照组。堆肥浸出液电导率上升是由于大分子有机物的不断矿化降解,产生大量磷酸盐、铵盐等无机离子,导致堆肥浸出液的电导率的逐渐上升。而后期电导率的下降一方面是由于氨气随热量和水蒸气不断逸出,同时,在微生物的利用下,可溶性无机盐不断减少,导致堆体电导率逐渐下降,最后趋于稳定。
[0094]
4.3总有机碳、总氮和碳氮比含量变化情况
[0095]
如图6(a)所示,两处理的初始有机碳含量相似,实验组为254.73
±
15.0g/kg,对照组为256.80
±
26.21g/kg,对照组略高于实验组,且在后续实验过程中,对照组有机碳含量总体来看始终高于实验组。在整个堆肥过程中,两处理的有机碳含量均呈递减趋势,这是由
于碳源作为微生物的能源物质和其细胞主要组成物质,堆肥原料中的大分子有机质例如糖类、氨基酸等被微生物分解利用,转化为co2和腐殖质等,而co2随热量逸出造成堆肥中有机碳含量不断下降。期间一到两次波动是由于注射/淋洒极端嗜热微生物菌剂时一同加入的培养基中含有大量可溶性淀粉,导致堆肥体系中有机碳含量随之增加。直至堆肥周期结束时,实验组toc含量降低32.08%,对照组降低25.01%,表明极端嗜热微生物菌剂的施入有利于堆肥中有机碳的降解,促进堆体有机物的快速矿化。
[0096]
堆肥中的氮含量是评估其农用价值的关键因素之一。在好氧堆肥过程中,有机氮经历了降解、浓缩、矿化和再固定阶段,微生物通过其生命活动不断富集矿物质中的氮,并将其转化为腐殖态氮。如图6(b)所示,两处理的总氮含量均呈现先上升后下降的变化趋势:实验组从初始12.65
±
4.55g/kg上升至15.19
±
1.31g/kg,在堆肥结束后又降至11.814
±
0.601g/kg;对照组从初始12.62
±
1.04g/kg上升至14.61
±
2.38g/kg,在堆肥结束时回落至12.57
±
1.14g/kg。其中,实验组前期总氮含量高于对照组,在接种极端嗜热微生物菌剂后,其降幅有所增加,直至堆肥结束其总氮含量均低于对照组。在堆肥前期,堆体总氮含量呈增加趋势主要是由于堆肥原料中的有机碳和有机氮均被微生物所利用,但微生物对碳氮元素的需求比例一般为25:1,对氮素的需求远低于碳素,因此,堆肥原料中有机碳的降解速率高于有机氮,导致堆肥过程中总氮的损耗率低于有机碳,所以其含量呈上升趋势。微生物代谢有机氮产生的大量nh3随着高温和翻堆等不断从堆体逸出,导致后期堆体总氮含量减少,但同时堆体含水率的减少以及有机质矿化伴随的堆体干物质重量减少,导致最终腐熟污泥中的总氮含量小幅增加或保持不变。本研究结果表明,极端嗜热微生物菌剂的施入对堆肥氮含量的影响不大,实验和对照两处理tn含量损失差异不显著(p》0.05)。
[0097]
堆肥原料的碳氮比(c/n)是评估堆肥腐熟程度的重要指标。当碳氮比在22-35之间时堆肥升温速率更快。如图7所示,实验组的初始碳氮比为20.14
±
0.94,对照组为20.35
±
1.04,在堆肥过程中,两处理的碳氮比总体变化趋势均为先降低、后增加、再降低,考虑到堆肥过程中伴随加菌时加入的培养基中含有大量营养物质,造成堆肥样品的碳氮比发生一定波动,对照组比实验组波动更为剧烈。堆肥周期结束时,实验组碳氮比降至14.64
±
0.93,对照组降至15.32
±
1.37。研究发现,腐熟污泥的理论碳氮比应趋于16,与微生物菌体碳氮比类似,两处理在反应结束时其碳氮比均低于16,据此可认为两处理均达到腐熟。
[0098]
4.4硝态氮和铵态氮含量变化情况
[0099]
如图8(a)所示,实验组和对照组的硝态氮含量在整个堆肥周期中总体均呈现先下降后上升的变化趋势。其中,实验组初始硝态氮含量为1.12
±
0.06g/kg,在第二次达到最高温时所取样品中降至最低0.27
±
0.03g/kg,随后直到堆肥结束硝态氮含量逐渐增加至0.70
±
0.08g/kg;对照组初始硝态氮含量与实验组相近,为1.10
±
0.08g/kg,在第一次达到最高温时所取样品中降至0.44
±
0.03g/kg,随后直到堆肥结束硝态氮含量逐渐增加至1.0
±
0.04g/kg。出现此变化趋势的原因在于:前期堆温迅速上升的过程中,堆肥中大多数微生物由于对高温的不耐受性导致其活性受到抑制,其硝化作用也随之受到抑制,因此堆肥中硝态氮含量于堆肥前期迅速降低;而随着高温不耐受微生物的逐渐失活,嗜热微生物及超嗜热微生物逐渐成为堆肥中的优势群体,在高温下快速生长繁殖,通过硝化作用使得堆肥中硝态氮含量逐渐上升。
[0100]
如图8(b)所示,在此次堆肥周期中,两处理的铵态氮含量总体均呈先上升后下降
的变化趋势。其中,实验组从初始3.34
±
0.44g/kg上升至7.66
±
0.56g/kg,到堆肥腐熟时重新降低至6.68
±
1.20g/kg;对照组从初始2.92
±
0.37g/kg上升至7.34
±
1.13g/kg,到堆肥腐熟时重新降至6.35
±
0.54g/kg。前期堆肥铵态氮含量上升,其原因在于堆肥原材料中的有机氮含量较高,在微生物的作用下含氮有机物(蛋白质等)被迅速分解为酰胺类化合物或氨基酸等中间体,最后形成无机铵盐,同时,堆肥初期含水率较高,生成的氨溶于水中以铵根离子形式存在,因此堆肥中铵含量前期迅速上升;而随后至堆肥结束铵含量逐渐降低,其原因则在于:一方面,堆体温度和ph值的升高使得铵根转化为氨气并随热量不断逸出;另一方面,堆肥度过高温期后,堆温逐渐下降,在此过程中微生物的腐殖化作用加强,矿质化作用减少,堆肥中的铵被其吸收转化为稳定的腐殖态氮。
[0101]
综上所述,在实验室规模下,对比研究了施加极端嗜热微生物菌剂高温堆肥(ex)与未施加菌剂普通高温堆肥(ck)过程中各项理化指标的变化情况。在此次城市污泥高温好氧堆肥实验过程中,前期未施加极端嗜热微生物菌剂时,两处理升温趋势接近一致并且实验组堆体温度比对照组略低,施加菌剂后,实验组较对照组堆体温度高、升温速度快,实验组最高温达到70.2℃,对照组64.1℃,堆肥结束时其理化指标达到我国农业废弃物无害化处理标准,且极端嗜热微生物菌剂的施入促进了堆肥的含水率降低、明显促进有机物降解(有机碳降解效率从25.01%增加至32.08%),提高了城市污泥的减量化效率,具有低成本、高效率的技术优势和广泛的应用前景。
[0102]
实施例3
[0103]
极端嗜热微生物的分离和鉴定
[0104]
1,培养基:富集培养基为营养肉汤(nb)培养基和cys培养基(成分见表4和5)。
[0105]
表4 cys培养基成分(ph7.5)
[0106][0107]
表5微量元素成分[40]
[0108][0109]
所用平板为上述培养基加1.5-2%琼脂所制。培养基于121℃蒸汽灭菌20min后可用。
[0110]
2.嗜热微生物的富集和分离
[0111]
吸取10ml发酵好的复合极端嗜热微生物菌剂分别于100ml nb和cys培养基中,置
于75℃摇床,170rpm富集培养72h,按1%接种比例将富集后的菌悬液接种至新配的nb和cys培养基中,传代富集3次后,分别采用浓度梯度稀释法和平板划线法分离单菌。其中,平板划线法是取富集后的菌悬液以10-1、10-2、10-3、
……
、10-6进行梯度稀释,取100μl稀释后的菌悬液涂布于对应的nb和cys平板上,置于55℃恒温培养箱中培养24-48h,视其生长情况而定。待平板上长出单菌落后挑取具有不同形态特征的单菌落进行划线纯化,重复划线几次,直到得到纯培养的单菌落。用灼烧灭菌后的接种针小心挑取纯培养单菌落,分别接种于30ml对应的nb和cys液体培养基中,置于75℃摇床,170rpm培养48h,取少量于显微镜下100倍油镜观察视野中微生物形态是否一致,检查其是否为纯培养,将确认为纯培养的细菌菌悬液进行革兰氏染色实验,剩余菌悬液取少量提取dna用于后续16s rrna鉴定,其余菌悬液与灭菌后的50%甘油1:1混合,保藏于-80℃冰箱。
[0112]
采用浓度梯度稀释法进行单菌分离,具体操作为:取50ml锥形瓶装入27ml nb或cys液体培养基,接入3ml富集后的菌悬液并摇匀,制成浓度为10-1的菌悬液;取3ml浓度为10-1菌悬液加入另一装有27ml nb或cys液体培养基的锥形瓶中,制成浓度为10-2的菌悬液;重复上述操作,依次制备10-1到10-9浓度梯度的菌悬液,每个梯度设置3个平行。将上述菌悬液置于75℃摇床,170rpm培养72h,取出现浑浊的菌悬液进行100倍油镜观察视野中微生物形态是否一致,初步判断是否为纯培养,再进行重复浓度梯度稀释,直到获得形态一致的菌悬液,按照上文所述步骤进行革兰氏染色实验后,取一部分菌悬液提取dna用于后续16s rrna鉴定,剩余菌悬液与灭菌后的50%甘油1:1混合,保藏于-80℃冰箱。
[0113]
3.单菌生长曲线测定
[0114]
将保藏于-80℃的5ml单菌甘油管取出化冻后分别接种于100ml预先配置灭菌冷却的nb、cys培养基活化培养48h,培养条件为75℃,170rpm。随后在无菌条件下以5%接种量转接至新鲜的nb、cys培养基中,置于75℃恒温摇床,170rpm培养,每隔2-3h吸取300μl菌液测定其在600nm波长处的吸光值,以未接菌种的nb、cys培养基作为空白对照,测定周期为72h。以时间为横坐标,吸光值od600为纵坐标,绘制单菌的生长曲线。
[0115]
4细菌生理生化特性实验
[0116]
为进一步检测所筛单菌是否具有降解堆肥原材料中各种有机物的能力,我们对其进行了一些简单的生理生化反应实验。
[0117]
4.1糖发酵实验
[0118]
按表6分别配制葡萄糖和蔗糖发酵固体培养基,调节ph值后加入3ml溴百里酚蓝的1%水溶液作为指示剂,115℃蒸汽灭菌30min后取出倒平板。取100μl培养18-24h的幼龄菌种涂布于冷却凝固的平板上,包好封口膜后于75℃恒温培养箱中培养观察。若细菌能够分解利用平板内的葡萄糖/蔗糖产酸,培养基由蓝变黄;若不能分解,则培养基仍为蓝色。
[0119]
表6糖发酵固体培养基成分(ph6.8-7.0)
[0120]
[0121]
4.2淀粉水解实验
[0122]
按表7所示配制淀粉琼脂固体培养基,调节ph值,121℃高压蒸汽灭菌20min后取出倒平板。取100μl培养18-24h的幼龄菌种涂布于冷却凝固的平板,封膜后75℃恒温培养24-48h,用滴加碘液至培养基上直至完全覆盖培养基表面,立即肉眼检视结果。若菌株能够分解淀粉,则培养基整体呈深蓝色,菌落周围产生无色透明圈;阴性反应则无透明圈。
[0123]
表7淀粉琼脂平板成分(ph7.2)
[0124][0125]
4.3纤维素水解实验
[0126]
按表8所示配制纤维素刚果红培养基平板,调节ph,121℃高压蒸汽灭菌20min后取出冷却。取100μl培养18-24h的幼龄菌种涂布于平板上,封膜后于75℃恒温培养24-48h,取出平板观察。平板整体呈红色,若菌株能够水解纤维素,则菌落周围产生无色透明圈;反之则证明菌株不能水解纤维素。
[0127]
表8纤维素刚果红平板成分(ph7.0)
[0128][0129]
4.4蛋白质水解实验
[0130]
按表9所示配制蛋白质水解固体培养基,121℃高压蒸汽灭菌20min后取出倒平板冷却。取100μl培养18-24h的幼龄菌种涂布于平板上,封膜后于75℃恒温培养24-48h后取出平板。滴加少量酸性升汞溶液倾注于平板表面,肉眼检视结果,若菌落周围有透明圈,则说明此菌株能够水解蛋白质,反之则证明该菌株不具蛋白质水解能力。
[0131]
表9蛋白质水解培养基成分(ph自然)
[0132][0133]
4.5 voges-proskauer(v-p)实验
[0134]
按表10所示配制葡萄糖蛋白胨水培养基,115℃高压蒸汽灭菌30min,冷却后接种实验菌株,置于75℃恒温培养箱中培养4d,取2.5ml培养液先加入0.6mlα萘酚纯酒精溶液,
再加入0.2ml 40%koh溶液,轻摇混匀2-5min,若培养液混合物在数分钟内变成红色,则为阳性反应;若无红色出现,于75℃孵育4h后再次观察,仍未出现红色则为阴性反应。
[0135]
表10葡萄糖蛋白胨水培养基成分(ph7.0-7.2)
[0136][0137]
4.6单菌的16s rrna鉴定及系统发育树构建
[0138]
取5ml纯化后的单菌菌悬液于10,000rpm离心1min,弃去上清,收集菌体。用细菌基因组dna提取试剂盒(百泰克)提取菌体dna。所得dna用16s通用引物27f(5
’‑
agagtttgatcctggctcag-3’)和1492r(5
’‑
tacggytaccttgttacgactt-3’)进行pcr扩增,扩增程序为:94℃预变性,5min;94℃变性,30s,56℃退火,30s,72℃延伸,90s,共30个循环;72℃延伸10min后4℃保存。取5μlpcr产物用琼脂糖凝胶电泳检验其质量,确认电泳结果为单一条带。剩余样品送至上海生工生物工程有限公司进行双端测序,鉴定菌种。
[0139]
利用软件bioedit先检测双端测序的序列质量,去除两端质量差的片段后,将双端测序的序列拼接成一条完整的序列,将此序列提交至ncbi数据库进行在线序列比对,利用软件mega9.0按照邻接法(neighbor-joining),设置自展值(bootstrap)为100,进行不同菌株的多种序列比对以及系统发育树的构建。
[0140]
结果:通过浓度梯度稀释法和平板划线法从富集的极端嗜热微生物菌剂中共分离筛选出6株单菌,对其菌落形态和个体形态进行观察。如图9所示,a、b、c、d、e、f分别为j1、j5、j6、j7、cys2和j8,其中,cys2是通过浓度梯度稀释法分离所得,其他五株为平板划线法所分离得到,j1在75℃无法生长,为嗜热菌,其余五株在75℃能够生长,为极端嗜热菌。j1、j5、j6、j7和j8在55℃恒温培养箱中培养24h,在固体平板上均形成乳白色不透明菌落(图9(a-f)),光学显微镜下观察均呈杆状,含短杆状(图9(g))和长杆状(图9(h)),其中j1、j5、j7和j8呈短杆状,菌体略微弯曲,两端粗细一致;cys2和j6单菌呈长杆状,菌体弯曲,由多个短链首尾连接排列而成。其中,j1菌落表面扁平、干燥、有皱褶,菌落呈树叶状沿划线处两侧生长;j5、j7和j8菌落形态类似:菌落呈圆形,表面凸起、光滑、湿润,用接种针挑取菌落时具有黄油状粘稠感;j6菌落表面扁平、干燥,边缘呈绒毛状,无固定大小,用接种针挑起后呈块状/片状,很难挑取单菌落;cys2菌落为浓度梯度稀释法分离得到单菌后稀释涂布于固体平板,置于75℃恒温培养箱培养48h得到,菌落呈乳白色、不透明,表面扁平、光滑、湿润,形状不规则,挑取时粘稠。
[0141]
2.生长曲线
[0142]
本实施例绘制的单菌生长曲线如图10所示,j1表现出与其他五株菌不同的生长特性,该菌株在0-6h有短暂迟滞期,6-36h进入对数生长期,细菌生长迅速,生长速率明显高于其他五株菌,36h后细菌生长趋于平稳且维持时间较长,最高od600为2.05;其余5株菌的生长趋势较为类似,迟滞期较短,对数生长期较长,j6、j7和j8在60h左右到达平台期,j5在48h到达平台期,而cys2生长较为缓慢,在72h测定结束时仍未到达平台期;五株菌的最高od600均未超过1.5,其大小顺序为j8》j7》cys2》j6》j5;尽管在测定期间内六驻菌的生长曲线都没
有明显衰亡期,但这并不影响生长曲线的走向以及对菌株对数期和稳定期的判断。可以看出,75℃培养的菌株生长速率和细菌数量明显低于55℃培养的菌株,j1的最佳培养时长为36h,j5、j6、j7和j8的最佳培养时长分别为48h、60h、60h和64h,cys2则需要72h以上。
[0143]
3.生理生化特性
[0144]
对筛选出的六株单菌进行生理生化特性分析,结果如表11所示。所筛六株菌均为革兰氏阳性菌,细胞壁较厚,在外界不良环境条件下能够更好的保持细胞形态完整,抑制机械力损伤和渗透损伤等。六株菌均能分解葡萄糖和蔗糖并产酸,淀粉水解、v-p反应均呈阳性,对纤维素和蛋白质的降解能力有所差异,详见表14。六株菌中,除cys2外,其余五株菌均能在55℃生长;此外,除j1外,其余五株菌均能在75℃生长。
[0145]
表11超嗜热微生物的生理生化特性
[0146][0147][0148]
表11中:“ ”表示阳性/能够生长,
“‑”
表示阴性/不能生长。
[0149]
4单菌的分子生物学鉴定:
[0150]
两株菌的16s rrna基因序列相似性小于97%,则可认为不是同一物种,若相似性高于97%,则需通过dna-dna杂交或其他基因序列分析方法判断二者是否为同一物种。
[0151]
表12嗜热微生物单菌16s rrna鉴定结果
[0152][0153]
提取分离出的六株嗜热菌单菌基因组dna,pcr扩增后结果见图11。可以看出,扩增
出的目的基因片段长度均为1500bp左右,经双向测序后拼接双链,上传序列至ncbi,利用blast将基因序列与genbank中已知序列进行比对分析后,寻找与其相似性最高的菌种,确定所筛单菌的分类地位,获得嗜热菌菌株近缘种相似种属。结果如表12所示。其中,j1、j5、j7和j8均从属于为bacillus属,与其16s rrna序列相似性最高的菌株分别为bacillus licheniformis strain q63(99.65%)、bacillus sp.sp79(99.65%)、bacillus amyloliquefaciens strain tps17(100%)和bacillus sp.sp22(99.79%);j6和cys2为thermaerobacter,与其16s rrna序列相似性最高的菌株分别为thermaerobacter sp.strain fw80(99.79%)和thermaerobacter composti jcm 15650strain ni80(99.86%)。下载与这六株菌具有不同程度相似性的菌株fasta序列,用mega 9.0中邻接法(neighbor-joining methods)构建系统发育树,确定了它们的分类归属(图12至图17)。综上所述,本研究从复合嗜热微生物菌剂中分离5株极端嗜热菌和一株嗜热菌,除j1外,其余五株菌均能在75℃生长,通过生理生化特性实验发现这六株菌均为革兰氏阳性菌,并且对污泥堆肥中的常见有机底物例如葡萄糖、淀粉、蛋白质和纤维素等具有不同程度的降解能力;进一步通过16s rrna基因序列分析发现,这六株菌主要分布于bacillus和thermaerobacter两个属,分别为bacillus licheniformis j1、bacillus sp.j5、bacillus amyloliquefaciens j7和bacillus sp.j8,以及thermaerobacter composti cys2和thermaerobacter sp.j6。
[0154]
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0155]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。