端粒g四链体dna与硫黄素t介导的荧光生物传感器及其在lncrna检测中的应用
技术领域
1.本发明属于荧光检测技术领域,具体涉及一种端粒g四链体dna与硫黄素t介导的荧光生物传感器及其在lncrna检测中的应用。
背景技术:
2.本发明背景技术中公开的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.非编码rna(noncoding rnas,ncrna)是一类rna分子,包含多种类型的rna转录物,具有蛋白质编码能力,它们参与许多生物过程,例如染色质修饰,转录后调控和表观遗传学。ncrna包括小非编码rna(small non-coding rnas,small ncrna)和长非编码rna(long non-coding rnas,lncrna)。其中,lncrna最初被认为是没有生物学功能的转录“噪音”。然而,最近的研究表明,lncrna在生物过程(例如,染色质重塑、转录调控、转录后调控和细胞质中蛋白质的运输)和病理过程(例如,氨基酸代谢、葡萄糖代谢紊乱、免疫系统功能改变、脂质代谢紊乱)中发挥着关键作用。此外,lncrna参与多种与肿瘤相关的生物学过程,例如细胞分化、凋亡、迁移、侵袭和转移。lncrna(例如,hox基因反义基因间rna(hox gene antisense intergenic rna,hotair)可以促进组蛋白h3k27的甲基化,从而诱导表观遗传和基因沉默的变化。hotair的高表达可以通过沉默抑癌基因的表达来促进肿瘤的生长和转移,而hotair表达的下调可以减少肿瘤的生长和转移。此外,lncrna可用作疾病生物标志物。因此,lncrnas的灵敏检测对于深入了解lncrnas的功能、临床诊断和治疗至关重要。
4.检测lncrna的常规方法包括微阵列、rna测序、数字pcr(digital pcr,dpcr)和定量聚合酶链反应(quantitative polymerase chain reaction,qrt-pcr)。微阵列和rna测序促进了新rna的发现,但它们受到昂贵仪器、特异性差和分析时间长的限制。qrt-pcr和dpcr能够灵敏检测低丰度的lncrna,但qrt-pcr需要通过精密仪器精确控制反应温度,而dpcr涉及复杂的样品预处理、昂贵的设备和试剂。最近,已经引入了各种等温扩增技术来检测mirna,包括环介导等温扩增、等温指数扩增反应和滚环扩增,但他们不能直接检测lncrna,因为长的lncrna不能作为引物。在基于等温扩增的荧光检测中,猝灭staudinger触发的报告探针(quenched staudinger-triggered reporters)、ssdna报告探针(ssdna reporters)、分子信标经常用于信号输出,但发明人发现,它们通常受到有机染料和荧光标记的限制,包括自淬灭不完全、稳定性差、容易降解、光漂白以及成本高。因此,迫切需要构建一种灵敏且无标记的lncrna检测方法。
技术实现要素:
5.针对现有技术中的不足,本发明提供一种端粒g四链体dna与硫黄素t介导的荧光生物传感器及其在lncrna检测中的应用。本发明设计的荧光生物传感器基于双链特异性核
酸酶(duplex-specific nuclease,dsn)介导的靶标回收、末端转移酶(terminal transferase,tdt)诱导的扩增和硫磺素t(thioflavin t,tht)/g-四链体复合物诱导的增强荧光方法用于无标记来灵敏地检测细胞中的lncrna,具有极佳的灵敏度和特异性,为基于lncrna的生物医学研究、临床诊断和治疗提供了一个有价值的平台,因此具有良好的实际应用之价值。
6.为实现上述技术目的,本发明的技术方案如下:
7.本发明的第一个方面,提供一种端粒g四链体dna与硫黄素t介导的荧光生物传感器,所述荧光生物传感器至少包括dna捕获探针,信号探针,双链特异性核酸酶,末端转移酶和硫磺素t;
8.其中,所述dna捕获探针具有与待测lncrna特异性杂交的互补区域,从而可以获得dna捕获探针-lncrna异源双链体;
9.进一步的,所述dna捕获探针近5'端设置有t9间隔区(即9个t碱基),用于减少末端转移酶延伸反应的空间位阻;所述dna捕获探针5'末端修饰有生物素,从而与链霉亲和素的磁珠结合;所述dna捕获探针3'末端修饰有spacer c3间隔子,从而用于避免靶标非依赖性聚合酶扩增;
10.所述信号探针包括端粒g四链体dna片段和聚t碱基链;
11.其中,所述端粒g四链体dna为人端粒g四链体dna,从而用于与硫磺素t特异性结合。
12.所述荧光生物传感器还包括链霉亲和素包被的磁珠。
13.本发明的第二个方面,提供上述荧光生物传感器在检测lncrna中的应用。
14.其中,所述lncrna可以为任意lncrna,如lncrna hotair、lncrna malat1等。
15.本发明的第三个方面,提供一种检测lncrna的方法,所述方法包括采用上述荧光生物传感器进行检测。
16.本发明的第四个方面,提供上述生物传感器和/或检测方法在lncrna相关药物筛选和/或生物样品lncrna分析中的应用。
17.需要说明的,本发明虽然以检测lncrna hotair为例,提供相关荧光生物传感器以及检测方法,但是基于本发明的构思,如将dna捕获探针中的与待测lncrna特异性杂交的互补区域进行替换用于检测其他lncrna显然也是容易想到的,因此同样应属于本发明的保护范围。
18.上述一个或多个技术方案的有益技术效果:
19.1.上述技术方案提出了一种新的无标记方法:通过人类端粒g-四链体dna与硫黄素t结合诱导的荧光来检测癌细胞中的lncrna。
20.2.上述技术方案荧光信号高:tht是一种荧光染料,可与g-四链体特异性结合。在存在k
的情况下,人类端粒的四重折叠能诱导tht产生显著增强的荧光。
21.3.高灵敏度和特异性:上述技术方案使用tht作为信号报告元件来感知靶标lncrna,进一步引入dsn辅助的靶标回收、磁分离和tdt介导的扩增方法,以提高灵敏度和特异性。
22.4.检测不同种类癌细胞中的lncrna:通过简单地改变捕获探针序列来实现对不同lncrna的检测,甚至可以区分癌细胞与正常细胞,因此具有良好的实际应用之价值。
附图说明
23.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
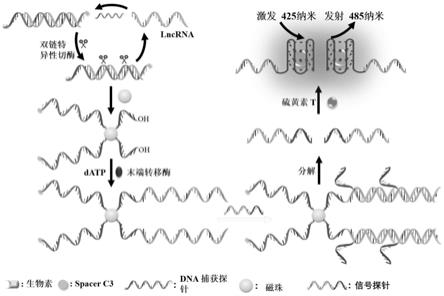
24.图1为本发明基于端粒g四链体dna与硫黄素t介导的荧光生物传感器用于检测lncrna的原理示意图。
25.图2为本发明实施例中可行性试验相关图;其中,a为page分析dsn催化的循环裂解产物。泳道m,20bp dna标记(dna marker);泳道1,捕获探针 dsn;泳道2,lncrna hotair 捕获探针 dsn;泳道3,捕获探针;泳道4,lncrna hotair;泳道5,捕获探针 lncrna hotair;b为dsn激活的tdt介导的扩增产物的page分析。泳道m,20bp dna marker;泳道1,捕获探针 dsn 磁珠 tdt,磁分离洗脱;泳道2,lncrna hotair 捕获探针 dsn 磁珠 tdt,磁分离洗脱。sybr gold作为荧光指示剂;c为lncrna hotair存在(1)和不存在(2)时的荧光发射光谱。实验中使用了100纳摩尔每升hotair、100纳摩尔每升捕获探针、0.01单位每微升dsn、1.25微升磁珠、0.27单位每微升tdt和2微摩尔每升信号探针。
26.图3为本发明实施例中磁珠-聚(a)链-信号探针-tht结构在hotair存在和不存在下的荧光图像。比例尺为5微米;其中,a-c为hotair存在情况下的荧光图像;d-f为不存在hotair情况下的荧光图像。
27.图4为本发明实施例中不同浓度hotair产生的tht/g-四链体复合物诱导的荧光信号图,其中,a为不同浓度hotair产生的荧光发射光谱;b为从10-5
到1纳摩尔每升,荧光强度对hotair浓度对数之间的线性关系。
28.图5为本发明实施例中灵敏度检测相关图,其中,a为荧光强度与信号探针数量之间的线性关系;b为信号探针的总数和信号探针的平均数分别在10-5
到1纳摩尔每升的范围内与hotair浓度的对数呈线性相关。误差棒显示三个实验的标准偏差。
29.图6为本发明实施例中特异性检测相关图,其中,a为分别为100纳摩尔每升hotair、100纳摩尔每升malat1、100纳摩尔每升let-7a、100纳摩尔每升mir-21、100纳摩尔每升mir-155和对照组产生的荧光强度;b为使用相应的捕获探针测量hotair和malat1。每个捕获探针的浓度为100纳摩尔每升。
30.图7为本发明实施例中细胞试验图,其中a为癌细胞(hct-116细胞、mcf-7细胞、h1975细胞、hela细胞和a549细胞)和正常细胞(hbe细胞)产生的荧光强度。本实验使用了从5
×
105个不同细胞系中提取的总rna。**p《0.01与正常hbe细胞相比,*p《0.05与正常hbe细胞相比;b为荧光强度与hct-116细胞数对数之间的线性关系。
31.图8为本发明实施例中不同数量的htc-116细胞的荧光发射光谱的测量图。
具体实施方式
32.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
33.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包
括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
34.现结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到。
35.如前所述,检测lncrna的常规方法包括微阵列、rna测序、数字pcr和定量聚合酶链反应。微阵列和rna测序促进了新rna的发现,但它们受到昂贵仪器、特异性差和分析时间长的限制。qrt-pcr和dpcr能够灵敏检测低丰度的lncrna,但qrt-pcr需要通过精密仪器精确控制反应温度,而dpcr涉及复杂的样品预处理、昂贵的设备和试剂。最近,已经引入了各种等温扩增技术来检测mirna,包括环介导等温扩增、等温指数扩增反应和滚环扩增,但他们不能直接检测lncrna,因为长的lncrna不能作为引物。在基于等温扩增的荧光检测中,分子信标等经常用于信号输出,但它们通常受到有机染料和荧光标记的限制,包括自淬灭不完全、稳定性差、容易降解、光漂白以及成本高。
36.有鉴于此,本发明构建一种基于双链特异性核酸酶(dsn)介导的靶标循环、tdt诱导的扩增和硫磺素t(tht)/g-四链体复合物诱导的荧光方法用于无标记灵敏地检测癌细胞中的lncrna。该方法能够灵敏检测lncrna hotair,检测限为1.7飞摩尔每升。通过简单地改变捕获探针序列,该方法可以进一步用于检测不同的lncrna和精确测量各种癌细胞中的lncrna hotair。此外,它可以量化癌细胞中的rna干扰结果。这为基于lncrna的生物医学研究、临床诊断和治疗提供了一个有价值的平台。
37.g-四链体可以作为核酸生物传感的响应/信号分子。硫磺素t是一种荧光染料,可与g-四链体特异性结合产生显著增强的荧光。在本发明中,提出了一种新的无标记方法,通过人类端粒g-四链体dna与硫黄素t结合诱导的荧光来检测癌细胞中的lncrna。在此,使用硫磺素t作为信号报告元件来感知靶标lncrna,同时引入dsn辅助的靶标回收、磁分离和tdt介导的扩增方法,以提高灵敏度和特异性。dna捕获探针与lncrna特异性杂交,获得dna捕获探针-lncrna异源双链体。随后,双链特异性核酸酶选择性水解异源双链中的dna捕获探针,导致lncrna和具有3'-oh末端ssdna片段的释放。释放的lncrna与新捕获探针的杂交启动了新一轮的dsn切割反应,产生了大量具有3'-oh末端的ssdna片段;5'端被生物素化的捕获探针可以通过与生物素链霉亲和素相互作用组装到磁珠的表面,然后tdt催化三磷酸脱氧腺苷同具有3'-oh末端的ssdna片段作用来获得长聚腺嘌呤链;长聚腺嘌呤链捕获信号探针,随后分离并加入tht,从而获得特异性增强的荧光。本技术具备高灵敏度,检测限为1.7飞摩尔每升,并且可以通过简单地改变捕获探针序列来实现对不同lncrna的检测。该方法可进一步用于检测不同种类癌细胞中的lncrna,甚至可以区分癌细胞与正常细胞。此外,该方法可用于量化癌细胞中干扰rna介导的lncrna hotair的基因沉默。
38.其实验原理(如图1):使用hox基因反义基因间rna作为模型长链非编码rna。图1展示了hox基因反义基因间rna检测的原理:5'-末端生物素化的dna捕获探针设计有t9间隔区(9个t碱基),用于减少末端转移酶延伸反应的空间位阻,互补区域用于捕获目标物hox基因反义基因间rna,以及spacer c3修饰的3'-末端用于避免靶标非依赖性聚合酶扩增。捕获探针的互补区域可以与lncrna特异性杂交,获得捕获探针-lncrna异源双链体。随后,双链特异性核酸酶(dsn,它对双链dna和dna-rna杂交体中的dna显示出很强的切割活性)选择性水
解异源双链中的捕获探针,导致长链非编码rna和具有3'-oh末端单链dna片段的释放。释放的长链非编码rna与新捕获探针的杂交启动了新一轮的双链特异性核酸酶切割反应,产生了大量具有3'-oh末端的单链dna片段。由于捕获探针的5'端被生物素化,因此获得的单链dna片段可以通过生物素-链霉亲和素相互作用组装到磁珠的表面。然后末端转移酶(一种不依赖模板的dna聚合酶)催化三磷酸脱氧腺苷连接到具有3'-oh末端的单链dna片段作用来获得长聚腺嘌呤链。为了实现荧光响应,设计的信号探针包含两个部分:(1)人端粒g四链体dna片段用于与硫磺素t特异性结合;(2)聚(t碱基)链用于与所获得长聚(a碱基)链杂交以形成稳定的双链体结构。因此,磁珠表面合成的长聚(a碱基)链可以与许多信号探针杂交以构建磁珠-聚(a)链-信号探针复合物。磁分离后,捕获的信号探针通过去离子水和加热处理释放。最后,硫磺素t与释放信号探针的g四链体dna结构域特异性结合,在485纳米处产生增强型荧光信号。本研究利用双链特异性核酸酶优异的特异性和切割效率、末端转移酶介导的高效扩增以及硫磺素t/g-四链体复合物增强型荧光来实现hox基因反义基因间rna的灵敏检测。
39.因此,本发明的一个典型具体实施方式中,提供一种端粒g四链体dna与硫黄素t介导的荧光生物传感器,所述荧光生物传感器至少包括捕获探针,信号探针,双链特异性核酸酶,末端转移酶和硫磺素t;
40.其中,所述捕获探针具有与待测lncrna特异性杂交的互补区域,从而可以获得捕获探针-lncrna异源双链体;
41.进一步的,所述dna捕获探针近5'端设置有t9间隔区(即9个t碱基),用于减少末端转移酶延伸反应的空间位阻;所述dna捕获探针5'末端修饰有生物素,从而与链霉亲和素的磁珠结合;所述dna捕获探针3'末端修饰有spacer c3间隔子,从而用于避免靶标非依赖性聚合酶扩增;
42.所述信号探针包括端粒g四链体dna片段和聚t碱基链;
43.其中,所述端粒g四链体dna为人端粒g四链体dna,从而用于与硫磺素t特异性结合。
44.所述荧光生物传感器还包括链霉亲和素包被的磁珠。
45.所述荧光生物传感器还包括三磷酸脱氧腺苷、氯化钴、氯化钾等;
46.进一步的,所述荧光生物传感器还包括缓冲液,所述缓冲液为双链特异性核酸酶缓冲液,具体为:5毫摩尔每升氯化镁、1毫摩尔每升二硫苏糖醇、50毫摩尔每升三羟甲基氨基甲烷-盐酸,ph 8.0。
47.本发明的又一具体实施方式中,提供上述荧光生物传感器在检测lncrna中的应用。
48.其中,所述lncrna可以为任意lncrna,如lncrna hotair、lncrna malat1等。
49.本发明的又一具体实施方式中,提供一种检测lncrna的方法,所述方法包括采用上述荧光生物传感器进行检测。
50.具体的,所述方法包括:
51.s1、将待测样品与上述捕获探针、双链特异性核酸酶进行孵育;
52.s2、将链霉亲和素包被的磁珠加入上述步骤s1获得的产物中进行孵育后进行磁分离,洗涤重悬后向其中加入末端转移酶进行孵育;
53.s3、将信号探针加入上述步骤s2获得的产物中进行混合得混合物,洗涤重悬后加热孵育,从而使信号探针从磁珠上洗脱;磁分离后加入氯化钾和硫磺素t进行孵育。
54.其中,所述步骤s1中,所述孵育条件为:在50~60℃(优选为55℃)孵育0.5-2小时(优选为1小时);
55.所述步骤s2中,加入末端转移酶进行孵育的具体条件为:在30~40℃(优选为37℃)下孵育0.5~2小时(优选为1.5小时);
56.所述步骤s3中,混合反应具体条件为;在室温下混合10-60分钟(优选为30分钟);
57.加热孵育具体条件为:在30~40℃(优选为37℃)下孵育10-60分钟(优选为30分钟);
58.磁分离后加入氯化钾和硫磺素t进行孵育的具体条件为:在30~40℃(优选为37℃)下孵育10-60分钟(优选为30分钟)。
59.本发明的又一具体实施方式中,所述方法还包括对步骤s3获得的反应产物进行荧光检测分析。
60.所述荧光检测分析具体为:反应产物的发射光谱在425nm激发波长下获得,并将485nm处的荧光强度进行数据分析。
61.其中,所述待测样品可以是生物样品,包括离体的血液、体液、组织和细胞,经试验证明,本发明荧光生物传感器能够在细胞水平灵敏检测细胞内的lncrna。
62.本发明又一具体实施方式中,提供上述生物传感器和/或检测方法在lncrna相关药物筛选和/或生物样品lncrna分析中的应用。
63.所述生物样品包括离体的血液、体液、组织和细胞,经试验证明,本发明的荧光生物传感器能够在细胞水平灵敏检测细胞内的lncrna,因此在生物医学基础研究(如区分正常细胞与癌细胞)以及临床诊断(如分子诊断以及即时检测等)领域具有广泛的应用价值。
64.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。下述实施例中,使用相关探针等核苷酸序列如下所示:
[0065][0066][0067]
实施例
[0068]
实验方法
[0069]
1.双链特异性核酸酶(duplex-specific nuclease,dsn)激活磁珠表面的末端转移酶(terminal transferase,tdt)扩增:
[0070]
将不同浓度的hox基因反义基因间rna(hox gene antisense intergenic rna,hotair)加入含有1
×
双链特异性核酸酶主缓冲液(5毫摩尔每升氯化镁、1毫摩尔每升二硫
苏糖醇、50毫摩尔每升三羟甲基氨基甲烷-盐酸,ph 8.0)、100纳摩尔每升hox基因反义基因间rna捕获探针、20单位rna酶抑制剂和0.2单位双链特异性核酸酶的溶液(20微升)中,并在55℃下孵育1小时。随后,将1.25微升磁珠(12.5微克)与20微升双链特异性核酸酶裂解产物孵育30分钟。为了去除未结合的产物,将反应溶液进行磁分离,然后用1
×
洗涤连接缓冲液洗涤5次,并用20微升的去离子水重悬。然后将混合物与1
×
双链特异性核酸酶缓冲液、500微摩尔每升三磷酸脱氧腺苷、8单位末端转移酶、0.25毫摩尔每升氯化钴的溶液(30微升)在37℃下孵育90分钟。
[0071]
2.荧光测量:
[0072]
末端转移酶扩增产物与2微摩尔每升信号探针室温混合30分钟。将混合物用1
×
洗涤连接缓冲液洗涤5次后,加入40微升去离子水重悬然后在37℃下孵育30分钟,从磁珠上洗脱信号探针。磁分离后,将0.2摩尔每升氯化钾和20微摩尔每升硫磺素t(thioflavin t,tht)与上清液(50微升)在37℃下孵育30分钟。反应产物的发射光谱采用fls-1000荧光光谱仪(爱丁堡仪器有限公司,利文斯顿,英国)在425纳米激发波长下获得,并将485纳米处的荧光强度进行数据分析。误差棒代表三个实验的标准偏差。
[0073]
3.基于全内反射荧光显微镜的成像:
[0074]
磁珠的图像是根据之前报导的通过使用全内反射荧光显微镜获得的。2微摩尔每升信号探针与末端转移酶扩增产物杂交后,加入20微摩尔每升硫磺素t和0.2摩尔每升氯化钾,37℃孵育30分钟,得到磁珠/信号探针/硫磺素t复合物。磁分离和洗涤后,磁珠被重新悬浮并通过uapon60
×
物镜(1.49na,olympus)成像。
[0075]
4.细胞培养和细胞提取物的制备:
[0076]
所有细胞均在含有5%二氧化碳的100%加湿室中在37℃下培养。人宫颈癌细胞系(hela细胞)、肺腺癌细胞系(a549细胞)和乳腺癌细胞系(mcf-7细胞)在dulbecco改良eagle培养基(dmem)中培养,并添加10%胎牛血清(fbs)和1%青霉素-链霉素。人支气管上皮细胞系(hbe细胞)在kerationcyte培养基(研究实验室,加利福尼亚州,美国)中培养。人肺腺癌细胞系(h1975细胞)在1640培养基(rpmi)(吉本,美国)中培养,其中含有10%胎牛血清和1%青霉素-链霉素。人结肠直肠癌细胞系(hct-116细胞)在含有10%胎牛血清和1%青霉素-链霉素的mccoy's 5a改良培养基中培养。含长链非编码rna的总rna根据mirneasy mini kit(凯杰,德国)试剂盒的说明书提取获得,其浓度用nanodrop 2000c分光光度计(赛默飞,威明顿市,美国)测定。总rna提取物于-80℃分装保存。
[0077]
5.细胞转染
[0078]
根据说明书lipofectaminetm 3000(赛默飞)用小分子干扰-hotair(small interfering-hotair,si-hotair)和阴性对照干扰rna(negative control sirna,nc-sirna)转染hct-116细胞24小时,然后分为三组:对照组、阴性对照组和sir-hotair组。转染后,收集总rna提取物并用于后续实验。
[0079]
实验结果
[0080]
1.可行性实验
[0081]
采用12%非变性聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,page)分析来验证dsn催化的捕获探针循环裂解。与捕获探针(图2a,泳道3)和hotair(图2a,泳道4)的带相比,lncrna hotair dna捕获探针 dsn(图2a,泳道2)中,捕获探针带消失,切
割下来的捕获探针条带出现,这表明捕获探针-hotair异源双链中的捕获探针可以被dsn特异性切割。为了研究被dsn激活后的tdt扩增,采用了12%page来分析扩增产物。在lncrna hotair dna捕获探针 dsn 磁珠 tdt(图2b,泳道2)中,检测到一条明显的延伸产物带,这表明dsn辅助切割捕获探针可以启动tdt介导的扩增。相反,没有检测到捕获探针 dsn 磁珠 tdt的延伸产物带(图2b,泳道1),这表明当lncrna hotair不存在时,捕获探针裂解和tdt介导的扩增都不会发生。进一步进行了荧光测量(图2c)和单颗粒成像(图3)来验证通过tdt介导的扩增产物捕获信号探针。hotair存在下,产物可以在485纳米处产生增强的荧光信号(图2c,1),而没有hotair则不能产生明显的荧光信号(图2c,2)。此外,当存在hotair时,会检测到磁珠上明亮而强烈的tht-g四链体荧光信号(图3b)。相比之下,没有hotair的对照组中则没有来自磁珠的荧光信号(图3e)。这些结果表明lncrna hotair诱导的dsn激活的tdt扩增产物可以捕获信号探针并触发tht与g四链体dna的结合以产生增强的荧光信号。
[0082]
2.灵敏度检测
[0083]
在最优条件下,测量了由不同浓度hotair产生的tht/g-四链体复合物诱导的荧光信号。如图4所示,随着hotair的浓度从10飞摩尔每升增加到10纳摩尔每升,tht/g-四链体复合物诱导的荧光信号依次增强,于hotair浓度为50纳摩尔每升时达到平台期。hotair浓度在10飞摩尔每升到1皮摩尔每升范围内时,荧光强度(f)与hotair浓度(c)的对数形式呈线性相关(图4b的插图)。回归方程为f=31856.00 4274.44log
10 c(r2=0.994)。lod为1.7飞摩尔每升。值得注意的是,该方法的灵敏度比基于dsn的荧光测定(100飞摩尔每升)提高了60倍,比基于dsn/纳米片的荧光测定(300飞摩尔每升)提高了18倍,比基于dsn的电催化扩增试验(100皮摩尔每升)提高了6
×
104倍。灵敏度提高可归因于以下因素:(1)捕获探针的dsn辅助循环裂解诱导产生大量具有3'-oh末端的ssdna片段,(2)dsn对dna-rna杂交体中单链捕获探针的高特异性,(3)能有效捕获由tdt介导的聚合扩增诱导的众多信号探针,(4)由于tht与信号探针的特异性结合,增强了荧光信号。此外,根据荧光强度与hotair浓度(图4)与捕获的信号探针数量(图5a)的标准曲线,进一步研究了捕获的信号探针数量与靶标hotair浓度(图5b)的关系。
[0084]
3.特异性实验
[0085]
为了评估该方法的特异性,使用lncrna转移相关肺腺癌转录物-1(lncrna metastasis-associated lung adenocarcinoma transcript-1,lncrna malat1)和三种mirna(即let 7a、mirna-21和mirna-155)作为潜在干扰物。图6a显示hotair产生的高荧光信号可以与malat1、let 7a、mirna-21、mirna-155和没有任何rna的对照组产生的荧光信号区分开来。这些结果表明,该方法能够以高特异性区分靶标lncrna hotair、无关lncrna和其他干扰mirna。
[0086]
使用相应的捕获探针进一步测量了lncrna hotair和lncrna malat1的混合物。高荧光信号仅在基于hotair捕获探针 lncrna hotair和lncrna malat1捕获探针 lncrna malat1时分别产生(图6b),并且获得的荧光信号与浓度具有相关性,进一步证实了该方法的良好特异性。
[0087]
4.细胞实验
[0088]
采用上述方法来检测人结直肠癌细胞系(hct-116细胞)、人乳腺癌细胞系(mcf-7细胞)、人宫颈癌细胞系(hela细胞)、人肺腺癌细胞系(a549细胞、h1975细胞)和人支气管上
皮细胞系(hbe细胞)(图7a)中的内源性lncrna hotair。与在正常细胞系(例如hbe细胞)中获得的弱荧光信号不同,癌细胞(即hct-116细胞、a549细胞、h1975细胞、hela细胞和mcf-7细胞)中能检测到增强的荧光信号。值得注意的是,各种癌细胞中的lncrna hotair水平远高于正常hbe细胞中的水平,这与之前的研究非常吻合,表明该方法可以很好地区分正常细胞和癌细胞之间的lncrna hotair表达。
[0089]
进一步测量了来自不同数量的hct-116细胞的lncrna hotair(图8)。随着hct-116细胞数从10增加到5
×
105个,荧光信号依次增强(图7b),并且荧光强度(f)与hct-116细胞数(n)从10到5
×
105个细胞数的对数呈线性相关,相关方程为f=6298.62 5526.59log
10 n(r2=0.9994)。细胞检测限为2个细胞。
[0090]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
