padm3c感染大鼠胰腺导管细胞促进转分化方法
技术领域
1.本发明属于分子生物学细胞免疫技术领域。具体涉及padm3c感染大鼠胰腺导管细胞促进转分化方法。
背景技术:
2.大鼠胰腺导管细胞的分离纯化培养,目前国内研究者多采用消化酶对胰腺组织直接消化分离,通过利用促进上皮细胞生长的培养基对原代细胞进行筛选培养,存活下来的细胞则认为是含有胰腺导管细胞的细胞群。胰腺导管细胞因为获取困难,培养不易,鉴定复杂,故研究的课题组较少,目前较常用的消化酶直接消化法获得的原代细胞,一方面,细胞获得率太低,另一方面细胞纯度不够,有很多成纤维细胞、腺泡细胞、胰岛细胞等混杂。目前国内未见采用腺病毒对胰腺导管细胞进行转分化的报道。
技术实现要素:
3.本发明的目的在于,针对上述问题,提供pad-m3c感染大鼠胰腺导管细胞促进转分化方法。
4.为实现上述目的,本发明采用如下技术方案:一种胰腺导管细胞分离培养基,包括培养基a、培养基b和培养基c,其中,培养基a为含10vol�s的cmrl1066培养基;培养基b为含0.02vol%大豆胰酶抑制剂、10vol�s、100μg /ml pen strep的cmrl1066培养基;培养基c为含20 ng /ml egf、10 ng /ml kgf、10 mm烟酰胺、25 mm glucose、100μg /ml pen strep、10vol�s的dmem / f12培养基。
5.一种密度梯度离心分离胰岛细胞的分离液,包括分离液a、分离液b和分离液c,其中,分离液a由biocoll分离液与hanks液按体积比为20:1的比例混合配制而成,密度为1.096 g/ml;分离液b由分离液a与hanks液按体积比为6.4 : 1.1的比例混合配制而成,密度为1.085g/ml;分离液c由分离液b与hanks液按体积比为2.4: 2.6的比例混合配制而成,密度为1.051g/ml。
6.pad-m3c感染大鼠胰腺导管细胞促进转分化方法,包括以下步骤:(1)使用biocoll分离液通过密度梯度离心分离胰岛细胞:利用密度梯度离心分离胰岛细胞的分离液分离胰岛细胞;(2)胰腺导管细胞分离;利用胰腺导管细胞分离培养基分离胰腺导管细胞;(3)利用腺病毒pad-m3c进行转分化诱导:腺病毒pad-m3c感染步骤(2)分离的胰腺导管细胞。
7.上述步骤(1)包括以下具体步骤:1)加分离液a液于胰岛中,轻轻混匀,小心勿起气泡;2)再沿离心管壁缓慢依次加入分离液a、分离液b和分离液c,三种分离液的体积比为1:1:1,小心保持界面,轻拿轻放;3)4℃离心,400 rpm,3 min后稳定加速至1700 rpm,14 min,无刹车减速;4)用玻璃吸管吸取交界面细胞团入新的15ml离心管中,加入4℃预冷的洗液至10 ml,1000 rpm,1 min,4℃离心,弃上清,重复洗涤3次,获得移除胰岛细胞后,含有腺泡和导管细胞的沉淀;5)洗涤后的细胞沉淀用2 ml洗液重悬置于培养皿中;所述洗液为含0.1wt% bsa 的hanks液。
8.上述步骤(2)包括以下具体步骤:1)重悬:步骤(1)获得的移除胰岛后,含有腺泡和导管细胞的沉淀加入装有20 ml pbs的50 ml离心管中,在室温下自然沉降10 min,弃上清,以除去包括死细胞的低密度组分;2)清洗:加入20 ml pbs,1000 rpm,1min,弃上清,清洗5次;3)消化:沉淀中加入10 ml的0.025wt%胰酶,涡旋振荡15 s 37℃孵育5 min,将外分泌组织解离成单细胞;4)终止消化:加入10 ml预冷的培养基a,用移液器上下吹打混匀终止消化;5)过滤:用pbs湿润30 ~ 40 μm滤器,过滤入50 ml离心管;6)离心:1000 rpm,1min,弃上清,细胞沉淀用5ml培养基b重悬;7)细胞计数;8)布板:细胞计数后,用培养基b补齐,1.0
×
105/ml接种于胶原蛋白包被过的6孔板上;9)培养:37℃,5% co2,培养2天;10)换液:第3天,将培养基换成培养基c,至第7天形成贴壁的单层上皮细胞,而大部分初始腺泡细胞在此阶段死亡;超过95%的贴壁细胞表达导管细胞特异性标记泛细胞角蛋白。
9.11)传代:根据细胞状态在第10天左右,1:2传代,每2天换液,传3~5代后开始后续实验。
10.上述步骤(2)包括以下具体步骤:1)种板:接种12孔板,每孔2.5
×
105 个胰腺导管细胞;2)24 h后,移去培养液,每孔加入500 μl新鲜的培养基c;3)换算moi为20、30、50、100、200μl对应体积的腺病毒pad-m3c病毒上清体积加入步骤2)培养的胰腺导管细胞;4)不断缓慢晃动培养板,培养3 h;5)加入1.5 ml新鲜培养基c培养72 h。
11.上述一种胰腺导管细胞分离培养基在胰腺导管细胞分离分离中的应用。
12.上述一种密度梯度离心分离胰岛细胞的分离液在胰岛细胞分离中的应用。
13.上述pad-m3c感染大鼠胰腺导管细胞促进转分化方法在胰腺导管细胞分化中的应
用。
14.本发明的有益效果:本发明提供pad-m3c感染大鼠胰腺导管细胞促进转分化方法。(1)使用biocoll分离液通过密度梯度离心分离胰岛能尽可能多的去除胰岛细胞团,使细胞得到初步分离纯化,取用去除了胰岛细胞团的管底细胞,则降低了胰岛细胞(例如:α、β等细胞)的影响。(2)管底细胞经过40μm小过滤器筛选,进一步去除大的胰岛细胞,在培养不同时间段换用培养基a、b、c,且c中的成分烟酰胺、kgf、egf比例和作用有利于导管细胞的成长,是腺泡细胞及成纤维细胞随着培养逐步死亡从而利用换液而被淘汰。存活下来的细胞中导管细胞进一步纯化,但由于胰腺细胞的生长的特性,由腺泡细胞、α细胞等转分化的导管样细胞同样也存活下来,但与目前国内采用的胰腺组织直接消化分离比较,所获得的细胞数量和纯度都有提高。特别是细胞纯度的提升对后续实验的影响更明显。(3)利用腺病毒(pad-m3c)感染胰腺导管细胞,其中加样体积经过感染力实验得到验证,使胰腺导管细胞的感染率高达80%以上,使其表达腺病毒(pad-m3c)携带的红色荧光基因,有利于后续的转分化实验。
附图说明
15.图1为外科手术路线示意图。
16.图2为培养第6、10、15天及第五代的胰腺导管细胞镜显微下观察图。
17.图3为显微镜下观察感染腺病毒pad-m3c后的胰腺导管细胞情况图。
具体实施方式
18.下面结合实施案例对本发明做进一步说明,实施案例将帮助更好地理解本发明,但本发明并不仅仅局限于下述实施例。
19.实施例1大鼠胰腺导管细胞分离与纯化一、实验2~3天前准备1 胰岛分离试剂:1)hanks液:(gibco, 14025)500 ml /瓶,或配制无ca
2
、mg
2
的hanks液, 灭菌后4℃保存。
20.2)25%bsa(牛血清白蛋白):1ml分装,-20℃保存。
21.3)12.5mg/ml胶原酶储存液:(ix型胶原酶,sigma,c-7657-1g)1ml分装,-20℃保存。
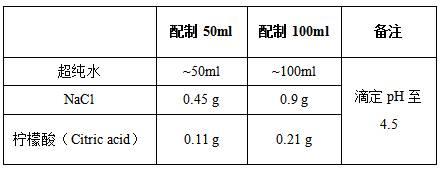
22.4)0.67g/l dtz染色剂储存液:50μl分装,-20℃保存。5)柠檬酸盐缓冲液:柠檬酸(citric acid,sigma,c2404-100g),过滤灭菌,1ml分装,-20℃保存。
23.胰腺导管细胞分离试剂:1)1
×
pbs-cmf:无钙镁,细胞级(即为本方案中的pbs)(约200ml/大鼠)2)0.025%胰酶:0.25%胰酶-edta,用pbs稀释10倍。
24.3)培养基:3 高压灭菌:hanks液、玻璃吸管、不锈钢筛网(20目即直径850μm)、各规格tip头、手术器械(大剪刀、大镊子、眼科直镊、眼科弯镊、眼科弯剪、普通止血钳)。
25.耗材:无菌50 ml离心管、15 ml离心管、10 ml移液管、洗耳球、巴氏吸管、30~40 μm过滤器、1ml和10ml注射器,pe50软管、30g针头。
26.其他:碎冰泡沫盒、4℃冰袋、外科操作台、手术灯、废液缸、75%酒精棉球、手套、口罩、黄色垃圾袋等。
27.二、实验前1天准备胶原蛋白包被6孔板4℃保存备用。
28.三、实验当天准备1 仪器:37℃水浴锅,4℃离心机(eppendorf,5810r),生物安全柜紫外灭菌。
29.麻醉剂:2.5wt%戊巴比妥3 洗液:含0.1wt% bsa 的hanks液,4℃保存备用。
30.胶原酶工作液:浓度0.5mg /ml,混匀后4℃保存备用,当天现配现用,勿超过24h。
31.密度梯度分离液(biochrom,biocoll分离液,l6155,1.10g/ml)1)配制a液:密度1.096 g/ml,避光4℃保存(无ca
2
、mg
2
hanks液密度为1.01916 g/ml)2)配制b液(密度1.085g/ml)、c液密度(1.051g/ml):混匀后4℃保存备用
6 2wt%链脲佐菌素溶液(streptozocin,stz,sigma,s0130-1g):现配现用10 min内有效。
32.一、实验步骤:实验动物:sd大鼠(雄性,6-8周,体重100~200g)1 外科手术操作:1)术前:禁食24h,禁饮4h,称重,术前1h腹膜内注射2wt%stz,160~200 mg / kg。
33.2)麻醉:腹膜内注射(ip)2.5wt%戊巴比妥,0.3ml/100g。
34.3)准备浓度0.5mg /ml胶原酶工作液于10 ml注射器中,连接pe10管与30g针头,排空气泡置于4℃冰袋上。
35.4)固定:腹部朝上,皮肤用75vol%酒精消毒,取上腹部正中切口,剪开皮肤,打开腹直肌,逐层进入腹腔,暴露肝、胃、肠(如图1)。
36.5)夹闭:定位
①
胆胰管(胆总管与胰管汇合处)入十二指肠壶腹部,血管钳夹闭。
37.6)布线:定位
②
胆总管与胆囊管汇合处,在近肝部位(
②
上方)布线a,血管钳牵拉a向上;在近十二指肠部位(
②
下方)布线b,打结不拉紧,待插管后系牢。
38.7)处死:大剪刀剪入胸腔,刺破心脏,放血处死大鼠。
39.8)插管:10ml注射器安装软管(pe50),于
②
处(分叉处)剪开一小v口(小心剪断!可见开口处有渗液),手持眼科镊夹住软管沿胆总管逆向(肝
→
十二指肠方向)插管1-2cm,拉紧b线,手持眼科直镊夹住b线打结处固定,以免在灌注时喷出漏液。
40.9)灌注:先缓推2ml浓度0.5mg /ml胶原酶工作液,观察胰腺充盈情况,随后较快推注8ml浓度0.5mg /ml胶原酶工作液,直至胰腺迅速肿大,包膜透明,小叶清晰可见,待充分充盈后停止推注,抽出软管结扎b线。
41.10)分离:定位直肠,牵拉剥离,沿盲肠至十二指肠壁迅速分离整个胰腺于50ml离心管中。
42.11)消化:将装有胰腺的离心管置于37℃水浴,消化16.5min,(若分离胰岛实验则消化时间太长容易导致胰腺外分泌酶消化胰岛,表现出胰岛偏小。)终止消化时,用力手甩
离心管15-20下,使胰腺充分散开,加入4℃预冷的洗液至50 ml,1000 rpm,1min,4℃离心,弃上清,重复洗涤3次。
43.12)过筛:取新的50 ml离心管,用洗液湿润筛子,洗涤完毕后向离心管中加入25ml洗液,轻轻吹打混匀,过筛(20目即直径850μm) 以去除大块组织杂质,取出过滤液,并加洗液至50ml,1000 rpm,3 min,4℃离心,弃上清。沉淀中加入500 μl的25wt%bsa,轻轻混匀。(其作用是使胰岛分散并保护好胰岛,且不影响梯度液的密度。)2 使用biocoll分离液通过密度梯度离心分离胰岛1)加a液9.5 ml于上述的沉淀中,轻轻混匀,小心勿起气泡。
44.2)再沿离心管壁缓慢加入a液5 ml,b液5 ml,c液5 ml,小心保持界面,轻拿轻放。
45.3)4℃离心,400 rpm,3 min后稳定加速至1700 rpm,14 min,无刹车减速。
46.4)用玻璃吸管吸取交界面细胞团入新的15ml离心管中,加入4℃预冷的洗液至10 ml,1000 rpm,1 min,4℃离心,弃上清,重复洗涤3次,获得移除胰岛细胞后,含有腺泡和导管细胞的沉淀。
47.5)洗涤后的细胞用2 ml洗液重悬置于培养皿中。
48.(选做)手捡胰岛1)在体式显微镜下,用200 μl的tip头手捡胰岛入新的无菌培养皿中。
49.2)dtz染色:取部分捡出的胰岛,滴加dtz工作液(将储存液用hanks液稀释100倍),室温下放置10 min后镜下计数红染细胞团。
50.胰腺导管细胞分离1)重悬:2.4)步骤移除胰岛后,收集含有腺泡和导管细胞的沉淀,加入装有20 ml pbs的50 ml离心管中,在室温(rt)下自然沉降10 min,弃上清,以除去包括死细胞的低密度组分。
51.)清洗:加入20 ml pbs,1000 rpm,1min,弃上清,清洗5次。
52.)消化:沉淀中加入10 ml的0.025wt%胰酶,涡旋振荡15s 37℃孵育5 min,将外分泌组织解离成单细胞。
53.)终止消化:加入10 ml预冷的培养基a,注意:用移液器上下吹打混匀终止消化。
54.)过滤:用pbs湿润30 ~ 40 μm滤器,过滤入50 ml离心管。
55.)离心:1000 rpm,1min,弃上清,细胞沉淀用5ml培养基b重悬。
56.)细胞计数8)布板:细胞计数后,用培养基b补齐,1.0
×
105/ml接种于胶原蛋白包被过的6孔板上。
57.)培养:37℃,5% co2,培养2天10)换液:第3天,将培养基换成培养基c,至第7天形成贴壁的单层上皮细胞,而大部分初始腺泡细胞在此阶段死亡。超过95%的贴壁细胞表达导管细胞特异性标记泛细胞角蛋白(ck19)。
58.)传代:根据细胞状态在第10天,1:2传代,每2天换液,传3~5代后开始后续实验。
59.图2为培养第6、10、15天及第五代的胰腺导管细胞显微镜下观察图。使用biocoll分离液通过密度梯度离心分离胰岛能尽可能多的去除胰岛细胞团,使细胞得到初步分离纯化,取用去除了胰岛细胞团的管底细胞,则降低了胰岛细胞(例如:α、β等细胞)的影响。
60.管底细胞经过40μm小过滤器筛选,进一步去除大的胰岛细胞,在培养不同时间段换用培养基a、b、c,且c中的成分烟酰胺、kgf、egf比例和作用有利于导管细胞的成长,是腺泡细胞及成纤维细胞随着培养逐步死亡从而利用换液而被淘汰。存活下来的细胞中导管细胞进一步纯化,但由于胰腺细胞的生长的特性,由腺泡细胞、α细胞等转分化的导管样细胞同样也存活下来,但与目前国内采用的胰腺组织直接消化分离比较,所获得的细胞数量和纯度都有提高。特别是细胞纯度的提升对后续实验的影响更明显。
61.实施例2利用腺病毒(pad-m3c)进行转分化诱导实验步骤:1 种板:接种12孔板,每孔2.5
×
10
5 个实施例1制备的胰腺导管细胞。
62.2 24 h后,移去培养液,每孔加入500 μl新鲜的培养基c。
63.3 换算moi为20、30、50、100、200μl对应体积的腺病毒(pad-m3c购买自addgene)病毒上清体积,按下表分别加入。
64.4 不断缓慢晃动培养板,培养3 h。
65.5 加入1.5 ml新鲜培养基c培养72 h。
66.图3为显微镜下观察感染后的胰腺导管细胞情况,其中红色荧光代表被感染的并表达报告基因的。由图可以看出,利用腺病毒(pad-m3c)感染胰腺导管细胞,其中加样体积经过感染力实验得到验证,使胰腺导管细胞的感染率高达80%以上,使其表达腺病毒(pad-m3c)携带的红色荧光基因,有利于后续的转分化实验。
67.以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。