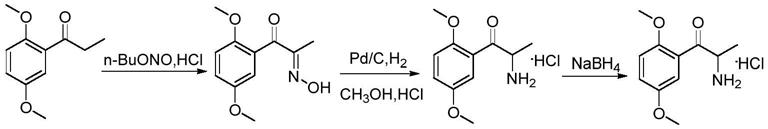
1.本发明涉及一种肿瘤突变负荷检测的质控品及其制备方法,属于医学检验和生物技术领域。
背景技术:
2.肿瘤突变负荷(tumor mutational burden,tmb)是一种肿瘤免疫治疗疗效预测的重要生物标志物。其被定义为肿瘤细胞中所含有的去除胚系突变后的体细胞突变数量,通常是指肿瘤细胞基因组外显子蛋白质编码区每百万个碱基中所发生的单核苷酸变异(single nucleotide variants,snvs)和小片段插入和缺失(indels)的总数。理论上,这些突变的基因进行转录后可表达形成新的抗原。当每兆碱基中累积的突变数量越多(即tmb越高)时,肿瘤细胞所显示的抗原性就越强,在肿瘤微环境中免疫t细胞可识别杀伤的肿瘤细胞就越多。目前,已有大量临床研究证实具有较高tmb水平的肿瘤患者总生存期显著延长、临床获益率显著升高。因此,基于大量有利的临床研究和实践,2017年,美国fda将包含tmb检测的foundation one cdx和msk-impact试剂盒正式批准用于泛癌种的临床诊断;而在2019年,美国国家综合肿瘤网络更是将tmb检测作为非小细胞肺癌患者接受免疫治疗的推荐检测方法写入了非小细胞肺癌nccn指南。
3.然而,尽管tmb在多项临床试验中均表现出了相对良好的预测作用,但若想要将tmb检测有效地应用于临床,目前还依旧存在着众多的挑战。其中,如何保证tmb检测结果的准确性是tmb能否被可靠的研究并最终成功应用于临床免疫治疗疗效预测的最基础也是最关键的问题。目前,tmb检测的方法包括对肿瘤组织样本或血浆游离dna样本进行全外显子组测序(whole exome sequencing,wes)以及大panel靶向基因测序。其中,wes虽然因其可对基因组≥30mb的外显子cds序列中的突变数量进行统计分析和计算而被业界公认为tmb检测的“金标准”,但是,由于wes对数据储存和分析技术要求高、测序时间长且价格昂贵,因此其在各分子检测实验室中应用也并不广泛。随着高通量测序技术的快速进展,针对全面基因组分析的大panel靶向基因测序现已被各研究实验室广泛应用。研究结果显示,针对cgp的靶向基因测序可与wes具有较好的相关性。因此,近年来有越来越多的大panel靶向基因测序试剂盒和实验室自建方法(laboratory develop tests,ldts)被开发和使用。但是,由于不同厂家靶向测序的panel覆盖基因范围不同、测序深度不同、测序影响因素不同、tmb分析和计算方法也不同,因此各靶向测序tmb检测结果之间存在着显著的差异性。这些检测结果的差异不仅影响了tmb临床研究的可靠性,还干扰着肿瘤患者的治疗决策,并阻碍了tmb研究的进一步发展。因此,为了保证tmb检测结果的准确性和可靠性并且提高不同平台之间结果的一致性,研制适用于多平台比对、ldts性能确认、检测实验室室内质量控制以及检测实验室之间检测质量评价的tmb质控品则显得十分关键。
4.为了保证tmb检测结果的准确性和可靠性并且提高不同平台之间结果的一致性,需研制适用于多平台比对、ldts性能确认、检测实验室室内质量控制以及检测实验室之间检测质量评价的tmb质控品。
5.理想条件下,适用于tmb检测的参考物质应:
①
可良好的模拟真实临床样本,突变类型包含snvs和indels;
②
突变数量覆盖tmb高中低水平;
③
适用于所有检测方法,突变类型覆盖同义突变和非同义突变;
④
具有相同基因组背景的配对样本;
⑤
可长期持续获得。故为获得理想的tmb检测参考物质,构建具有相同基因组背景但含有不同tmb水平的新型肿瘤细胞系是人工制备模拟真实临床样本tmb检测参考物质的最佳途径。
6.目前,各厂家和检测实验室用于验证的参考物质通常为福尔马林固定的石蜡包埋的(formalin fixed,paraffin embedded,ffpe)手术切除肿瘤组织样本、应用标准化人肿瘤细胞系(非配对)制备的dna样本或应用标准化人肿瘤细胞系(配对)制备的dna样本。
7.然而,由于肿瘤组织样本来源困难、无法大批量获得且具有不同患者间、不同肿瘤组织间以及肿瘤组织内的异质性,因此来源于肿瘤患者的手术切除组织ffpe样本因重复性差而难以广泛应用。来源于标准化人肿瘤细胞系(非配对)的dna样本虽然可在一定程度上解决重复性问题和批量生产的局限,但是由于其不具备与之相匹配的含有相同基因组背景的正常样本,因此无法有效地滤过胚系突变以及体细胞单核苷酸变异,故也难以良好的应用于tmb检测性能评估和质量控制。而来源于标准化人肿瘤细胞系(配对)的dna样本虽然可弥补上述所述缺陷,但是由于目前可获得的商品化、标准化人肿瘤-正常配对细胞系非常有限,且其tmb水平通常不是很高,因此其也具有一定的局限性。
技术实现要素:
8.本发明要解决的技术问题是:提供一种肿瘤突变负荷检测质控品及其制备方法。
9.为实现上述目的,本发明采用以下技术方案:
10.一种肿瘤突变负荷检测的质控品,以正常人源细胞为基础,采用基因编辑技术进行编辑,制备得到同时具有dna错配修复基因突变和dna复制修复基因突变的超高肿瘤突变负荷细胞系;将制备得到的超高肿瘤突变负荷细胞系与基因编辑基础细胞系按比例进行混合、固定及石蜡包埋,制备成为模拟肿瘤组织ffpe样本类型且具有不同tmb水平的肿瘤突变负荷检测质控品。
11.所述基因编辑技术为crispr/cas9技术。
12.所述crispr/cas9技术为采用crispr/cas9技术进行两步法编辑。
13.所述dna错配修复基因包括:mlh1、mlh3、msh2、msh3、msh4、msh5、msh6、pms1、pms2;dna复制修复基因包括:pole、pold1。
14.所述dna错配修复基因为msh2基因,dna复制修复基因为pole基因;msh2基因与pole基因的基因突变位点包括但不限于:msh2 c.595t>c(p.c119r)、msh2c.1046c>g(p.p349r)、msh2 c.1865c>t(p.p622l)、msh2 c.2089t>c(p.c697r)、msh2 c.2251g>a(p.g751r);pole c.857c>g(p.p286r)、pole c.1231g>t/c(p.v411l)、pole c.1270c>a(p.l424i)。
15.所述超高肿瘤突变负荷细胞系与基因编辑基础细胞系的混合比例为0%~100%,其中超高肿瘤突变负荷细胞系与基因编辑基础细胞系的混合比例为0%时模拟阴性样本。
16.一种肿瘤突变负荷检测的质控品的制备方法,包括以下步骤:
17.(1)采用crispr/cas9技术进行两步法编辑,将第一基因突变和第二基因突变,先后引入到基因编辑基础细胞系中,构建得到超高肿瘤突变负荷细胞系;
18.(2)将制备得到的超高肿瘤突变负荷细胞系与基因编辑基础细胞系按比例进行混合、固定及石蜡包埋,制备成为模拟肿瘤组织ffpe样本类型且具有不同tmb水平的肿瘤突变负荷检测质控品。
19.所述基因编辑基础细胞系为正常人细胞系。
20.所述第一基因突变为dna错配修复基因突变,第二基因突变为dna复制修复基因突变;第一基因包括mlh1、mlh3、msh2、msh3、msh4、msh5、msh6、pms1、pms2,第二基因包括pole、pold1。
21.所述dna错配修复基因为msh2基因,dna复制修复基因为pole基因;msh2基因与pole基因的突变位点包括但不限于:msh2 c.595t>c(p.c119r)、msh2 c.1046c>g(p.p349r)、msh2 c.1865c>t(p.p622l)、msh2 c.2089t>c(p.c697r)、msh2 c.2251g>a(p.g751r);pole c.857c>g(p.p286r)、pole c.1231g>t/c(p.v411l)、pole c.1270c>a(p.l424i)。
22.本发明的优点如下:本发明质控品来源于可体外培养的细胞系,可长期持续获得。本发明质控品具有相同基因组背景的正常配对样本,可适用于所有tmb检测方法。本发明质控品可良好地模拟真实临床肿瘤样本,突变类型包含snvs和indels,覆盖同义突变和非同义突变。本发明质控品突变数量可覆盖tmb高中低水平,可满足不同实验室的不同应用目的(包括但不限于:商品化试剂的性能验证、自建方法的性能确认、实验室间比对、实验室性能比对、室间质量评价等)。此外,本发明方法进一步从科学研究方面证实了msh2基因和pole基因在肿瘤突变进程中的作用。
附图说明
23.下面结合附图对本发明的具体实施方式作进一步详细的说明。
24.图1示出msh2 c.595t》c(p.c199r)阳性克隆sanger测序结果
25.图2示出msh2 c.1046c》g(p.p349r)阳性克隆sanger测序结果
26.图3示出pole c.857c》g(p.p286r)阳性克隆sanger测序结果
27.图4示出pole c.1231g》t(p.v411l)阳性克隆sanger测序结果
具体实施方式
28.实施例1.制备肿瘤突变负荷检测的质控品
29.一.材料
30.正常人细胞系:hek293t/17细胞(atcc购买)
31.px458质粒载体(atcc购买)
32.二.方法
33.1.采用crispr/cas9技术进行两步法编辑,将msh2基因突变和pole基因突变,先后引入到基因编辑基础细胞系中,得到超高肿瘤突变负荷细胞。
34.(1)设计针对msh2基因突变msh2 c.595t》c(p.c199r)、msh2 c.1046c》g(p.p349r)的sgrna和ssodns;
35.表1.针对msh2基因突变的sgrna和ssodns
[0036][0037]
(2)通过化学合成得到步骤(1)中设计的特异sgrna,并将其构建进入含有cas9蛋白和gfp蛋白的px458质粒载体中;
[0038]
(3)验证重组后的含有相应sgrna的px458重组质粒,并将其扩大培养,提取质粒dna;
[0039]
(4)将步骤(3)中得到的重组质粒dna与相应的ssodns共同电穿孔转染至正常人源细胞hek293t/17中;
[0040]
(5)转染48小时后,通过镜下观察gfp荧光表达情况确认转染效率;并通过荧光细胞流式分选获得单克隆细胞。
[0041]
(6)扩增培养单克隆细胞,当单克隆细胞生长至足量数目后,进行dna提取、pcr扩增以及sanger测序以验证单克隆细胞突变情况;
[0042]
表2.针对msh2基因突变的pcr引物
[0043][0044]
(7)将步骤(6)中sanger测序验证为阳性的细胞克隆进行扩大培养,得到分别含有msh2 c.595t》c(p.c199r)和msh2 c.1046c》g(p.p349r)基因突变的细胞系;
[0045]
(8)设计针对pole基因突变pole c.857c>g(p.p286r)、pole c.1231g>t(p.v411l)的sgrna和ssodns;
[0046]
表3.针对pole基因突变的sgrna和ssodns
[0047][0048][0049]
(9)通过化学合成得到步骤(8)中设计的特异sgrna,并将其构建进入含有cas9蛋白和gfp蛋白的px458质粒载体中;
[0050]
(10)验证重组后的含有相应sgrna的px458重组质粒,并将其扩大培养,提取质粒dna;
[0051]
(11)将步骤(10)中得到的重组质粒dna与相应的ssodns共同电穿孔转染至步骤(7)中获得的含msh2 c.1046c》g(p.p349r)基因突变阳性克隆细胞中;
[0052]
(12)转染48小时后,通过镜下观察gfp荧光表达情况确认转染效率;并通过荧光细胞流式分选获得单克隆细胞,进行培养增殖;
[0053]
(13)当单克隆细胞生长至足量数目后,进行dna提取、pcr扩增以及sanger测序以验证单克隆细胞突变情况;
[0054]
表4.针对pole基因突变的pcr引物
[0055][0056]
(14)将sanger测序验证为阳性的细胞克隆进行扩大培养,得到msh2和pole基因共突变细胞系;
[0057]
(15)将msh2和pole基因共突变细胞系进行全外显子测序验证,确认其为超高肿瘤
突变负荷细胞系(测得其tmb水平为100-150mut/mb)。
[0058]
2.将制备得到的超高肿瘤突变负荷细胞系与基因编辑基础细胞系按比例进行混合、固定及石蜡包埋,制备成为模拟肿瘤组织ffpe样本类型且具有不同tmb水平的肿瘤突变负荷检测质控品。
[0059]
将上述步骤1中得到的超高肿瘤突变负荷细胞系与基础编辑细胞系hek293t/17细胞进行比例混合,随后进行固定、脱水、石蜡包埋,最终制备成为一系列质控品。
[0060]
表5.梯度混合配比情况
[0061][0062]
实施例2.质控品tmb水平验证实验
[0063]
将实施例1中得到的系列质控品进行ffpe样本切片,dna提取,随后进行全外显子测序检测,计算tmb值;
[0064]
表6.全外显子测序参数表
[0065]
[0066][0067]
根据上述测序流程,得到各样本tmb值如下:
[0068]
表7.梯度混合配比情况
[0069][0070]
三.结果讨论
[0071]
经过实验验证可知,本发明制备的质控品具有如下特点及优点:
[0072]
1.可良好地模拟真实临床样本,突变类型包含snvs和indels,覆盖同义突变和非同义突变。
[0073]
本发明以正常人源细胞为基础,采用crispr/cas9技术进行两步法编辑,制备得到同时具有msh2及pole基因突变的细胞系(即具有超高肿瘤突变负荷细胞系)。将制备得到的超高肿瘤突变负荷细胞系与基因编辑基础细胞系按比例进行混合、固定及石蜡包埋,即可制备成为模拟肿瘤组织ffpe样本类型且具有不同tmb水平的肿瘤突变负荷检测质控品。本发明制备得到的质控品经全外显子测序验证,显示存在大量新生突变。突变的类型包含snvs和indels,覆盖同义突变和非同义突变,与真实肿瘤样本中突变谱系和突变特征相似,因此可良好地模拟真实临床样本。
[0074]
表8.梯度质控品突变类型情况
[0075][0076]
2.具有相同基因组背景的正常配对样本,可适用于所有检测方法。
[0077]
本发明的目的是提供一种肿瘤突变负荷检测质控品及其制备方法。其以正常人源细胞为基础,采用crispr/cas9技术进行两步法编辑,制备得到同时具有msh2及pole基因突变的细胞系(即具有超高肿瘤突变负荷细胞系)。通过本发明,不仅可获得具有超高肿瘤突变负荷细胞系,同时其基因编辑细胞系还可作为正常配对样本,用于后续tmb检测中有效地滤过胚系突变以及体细胞单核苷酸变异。
[0078]
3.突变数量覆盖tmb高中低水平,且可长期持续获得。
[0079]
由于本发明中的肿瘤突变负荷检测质控品制备来源为编辑细胞系,其可在体外大量培养,因此该质控品可长期持续获得。而同时,由于通过本发明中方法所编辑得到的细胞系具有超高突变细胞表型,因此其可通过梯度稀释的方式制备一系列具有不同tmb水平的样本。经全外显子测序验证,其检测tmb值如下。
[0080]
表9.梯度混合配比情况
[0081][0082][0083]
对比例:制备msh2单基因突变细胞系
[0084]
一.材料
[0085]
正常人细胞系:hek293t/17细胞(atcc购买)
[0086]
px458质粒载体(atcc购买)
[0087]
二.方法
[0088]
1.采用crispr/cas9技术进行单基因编辑,将msh2基因突变引入到基因编辑基础细胞系中,得到编辑后细胞。
[0089]
(1)设计针对msh2基因突变msh2 c.595t》c(p.c199r)、msh2 c.1046c》g(p.p349r)的sgrna和ssodns(同表1);
[0090]
(2)通过化学合成得到步骤(1)中设计的特异sgrna,并将其构建进入含有cas9蛋白和gfp蛋白的px458质粒载体中;
[0091]
(3)验证重组后的含有相应sgrna的px458重组质粒,并将其扩大培养,提取质粒dna;
[0092]
(4)将步骤(3)中得到的重组质粒dna与相应的ssodns共同电穿孔转染至正常人源细胞hek293t/17中;
[0093]
(5)转染48小时后,通过镜下观察gfp荧光表达情况确认转染效率;并通过荧光细胞流式分选获得单克隆细胞。
[0094]
(6)扩增培养单克隆细胞,当单克隆细胞生长至足量数目后,进行dna提取、pcr扩增以及sanger测序以验证单克隆细胞突变情况(同表2);
[0095]
(7)将步骤(6)中sanger测序验证为阳性的细胞克隆进行扩大培养,得到分别含有msh2 c.595t》c(p.c199r)和msh2 c.1046c》g(p.p349r)基因突变的细胞系;
[0096]
(8)将sanger测序验证为阳性的细胞克隆进行扩大培养,得到msh2单基因细胞系。
[0097]
三.结果和讨论
[0098]
将msh2单基因突变细胞系进行全外显子测序验证,测得其tmb水平为3-4mut/mb。对比例得到的msh2单基因突变细胞系的tmb水平,远低于实施例1的msh2 pole双基因突变细胞系的tmb水平。
[0099]
本发明通过实验发现,对正常细胞系进行dna错配修复基因突变叠加dna复制修复基因突变,将极大地增加细胞突变数量,相对于单个dna错配修复基因突变具有显著的突变量的增加。从实验的便捷性和技术效果等角度综合考量,本发明选择了实施例1所代表的双基因突变的模式,以获得具有高tmb水平的细胞系。
[0100]
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施方式的具体说明,它们并非用以限制本发明的保护范围,本领域技术人员可以设计出很多其他的修改和实施方式,这些修改和实施方式将落在本技术公开的原则范围和精神之内。更具体地说,在本技术公开、附图和权利要求的范围内,可以对主题组合布局的组成部件和/或布局进行多种变型和改进。除了对组成部件和/或布局进行的变型和改进外,对于本领域技术人员来说,其他的用途也将是明显的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。