1.本发明属于细胞工程中丝状真菌原生质体制备与再生领域,具体涉及一种麝香霉菌zjlq024原生质体制备和再生方法。
背景技术:
2.麝香霉菌(muscodor)是一类属于炭角菌科、可产生挥发性有机化合物(volatile organic compounds,vocs)的内生真菌。该类真菌产生的vocs具有较强的生物活性,能抑制或杀死多种病原菌以及部分昆虫。由于该类真菌产生的vocs具有抑菌性,且不与物体直接接触,因此在生产应用方面受到极大关注。但该类真菌产生的vocs对菌株自身生长也具有一定抑制作用,使得菌株自身生长缓慢。运用根癌农杆菌介导的转化方法构建随机插入突变体库,对转化子进行筛选,找到生长速度明显高于野生型菌株的突变菌株,这是对其抑菌性及应用进行初步研究的基础。
3.由于麝香霉菌株zjlq024在常规培养基上不产孢子,因此对其进行遗传转化需要以原生质体作为受体。所以原生质体的制备和再生是其遗传转化过程中不或缺的一环。不同真菌以及不同菌株间的细胞壁组成及生物学特性方面都存在差异,因此制备原生质体的方法有所区别。
技术实现要素:
4.本发明的目的在于提供一种麝香霉菌原生质体制备和再生方法,可制备出制备率和再生率高的麝香霉菌的原生质体,为麝香霉菌原生质体转化、基因表达等遗传操作奠定基础,且大大缩短了研究所需时间,提高了转化效率。
5.本发明技术方案如下:
6.一种麝香霉菌原生质体制备和再生方法,其特征在于,包括下述步骤:
7.将保存有麝香霉菌zjlq024的冷冻保存管于室温中自然解冻,接种到pda培养基黑暗培养,培养后将菌丝洗入pdb液体培养基中,振荡培养4~7d;
8.将摇床中培养的菌丝体用灭菌漏斗及滤纸过滤,取出菌丝,将其转移至用渗透压稳定剂配制的裂解酶中,并在水浴锅酶解2~5h;所述渗透压稳定剂为nac、kc、山梨醇或蔗糖中的一种或多种;所述裂解酶为溶壁酶、崩溃酶、β-葡聚糖酶或复合酶中的一种或多种;
9.菌丝匀浆经无菌注射器过滤后,离心弃去上清,悬浮沉淀,用枪头轻轻的吹打,得到原生质体;
10.将制备好的原生质体涂布于再生培养基上,观察再生菌落数量。
11.进一步的,所述裂解酶为溶壁酶,浓度为10~30mg/ml。
12.进一步的,所述渗透压稳定剂为山梨醇,浓度为0.4~0.7mol/l。
13.进一步的,振荡培养的条件为25℃,160rpm,振荡培养的时间为6d。
14.进一步的,菌丝与裂解酶酶液的质量体积比为1:2。
15.进一步的,将菌块接种到pda培养基,封口膜封口,25℃培养箱黑暗培养。
16.进一步的,将菌丝转移至用0.6mol/l的山梨醇配制的浓度为15mg/ml的溶壁酶中,于30℃水浴锅酶解4h。
17.进一步的,所述pda培养基的配置方法为:马铃薯200g,葡萄糖20g,琼脂粉18%,纯水1000ml,121℃高压灭菌15min。
18.进一步的,所述pdb液体培养基的配置方法为:马铃薯200g,葡萄糖20g,纯水1000ml,121℃高压灭菌15min。
19.进一步的,所述的再生培养基为tb3固体再生培养基;所述tb3固体再生培养基的配置方法为:酵母提取物3g,酪蛋白氨基酸3g,葡萄糖10g,蔗糖200g,琼脂粉18%,用纯水定容至1000ml,121℃灭菌15min。
20.一种麝香霉菌原生质体制备和再生制备方法,包括下述步骤:
21.步骤一,活化菌体:
22.将保存有麝香霉菌zjlq024的冷冻保存管于室温中自然解冻,使用灭菌牙签将菌块从管中取出,接种到pda培养基,封口膜封口,25℃培养箱黑暗培养;
23.pda培养基:马铃薯200g,葡萄糖20g,琼脂粉18%,纯水1000ml,121℃高压灭菌15min;
24.步骤二,制备种子培养液:
25.在超净工作台,将25℃培养箱中培养适宜时间的zjlq024菌落表面的菌丝洗入pdb液体培养基中,25℃,160rpm振荡培养一定时间;
26.pdb液体培养基:马铃薯200g,葡萄糖20g,纯水1000ml,121℃高压灭菌15min;
27.所述的25℃,160rpm振荡培养4~7d;优选为25℃,160rpm振荡培养6d;
28.步骤三,细胞壁的酶解:
29.将摇床中培养的菌丝体用灭菌漏斗及滤纸过滤,取约0.2g菌丝,按照每1g湿菌丝加入2ml的酶液的比例,将其转移至用渗透压稳定剂配制的一定浓度的裂解酶中,于30℃水浴锅酶解一定时间;
30.所述的渗透压稳定剂为nacl;或者,kcl;或者,山梨醇;或者,蔗糖;浓度为0.4~0.7mol/l;浓度为0.4~0.7mol/l;优选的,所述的渗透压稳定剂为山梨醇,浓度为0.6mol/l;
31.所述的裂解酶为溶壁酶;或者,崩溃酶;或者,β-葡聚糖酶;或者,复合酶;浓度为10~30mg/ml;优选的,所述的裂解酶为溶壁酶,浓度为15mg/ml;
32.所述的在30℃水浴锅中酶解的时间为2~5h;优选为4h;
33.步骤四,原生质体悬浮液的制备:
34.菌丝匀浆经10ml无菌注射器过滤至2ml离心管中。4℃,6000rpm离心10min弃去上清,用100μlstc悬浮沉淀,用枪头轻轻的吹打;
35.所述stc的组成为:1.2m山梨醇,20mmcacl2,10mmtris-hcl;
36.所述stc的配制方法为:配置10mmtris-hcl,使用hcl调节ph至7.5,加入cacl2,最后加入山梨醇;
37.步骤五,原生质体的再生:
38.将制备好的原生质体涂布于再生培养基上,观察再生菌落数量;
39.所述的再生培养基为tb3固体再生培养基;
40.所述tb3固体再生培养基的配置方法为:酵母提取物3g,酪蛋白氨基酸3g,葡萄糖10g,蔗糖200g,琼脂粉18%,用纯水定容至1000ml,121℃灭菌15min。
41.有益效果
42.本发明确定了麝香霉菌zjlq024原生质体制备和再生的适宜条件,为麝香霉菌原生质体转化、基因表达等遗传操作奠定基础,且大大缩短了研究所需时间,提高了转化效率。
附图说明
43.图1是麝香霉菌zjlq024原生质体形态。
44.图2是菌龄对原生质体制备的影响。
45.图3-a是不同裂解酶对原生质体制备的影响(l代表溶壁酶,β代表β-葡聚糖酶,d代表崩溃酶)。
46.图3-b是溶壁酶浓度对原生质体制备数量的影响。
47.图3-c是溶壁酶酶解时间对原生质体制备数量的影响。
48.图4渗透压稳定剂种类对原生质体制备数量的影响。
49.图5渗透压稳定剂山梨醇浓度对原生质体制备数量的影响。
具体实施方式
50.以下通过具体实施例对本发明作进一步的详述,但并不以此对本发明进行任何限制。
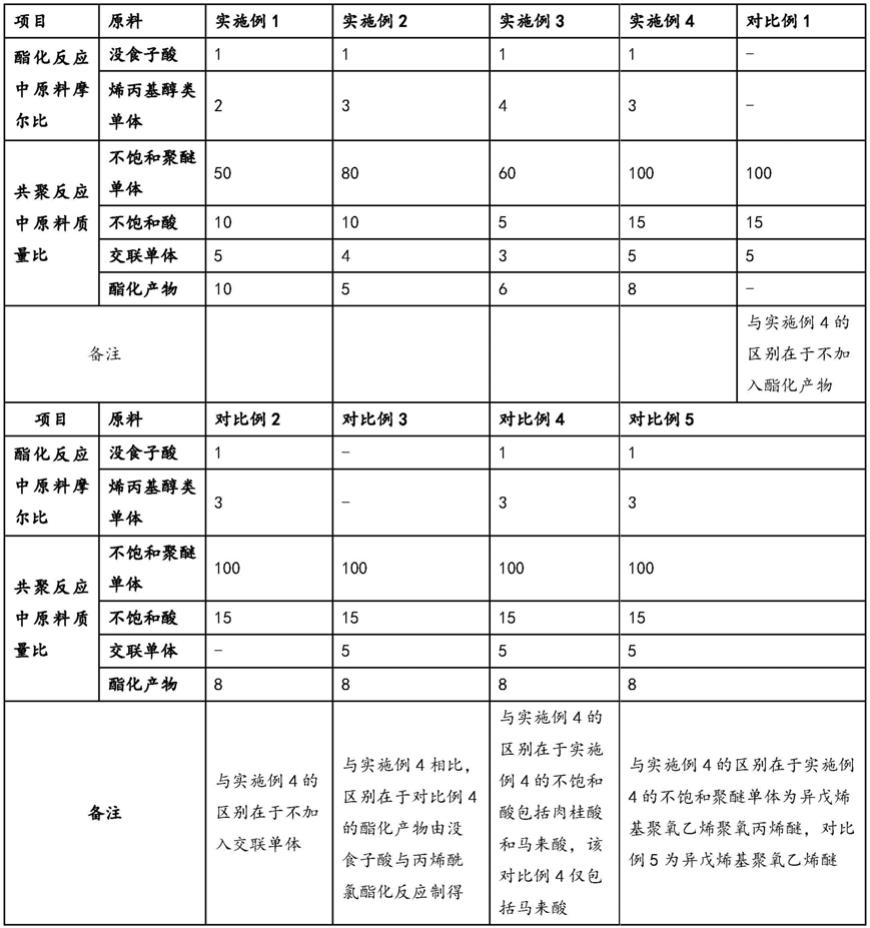
51.实施例1
52.一种麝香霉菌原生质体制备和再生方法,包括下述步骤:
53.步骤一,活化菌体:
54.将保存有麝香霉菌zjlq024的冷冻保存管于室温中自然解冻,使用灭菌牙签将菌块从管中取出,接种到pda培养基,封口膜封口,25℃培养箱黑暗培养;
55.其中麝香霉菌株zjlq024菌种来源于由浙江大学农业与生物技术学院,并保存于中国普通微生物菌种保藏管理中心(保存号:cgmcc2863)。
56.pda培养基:马铃薯200g,葡萄糖20g,琼脂粉18%,纯水1000ml,121℃高压灭菌15min;
57.步骤二,制备种子培养液:
58.在超净工作台,将25℃培养箱中培养适宜时间的zjlq024菌落表面的菌丝洗入pdb液体培养基中,25℃,160rpm振荡培养6d;
59.pdb液体培养基:马铃薯200g,葡萄糖20g,纯水1000ml,121℃高压灭菌15min;
60.步骤三,细胞壁的酶解:
61.将摇床中培养的菌丝体用灭菌漏斗及滤纸过滤,取约0.2g菌丝,按照每1g湿菌丝加入2ml的酶液的比例,将其转移至用0.6mol/l的山梨醇配制的浓度为15mg/ml的溶壁酶中,于30℃水浴锅酶解4h;
62.步骤四,原生质体悬浮液的制备:
63.菌丝匀浆经10ml无菌注射器过滤至2ml离心管中。4℃,6000rpm离心10min弃去上
清,用100μlstc悬浮沉淀,用枪头轻轻的吹打;
64.所述stc的组成为:1.2m山梨醇,20mmcacl2,10mmtris-hcl;
65.所述stc的配制方法为:配置10mmtris-hcl,使用hcl调节ph至7.5,加入cacl2,最后加入山梨醇;
66.步骤五,原生质体的再生:
67.将制备好的原生质体涂布于tb3固体再生培养基上,观察再生菌落数量;
68.所述tb3固体再生培养基的配置方法为:酵母提取物3g,酪蛋白氨基酸3g,葡萄糖10g,蔗糖200g,琼脂粉18%,用纯水定容至1000ml,121℃灭菌15min。
69.结果:
70.取液体培养基摇床培养6d的菌丝液,使用15mg/ml溶壁酶作为裂解酶,于30℃水浴锅中酶解4h,选择tb3固体再生培养基,进行麝香霉菌zjlq024原生质体的再生,最后可获得大量麝香霉菌zjlq024的原生质体。
71.实施例2
72.将实施例1步骤二中振荡培养时间分别替换成4d、5d、6d和7d,对原生质体的产生情况进行观察。
73.结果分析:菌龄不同时制备原生质体的数量有明显差异。使用摇床培养4d的菌丝液制备原生质体的数量为2.8
×
106个/ml。培养5d和6d的菌丝液制备出原生质体数量与4d相比有所增加,分别为6.5
×
106个/ml,10.3
×
106个/ml。菌龄7d时制备出的原生质体数量与菌龄6d相比有明显减少(图2)。
74.实施例3
75.将实施例1步骤三中裂解酶分别替换成溶壁酶、崩溃酶、β-葡聚糖酶和复合酶,对原生质体的产生情况进行观察。
76.结果分析:使用单一溶壁酶时,制备出原生质体的数量明显多于使用其他酶液制备出的原生质体数量,达到10.5
×
106个/ml。使用单一β-葡聚糖酶和崩溃酶制备出的原生质体数量较少,将上述两种酶与溶壁酶混合,制备出的原生质体数量与使用单一酶相比有所增加,β-葡聚糖酶与溶壁酶混合酶液制备出的原生质体数量达到6.6
×
106个/ml;崩溃酶与溶壁酶混合酶液制备出的原生质体数量达到8.2
×
106个/ml。三种酶混合酶液制备出的原生质体数量为8.1
×
106个/ml(图3-a)。
77.实施例4
78.将实施例1步骤三中溶壁酶的浓度分别替换成10mg/ml、15mg/ml、20mg/ml和30mg/ml,对原生质体的产生情况进行观察。
79.结果分析:当酶液浓度为10mg/ml、15mg/ml、20mg/ml、30mg/ml时,制备出的原生质体数量分别为3.3
×
106个/ml、6.5
×
106个/ml、6.6
×
106个/ml、5.6
×
106个/ml。当酶液浓度为20mg/ml时,制备出原生质体的数量与酶液浓度15mg/ml条件下制备出的原生质体数量相近(图3-b)。
80.实施例5
81.将实施例1步骤三中溶壁酶酶解时间分别替换成2h、3h、4h和5h,对原生质体的产生情况进行观察。
82.结果分析:溶壁酶酶解处理2h时制备出原生质体的数量为2.5
×
106个/ml。处理3h
时制备出原生质体的数量为5.4
×
106个/ml。处理4h时制备出原生质体的数量明显增加,达到11.5
×
106个/ml。处理时间为5h时,制备出原生质体的数量与4h相比减少到8.5
×
106个/ml(图3-c)。
83.实施例6
84.将实施例1步骤三中渗透压稳定剂分别替换成nacl、kcl、山梨醇和蔗糖,对原生质体的产生情况进行观察。
85.结果分析:使用山梨醇作为稳渗剂时,制备出的原生质体数量为8.3
×
106个/ml,远高于nacl作为稳渗剂制备出的2.3
×
106个/ml原生质体、kcl作为稳渗剂制备出的2.6
×
106个/ml原生质体以及蔗糖作为稳渗剂制备出的1.7
×
106个/ml原生质体(图4)。
86.实施例7
87.将实施例1步骤三中山梨醇的浓度分别替换成0.4mol/l、0.5mol/l、0.6mol/l和0.7mol/l,对原生质体的产生情况进行观察。
88.结果分析:山梨醇浓度为0.6mol/l时,制备出的原生质体数量为8.3
×
106个/ml。浓度为0.4mol/l、0.5mol/l时,制备出的原生质体数量逐渐增加,浓度到0.6mol/l时制备出的原生质数量最多。浓度为0.7mol/l时,制备出的原生质体数量减少到4.4
×
106个/ml(图5)。
89.上述实施例仅为本发明较佳的具体实施方式,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。