一种高产d-泛酸的基因工程菌及其应用
(一)技术领域
1.本发明涉及一种高产d-泛酸的基因工程菌及其构建方法,以及该工程菌在微生物发酵制备d-泛酸中的应用。
(二)
背景技术:
2.d-泛酸又可称之为维生素b5,是一种重要的水溶性维生素,在生物体内起着重要的生理作用,是辅酶a和酰基载体蛋白(acp)的重要合成前体。d-泛酸及其衍生物在食品、医药、饲料、化妆品等领域有广泛的应用。在食品领域,d-泛酸可作为一种食品营养强化剂可用于多种食品添加以补充营养成分;在医药方面,d-泛酸作为人体必需的维生素普遍存在于生物体内,其衍生物d-泛酸钙的单方制剂可用于治疗d-泛酸缺乏症,与其他组分构成的复方制剂可用于治疗神经炎、神经衰弱、术后肠绞痛和呼吸道等疾病,同时也可用于多种保健食品等;在饲料方面,饲料中添加一定剂量的d-泛酸能满足猪、鸡和鱼类等生长发育、脂肪代谢的需求,避免出现生长迟缓、适应性及抗病性下降、生殖系统障碍、毛发脱落的现象;在化妆品方面,d-泛酸及其衍生物d-泛醇与皮肤、毛发的营养状态息息相关,可用于防治毛发干枯和损伤,提高毛发营养使其光线亮泽。并且有增加保湿和抗老化的作用,促进皮肤对营养成分的吸收,广泛应用与保湿霜、护发液和乳液等化妆品。
3.目前生产d-泛酸的方法主要有三种:化学合成法,酶催化法和发酵合成法。化学合成法,先通过化学法制备得到前体物β-丙氨酸和d,l-泛解酸内酯,再合成d-泛酸。其中的β-丙氨酸主要通过丙烯腈法、丙烯酸法和琥珀酸亚胺法合成得到,而d,l-泛解酸内酯主要通过异丁醛-甲醛法、异丁醛-醛乙酸法和异丁醛-三氯甲烷法制备得到,但是法学法高耗能、对设备损耗大,同时产生对人体和环境的有害物质。得到上述中间体后,其中β-丙氨酸用氢氧化钙处理形成β-丙氨酸钙,β-丙氨酸钙再跟d,l-泛解酸内酯在甲醇溶液和高温下发生酰化反应得到d,l-泛酸钙,在通过物理拆分得到高纯度的d-泛酸钙。另一种拆分方法是先对d,l-泛解酸内酯拆分,d,l-泛解酸内酯的拆分方法又包含化学拆分法和酶法拆分,其中化学拆分主要采用奎宁、麻黄素、l-亮氨酸、l-1-对硝基甲苯-2-氨基-1,3-丙二醇等拆分试剂对d,l-泛解酸内酯拆分。酶法拆分主要使用l-泛解酸内酯水解酶、d-泛解酸内酯水解酶、酮泛解酸还原酶和醇脱氢酶等对d,l-泛解酸内酯进行拆分。得到的d-泛解酸内酯后,在将其跟β-丙氨酸钙在甲醇溶液和高温条件下进行酰化反应得到d-泛酸钙。酶法合成d-泛酸,利用微生物来源的泛酸合成酶,以d-泛解酸和β-丙氨酸为底物完成d-泛酸的合成,但是其前体物d-泛解酸和β-丙氨酸仍需要化学合成得到。
4.随着对微生物代谢过程的不断了解和代谢工程技术的日益发展,使用葡萄糖作为廉价的原料来生产d-泛酸在内的高附加值产品具有广阔的应用前景。但是,由于野生型菌株的自身原因,细胞内合成d-泛酸的途径受限,所以发酵法生产d-泛酸最重要的是得到适当的d-泛酸高产菌株。在代谢改造过程中,由于不同的代谢途径之间存在非线性的关系,以及辅因子的与中心代谢途径的竞争和协作关系,需要从多个维度改造目的代谢途径。
5.在大肠杆菌中d-泛酸的合成是非线性的途径,包含了泛解酸的合成途径和β-丙氨
ilva-f/r-ilva-r为引物,扩增基因供体donor dna;以e.coli w3110的基因组为模板,以ilva-f和ilva-r引物扩增得到ilva片段;以ptarget质粒为模板,以ptarget-ilva-f和ptarget-ilva-r为引物扩增质粒并线性化处理得到线性化ptarget-ilva质粒;将donor dna、ilva片段和线性化ptarget-ilva质粒连接后转化出发菌株电转感受态细胞,消除ptarget和pcas9质粒,回补已经敲除的ilva基因,构建菌株dpa11(ilva
*
),记为菌株dpa12;
13.(2)ilve的起始密码子突变:以ptarget质粒为模板,以ptarget-ilve
**-f和ptarget-ilve
**-r为引物扩增质粒并线性化处理得到线性化质粒ptarget-ilve
**
;以出发菌株基因组为模板,以引入突变的起始密码子ttg的l-ilve
**-f/l-ilve
**-r和r-ilve
**-f/r-ilve
**-r引物扩增得到上下游donor dna;将线性化质粒ptarget-ilve
**
与上下游donor dna连接后转化菌株dpa12电转感受态细胞,消除ptarget和pcas9质粒,将菌株dpa11(ilva
*
)基因组中的ilve的起始密码子gtg突变成ttg,构建菌株dpa11(ilva
*
ilve
**
),记为菌株dpa13;
14.(3)sera启动子替换:以ptarget作为模板,以ptarget-sera-f和ptarget-sera-r为引物扩增质粒并线性化处理,获得线性化质粒ptarget-sera;以出发菌株基因组为模板,以l-sera-f/l-sera-r和r-sera-f/r-sera-r为引物扩增得到上下游donor dna;将线性化质粒ptarget-sera与上下游donor dna连接后转化菌株dpa13电转感受态细胞并消除质粒ptarget和pcas9,将菌株dpa11(ilva
*
ilve
**
)基因组中的基因sera启动子替换成trc启动子,构建菌株dpa11(ilva
*
ilve
**
trc-sera),记为菌株dpa14;
15.(4)glya启动子替换:以ptarget作为模板,以ptarget-glya-f和ptarget-glya-r为引物扩增质粒并进行线性化处理获得线性化质粒ptarget-glya;以出发菌株基因组为模板,以l-glya-f/l-glya-r和r-glya-f/r-glya-r为引物扩增得到上下游donor dna;将线性化质粒ptarget-glya和上下游donor dna连接后转化菌株dpa14电转感受态细胞并消除质粒ptarget和pcas9,将菌株dpa11(ilva
*
ilve
**
trc-sera)基因组中的基因glya的原始启动子替换成trc启动子,构建菌株dpa11(ilva
*
ilve
**
trc-seratrc-glya),记为菌株dpa15;
16.(5)ilvb、ilvn的启动子替换:以ptarget作为模板,以ptarget-ilvbn-f和ptarget-ilvbn-r为引物扩增质粒并进行线性化处理获得线性化质粒ptarget-ilvbn;以出发菌株基因组为模板,以l-ilvbn-f/l-ilvbn-r和r-ilvbn-f/r-ilvbn-r为引物扩增得到上下游donor dna;将线性化质粒ptarget-ilvbn和上下游donor dna连接后转化菌株dpa15电转感受态细胞并消除质粒ptarget和pcas9,将菌株dpa11(ilva
*
ilve
**
trc-seratrc-glya)基因组中的基因ilvb、ilvn的原始启动子替换成trc启动子,构建菌株dpa11(ilva
*
ilve
**
trc-seratrc-glya trc-ilvbn),记为菌株dpa16;
17.(6)pnta、pntb的启动子替换:以ptarget作为模板,以ptarget-pntab-f和ptarget-pntab-r为引物扩增质粒并进行线性化处理获得线性化质粒ptarget-pntab;以出发菌株基因组为模板,以l-pntab-f/l-pntab-r和r-pntab-f/r-pntab-r为引物扩增得到上下游donor dna;将线性化质粒ptarget-pntab与上下游donor dna连接后转化菌株dpa16电转感受态细胞并消除质粒ptarget和pcas9,将菌株dpa11(ilva
*
ilve
**
trc-seratrc-glyatrc-ilvbn)基因组中的基因pnta、pntb的原始启动子替换成trc启动子,构建菌株dpa11(ilva
*
ilve
*
trc-seratrc-glyatrc-ilvbntrc-pntab),记为菌株dpa17;
18.(7)cyo启动子的替换:以ptarget作为模板,以ptarget-cyo-f和ptarget-cyo-r为
引物扩增并进行线性化处理获得线性化质粒ptarget-cyo;以出发菌株基因组为模板,以l-cyo-f/l-cyo-r和r-cyo-f/r-cyo-r为引物扩增得到上下游donor dna;将线性化质粒ptarget-cyo与上下游donor dna连接后转化菌株dpa17电转感受态细胞并消除质粒ptarget和pcas9,将菌株dpa11(ilva
*
ilve
*
trc-seratrc-glyatrc-ilvbntrc-pntab)基因组中的基因cyo的原始启动子替换成trc启动子,构建菌株dpa11(ilva
*
ilve
*
trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo),记为菌株dpa18;
19.(8)在质粒上过表达来源于谷氨酸棒状杆菌的panb和panc:以质粒ptrc99a为模板,以ptrc99a-line-f/ptrc99a-line-r为引物进行pcr扩增,pcr产物经过dpn i在37℃保温消化2h,去除其中的甲基化载体,获得线性化ptrc99a质粒;以corynebacterium glutamicumatcc13032的基因组为模板,以引物panb-f/panb-r和panc-f/panc-r,分别pcr扩增panb和panc片段;将线性化ptrc99a质粒、片段panb和panc连接转化e.colidh5α感受态,提取质粒pbc;将pbc质粒转化到菌株dpa18电转感受态细胞中,构建菌株dpa11(ilva
*
ilve
*
trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)/pbc,即为所述的高产d-泛酸的基因工程菌,记为菌株dpa19。
20.本发明通过(1)回补ilva基因恢复了细胞内异亮氨酸合成途径,避免了发酵过程中外源添加异亮氨酸,简化了操作过程;(2)在原始菌株的基础上进一步弱化异亮氨酸的合成,在保证菌株正常生长的基础上,节约了丙酮酸,为泛解酸的合成提供充分的前体;(3)强化乙酰乳酸合成酶基因的表达,将更多前体丙酮酸拉向泛解酸合成途径;(4)强化一碳单位的循环,增加了泛解酸代谢通路的碳流量;(5)强化了辅因子nadph和atp合成基因的表达;(6)在质粒上表达来源于谷氨酸棒状杆菌的3-甲基-2-氧桥丁酸羟甲基转移酶基因panb和泛酸合成酶基因panc,最终得到d-泛酸高产的大肠杆菌基因工程菌株。
21.本发明还涉及到所述基因工程菌在微生物发酵制备d-泛酸中的应用,所述应用为:将所述基因工程菌菌株接种到含有50mg/l卡那霉素的发酵培养基中,25-32℃、180-200rpm条件下发酵培养od
600
=0.4-0.6时(优选30℃、180rpm发酵至od
600
=0.5),添加终浓度为0.2mm的iptg,继续发酵培养至48h,发酵结束后,获得d-泛酸的发酵液,分离纯化,获得d-泛酸;所述发酵培养基组成:葡萄糖20g/l、酵母提取物3g/l、(nh4)2so416g/l、kh2po41 g/l、mgso40.5g/l、碳酸钙15g/l、β-丙氨酸2.5g/l、1ml微量元素溶液,用自来水溶解,ph值为自然值;微量元素溶液组成为:10g/l cacl2、10g/l feso4·
7h2o、1g/l znso4·
7h2o、0.2g/l cuso4、0.02g/l nicl2·
7h2o,溶剂为去离子水。
22.所述发酵还可以是发酵罐补料发酵培养,将所述基因工程菌接种至含有50mg/l卡那霉素抗性lb试管培养基中,37℃培养10h作为种子液;按体积浓度5%接种量接种至lb培养基中,37℃培养12h,作为上罐的种子液;将上罐种子液按体积浓度15%接种至装有发酵培养基的发酵罐中,在30℃、500rpm、通气量为0.5v/v
·
min条件下发酵培养,当发酵液中的溶氧量瞬间大幅度提高时(正常情况下溶氧维持在10左右,当葡萄糖耗尽时,溶氧在1min内升高到40-50,此时表明葡萄糖消耗完毕),表明初始糖消耗完毕,此时打开自动补料程序,补料方式采用ph联动,当发酵液中的ph值高于6.80时自动补料,当发酵液中ph值低于6.80时停止补料,保持发酵液中的糖浓度维持较低水平(所述较低水平是指维持葡萄糖浓度在2-4g/l,优选3g/l),继续发酵培养92h,获得含d-泛酸的发酵液。
23.补料培养基:葡萄糖500g/l,酵母粉3g/l,(nh4)2so
4 16g/l、kh2po414 g/l、
mgso48g/l,β-丙氨酸30g/l,利用去离子水溶解,用50%的氨水调节ph为6.80。所述补料培养基总添加量为500ml/2l发酵培养基,补料速度为25ml/h。
24.所述基因工程菌发酵前,先将平板上的新鲜单菌落接种到试管lb培养基中,在37℃、100-200rpm震荡培养过夜,作为种子液,然后按体积浓度1-5%接种量接种至发酵培养基中。
25.本发明改造了大肠杆菌的d-泛酸的合成网络,通过crispr/cas9基因编辑系统回补出发菌株已经敲除的ilva基因,恢复细胞内异亮氨酸的正常合成,构建菌株dpa11(ilva
*
);通过利用启动子ttg替换工程菌中的ilve基因的启动子gtg,进一步弱化异亮氨酸的合成为泛解酸的合成提供充分的前体丙酮酸,构建菌株dpa11(ilva
*
ilve
**
);通过来源于ptrc99a的trc启动子置换sera的原始启动子,增强胞内丝氨酸的积累,为泛解酸合成提供充分的一碳单位,构建菌株dpa11(ilva
*
ilve
**
trc-sera);利用trc启动子替换基因glya的原始启动子,强化一碳单位的循环,加强了泛解酸合成途径的碳流量,提高d-泛酸产量,构建菌株dpa11(ilva
*
ilve
**
trc-seratrc-glya);利用trc启动子替换ilvb、ilvn原始启动子,将更多的丙酮酸拉向泛解酸代谢途径,构建菌株dpa11(ilva
*
ilve
**
trc-seratrc-glyatrc-ilvbn);利用trc启动子替换pnta、pntb原始启动子,增强胞内辅因子nadph的积累,构建菌株dpa11(ilva
*
ilve
**
trc-seratrc-glyatrc-ilvbntrc-pntab);利用trc启动子替换基因cyo原始的启动子,增强胞内辅因子atp的积累,构建菌株dpa11(ilva
*
ilve
*
trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo);并且在质粒上过表达来源于谷氨酸棒状杆菌的panb和panc,达到增加产量的目的,构建菌株dpa11(ilva
*
ilve
*
trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)/pbc。
26.与现有的技术相比,本发明有益效果主要体现在:
27.本发明回补了ilva基因从而恢复了原始菌中异亮氨酸的正常合成,同时用ttg起始密码子替换ilve基因的gtg起始密码子,达到进一步弱化异亮氨酸的合成,减少了泛解酸合成的前体丙酮酸的消耗,用trc启动子替换sera和glya原始启动子,强化了一碳单位合成及其循环利用,利用trc启动子替换ilvbn的原始启动子,将前体丙酮酸拉向泛解酸合成途径,利用trc启动子替换pntab和cyo的原始启动子,强化辅因子nadph和atp合成,最后导入含有来源于谷氨酸棒状杆菌panb和panc质粒,在摇瓶水平上d-泛酸的产量达到了6.81g/l,是原始出发菌株的3.83倍,并且避免了外源添加异亮氨酸,节约成本,同时发酵罐放大培养节约大量的时间成本,因为在发酵罐放大培养时需要对异亮氨酸的添加时间和浓度进行大量的优化实验。
(四)附图说明
28.图1为d-泛酸代谢途径及其改造位点。
29.图2为菌株dap12和菌株dpa11的生物量od
600
和d-泛酸浓度的柱形图。
30.图3为菌株dap13和菌株dap12的生物量od
600
和d-泛酸浓度的柱形图。
31.图4为菌株dap14和菌株dap13的生物量od
600
和d-泛酸浓度的柱形图。
32.图5为菌株dap15和菌株dap14的生物量od
600
和d-泛酸浓度的柱形图。
33.图6为菌株dap16和菌株dap15的生物量od
600
和d-泛酸浓度的柱形图。
34.图7为菌株dap17和菌株dap16的生物量od
600
和d-泛酸浓度的柱形图。
35.图8为菌株dap18和菌株dap17的生物量od
600
和d-泛酸浓度的柱形图。
36.图9为菌株dap19和菌株dap18的生物量od
600
和d-泛酸浓度的柱形图。
37.图10为菌株dap19在5-l发酵罐补料发酵的生物量od
600
,残糖和d-泛酸的浓度曲线图。
(五)具体实施方式
38.下面结合具体实施例对本发明进一步描述,但本发明的保护范围并不限于此:
39.本发明实施例中,所述使用的卡那霉素在培养基中的终浓度均为50mg/l,所述壮观霉素在培养基中的终浓度均为50mg/l。
40.lb平板组成:酵母粉5g/l,蛋白胨10g/l,氯化钠10g/l,琼脂粉20g/l,溶剂为水,ph自然。
41.lb培养基:10g/l蛋白胨,5g/l酵母粉,10g/l nacl,溶剂为去离子水,ph值自然。
42.发酵培养基:葡萄糖20g/l,酵母提取物3g/l,(nh4)2so
4 16g/l、kh2po
4 1g/l、mgso
4 0.5g/l、caco
3 15g/l、2.5g/lβ-丙氨酸、1ml/l微量元素溶液,利用去离子水溶解,无需调节ph值。微量元素溶液组成为:0.15g/l na2moo4·
2h2o、2.5g/l h3bo3、0.7g/lcocl2·
6h2o、0.25g/l cuso4·
5h2o、1.6g/l mncl2·
4h2o、0.3g/l znso4·
7h2o,溶剂为去离子水。
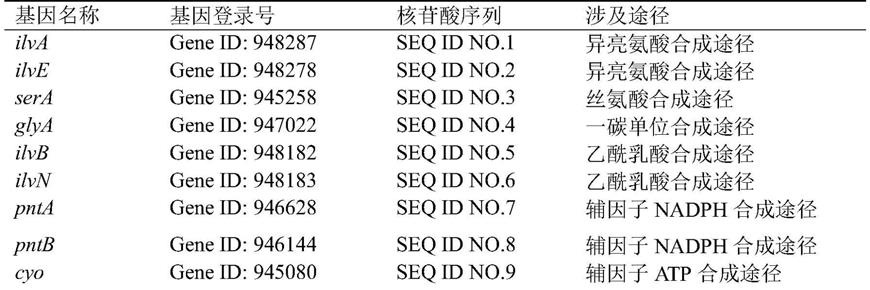
43.表1:基因编辑所涉及的基因及其相应途径
[0044][0045][0046]
表2:引物序列
[0047]
[0048][0049]
实施例1:底盘菌dpa11的构建
[0050]
底盘菌dpa11的基因型是:e.coli w3110trc-pancpanepanbilvc/ilvga/δavta/ilveb/coaacδilvatrc-lpdδglk;a表示ilvg基因的979碱基突变成atc,恢复ilvg的正常表达;b表示ilve基因的起始密码子atg突变成gtg;c表示coaa基因的316-318位碱cgt基突变成gct,构建参照zhang,b.,zhang,x.m.,wang,w.,liu,z.q.,zheng,y.g.,2019.metabolic engineering of escherichia coli for d-pantothenic acid production.food chem.294,267-275.。
[0051]
实施例2:构建产d-泛酸菌株dpa11(ilva
*
)及摇瓶发酵
[0052]
以底盘菌株dpa11为出发菌株,使用crispr/cas9介导的基因编辑技术,在基因组水平上回补已经敲除的ilva基因,恢复细胞内异亮氨酸的合成。
[0053]
(1)构建ptarget-ilva质粒:以ptarget质粒(惠赠于上海植物生理生态研究所杨
晟研究员)为模板,以ptarget-ilva-f和ptarget-ilva-r为引物进行pcr扩增,pcr产物经过dpni酶切后在37℃保温消化2h,再转化到e.coli dh5α,接种至含有50mg/l壮观霉素的lb平板,37℃培养筛选,测序验证获得正确的ptarget-ilva质粒。以ptarget-ilva质粒为模板,以ptd-line-f/ptd-line-r为引物扩增质粒线性化片段,pcr产物经过dpni酶切后在37℃保温消化2h,clean up试剂盒回收dna片段,即线性化的ptarget-ilva质粒,用于后续连接donor dna;
[0054]
(2)构建ptdilva含有donor质粒:以实施例1菌株dpa11的基因组为模板,l-ilva-f和l-ilva-r引物pcr扩增得到上游部分donor dna,以r-ilva-f和r-ilva-r引物pcr扩增得到下游部分donor dna。以e.coli w3110的基因组为模板,以t-ilva-f和t-ilva-r引物扩增得到ilva片段(核苷酸序列如seq id no.1所示),所得的pcr片段回收纯化,备用。按照clonexpress(one step clone kit,vazyme biotech,nanjing,china)说明书将线性化的ptarget-ilva质粒、上下游donordna片段和ilva片段连接在一起,再通过菌落pcr和测序验证得到构建成功的ptdilva质粒;
[0055]
(3)菌株dpa11感受态细胞的制备:将pcas9质粒转化到菌株dpa11的化转感受态细胞中,涂布在含有50mg/l卡那抗性lb平板上,30℃培养24h,挑取单菌落至含有50mg/l卡那霉素抗性lb试管中,30℃过夜培养。再以体积浓度1%接种量接种到100ml lb培养基中,并且加入终浓度为10mm的l-阿拉伯糖,150rpm、30℃培养至od
600
=0.5,5000rpm、4℃离心6min收集菌体,并用4℃预冷的超纯水洗涤2次,再用4℃预冷的10%甘油洗涤一次,最后用4℃预冷的10%甘油重悬、分装,每管100μl,-80℃保存,即为电转感受态细胞,备用;
[0056]
(4)构建菌株dpa11(ilva
*
):取100ng步骤(2)方法制备的ptdilva质粒和100μl步骤(3)方法制备的电转感受态细胞混合,转入到4℃预冷的2mm电击杯中,冰浴1min,用电穿孔仪(micropluser,bio-rad)进行电击转化,电击完成后立即加入4℃预冷的1ml的lb培养基中并立即转移至无菌1.5ml离心管中,30℃、150rpm复苏3h后涂布在含有50mg/l卡那霉素和50mg/l壮观霉素的lb平板上,30℃倒置培养24h至单菌落出现。以引物t-ilva-f和t-ilva-r为验证引物进行菌落pcr,再通过测序验证菌种构建的正确性,得到构建的菌株dpa11(ilva
*
);
[0057]
(5)ptarget和pcas9质粒消除:挑取步骤(4)基因编辑成功的单菌落至含有1mm iptg和50mg/l卡那霉素的lb试管,30℃培养过夜,蘸取菌液划线至含有50mg/l卡那霉素的lb平板上,30℃培养24h至单菌落出现,挑取单菌落划线至含有50mg/l的壮观霉素的lb平板上,其中不能在壮观霉素平板上生长的单菌落即为ptarget消除的菌株。再挑取ptarget消除的菌株至lb试管中,42℃培养过夜,菌液划线至无抗固体lb平板上,37℃倒置培养10h至单菌落出现,挑取单菌落划线至含有50mg/l卡那霉素的lb固体平板上37℃倒置培养10h,不能在此平板上生长的菌株即为pcas9质粒成功消除的菌株,最终得到无质粒基因工程菌dpa11(ilva
*
),记为菌株dpa12;
[0058]
(6)将步骤(5)菌株dpa12和实施例1菌株dpa11单菌落分别接种到无抗lb试管培养基中,37℃、180rpm培养10h作为备用种子液,其中菌株dpa11为对照组。按体积浓度5%接种量将种子液接种至含有20ml的发酵培养基的500ml摇瓶中,同时加入终浓度为0.2mm iptg,30℃、180rpm震荡培养48h。发酵结束后,取1ml发酵液,12000rpm离心2min,弃上清,再用1ml超纯水洗涤2次,然后再加入800μl超纯水重悬,再加入200μl乙酸溶解其中的碳酸钙,最后
取50μl乙酸溶解碳酸钙的菌液加入1950μl超纯水,稀释40倍后测od
600
,其中1od600=0.323g/lcdw(细胞干重)(1od600对应的是每升发酵培养液中细胞干重,发酵液离心后弃上清,将细胞沉淀置于80℃烘箱烘干至恒重),菌株dpa12的od
600
=20.32,菌株dpa11的od
600
=22.36。
[0059]
另取1ml 发酵液12000rpm室温离心3min,将上清液用超纯水稀释10倍,采用高效液相色谱法检测d-泛酸的浓度,最后再换算成发酵液中d-泛酸的浓度,菌株dpa12发酵液中d-泛酸的浓度2.52g/l,菌株dpa11发酵液中d-泛酸的浓度1.78g/l。其中生物量od
600
及发酵液中d-泛酸的含量如图2所示。
[0060]
d-泛酸含量的测定采用高效液相色谱法,具体条件如下:
[0061]
流动相:乙腈:甲醇:水=949:50:1,v/v/v;
[0062]
高效液相色谱仪型号:thermo scientific utimate 3000;
[0063]
检测条件:流动相流速0.9ml/min,c18柱(250*4.6mm*5μm,安捷伦),波长200nm,柱温30℃。
[0064]
由图2可见,在基因组上回补基因ilva,恢复细胞内异亮氨酸的正常合成,d-泛酸产量从1.78g/l增加到2.52g/l,说明在基因组上恢复ilva的正常表达,为细胞正常生长提供必需氨基酸异亮氨酸,从而有利于大肠杆菌d-泛酸的合成。
[0065]
实施例3:支链氨基酸氨基转移酶表达基因进一步弱化菌株dpa11(ilva
*
ilve
**
)的构建及其摇瓶发酵
[0066]
(1)构建ptarget-ilve
**
质粒:以ptarget为模板,以ptarget-ilve-f和ptarget-ilve-r为引物pcr扩增,pcr产物经过dpn i酶切后在37℃保温消化2h,再转化到e.coli dh5α,接种至含50mg/l壮观霉素的lb平板,37℃培养筛选,测序验证获得正确的ptarget-ilve
**
质粒,用于后续连接donor dna;
[0067]
(2)构建ptd-ilve
**
含有donor质粒:以实施例1菌株dpa11的基因组为模板,以l-ilve-f/l-ilve-r和r-ilve-f/r-ilve-r引物扩增得到上下游donor dna,其中在设计引物时引入突变的起始密码子ttg,将起始密码子gtg突变为ttg,所得的pcr片段回收纯化,备用,其中ilve的核苷酸序列如seq id no.2所示。以ptarget-ilve
**
质粒为模板,以ptd-line-f/ptd-line-r为引物扩增质粒线性化片段,pcr产物经过dpn i在37℃保温消化2h,消除掉其中甲基化模板,clean up试剂盒回收dna片段,即线性化ptarget-ilve
**
质粒。按照clonexpress(one step clone kit,vazyme biotech,nanjing,china)说明书将线性化的ptarget-ilve
**
质粒和上下游片段连接在一起,再通过引物t-ilve-f/t-ilve-r菌落pcr和测序验证得到构建成功的ptd-ilve
**
质粒;
[0068]
(3)将pcas9质粒导入到实施例2构建菌株dpa11(ilva
*
)的感受态细胞中,其中菌株dpa11(ilva
*
)感受态细胞制备方法同实施例2步骤(3);
[0069]
(4)构建得到dpa11(ilva
*
ilve**)阳性菌落,构建方法同实施例2步骤(4);
[0070]
(5)质粒消除:实施方法同实施例2步骤(5),获得无质粒菌株dpa11(ilva
*
ilve**),记为菌株dpa13;
[0071]
(6)将构建的菌株dpa13和实施例2构建菌株dpa12按照实施例2步骤(6)方法进行摇瓶发酵测设和检测,其中dpa12为对照菌。生物量od
600
和发酵液中d-泛酸的产量如图3所示,菌株dpa13的od
600
=18.21,发酵液中d-泛酸的产量为3.63g/l;菌株dpa12的od
600
=
glya-r和r-glya-f/r-glya-r为引物扩增得到上下游donor dna。所得的pcr片段回收纯化,备用,其中glya的核苷酸序列如seq id no.4所示。以ptarget-glya质粒为模板,以ptd-line-f/ptd-line-r为引物扩增质粒线性化片段,pcr产物经过dpn i在37℃保温消化2h,消除掉其中甲基化模板,clean up试剂盒回收dna片段。按照clonexpress(one step clone kit,vazyme biotech,nanjing,china)说明书将线性化的ptarget-glya质粒和上下游片段连接在一起,再通过引物t-glya-f/t-glya-r菌落pcr和测序验证得到构建成功的ptd-glya质粒;
[0084]
(3)将pcas9质粒导入到实施例4构建菌株dpa11(ilva
*
ilve**trc-sera)的感受态细胞中,其中菌株dpa11(ilva
*
ilve**trc-sera)感受态细胞制备方法同实施例2步骤(3);
[0085]
(4)构建得到dpa11(ilva
*
ilve**trc-seratrc-glya)阳性菌落,构建方法同实施例2步骤(4);
[0086]
(5)质粒消除:实施方法同实施例2步骤(5),获得无质粒菌株dpa11(ilva
*
ilve**trc-seratrc-glya),记为菌株dpa15;
[0087]
(6)将构建的菌株dpa11(ilva
*
ilve**trc-seratrc-glya)和实施例4构建菌株dpa11(ilva
*
ilve**trc-sera)按照实施例2步骤(6)方法进行摇瓶发酵测设和检测,其中dpa11(ilva
*
ilve**trc-sera)为对照菌。生物量od
600
和发酵液中d-泛酸的产量如图5所示,菌株dpa15的od
600
=15.68,发酵液中d-泛酸的产量为5.63g/l;菌株dpa14的od
600
=16.56,发酵液中d-泛酸的产量为4.32g/l。
[0088]
由图5可见,利用trc启动子替换菌株dpa11(ilva
*
ilve**trc-sera)基因组glya原始启动子,强化了一碳单位循环,为d-泛酸的合成提供充分的一碳单位供体,d-泛酸的产量从4.32g/l增加到5.63g/l,说明强化一碳单位循环,提供氨基供体有利于d-泛酸的合成。
[0089]
实施例6:强化乙酰乳酸合成酶表达菌株dpa11(ilva
*
ilve**trc-seratrc-glya trc-ilvbn)构建及其摇瓶发酵
[0090]
(1)构建ptarget-ilvbn质粒:以ptarget作为模板,以ptarget-ilvbn-f和ptarget-ilvbn-r为引物扩增,pcr产物经过dpn i酶切后在37℃保温消化2h,再转化到e.coli dh5α,接种至含50mg/l壮观霉素的lb平板,37℃培养筛选,测序验证获得正确的ptarget-ilvbn质粒,用于后续连接donor dna;
[0091]
(2)构建ptd-ilvbn含有donor质粒:以菌株dpa11的基因组为模板,以l-ilvbn-f/l-ilvbn-r和r-ilvbn-f/r-ilvbn-r为引物扩增得到上下游donor dna。所得的pcr片段回收纯化,备用,其中ilvb的核苷酸序列如seq id no.5所示,ilvn的核苷酸序列如seq id no.6所示。以ptarget-ilvbn质粒为模板,以ptd-line-f/ptd-line-r为引物扩增质粒线性化片段,pcr产物经过dpn i在37℃保温消化2h,消除掉其中甲基化模板,clean up试剂盒回收dna片段。按照clonexpress(one step clone kit,vazyme biotech,nanjing,china)说明书将线性化的ptarget-glya质粒和上下游片段连接在一起,再通过引物t-ilvbn-f/t-ilvbn-r菌落pcr和测序验证得到构建成功的ptd-ilvbn质粒;
[0092]
(3)将pcas9质粒导入到实施例5构建菌株dpa11(ilva
*
ilve**trc-seratrc-glya)的感受态细胞中,其中菌株dpa11(ilva
*
ilve**trc-seratrc-glya)感受态细胞制备方法同实施例2步骤(3);
[0093]
(4)构建得到dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbn)阳性菌落,构建方
法同实施例2步骤(4);
[0094]
(5)质粒消除:实施方法同实施例2步骤(5),获得无质粒菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbn),记为dpa16;
[0095]
(6)将构建的菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbn)和实施例5构建菌株dpa11(ilva
*
ilve**trc-seratrc-glya)按照实施例2步骤(6)方法进行摇瓶发酵测设和检测,其中dpa11(ilva
*
ilve**trc-seratrc-glya)为对照菌。生物量od
600
和发酵液中d-泛酸的产量如图6所示,菌株dpa16的od
600
=16.89,发酵液中d-泛酸的产量为5.89g/l;菌株dpa15的od
600
=15.68,发酵液中d-泛酸的产量为5.63g/l。
[0096]
由图6可见,利用trc启动子替换菌株dpa11(ilva
*
ilve**trc-seratrc-glya)基因组ilvbn原始启动子,强化了乙酰乳酸合成酶的表达,将碳流量从丙酮酸更多的拉向泛解酸合成途径,d-泛酸的产量从5.63g/l增加到5.89g/l,说明强化了乙酰乳酸合成酶的表达有利于d-泛酸的合成。
[0097]
实施例7:强化辅因子nadph合成菌株dpa11(ilva
*
ilve**trc-seratrc-glya trc-ilvbntrc-pntab)构建及其摇瓶发酵
[0098]
(1)构建ptarget-pntab质粒:以ptarget作为模板,以ptarget-pntab-f和ptarget-pntab-r为引物扩增,pcr产物经过dpn i酶切后在37℃保温消化2h,再转化到e.coli dh5α,接种至50mg/l壮观霉素的lb平板,30℃培养筛选,测序验证获得正确的ptarget-pntab质粒,用于后续连接donor dna;
[0099]
(2)构建ptd-pntab含有donor质粒:以菌株dpa11的基因组为模板,以l-pntab-f/l-pntab-r和r-pntab-f/r-pntab-r为引物扩增得到上下游donor dna。所得的pcr片段回收纯化,备用,其中pnta的核苷酸序列如seq id no.7所示,pntb的核苷酸序列如seq id no.8所示)。以ptarget-pntab质粒为模板,以ptd-line-f/ptd-line-r为引物扩增质粒线性化片段,pcr产物经过dpn i在37℃保温消化2h,消除掉其中甲基化模板,clean up试剂盒回收dna片段。按照clonexpress(one step clone kit,vazyme biotech,nanjing,china)说明书将线性化的ptarget-pntab质粒和上下游片段连接在一起,再通过引物t-pntab-f/t-pntab-r菌落pcr和测序验证得到构建成功的ptd-pntab质粒;
[0100]
(3)将pcas9质粒导入到实施例6构建菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbn)的感受态细胞中,其中菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbn)感受态细胞制备方法同实施例2步骤(3);
[0101]
(4)构建得到dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntab)阳性菌落,构建方法同实施例2步骤(4);
[0102]
(5)质粒消除:实施方法同实施例2步骤(5),获得无质粒菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntab),记为菌株dpa17;
[0103]
(6)将构建的dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntab)生产菌株和实施例6构建菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbn)按照实施例2步骤(6)方法进行摇瓶发酵测设和检测,其中dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbn)为对照菌。生物量od
600
和发酵液中d-泛酸的产量如图7所示,菌株dpa17的od
600
=16.38,发酵液中d-泛酸的产量为6.51g/l;菌株dpa16的od
600
=16.89,发酵液中d-泛酸的产量=5.89g/l。
[0104]
由图7可见,利用trc启动子替换菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntab)基因组pntab原始启动子,强化了辅因子nadph合成,d-泛酸的产量从5.89g/l增加到6.51g/l,说明强化辅因子nadph合成有利于d-泛酸的合成。
[0105]
实施例8:强化辅因子atp合成菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)构建及其摇瓶发酵
[0106]
(1)构建ptarget-cyo质粒:以ptarget作为模板,以ptarget-cyo-f和ptarget-cyo-r为引物扩增,pcr产物经过dpn i酶切后在37℃保温消化2h,再转化到e.coli dh5α,接种至含50mg/l壮观霉素的lb平板,30℃培养筛选,测序验证获得正确的ptarget-cyo质粒,用于后续连接donor dna;
[0107]
(2)构建ptd-cyo含有donor质粒:以菌株dpa11的基因组为模板,以l-cyo-f/l-cyo-r和r-cyo-f/r-cyo-r为引物扩增得到上下游donor dna。所得的pcr片段回收纯化,备用,其中cyo的核苷酸序列如seq id no.9所示。以ptarget-cyo质粒为模板,以ptd-line-f/ptd-line-r为引物扩增质粒线性化片段,pcr产物经过dpn i在37℃保温消化2h,消除掉其中甲基化模板,clean up试剂盒回收dna片段。按照clonexpress(one step clone kit,vazyme biotech,nanjing,china)说明书将线性化的ptarget-cyo质粒和上下游片段连接在一起,再通过引物t-cyo-f/t-cyo-r菌落pcr和测序验证得到构建成功的ptd-cyo质粒;
[0108]
(3)将pcas9质粒导入到实施例7构建菌株dpa11(ilva
*
ilve**trc-sera trc-glyatrc-ilvbntrc-pntab)的感受态细胞中,其中菌株dpa11(ilva
*
ilve**trc-seratrc-glya trc-ilvbntrc-pntab)感受态细胞制备方法同实施例2步骤(3);
[0109]
(4)构建得到dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)阳性菌落,构建方法同实施例2步骤(4);
[0110]
(5)质粒消除:实施方法同实施例2步骤(5),获得无质粒菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo),记为菌株dpa18;
[0111]
(6)将构建的dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)生产菌株和实施例7构建菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntab)按照实施例2步骤(6)方法进行摇瓶发酵测设和检测,其中dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntab)为对照菌。生物量od
600
和发酵液中d-泛酸的产量如图8所示,菌株dpa18的od
600
=14.95,发酵液中d-泛酸的产量为6.71g/l;菌株dpa17的od
600
=16.38,发酵液中d-泛酸的产量为6.51g/l。
[0112]
由图8可见,利用trc启动子替换菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntab)基因组cyo原始启动子,强化了辅因子atp合成,d-泛酸的产量从6.51g/l增加到6.71g/l,说明强化辅因子atp合成有利于d-泛酸的合成。
[0113]
实施例9:在质粒上过表达pbc菌株的构建及其摇瓶发酵
[0114]
(1)构建pbc质粒:以质粒ptrc99a为模板,以ptrc99a-line-f/ptrc99a-line-r为引物pcr扩增,其中pcr产物经过dpn i酶切后在37℃保温消化2h,去除其中的甲基化载体,再用clean up试剂盒回收dna片段,备用。再以谷氨酸棒杆菌(corynebacterium glutamicum)atcc13032的基因组为模板,以引物panb-f/panb-r和panc-f/panc-r,分别pcr扩增panb(seq id no.10)和panc(seq id no.11)片段,再用clean up试剂盒回收dna片段,备用。按照(one step clone kit,vazyme biotech,nanjing,china)说明书将
线性化ptrc99a质粒、片段panb和panc连接在一起,将连接产物通过化学转化法转化到e.colidh5α感受态中;最后挑选克隆子,通过测序验证得到pbc质粒。
[0115]
(2)制备dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)化学转化感受态,阳性菌落验证以及质粒消除同实施例2。
[0116]
(3)同实施例2,将(1)中构建pbc质粒转化到步骤(2)菌株dpa11(ilva
*
ilve**trc-seratrc-glya trc-ilvbntrc-pntabtrc-cyo)的感受态细胞中,从而获得最终构建的菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)/pbc,记为菌株dpa19。
[0117]
(4)将构建的生产菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)/pbc和实施例8构建的dpa11(ilva
*
ilve**trc-seratrc-glya trc-ilvbntrc-pntabtrc-cyo),按照实施例2(6)方法进行摇瓶测试和检测。其中菌株dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)为对照组。生物量od
600
及发酵液上清中的d-泛酸含量如图9所示,菌株dpa19的od
600
=15.14,发酵液中d-泛酸的产量为6.85g/l;菌株dpa18的od
600
=14.95,发酵液中d-泛酸的产量为6.71g/l。
[0118]
由图9可见,在质粒上过表达来源于corynebacterium glutamicum的panb和panc强化泛解酸合成途径关键酶的表达,有利于d-泛酸的合成。从而使d-泛酸的产量从6.71g/l增加到6.85g/l。
[0119]
实施例10:5-l发酵罐的补料发酵
[0120]
挑取平板上新鲜单菌落dpa11(ilva
*
ilve**trc-seratrc-glyatrc-ilvbntrc-pntabtrc-cyo)/pbc至含有50mg/l卡那霉素抗性lb试管培养基中,37℃培养10h作为种子液。按体积浓度5%接种量接种至100ml lb培养基中,37℃培养12h,作为上罐的种子液。
[0121]
将上罐种子液按体积浓度15%接种至装有2l发酵培养基的发酵罐中,30℃、500rpm、通气量为0.5v/v
·
min条件下发酵培养,当发酵液中的溶氧量瞬间大幅度提高时(发酵过程中正常溶氧维持在10左右,当葡萄糖消耗完毕后再1min内溶氧可升高到40-50,此时就要开始补料),表明初始糖消耗完毕,此时打开自动补料程序,补料方式采用ph联动,当发酵液中的ph值高于6.80时自动补料,当发酵液中的ph值低于6.80时时停止补料,保持发酵液中的糖浓度维持较低水平(2-4g/l),补料速度为25ml/h,补料培养基总添加量为500ml,在30℃、500rpm、通气量为0.5v/v
·
min条件培养92h;发酵液中d-泛酸的产量为45.35g/l,如图10所示,其中发酵进程曲线中分别标注了发酵液中葡萄糖浓度,生物量od
600
和d-泛酸的浓度随发酵时间的变化。其中葡萄糖浓度测定采用dns法,生物量od
600
采用分光光度计法测定,d-泛酸浓度采用实施例2所述高效液相法。从发酵结果可见,通过理性改造后的菌株,在发酵92h后d-泛酸的产量是45.35g/l,生物量od
600
在发酵后期保持在50左右,糖酸转化率是31.2%,并且发酵液中未检测到其他的氨基酸。
[0122]
补料培养基:葡萄糖500g/l,酵母提取物3g/l,(nh4)2so
4 16g/l、kh2po414g/l、mgso48g/l,β-丙氨酸30g/l,利用去离子水溶解,用50%的氨水调节ph为6.8。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。