1.本发明属于药物化学领域,涉及一种用作hpk1(hematopoietic progenitor kinase 1)抑制剂的吡啶类化合物,包含其的药物组合物,其制备方法,及其用于预防和/或治疗hpk1相关疾病的用途。
背景技术:
2.造血祖细胞激酶1(hpk1),又称丝裂原活化蛋白激酶激酶激酶激酶1(mitogen-activated protein kinase kinase kinase kinase 1,map4k1),是丝/苏氨酸激酶亚家族ste20中的一员,其家族成员还包括map4k2(gck)、map4k3(glk)、map4k4(hgk)、map4k5(khs)和map4k6(mink)。hpk1主要限制性地表达在造血系统细胞中,包括早期祖细胞,以及造血细胞系中,比如人急性成淋巴细胞性白血病细胞(molt4)、人淋巴瘤细胞(daudi)等。
3.在生理条件下,hpk1通过jnk/sapk信号通路行使外周免疫耐受的功能。然而,在某些肿瘤进程中,hpk1负调节t细胞、b细胞响应以及树突细胞的激活。当t细胞受体(t cell receptor,tcr)结合配体(cd3/28)后,hpk1被tcr信号通路激活,激活后的hpk1可以磷酸化接头蛋白slp-76的376位丝氨酸,从而招募14-3-3蛋白,进而导致tcr复合体不稳定,最终导致t细胞响应减弱以及t细胞增殖受抑制。因此,在肿瘤治疗中通过抑制hpk1的免疫负调节作用从而发挥病人本身免疫系统的抗肿瘤效应已经受到越来越多的重视。
4.有研究表明,小鼠树突细胞hpk1酶活性特异性缺失,其抗原递呈作用得到加强(alzabin,s.,n.bhardwaj,f.kiefer,s.sawasdikosol and s.burakoff(2009)."hematopoietic progenitor kinase 1is a negative regulator of dendritic cell activation."j immunol 182(10):6187-6194)。与此类似,lewis肺癌移植瘤小鼠在接受hpk1敲除的t细胞移植治疗后,抑瘤率比对照组(野生型t细胞移植治疗)显著增加(alzabin,s.,s.pyarajan,h.yee,f.kiefer,a.suzuki,s.burakoff and s.sawasdikosol(2010)."hematopoietic progenitor kinase 1is a critical component of prostaglandin e2-mediated suppression of the anti-tumor immune response."cancer immunol immunother 59(3):419-429)。因此,寻找hpk1抑制剂(特别是小分子抑制剂)可作为肿瘤免疫治疗的一个新方向。
技术实现要素:
5.发明要解决的问题
6.本发明通过大量的研究发现一系列新颖的吡啶类化合物,该类化合物具有较高的hpk1抑制活性,其可以单独使用或与其它药物联用,用于预防和/或治疗hpk1相关疾病,尤其是肿瘤疾病,展示出良好的应用前景。
7.用于解决问题的方案
8.第一方面,本发明提供了一种具有式i结构的化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物、同位素标记物、代谢物、前药或者其中任意
两种或多种的混合物,
[0009][0010]
其中,
[0011]
a选自c
6-c
14
芳基和5-14元杂芳基,所述c
6-c
14
芳基和5-14元杂芳基各自任选地被一个或多个rd取代;
[0012]
r1选自c
1-c6烷氧基、氰基、硝基、p(o)rbrc、c(o)nrbrc、s(o)2ra、s(o)2nrbrc、c(o)ra和nrbc(o)ra,所述c
1-c6烷氧基任选地被一个或多个rd取代;
[0013]
r2选自氢和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个rd取代;
[0014]
r3选自氢、卤素、羟基、氰基、硝基、c
1-c6烷基、c
3-c7环烃基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c(o)nrbrc、nrbc(o)ra和nrbrc,所述c
1-c6烷基、c
3-c7环烃基、c
2-c6烯基、c
2-c6炔基和c
1-c6烷氧基各自任选地被一个或多个rd取代;
[0015]
r4和r5各自独立地选自氢、卤素、氰基、硝基、c(o)ra、c(o)ora、c(o)nrbrc、s(o)ra、s(o)2ra、s(o)2nrbrc、nhc(o)ra、nhc(o)ora、nrbrc、oc(o)ra、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基,所述c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基各自任选地被一个或多个rd取代;
[0016]
r6选自氢、卤素、羟基、氰基、硝基、nrbrc、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基,所述c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基各自任选地被一个或多个rd取代;
[0017]
x选自cr7和n;
[0018]
r7选自氢、卤素、氰基、硝基、c(o)ra、c(o)ora、c(o)nrbrc、s(o)ra、s(o)2ra、s(o)2nrbrc、nhc(o)ra、nhc(o)ora、oc(o)ra、nrbrc、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基,所述c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基各自任选地被一个或多个rd取代;
[0019]
若存在,每一个ra各自独立地选自c
1-c6烷基、c
3-c7环烷基、c
6-c
14
芳基、5-14元杂芳基和5-10元杂环基,所述c
1-c6烷基、c
3-c7环烷基、c
6-c
14
芳基、5-14元杂芳基和5-10元杂环基各自任选地被一个或多个rd取代;
[0020]
若存在,每一个rb和rc各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基和4-7元杂环基,所述c
1-c6烷基、c
3-c7环烷基和4-7元杂环基各自任选地被一个或多个rd取代;或者,若存在,每一对rb和rc与其所连接的氮原子一起形成4-7元杂环基,所述4-7元杂环基任选地被一个或多个rd取代;
[0021]
若存在,每一个rd各自独立地选自氢、羟基、卤素、氧代、氰基、硝基、c(o)re、c(o)ore、nrfs(o)2rg、s(o)re、s(o)2re、c(o)nrfrg、s(o)2nrfrg、nrfrg、nrfc(o)rg、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
3-c7环烷基、c
1-c6亚烷氧基-c
1-c6烷氧基、c
6-c
14
芳基、5-14元杂芳基和3-8元杂环基,所述c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
3-c7环烷基、c
1-c6亚烷氧基-c
1-c6烷氧基、c
6-c
14
芳基、5-14元杂芳基和3-8元杂环基各自任选地被一个或多个rj取代;
[0022]
若存在,每一个re各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基、c
6-c
14
芳基和5-14元杂芳基;
[0023]
若存在,每一个rf和rg各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基和4-7元杂环基,所述c
1-c6烷基任选地被一个或多个c
1-c6烷氧基或nrhri取代;或者,若存在,每一对rf和rg与其所连接的氮原子一起形成4-7元杂环基;
[0024]
若存在,每一个rh和ri各自独立地选自氢和c
1-c6烷基;并且
[0025]
若存在,每一个rj各自独立地选自卤素、羟基、氰基和3-8元杂环基。
[0026]
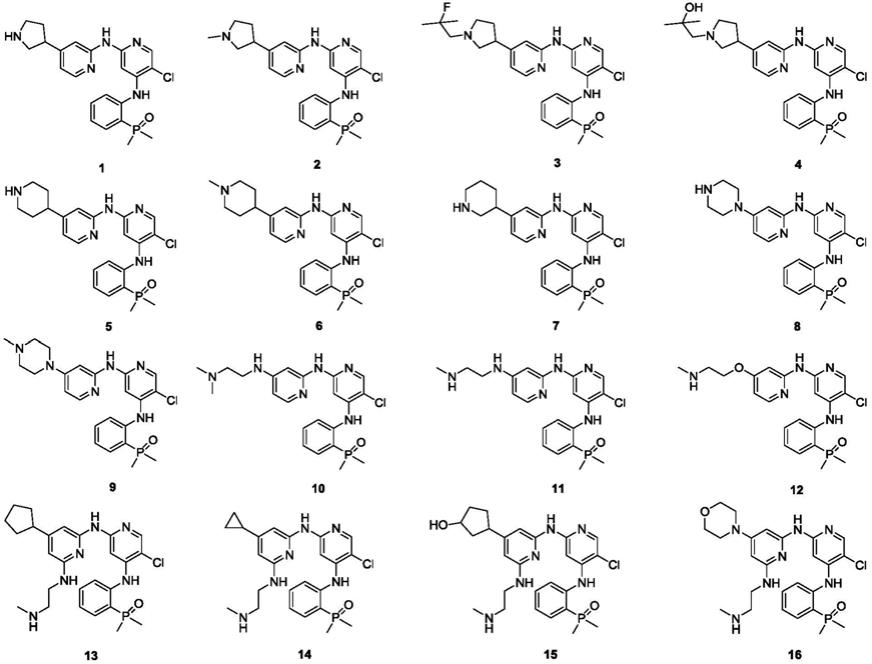
第二方面,本发明提供了所述具有式i结构的化合物的具体实例,其包括:
[0027]
(1)(2-((5-氯-2-((4-(吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0028]
(2)(2-((5-氯-2-((4-(1-甲基吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0029]
(3)(2-((5-氯-2-((4-(1-(2-氟-2-甲基丙基)吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0030]
(4)(2-((5-氯-2-((4-(1-(2-羟基-2-甲基丙基)吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0031]
(5)(2-((5-氯-2-((4-(哌啶-4-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0032]
(6)(2-((5-氯-2-((4-(1-甲基哌啶-4-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0033]
(7)(2-((5-氯-2-((4-(哌啶-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0034]
(8)(2-((5-氯-2-((4-(哌嗪-1-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0035]
(9)(2-((5-氯-2-((4-(4-甲基哌嗪-1-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0036]
(10)(2-((5-氯-2-((4-((2-(二甲基氨基)乙基)氨基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0037]
(11)(2-((5-氯-2-((4-((2-(甲基氨基)乙基)氨基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0038]
(12)(2-((5-氯-2-((4-(2-(甲基氨基)乙氧基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0039]
(13)(2-((5-氯-2-((4-环戊基-6-((2-(甲基氨基)乙基)氨基)吡啶-2-基)氨基)
吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0040]
(14)(2-((5-氯-2-((4-环丙基-6-((2-(甲基氨基)乙基)氨基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0041]
(15)(2-((5-氯-2-((4-(3-羟基环戊基)-6-((2-(甲基氨基)乙基)氨基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0042]
(16)(2-((5-氯-2-((6-((2-(甲基氨基)乙基)氨基)-4-吗啉基吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0043]
(17)(2-((5-氯-2-((6-((2-(甲基氨基)乙基)氨基)-4-(四氢-2h-吡喃-4-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0044]
(18)(2-((5-氯-2-((4-(3-羟基吡咯烷-1-基)-6-((2-(甲基氨基)乙基)氨基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦;
[0045]
(19)(2-((5-氯-2-((4-(吡咯烷基-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二乙基氧化膦;
[0046]
(20)5-氯-n
4-(2-(甲基磺酰基)苯基)-n
2-(4-(吡咯烷-3-基)吡啶-2-基)吡啶-2,4-二胺;
[0047]
(21)5-氯-n
4-(2-(异丙基磺酰基)苯基)-n
2-(4-(吡咯烷-3-基)吡啶-2-基)吡啶-2,4-二胺;
[0048]
(22)2-((5-氯-2-((4-(吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)-n,n-二甲基苯磺酰胺;
[0049]
(23)2-((5-氯-2-((4-(吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)-n-甲基苯甲酰胺;和
[0050]
(24)(2-((2-((4-(吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦。
[0051]
第三方面,本发明提供了所述具有式i结构的化合物的制备方法,其包括下列步骤:
[0052]
1)化合物i-1与化合物i-2反应,得到化合物i-3;
[0053][0054]
2)化合物i-3与化合物i-4反应,得到具有式i结构的化合物;
[0055][0056]
其中,
[0057]
r1、r2、r3、r4、r5、r6和x如上文所定义;
[0058]
lg1和lg2表示离去基团,各自独立地选自卤素原子(例如cl、br或i)、对甲苯磺酸酯基和三氟甲磺酸酯基。
[0059]
第四方面,本发明提供了一种药物组合物,其包含至少一种所述具有式i结构的化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,以及一种或多种药学上可接受的载体。
[0060]
第五方面,本发明提供了一种药品,其包含:
[0061]
a)容器;
[0062]
b)位于所述容器中的至少一种所述具有式i结构的化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物;和
[0063]
c)任选存在的包装和/或说明书。
[0064]
第六方面,本发明提供了所述具有式i结构的化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,或者所述药物组合物,或者所述药品,在制备用于预防和/或治疗至少部分由hpk1介导的疾病或病症(尤其是肿瘤)的药物中的用途。
[0065]
第七方面,本发明提供了所述具有式i结构的化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,或者所述药物组合物,或者所述药品,用作hpk1抑制剂的用途。优选地,所述hpk1抑制剂用于预防和/或治疗至少部分由hpk1介导的疾病或病症(尤其是肿瘤)。
[0066]
第八方面,本发明提供了一种用于预防和/或治疗至少部分由hpk1介导的疾病或病症(尤其是肿瘤)的方法,其包括下列步骤:将预防和/或治疗有效量的所述具有式i结构的化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,或者所述药物组合物,或者所述药品,施用于对其有需求的个体。
[0067]
发明的效果
[0068]
本发明的化合物对hpk1具有很强的抑制活性,具有良好的物理化学性质(例如溶解度、物理和/或化学稳定性)、良好的药物代谢动力学性质(例如良好的生物利用度、合适的血药浓度、半衰期和作用持续时间)、良好的安全性(较低的毒性,例如较低的心脏、肝脏毒性,和/或较少的副作用,以及较宽的治疗窗)等优异的性质。
具体实施方式
[0069]
一般术语和定义
[0070]
除非另有定义,本文中所使用的术语的含义与本领域技术人员通常所理解的相同。本文中所使用的技术意图是指本领域中通常所理解的技术,包括对于本领域技术人员显而易见的技术的变化或等效替换。虽然下列术语对于本领域技术人员容易理解,但仍然阐述如下,以便更好地解释本发明。
[0071]
术语“包括”、“包含”、“具有”或“涉及”及其在本文中的其它变体形式是指包含性的或开放式的集合概念,且不排除其它未列举的元素或方法步骤。本领域技术人员应当理解,上述术语如“包括”涵盖“由
…
组成”的含义。
[0072]
术语“一个(种)或多个(种)”或者类似的表述“至少一个(种)”是指例如1、2、3、4、5、6、7、8、9、10个(种)或更多个(种)。
[0073]
当数值范围的下限和上限被公开时,落入该范围中的任何数值或任何亚范围都表示被具体公开。特别地,本文中所公开的参数的每一个数值范围(例如,以“约a至b”,或同等的“大约a至b”,或同等的“约a-b”的形式)均应理解为涵盖其中的每一个数值和亚范围。例如,“c
1-c
6”应理解为涵盖其中的任意亚范围以及每一个点值,如c
2-c5、c
3-c4、c
1-c2、c
1-c3、c
1-c4、c
1-c5等,以及c1、c2、c3、c4、c5、c6等。又例如,“3-10元”应理解为涵盖其中的任意亚范围以及每一个点值,例如3-4元、3-5元、3-6元、3-7元、3-8元、3-9元、4-5元、4-6元、4-7元、4-8元、5-7元、5-8元、6-7元等,以及3、4、5、6、7、8、9、10元等。
[0074]
术语“药学上可接受的盐”是指对生物体基本上无毒性的,本发明的化合物的盐。药学上可接受的盐通常包括(但不限于)本发明的化合物与药学上可接受的无机酸/有机酸/酸性氨基酸或无机碱/有机碱/碱性氨基酸反应而形成的盐,此类盐又被称为酸加成盐或碱加成盐。适合的盐的综述参见stahl及wermuth的“handbook of pharmaceutical salts:properties,selection,and use”(wiley-vch,2002)。用于制备本发明的化合物的药学上可接受的盐的方法为本领域技术人员已知的。
[0075]
术语“药学上可接受的酯”是指对生物体基本上无毒性的,在生物体体内水解成本发明的化合物或其盐的酯。药学上可接受的酯通常包括(但不限于)本发明的化合物与药学上可接受的羧酸或磺酸形成的酯,此类酯又被称为羧酸酯或磺酸酯。另外,本发明的化合物本身也可以是酯。
[0076]
术语“异构体”是指因具有相同的原子数和原子类型而具有相同的分子量,但原子的空间排列或构型不同的化合物。
[0077]
术语“立体异构体”(或称“旋光异构体”)是指由于具有至少一个手性因素(包括手性中心、手性轴、手性面等)而导致具有垂直的不对称平面,从而能够使平面偏振光旋转的稳定异构体。由于本发明的化合物存在可能导致立体异构的不对称中心以及其他化学结构,因此本发明也包括这些立体异构体及其混合物。由于本发明的化合物(或其药学上可接受的盐)包括不对称碳原子,因而能够以单一立体异构体形式、外消旋物、对映异构体和非对映异构体的混合物形式存在。通常,这些化合物能够以外消旋物的形式制备。然而,如果需要的话,可以将这类化合物制备或分离后得到纯的立体异构体,即单一对映异构体或非对映异构体,或者单一立体异构体富集化(纯度≥99%、≥98%、≥97%、≥96%、≥95%、≥90%、≥85%、≥80%、≥75%、≥70%、≥65%或≥60%)的混合物。如下文中所述,化合物
的单一立体异构体是由含有所需手性中心的旋光起始原料合成制备得到的,或者是通过制备得到对映异构体产物的混合物之后再分离或拆分制备得到的,例如转化为非对映异构体的混合物之后再进行分离或重结晶、色谱处理、使用手性拆分试剂,或者在手性色谱柱上将对映异构体进行直接分离。具有特定立体化学的起始化合物既可以商购得到,也可以按照下文中描述的方法制备再通过本领域熟知的方法拆分得到。术语“对映异构体”是指彼此具有不能重叠的镜像的一对立体异构体。术语“非对映异构体”或“非对映体”是指彼此不构成镜像的旋光异构体。术语“外消旋混合物”或“外消旋物”是指含有等份的单一对映异构体的混合物(即两种r和s对映体的等摩尔量混合物)。术语“非外消旋混合物”是指含有不等份的单一对映异构体的混合物。除非另外指出,本发明的化合物的所有立体异构体形式都在本发明的范围之内。
[0078]
本文中使用实线实楔形或虚楔形以描绘本发明的化合物的共价化学键。当使用实线以描绘键连至手性原子的键时,表示包括该手性原子处的所有可能的立体异构体(例如,特定的对映异构体、外消旋混合物等)。当使用实或虚楔形以描绘键连至手性原子的键时,表示存在所示的立体异构体。除非另外指明,本发明的化合物的立体异构体可以涵盖特定的对映异构体、非对映异构体、外消旋体或其任意比例的混合物。
[0079]
术语“互变异构体”(或称“互变异构形式”)是指具有不同能量的,可通过低能垒互相转化的结构异构体。若互变异构是可能的(如在溶液中),则可以达到互变异构体的化学平衡。例如,质子互变异构体(或称质子转移互变异构体)包括(但不限于)通过质子迁移来进行的互相转化,如酮-烯醇异构化、亚胺-烯胺异构化、酰胺-亚胺醇异构化、亚硝基-肟异构化等。除非另外指出,本发明的化合物的所有互变异构体形式都在本发明的范围之内。
[0080]
术语“多晶型物”(或称“多晶型形式”)是指化合物或复合物的固体晶体形式。本领域技术人员可通过许多已知的方法获得分子的多晶型物。这些方法包括(但不限于)熔融重结晶、熔融冷却、溶剂重结晶、去溶剂化、快速蒸发、快速冷却、慢速冷却、汽相扩散和升华。另外,可用熟知的技术检测、分类和鉴定多晶型物,这些技术包括(但不限于)差示扫描量热法(dsc)、热重分析法(tga)、x射线粉末衍射法(xrpd)、单晶x射线衍射法(scxrd)、固态核磁共振(nmr)、红外光谱法(ir)、拉曼光谱法和扫描电镜术(sem)等。本发明涵盖本发明的化合物的所有可能的结晶形式或多晶型物,其可以为单一的多晶型物或多种多晶型物以任意比例混合而得的混合物。
[0081]
术语“溶剂化物”是指由本发明的化合物(或其药学上可接受的盐)与至少一种溶剂分子通过非共价分子间作用力结合而形成的物质。常见的溶剂化物包括(但不限于)水合物(包括半水合物、一水合物、二水合物、三水合物等)、乙醇合物、丙酮合物等。本发明的化合物可以溶剂化物(优选水合物)的形式存在,其中包含作为晶格结构要素的极性溶剂(特别是水、甲醇或乙醇)。极性溶剂(特别是水)的量可以化学计量比或非化学计量比的形式存在。
[0082]
术语“同位素标记物”是指将本发明的化合物中的特定原子替换为其同位素原子而形成的衍生化合物。除非另外指出,本发明的化合物包括h、c、n、o、f、p、s、cl的各种同位素,如2h(d)、3h(t)、
13
c、
14
c、
13
n、
15
n、
17
o、
18
o、
18
f、
31
p、
32
p、
34
s、
35
s、
36
s、
37
cl和
125
i。例如,
12
c可被
12
c、
13
c或
14
c替代;1h可被2h(d,氘)或3h(t,氚)替代;
16
o可被
18
o替代等。
[0083]
术语“代谢物”是指本发明的化合物经代谢后形成的衍生化合物,例如经过氧化、
还原、水解、酰胺化、脱酰胺化、酯化、酶解等反应而产生。关于代谢的进一步信息参见goodman and gilman's:the pharmacological basis of therapeutics[m],mcgraw-hill international editions,1996。本发明涵盖本发明的化合物的所有可能的代谢物形式,即在施用本发明的化合物的个体体内形成的物质。化合物的代谢物可以通过所属领域的公知技术来鉴定,其活性可以通过试验来表征。
[0084]
术语“前药”是指在施用于个体后能够直接或间接地提供本发明的化合物的衍生化合物。特别优选的衍生化合物或前药是在施用于个体时可以提高本发明的化合物的生物利用度的化合物(例如,更易吸收入血),或者促进母体化合物向作用位点(例如,淋巴系统)递送的化合物。除非另外指出,本发明的化合物的所有前药形式都在本发明的范围之内,且各种前药形式是本领域已知的,例如参见t.higuchi,v.stella,pro-drugs as novel drug delivery systems[j],american chemical society,vol.14,1975。此外,本发明还涵盖含有保护基的本发明的化合物。在制备本发明的化合物的任何过程中,保护在任何有关分子上的敏感基团或反应基团可能是必需的和/或期望的,由此形成本发明的化合物的化学保护的形式。这可以通过常规的保护基实现,例如在t.w.greene,p.g.m.wuts,protective groups in organic synthesis[m],john wiley&sons,2006中描述的保护基。使用本领域已知的方法,在适当的后续阶段可以移除这些保护基。
[0085]
术语“化学键”是指纯净物分子内或晶体内相邻两个或多个原子(或离子)间使其相互结合的强烈的作用力,主要包括共价键、离子键、金属键、配位键等。除非另有说明,以游离形式存在的本发明的化合物中的化学键大多为共价键。
[0086]
在本文中单独或与其他基团组合使用时,术语“烷基”是指直链或支链的饱和脂肪族烃基。在一些实施方案中,烷基具有1至10个碳原子,例如1至8个碳原子(c
1-c8烷基)、1至6个碳原子(c
1-c6烷基)、1至4个碳原子(c
1-c4烷基)、1至3个碳原子(c
1-c3烷基)、2至6个碳原子(c
2-c6烷基)、2至4个碳原子(c
2-c4烷基)或3至4个碳原子(c
3-c4烷基)。例如,本文中所使用的术语“c
1-c6烷基”是指具有1-6个碳原子(如1、2、3、4、5或6个碳原子)的烷基(如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基等),其任选地被一个或多个(如1-3个)本文中所描述的取代基取代(如被卤素取代时,该基团为“c
1-c6卤代烷基”,如-cf3、-c2f5、-chf2、-ch2f、-ch2cf3、-ch2cl、-ch2ch2cf3等)。
[0087]
在本文中单独或与其他基团组合使用时,术语“环烃基”是指饱和的和部分饱和的脂肪族单环或多环(如双环)的烃基(包括环烷基、环烯基、环炔基等,例如单环,诸如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基等,或双环,包括螺环、稠环或桥环,诸如双环[1.1.1]戊基、双环[2.2.1]庚基等),其任选地被一个或多个(如1-3个)适合的取代基取代。
[0088]
在本文中单独或与其他基团组合使用时,术语“环烷基”是指饱和的脂肪族单环或多环(如双环)的烃基(例如单环环烷基,如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基等;或双环环烷基,包括稠环、桥环或螺环,如十氢萘基、双环[2.2.1]庚基、螺[4.5]癸基等)。在一些实施方案中,环烷基具有3至15个碳原子,例如3至10个碳原子(c
3-c
10
环烷基)、3至7个碳原子(c
3-c7环烷基)、3至6个碳原子(c
3-c6环烷基)、3至5个碳原子(c
3-c5环烷基)、5至7个碳原子(c
5-c7环烷基)、4至6个碳原子(c
4-c6环烷基)或5至6个碳原子(c
5-c6环烷基)等。例如,本文中所使用的术语“c
3-c7环烷基”是指具有3-7个成环碳原子的环烷基,
其任选地被一个或多个(如1-3个)本文中所描述的取代基取代(如被卤素取代时,该基团为“c
3-c7卤代环烷基”,如2-氟环丙基、3-氯环丁基、4-溴环己基等)。
[0089]
在本文中单独或与其他基团组合使用时,术语“杂环基”是指脂肪族单环或多环(如双环、三环或更多环)的烃基,其环中具有一个或多个碳原子(如1、2、3、4、5、6、7、8或9个)以及一个或多个(如1、2、3或4个)各自独立地选自c(=o)、o、s、s(=o)、s(=o)2和nr(r表示氢原子或取代基,例如烷基或环烷基)的片段(例如3-7元杂环基、4-7元杂环基、3-8元杂环基、5-10元杂环基等)。杂环基可以是饱和的(不包含双键或叁键)或不饱和的(包含至少一个双键或叁键),饱和的杂环基又可称为杂环烷基,例如3-8元杂环烷基、5-6元杂环烷基等。例如,本文中所使用的术语“3-7元杂环基”是指具有3-7个环原子(其中包含一个或多个杂原子)的杂环基,其任选地被一或多个(例如1至3个)本文中所描述的取代基取代(如环氧乙烷基、环硫乙烷基、环氮乙烷基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、四氢呋喃基、二氧杂环戊烷基、四氢噻吩基、吡咯烷基、吡咯烷酮基、咪唑烷基、吡唑烷基、四氢吡喃基、四氢噻喃基、哌啶基、氮杂基、吗啉基、硫吗啉基、1,4-噻噁烷基、1,4-二氧六环基、1,4-二噻烷基、哌嗪基、三噁烷基、三噻烷基、噻嗪烷基等;或其并环衍生物,如环戊烷并氮杂环丙基、吡咯烷并环丙基、吡咯烷并环丁基、吡咯烷并吡咯烷基、吡咯烷并哌啶基、吡咯烷并哌嗪基、吡咯烷并吗啉基、哌啶并吗啉基等;或其螺环衍生物,如等)。
[0090]
在本文中单独或与其他基团组合使用时,术语“烷氧基”是指通过氧原子连接至母体分子部分的上述烷基,即-o-烷基。例如,本文中所使用的术语“c
1-c6烷氧基”是指具有1-6个碳原子(如1、2、3、4、5或6个碳原子)的烷氧基(如甲氧基、乙氧基、异丙氧基、叔丁氧基等),其任选地被一个或多个(如1-3个)本文中所描述的取代基取代(如被卤素取代时,该基团为“c
1-c6卤代烷氧基”,如-ocf3、-oc2f5、-ochf2、-och2cl等)。
[0091]
在本文中单独或与其他基团组合使用时,术语“亚烷氧基”是指从上述烷氧基中去掉一个氢原子后形成的二价基团,即-o-亚烷基-。例如,本文中所使用的术语“c
1-c6亚烷氧基”是指具有1-6个碳原子(如1、2、3、4、5或6个碳原子)的亚烷氧基(如亚甲氧基、亚乙氧基等),其任选地被一个或多个(如1-3个)本文中所描述的取代基取代(如被卤素取代时,该基团为“c
1-c6卤代亚烷氧基”,如-ocf
2-、-oc2f
4-、-ochf-、-ochcl-等)。
[0092]
在本文中单独或与其他基团组合使用时,术语“芳基”是指具有共轭π电子系统的单环或稠环的芳香族烃基。例如,本文中所使用的术语“c
6-c
14
芳基”是指具有6-14个碳原子的芳基(如苯基、萘基等),其任选地被一个或多个本文中所描述的取代基取代(如被c
1-c6烷基取代的甲苯基、被卤素取代的氯苯基等)。
[0093]
在本文中单独或与其他基团组合使用时,术语“杂芳基”是指具有共轭π电子系统的单环或稠环的芳香族基团。如本文中所使用,“5-14元杂芳基”具有5-14个环原子,例如具有5、6、7、8、9、10、11、12、13或14个环原子,或者是1、2、3、4、5、6、7、8、9或10个碳原子,以及一个或多个(例如1、2、3或4个)各自独立地选自n、o、p和s的杂原子。如果满足价键要求,杂芳基可以通过任意一个环原子连接至母体分子部分。如果满足价键要求,杂芳基可以通过环中的任意一个碳原子或杂原子(如n原子)连接至其他基团(或片段)。并且,杂芳基可以任选地稠合于芳基、杂环基(例如杂环烷基)或环烃基(例如环烷基)环上,其中与母体结构连
接在一起的环为杂芳基环。例如,本文中所使用的术语“5-14元杂芳基”是指具有5-14个环原子的杂芳基(如噻吩基、呋喃基、吡咯基、噻唑基、噁唑基、咪唑基、异噻唑基、异噁唑基、吡唑基、噻二唑基、噁二唑基、三唑基、四唑基等,或如吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基等,或其苯并衍生物,如吲唑基、吲哚基、异吲哚基、喹啉基、异喹啉基等,或如吡唑并吡啶、吡咯并嘧啶、吡咯并吡啶基、吡唑并嘧啶等),其任选地被一个或多个本文中所描述的取代基取代(如被c
1-c6烷基取代的甲基吡啶基、被卤素取代的氯吡啶基等)。
[0094]
如本文中单独或与其他基团组合使用时,术语“烯基”是指具有一个或多个碳-碳双键的直链或支链的脂肪族烃基。在一些实施方案中,烯基具有2至15个碳原子。例如,本文中所使用的术语“c
2-c6烯基”是指具有2-6个碳原子以及一个、两个或三个碳-碳双键的烯基(如乙烯基、1-丙烯基、2-丙烯基、2-丁烯基、3-丁烯基、2-戊烯基、3-戊烯基、4-戊烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基、2-甲基-2-丙烯基、4-甲基-3-戊烯基等),其任选地被一个或多个(如1-3个)本文中所描述的取代基取代。
[0095]
如本文中单独或与其他基团组合使用时,术语“炔基”是指具有一个或多个碳-碳三键的直链或支链的脂肪族烃基。例如,如本文中所使用的术语“c
2-c6炔基”是指具有2-6个碳原子以及一个、两个或三个碳-碳三键的炔基(如乙炔基、1-丙炔基、2-丙炔基、2-丁炔基、3-丁炔基、2-戊炔基、3-戊炔基、4-戊炔基、2-己炔基、3-己炔基、4-己炔基、5-己炔基等),其任选地被一个或多个(如1-3个)本文中所描述的取代基取代。
[0096]
在本文中单独或与其他基团组合使用时,术语“卤素”是指氟(f)、氯(cl)、溴(br)或碘(i)。
[0097]
在本文中单独或与其他基团组合使用时,术语“羟基”是指-oh。
[0098]
在本文中单独或与其他基团组合使用时,术语“氰基”是指-cn。
[0099]
在本文中单独或与其他基团组合使用时,术语“硝基”是指-no2。
[0100]
在本文中单独或与其他基团组合使用时,术语“氨基”是指-nh2。
[0101]
在本文中单独或与其他基团组合使用时,术语“氧代”是指=o。
[0102]
本文中所使用的术语“各自独立地”是指结构中存在的取值范围相同或相近的至少两个基团(或片段)可以在特定情形下具有相同或不同的含义。例如,取代基x和取代基y各自独立地为氢、卤素、羟基、氰基、烷基或芳基,则当取代基x为氢时,取代基y既可以为氢,也可以为卤素、羟基、氰基、烷基或芳基;同理,当取代基y为氢时,取代基x既可以为氢,也可以为卤素、羟基、氰基、烷基或芳基。
[0103]
术语“取代”及其在本文中的其它变体形式是指所指定的原子上的一个或多个(如1、2、3或4个)原子或原子团(如氢原子)被其他等同物代替,条件是未超过所指定的原子或原子团在当前情况下的正常化合价,并且能够形成稳定的化合物。如果某一原子或原子团被描述为“任选地被
……
取代”,则其既可以被取代,又可以未被取代。除非另有说明,本文中取代基的连接位点可以来自取代基的任意适宜位置。当取代基中的连接键显示为穿过环系中相互连接的两个原子之间的化学键时,则表示该取代基可以连接该环系中的任意一个成环原子。
[0104]
通式化合物
[0105]
本发明提供了一种式i化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,
[0106][0107]
其中,
[0108]
a选自c
6-c
14
芳基和5-14元杂芳基,所述c
6-c
14
芳基和5-14元杂芳基各自任选地被一个或多个rd取代;
[0109]
r1选自c
1-c6烷氧基、氰基、硝基、p(o)rbrc、c(o)nrbrc、s(o)2ra、s(o)2nrbrc、c(o)ra和nrbc(o)ra,所述c
1-c6烷氧基任选地被一个或多个rd取代;
[0110]
r2选自氢和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个rd取代;
[0111]
r3选自氢、卤素、羟基、氰基、硝基、c
1-c6烷基、c
3-c7环烃基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c(o)nrbrc、nrbc(o)ra和nrbrc,所述c
1-c6烷基、c
3-c7环烃基、c
2-c6烯基、c
2-c6炔基和c
1-c6烷氧基各自任选地被一个或多个rd取代;
[0112]
r4和r5各自独立地选自氢、卤素、氰基、硝基、c(o)ra、c(o)ora、c(o)nrbrc、s(o)ra、s(o)2ra、s(o)2nrbrc、nhc(o)ra、nhc(o)ora、nrbrc、oc(o)ra、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基,所述c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基各自任选地被一个或多个rd取代;
[0113]
r6选自氢、卤素、羟基、氰基、硝基、nrbrc、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基,所述c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基各自任选地被一个或多个rd取代;
[0114]
x选自cr7和n;
[0115]
r7选自氢、卤素、氰基、硝基、c(o)ra、c(o)ora、c(o)nrbrc、s(o)ra、s(o)2ra、s(o)2nrbrc、nhc(o)ra、nhc(o)ora、oc(o)ra、nrbrc、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基,所述c
1-c6烷基、c
3-c7环烃基、3-7元杂环基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
6-c
14
芳基和5-14元杂芳基各自任选地被一个或多个rd取代;
[0116]
若存在,每一个ra各自独立地选自c
1-c6烷基、c
3-c7环烷基、c
6-c
14
芳基、5-14元杂芳基和5-10元杂环基,所述c
1-c6烷基、c
3-c7环烷基、c
6-c
14
芳基、5-14元杂芳基和5-10元杂环基各自任选地被一个或多个rd取代;
[0117]
若存在,每一个rb和rc各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基和4-7元杂环基,所述c
1-c6烷基、c
3-c7环烷基和4-7元杂环基各自任选地被一个或多个rd取代;或者,若存在,每一对rb和rc与其所连接的氮原子一起形成4-7元杂环基,所述4-7元杂环基任选地被一个或多个rd取代;
[0118]
若存在,每一个rd各自独立地选自氢、羟基、卤素、氧代、氰基、硝基、c(o)re、c(o)ore、nrfs(o)2rg、s(o)re、s(o)2re、c(o)nrfrg、s(o)2nrfrg、nrfrg、nrfc(o)rg、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
3-c7环烷基、c
1-c6亚烷氧基-c
1-c6烷氧基、c
6-c
14
芳基、5-14元杂芳基和3-8元杂环基,所述c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、c
3-c7环烷基、c
1-c6亚烷氧基-c
1-c6烷氧基、c
6-c
14
芳基、5-14元杂芳基和3-8元杂环基各自任选地被一个或多个rj取代;
[0119]
若存在,每一个re各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基、c
6-c
14
芳基和5-14元杂芳基;
[0120]
若存在,每一个rf和rg各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基和4-7元杂环基,所述c
1-c6烷基任选地被一个或多个c
1-c6烷氧基或nrhri取代;或者,若存在,每一对rf和rg与其所连接的氮原子一起形成4-7元杂环基;
[0121]
若存在,每一个rh和ri各自独立地选自氢和c
1-c6烷基;并且
[0122]
若存在,每一个rj各自独立地选自卤素、羟基、氰基和3-8元杂环基。
[0123]
在本发明的一些优选的实施方案中,上述式i化合物中的a为c
6-c
14
芳基,优选c
6-c
10
芳基。
[0124]
在本发明的一些优选的实施方案中,上述式i化合物中的r1选自c
1-c6烷氧基、氰基、硝基、p(o)rbrc、c(o)nrbrc、s(o)2ra和s(o)2nrbrc,优选p(o)rbrc、c(o)nrbrc、s(o)2ra和s(o)2nrbrc。
[0125]
在本发明的一些优选的实施方案中,上述式i化合物中的r2选自氢和c
1-c6烷基,优选氢。
[0126]
在本发明的一些优选的实施方案中,上述式i化合物中的r3选自氢、卤素、氰基、硝基、c
1-c6烷基、c
3-c7环烃基和c
1-c6烷氧基,优选氢和卤素。
[0127]
在本发明的一些优选的实施方案中,上述式i化合物中的r4和r5各自独立地选自氢、卤素、氰基、硝基、nhc(o)ra、nhc(o)ora、nrbrc、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基和c
1-c6烷氧基,所述c
1-c6烷基、c
3-c7环烃基、3-7元杂环基和c
1-c6烷氧基各自任选地被一个或多个rd取代;优选氢、nrbrc、c
3-c7环烃基、3-7元杂环基和c
1-c6烷氧基,所述c
3-c7环烃基、3-7元杂环基和c
1-c6烷氧基各自任选地被一个或多个rd取代;更优选氢、nrbrc、c
3-c7环烷基、3-7元杂环基和c
1-c6烷氧基,所述c
3-c7环烷基、3-7元杂环基和c
1-c6烷氧基各自任选地被一个或多个rd取代。
[0128]
在本发明的一些优选的实施方案中,上述式i化合物中的r6选自氢、卤素、氰基、硝基、nrbrc、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基和c
1-c6烷氧基,优选氢、卤素、氰基、硝基、nrbrc、c
1-c6烷基、c
3-c7环烷基、3-7元杂环基和c
1-c6烷氧基,更优选氢和nrbrc。
[0129]
在本发明的一些优选的实施方案中,上述式i化合物中的x为cr7。
[0130]
在本发明的一些优选的实施方案中,上述式i化合物中的r7选自氢、卤素、氰基、硝基、c
1-c6烷基、c
3-c7环烃基和c
1-c6烷氧基,优选氢、卤素、氰基、硝基、c
1-c6烷基、c
3-c7环烷基和c
1-c6烷氧基,更优选氢。
[0131]
在本发明的一些优选的实施方案中,每一个ra各自独立地选自c
1-c6烷基、c
3-c7环烷基、c
6-c
10
芳基、5-10元杂芳基和5-10元杂环基,优选c
1-c6烷基、c
3-c7环烷基和c
6-c
10
芳基。
[0132]
在本发明的一些优选的实施方案中,每一个rb和rc各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基和4-7元杂环基,所述c
1-c6烷基、c
3-c7环烷基和4-7元杂环基各自任选地被一个或多个rd取代;优选氢和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个rd取代;或者,每一对rb和rc与其所连接的氮原子一起形成4-6元杂环基,优选5-6元杂环基。
[0133]
在本发明的一些优选的实施方案中,每一个rd各自独立地选自氢、羟基、卤素、氰基、硝基、nrfs(o)2rg、nrfrg、nrfc(o)rg、c
1-c6烷基、c
1-c6烷氧基和c
3-c7环烷基,所述c
1-c6烷基、c
1-c6烷氧基和c
3-c7环烷基各自任选地被一个或多个rj取代;优选羟基、卤素、nrfrg和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个rj取代。
[0134]
在本发明的一些优选的实施方案中,每一个re各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基、c
6-c
10
芳基和5-10元杂芳基,优选氢、c
1-c6烷基和c
3-c7环烷基。
[0135]
在本发明的一些优选的实施方案中,每一个rf和rg各自独立地选自氢、c
1-c6烷基和c
3-c7环烷基,所述c
1-c6烷基任选地被一个或多个nrhri取代;优选氢和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个nrhri取代;或者,每一对rf和rg与其所连接的氮原子一起形成4-6元杂环基。
[0136]
在本发明的一些优选的实施方案中,每一个rh和ri各自独立地选自氢和c
1-c4烷基。
[0137]
在本发明的一些优选的实施方案中,每一个rj各自独立地选自卤素、羟基、氰基和3-6元杂环基,优选卤素和羟基。
[0138]
在本发明的一些更优选的实施方案中,上述式i化合物具有如式ii所示的结构,
[0139][0140]
其中,
[0141]
每一个y各自独立地选自cr7和n;
[0142]
x、r1、r2、r3、r4、r5、r6和r7如上文所定义。
[0143]
在本发明的一些更优选的实施方案中,上述式i化合物具有如式iii所示的结构,
[0144][0145]
其中,
[0146]
每一个y各自独立地选自cr7和n;
[0147]
x、r1、r2、r3、r4、r5、r6和r7如上文所定义。
[0148]
在本发明的一些更优选的实施方案中,上述式i化合物具有如式iv所示的结构,
[0149][0150]
其中,x、r1、r2、r3、r4、r5和r6如上文所定义。
[0151]
在本发明的一些更优选的实施方案中,上述式i化合物具有如式v所示的结构,
[0152][0153]
其中,r1、r2、r3、r4、r5和r6如上文所定义。
[0154]
在本发明的一些更优选的实施方案中,上述式i化合物具有如式vi所示的结构,
[0155][0156]
其中,r1、r3、r4、r5和r6如上文所定义。
[0157]
在本发明的一些更优选的实施方案中,上述式i化合物具有如式vii所示的结构,
[0158]
烷氧基;优选地,r6选自氢、卤素、氰基、硝基、nrbrc、c
1-c6烷基、c
3-c7环烷基、3-7元杂环基和c
1-c6烷氧基;更优选地,r6选自氢和nrbrc,优选氢和-nhch2ch2nhch3。
[0166]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii和式iv结构化合物中,x为cr7。
[0167]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii和式iv结构化合物中,r7选自氢、卤素、氰基、硝基、c
1-c6烷基、c
3-c7环烃基和c
1-c6烷氧基;优选地,r7选自氢、卤素、氰基、硝基、c
1-c6烷基、c
3-c7环烷基和c
1-c6烷氧基;更优选地,r7为氢。
[0168]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii、式iv、式v、式vi和式vii结构化合物中,每一个ra各自独立地选自c
1-c6烷基、c
3-c7环烷基、c
6-c
10
芳基、5-10元杂芳基和5-10元杂环基;优选地,每一个ra各自独立地选自c
1-c6烷基、c
3-c7环烷基和c
6-c
10
芳基。
[0169]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii、式iv、式v、式vi和式vii结构化合物中,每一个rb和rc各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基和4-7元杂环基,所述c
1-c6烷基、c
3-c7环烷基和4-7元杂环基各自任选地被一个或多个rd取代;优选地,每一个rb和rc各自独立地选自氢和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个rd取代;或者,每一对rb和rc与其所连接的氮原子一起形成4-6元杂环基,优选5-6元杂环基。
[0170]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii、式iv、式v、式vi和式vii结构化合物中,每一个rd各自独立地选自氢、羟基、卤素、氰基、硝基、nrfs(o)2rg、nrfrg、nrfc(o)rg、c
1-c6烷基、c
1-c6烷氧基和c
3-c7环烷基;所述c
1-c6烷基、c
1-c6烷氧基和c
3-c7环烷基各自任选地被一个或多个rj取代;优选地,每一个rd各自独立地选自羟基、卤素、nrfrg和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个rj取代。
[0171]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii、式iv、式v、式vi和式vii结构化合物中,每一个re各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基、c
6-c
10
芳基和5-10元杂芳基;优选地,每一个re各自独立地选自氢、c
1-c6烷基和c
3-c7环烷基。
[0172]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii、式iv、式v、式vi和式vii结构化合物中,每一个rf和rg各自独立地选自氢、c
1-c6烷基和c
3-c7环烷基,所述c
1-c6烷基任选地被一个或多个nrhri取代;优选地,每一个rf和rg各自独立地选自氢和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个nrhri取代;或者,每一对rf和rg与其所连接的氮原子一起形成4-6元杂环基。
[0173]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii、式iv、式v、式vi和式vii结构化合物中,每一个rh和ri各自独立地选自氢和c
1-c4烷基。
[0174]
在本发明的一些优选的实施方案中,上述式i、式ii、式iii、式iv、式v、式vi和式vii结构化合物中,每一个rj各自独立地选自卤素、羟基、氰基和3-6元杂环基;优选地,每一个rj各自独立地选自卤素和羟基。
[0175]
在部分实施方案中,上述式i结构化合物中,
[0176]
a为c
6-c
14
芳基,优选c
6-c
10
芳基;
[0177]
r4和r5各自独立地选自氢、卤素、氰基、硝基、nhc(o)ra、nhc(o)ora、nrbrc、c
1-c6烷基、c
3-c7环烃基、3-7元杂环基和c
1-c6烷氧基,所述c
1-c6烷基、c
3-c7环烃基、3-7元杂环基和c
1-c6烷氧基各自任选地被一个或多个rd取代;优选氢、nrbrc、c
3-c7环烃基、3-7元杂环基和c1-c6烷氧基,所述c
3-c7环烃基、3-7元杂环基和c
1-c6烷氧基各自任选地被一个或多个rd取代。
[0178]
在部分实施方案中,上述式i、式ii、式iii、式iv和式v结构化合物中,
[0179]
r1选自c
1-c6烷氧基、氰基、硝基、p(o)rbrc、c(o)nrbrc、s(o)2ra和s(o)2nrbrc;
[0180]
r2选自氢和c
1-c6烷基;
[0181]
r3选自氢、卤素、氰基、硝基、c
1-c6烷基、c
3-c7环烃基和c
1-c6烷氧基。
[0182]
在部分实施方案中,上述式i、式ii、式iii、式iv、式v、式vi和式vii结构化合物中,
[0183]
每一个ra各自独立地选自c
1-c6烷基、c
3-c7环烷基、c
6-c
10
芳基、5-10元杂芳基和5-10元杂环基,优选c
1-c6烷基、c
3-c7环烷基和c
6-c
10
芳基;
[0184]
每一个rb和rc各自独立地选自氢、c
1-c6烷基、c
3-c7环烷基和4-7元杂环基,所述c
1-c6烷基、c
3-c7环烷基和4-7元杂环基各自任选地被一个或多个rd取代;优选氢和c
1-c6烷基,所述c
1-c6烷基任选地被一个或多个rd取代;或者,每一对rb和rc与其所连接的氮原子一起形成4-6元杂环基;
[0185]
每一个rd各自独立地选自氢、羟基、卤素、氰基、硝基、nrfs(o)2rg、nrfrg、nrfc(o)rg、c
1-c6烷基、c
1-c6烷氧基和c
3-c7环烷基。
[0186]
在部分实施方案中,上述式i、式ii、式iii和式iv结构化合物中,
[0187]
x为cr7;
[0188]
r7选自氢、卤素、氰基、硝基、c
1-c6烷基、c
3-c7环烃基和c
1-c6烷氧基。
[0189]
本发明提供了式i、式ii、式iii、式iv、式v、式vi或式vii化合物所涵盖的下列化合物:
[0190][0191]
化合物的制备方法
[0192]
本发明提供了式i化合物的制备方法,其包括下列步骤:
[0193]
1)化合物i-1与化合物i-2反应,得到化合物i-3;
[0194][0195]
2)化合物i-3与化合物i-4反应,得到具有式i结构的化合物;
[0196][0197]
其中,
[0198]
r1、r2、r3、r4、r5、r6和x如上文所定义;
[0199]
lg1和lg2表示离去基团,各自独立地选自卤素原子(例如cl、br或i)、对甲苯磺酸酯基(ots)和三氟甲磺酸酯基(otf)。
[0200]
在本发明的一些实施方案中,lg1为卤素离去基团(如氯、溴或碘)。
[0201]
在本发明的一些实施方案中,lg2为卤素离去基团(如氯、溴或碘)。
[0202]
在本发明的一些实施方案中,上述步骤(1)中的反应在碱和金属催化剂的存在下进行。在本发明的一些优选的实施方案中,碱为无机碱类,如碳酸铯。在本发明的另一些优选的实施方案中,金属催化剂为钯催化剂,如四(三苯基膦)钯、醋酸钯、三(二亚苄基丙酮)二钯、1,1'-双(二苯基膦基)二茂铁二氯化钯、1,2-双(二苯基膦基)乙烷二氯化钯、双(三苯基膦)二氯化钯等。
[0203]
在本发明的一些实施方案中,上述步骤(2)中的反应在碱和金属催化剂的存在下进行。在本发明的一些优选的实施方案中,碱为无机碱类,如碳酸铯。在本发明的另一些优选的实施方案中,金属催化剂为钯催化剂,如四(三苯基膦)钯、醋酸钯、三(二亚苄基丙酮)二钯、1,1'-双(二苯基膦基)二茂铁二氯化钯、1,2-双(二苯基膦基)乙烷二氯化钯、双(三苯基膦)二氯化钯等。
[0204]
本领域技术人员应当理解,根据期望获得的产物结构,可以省略上述制备方法中的一个或多个步骤,也可根据需要适当地调整反应步骤的顺序以及增加或省略保护/脱保护反应步骤。
[0205]
本发明的式ii、式iii、式iv、式v、式vi和式vii化合物等均可通过类似的方法合成。
[0206]
药物组合物
[0207]
术语“药物组合物”是指可以用作药物的组合物,其包含药物活性成分(api)(或治疗剂)以及可选的一种或多种药学上可接受载体,目的是促进对生物体的给药,利于活性成分的吸收,进而发挥生物活性。术语“药学上可接受的载体”是指与治疗剂一同给药的辅料,并且其在合理的医学判断的范围内适于接触人类和/或其它动物的组织而没有过度的毒性、刺激性、过敏反应或与合理的益处/风险比相应的其它问题或并发症。在本发明中可使用的药学上可接受的载体包括(但不限于)a)稀释剂;b)润滑剂;c)粘合剂;d)崩解剂;e)吸收剂、着色剂、调味剂和甜味剂;f)乳化剂或分散剂;和/或g)增强化合物的吸收的试剂。
[0208]
本发明提供了一种药物组合物,其包含至少一种本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物。
[0209]
在本发明的一些实施方案中,上述药物组合物还包含一种或多种药学上可接受的载体。
[0210]
在本发明的一些实施方案中,上述药物组合物可以系统地作用和/或局部地作用。为此目的,它们可以通过适合的途径给药,例如通过胃肠外、局部、静脉内、口服、皮下、动脉内、真皮内、经皮、直肠、颅内、腹膜内、鼻内、肌内、吸入途径或者医药领域技术人员熟知的所有方式施用。上述药物组合物可以与至少一种具有疾病或病症治疗效果的其他治疗剂进行联合给药。
[0211]
在本发明的一些实施方案中,上述给药途径可以通过适合的剂型来实现。在本发明中可使用的剂型包括(但不限于)片剂、胶囊剂、锭剂、硬糖剂、散剂、喷雾剂、乳膏剂、软膏剂、栓剂、凝胶剂、糊剂、洗剂、软膏剂、水性混悬剂、可注射溶液剂、酏剂、糖浆剂等。
[0212]
在本发明的一些实施方案中,上述药物组合物可以包含0.01mg至1000mg的至少一种本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物。
[0213]
本发明还提供了上述药物组合物或其相应的制剂形式的制备方法,其包括将至少一种本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物与一种或多种药学上可接受的载体组合。
[0214]
药品
[0215]
术语“药品”是指包含治疗剂、任选的其他治疗剂和任选的包装和/或说明书的组合产品。
[0216]
术语“药物活性成分”、“药物活性物质”、“药物活性剂”或“治疗剂”是指一种化学实体,其可以有效地预防和/或治疗目标疾病或其一种或多种症状。
[0217]
本发明提供了一种药品,其包含:
[0218]
a)容器;
[0219]
b)位于容器中的至少一种本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,或者药物组合物;和
[0220]
c)任选存在的包装和/或说明书。
[0221]
说明书列出了上述药品中药物活性成分或药物组合物的相关信息,优选具体列出了药物活性成分或药物组合物获准使用的适应症。说明书为可印刷材料(如纸、塑料、金属箔、胶粘纸等),其上可形成(如印刷或施涂)所需的信息。
[0222]
在本发明的一些实施方案中,上述药品可以包含0.01mg至1000mg的至少一种本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物。
[0223]
本发明还提供了上述药品的制备方法,其包括将至少一种本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的
混合物,或者药物组合物,与容器以及任选存在的包装和/或说明书组合。
[0224]
医药用途
[0225]
本发明的化合物能够对hpk1表现出较强的抑制作用,可以用作hpk1抑制剂。因此,本发明提供了本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,或者药物组合物,或者药品,用作hpk1抑制剂的用途。优选地,该hpk1抑制剂可以用于预防和/或治疗至少部分由hpk1介导的疾病或病症(尤其是肿瘤)。
[0226]
另外,本发明还提供了本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,或者药物组合物,或者药品,在制备用于预防和/或治疗至少部分由hpk1介导的疾病或病症(或称hpk1相关疾病,尤其是肿瘤)的药物中的用途。
[0227]
术语“至少部分由hpk1介导的疾病或病症(或hpk1相关疾病)”是指发病机理中至少包含一部分与hpk1有关的因素的疾病,这些疾病包括(但不限于)肿瘤类疾病。
[0228]
治疗方法
[0229]
本发明提供了一种用于预防和/或治疗至少部分由hpk1介导的疾病(尤其是肿瘤)的方法,其包括下列步骤:将预防和/或治疗有效量的至少一种本发明的式i、式ii、式iii、式iv、式v、式vi或式vii化合物或其药学上可接受的盐、酯、立体异构体、互变异构体、多晶型物、溶剂化物(如水合物)、同位素标记物、代谢物、前药或者其中任意两种或多种的混合物,或者药物组合物,或者药品,施用于对其有需求的个体。
[0230]
术语“有效量”是指被给药后会在一定程度上缓解所治疗病症的一种或多种症状的化合物的量。可调整给药方案以提供最佳响应。例如,可单次给药,可随时间分剂量给药,或可根据实际情况按比例减少或增加剂量后给药。可以理解的是,对于任何特定个体,具体的给药方案应根据需要以及给药人员的专业判断而调整。另外,也要区分是预防性应用,还是治疗性应用。在预防性应用中,通常以相对长的间隔长期给予相对低的剂量。在治疗性应用中,则通常以相对短的间隔给予相对高的剂量,直至疾病的进展被延缓或停止,优选直至个体表现出症状的部分或完全改善。
[0231]
在本发明中,进行合适的体外或体内测定来确定化合物、药物组合物和/或药品的效果以及给药是否适用于治疗个体所患疾病或病症。这些测定的实例将在下文非限制性实施例中进行描述。通常,足以实现预防和/或治疗效果的化合物的有效量为约0.001mg/千克体重/天至约10,000mg/千克体重/天。在合适的情况下,有效量为约0.01mg/千克体重/天至约1,000mg/千克体重/天。在更普遍的情况下,有效量为每天、每两天或每三天约0.01~1,000mg/千克体重,优选约0.1~500mg/千克体重。示例性的治疗方案为每两天一次或每周一次或每月一次给药。
[0232]
术语“治疗”是指逆转、减轻或消除所针对的疾病或病症。如果受试者接受了治疗量的本发明的化合物或其药学上可接受的形式或者本发明的药物组合物,该受试者的至少一种指标和症状表现出可观察到的和/或可检测出的缓解和/或改善,则表明该受试者已被成功地“治疗”。可以理解的是,治疗不仅包括完全地治疗,还包括未达到完全地治疗,但实
现了一些生物学或医学相关的结果。具体而言,“治疗”表示本发明的化合物或其药学上可接受的形式或者本发明的药物组合物可以实现下列效果中的至少一种:(1)在可能有疾病倾向,但尚未经历或显示疾病病理学或症状学的动物中防止疾病发生;(2)在正在经历或显示疾病病理学或症状学的动物中抑制疾病(即阻止病理学和/或症状学的进一步发展);(3)在正在经历或显示疾病病理学或症状学的动物中改善疾病(即逆转病理学和/或症状学)。
[0233]
术语“施用”是指将药物活性成分(比如本发明的化合物)或包含药物活性成分的药物组合物(例如本发明的药物组合物)应用于个体或其细胞、组织、器官、生物流体等部位,以便使药物活性成分或药物组合物与个体或其细胞、组织、器官、生物流体等部位接触的过程。常见的施用方式包括(但不限于)口服施用、皮下施用、肌内施用、腹膜下施用、眼部施用、鼻部施用、舌下施用、直肠施用、阴道施用等。
[0234]
术语“对其有需求”是指医生或其他护理人员对个体需要或者将要从预防和/或治疗过程中获益的判断,该判断的得出基于医生或其他护理人员在其专长领域中的各种因素。
[0235]
术语“个体”(或称受试者)是指人类或非人动物。本发明的个体包括患有疾病和/或病症的个体(患者)和正常的个体。本发明的非人动物包括所有脊椎动物,例如非哺乳动物,例如鸟类、两栖类、爬行类等,和哺乳动物,例如非人灵长类、家畜和/或驯化动物(例如绵羊、犬、猫、奶牛、猪等)。
[0236]
为了使本发明的目的和技术方案更加清楚,以下结合实施例对本发明的实施方案进行详细描述。但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。
[0237]
实施例中所使用的试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。未注明具体条件者,均按照常规条件或制造商建议的条件进行。本文中所使用的术语“室温”是指20℃
±
5℃。在用于修饰某一数值或数值范围时,本文中所使用的术语“约”是指包括该数值或数值范围以及该数值或数值范围的本领域技术人员可接受的误差范围,例如该误差范围为
±
10%、
±
5%、
±
4%、
±
3%、
±
2%、
±
1%、
±
0.5%等。除非另有声明,浓度以重量计,比例(包括百分比)以摩尔量计。
[0238]
在常规的合成法以及实施例和中间体合成例中,各缩写的含义如下表所示。
[0239][0240]
以下实施例中记载的化合物的结构通过核磁共振(nmr)和/或质谱(ms)来确证。
[0241]
核磁共振nmr)的测定仪器使用bruker 400mhz核磁共振仪,测定溶剂为氘代甲醇
(cd3od)、氘代氯仿(cdcl3)、氘代二甲基亚砜(dmso-d6)或重水(d2o),内标物质为四甲基硅烷(tms)。
[0242]
以下实施例中的核磁共振(nmr)数据中的缩写代表的含义如下:
[0243]
s:单峰(singlet)、d:二重峰(doublet)、t:三重峰(triplet)、q:四重峰(quartet)、dd:双二重峰(double doublet)、qd:四二重峰(quartet doublet)、ddd:双双二重峰(double double doublet)、ddt:双双三重峰(double double triplet)、dddd:双双双二重峰(double double double doublet)、m:多重峰(multiplet)、br:宽峰(broad)、j:偶合常数、hz:赫兹、δ:化学位移。
[0244]
全部化学位移(δ)值以百万分之一(ppm)的单位给出。
[0245]
反应的监测采用薄层色谱法(tlc)或液相色谱-质谱联用(lc/ms)。tlc采用硅胶gf 254作为固定相,lc/ms采用aglient 1260infinity/aglient 6120quadrupole进行。
[0246]
微波反应采用biotageinitiator 微波合成仪进行。
[0247]
柱色谱使用200~300目硅胶(青岛海洋化工有限公司)作为固定相,洗脱剂的体系包括:a:石油醚/乙酸乙酯;b:二氯甲烷/甲醇,溶剂的体积比可以根据化合物的极性不同而进行调节。
[0248]
制备型高效液相(prep-hplc)采用agilent 1260型、waters 2489型或gelai 3500型色谱仪进行。
[0249]
除非另有说明,以下实施例中的反应温度为室温(20~30℃)
[0250]
除非另有说明,以下实施例中的试剂购自acros organics、aldrich chemical company、特伯化学等公司。
[0251]
[化合物制备]
[0252]
实施例1:(2-((5-氯-2-((4-(吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦(化合物1)
[0253][0254]
第一步:3-(2-氨基吡啶-4-基)-2,5-二氢-1h-吡咯-1-羧酸叔丁酯(1b)
[0255]
将4-溴吡啶-2-胺(1a,1.5g,8.67mmol)、3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-2,5-二氢-1h-吡咯-1-羧酸叔丁酯(3.07g,10.40mmol)、pd(dppf)cl2·
ch2cl2(707.47mg,867μmol)和k2co3(2.99g,21.67mmol)加入到1,4-二氧六环(50ml)和水
(10ml)中,在n2保护下,加热至90℃,反应5h。反应结束后,用硅藻土过滤,滤液减压蒸干后,经快速柱层析(洗脱剂体系a)纯化,得到化合物1b(2.2g)。
[0256]
ms(esi):m/z 262.0[m h]
。
[0257]
第二步:3-(2-氨基吡啶-4-基)吡咯烷-1-羧酸叔丁酯(1c)
[0258]
将化合物1b(2.1g,8.04mmol)溶于甲醇(50ml)中,然后加入10%pd/c(975.99mg,8.04mmol),在h2保护下,于室温反应7h。反应结束后,将反应液过滤,滤液减压蒸干后,得到化合物1c(2.0g)粗品,未经纯化直接用于下一步反应。
[0259]
ms(esi):m/z 264.1[m h]
。
[0260]
第三步:3-(2-((4,5-二氯吡啶-2-基)氨基)吡啶-4-基)吡咯烷-1-羧酸叔丁酯(1d)
[0261]
将化合物1c(1.21g,4.60mmol)、2,4,5-三氯吡啶(700mg,3.84mmol)、pd2(dba)3(351.36mg,383.70μmol)、xantphos(444.03mg,767.40μmol)和cs2co3(3.13g,959mmol)加入到1,4-二氧六环(100ml)中,在n2保护下,加热至75℃,反应18h。反应结束后,用硅藻土过滤,滤液减压蒸干后,经快速柱层析(洗脱剂体系a)纯化,得到化合物1d(1.1g)。
[0262]
ms(esi):m/z 408.9[m h]
。
[0263]
第四步:3-(2-((5-氯-4-((2-(二甲基磷酰基)苯基)氨基)吡啶-2-基)氨基)吡啶-4-基)吡咯烷-1-羧酸叔丁基酯(1e)
[0264]
将化合物1d(300mg,732.94μmol)、(2-氨基苯基)二甲基氧化膦(247.97mg,1.47mmol)、pd2(dba)3(67.12mg,73.29μmol)、brettphos(78.67mg,146.59μmol)和cs2co3(597.02mg,1.83mmol)加入到甲苯(5ml)中,在n2保护下,加热至120℃,反应6h。反应结束后,用硅藻土过滤,滤液减压蒸干后,经快速柱层析(洗脱剂体系b)纯化,得到化合物1e(230mg)。
[0265]
ms(esi):m/z 541.9[m h]
。
[0266]
第五步:(2-((5-氯-2-((4-(吡咯烷-3-基)吡啶-2-基)氨基)吡啶-4-基)氨基)苯基)二甲基氧化膦(化合物1)
[0267]
将化合物1e(230mg,424.35μmol)加入到4n盐酸的1,4-二氧六环溶液(15ml)中,于室温下搅拌反应4h。反应结束后,用k2co3水溶液调节体系ph为8~9,减压蒸干后,得到粗品,经制备型高效液相制备纯化(仪器型号:agilent 1260;色谱柱:waters sunfire prep c
18 obd(19mm
×
150mm
×
5.0μm);色谱柱温:25℃;流速:28.0ml/min;检测波长:214nm;流动相a:乙腈;流动相b:0.05%w/v碳酸氢铵水溶液;洗脱梯度:0min时,10%v/v a,90%v/v b;16.0min时,90%v/v a,10%v/v b),得到化合物1(125mg)。
[0268]
ms(esi):m/z 441.9[m h]
。
[0269]1h-nmr(400mhz,dmso-d6):δ9.89(s,1h),9.52(d,j=27.3hz,1h),8.09(s,1h),8.07-8.01(m,2h),7.66-7.57(m,3h),7.40(d,j=29.7hz,1h),7.17(t,j=8.8hz,1h),6.78-6.75(m,1h),3.70-3.66(m,1h),3.58-3.40(m,1h),3.30-3.28(m,1h),3.23-3.17(m,1h),3.06-2.89(m,2h),2.67-2.59(m,0.5h),2.26-2.18(m,0.5h),2.15-2.06(m,0.5h),1.75(d,j=13.5hz,6h),1.71-1.55(m,0.5h)。
[0270]
[生物学评价]
[0271]
以下将通过实验例进一步描述和解释本发明,但这些实验例并非旨在限制本发明
的范围。
[0272]
实验例1:化合物对hpk1酶学活性抑制测试。
[0273]
试剂及仪器:
[0274]
mbp(promega corporation)
[0275]
atp-glo试剂(promega corporation)
[0276]
atp-glo检测缓冲液(promega corporation)
[0277]
bmg labtech(型号为pherastar-fs)
[0278]
采用atp-glo分析试剂盒测试本发明的化合物对hpk1酶学活性抑制作用,试剂(hpk1,5x激酶缓冲液,髓鞘碱性蛋白(mbp),atp)购自promega corporation,试验操作及优化基于试剂说明书推荐。
[0279]
向384孔板中加入2μl的2.5x hpk1(2ng/μl),然后加入1μl的5x一系列浓度的待测化合物,室温孵育结束后,加入2μl的2.5x mbp(0.25μg/μl)/atp(25μm),室温孵育1h。孵育完毕后,向每孔中加入5μl的atp-glo试剂(atp-glo reagent),室温孵育,终止反应,并将剩余的atp去除。40min后,向每孔中加入10μl的atp-glo检测缓冲液(atp-glo detection buffer),于室温反应1h。反应结束后,将384孔板移入pherastar-fs酶标仪(bmg labtech)中进行读数,选择模式:luminescence,数据呈现方式:相对化学发光值rlu(relative luminescence units)。
[0280]
根据以下公式计算化合物对hpk1酶学活性抑制率:
[0281]
抑制率(%)=((rlu
最大-rlu
空白
)-(rlu
处理-rlu
空白
))
÷
(rlu
最大-rlu
空白
)
×
100%
[0282]
其中,rlu
最大
为未加化合物处理组的相对化学发光值;rlu
空白
为未加hpk1且未加化合物处理组的相对化学发光值;rlu
处理
为化合物处理组的相对化学发光值。
[0283]
采用graphpad prism软件,通过将数据拟合至log(抑制剂浓度)对标准化响应(可变斜率)方程,计算ic
50
[0284]
化合物针对hpk1的ic
50
(nm)12.01
[0285]
测试结果表明,化合物1对hpk1酶学活性抑制较高。
[0286]
除本文中描述的那些实施方案外,根据前述描述,本发明的多种修改对本领域技术人员而言会是显而易见的。这样的修改也意图落入所附权利要求书的范围内。本技术中所引用的各参考文献(包括所有专利、专利申请、期刊文章、书籍及任何其它公开)均以其整体援引加入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
