1.本发明属于医药领域,涉及阿匹莫德的新用途,具体涉及阿匹莫德在治疗冠状病毒感染的用途。
背景技术:
2.高致病性冠状病毒感染成了这十年来广受关注公共卫生问题。严重急性呼吸综合征(sars,2002-2004),中东呼吸综合征(mers,2012-至今),2019新型冠状病毒2019-ncov(covid-19),每一个对人类健康,经济发展都带来了巨大的冲击。
3.由于没有针对性的有效药物和疫苗,新型冠状病毒的新药研发意义重大,在这场没有硝烟的战争中,全球多家科研机构和制药公司致力于研发新型冠状病毒疫苗和治疗药物。此领域发明具有重大的社会学和经济学意义。
4.阿匹莫德,apilimod,治疗自体免疫疾病(如克罗恩病),是一种具有细胞通透性的小分子化合物,抑制pikfyve,ic50为14nm。它还是il-12/23抑制剂,对其他脂质激酶和蛋白激酶如pip4k、pip5k,mtor,pi3k和pi4k亚型没有活性。
技术实现要素:
5.本发明目的在于提供包括2019新型冠状病毒(covid-19)在内的冠状病毒的有效抑制剂,可以预防及治疗包括2019新型冠状病毒在内的冠状病毒感染。本发明提供了一种阿匹莫德的新用途,作为包括2019新型冠状病毒在内的冠状病毒的有效抑制剂,在制备预防或治疗冠状病毒感染的药物中的应用。
6.所述的应用,其中冠状病毒包括2019新型冠状病毒(covid-19)、严重急性呼吸综合症(sars)病毒、中东呼吸综合症(mers)病毒以及普通感冒人冠状病毒oc43(hcov-oc43),还包括人冠状病毒nl63(hcov-nl63)、人冠状病毒229e(hcov-229e)、人冠状病毒hku1(hcov-hku1)。
7.所述的应用,其中冠状病毒为2019新型冠状病毒(covid-19)。
8.所述的应用,其中冠状病毒感染为冠状病毒肺炎或者普通感冒。
9.所述的应用,其中冠状病毒感染包括2019新型冠状病毒covid-19肺炎、严重急性呼吸综合症sars、中东呼吸综合症mers、人冠状病毒oc43肺炎、人冠状病毒nl63肺炎、人冠状病毒229e肺炎、人冠状病毒hku1肺炎、普通感冒。
10.所述的应用,其中冠状病毒感染为2019新型冠状病毒肺炎。
11.本发明人经过大量研究发现阿匹莫德的新用途,阿匹莫德可以结合2019新型冠状病毒的刺突蛋白s1,从而阻断病毒进入细胞,阿匹莫德在细胞水平ec50=86nm,cc50=47.39um,si=551。
12.2019新型冠状病毒进入细胞靠刺突蛋白spike识别受体ace2,因此针对spike蛋白为靶点的小分子抑制剂可应用于针对新型冠状病毒的治疗。
13.本发明人还发现阿匹莫德对sars和mers的s1靶蛋白同样能有效结合。因此,阿匹
莫德可应用于针对这些亚型冠状病毒感染的治疗。
14.本发明的化合物可以配制成各种适合的药物制剂形式。可以单独使用,或者将其与药用辅料(例如赋形剂、稀释剂等)混合,配制成口服给药的片剂、胶囊剂、颗粒剂或糖浆剂等或注射给药的粉针剂、溶液剂。
15.与现有技术相比,本发明的技术效果如下:
16.阿匹莫德在细胞水平能够结合刺突蛋白s1,阻止病毒进入细胞,从而达到治疗冠状病毒肺炎感染以及普通感冒,抑制gx-p2v冠状病毒的ec50=86nm。
17.发明人发现,阿匹莫德不能抑制水疱性口炎病毒vsv,证明阿匹莫德抑制冠状病毒是和刺突蛋白spike相关的。
附图说明
18.图1.sars-cov-2 s1&阿匹莫德结合位点的预测
19.图1显示阿匹莫德和2019新型冠状病毒s1蛋白的ai预测结合位点。
20.图2.sars-cov s1&阿匹莫德结合位点的预测
21.图2显示阿匹莫德和sars冠状病毒s1蛋白的ai预测结合位点。
22.图3.mers-cov s1&阿匹莫德结合位点的预测
23.图3显示阿匹莫德和mers冠状病毒s1蛋白的ai预测结合位点。
24.图4.sars-cov-2 s1&阿匹莫德传感图
25.图4显示阿匹莫德和2019新型冠状病毒s1蛋白的亲和力。
26.图5.sars s1&阿匹莫德传感图
27.图5显示阿匹莫德和sars病毒s1蛋白的亲和力。
28.图6.mers s1 s2 ecd&阿匹莫德传感图
29.图6显示阿匹莫德和mers病毒s1 s2 ecd蛋白的亲和力。
30.图7.oc43 s1 s2 ecd&阿匹莫德传感图
31.图7显示阿匹莫德和oc43病毒s1 s2 ecd蛋白的亲和力。
32.图8.nl63 s1 s2 ecd&阿匹莫德传感图
33.图8显示阿匹莫德和nl-63病毒s1 s2 ecd蛋白的亲和力。
34.图9.hku-1 s1 s2 ecd&阿匹莫德传感图
35.图9显示阿匹莫德和hku-1病毒s1 s2 ecd蛋白的亲和力。
36.图10.阿匹莫德抑制sars-cov-2假病毒进入细胞
37.图11.阿匹莫德抑制sars-cov假病毒进入细胞
38.图12.阿匹莫德抑制mers-cov病毒的的ec
50
39.图13.阿匹莫德抑制nl63-cov病毒的的ec
50
40.图14.阿匹莫德抑制gx-p2v病毒的的ec
50
和cc
50
41.图15.阿匹莫德不能抑制vsv病毒
具体实施例
42.下面结合具体实验操作及数据,进一步说明本方面的技术方案。
43.以下通过试验说明阿匹莫德对各个亚型冠状病毒的抑制作用。阿匹莫德来源:购
买于selleck chemicals公司,货号(s6414)。
44.实施例1ai预测结合位点
45.从pdb(http://www.rcsb.org/)下载了sars-cov-2spike蛋白(pdb:6vw1);sars spike蛋白(pdb:2dd8);mers spike蛋白(pdb:6c6z)。除去所有异质原子和spike配体。mpro对接网格最大化用于阿匹莫德对接。在虚拟筛选之前,将pdb文件转换为pdbqt格式的大分子。网格(配体对接搜索空间)的位置如上所述。然后,用autodock vina 1.1.2用于后续的分子对接。使用1.7.4.5版的pymol可以观察到蛋白质与配体的相互作用。spike蛋白质接近命中配体的氨基酸残基被突出显示为参与蛋白质-配体相互作用的潜在相互作用残基。结果见图1-3。
46.实验结果:
47.1.apilimod与sars-cov-2 spike蛋白的结合位点是val341,ala344,phe347,ala348,ser349,trp353,asn354,arg355,ser399。
48.2.apilimod与sars-cov spike蛋白的结合位点是phe325,gly326,phe329,asn330,asp351,val354,leu355,ser358,phe360。
49.3.apilimod与mers-cov spike蛋白的结合位点是lys502,ser504,phe506,glu513,pro515,tyr540,val555。
50.实施例2冠状病毒s蛋白spr实验
51.实验材料与仪器
52.biacore t200(ge healthcare,uppsala,sweden),cm5芯片(ge healthcare,uppsala,sweden),阿匹莫德(selleck chemicals),2019-cov s1蛋白(义翘神州),sars s1蛋白(义翘神州),mers s1 s2 ecd蛋白(义翘神州),oc43 s1 s2 ecd蛋白(义翘神州),nl63 s1 s2 ecd蛋白(义翘神州),hku-1s1 s2 ecd蛋白(义翘神州)。
53.机型为ge公司的biacore t200,将2019新型冠状病毒的s1蛋白(义翘神州),sars病毒s蛋白(义翘神州),mers病毒s1 s2 ecd蛋白(义翘神州),oc43 s1 s2 ecd蛋白(义翘神州),nl63 s1 s2 ecd蛋白(义翘神州),hku-1s1 s2 ecd蛋白(义翘神州)通过氨基偶联到cm5芯片上,偶联量分别为9499.3ru,13628.8ru,14187.7ru,6082.3ru,14602.8ru,16061.2ru,测量阿匹莫德和s蛋白在25℃下的亲和力。以30μl/分钟的流速以100um,50um,25um,12.5um,6.25um,3.125um,1.5625um,0.78125um,0um的浓度注入阿匹莫德,进样时间180s,解离时间300s。数据分析方式为稳态分析。结果见图4-9。spr结果总结在如下表1中。
54.表1在25℃下阿匹莫德结合各个亚型冠状病毒s蛋白的亲和力
55.蛋白kd(m)rmax(ru)chi2(ru2)chi2019cov s12.739*10-6
19.43.321.82sars s13.22*10-5
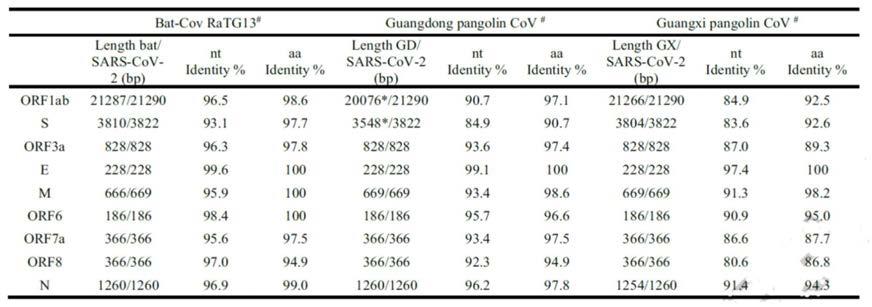
42.630.8130.901mers s1 s21.029*10-4
129.83.431.85oc43 s1 s29.829*10-5
76.312.191.48nl63 s1 s27.497*10-5
119.39.043.01hku-1 s1 s27.155*10-6
46.983.761.94
56.实施例3
57.冠状病毒外膜的vsv-dg-fluc的复制缺陷型假病毒感染实验——检测阿匹莫德抑
制冠状病毒进入细胞的效果
58.实验材料
59.vsv-dg-gfp,其中vsv的糖蛋白(g)被gfp荧光蛋白所替代。vsv-dg-fluc(firefly luciferase)水泡性口炎病毒(vesicular stomatitis virus,vsv)的假病毒包装系统由反向遗传学质粒拯救(rescue)获得,相关质粒均从karafast购得。其中pvsv-δg-luciferase用于转录复制缺陷型的重组vsv基因组,其中vsv的糖蛋白(g)被荧火虫荧光素酶(firefly luciferase,fluc)所替代,而pbs-n,pbs-p,pbs-l,pbs-g作为辅助载体用于帮助第一轮的病毒拯救。
60.拯救与扩增含vsvg外膜的vsv-dg-fluc复制缺陷型病毒
61.将bhk21细胞贴壁于3.5cm dish,第二天待细胞达到90%密度时,并用重组表达t7 rna聚合酶的痘病毒(vaccinia virus-t7,vv-t7)以moi=5的滴度(dmem,无血清)在37℃感染45分钟。用pbs漂洗细胞一遍后,用lipo3000转染已混合好的反向遗传学质粒(pvsv-δg-luciferase:pbs-n:pbs-p:pbs-g:pbs-l=5:3:5:8:1)转染已被vv-t7感染过的细胞,12小时后换液,48小时后收取含有初代vsv-dg-fluc病毒的上清,用0.22μm滤膜过滤上清除去残留的vv-t7。为进一步扩增病毒,用过表达vsv g蛋白的pmd2.g(atcc:plasmid#12259)转染hek293t细胞,24小时后,初代上清与dmem 10%血清1:1混合用于感染,24-48小时后收取上清,12000转离心2分钟后保留上清并分装,用噬斑法测定病毒滴度,并保存于-80℃。
62.包装含冠状病毒sars-cov-2,sars-cov,mers-cov,nl63-cov外膜的vsv-dg-fluc的复制缺陷型假病毒
63.用过表达sars-cov-2,sars-cov,mers-cov,nl63-cov外膜蛋白的质粒(pcaggs-sars-2-s-dc)(pcaggs-sars-s-dc)转染hek293t细胞或vero-e6细胞。24小时后,用moi=10的含vsvg外膜的vsv-dg-fluc病毒(1:30稀释)在37℃感染转染后的细胞1小时,然后加入含1:300稀释的大鼠抗vsvg抗血清的dmem 10%fbs的培养基,用于完全中和残留的含vsvg外膜的vsv-dg-fluc假病毒。24-48小时后收取含有病毒的上清,12000转离心2分钟后保留上清并分装,用有限稀释法通过cpe测定病毒滴度(infectious unit),并保存于-80℃。
64.用基于vsv的sars-cov-2,sars-cov,mers-cov和nl63-cov假病毒感染确定药物半数有效深度(ec50)
65.将bhk21-ace2细胞(武大筛选)贴壁于96孔板。24小时后,细胞密度约达到90%,在dmem 10%fbs的培养基中将不同浓度的药物分别与不同的假病毒混合,如表达gfp或fluc的含vsvg外膜蛋白或sars-cov-2/sars-cov/mers-cov外膜蛋白的vsv-dg假病毒(moi=0.1),然后感染细胞。24小时后,通过荧光显微镜拍摄感染后表达gfp的细胞;或要测定细胞内的荧光素酶强度,则除去培养上清,加入20μl 1x passive lysis缓冲液(promega),室温放置10分钟后通过one-glo luciferase kit(promega)和20/20生物发光测定仪(promega)进行测定。细胞毒性通过显微镜明视野进行观察。实验结果见图10-13。
66.实施例4gx-p2v冠状病毒感染实验检测阿匹莫德抑制冠状病毒复制的效果
67.检测原理:gx-p2v与sars-cov-2高度同源,通过全基因组和各个病毒编码基因(核苷酸水平和氨基酸水平)比较分析发现:gx-p2v与sars-cov-2高度同源,与sars-cov-2的s蛋白同源性达92.5%,是迄今为止成功分离培养的与sars-cov-2的s蛋白同源性最高的病毒,不论是全基因组水平还是病毒吸附进入细胞的关键基因s基因,gx p2v与sars-cov-2的
同源性均远高于sars病毒,见表2。
68.表2gx p2v与其它冠状病毒核酸和氨基酸同源性比较
[0069][0070]
#wuhan-hu-1 sars-cov-2(nc_045512.2)was used for comparison with bat-cov ra tg13(epi_isl_402132),guangdong pangolin cov(merged of gd/pil and gd/p2s),and guangxi pangolincov(gx/p5l)
[0071]
*
partial sequence
[0072]
使用了2019-ncov的替代模型,避免p3实验室操作实验的风险与繁琐。我们使用的gx p2v病毒可在普通p2实验室进行培养,可以作为理想的抗2019-ncov病毒的替代模型,大量基础实验可在该病毒模型上探索后用2019-ncov病毒验证。
[0073]
实验材料与仪器:
[0074]
细胞:vero e6,产商atcc
[0075]
病毒:gx-p2v病毒,产商北化工
[0076]
样品:阿匹莫德,厂商selleck chemicals,浓度10mm,存储条件-20度
[0077]
检测试剂:
[0078]
表3检测试剂
[0079][0080][0081]
阿匹莫德抑制gx-p2v的ec50和cc50研究
[0082]
1)细胞的培养
[0083]
vero e6细胞(atcc)用高糖dmem 10%胎牛血清培养。细胞以1.5x104/孔的密度接种到96孔板(thermo fisher)或者8x104/孔的密度接种到24孔板中,37度在5%co2温箱中孵育。
[0084]
2)阿匹莫德半有效浓度ec50的确定
[0085]
vero e6细胞接种到24孔板中,次日,细胞用gx-p2v病毒感染,并加入2倍稀释的化合物(最大浓度100um),2h后吸走上清,并加入pbs缓冲液清洗,接着再加入2倍稀释的药物(最大浓度为100um)。37℃,5%co2培养箱培养72小时。利用qrt-pcr来检测病毒拷贝数。ec50的值用非线性回归来确定。
[0086]
3)阿匹莫德抑制gx-p2v的ec50和cc50的确证
[0087]
vero e6细胞接种到24孔板中,次日,细胞先分别加入0.195,0.39,0.78,1.56,3.12,6.24,12.5,25,5和100μm的阿匹莫德,后加入病毒。2小时后,换液除去上清,并加入pbs缓冲液清洗以便去除未进入细胞的病毒颗粒,然后细胞再次加入0.195,0.39,0.78,1.56,3.12,6.24,12.5,25,5和100μm的阿匹莫德。病毒感染后的72h通过qrt-pcr的方法对细胞内病毒rna的拷贝数进行定量并用gapdh水平归一化。药物对vero e6的细胞毒性用celltiter-blue活性检测来测量。
[0088]
结果见图14,低浓度的阿匹莫德可以显著抑制gx-p2v,阿匹莫德对gx-p2v的ec50、cc50和si分别为86nm、47.39μm和551,上述数据表明,阿匹莫德抗冠状病毒gx p2v效果很好,有临床上治疗冠状病毒感染的潜质。
[0089]
实施例5
[0090]
阿匹莫德不能抑制水疱性口炎病毒vsv,证明阿匹莫德抑制冠状病毒是和刺突蛋白spike相关的。见图15。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
