化合物3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-(1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮的立体异构体及其作为抗肿瘤剂和磷酸二酯酶抑制剂的用途
技术领域
[0001]
第一方面,本专利申请涉及磷酸二酯酶抑制剂(pde)化合物。
[0002]
第二方面,本技术涉及抗增殖和抗肿瘤化合物。
[0003]
所述化合物可用作例如抗炎剂、血管收缩剂、心功能不全和肺部疾病的兴奋剂和正性肌力药。值得注意的是,pde抑制剂已显示其本身可用于治疗男性勃起功能障碍。此外,所述化合物可用作抗增殖和抗肿瘤剂。
现有技术
[0004]
磷酸二酯酶抑制剂化合物是临床医学使用的主要药物,用于治疗和/或预防勃起功能障碍、可用组织松弛治疗的病症和/或病况以及可用磷酸二酯酶抑制剂治疗的其它疾病。在勃起功能障碍的情况下,pde-5抑制剂是临床医学中最常用的抑制剂。
[0005]
勃起功能障碍,更通常称为阳痿,是对男性生活质量最有害的疾病之一。长期以来,勃起功能障碍困扰着男性,并且有效治疗的可能性不大。
[0006]
在70年代之前,几乎所有勃起功能障碍病例都被认为是由心理原因引起的,并且治疗包括经验性施用睾酮或转诊给精神科医生。
[0007]
口服治疗源于使用cgmp-pde抑制剂、更具体地说是pde-5抑制剂的临床研究。这些化合物的前体是5-[2-乙氧基-5-(4-甲基哌嗪基-磺酰基)苯基]-1-甲基-3-正丙基-1,6-二氢-7h-吡唑并[4,3-d]嘧啶-7-酮,或称为西地那非,其具有血管扩张剂特性,并可能产生一氧化氮的作用。西地那非分子最初描述于北美专利us5250534中。
[0008]
随后,pde-5酶的其它抑制剂化合物被开发并在大量技术文献出版物以及专利出版物中被引用。在已知的化合物中,特别强调:伐地那非分子,最初描述于专利us3635178中;他达拉非,最初描述于美国专利us5859006中;尚未商业化的bl-106、bl-230和bl-236化合物,最初描述于美国专利us8338432和us9359378中,由本专利申请的相同研究团队开发。
[0009]
另外,研究人员证实组织松弛剂化合物已经用于促进几种组织的松弛,目的是在与结石病(korkes,f.等人,j bras nefrol.(2009)31(1):55)、前列腺肥大(例如前列腺增生、前列腺炎)(wo9911279)和尿道狭窄(van der werf等人,bju international(2002)90:588)相关的治疗、操作或外科手术中进行治疗或作为辅助。其它组织松弛剂可治疗的状况和/或病症是已知的,并在现有技术中有所描述。
[0010]
鉴于这种情况,在寻找用于治疗勃起功能障碍、可用组织松弛药治疗的状况和/或病症以及其它可用磷酸二酯酶抑制剂治疗的疾病的磷酸二酯酶抑制剂化合物、更具体而言是pde-5抑制剂的新的替代物中,本发明的研究人员开发了现在描述并要求保护的新化合物,包括化合物3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-(1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮及其存在的立体异构体,它们一起和分
别地呈现作为pde抑制剂、抗增殖和抗肿瘤的显著活性。
[0011]
在这种方式中,一方面,本发明要求保护的化合物可作为替代物用于治疗几种受益于pde抑制的疾病和医学病症,例如勃起功能障碍、心功能不全、肺动脉高压,以及用于治疗几种受益于抗增殖和抗肿瘤作用的医学疾病和病症。
[0012]
发明详述
[0013]
一方面,本专利申请涉及式(i)的化合物3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-(1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮及其立体异构体,
[0014][0015]
以及它们的盐、溶剂化物、水合物、前药和药学上可接受的酯;
[0016]
另一方面,式(i)化合物的所述立体异构体是它们的单个的形式和/或外消旋混合物的形式或任何比例非对映异构体过量的非外消旋混合物的形式。
[0017]
在具体的方面,立体异构体是式(ii)和(iii)的化合物
[0018][0019]
式(ii)化合物命名为3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-236),式(iii)化合物命名为3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-239)。
[0020]
在优选的方面,本专利申请涉及分离的立体异构体,其由下式(iv)、(v)、(vi)和(vii)表示:
[0021][0022][0023]
上述立体异构体命名为:
[0024]
式(iv)化合物:(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-236a);
[0025]
式(v)化合物:(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-236b);
[0026]
式(vi)化合物:(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-239a);和
[0027]
式(vii)化合物:(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-239b)。
[0028]
本专利申请的另一方面涉及式(i)的化合物3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-(1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮的立体异构体的混合物,其中所述混合物可以是外消旋混合物或非外消旋混合物。
[0029]
优选地,本专利申请寻求保护任何比例非对映异构体过量的非外消旋混合物。
[0030]
更具体地说,非对映异构体的比例在1:99至99:1的范围内。在另一个优选的方面,混合物在1:50至50:1的范围内,或者在1:25至25:1的范围内。在更优选的方面,非对映异构体过量的非外消旋混合物在1:2至2:1的范围内,或者比例为1:1。
[0031]
在另一个优选的方面,本专利申请涉及式(viii)和(ix)所述的非对映异构体的混合物,其中该混合物可以含有任意比例的非对映异构体。
[0032]
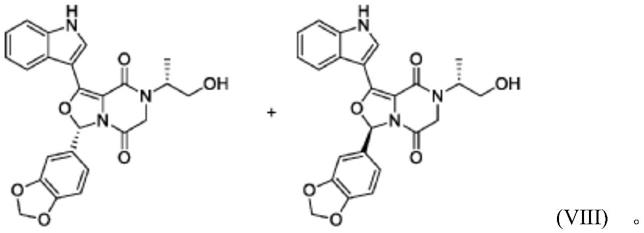
式(viii)的非对映异构体的混合物命名为(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-380),并具有以下结构:
[0033][0034]
其中非对映异构体的比例为1:99-99:1。在另一个优选的方面,混合物在1:50至50:1的范围内,更优选在1:25至25:1的范围内。在更优选的方面,混合物的比例为1:2至2:1,更优选为1:1。
[0035]
式(ix)的非对映异构体的混合物命名为(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-241),并具有以下结构:
[0036][0037]
其中非对映异构体的比例在1:99至99:1的范围内。在另一个优选的方面,混合物在1:50至50:1的范围内,或者在1:25至25:1的范围内。在更优选的方面,混合物在1:2至2:1的范围内,或者比例为1:1。
[0038]
作为本专利申请的目的的非对映异构体及其混合物可以例如根据以下反应方案制备:
[0039]
方案1:式(viii)化合物(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-380)的制备方法。
[0040]
[0041]
方案2:式(ix)化合物(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-241)的制备方法。
[0042][0043]
本专利申请还包括包含式(i)化合物的所述立体异构体的药物组合物和包含所述立体异构体的药物,所述立体异构体以其单独的形式和/或外消旋混合物的形式或任何比例非对映异构体过量的非外消旋混合物的形式存在。所述组合物可以根据制药技术中已知的方法,使用稀释剂、赋形剂或药学上可接受的载体来制备。
[0044]
本专利申请的另一方面涉及式(i)化合物及其立体异构体的用途,例如作为抗肿瘤剂和5型磷酸二酯酶(pde-5)抑制剂的用途;以及所述立体异构体在治疗良性前列腺增生和癌症,更具体地,前列腺癌中的用途。
[0045]
在另一个优选的方面,本专利申请涉及式(viii)所定义并命名为(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-380)的任何比例的非对映异构体的混合物作为抗肿瘤剂和用于治疗哺乳动物中可用pde-5抑制剂治疗的疾病的用途。特别是用于治疗前列腺癌和良性前列腺增生。
[0046]
本专利申请的另一个优选方面涉及分离的立体异构体作为抗肿瘤剂和用于治疗哺乳动物中可用pde-5抑制剂治疗的疾病的用途,所述立体异构体由式(iv)、(v)、(vi)和(vii)定义并分别命名为:(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-236a);(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-236b);(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-239a);和(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-239b)。特别是用于治疗前列腺癌和良性前列腺增生。
[0047]
本专利申请的其它目的是本文所述的式(i)化合物及其立体异构体、盐、酯、前药在制备抗增殖、抗肿瘤和磷酸二酯酶抑制剂,更具体地说是5型磷酸二酯酶(pde-5)抑制剂药物中的用途;以及所述立体异构体在制备用于治疗疾病和病症的药物中的用途,所述疾病和病症是例如炎性疾病和病症、心血管疾病、肺部疾病、男性勃起功能障碍、良性前列腺增生和癌症,更具体而言,前列腺癌。
[0048]
本专利申请进一步描述了使用式(i)的立体异构体、其盐、水合物、前药和药学上
可接受的酯治疗癌症,例如良性前列腺增生和癌症,更具体而言前列腺癌的方法;其中立体异构体是它们的单个的形式和/或外消旋混合物的形式或任何比例非对映异构体过量的非外消旋混合物的形式。
[0049]
以上所述的用途和治疗方法包括提供治疗有效量的化合物及其各自的盐、溶剂化物、前药、立体异构体和外消旋混合物。
[0050]
本专利申请的另一个目的是如上述方案和以下实施例中所述的制备式(i)的化合物3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-(1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮的立体异构体的方法。
实施例:
[0051]
必须理解,本文详细描述的实施例和实施方案解释说明了本专利申请,然而不限制其范围。
[0052]
实施例1:式(viii)化合物的制备
[0053]
在配有机械搅拌器、加料漏斗和含有cacl2的干燥管的500ml烧瓶中,加入式(a)的中间体化合物(e)-2-((苯并[d][1,3]二氧杂环戊烯-5-基亚甲基)胺)-3-(1h-吲哚-3-基)-3-氧代丙酸甲酯(5.0g,13.7mmol)、干燥的thf(90ml)和干燥的吡啶(5.5ml),将其搅拌30分钟。在约3小时内向该悬浮液中缓慢加入氯乙酰氯(1.5ml,19.2mmol)在无水thf(23ml)中的溶液。加入后,将反应混合物在室温下反应4小时。在该阶段结束时,将(r)-2-氨基丙烷-1-醇(23.7g,315.1mmol)加入到该介质中,将该混合物搅拌16小时。该时间结束时,加入100ml乙醇。将该体系进行真空蒸馏,除去过量的溶剂直到产物沉淀。将烧瓶冷却至室温,随后冷却至0至5℃并在该温度下搅拌2小时。将固体置于100ml烧瓶中,加入30ml乙醇;将混合物搅拌30分钟。在该阶段结束时,过滤固体并真空干燥得到由化合物(vi)和(vii)的混合物构成的式(viii)化合物,相当于41%的产率。
[0054]
通过该方法获得的化合物的iupac命名为(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-380),由化学结构(viii)表示:
[0055][0056]
其呈现以下特征:黄色固体;熔点256-262℃;nmr 1
h(500mhz,dmso-d6):δ11.84(ls,2h),8.97-8.95(m,2h),7.87-7.85(m,2h),7.47-7.46(m,2h),7.17-7.09(m,8h),7.08-7.04(m,2h),6.04(s,4h),4.84(t,j=5.8hz,1h),4.80(t,j=5.8hz,1h),4.67-4.60(m,2h),4.14-4.03(m,4h),3.57-3.42(m,4h),1.11(d,j=7.0hz,3h),1.08(d,j=7.0hz,3h);nmr 13
c(125mhz,dmso-d6):δ159.0,158.7,157.0,156.7,148.3,147.6,147.57,147.55,
135.77,135.76,131.1 131.0,130.9,130.8,125.2,122.1,121.3,120.50,120.49,120.44,120.36,112.1,108.3,108.2,106.5,106.4,105.2,105.1,102.3,101.4,90.3,90.1,61.8,61.4,49.4,49.3,46.3,46.1,13.2,13.1。c
24h21
n3o6的hrms(ei)m/z计算值:[447.1430] ,实测值:448.1542[m h] 。
[0057]
使用下列化合物作为反应中间体:(e)-2-((苯并[d][1,3]二氧杂环戊烯-5-基亚甲基)胺)-3-(1h-吲哚-3-基)-3-氧代丙酸甲酯,如化学结构(a)所述;化合物(r)-2-氨基丙烷-1-醇(3)和2-氯乙酰氯(1),如以下和方案1中举例说明的。
[0058][0059]
实施例2:式(ix)化合物的制备
[0060]
在配有机械搅拌器、加料漏斗和含有cacl2的干燥管的500ml烧瓶中,加入式(a)的中间体化合物(e)-2-((苯并[d][1,3]二氧杂环戊烯-5-基亚甲基)胺)-3-(1h-吲哚-3-基)-3-氧代丙酸甲酯(5.0g,13.7mmol)、干燥的thf(90ml)和干燥的吡啶(5.5ml),将其搅拌30分钟。在约3小时内向该悬浮液中缓慢加入氯乙酰氯(1.5ml,19.2mmol)在无水thf(23ml)中的溶液。加入后,将反应混合物在室温下反应4小时。在该阶段结束时,将(s)-2-氨基丙烷-1-醇(23.7g,315.1mmol)加入到该介质中,将该混合物搅拌16小时。该时间结束时,加入100ml乙醇。将该体系进行真空蒸馏,除去过量的溶剂直到产物沉淀。将烧瓶冷却至室温,随后冷却至0至5℃并在该温度下搅拌2小时。将固体置于100ml烧瓶中,加入30ml乙醇;将混合物搅拌30分钟。在该阶段结束时,过滤固体并真空干燥得到由化合物(iv)和(v)的混合物构成的式(ix)化合物,相当于40%的产率。
[0061]
通过该方法获得的化合物的iupac命名为(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-241),由化学结构(ix)表示:
[0062][0063]
其呈现以下特征:黄色固体;熔点256-261℃;nmr 1
h(500mhz,dmso-d6):δ11.84(ls,2h),8.97-8.95(m,2h),7.88-7.85(m,2h),7.47-7.46(m,2h),7.17-7.05(m,10h),
6.98-6.96(m,2h),6.04(s,4h),4.84(t,j=5.5hz,1h),4.80(t,j=5.5hz,1h),4.67-4.60(m,2h),4.14-4.03(m,4h),3.57-3.42(m,4h),1.11(d,j=7.0hz,3h),1.08(d,j=7.0hz,3h);nmr 13
c(125mhz,dmso-d6):δ159.0,158.7,157.0,156.8,148.3,147.6,147.57,147.55,135.8,135.78,135.77,131.1 131.0,130.9,130.8,125.2,122.1,121.3,120.5,120.49,120.44,120.36,112.1,108.3,108.2,106.5,106.4,105.2,105.1,102.3,101.4,90.3,90.1,61.8,61.4,49.4,49.3,46.3,46.1,13.2,13.1。c
24h21
n3o6的hrms(ei)m/z计算值:[447.1430] ,实测值:448.1541[m h] 。
[0064]
使用下列化合物作为反应中间体:(e)-2-((苯并[d][1,3]二氧杂环戊烯-5-基亚甲基)胺)-3-(1h-吲哚-3-基)-3-氧代丙酸甲酯,如化学结构(a)所述;和化合物(s)-2-氨基丙烷-1-醇(4)和氯乙酰氯(1),如以下和方案2中举例说明的。
[0065][0066]
实施例3:式(iv)和(v)的非对映异构体的纯化方法
[0067]
在1.0l的烧瓶中,加入4.5g式(ix)化合物(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-241)和75ml thf/h2o(8:2)的混合物。将悬浮液在50℃加热至溶解。溶解后,向介质中加入560ml甲醇,在室温下搅拌2小时。真空过滤形成的固体,在50ml甲醇中洗涤,并在100℃下烘干4小时。该步骤分离出了化合物bl-236a或bl-236b之一,其具有以下特征:黄色固体,熔点:227-231℃;nmr 1
h(300mhz,dms0-d6):δ11.89(ls,1h),8.97(d,j=1.8hz,1h),7.86(d,j=7.9hz,1h),7.46(d,j=7.9hz,1h),7.18-7.03(m,5h),6.98(dd,j=7.4hz,j=1.0hz,1h),6.04(s,2h),4.88(t,j=5.5hz,1h),4.69-4.58(m,1h),4.07(dd,j=22.5hz,j=17.5hz,2h),3.58-3.41(m,2h),1.07(d,j=6.9hz,3h);nmr 13
c(75mhz,dmso-d6):δ159.9,157.1,148.4,147.7,147.6,135.8,131.2,130.9,125.3,122.2,121.4,120.6,120.5,112.3,108.4,106.6,105.2,102.5,101.5,90.2,61.4,49.4,46.1,13.2;c
24h21
n3o6的hrms(ei)m/z计算值:[447.1430] ,实测值:448.1321[m h] 。通过核磁共振分析、高分辨率质谱和x射线晶体学阐明了化合物的化学结构。
[0068]
将先前过滤的母液返回到反应烧瓶中,缓慢加入200ml h2o,导致反应介质混浊,将其在室温下搅拌一小时。真空过滤悬浮液,用50ml乙醇洗涤。将得到的固体再悬浮于50ml乙醇中,再次过滤,随后在100℃下烘干4小时,分离出bl-236的另一种化合物,其具有以下特征:黄色固体,熔点:221-225℃;nmr 1
h(300mhz,dmso-d6):δ11.90(1s,1h),8.96(s,1h),7.85(d,j=7.9hz,1h),7.46(d,j=7.9hz,1h),7.18-7.03(m,5h),6.97(d,j=7.9hz,1h),6.04(s,2h),4.83(t,j=5.7hz,1h),4.67-4.60(m,1h),4.09(dd,j=25.7hz,j=17.6hz,
2h),3.56-3.41(m,2h),1.10(d,j=6.9hz,3h);nmr 13
c(75mhz,dmso-d6):δ158.7,156.8,148.4,147.6(2c),135.8,131.1,130.9,125.3,122.2,121.4,120.6,120.5,112.2,108.3,106.6,105.2,102.4,101.5,90.4,61.8,49.4,46.3,13.3;c
24h21
n3o6的hrms(ei)m/z计算值:[447.1430] ,实测值:448.1530[m h] 。通过核磁共振分析、高分辨率质谱和x射线晶体学阐明了化合物的化学结构。
[0069]
采用该方法,分离了化合物(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-236a)和(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((s)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-236b),分别由结构式(iv)和(v)表示。
[0070][0071]
实施例4:式(vi)和(vii)的非对映异构体的纯化方法
[0072]
在1.0l的烧瓶中,加入4.5g式(viii)化合物(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮与(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-380)和75ml thf/h2o(8:2)的混合物。将悬浮液在50℃加热至溶解。溶解后,向介质中加入560ml甲醇,在室温下搅拌2小时。真空过滤形成的固体,在50ml甲醇中洗涤,并在100℃下烘干4小时。该步骤分离出了化合物bl-239a或bl-239b之一,其具有以下特征:黄色固体,熔点:233-236℃;nmr 1
h(300mhz,dmso-d6):δ11.89(ls,1h),8.97(d,j=2.4hz,1h),7.86(d,j=7.9hz,1h),7.46(d,j=8.0hz,1h),7.18-7.04(m,5h),6.98(d,j=8.3hz,1h),6.04(s,2h),4.88(t,j=5.7hz,1h),4.67-4.60(m,1h),4.07(dd,j=22.5hz,j=17.5hz,2h),3.58-3.41(m,2h),1.06(d,j=6.9hz,3h);nmr 13
c(75mhz,dmso-d6):δ159.1,157.1,148.4,147.7,147.6,135.8,131.2,130.9,125.3,122.2,121.4,120.6,120.5,112.3,108.4,106.6,105.2,102.4,101.5,90.2,61.4,49.4,46.1,13.2;c
24h21
n3o6的hrms(ei)m/z计算值:[447.1430] ,实测值:448.1540[m h] 。通过核磁共振分析、高分辨率质谱和x射线晶体学阐明了化合物的化学结构。
[0073]
将先前过滤的母液返回到反应烧瓶中,缓慢加入200ml h2o,导致反应介质混浊,将其在室温下搅拌一小时。真空过滤悬浮液,用50ml乙醇洗涤。将得到的固体再悬浮于50ml乙醇中,再次过滤,随后在100℃下烘干4小时,得到目标产物(另一种bl-239分子)。黄色固体,熔点:223-225℃;nmr 1
h(300mhz,dmso-d6):δ11.90(ls,1h),8.96(s,1h),7.85(d,j=8.2hz,1h),7.47(d,j=8.2hz,1h),7.18-7.03(m,5h),6.98(d,j=8.0hz,1h),6.04(s,2h),4.84(t,j=5.6hz,1h),4.69-4.58(m,1h),4.09(dd,j=25.7hz,j=17.6hz,2h),3.55-3.41
(m,2h),1.10(d,j=6.7hz,3h);nmr 13
c(75mhz,dmso-d6):δ158.7,156.8,148.4,147.6(2c),135.8,131.1,130.9,125.3,122.2,121.4,120.6,120.5,112.2,108.3,106.6,105.2,102.4,101.5,90.4,61.8,49.4,46.3,13.3;c
24h21
n3o6的hrms(ei)m/z计算值:[447.1430] ,实测值:448.1529[m h] 。通过核磁共振分析、高分辨率质谱和x射线晶体学阐明了化合物的化学结构。
[0074]
采用该方法,分离了化合物(s)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-239a)和(r)-3-(苯并[d][1,3]二氧杂环戊烯-5-基)-7-((r)-1-羟基丙-2-基)-1-(1h-吲哚-3-基)-6,7-二氢-3h-噁唑并[3,4-a]吡嗪-5,8-二酮(bl-239b),分别由结构式(vi)和(vii)表示。
[0075][0076]
实施例7:体外评价化合物对人磷酸二酯酶5活性的抑制潜力
[0077]
使用bps bioscience酶测定试剂盒(目录60350)进行化合物的评价。pde5a1测定试剂盒被设计用于使用荧光偏振鉴定pde5a1抑制剂。该测定基于由pde5a1酶产生的荧光一磷酸核苷酸与结合试剂的结合。
[0078]
在该方法中,pde5a1反应仅需要微量滴定板上的两个简单步骤。首先,将荧光标记的cgmp与pde5a1温育1小时。其次,将结合试剂加入反应混合物中以产生荧光偏振的变化,然后可以使用配备用于测量荧光偏振的荧光读数器来测量该变化。
[0079]
对于测定,将储备试剂fam-环状-3',5'-gmp(20μm)用pde测定缓冲液稀释以获得200μm浓度的溶液;将pde5a1酶解冻并用pde缓冲液稀释,得到10pg/ml的pde5a1溶液。
[0080]
用dmso 100%(v/v)将测定化合物稀释至1000μm的浓度,随后在0.9%氯化钠溶液中稀释以获得用于测定的目标浓度曲线。将化合物稀释成以下浓度:10nm、30nm、50nm、100nm、300nm、500nm、1μm、3μm、5μm(dmso10%v/v)。
[0081]
该研究由以下组组成:(i)底物对照;(ii)阳性对照(kit);(iii)几种浓度的样品;(iv)他达拉非(比较对照)。每个参数(组)一式三份。
[0082]
测定程序:
[0083]
·
对于4个组,向每个微孔板的孔中加入25μl试剂fam-环状-3',5'-gmp(200μm)。
[0084]
·
底物对照组中,向每孔中加入5μl载体(dmso 10%v/v)和20μl pde缓冲液。
[0085]
·
阳性对照组中,向每孔中加入5μl载体(dmso 10%v/v)。
[0086]
·
他达拉非组:加入5μl目标浓度的溶液。
[0087]
·
向试验组中加入5μl样品溶液(试验化合物)
[0088]
观察:测试的参数一式三份。
[0089]
为了开始反应,将20μl pde5a1酶(如上所述进行稀释)加入指定为阳性对照和样
品(测试化合物和他达拉非)的微孔板的孔中,并在25℃的温度下温育微孔板1小时。
[0090]
在温育期后,通过在所有孔中加入100μl结合试剂溶液中断反应,并在室温下在轻柔搅拌下温育微孔板30分钟。微孔板的读数在偏振荧光(475-495nm-激发和518-538nm-发射检测)下进行,积分时间为500纳秒。
[0091]
对于化合物bl-380,制备10nm、30nm、50nm、100nm、300nm、500nm、1μm(1000nm)、3μm(3000nm)和5μm(5000nm)的浓度。基于所得结果(表1),可以观察到化合物bl-380能够以剂量依赖性方式抑制pde5,然而,这种抑制仅在bl-380浓度为300nm时观察到。
[0092]
表1-化合物bl-380对pde5酶的抑制百分比
[0093][0094]
对于化合物bl-241,制备500nm、1μm(1000nm)和3μm(3000nm)的浓度。基于所得结果(表2),可以观察到化合物bl-241也能够以剂量依赖性方式抑制pde5。
[0095]
表2-化合物bl-241对pde5酶的抑制百分比
[0096][0097]
实施例6:评价化合物在人前列腺癌、胃癌和膀胱癌细胞系培养物中的抗增殖作用
[0098]
为了进行测定,将化合物以1000μm的浓度稀释于dmso 100%(v/v)中,随后于0.9%氯化钠溶液中稀释以获得用于测定的目标储备溶液。直接在细胞培养基中稀释至目标最终浓度。
[0099]
对于该测定,使用以下肿瘤细胞系:pc3-人前列腺癌细胞;lncap-人前列腺癌细胞;du145-人前列腺癌细胞;mnk45-人胃癌和rt4-人膀胱癌细胞。
[0100]
根据里约热内卢细胞库(细胞系来源地点)建立的标准方法,将肿瘤细胞系维持在培养基中。
[0101]
方法步骤:
[0102]
·
对于该测定,以10000个细胞/孔的浓度接种肿瘤细胞(200μl反应最终体积),将板温育8小时,以使细胞粘附到孔壁上。在该时间段之后,将板分成以下各组:
[0103]
(a)试验组:加入20μl目标浓度的样品(测试化合物);
[0104]
(b)阳性对照组:加入20μl培养基(100%细胞增殖);
[0105]
(c)阴性对照组:加入200μl培养基和20μl用于稀释化合物的载体(无细胞-零增殖);
[0106]
(d)对照组:加入20μl用于稀释化合物的载体。该组对评价所用的载体是否干扰细胞增殖是重要的。
[0107]
观察:用各种浓度的样品(测试化合物)和对照一式三份地进行处理。
[0108]
·
在co2烘箱中于37℃下将板保温72小时。
[0109]
·
温育期后,加入100μl/孔的来自cyquant试剂盒的dna标记物溶液,并在co2培养箱中于37℃温育该板60分钟。使用荧光微孔板读数器以485nm激发和530nm发射检测测定荧光强度。将获得的结果相对于阳性对照组(100%增殖)标准化。
[0110]
对于化合物,制备以下浓度的储备溶液:100nm、1μm、3μm、5μm、10μm和30μm(dmso 10%v/v)。试验中的最终浓度为:10nm、100nm、300nm、500nm、1000nm和3000nm(在1%v/v dmso中)。
[0111]
所获得的结果证明,化合物bl-380对测试的3种前列腺癌肿瘤细胞系(pc3、lncap和du145)和膀胱癌肿瘤细胞系(rt4)具有抗增殖作用,如表3中所观察到的。化合物bl-241对测试的3种前列腺癌肿瘤细胞系(pc3、lncap和du145)和膀胱癌肿瘤细胞系(rt4)具有抗增殖作用,如表4中所观察到的。
[0112]
表3-细胞增殖抑制百分比-化合物bl-380
[0113][0114]
表4-细胞增殖抑制百分比-化合物bl-241
[0115]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。