1.本发明涉及微生物基因工程技术领域,具体涉及一株同步生产木糖醇和乙醇 的工业酿酒酵母菌株及其构建方法。
背景技术:
2.化石燃料的大量消耗已经引起了能源枯竭、价格上涨和全球气候变化等严重 的问题。木质纤维素生物质如农业废弃物(甘蔗渣、玉米芯、玉米秸秆、小麦和 稻秆等)、废木料、工业废弃物(包括纸浆、纸张加工废物等)可作为生物燃料 的潜在原料,因其来源广泛,成本低廉,经过对环境无害的生物处理来生产燃料 乙醇,有利于农村社区和整个社会的宏观经济效益。在中国每年约有9亿多吨秸 秆产生,秸秆综合利用率超85%,2020年后秸秆综合利用率还需要进一步提升。 在此背景下,基于碳中和的生命周期分析,木质纤维素生物质是燃料乙醇生产的 有利原料。燃料乙醇的使用可以改善城市空气质量,减少温室气体、氮氧化物和 碳氢化合物的排放,减轻环境压力。
3.木质纤维素生物质原料主要由纤维素、半纤维素和木质素三部分组成,其水 解液中主要六碳糖为葡萄糖,主要五碳糖为木糖。然而,利用木糖、阿拉伯糖等 戊糖发酵成乙醇,代谢效率较低,因此,基于生物炼制的概念,利用这些戊糖生 产高值化学品,如木糖醇,更经济可行。木糖醇是一种天然的五碳糖醇,可作为 糖尿病患者的糖替代品等。生物法生产木糖醇条件温和、工艺简单可行,操作性 可控性强,污染少,分离成本低,具有良好的应用前景,是实现废物资源化、无 害化,替代化学加氢法生产的有效途径。酿酒酵母(saccharomyces cerevisiae) 是经由gras(generally recognized as safe)认证的安全菌株。而工业酿酒酵 母具有耐热性能好、耐受抑制物性能佳等优点,用其作为基因工程改造的出发菌 株,将木糖还原酶基因xyl1导入酿酒酵母可使木糖还原为木糖醇,并可获得高 产木糖醇的工程菌。但是在葡萄糖和木糖共发酵的情况下,由于存在葡萄糖效应, 胞内木糖的高速代谢仍处于瓶颈,因而提高木糖的代谢通量至关重要。
4.结合前期研究,本发明旨在人为改造工业酿酒酵母,在突变了转运子hxt3 之后获得的菌株seb10(申请号:cn201810092198.9)的基础上,为了进一步 提升木糖代谢通量,通过高表达水甘油通道蛋白基因fps1和提高xyl1基因拷 贝数,提高酿酒酵母利用实际物料如秸秆共发酵木糖和葡萄糖的能力,从而提高 其木糖醇和乙醇的同步生产性能。
技术实现要素:
5.本发明的目的在于解决现有来源于热带假丝酵母ctxyl1(编码木糖还原酶) 基因在酿酒酵母中异源表达后,为了模拟其在木质纤维素水解液中的发酵过程, 选取初始浓度高的葡萄糖作为碳源供给时,其构建的重组菌木糖代谢速率慢、木 糖醇产量低、不能满足发酵需求的问题,进而提供解决上述问题的一株高表达 fps1基因,且将sor1/sor2基因编码区替换为ctxyl1基因使其在共发酵葡萄 糖和木糖条件下高产木糖醇及乙醇的工业酿酒
酵母菌株seb20及其构建方法。
6.为实现上述目的,本发明采用如下技术方案:
7.本发明的第一方面是提供一株同步生产木糖醇和乙醇的工业酿酒酵母菌株, 该菌株高表达fps1基因和xyl1基因。
8.进一步地,上述酿酒酵母菌株为seb20,其分类命名为酿酒酵母 saccharomyces cerevisiae,保藏编号为cgmcc no.22590。
9.本发明的第二方面是提供上述工业酿酒酵母菌株的构建方法,以酿酒酵母 seb10为出发菌株,将基因fps1的启动子p
fpsl
替换为强启动子p
tdh3
,且在sor1 和sor2两个位点基因编码区敲除的同时增加ctxyl1基因的拷贝数。
10.进一步地,上述构建方法包括如下步骤:
11.步骤一,将核酸序列为seq id no.1的质粒cas9-nat通过醋酸锂转化法转 化到酿酒酵母seb10菌株中,通过pcr扩增筛选获得阳性转化子seb10-cas9;
12.步骤二,设计识别fps1基因上游的grna片段:
13.gcaattcagtagttaaaagc,以及重组修复dna片段并合成双链 p
fps1-p
tdh3
:以seb10基因组为dna为模板,采用序列为seq id no.5和seq id no.6的引物进行pcr扩增;
14.步骤三,构建识别fps1基因上游的grna质粒:以pmel13质粒为模板, 利用5’端经过磷酸化的引物扩增含grna的线性质粒,回收线性质粒骨架,转 化筛选得到质粒pmel13-upfps1-grna-3;该5’端经过磷酸化的引物的序列为 seq id no.8和seq id no.9;
15.步骤三,将上述质粒pmel13-upfps1-grna-3以及重组修复片段p
fps1-p
tdh3
通过醋酸锂转化法转化到酿酒酵母seb10-cas9菌株中,筛选获得fps1突变菌 株;
16.步骤四,脱除cas9-nat质粒以及pmel13-m-hxt3-grna质粒获得不含 cas9-nat质粒以及grna质粒的菌株;然后进行试管发酵,根据发酵结果筛选 出一株高木糖消耗菌株seb10-ftd13;
17.步骤五,将cas9-nat质粒导入酿酒酵母seb10-ftd13得到菌株 seb10-ftd13-cas9:
18.步骤六,设计识别sor1/sor2基因编码区的grna片段: agagtgtacaccgactgata,以及重组修复dna片段的扩增:以seb10基 因组dna为模板,采用序列为seq id no.14和seq id no.15的引物进行扩增;
19.步骤七,构建识别sor1/sor2基因上游的grna质粒:以pmel13质粒为 模板,利用5’端经过磷酸化的引物扩增含grna的线性质粒,回收线性质粒骨 架,转化筛选得到质粒pmel13-sor-grna;该5’端经过磷酸化的引物的序列 为seq id no.14和seq d no.15;
20.步骤八,将步骤六扩增的重组修复dna片段和质粒pmel13-sor-grna通 过醋酸锂转化法转化到酿酒酵母sebi0-ftd13-cas9菌株;
21.步骤九,脱除cas9-nat质粒以及pmel13-sor-grna质粒,然后进行试 管发酵,根据发酵结果筛选出一株高木糖消耗菌株seb20。
22.进一步地,步骤一中pcr扩增所采用的引物的序列为seq id no.2和seqid no.3。
23.进一步地,步骤三中的筛选包括如下步骤:
24.(1)在含有g418以及诺尔斯菌素的2%ypd平板中筛选菌落形态完好的转 化子;
25.(2)以上述转化子基因组dna为模板,采用序列为seq id no.10和seqid no.11的
引物进行扩增并测序,与上述p
fps1-p
tdh3
序列进行比对,以筛选正 确的转化子。
26.进一步地,上述测序采用的引物序列为seq id no.12。
27.进一步地,上述2%ypd平板包括10g/l酵母浸出粉、20g/l蛋白胨、20g/l 葡萄糖、15g/l琼脂、100μg/ml g418和80μg/ml诺尔斯菌素。
28.进一步地,步骤四和步骤九的具体过程如下:
29.针对上步骤的阳性转化子,在营养丰富的ypd培养基中过夜培养,涂布于 ypd平板上;之后挑取单菌落分别于ypd平板、ypd/g418平板和ypd/nat 平板上,于30℃静置培养,选取在ypd上生长,而不在含有抗性平板上生长的 菌落再次重复这样的筛选得到目标菌株;
30.目标菌株于35℃,140rpm条件下,利用ypdx培养基进行试管发酵。
31.进一步地,上述ypdx培养基包括:10g/l酵母浸出粉、20g/l蛋白胨、45 g/l d-木糖和58g/l葡萄糖。
32.本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
33.1、本发明通过crispr/cas9基因编辑技术,可以定点迅速而准确地将fps1 的启动子p
fps1
替换为强启动子p
tdh3
,且在sor1和sor2两个位点基因编码区 敲除的同时增加ctxyl1基因的拷贝数。
34.2、通过本发明所述构建方法制备的酿酒酵母菌株seb20在初始葡萄糖浓度 较高的条件下,木糖消耗速率,木糖醇乙醇产量均有提升。试管发酵条件下,与 seb10相比,木糖消耗速率加快了73.5%,木糖醇产量提高了27.0%。秸秆预糖 化同步糖化发酵条件下,与出发菌株seb10相比,菌株seb10-ftx1(命名为 seb20)木糖消耗速率提升了24.1%,木糖醇产量提升了42.9%,且木糖醇的收 率接近理论值1.0,乙醇产量提升了5.0%。
附图说明
35.本发明公开的一株同步生产木糖醇和乙醇的工业酿酒酵母菌株为seb20,其 已进行保藏,其分类命名为酿酒酵母saccharomyces cerevisiae,其保藏编号为 cgmcc no.22590,保藏日期为2021年5月24日,保藏单位为中国微生物菌种 保藏管理委员会普通微生物中心,保藏单位地址为北京市朝阳区北辰西路1号院 3号。
36.图1是本发明一实施例中启动子p
fps1
替换为p
tdh3
时转化子的试管发酵评价 结果;
37.图2是本发明一实施例中启动子p
fps1
替换为p
tdh3
时转化子的试管发酵评价 结果;
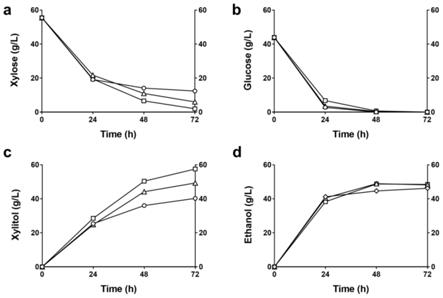
38.图3是本发明一实施例中应用秸秆纤维素物料预糖化物料进行同步糖化发 酵的结果;其中,图a、b、c、d分别为木糖、葡萄糖、木糖醇和乙醇含量测定 曲线;
“○”
表示seb10,“δ”表示seb10-ftd13,
“□”
表示seb20。
具体实施方式
39.本发明使用具有木糖代谢背景的絮凝性工业酵母seb10(cgmcc no. 14177)作为出发菌株,构建了一株高产木糖醇菌株seb20(cgmcc no.22590)。 为了确保重组菌株在工业生产中的安全性,利用crispr/cas9基因编辑技术来 高表达fps1基因,提高木糖醇的胞外分泌能力,并进一步提升木糖还原酶基因 ctxyl1拷贝数,增加菌株的木糖代谢速率,从而进一步提高木糖代谢通量,从 而提高木糖醇产量。
40.下面通过具体实施例和附图对本发明进行详细和具体的介绍,以使更好的理 解
本发明,但是下述实施例并不限制本发明范围。
41.实施例中方法如无特殊说明的采用常规方法,使用的试剂如无特殊说明的使 用常规市售试剂或按常规方法配制的试剂。
42.以下实施例中采用的培养基配方如下:
43.液体培养基:
44.2%ypd培养基(10g/l酵母浸出粉、20g/l蛋白胨、20g/l葡萄糖),121℃, 灭菌15min,冷却至60℃,可根据情况添加100μg/ml g418或80μg/ml诺尔 斯菌素。用于酵母发酵前的预培养。
45.ypdx培养基(10g/l酵母浸出粉、20g/l蛋白胨、40g/l d-木糖、58g/l 葡萄糖),121℃灭菌15min,冷却至60℃,可根据情况添加100μg/ml g418或 80μg/ml诺尔斯菌素。用于试管发酵。
46.固体培养基:
47.lb/kana培养基(10g/l蛋白胨、5g/l酵母浸出粉、10g/l nacl),121℃, 冷却至60℃,加入100μg/ml卡那霉素。用于培养大肠杆菌。
48.2%ypd/g418/nat固体培养基(10g/l酵母浸出粉、20g/l蛋白胨、20g/l 葡萄糖、15g/l琼脂),121℃,冷却至60℃,加入100μg/ml g418,80μg/ml 诺尔斯菌素。用于培养酵母,根据试验情况添加两种抗生素筛选酵母转化子。
49.实施例1
50.本实施例提供一种同步生产木糖醇和乙醇的工业酿酒酵母菌株,其构建方法 包括以下步骤:
51.(1)将cas9-nat质粒导入酿酒酵母seb10:将现有质粒cas9-nat(1μg) (核酸序列为seq id no.1)通过醋酸锂转化法转化到酿酒酵母seb10菌株中, 在含有诺尔斯菌素的2%ypd平板中筛选菌落形态完好的阳性转化子;
52.(2)粗提酿酒酵母转化子基因组dna:将可能的阳性转化子用牙签挑取至 95μl 1%sds(十二烷基磺酸钠)中,并加入4μl 4m醋酸锂溶液,之后操作步 骤按照公开在2015年robert mans等人报道的一篇文献中,该文献名称为: crispr/cas9:a molecular swiss army knife for simultaneous introduction ofmultiple genetic modifications in saccharomyces cerevisiae;公开的刊物为:femsyeast research(欧洲微生物学联合会酵母研究杂志)2015,15(2):1-15。
53.(3)通过菌落pcr验证筛选出菌株seb10-cas9:从步骤(2)中得到的转 化子基因组dna为模板,cas9-dg-f:tcacccttacgttgtttgaa(seq id no. 2)和cas9-dg-r:aggggacgttatcactcttc(seq id no.3)为引物,进 行pcr扩增,出现753bp的电泳条带则为阳性转化子。将验证的阳性转化子命 名为seb10-cas9;
54.(4)设计识别fps1基因上游的grna片段以及重组修复dna片段并合成 双链:利用在线工具e-crisp design设计grna靶序列(参考网址 http://www.e-crisp.org/e-crisp/),以酿酒酵母r64-1-1为基准,上传fps1基因 上游1000bp序列,获得识别fpsl基因上游的grna序列,命名为 upfps1-grna-3:gcaattcagtagttaaaagc(seq id no.4)。然后以 seb10基因组dna为模板,以pfps1-tdh3-f: ttccatcgcaagaaaaaggcagcaacggactgaggaacggcagttcgag tttatcattatcaatactg(seq d no.5)和pfps1-tdh3-r:tggacagaaagtcgtttag
agctttttgaggattactcattgtttatgtgt gtttattcgaaacta(seq id no.6)为引物,进行pcr扩增。pcr产物进 行凝胶电泳,出现753bp的电泳条带p
fps1-p
tdh3
则为修复片段。
55.(5)构建识别fps1基因上游的grna质粒:以pmel13质粒(seq id no.7) 为模板,利用5’端经过磷酸化的引物grna-r:
56.gatcatttatctttcactgcggagaag(seq id no.8)和
57.upfps1-grna-3-f:gcaattcagtagttaaaagcgttttagagctagaa (seq id no.9),扩增含grna的线性质粒,回收线性质粒骨架。将回收的线 性质粒用于做大肠杆菌转化实验,该转化方法为本领域常规技术手段,因此在此 不再赘述。将转化的菌落在含有卡那霉素的lb培养基上生长,提取转化子质粒。 对质粒进行测序,确认正确的转化子。提取出的质粒命名为
58.pmel 13-upfps1-grna-3。
59.(6)利用crispr/cas9系统高表达fps1基因:通过替换fps1的启动子, 从而提高fps1基因的表达量,将fps1启动子p
fps1
替换为p
tdh3
。将上述质粒 pmel13-upfps1-grna-3以及重组修复片段p
fps1-p
tdh3
通过醋酸锂转化法转化 到酿酒酵母seb10-cas9菌株中,在含有g418以及诺尔斯菌素的2%ypd平板 中筛选菌落形态完好的转化子。
60.(7)筛选fps1突变菌株:以上述步骤中提取的转化子基因组dna为模板, 以dg-pfps1-f:agcaacggactgaggaacgg(seq id no.10)和 dg-pfps1-r:gctttttgaggattactcatgtct(seq id no.11)为引物, 进行pcr扩增,获得的基因片段用upfps1-cx-f:atgctgttattgctttctcc (seq id no.12)为引物进行测序,与设计的p
fps1-p
tdh3
序列进行比对,以筛 选正确的转化子;
61.(8)脱除cas9-nat质粒以及pmel13-m-hxt3-grna质粒:针对上述步 骤的阳性转化子,在营养丰富的ypd培养基中过夜培养,涂布于ypd平板上。 之后挑取单菌落分别于ypd平板、ypd/g418平板和ypd/nat平板上,于30℃ 静置培养,选取在ypd上生长,而不在含有抗性平板上生长的菌落再次重复这 样的筛选,最终得到的菌株即为不含cas9-nat质粒以及grna质粒的菌株。
62.(9)试管发酵筛选具有高木糖消耗率的菌株:从上述步骤中得到的菌株于35℃,140rpm条件下,利用ypdx(10g/l酵母浸出粉、20g/l蛋白胨、45g/l d-木糖,58g/l葡萄糖)进行试管发酵,根据发酵结果筛选出一株高木糖消耗菌 株,命名为seb10-ftd13。
63.(10)将cas9-nat质粒导入酿酒酵母seb10-ftd13:借鉴步骤(1)、(2) 和(3),得到的菌株命名为seb10-ftd13-cas9。
64.(11)设计识别sor1/sor2基因编码区的grna片段以及重组修复dna 片段的扩增:利用在线grna靶序列设计工具crispy
65.(http://staff.biosustain.dtu.dk/laeb/crispy_yeast/)设计一个grna靶位点同时敲除 这两个基因,这个片段命名为sor-grna:agagtgtacaccgactgata(seqid no.13)。以seb10基因组dna为模板,以sor-ctxyl1-f: ggaaaaaagaaacatcaaacaatcaacaagaaaaaatactaaaaaaaa aaattgaaaaattcaatcaatgaatcgaaaat(seq id no.14)和 sor-ctxyl1-r: actgcttttgaattggtctatatatatggacatgaaccagtgccgaaaagt attcacttttcagttcgagtttatcattat(seq id no.15)为引物,进行 pcr扩增,获得相应基因的重组修复dna片段sor-ctxyl1(1932bp)。
66.(12)构建识别sor1/sor2基因的grna质粒:以pmel13质粒(seq idno.7)为模板,利用5’端经过磷酸化的引物grna-r: gatcatttatctttcactgcggagaag(seq id no.16)和sor-grna-f: agagtgtacaccgactgatagttttagagctagaa(seq id no.17),扩 增含grna的线性质粒pmel13-sor-grna。其余方法与步骤(5)相同。
67.(13)利用crispr/cas9系统在sor1/sor2高表达ctxyl1基因:通过在 两个位点额外增加ctxyl1基因的拷贝数,从而提高ctxyl1基因的表达量。将 现有质粒pmel13-sor-grna以及重组修复片段sor-ctxyl1通过醋酸锂转化 法转化到酿酒酵母seb10-ftd13-cas9菌株中,在含有g418以及诺尔斯菌素的 2%ypd平板中筛选菌落形态完好的转化子。
68.(14)筛选在sor1/sor2高表达ctxyl1基因的转化子:以上述步骤中提 取的转化子基因组dna为模板,以转化子基因组dna为模板,以 sor-ctxyl1-dg-f:gctcaatgtcttaccgttcatctt(seq id no.18)和sor-ctxyl1-dg-r:ttcggtgttattttcaagtattactgc(seq id no.19) 为引物,进行pcr扩增并进行测序以验证转化子。
69.(15)脱除cas9-nat质粒以及pmel13-sor-grna质粒参照步骤(8)。
70.(16)试管发酵筛选具有高木糖消耗率的菌株参照步骤(9),根据发酵结 果筛选出一株高木糖消耗菌株seb10-ftx1,命名为seb20。
71.验证实施例
72.本实施例对实施例1提供的酿酒酵母菌株进行实际物料预糖化同步糖化发 酵评价,具体的实验步骤和结果如下:
73.实验
74.为了评价构建的酿酒酵母菌株,应用秸秆纤维素物料预糖化物料进行同步糖 化发酵。用于发酵的秸秆预处理物料固含量20%,水解后葡萄糖与木糖质量比为 2:1,乙酸和甲酸的浓度分别为1.95g/kg湿物料和0.9g/kg湿物料。将预处理物 料分装于300ml锥形瓶中,每瓶含物料100g,于50℃,200rpm的条件下预糖 化8h后,接入0.2g细胞,于200rpm,35℃条件下进行同步糖化发酵。
75.发酵参数的测定:评价菌株生长情况是在紫外分光光度计600nm处测吸光 度值记为od600;通过气象色谱仪gc(353b)(gl science inc.公司)测出乙 醇含量,通过hplc(shimadzu)液相色谱仪测出葡萄糖、木糖、木糖醇、甲 酸、乙酸的含量。
76.结果
77.1.根据图1和下表1结果可知,将基因fps1的启动子替换成p
tdh3
启动子 时,四个转化子seb10-ftd1、seb10-ftd13、seb10-ftd18、seb10-ftd25 的木糖消耗均优于出发菌株seb10,相应木糖醇生成速率也均提高,乙醇产量和 生长量和出发菌株则类似。其中seb10-ftd13最优秀,其木糖消耗速率提升了 32.6%,木糖醇生成速率提高了29.5%。
78.表1试管发酵评价高表达fps1转化子的性能的结果
[0079][0080][0081]
2.根据图2和下表2的结果可知,试管发酵条件下,其中seb20木糖代谢 性能最佳,其木糖消耗速率相比seb10-ftd13加快了32.8%,木糖醇产量提高 了23.1%,乙醇产量仅少量下降;而与seb10相比,木糖消耗速率加快了73.5%, 木糖醇产量提高了27.0%。
[0082]
表2试管发酵评价sor1/sor2位点高表达ctxyl1菌株性能的结果
[0083][0084]
3.根据图3可知,以糖化结束后木糖含量55.51g/l计算木糖消耗速率以及 木糖醇收率。发酵48h葡萄糖几乎完全消耗殆尽,seb20木糖发酵性能最佳, 木糖消耗速率0.743g/l/h,比出发菌株seb10提升24.1%;木糖醇生产能力最佳 (木糖醇积累57.53g/l,木糖醇生产速率0.799g/l/h,木糖醇收率1.00g/g), 木糖醇产量比出发菌株seb10提升了42.9%;葡萄糖的初始浓度112.76g/l,乙 醇积累量为48.5g/l,乙醇生产速率为0.674g/l/h,乙醇收率比出发菌株seb10 提升5.0%,基于初始葡萄糖的乙醇收率为84.3%。由表3可知,大多数生物发 酵法联产乙醇和木糖醇用的都是马克思克鲁维酵母,但其乙醇产量和木糖醇产量 均较低,利用基因工程改造的酿酒酵母同时生产木糖醇和乙醇前景广泛切实可 行。
[0085]
表3生物发酵法联产木糖醇和乙醇的相关研究结果
[0086]
[0087][0088]
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不 限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行等 同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明精神和范围下所 作的均等变换和修改,都应涵盖在本发明的范围内。
[0089]
参考文献
[0090]
[1]du c,li y,zong h,et al.production of bioethanol and xylitol from non-detoxified corn cob via a two-stage fermentation strategy[j].bioresource technology,2020,310∶123427.
[0091]
[2]zahed o,jouzani g s,abbasalizadeh s,et al.continuous co-production of ethanol and xylitol from rice straw hydrolysate in a membrane bioreactor[j]folia microbiologica,2016,61(3):1-11.
[0092]
[3]洪泂,张标,张佳.木糖醇和乙醇同时高温高产工程菌株的构建及应用: cn105062907a[p].2015.
[0093]
[4]袁文杰,杜聪,李益民.一种利用未脱毒纤维素原料生产木糖醇和乙醇的发酵方法: cn111118071a[p].2020.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
