1.本发明涉及有机合成领域,具体是一种多取代苯乙酸衍生物的制备方法。
背景技术:
2.吗啡类药物在临床上主要用于由严重创伤、烧伤、骨折、癌症等导致的中度、重度疼痛和姑息治疗,还可以作为戒断阿片类毒品和酒精的成瘾性治疗药物,是世界卫生组织认定的基本药物品种,在药物市场上具有不可替代的作用和极其重要的临床价值,市场需求呈现出快速增长趋势(world health organization,“18th who essential medicines list”(geneva, switzerland,2013);seya,m.j.;gelders,s.f.;achara,o.u.;milani,b.;scholten,w.k.;painpalliat,j.care pharmacother.2011,25,6)。
3.目前,工业上主要是通过农业种植罂粟来提取吗啡和蒂巴因及其类似物,然后再由吗啡和蒂巴因及其类似物通过半合成的方式来生产吗啡类衍生药物。2020年和2021年,四川大学秦勇课题组基于生源合成途径,从多取代苯乙酸出发,发展了一种基于全合成的方法来工业化生产吗啡类药物的新方法(ccs chem.2021,3,1376
–
1383;pct/cn2021123641; pct/cn2021123651;中国发明专利申请号:202110064494.x;中国发明专利申请号: 202011504911.x)。在其所发展方法中,多取代苯乙酸i的制备是从苯甲醛a出发,在 ph3p
ch2omecl-作用下,发生wittig反应。所得化合物b随后在盐酸/丙酮中经水解反应实现烯烃羰基化,转化为苯乙醛衍生物c。醛c通过pinnick氧化反应,最终以三步42%的收率得到吗啡类药物的重要合成前体i。该方法虽然各中间体不需进一步纯化即可直接用于下一步反应,但由于wittig反应试剂用量较大(3当量),会产生大量难以除去的三苯氧磷固废;同时,pinnick氧化反应需要用到昂贵的2-甲基-2-丁烯和在后处理中对反应体系的ph值控制要求较高,且三步总收率仅42%。可见,作为吗啡类药物的重要合成原料,若能进一步简化操作、提高反应总收率,有助于进一步降低生产成本,使其更符合工业化生产的要求。
[0004][0005]
秦勇小组报道的多取代苯乙酸的制备方法
[0006]
ross,stephen t.小组于1987年率先报道了从多取代苯乙腈f出发,在浓硫酸和醋酸作用下,可以84%的收率经水解制备化合物i(j.med.chem.1987,30,35-40)。1999年,orito, kazuhiko小组从多取代苯甲醛a出发,经硼氢化钠还原羰基(化合物d)、氯化亚砜作用下的卤代(化合物e)、氰化钠作用下的氰基化(化合物f)和浓硫酸作用下的酸水解等四步反应,以82%的收率实现了多取代苯乙酸i的制备(j.org.chem.1999,64,6583-6596)。2010 年和2012年,lavoie,edmond j.小组对orito,kazuhiko小组的合成策略进行了改进,分别用盐酸和氰化钾替代了原策略中的卤代试剂氯化亚砜和氰基化试剂氰化钠,最终从多取代苯乙醇d出发,以三步79%的收率完成了化合物i的制备(pct int.appl.,2010127307;
bioorg.med. chem.lett.2012,22,6962-6966)。
[0007][0008]
ross,s.t.小组、orito,k.小组和lavoie,e.j.小组报道的多取代苯乙酸的制备方法
[0009]
由前述可见,化合物的i的制备关键在于氰基中间体f的制备。而目前报道的方法中,中间体f都是在氰化钠或氰化钾的作用下,从化合物e经氰基化反应转化而来。而氰化钠或氰化钾作为列入危险化学品名录中严格监督管理的限用的剧毒化学品,易致人中毒或者死亡,对人体、环境具有极大的毒害性和极度危险性,在工业生产中难以大量使用。
[0010]
因此,目前亟需一种合成效率高、操作简单、反应物料安全低毒、可规模化放大的多取代苯乙酸的合成方法。
技术实现要素:
[0011]
本发明的目的在于克服现有技术中多取代苯乙酸衍生物制备方法成本高、反应物料毒性大、不利于工业生产的现实问题,提供了一种多取代苯乙酸衍生物的制备方法,显著提高了终产物收率,降低了生产成本,且反应操作简单,使用物料安全。
[0012]
本发明的目的是通过以下技术方案来实现的:
[0013]
一种多取代苯乙酸衍生物的制备方法,包括以下步骤:
[0014]
(1)
[0015]
提供化合物3,所述化合物3在碱性条件下发生氰基化反应,生成化合物4;其中,所述氰基化反应的氰基化试剂为三甲基硅氰;
[0016]
(2)
[0017]
所述化合物4在碱性条件下发生水解反应,生成化合物5,所述化合物5即为所述多取代苯乙酸衍生物;
[0018]
上述式中,r1为羟基保护基或氢原子,r2为羟基保护基,x1为卤原子,x2为卤原子。
[0019]
在某些实施例中,所述羟基保护基为甲基或亚甲基,且r1和r2可以为同一个亚甲基。
[0020]
优选的,所述羟基保护基为甲基或亚甲基,且r1和r2可以为同一个亚甲基。
[0021]
在某些实施例中,所述卤原子为氯、溴和碘中的一种。
[0022]
在某些实施例中,步骤(1)中,所述化合物3和所述氰基化试剂的摩尔比为1:1~3;
[0023]
和/或,步骤(1)中,所述氰基化反应的碱选自碳酸钾、碳酸钠、碳酸氢钾、碳酸氢钠、磷酸钾、磷酸氢钾、氢化钠和氢化钾中的一种;
[0024]
和/或,步骤(1)中,所述氰基化反应的反应溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲亚砜、四氢呋喃、乙腈和n-甲基吡咯烷酮中的一种;
[0025]
和/或,步骤(1)中,所述氰基化反应的反应温度为0~120℃。
[0026]
在某些实施例中,步骤(2)中,所述水解反应中的碱选自氢氧化钠、氢氧化钾、氢氧化锂中的一种;所述水解反应中化合物4与碱的摩尔比为1:1~5;
[0027]
和/或,步骤(2)中,所述水解反应的反应溶剂选自乙醇、甲醇、四氢呋喃、水中的一种或两种;
[0028]
和/或,步骤(2)中,所述水解反应的反应温度为50~130℃。
[0029]
在某些实施例中,所述化合物3的合成路线如下:
[0030][0031]
提供化合物2,所述化合物2发生卤代反应,生成化合物3。
[0032]
在某些实施例中,所述卤代反应的卤代试剂选自氯化亚砜、盐酸、三氯化磷和三溴化磷中的一种;所述化合物2和卤代试剂的摩尔比为1:1~3;
[0033]
和/或,所述卤代反应的反应溶剂选自甲苯、苯、二氯甲烷和氯仿中的一种;
[0034]
和/或,所述卤代反应的反应温度为0~80℃。
[0035]
在某些实施例中,所述化合物2的合成路线如下:
[0036][0037]
提供化合物1,所述化合物1发生羰基还原反应,生成化合物2。
[0038]
在某些实施例中,所述羰基还原反应的还原试剂选自硼氢化钠、硼氢化锂的一种;所述化合物1和还原剂的摩尔比为1:0.1~0.6;
[0039]
和/或,所述羰基还原反应的还原试剂选自硼氢化钠、硼氢化锂的一种;
[0040]
和/或,所述羰基还原反应的反应溶剂选自甲醇、乙醇、乙腈和四氢呋喃中的一种或两种;
[0041]
和/或,所述羰基还原反应的反应温度为-10~40℃。
[0042]
上述多取代苯乙酸衍生物作为吗啡及其衍生药物的合成前体的应用。应当理解的是,所述吗啡类药物包括可待因、羟考酮、氢可酮、丁丙诺非、二氢埃托啡、纳洛酮、纳曲酮和纳布芬等。
[0043]
进一步指出,当上述多取代苯乙酸衍生物作为吗啡及其衍生药物的合成前体的应
用时,其中的r1为甲基或氢原子,r2为甲基。
[0044]
本发明提供还提供一种中间体,结构式如下:
[0045][0046]
式中,r为二级胺保护基。本发明使用的二级胺保护基主要是基于官能团的兼容性、避免副反应而选择的,例如避免在后续的氧化去芳构化heck反应、环化反应等过程中引起不必要的副反应。
[0047]
在某些实施例中,所述二级胺保护基优选自苯磺酰基、对甲苯磺酰基、对硝基苯磺酰基、甲基、甲酸甲酯基、叔丁氧羰基、苄基、苄氧羰基、三氟磺酰基、甲磺酰基和三甲基苯磺酰基中的一种。
[0048]
本发明还提供一种上述的中间体的方法,包括以下步骤:
[0049]
s1.
[0050]
提供化合物18,经脱除羟基保护基r1反应,生成化合物19;式中,所述r1为羟基保护基ⅰ;
[0051]
s2.
[0052]
所述化合物19经还原反应,生成化合物20;
[0053]
s3.
[0054]
所述化合物20经环化反应,生成中间体ⅰ。
[0055]
在某些实施例中,s1中,所述羟基保护基ⅰ选自对甲氧基苄基、苄基、乙酰基、苄氧羰基、甲氧基亚甲基、甲基、三异丙基硅醚基、三乙基硅醚基和叔丁基二苯基硅基中的一种。
本发明羟基保护基ⅰ同样是基于官能团的兼容性、避免副反应而选择的。
[0056]
在某些实施例中,s1中,所述脱除羟基保护基r1所采用的脱除试剂选自硫氢化钠、硫化钠、乙硫醇钠、苯硫酚、对甲苯硫酚钠、氟化钾、四丁基氟化铵、乙酸、三氟乙酸、氢溴酸、三甲基碘硅烷、三氯化铈、硝酸铈铵、樟脑磺酸、对甲苯磺酸、三氯氧磷、2,3-二氯-5,6
‑ꢀ
二氰基-1,4-苯醌和盐酸中的一种;本发明脱除羟基保护基r1所采用的脱除试剂的主要是基于不同的脱除羟基保护基r1而选择。例如本领域技术人员常使用硫氢化钠、硫化钠、乙硫醇钠、苯硫酚、对甲苯硫酚钠等脱除甲基;本领域技术人员常使用氟化钾、四丁基氟化铵来脱除硅保护基等,均是本领域常见的脱除方法。
[0057]
和/或,s1中,所述脱除羟基保护基r1所采用的反应溶剂选自n,n-二甲基乙酰胺、氮甲基吡咯烷酮、甲醇、n,n-二甲基甲酰胺、乙腈、四氢呋喃、二氯甲烷、1,2-二氯乙烷和乙酸中的一种;本发明脱除羟基保护基r1所采用的反应溶剂同样主要是基于利于减少副反应、或节约能耗、或利于反应正向进行等原因,以及针对不同的脱除羟基保护基r1、脱除试剂的适应性而选择的,均为本领域常见的反应溶剂。
[0058]
和/或,s1中,所述脱除羟基保护基的反应温度为-50~150℃。本发明脱除羟基保护基 r1所使用的温度可根据所述脱除羟基保护基r1所采用的反应溶剂、脱除试剂等条件具体选择,或是基于提高产率,加快反应速度,减少副反应等原因进行合理选择;如当脱除试剂为氢溴酸,反应溶剂为n,n-二甲基甲酰胺时的温度可以选择为0-70℃;当脱除试剂为三氟乙酸,反应溶剂为二氯甲烷时的温度可以选择为-40~0℃。
[0059]
此外,本发明其他反应涉及到的保护基的选择、反应试剂及配比、反应条件等,本领域技术人员均可根据不同的情况进行合理选择,在此不一一阐述。
[0060]
在某些实施例中,s1中,所述化合物18和脱除试剂的摩尔比为1:3~25;
[0061]
和/或,s1中,所述脱除试剂为氢溴酸,三氟乙酸或硫氢化钠;
[0062]
和/或,s1中,所述反应溶剂为二氯甲烷,n,n-二甲基甲酰胺或n,n-二甲基乙酰胺;
[0063]
和/或,s1中,所述脱除羟基保护基r1的反应温度为-40~150℃。
[0064]
在某些实施例中,s2中,所述还原反应的还原剂选自硼氢化钠、硼氢化锂、四氢铝锂和三叔丁基四氢铝锂中的一种;
[0065]
和/或,s2中,所述还原反应的反应溶剂选自甲醇、乙醇、四氢呋喃和二氯甲烷中的一种或两种;
[0066]
和/或,s2中,所述还原反应的反应温度为-10~40℃。
[0067]
在某些实施例中,s2中,所述化合物19和还原剂的摩尔比为1:1.8~3;
[0068]
和/或,s2中,所述还原剂为硼氢化钠;
[0069]
和/或,s2中,所述反应溶剂为甲醇和二氯甲烷;
[0070]
和/或,s2中,所述还原反应的温度为0~25℃。
[0071]
在某些实施例中,s3中,所述环化反应的反应溶剂选自n,n-二甲基甲酰胺、n,n-二甲基甲酰胺二甲基缩醛、乙腈、四氢呋喃、二氯甲烷和1,4-二氧六环中的一种;
[0072]
s3中,所述环化反应的环化试剂选自n,n-二甲基甲酰胺二新戊基乙缩醛、n,n-二甲基甲酰胺二甲基缩醛、n,n-二甲基甲酰胺二乙基缩醛、n,n-二甲基甲酰胺二异丙基缩醛的一种;
[0073]
和/或,s3中,所述环化反应的反应温度为0~130℃。
[0074]
在某些实施例中,s3中,所述化合物20和环化试剂的摩尔比为1:2~12;
[0075]
和/或,s3中,所述环化试剂为n,n-二甲基甲酰胺二甲基缩醛;
[0076]
和/或,s3中,所述反应溶剂为四氢呋喃、1,4-二氧六环或n,n-二甲基甲酰胺二甲基缩醛;使用n,n-二甲基甲酰胺二甲基缩醛会加快反应速度。
[0077]
和/或,s3中,所述环化反应的反应温度为50~130℃。
[0078]
在某些实施例中,所述化合物18的合成路线如下:
[0079][0080]
式中,r2为羟基保护基ⅱ,x为卤原子,r
11
为羟基保护基ⅰ或氢原子,r1为羟基保护基ⅰ;
[0081]
当r
11
为羟基保护基ⅰ时,包括以下步骤:
[0082]
1)提供化合物15;
[0083]
2)将所述化合物15经脱除羟基保护基ⅱ生成化合物17;
[0084]
3)所述化合物17经分子内氧化去芳香化heck反应,生成所述化合物18;
[0085]
当r
11
为氢原子时,所述化合物15引入羟基保护基ⅰ后再进行步骤2)和步骤3)。
[0086]
在某些实施例中,所述羟基保护基ⅱ选自对甲氧基苄基、苄基、乙酰基、苯甲酰基、特戊酰基、叔丁基二甲基硅基、叔丁基二苯基硅基、三异丙基硅基和三乙基硅基中的一种。
[0087]
在某些实施例中,所述卤原子选自氯原子、溴原子和碘原子中的一种。
[0088]
在某些实施例中,步骤2)中,所述脱除羟基保护基ⅱ所采用的脱除试剂选自碳酸钾、甲醇钠、氢氧化钠、氢氧化钾、三氟醋酸、盐酸、三氯化硼、醋酸、四丁基氟化铵、四乙基氟化铵、氢溴酸、氟化钾和氟化铯中的一种或两种;
[0089]
和/或,步骤2)中,所述脱除羟基保护基ⅱ所采用的反应溶剂选自甲醇、n,n-二甲基甲酰胺、乙腈、四氢呋喃、二氯甲烷和水中的一种或两种;
[0090]
和/或,步骤2)中,所述脱除羟基保护基ⅱ的反应温度为-20~90℃。
[0091]
在某些实施例中,步骤2)中,所述脱除试剂为碳酸钾;
[0092]
和/或,步骤2)中,所述反应溶剂为甲醇;
[0093]
和/或,步骤2)中,所述脱除羟基保护基ⅱ的反应温度为40~60℃。
[0094]
在某些实施例中,步骤2)中,所述脱除试剂为氟化钾;
[0095]
和/或,步骤2)中,所述反应溶剂为乙腈和水;
[0096]
和/或,步骤2)中,所述脱除羟基保护基ⅱ的反应温度为0~60℃。
[0097]
在某些实施例中,步骤3)中,所述分子内氧化去芳香化heck反应在反应试剂和碱的存在下进行。
[0098]
在某些实施例中,步骤3)中,所述反应试剂为络合物,或,配体ⅱ和过渡金属催化剂ⅱ。
[0099]
在某些实施例中,步骤3)中,所述络合物选自pd(pph3)4、pd(pph3)2cl2、pd(ptbu3)2、 pd(pcy3)2、pd(pphtbu2)2cl2、[1,2-双(二苯基膦基)乙烷]二氯化钯、[1,3-双(二
苯基磷基)丙烷] 二氯化钯和[1,4-双(二苯基膦基)丁烷]二氯化钯中的一种;
[0100]
和/或,所述化合物17、络合物和碱的摩尔比为1:0.025~0.2:1~3。
[0101]
在某些实施例中,步骤3)中,所述配体ⅱ如式(ⅱ)所示,或式(ⅱ)的立体异构体、互变异构体或式(ⅱ)对应的氢卤酸鏻盐;
[0102][0103]
式中:
[0104]
r4和r5选自金刚烷基或叔丁基的一种;
[0105]
r6选自烷基、环烷基、芳基和杂芳基中的一种,所述烷基、环烷基、芳基和杂芳基分别被一个或多个各自独立的氢原子、烷基、卤素、环烷基、芳基和杂芳基所取代;
[0106]
和/或,步骤3)中,所述过渡金属催化剂ⅱ选自[pd(cinnamy)cl]2、[pd(allyl)cl]2、pd2(dba)3、 pd(oac)2、pd(tfa)2、pd(acac)2、pd(mecn)2cl2、pd(phcn)2cl2、pdcl2、pd(cp)(allyl)、 pd(mecn)4(bf4)2、pd(mecn)4(otf)2、pd(cod)cl2、pd(norbornadiene)cl2、pd(tmeda)cl2和 pd(amphos)cl2中的一种;
[0107]
和/或,所述化合物17、配体ⅱ、过渡金属催化剂ⅱ和碱的摩尔比为 1:0.05~0.5:0.05~0.15:2~4。
[0108]
在某些实施例中,步骤3)中,优选的,所述配体ⅱ选自
[0109][0110]
或及氢卤酸鏻盐式中r6选自c
1~20
烷基或苄基, x为卤原子。
[0111]
更为优选的,步骤3)中,所述配体ⅱ选自下列化合物中的一种:
[0112][0113]
在某些实施例中,步骤3)中,所述碱选自叔丁醇钾、碳酸锂、碳酸钠、碳酸铯、碳酸银、碳酸氢钾、碳酸钾、硼氟酸钾、磷酸钾、磷酸氢二钾、叔丁醇钠、叔丁醇锂、氢化钠、氢化
钾、醋酸钠、甲醇钠、苯甲酸钠、苯甲酸钾、吡啶、三乙胺、氟化铯、氢氧化钾和特戊酸盐中的一种或两种;
[0114]
和/或,步骤3)中,所述分子内氧化去芳香化heck反应的反应溶剂选自苯甲醚、三氟甲苯、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲基亚砜、n-甲基吡咯烷酮、三甲基苯、二甲醚、乙醇、叔丁醇、甲苯、氯苯、二甲苯、1,4-二氧六环、二乙二醇二甲醚、甲基叔丁基醚、四氢呋喃和乙二醇二甲醚中的一种;
[0115]
和/或,步骤3)中,所述分子内氧化去芳香化heck反应中化合物17的浓度为0.05~2.5mol/l;
[0116]
和/或,步骤3)中,所述分子内氧化去芳香化heck反应的温度为50~160℃。
[0117]
在某些实施例中,步骤3)中,所述碱为磷酸钾和碳酸钾;
[0118]
和/或,步骤3)中,所述反应溶剂为n,n-二甲基甲酰胺、n,n-二甲基乙酰胺和苯甲醚中的一种;
[0119]
和/或,步骤3)中,所述分子内heck反应反应中化合物17浓度为0.05~1mol/l;
[0120]
和/或,步骤3)中,所述分子内heck反应的温度为60~150℃。
[0121]
在某些实施例中,所述化合物15的合成路线如下:
[0122][0123]
式中,r2为羟基保护基ⅱ,r
22
为羟基保护基ⅱ或氢原子,x为卤原子,r
11
为羟基保护基ⅰ或氢原子;
[0124]
当r
22
为羟基保护基ⅱ时,包括以下步骤:
[0125]
a、提供化合物11;
[0126]
b、将所述化合物11经bischler-napieralski反应,得到化合物13;
[0127]
c、将所述化合物13经不对称转移氢化反应,得到手性四氢异喹啉型化合物14;
[0128]
d、所述化合物14进行二级胺保护,生成化合物15;
[0129]
当r
22
为氢原子时,所述化合物11引入羟基保护基ⅱ后再进行步骤b、c和d。
[0130]
在某些实施例中,步骤b中,所述bischler-napieralski反应在缩合剂和碱的存在下进行;所述化合物11、缩合剂和碱的摩尔比为1:0.9~1.3:1.5~2.5。
[0131]
在某些实施例中,所述缩合剂选自三氯氧膦、五氧化二磷和三氟甲磺酸酐中的一种;
[0132]
和/或,步骤b中,所述碱选自2-氟吡啶、吡啶、4-二甲氨基吡啶、二甲基吡啶和三乙胺中的一种;
[0133]
和/或,步骤b中,所述bischler-napieralski反应的反应溶剂选自二氯甲烷、二氯乙烷、四氢呋喃和甲苯中的一种;
[0134]
和/或,步骤b中,所述bischler-napieralski反应的温度为-50~40℃。
[0135]
在某些实施例中,步骤b中,所述缩合剂三氟甲磺酸酐;
[0136]
和/或,步骤b中,所述碱为2-氟吡啶;
[0137]
和/或,步骤b中,所述反应溶剂为二氯甲烷;
[0138]
和/或,步骤b中,所述bischler-napieralski反应的温度为-30~35℃。
[0139]
在某些实施例中,步骤c中,所述不对称转移氢化反应在手性配体ⅰ、氢源ⅰ和金属催化剂ⅰ的存在下进行;所述化合物13、金属催化剂ⅰ、手性配体ⅰ、氢源ⅰ的摩尔比优选为1:0.001~0.01:0.002~0.02:1.2~3。
[0140]
在某些实施例中,步骤c中,所述手性配体ⅰ选自
[0141][0141]
中的一种;
[0142]
和/或,步骤c中,所述氢源ⅰ选自甲酸、甲酸铵及甲酸和三烷基胺的络合物中的一种;
[0143]
和/或,步骤c中,所述金属催化剂ⅰ选自
[0144] 中的一种;
[0145]
和/或,步骤c中,所述不对称氢化反应的反应溶剂选自二氯甲烷、二氯乙烷、氯仿、四氢呋喃、二甲醚、叔丁基甲醚、三氟乙醇、苯甲醚、n,n-二甲基甲酰胺、三氟甲苯、n,n
‑ꢀ
二甲基乙酰胺、二甲基亚砜、n-甲基吡咯烷酮、三甲基苯、乙醇、叔丁醇、甲苯、氯苯、二甲苯、1,4-二氧六环、二氯苯、六氟异丙醇、甲醇和异丙醇中的一种;
[0146]
和/或,步骤c中,所述转移氢化反应的温度为-10~40℃。
[0147]
在某些实施例中,步骤c中,所述氢源ⅰ为甲醇和三乙胺络合物;
[0148]
和/或,步骤c中,所述反应溶剂为n,n-二甲基甲酰胺;
[0149]
和/或,步骤c中,所述转移氢化反应的温度为0~35℃。
[0150]
在某些实施例中,步骤d中,所述二级胺保护在碱性条件下进行;所述碱性条件所采用的碱选自磷酸氢二钠、磷酸二氢钠、碳酸钾、碳酸钠、三乙胺、n,n-二异丙基乙胺、吡啶和4-二甲氨基吡啶中的一种。
[0151]
在某些实施例中,步骤d中,所述二级胺保护的反应温度为-10~50℃。
[0152]
在某些实施例中,所述化合物11的制备方法,包括以下步骤:提供化合物9和化合物5,经胺酸缩合反应得到化合物11ⅰ,反应式如下:
[0153][0154]
其中,r3为甲基或氢原子,x为卤原子,r
22
为氢原子或羟基保护基ⅱ。
[0155]
在某些实施例中,所述胺酸缩合反应在缩合试剂和碱的存在下进行;所述化合物9、化合物5、缩合试剂和碱的摩尔比为1~1.6:1:1~1.2:1.5~3。
[0156]
在某些实施例中,所述缩合试剂选自o-苯并三氮唑-n,n,n',n'-四甲基脲四氟硼酸、1
‑ꢀ
乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐、2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯、二环己基碳二亚胺和苯并三氮唑-1-基氧基三(二甲基氨基)磷鎓六氟磷酸盐中的一种;
[0157]
和/或,所述碱选自三乙胺、n,n-二异丙基乙胺、4-二甲氨基吡啶和吡啶中的一种;
[0158]
和/或,所述胺酸缩合反应的温度为-10~50℃。
[0159]
在某些实施例中,所述缩合试剂o-苯并三氮唑-n,n,n',n'-四甲基脲四氟硼酸;
[0160]
和/或,所述碱为三乙胺;
[0161]
和/或,所述胺酸缩合反应的温度为0~25℃。
[0162]
在某些实施例中,所述化合物11ⅰ中的r3被基保护基ⅰ取代羟得到化合物11ⅱ反应式如下:
[0163]
式中,r1为羟基保护基ⅰ,r2为羟基保护基ⅱ。需要指出的是,所述化合物11包括所述化合物11ⅰ和化合物11ⅱ的所有结构式。
[0164]
在某些实施例中,所述化合物9的制备方法,包括以下步骤:
[0165][0166]
a、提供化合物6;
[0167]
b、所述化合物6与硝基甲烷经henry反应,生成化合物7;
[0168]
c、所述化合物7经双键还原反应,生成化合物8;
[0169]
d、所述化合物8经硝基还原反应,生成化合物9ⅰ。
[0170]
在某些实施例中,步骤b中,所述化合物6与硝基甲烷在碱的催化下进行henry反应,所述碱为乙二胺、醋酸铵、氢氧化钠、哌啶、二乙胺和吗啉中的一种或多种。
[0171]
在某些实施例中,步骤c中,所述双键还原反应的还原剂选自四氢铝锂、硼氢化钠、钯碳 氢气、雷尼镍 氢气、硼氢化锂、red-al、锌粉和铁粉中的一种;本发明所述的雷尼镍 氢气是指以雷尼镍为催化剂,氢气为氢源进行氢化还原;钯碳 氢气是指以钯碳为催化剂,氢气为氢源进行氢化还原,均是本领域技术人员常用的还原剂。
[0172]
和/或,步骤c中,所述双键还原反应的反应溶剂选自乙醇、乙醚、异丙醚、甲基叔丁基醚、四氢呋喃、1,4-二氧六环、甲苯、乙二醇二甲醚和二乙二醇二甲醚中的一种;
[0173]
和/或,步骤c中,所述双键还原反应的温度为-10~10℃。
[0174]
在某些实施例中,步骤c中,所述化合物7和还原剂的摩尔比为1:1~3;
[0175]
和/或,步骤c中,所述还原剂为硼氢化钠;
[0176]
和/或,步骤c中,所述反应溶剂为乙醇和四氢呋喃;
[0177]
和/或,步骤c中,所述还原反应的温度为0℃。
[0178]
在某些实施例中,步骤d中,所述硝基还原反应的还原剂选自四氢铝锂、硼氢化钠、钯碳 氢气、雷尼镍 氢气、硼氢化锂、red-al、锌粉和铁粉中的一种;
[0179]
和/或,步骤d中,所述硝基还原反应的反应溶剂选自乙醇、乙醚、异丙醚、甲基叔丁基醚、四氢呋喃、1,4-二氧六环、甲苯、乙二醇二甲醚和二乙二醇二甲醚中的一种;
[0180]
和/或,步骤d中,所述硝基还原反应的温度为-10~80℃。
[0181]
在某些实施例中,步骤d中,所述化合物8和还原剂的摩尔比为1:1~3;
[0182]
和/或,步骤d中,所述还原剂为雷尼镍 氢气;
[0183]
和/或,步骤d中,所述反应溶剂为乙醇;
[0184]
和/或,步骤d中,所述还原反应的温度为10~80℃。
[0185]
在某些实施例中,所述化合物9i经羟基保护反应进一步生成化合物9ⅱ,反应式如下:
[0186]
其中,r2为羟基保护基ⅱ。需要指出的是,所述化合物9包括所述化合物9i和化合物9ⅱ的所有结构式。
[0187]
在某些实施例中,所述化合物9i的羟基保护反应在碱性条件下进行;所述碱性条件所采用的碱选自4-二甲氨基吡啶、氢化钠、三乙胺、吡啶和咪唑中的一种或两种;
[0188]
和/或,所述化合物9i的羟基保护反应的反应溶剂选自二氯甲烷、二氯乙烷、四氢呋喃和甲苯中的一种;
[0189]
和/或,所述化合物9i的羟基保护反应的温度为0~40℃。
[0190]
本发明的有益效果是:
[0191]
1.本发明提供的多取代苯乙酸衍生物的制备方法,使得反应底物在所设计的反应条件下能有效转化为预期产物,达到了操作简单、反应物料使用安全、成本低、总收率高的高效合成效果。
[0192]
2.本发明提供的多取代苯乙酸衍生物的制备方法所用试剂均为常用化学试剂,避
免原报道方法中价格较贵的wittig反应试剂和2-甲基-2-丁烯的使用,生产成本显著降低;在氰基化反应的过程中,不使用现有文献报道的氰化钠或氰化钾等剧毒管控试剂,操作安全,规模化生产操作性强。
[0193]
3.本发明提供的多取代苯乙酸衍生物的制备方法操作简单,所有合成中间体不需经进一步分离纯化即可直接进行后继反应,从而实现多步反应连续操作,后处理简单,4步反应连续操作总收率达72~74%。大大提高合成效率,降低三废排放,节约生产成本,适于其规模化制备。
具体实施方式
[0194]
下面进一步详细描述本发明的技术方案,但本发明的保护范围不局限于以下所述。
[0195]
实施例1化合物5的制备方法,以r1和r2为甲基,x1为溴,x2为氯为例,合成化合物 5i;
[0196]
包括以下步骤:
[0197][0198]
将化合物1i(250.0g,1.020mol,1.0equiv.)溶于meoh/thf(v/v=1:1)混合溶剂(1000 ml)中,冰浴冷却至0℃,在搅拌下向其中分批缓慢加入nabh4(15.44g,0.4080mol,0.4equiv.),加毕升至室温搅拌反应,约1小时后tlc检测原料消失完全。将反应液减压抽除溶剂,依次向其中加入ch2cl2(500ml)、水(500ml)稀释,在搅拌下加2m hcl水溶液将ph调至 4-5。水层用ch2cl2(200ml
×
3)萃取,合并有机层,经无水硫酸镁干燥,过滤,减压抽干后得到化合物2i粗品(白色固体),不经分离纯化,直接用于下一步反应。
[0199]
将上述粗品2i分散于干燥甲苯(500ml),冰浴冷却至0℃,在搅拌下向其中滴加socl
2 (182g,111ml,1.53mol,1.5equiv.),固体逐渐溶解,加毕升至室温搅拌过夜(约12小时), tlc显示原料消失完全。将反应液减压抽除溶剂,所得粗品3i不经分离直接用于下一步反应。
[0200]
将上述粗品3i溶于干燥dmf(500ml),在搅拌下于室温依次向其中加入k2co3(155.1 g,1.122mol,1.1equiv.)和tmscn(111.3g,140ml,1.122mol,1.1equiv.),加毕于室温搅拌 5分钟后加热至80℃搅拌过夜(约12小时),tlc显示原料消失完全。将反应液冷却至室温,加水稀释使碳酸钾固体溶解,用乙酸乙酯萃取(500ml
×
4),合并有机层依次用水(500ml) 和饱和氯化钠溶液(500ml)洗涤。有机层经无水硫酸镁干燥、过滤、浓缩后,得化合物4i 粗品,不经分离纯化,直接用于下一步反应。
[0201]
将上一步所得粗品4i溶于乙醇(1000ml),于室温搅拌下向其中加入4m naoh水溶液 (500ml),加热回流反应约30小时后,tlc检测原料消失完全。将反应液冷却至室温,加水(200ml)稀释,减压抽除乙醇,用ch2cl2(500ml
×
3)萃取,弃去有机层。水层冷却至0℃,在搅
拌下用浓盐酸调ph=1。继续搅拌30分钟后过滤,滤饼用冰水(100ml
×
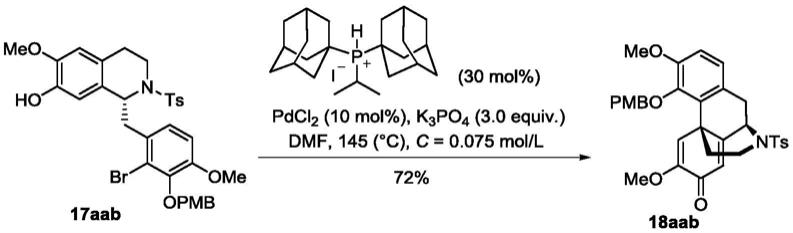
2) 洗涤。收集固体,置于烘箱80℃干燥5小时后,再真空干燥(50℃)6小时。向所得固体中加入甲苯(500ml),于室温搅拌0.5小时,过滤,收集滤饼,得到白色粉末状固体化合物 5i(即多取代苯乙酸衍生物)(202g,四步收率72%)。1h nmr(400mhz,cdcl3)δ7.01(d,j =8.4hz,1h),6.85(d,j=8.5hz,1h),3.86(d,j=4.7hz,6h),3.80(s,2h);
13
c nmr(101mhz, cdcl3)δ176.6,152.9,146.7,126.5,126.2,126.2,120.9,111.2,111.2,60.4,56.1,40.9.
[0202]
实施例2化合物5的制备方法,以r1和r2为同一个亚甲基,x1为溴,x2为氯为例,合成化合物5ii;
[0203]
包括以下步骤:
[0204][0205]
将化合物1ii(100.0g,0.4367mol,1.0equiv.)溶于meoh/thf(v/v=1:1)混合溶剂(1000 ml)中,冰浴冷却至0℃,在搅拌下向其中分批缓慢加入nabh4(6.6g,0.1746mol,0.4equiv.),加毕升至室温搅拌反应,约1小时后tlc检测原料消失完全。将反应液减压抽除溶剂,依次向其中加入ch2cl2(500ml)、水(500ml)稀释,在搅拌下加2m hcl水溶液将ph调至 4-5。分层,水层用ch2cl2(200ml
×
3)萃取,合并有机层,经无水硫酸镁干燥,过滤,减压抽干后得到化合物2ii粗品(白色固体),不经分离纯化,直接用于下一步反应。
[0206]
将上述粗品2ii分散于干燥甲苯(400ml),冰浴冷却至0℃,在搅拌下向其中滴加socl
2 (77.95g,47.5ml,0.665mol,1.5equiv.),加毕升至室温搅拌过夜(约12小时),tlc显示原料消失完全。将反应液减压抽除溶剂,所得粗品3ii不经分离直接用于下一步反应。
[0207]
将上述粗品3ii溶于干燥dmf(500ml),在搅拌下于室温依次向其中加入khco3(48.0 g,0.48mol,1.1equiv.)和tmscn(47.55g,60ml,0.48mol,1.1equiv.),加毕于室温搅拌5 分钟后加热至80℃搅拌过夜(约12小时),tlc显示原料消失完全。将反应液冷却至室温,泼入1l冰水中,充分搅拌,过滤,滤饼用水洗(300ml
×
3)。得化合物4ii粗品,不经干燥,直接用于下一步反应。
[0208]
将上一步所得粗品4ii溶于乙醇(750ml),于室温搅拌下向其中加入4m naoh水溶液 (250ml),加热回流反应约30小时后,tlc检测原料消失完全。将反应液冷却至室温,加水(200ml)稀释,减压抽除乙醇,用ch2cl2(500ml
×
3)萃取,弃去有机层。水层冷却至 0℃,在搅拌下用浓盐酸调ph=1。继续搅拌30分钟后过滤,滤饼用冰水(100ml
×
2)洗涤。收集固体,置于烘箱80℃干燥5小时,真空干燥(50℃)6小时。向所得固体中加入甲苯 (500ml),于室温搅拌0.5小时,过滤,收集滤饼,得到白色粉末状固体化合物5ii(即多取代苯乙酸衍生物)(83.7g,四步收率74%)。1h nmr(400mhz,dmso-d6)δ12.33(s,1h), 6.85(s,2h),6.10(s,2h),3.62(s,2h).
13
c nmr(100mhz,dmso)δ171.43,146.09,145.56, 128.06,124.15,106.97,102.97,101.46,39.52.
[0209]
实施例3化合物9ⅰ的制备:以r
22
为氢原子为例,合成化合物9a,合成路线为:
[0210][0211]
包括以下步骤:
[0212]
将香兰素6(200g,1.31mol,1.0equiv.)溶于ch3no2(1000ml),在搅拌下向其中加入乙二胺(1.0ml),加热至回流,tlc监测反应完全后(约2小时),将反应液冷却至室温,有大量黄色固体析出。过滤,滤饼依次用甲醇/水(v/v=1:1)(200ml
×
3)、无水乙醇(200 ml
×
2)洗,收集固体,水泵减压干燥,得化合物7(亮黄色细针状晶体,185g,产率72%)。
[0213]
将化合物7(40.0g,0.205mol,1.0equiv.)溶于thf/etoh的混合溶液(v/v=1:1,480ml),冰浴冷却至0℃,在搅拌下向其中分批缓慢加入nabh4(15.5g,0.410mol,2.0equiv.),0℃反应3小时,tlc检测原料消失完全,向其中加入醋酸水溶液(ch3cooh/h2o,v/v=1:4,250ml) 淬灭反应。减压蒸馏除去有机溶剂后,残余物以乙酸乙酯(300ml
×
3)萃取,合并有机层,无水硫酸镁干燥,过滤,浓缩,所得粗品经硅胶垫过滤(洗脱剂pe:ea=2:1,v/v)得化合物 8(黄色油状物),直接用于下一步反应。
[0214]
将化合物8溶于etoh(400ml),加入raney-ni(约4.0g),置于高压氢化釜中,在 10atm氢气压力下,于室温反应10小时,tlc检测原料消失完全。反应液中析出大量固体,加入meoh(300ml),将混合物加热至70℃使固体溶解后,趁热经硅藻土过滤,滤饼用meoh洗(100ml
×
3)。滤液减压浓缩至溶剂量剩余约200ml,此时已有大量固体析出。置于室温冷却3小时,过滤,收集滤饼,水泵真空干燥(40℃)1小时,再于室温经油泵真空干燥约0.5小时,得棕黄色固体化合物9a(22.2g,两步收率55%)。m.p.:139
–
141℃.1h nmr(400mhz,cdcl3)δ6.84(d,j=8.4hz,1h),6.72
–
6.67(m,2h),3.87(s,3h),2.94(t,j= 6.8hz,2h),2.68(t,j=6.8hz,2h).
13
c nmr(100mhz,cdcl3)δ146.5,144.0,131.6,121.4, 114.4,111.3,55.9,43.6,39.6.ir(neat):ν
max
=2512,1610,1496,1469,1232,1153,1128,1033, 812cm-1
.hrms(m/z):[m h]
calculated for c9h
14
no
2
,168.1019;found,168.1025.
[0215]
实施例4化合物9ⅱ的制备,以r
22
为tbdps为例,合成化合物9b,合成路线为:
[0216][0217]
将化合物9a(20.0g,0.120mol,1.0equiv.)、咪唑(12.2g,0.179mol,1.5equiv.)溶于干燥 ch2cl2(250ml)中,室温搅拌10分钟后,加入tbdpscl(34.5g,0.125mol,1.05equiv.)。室温反应5小时后,tlc检测反应完全。向其中加入饱和nh4cl水溶液(300ml)淬灭反应,所得混合物经硅藻土过滤,滤液分层,水层以ch2cl2萃取(100ml
×
2),合并有机层,用饱和nacl水溶液洗(100ml
×
2),无水硫酸镁干燥,过滤,减压浓缩滤液,所得粗品经硅
胶柱层析纯化(二氯甲烷/甲醇=6:1,v/v,含0.5%氨水),得油状化合物9b(41.3g,收率 85%)。1h nmr(400mhz,cdcl3)δ7.72
–
7.70(m,4h),7.41
–
7.32(m,6h),6.64(d,j=8.0hz, 1h),6.59(s,1h),6.47(dd,j=8.0,1.6hz,1h),3.55(s,3h),2.88(t,j=6.8hz,2h),2.62(t,j= 6.8hz,2h),1.11(s,9h).
13
c nmr(100mhz,cdcl3)δ150.4,143.5,135.4,134.8,133.6,132.5, 129.5,127.6,127.4,120.6,120.0,113.0,55.4,43.2,38.9,26.7,19.7.ir(neat):ν
max
=3053,2933, 2858,1587,1513,1264cm-1
.hrms(m/z):[m h]
calculated for c
25h32
no2si
,406.2197;found,406.2190.
[0218]
实施例5化合物9ⅱ的制备,以r
22
为tbs为例,合成化合物9c,合成路线为:
[0219][0220]
合成路线参考实施例4,区别在于实施例5的加入的是tbscl,得到油状化合物9c。1h nmr(400mhz,cdcl3)δ6.77(d,j=8.0hz,1h),6.68
–
6.63(m,2h),3.79(s,3h),2.93(t,j= 6.8hz,2h),2.67(t,j=6.8hz,2h),1.30(s,2h),0.99(s,9h),0.14(s,6h).
13
c nmr(100mhz, cdcl3)δ150.8,143.3,133.2,120.9,120.7,112.8,55.5,43.6,39.7,25.7,18.4,
–
4.66.ir(neat): ν
max
=2929,2856,1578,1463,1275,1156,1126,1034,838cm-1
.hrms(m/z):[m h]
calculated for c
15h28
no2si
,282.1884;found,282.1881.
[0221]
实施例6化合物11的制备,以r
22
为tbdps、x为溴、r
11
为氢原子为例,合成化合物 11a,合成路线为:
[0222][0223]
包括以下步骤:
[0224]
将化合物9b(51.3g,0.126mol,1.1equiv.)、化合物5a(30.0g,0.115mol,1.0equiv.)和 tbtu(44.3g,0.138mol,1.2equiv.)溶于干燥ch2cl2(300ml)中。冰浴下加入三乙胺(40.0 ml,0.287mol,2.5equiv.),随后升至室温反应4小时,tlc检测原料完全消失,加入饱和氯化铵水溶液(300ml)淬灭反应。分出有机层,水层用ch2cl2萃取(400ml
×
1),合并有机层,依次用水(200ml
×
1)、饱和氯化钠溶液(100ml
×
1)洗,无水硫酸镁干燥、过滤,减压浓缩。所得粗品用乙酸乙酯(300ml)溶解,依次用0.1m hcl(100ml
×
2)、饱和nahco3(100ml
×
2)、水(100ml
×
1)、饱和氯化钠溶液(100ml
×
1)洗。经无水硫酸钠干燥、过滤、浓缩。所得粗品经硅胶柱层析纯化(石油醚/丙酮=4:1,v/v),得白色泡沫状固体11a(67.1g,产率90%)。1h nmr(400mhz,cdcl3)δ7.71
–
7.68(m,4h), 7.42
–
7.32(m,6h),6.71(q,j=8.0hz,2h),6.56(d,j=8.0hz,1h),6.49(d,j=2.0hz,1h), 6.29(dd,j=8.0,2.0hz,1h),6.01(s,1h),5.35(t,j=4.0hz,1h),3.84(s,3h),3.59(s,2h),3.50 (s,3h),3.38(q,j=6.0hz,2h),2.59(t,j=6.9hz,2h),1.10(s,9h).
13
c nmr(100mhz,cdcl3) δ170.0,150.6,146.5,143.7,135.5,133.8,132.0,129.7,127.8,127.6,122.1,120.7,120.1,112.9, 111.3,109.9,56.5,55.5,43.7,40.8,35.2,26.8,19.9.ir(neat):ν
max
=3297,3050,2932,2857,
1650, 1605,1512,1488,1111,1034,700cm-1
.hrms(m/z):[m h]
calculated for c
34h3979
brno5si
, 648.1775;found,648.1778;c
34h3981
brno5si
,650.1755;found,650.1763.
[0225]
实施例7化合物11的制备,以r
22
为tbdps、x为溴、r
11
为me为例,合成化合物11b,合成路线为:
[0226][0227]
将化合物9b(64.9g,0.160mol,1.1equiv.)、化合物5b(40.0g,0.145mol,1.0equiv.)和 tbtu(55.9g,0.174mol,1.2equiv.)溶于干燥ch2cl2(400ml)中。冰浴下加入三乙胺(50.6 ml,0.364mol,2.5equiv.),随后升至室温反应,tlc检测原料完全消失,加入饱和氯化铵水溶液(400ml)淬灭反应。分出有机层,水层用ch2cl2萃取(500ml
×
1),合并有机层,依次用水(300ml
×
1)、饱和氯化钠溶液(200ml
×
1)洗,无水硫酸镁干燥、过滤,减压浓缩。所得粗品用乙酸乙酯(400ml)溶解,依次用0.1m hcl(150ml
×
2)、饱和 nahco3(150ml
×
2)、水(150ml
×
1)、饱和氯化钠溶液(150ml
×
1)洗。经无水硫酸钠干燥、过滤、浓缩。所得粗品经硅胶柱层析纯化(石油醚/丙酮=4:1,v/v),得白色泡沫状固体11b(87.7g,产率91%)。1h nmr(400mhz,cdcl3)δ7.70
–
7.68(m,4h),7.43
ꢀ–
7.37(m,2h),7.37
–
7.30(m,4h),6.93(d,j=8.0hz,1h),6.76(d,j=8.0hz,1h),6.57(d,j= 8.0hz,1h),6.51(d,j=1.8hz,1h),6.31(dd,j=8.0,1.6hz,1h),5.38(t,j=4.8hz,1h),3.820 (s,3h,overlapped),3.818(s,3h,overlapped),3.59(s,2h),3.51(s,3h),3.39(q,j=6.0hz,2h), 2.60(t,j=6.8hz,2h),1.10(s,9h).
13
c nmr(100mhz,cdcl3)δ169.8,152.8,150.5,146.8, 143.6,135.3,133.6,131.8,129.6,127.6,127.4,126.3,120.7,120.5,120.0,112.7,111.5,60.4,56.0, 55.3,43.6,40.7,35.1,26.6,19.7.ir(neat):ν
max
=3311,3052,2934,2858,1663,1512,1486,1265, 1034,733,701cm-1
.hrms(m/z):[m h]
calculated for c
35h41
79brno5si
,662.1932; found,662.1930;c
35h4181
brno5si
,664.1911;found,664.1922.
[0228]
实施例8化合物11的制备,以r
22
为氢原子、x为溴、r
11
为me为例,合成化合物11c,合成路线为:
[0229][0230]
将化合物9a(2.00g,0.012mol,1.1equiv.)、化合物5b(3.00g,0.011mol,1.0equiv.)和 tbtu(4.24g,0.013mol,1.2equiv.)溶于干燥ch2cl2(30ml)中。冰浴下加入三乙胺(3.8 ml,0.027mol,2.5equiv.),随后升至室温反应13小时,tlc检测原料完全消失,加入饱和氯化铵水溶液(30ml)淬灭反应。分出有机层,水层用ch2cl2萃取(20ml
×
3),合并有机层,依次用1m hcl(50ml
×
2)、饱和nahco3(50ml
×
1)、饱和氯化钠溶液(50 ml
×
1)洗。无水硫酸镁干燥、过滤,减压浓缩。所得粗品经硅胶柱层析纯化(石油醚/丙酮=3:1,v/v),得白
色泡沫状固体11c(3.5g,产率75%)。1h nmr(400mhz,cdcl3)δ6.96
ꢀ–
6.50(m,5h),5.83(s,1h),5.52(s,1h),3.85(s,6h,overlapped),3.82
–
3.81(m,3h),3.60(m, 2h),3.45
–
3.40(m,2h),2.67
–
2.64(m,2h).
13
c nmrδ169.9,152.8,146.7,146.6,144.2,130.3, 127.5,126.3,121.2,120.7,114.3,111.5,111.0,60.4,56.0,55.8,43.6,40.7,35.1.ir(neat):ν
max
=3307,1650,1598,1523,1488,1271,1031cm-1
.hrms(m/z):[m h]
calculated for c
19h2379
brno
5
,424.0754;found,424.0748;c
19h2381
brno
5
,426.0734;found,426.0731.
[0231]
实施例9化合物11的制备,以r
22
为tbs、x为溴、r
11
为氢原子为例,合成化合物11d,合成路线为:
[0232][0233]
化合物11d的合成路线如上所示,合成操作参照实施例6的方法。1h nmr(400mhz, cdcl3)δ6.77
–
6.73(m,2h),6.67(d,j=8.0hz,1h),6.59
–
6.58(m,1h),6.48
–
6.46(m,1h), 6.09(s,1h),5.39(m,1h),3.90(s,3h),3.75(s,3h),3.62(s,2h),3.44(q,j=6.8hz,2h),2.66(t, j=6.8hz,2h),0.98(s,9h),0.13(s,6h).
13
c nmr(100mhz,cdcl3)δ169.9,150.9,146.4, 143.6,143.5,132.0,127.6,121.9,120.8,120.7,112.5,111.2,109.7,56.3,55.4,43.5,40.6,35.1, 25.7,18.4,
–
4.69.ir(neat):ν
max
=3300,2931,2855,1646,1604,1513,1488,1277,1231,1032 cm-1
.hrms(m/z):[m h]
calculated for c
24h3579
brno5si
,524.1462;found,524.1464; c
24h3579
brno5si
,526.1442;found,526.1445.
[0234]
实施例10化合物11的制备,以r
22
为tbs、x为溴、r
11
为me为例,合成化合物11e,合成路线为:
[0235][0236]
化合物11e的合成路线如上所示,合成操作参照实施例6的方法。1h nmr(400mhz, cdcl3)δ6.96(d,j=8.4hz,1h),6.81(d,j=8.4hz,1h),6.69(d,j=8.0hz,1h),6.60(d,j=2.0hz,1h),6.48(dd,j=8.0,2.0hz,1h),5.44(t,j=5.8hz,1h),3.87(s,3h),3.84(s,3h),3.75 (s,3h),3.61(s,2h),3.45(q,j=6.6hz,2h),2.67(t,j=6.8hz,2h),0.98(s,9h),0.13(s,6h). 13
c nmr(100mhz,cdcl3)δ169.9,152.8,150.9,146.8,143.5,132.0,127.5,126.3,120.8,120.7, 112.4,111.5,60.4,56.0,55.4,43.7,40.7,35.1,25.7,18.4,-4.7.ir(neat):ν
max
=3055,1669,1512, 1264,1036,731cm-1
.hrms(m/z):[m h]
calculated for c
25h3779
brno5si
,538.1619;found, 538.1622;c
25h3781
brno5si
,540.1598;found,540.1603.
[0237]
实施例11化合物12的制备。当化合物11中的r
22
为氢原子时,所述化合物11引入羟基保护基ⅱ得到化合物12。
[0238]
以r
22
为氢原子、x为溴、r
11
为me、引入的羟基保护基ⅱ为bn为例,合成化合物12ca,
合成路线为:
[0239][0240]
将化合物11c(830mg,1.96mmol,1.0equiv.),无水碳酸钾(540mg,3.92mmol,2.0equiv.) 溶解于干燥dmf(8ml)中,氩气保护,加入溴苄(0.35ml,2.94mmol,1.5equiv.),室温反应1小时。tlc显示原料反应完全,加入水淬灭,加入乙酸乙酯(10ml),析出大量固体,过滤,固体用甲基叔丁基醚(10ml
×
2)洗。收集固体,真空干燥,得化合物12ca(白色粉末状固体,982mg,产率90%)。m.p.:151
–
152℃.1h nmr(400mhz,cdcl3)δ7.45
–
7.43(m, 2h),7.37(t,j=7.2hz,2h),7.32
–
7.28(m,1h),6.97(d,j=8.4hz,1h),6.80(d,j=8.4hz,1h), 6.75(d,j=8.0hz,1h),6.66(d,j=1.6hz,1h),6.52(dd,j=8.0,1.6hz,1h),5.42(m,1h),5.12 (s,2h),3.86(s,3h),3.84(s,3h,overlapped),3.84(s,3h,overlapped),3.62(s,2h),3.45(q,j= 6.4hz,2h),2.68(t,j=7.2hz,2h).
13
c nmr(100mhz,cdcl3)δ170.0,153.0,149.9,146.9, 137.4,131.9,128.6,127.9,127.7,127.4,126.5,120.9,120.8,114.4,112.5,111.6,71.3,56.2,56.1, 43.8,40.8,35.2.ir(neat):ν
max
=3304,2936,1642,1592,1515,1487,1453,1266,1230,1034 cm-1
.hrms(m/z):[m h]
calculated for c
26h2979
brno
5
,514.1224;found,514.1219; c
26h2981
brno
5
,516.1203;found,516.1201.
[0241]
实施例12化合物12的制备。当化合物11中的r
22
为氢原子时,所述化合物11引入羟基保护基ⅱ得到化合物12。
[0242]
以r
22
为氢原子、x为溴、r
11
为me、引入的羟基保护基ⅱ为pmb为例,合成化合物12cb,合成路线为:
[0243][0244]
将化合物11c(674mg,1.60mmol,1.0equiv.),无水碳酸钾(442mg,3.20mmol,2.0equiv.) 溶解于干燥dmf(8ml)中,氩气保护,加入pmbcl(0.33ml,2.40mmol,1.5equiv.),室温反应3小时。tlc显示原料反应完全,加入水淬灭,加入乙酸乙酯(10ml),析出大量固体,过滤,固体用甲基叔丁基醚(10ml
×
2)洗。收集固体,真空干燥,得化合物12cb(白色粉末状固体,788mg,产率84%)。m.p.:144
–
146℃.1h nmr(400mhz,cdcl3)δ7.36(d,j= 8.8hz,2h),6.97(d,j=8.4hz,1h),6.90(d,j=8.4hz,2h),6.81(d,j=8.4hz,1h),6.76(d,j= 8.0hz,1h),6.65(d,j=1.6hz,1h),6.53(dd,j=8.0,1.6hz,1h),5.40(m,1h),5.04(s,2h), 3.86(s,3h),3.84(s,3h),3.83(s,3h),3.81(s,3h),3.62(s,2h),3.45(q,j=6.4hz,2h),2.68(t,j =6.8hz,2h).
13
c nmr(100mhz,cdcl3)δ170.0,159.5,153.0,150.0,147.0,131.9,129.5, 129.2,127.7,126.5,120.9,120.8,114.5,114.1,112.5,111.7,71.1,56.2,56.1,55.4,43.8,40.9, 35.2.ir(neat):ν
max
=3313,2932,1646,1591,1515,1249,1033cm-1
.hrms
6.69(dd,j=8.0,2.0hz,1h),3.86(s,3h),3.85(s,3h),3.77(s,3h),3.65(s,2h),3.54
–
3.45(m, 2h),2.78(t,j=7.2hz,2h).
13
c nmr(100mhz,cdcl3)δ170.0,164.8,152.9,151.3, 146.8,138.5,137.7,133.5,130.2,129.4,128.5,127.5,126.4,122.8,120.8,120.7,112.9,111.6,60.5, 56.0,55.9,43.7,40.6,35.5.ir(neat):ν
max
=3055,2939,1736,1665,1598,1510,1487,1264,1033, 731,704cm-1
.hrms(m/z):[m h]
calculated for c
26h2779
brno
6
,528.1012;found,528.1016; c
26h2781
brno
6
,530.0996;found,530.0994.
[0253]
实施例15化合物12的制备。当化合物11中的r
22
为氢原子时,所述化合物11引入羟基保护基ⅱ得到化合物12。
[0254]
以r
22
为氢原子、x为溴、r1为me、引入的羟基保护基ⅱ为piv为例,合成化合物12ce,合成路线为:
[0255][0256]
将化合物11c(1.00g,2.36mmol,1.0equiv.)溶解于干燥二氯甲烷(20ml)中,氩气保护,冷却至0℃,依次加入三乙胺(0.66ml,4.71mmol,2.0equiv.)和特戊酰氯(0.35ml,2.83 mmol,1.2equiv.),升至室温反应2小时,tlc显示原料反应完全。加入饱和氯化铵水溶液淬灭反应,水层用二氯甲烷萃取(20ml
×
4),合并有机层,无水硫酸镁干燥、过滤,减压浓缩,所得粗品经硅胶柱层析纯化(石油醚/丙酮=10:1至6:1,v/v),得白色泡沫状固体12ce (1.03g,产率86%)。1h nmr(400mhz,cdcl3)δ6.96(d,j=8.8hz,1h),6.97
–
6.91(m,2h), 6.70(d,j=1.6hz,1h),6.63(dd,j=8.0,2.0hz,1h),3.87(s,3h),3.84(s,3h),3.75(s,3h),3.63 (s,2h),3.51
–
3.43(m,2h),2.74(t,j=6.8hz,2h),1.35(s,9h).
13
c nmr(100mhz,cdcl3)δ 176.7,170.0,152.9,151.2,146.8,138.7,137.3,127.5,126.4,122.6,120.7,120.7,112.8,111.6,60.5, 56.0,55.9,43.6,40.6,39.0,35.4,27.2.ir(neat):ν
max
=2968,1752,1683,1598,1511,1486,1268, 1114,1032cm-1
.hrms(m/z):[m h]
calculated for c
26h2779
brno
6
,528.1012;found, 528.1016;c
26h2781
brno
6
,530.0996;found,530.0994.
[0257]
实施例16化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0258]
以r2为tbdps、x为溴、r
11
为氢原子、r为co2me为例,合成化合物15ab,合成路线为:
[0259][0260]
将固体化合物11a(100.0mg,0.154mmol,1.0equiv.)溶于干燥ch2cl2(1ml),于0℃搅拌下向其中依次加入2-氟吡啶(27ul,0.308mmol,2.0equiv.),三氟甲磺酸酐(32ul,0.185 mmol,1.2equiv.),加毕升至室温反应10分钟,tlc显示原料完全消失。将反应液冷却至0℃, 加入饱和nh4cl水溶液(1ml)淬灭反应。分出有机层,水层以ch2cl2萃取(2ml
×
3),合并有机层,用饱和nacl洗(2ml
×
1),无水硫酸镁干燥,过滤,减压浓缩得化合物13a 的粗品,不经分离纯化直接用于后续反应。
[0261]
将上述粗品13a溶于干燥脱气的dmf(2.9ml),于室温下搅拌。另取一反应瓶,加入金属催化剂(1.0mg,0.0154mmol,0.01equiv.)、配体(1s,2s)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺(1.2mg,0.0308mmol,0.02equiv.),抽换气,氩气保护,加入脱气的干燥dmf(40ul),室温下搅拌30分钟后,将该混合溶液加入化合物13a的dmf溶液中,继续于室温搅拌10 分钟,随后冷却至0℃,向其中加入hcooh/et3n(5:2络合物)(55ul,0.385mmol,2.5equiv.),升至室温反应17h。tlc检测反应完全。将反应液冷却至0℃,加入饱和nahco3水溶液淬灭反应,将ph调至9。分出有机层,水层以乙酸乙酯萃取(1ml
×
4),合并有机层,用水 (2ml
×
1)、饱和nacl洗(2ml
×
1)依次洗,有机层经无水硫酸镁干燥,过滤,减压浓缩得化合物14a的粗品,不经分离纯化直接用于后续反应。
[0262]
将上述化合物14a溶于thf/h2o的混合溶剂(2ml,v/v=3:2)中,冷却至0℃,依次向其中加入二水合磷酸二氢钠(96.1mg,0.616mmol,4.0equiv.),氯甲酸甲酯(0.462mmol,3.0 equiv.)。升至室温搅拌反应1小时,tlc显示原料消失完后,加入h2o,用乙酸乙酯萃取(2ml
ꢀ×
3),合并有机层,无水硫酸镁干燥,过滤,减压浓缩,所得粗品经硅胶柱层析纯化(石油醚/丙酮=7:1,v/v),得白色泡沫状固体15ab(87mg,三步总产率82%,ee=95%)。hplc 条件:od-h柱,hexane:i-proh=80:20,流速1ml/min,柱温25℃,检测波长254nm,两个对映异构体保留时间:t
major
=8.705min,t
minor
=6.352min。optical rotation:[α]
d25
=
–
52.5 (c=0.2,chcl3).1h nmr(400mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ 7.77
–
7.70(m,4h),7.46
–
7.33(m,6h),6.72(d,j=8.4hz,1h),6.69
–
6.60(m,1h),6.53(s, 0.8h),6.53(s,0.2h),6.46
–
6.44(m,1h),5.92(s,0.8h),5.87(s,0.2h),5.16
–
5.12(m,0.2h), 5.05
–
5.01(m,0.8h),4.28(dd,j=13.2,4.8hz,0.7h),3.94
–
3.89(m,0.3h),3.85
–
3.84(m,3h), 3.69(s,2.3h),3.57(d,j=6.8hz,1.4h),3.22
–
3.15(m,1h),3.12(s,2.3h),2.94
–
2.77(m,2h), 2.68
–
2.49(m,2h),1.13(s,7h),1.11(s,2h,overlapped).
13
c nmr(100mhz,
cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ156.0,155.8,149.4,149.2,145.5,143.5,143.3,142.8,142.7, 135.54,135.47,135.4,135.35,133.5,133.4,133.3,130.9,130.7,129.75,129.68,129.64,128.5, 128.3,127.65,127.62,127.60,127.53,126.8,126.6,121.6,121.5,118.8,118.4,112.5,112.1,111.8, 111.2,109.0,56.3,56.2,55.8,55.6,54.2,53.2,52.4,51.9,42.0,41.0,38.3,36.8,29.7,28.2,26.71, 26.67,19.72.ir(neat):ν
max
=2928,2856,1692,1609,1488,1463,1262,1106,1033cm-1
;hrms (m/z):[m h]
calculated for c
36h4179
brno6si
,690.1881;found,690.1880; c
41h4581
brno6ssi
,692.1861;found,692.1868.
[0263]
实施例17-21化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0264]
以r2为tbdps、x为溴、r
11
为氢原子、r为co2me为例,合成化合物15ab,合成路线为:
[0265][0266]
实施例17-21的合成步骤均与实施例16相同,合成的温度、时间、试剂及其用量等条件均如合成路线中所示。各组实施例的区别仅在于:合成过程中在由中间体13a制备化合物14a 的不对称氢化反应中使用了不同的配体。结果如下表所示:
[0267]
[0268][0269]
实施例22-25化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0270]
以r2为tbdps、x为溴、r
11
为氢原子、r为co2me为例,合成化合物15ab,合成路线为:
[0271][0272]
实施例22-25中,化合物15ab的合成步骤与实施例16相同,合成的温度、时间、试剂及其用量等条件均如合成路线中所示。各组实施例的区别仅在于:合成过程中在由中间体13a 制备化合物14a的不对称氢化反应中hcooh/et3n的用量不同。结果如下表所示:
[0273][0274][0275]
实施例26-29化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0276]
以r2为tbdps、x为溴、r
11
为氢原子、r为co2me为例,合成化合物15ab,合成路线为:
[0277][0278]
实施例26-29中,化合物15ab的合成步骤与实施例16相同,合成的温度、时间、试剂及其用量等条件均如合成路线中所示;各组实施例的区别仅在于。各组实施例的区别仅在于:合成过程中在由中间体13a制备化合物14a的不对称氢化反应中金属催化剂和配体用量不同。结果如下表所示:
[0279][0280]
实施例30-31化合物15的制备(bischler-napieralski/转移氢化)。
[0281]
以r2为tbdps、x为溴、r
11
为氢原子、r为co2me为例,合成化合物15ab,合成路线为:
[0282][0283]
实施例30-31中,化合物15ab的合成步骤与实施例16相同,合成的温度、时间、试剂及其用量等条件均如合成路线中所示;各组实施例的区别仅在于:合成过程中在由中间体13a 制备化合物14a的不对称氢化反应中金属催化剂种类不同。结果如下表所示:
[0284][0285]
实施例32-36化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0286]
以r2为tbdps、x为溴、r
11
为氢原子、r为co2me为例,合成化合物15ab,合成路线为:
[0287][0288]
实施例32-36中,化合物15ab的合成步骤与实施例16相同,合成的温度、时间、试剂
及其用量等条件均如合成路线中所示。各组实施例的区别仅在于:合成过程中在由中间体13a 制备化合物14a的不对称氢化反应浓度不同。结果如下表所示:
[0289][0290]
实施例37化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0291]
以r2为tbdps、x为溴、r
11
为氢原子、r为ts为例,合成化合物15aa,合成路线为:
[0292][0293]
将上述固体化合物11a(10.00g,15.42mmol,1.0equiv.)溶于干燥ch2cl2(100ml),于0 ℃搅拌下向其中依次加入2-氟吡啶(2.65ml,30.83mmol,2.0equiv.),三氟甲磺酸酐(3.10ml, 18.50mmol,1.2equiv.),加毕升至室温反应10分钟,tlc显示原料完全消失。将反应液冷却至0℃,加入饱和nh4cl水溶液(100ml)淬灭反应。分出有机层,水层以ch2cl2萃取(100 ml
×
3),合并有机层,用饱和nacl洗(50ml
×
1),无水硫酸镁干燥,过滤,减压浓缩得化合物13a的粗品,不经分离纯化直接用于后续反应。
[0294]
将上述粗品13a溶于干燥脱气的dmf(46ml),于室温下搅拌。另取一反应瓶,加入金属催化剂(47.2mg,0.077mmol,0.005equiv.)、配体(1s,2s)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺(56.5mg,0.154mmol,0.01equiv.),抽换气,氩气保护,加入脱气的干燥dmf(4ml),室温下搅拌30分钟后,将该混合溶液加入化合物12的dmf溶液中,继续于室温搅拌10
分钟,随后冷却至0℃,向其中加入hcooh/et3n(5:2络合物)(4.90ml,33.9mmol,2.2equiv.),升至室温反应17h。tlc检测反应完全。将反应液冷却至0℃,加入饱和nahco3水溶液淬灭反应,将ph调至9。分出有机层,水层以乙酸乙酯萃取(100ml
×
4),合并有机层,用水(50ml
×
1)、饱和nacl洗(50ml
×
1)依次洗,有机层经无水硫酸镁干燥,过滤,减压浓缩得化合物14a的粗品,不经分离纯化直接用于后续反应。
[0295]
将上述化合物14a溶于thf/h2o的混合溶剂(150ml,v/v=3:2)中,于室温依次向其中加入十二水磷酸氢二钠(16.57g,46.26mmol,3.0equiv.),对甲苯磺酰氯(2.94g,15.42mmol, 1.0equiv.)。于室温搅拌反应1小时,tlc显示原料消失完后,加入h2o稀释至磷酸氢二钠固体溶解,用乙酸乙酯萃取(100ml
×
3),合并有机层,无水硫酸镁干燥,过滤,减压浓缩,所得粗品经硅胶柱层析纯化(石油醚/丙酮=7:1,v/v),得白色泡沫状固体15aa(9.34g, 三步总产率77%,ee=96%)。hplc条件:ic-h柱,hexane:i-proh=70:30,流速1ml/min,柱温25℃,检测波长254nm,t
major
=27.883min,t
minor
=21.832min。optical rotation:[α]
d25
=
–
119.5(c=0.44,chcl3);1h nmr(400mhz,cdcl3)δ7.74
–
7.71(m,4h),7.47
–
7.33(m,6h), 7.30
–
7.26(m,2h),6.95(d,j=8.0hz,2h),6.63(d,j=8.0hz,1h),6.51(d,j=10.4hz,1h), 6.49(s,1h,overlapped),6.35(s,1h),5.83(s,1h),4.81(dd,j=10.0,4.4hz,1h),3.91(dd,j= 14.4,5.6hz,1h),3.86(s,3h),3.59(s,3h),3.49
–
3.42(m,1h),2.80
–
2.71(m,2h),2.69
–
2.58 (m,1h),2.43(dd,j=16.0hz,2.4hz,1h),2.31(s,3h),1.12(s,9h);
13
c nmr(100mhz,cdcl3) δ149.5,145.7,143.3,142.8,142.5,137.4,135.5,135.5,133.4,133.4,130.0,129.8,129.7,128.9, 127.7,127.6,127.6,127.0,125.7,122.1,118.6,112.4,111.3,109.0,56.1,55.6,55.4,42.5,38.7, 26.7,26.5,21.4,19.7;ir(neat):ν
max
=3431,2933,2857,1609,1513,1489,1442,1228,1154,1114, 1033,702cm-1
;hrms(m/z):[m h]
calculated for c
41h4579
brno6ssi
,786.1915;found, 786.1920;c
41h4581
brno6ssi
,788.1894;found,788.1904.
[0296]
实施例38化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0297]
以r2为tbdps、x为溴、r
11
为氢原子、r为cbz为例,合成化合物15ac,合成路线为:
[0298][0299]
化合物15ac的合成路线和反应条件如上所示,使用配体为(1s,2s)-( )-n-对甲苯磺酰基
ꢀ‑
1,2-二苯基乙二胺合成操作参照15ab的合成(三步总产率75%,ee=97%(r))。
hplc条件: ic00c3-qg035柱,hexane:i-proh=80:20,流速1ml/min,柱温25℃,检测波长254nm, t
major
=10.179min,t
minor
=8.966min。optical rotation:[α]
d25
=
–
69.0(c=0.68,chcl3);1h nmr (400mhz,cdcl3)δ7.75
–
7.72(m,4h),7.43
–
7.22(m,9.6h),7.02
–
7.01(m,1.4h),6.61
–
6.42 (m,4h),5.87
–
5.76(m,1h),5.19
–
5.02(m,1h),4.97
–
4.76(m,1h),4.41(d,j=12.4hz,1h), 4.34
–
3.98(m,1h),3.82
–
3.81(m,3h),3.68(s,2.3h),3.59(s,0.7h),3.33
–
3.19(m,1h),2.92
–ꢀ
2.47(m,4h),1.13
–
1.11(m,9h);
13
c nmr(100mhz,cdcl3)δ155.4,155.0,149.4,149.2, 145.57,145.55,143.5,143.4,142.8,142.7,137.1,136.1,135.53,135.49,135.5,135.4,133.44, 133.40,133.3,130.8,130.7,129.73,129.70,129.65,128.5,128.4,128.3,128.2,127.8,127.7, 127.64,127.62,127.60,127.5,126.7,126.6,121.54,121.51,118.8,118.5,112.5,112.2,111.8, 111.4,109.00,108.9,66.9,66.6,56.2,55.8,55.6,54.3,53.5,41.9,41.0,38.4,36.9,28.3,28.1, 26.70,26.68,19.7;ir(neat):ν
max
=2961,2857,1688,1487,1428,1261,1100,1031,753,700cm-1
; hrms(m/z):[m h]
calculated for c
42h4579
brno6si
,766.2194;found,766.2194; c
42h4581
brno6si
,768.2174;found,768.2187.
[0300]
实施例39化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0301]
以r2为tbs、x为溴、r
11
为氢原子、r为co2me为例,合成化合物15da,合成路线为:
[0302][0303]
化合物15da的合成路线和反应条件如上所示,合成操作参照实施例16化合物15ab 的合成,所用配体为(1r,2r)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺(三步总产率68%,ee=97% (s))。hplc条件:od-h柱,hexane:i-proh=85:15,流速0.5ml/min,柱温25℃,检测波长254nm,t
major
=15.247min,t
minor
=18.434min。optical rotation:[α]
d25
= 55.3(c=2.0,chcl3);1h nmr(400mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ6.73
–
6.67(m,2h), 6.58
–
6.43(m,1.7h),6.43(s,0.3h),5.99
–
5.91(m,1h),5.35
–
5.29(m,1h),4.30
–
4.25(m, 0.7h),3.91
–
3.87(m,3.3h,overlapped),3.76
–
3.77(m,3h),3.64(s,0.8h),3.48
–
3.42(m,0.3h), 3.35
–
3.28(m,0.7h,overlapped),3.26(s,2.2h),3.24
–
3.07(m,1h),2.98
–
2.84(m,1h),2.81
–ꢀ
2.65(m,1h),1.00(s,6h),0.95(s,3h),0.16
–
0.08(m,6h);
13
c nmr(100mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ156.1,156.0,149.81,149.76,145.7,145.6,143.4, 143.1,143.0,142.8,130.79,130.76,128.6,127.2,127.0,121.80,121.75,119.6,119.1,112.1,111.9, 111.8,111.3,109.3,109.2,56.3,56.2,
55.6,54.9,53.6,52.5,52.1,42.3,41.1,39.0,37.4,28.2,25.72, 25.67,18.5,18.4,
–
4.8,
–
4.8,
–
4.7,
–
4.6;ir(neat):ν
max
=2930,2856,1685,1512,1488,1260,1226, 1033,755cm-1
;hrms(m/z):[m h]
calculated for c
26h3779
brno6si
,566.1568;found, 566.1565;c
26h3781
brno6si
,568.1548;found,568.1545.
[0304]
实施例40化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0305]
以r2为tbdps、x为溴、r
11
为me、r为ts为例,合成化合物15ba,合成路线为:
[0306]
将上述固体化合物11b(30.00g,45.27mmol,1.0equiv.)溶于干燥ch2cl2(300ml),于0 ℃搅拌下向其中依次加入2-氟吡啶(7.8ml,90.54mmol,2.0equiv.),三氟甲磺酸酐(9.2ml, 54.32mmol,1.2equiv.),加毕升至室温反应10分钟,tlc显示原料完全消失。将反应液冷却至0℃,加入饱和nh4cl水溶液(300ml)淬灭反应。分出有机层,水层以ch2cl2萃取(300 ml
×
3),合并有机层,用饱和nacl洗(100ml
×
1),无水硫酸镁干燥,过滤,减压浓缩得黄色泡沫状固体13b的粗品,不经分离纯化直接用于后续反应。
[0307]
将上述粗品13b溶于干燥脱气的dmf(140ml),于室温下搅拌。另取一反应瓶,加入金属催化剂(139mg,0.226mmol,0.005equiv.)、配体(1s,2s)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺(166mg,0.453mmol,0.01equiv.),抽换气,氩气保护,加入脱气的干燥dmf(10ml),室温下搅拌30分钟后,将该混合溶液加入化合物13b的dmf溶液中,继续于室温搅拌10 分钟,随后冷却至0℃,向其中加入hcooh/et3n(5:2络合物)(14.2ml,99.6mmol,2.2equiv.),升至室温反应17h。tlc检测反应完全。将反应液冷却至0℃,加入饱和nahco3水溶液淬灭反应,将ph调至9。分出有机层,水层以乙酸乙酯萃取(300ml
×
3),合并有机层,用水(50ml
×
1)、饱和nacl洗(50ml
×
1)依次洗,有机层经无水硫酸镁干燥,过滤,减压浓缩得黑色泡沫状固体14b的粗品,不经分离纯化直接用于后续反应。
[0308]
将上述化合物14b溶于thf/h2o的混合溶剂(300ml,v/v=3:2)中,于室温依次向其中加入十二水磷酸氢二钠(48.64g,135.8mmol,3.0equiv.),对甲苯磺酰氯(8.63g,45.27mmol, 1.0equiv.)。于室温搅拌反应1小时,tlc显示原料消失完后,加入h2o稀释至磷酸氢二钠固体溶解,用乙酸乙酯萃取(200ml
×
3),合并有机层,无水硫酸镁干燥,过滤,减压浓缩,所得粗品经硅胶柱层析纯化(石油醚/丙酮=7:1,v/v),得白色泡沫状固体15ba(29.9g, 三步总产率84%,ee=96%)。hplc条件:ad-h柱,hexane:i-proh=70:30,流速
1.0ml/min,柱温25℃,检测波长254nm,t
major
=5.585min,t
minor
=4.769min。opticalrotation:[α]
d25
=
–
117.9(c=0.8,chcl3);1hnmr(400mhz,cdcl3)δ7.73
–
7.70(m,4h),7.46
–
7.28(m,8h),6.96(d,j=8.2hz,2h),6.70(s,2h),6.50(s,1h),6.32(s,1h),4.89(q,j=4.8hz,1h),3.88
–
3.87(m,1h,overlapped),3.84(s,3h),3.81(s,3h),3.58(s,3h),3.50
–
3.42(m,1h),2.83
–
2.72(m,2h),2.56
–
2.48(m,1h),2.41
–
2.36(m,1h),2.30(s,3h),1.12(s,9h);
13
cnmr(100mhz,cdcl3)δ152.2,149.5,146.2,143.3,142.6,137.6,135.5,135.44,133.38,133.3,130.0,129.74,129.71,129.0,127.7,127.6,126.8,126.5,125.6,120.7,118.5,112.2,110.6,60.4,55.8,55.53,55.46,42.6,38.6,26.7,26.2,21.4,19.7;ir(neat):ν
max
=2933,1513,1487,1448,1261,1155,1113,1033,701cm-1
;hrms(m/z):[m h]
calculatedforc
42h4779
brno6ssi
,800.2071;found,800.2066;c
26h3781
brno6si
,802.2051;found,802.2050.
[0309]
实施例41化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0310]
以r2为tbdps、x为溴、r
11
为me、r为co2me为例,合成化合物15bb,合成路线参考实施例40,使用的配体为(1r,2r)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺。
[0311][0312]
15bb(三步收率81%,96%ee(s)),hplc条件:ad-h柱,hexane:i-proh=95:5,流速0.8ml/min,柱温25℃,检测波长254nm,t
major
=8.100min,t
minor
=10.942min。opticalrotation:[α]
d25
=
–
52.5(c=0.2,chcl3);opticalrotation:[α]
d25
= 53.6(c=0.8,chcl3);1hnmr(400mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ7.76
–
7.70(m,4h),7.46
–
7.32(m,6h),6.66(d,j=8.4hz,1h),6.62
–
6.61(m,2h),6.53(s,0.8h),6.49(s,0.2h),5.15
–
5.12(m,0.2h),5.06
–
5.02(m,0.8h),4.27(dd,j=13.2,4.4hz,1h),3.84(s,2.4h),3.82(s,3.6h,overlapped),3.69(s,2.4h),3.56(d,j=8.8hz,1.2h),3.29
–
3.14(m,1h),3.11(s,2.4h),2.91
–
2.77(m,2h),2.68
–
2.56(m,2h),1.14(s,7h),1.10(s,2h,overlapped);
13
cnmr(100mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ155.9,155.7,152.00,149.4,149.2,146.2,143.5,143.3,135.51,135.46,135.41,135.36,133.4,133.3,130.9,130.8,129.73,129.66,129.6,128.5,128.3,127.62,127.60,127.57,127.5,126.8,126.6,126.0,121.1,120.6,118.8,118.3,112.4,112.1,110.7,60.4,60.4,56.0,56.0,55.8,55.5,54.3,53.2,52.4,51.9,42.1,41.1,38.4,36.8,
28.20,28.15,26.71,26.68,19.7;ir(neat):ν
max
=2932,2857,1696,1593,1513,1486,1447,1260, 1104,1032,701cm-1
;hrms(m/z):[m h]
calculated for c
37h4379
brno6si
,704.2038;found, 704.2037;c
26h3781
brno6si
,706.2017;found,706.2018.
[0313]
实施例42化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0314]
以r2为tbdps、x为溴、r
11
为me、r为cbz为例,合成化合物15bc,合成路线参考实施例40,使用配体为(1s,2s)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺。
[0315][0316]
15bc(三步收率72%,94%ee(r)),hplc条件:adh0ce-ek072柱,梯度洗脱,0-5.5 min,hexane:i-proh=60:40至40:60;5.5-25min,hexane:i-proh=40:60,流速1ml/min,柱温40℃,检测波长254nm,t
major
=11.470min,t
minor
=4.066min。optical rotation:[α]
d25
=
–ꢀ
66.3(c=0.76,chcl3);1h nmr(400mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ7.75
–
7.70(m,4h),7.44
–
7.22(m,9.5h),7.04
–
7.02(m,1.5h),6.68
–
6.46(m,4h),5.20
–ꢀ
5.07(m,1h),5.05
–
4.84(m,1h),4.42
–
3.97(m,2h),3.80
–
3.79(m,3.8h),3.67(d,j=5.8hz, 4.4h),3.59(s,0.8h),3.32
–
3.20(m,1h),2.95
–
2.44(m,4h),1.13
–
1.11(m,9h);
13
c nmr(100 mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ155.3,155.0,152.04,151.99,149.4, 149.2,146.3,146.2,143.44,143.37,137.1,136.4,135.51,135.49,135.44,135.40,133.4,133.3, 130.79,130.76,129.73,129.66,128.5,128.4,128.3,128.2,127.7,127.64,127.59,127.54,127.45, 126.8,126.6,126.0,121.1,120.1,118.7,118.5,112.4,112.2,110.72,110.68,66.71,66.65,60.4, 60.3,56.0,55.7,55.6,54.2,53.6,41.9,41.1,38.4,37.0,28.3,28.0,26.9,26.7,26.7,19.7;ir(neat): ν
max
=2932,2857,1697,1593,1513,1486,1427,1261,1102,1034,700cm-1
;hrms(m/z):[m h]
calculated for c
43h4779
brno6si
,780.2351;found,780.2355;c
43h4781
brno6si
,782.2330;found,782.2340.
[0317]
实施例43化合物15的制备(bischler-napieralski/不对称转移氢化)。
[0318]
以r2为tbs、x为溴、r
11
为me、r为ts为例,合成化合物15ea,合成路线为:
[0319][0320]
化合物15ea以11e为起始原料,经过中间体13e,14e,再引入cbz保护基制得。合成步骤与15aa相同。由11e至15ea的反应条件和试剂用量如上所示。15ea:使用配体为(1s, 2s)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺,三步收率69%,96%ee(s)。hplc条件: ic00c3-qg035柱,hexane:i-proh=60:40,流速1ml/min,柱温25℃,检测波长254nm, t
major
=16.703min,t
minor
=13.134min。optical rotation:[α]
d25
=
–
111.8(c=0.6,chcl3).1h nmr (400mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ7.44(d,j=8.0hz,2h), 7.03(d,j=8.0hz,2h),6.82(d,j=8.4hz,1h),6.74(d,j=8.4hz,1h),6.46(s,1h),6.40(s, 1h),5.16
–
5.12(m,1h),3.89
–
3.87(m,1h,overlapped),3.85(s,3h),3.83(s,3h),3.72(s,3h), 3.62
–
3.55(m,1h),3.15
–
3.06(m,2h),2.70
–
2.50(m,2h),2.31(s,3h),0.96(s,9h),0.10(s, 6h).
13
c nmr(100mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ152.3,149.9, 146.4,143.1,142.7,137.4,130.1,129.2,127.8,127.0,126.7,126.1,120.8,119.2,111.9,110.8,60.4, 55.9,55.8,55.5,43.0,39.2,26.5,25.7,21.4,18.4,-4.66,-4.73.ir(neat):ν
max
=2931,2857, 1511,1487,1259,1156,1092,1033,801cm-1
.hrms(m/z):[m h]
calculated for c
32h4379
brno6ssi
,676.1758;found,676.1752;c
32h4379
brno6ssi
,678.1738;found,678.1735.
[0321]
实施例44-50化合物15的制备(bischler-napieralski/转移氢化)。
[0322]
以r2为羟基保护基ⅱ、x为溴、r
11
为me或pmb、r为二级胺保护基为例,合成化合物15,合成路线为:
[0323][0324]
实施例44为以r2为tbdps、x为溴、r
11
为pmb、r为coome为例,合成化合物15ad,使用配体为(1r,2r)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺,三步总收率80%,ee=86%(s)。 hplc条件:ic-h柱,hexane:i-proh=85:15,流速0.8ml/min,柱温25℃,检测波长254 nm,
t
major
=21.438min,t
minor
=24.448min。opticalrotation:[α]
d25
= 49.9(c=0.68,chcl3);1hnmr(400mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ7.77
–
7.69(m,4h),7.53
–
7.31(m,8h),6.97
–
6.90(m,2h),6.74
–
6.45(m,4h),5.17
–
5.03(m,1h),4.91
–
4.90(m,2h),4.30
–
4.12(m,1h),3.85
–
3.80(m,6.2h),3.67
–
3.56(m,3.6h),3.21
–
3.14(m,1h),3.11(s,2h),2.97
–
2.77(m,2h),2.68
–
2.40(m,2h),1.14
–
1.11(m,9h).
13
cnmr(100mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ159.6,159.4,156.0,155.8,152.2,149.4,149.2,145.2,145.1,143.5,143.3,135.53,135.48,135.44,135.39,133.5,133.3,131.0,130.8,130.3,130.2,129.72,129.65,129.4,128.5,128.4,127.64,127.61,127.5,126.9,126.6,126.0,121.6,121.1,118.8,118.4,113.7,113.6,112.4,112.1,110.7,74.4,74.2,56.1,56.0,55.7,55.6,55.32,55.28,54.3,53.2,52.4,52.0,42.2,41.1,38.4,36.9,28.22,28.15,26.74,26.71,19.7.ir(neat):ν
max
=2932,2858,1697,1612,1592,1513,1484,1447,1260,1106,1032,752,702cm-1
.hrms(m/z):[m h]
calculatedforc
44h4979
brno7si
,810.2456;found,810.2450;c
44h4981
brno7si
,812.2436;found,812.2441.
[0325]
实施例45为以r2为bn、x为溴、r
11
为me、r为coome为例,合成化合物15ca,使用配体为(1r,2r)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺,三步总收率82%,ee=96%(s)。hplc条件:ic-h柱,hexane:i-proh=60:40,流速1.0ml/min,柱温25℃,检测波长254nm,t
major
=18.441min,t
minor
=14.962min。opticalrotation:[α]
d25
= 75.3(c=0.68,chcl3).1hnmr(400mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ7.46
–
7.28(m,5h),6.79
–
6.70(m,2.8h),6.61(d,j=12.4hz,1h),6.37(s,0.2h),5.31
–
5.23(m,1h),5.14(s,1.5h),4.32(dd,j=13.2,4.2hz,0.5h),4.34
–
4.30(m,0.7h),3.96
–
3.91(m,0.3h),3.88
–
3.82(m,9h),3.63(s,0.7h),3.45
–
3.38(m,0.3h),3.28(td,j=12.8,4.0hz,0.8h),3.21(s,2h),3.13
–
3.04(m,1.2h),2.92
–
2.76(m,2h),2.68
–
2.61(m,1h).
13
cnmr(100mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ155.91,155.87,152.14,148.5,148.4,146.4,146.3,146.2,137.2,137.1,130.8,130.7,128.6,128.5,128.3,128.2,127.9,127.8,127.2,127.1,126.8,126.7,126.3,126.2,121.3,120.6,113.2,112.9,111.8,111.6,110.9,110.8,71.4,71.1,60.5,60.4,56.1,56.02,55.98,54.7,53.5,52.5,52.1,42.3,41.2,38.7,37.0,28.2,28.1.ir(neat):ν
max
=2929,1695,1594,1515,1486,1448,1256,1101,1032cm-1
.hrms(m/z):[m h]
calculatedforc
28h31
brno
6
,556.1329;found,556.1326;c
44h4981
brno7si
,558.1309;found,558.1310.
[0326]
实施例46为以r2为pmb、x为溴、r
11
为me、r为coome为例,合成化合物15cb,使用配体为(1r,2r)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺,三步总收率68%,ee=96%(s)。hplc条件:ic-h柱,hexane:i-proh=60:40,流速1ml/min,柱温25℃,检测波长254nm,t
major
=30.306min,t
minor
=24.274min。opticalrotation:[α]
d25
= 66.3(c=0.48,chcl3).1hnmr(400mhz,cdcl3,由于酰胺旋转异构现象,某些信号成对出现)δ7.38(d,j=8.8hz,1.5h),7.30(d,j=8.4hz,0.5h),6.92
–
6.86(m,2h),6.78
–
6.71(m,2.8h),6.62
–
6.59(m,1h),6.38(s,0.2h),5.33
–
5.25(m,1h),5.05(s,1.5h),4.85(q,j=12.0hz,0.5h),4.32(dd,j=13.2,5.6hz,0.7h),3.98
–
3.91(m,0.3h),3.88
–
3.80(m,12h),3.63(s,0.7h),3.45
–
3.38(m,0.2h),3.32
–
3.25(m,0.8h,overlapped),3.22(s,2.3h),3.15
–
3.11(m,1.2h),2.91
–
2.76(m,1.8h),2.68
–
2.61(m,1h).
13
cnmr(100mhz,cdcl3,由于酰胺旋转异构
现象,某些信号成对出现)δ159.34,159.28,155.92,155.88,152.2,148.6,148.4,146.5,146.3,146.2,130.9,130.7,129.2,129.1,129.0,128.9,128.3,128.2,126.7,126.6,126.3,126.2,121.3,120.6,114.0,113.9,113.3,113.0,111.8,111.5,110.9,110.8,71.1,70.9,60.5,60.4,56.1,56.0,55.96,55.3,55.2,54.7,53.5,52.5,52.1,42.3,41.2,38.7,37.0,28.2,28.1.ir(neat):ν
max
=3013,2935,1690,1613,1486,1451,1243,1102,748cm-1
.hrms(m/z):[m h]
calculatedforc
29h3379
brno
7
,586.1435;found,586.1434;c
29h3381
brno
7
,588.1414;found,588.1420.
[0327]
实施例47为以r2为ac、x为溴、r
11
为me、r为ts为例,合成化合物15cc,使用配体为(1r,2r)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺,三步总收率84%,ee=94%(s)(为脱除ac后测得)。hplc条件:ic-h柱,hexane:i-proh=85:15,流速1.5ml/min,柱温25℃,检测波长254nm,t
major
=34.567min,t
minor
=44.746min。opticalrotation:[α]
d25
= 87.4(c=0.88,chcl3).1hnmr(400mhz,cdcl3)δ7.40(d,j=8.4hz,2h),7.05(d,j=8.0hz,2h),6.80
–
6.69(m,2h),6.67(s,1h),6.55(s,1h),5.18(dd,j=8.0,6.0hz,1h),3.92(m,1h),3.82(s,3h),3.81(s,3h),3.76(s,3h),3.50
–
3.62(m,1h),3.14
–
3.05(m,2h),2.73
–
2.85(m,1h),2.53
–
2.64(m,1h),2.33(s,3h),2.28(s,3h).
13
cnmr(100mhz,cdcl3)δ168.8,152.3,149.8,146.3,142.9,137.9,137.1,131.7,129.7,129.2,128.0,127.0,126.7,121.2,120.7,112.3,110.9,60.4,55.9,55.8,55.3,42.9,38.7,27.1,21.4,20.6.ir(neat):ν
max
=2962,1763,1596,1511,1488,1261,1155,1032cm-1
.hrms(m/z):[m h]
calculatedforc
28h3179
brno7s
,604.0999;found,604.1004;c
28h3181
brno7s
,606.0979;found,606.0984.
[0328]
实施例48为以r2为bz、x为溴、r
11
为me、r为ts基为例,合成化合物15cd,使用配体为(1r,2r)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺,三步总收率84%,ee=94%(s)。hplc条件:ad-h柱,hexane:i-proh=80:20,流速1.0ml/min,柱温25℃,检测波长254nm,t
major
=15.023min,t
minor
=18.524min。opticalrotation:[α]
d25
= 120.5(c=0.64,chcl3).1hnmr(400mhz,cdcl3)δ8.21
–
8.15(m,2h),7.67
–
7.60(m,1h),7.54
–
7.40(m,4h),7.10
–
7.03(m,2h),6.79(d,j=9.2hz,1h),6.77(s,1h,overlap),6.73(d,j=8.4hz,1h),6.61(s,1h),5.21(t,j=7.6hz,1h),4.04
–
3.89(m,1h),3.83(s,3h),3.81(s,3h),3.75(s,3h),3.66
–
3.54(m,1h),3.19
–
3.07(m,2h),2.88
–
2.76(m,1h),2.68
–
2.59(m,1h),2.34(s,3h).
13
cnmr(100mhz,cdcl3)δ164.6,152.4,150.1,146.3,143.0,138.2,137.2,133.5,131.8,130.2,129.8,129.3,129.3,128.5,128.1,127.1,126.8,121.4,120.7,112.5,110.9,60.4,55.9,55.9,55.4,42.9,38.8,27.2,21.4.ir(neat):ν
max
=1738,1511,1487,1450,1261,1213,1154,1025,811,729cm-1
.hrms(m/z):[m h]
calculatedforc
33h3379
brno7s
,666.1156;found,666.1151;c
33h3381
brno7s
,668.1135;found,668.1135.
[0329]
实施例49为以r2为piv、x为溴、r
11
为me、r为ts为例,合成化合物15ce,使用配体为(1r,2r)-( )-n-对甲苯磺酰基-1,2-二苯基乙二胺,三步总收率82%,ee=95%(s)。hplc条件:ic00c3-qg035,h2o:meoh=10:90,流速1ml/min,柱温25℃,检测波长254nm,t
major
=16.37min,t
minor
=18.44min。opticalrotation:[α]
d25
= 104.3(c=0.6,chcl3).1hnmr(400mhz,cdcl3)δ7.45
–
7.41(m,2h),7.06(d,j=8.0hz,2h),6.78
–
6.69(m,2h),6.54(s,1h),6.53(s,1h),5.18(t,j=7.2hz,1h),3.95
–
3.87(m,1h),3.86(s,3h),3.83(s,3h),
3.73(s,3h), 3.62
–
3.52(m,1h),3.11(d,j=7.6hz,2h),2.81
–
2.70(m,1h),2.64
–
2.54(m,1h),2.33(s,3h), 1.33(s,9h).
13
c nmr(100mhz,cdcl3)δ176.5,152.3,150.0,146.3,143.0,138.3,137.3,131.3, 129.8,129.3,127.8,127.0,126.8,121.2,120.8,112.3,110.9,60.4,55.9,55.9,55.3,42.9,39.0,38.8, 27.2,27.1,21.4.ir(neat):ν
max
=1751,1511,1486,1449,1272,1154,1097,1030,749cm-1
.hrms (m/z):[m h]
calculated for c
31h3779
brno7s
,646.1469;found,646.1469;c
31h3781
brno7s
, 648.1448;found,648.1457.
[0330]
实施例50化合物17的制备(分子内氧化去芳香化heck偶联反应底物的制备)。当化合物15中的r
11
为氢原子时,所述化合物15引入羟基保护基ⅰ(pmb)后再进行制备化合物 17。
[0331]
以r2为tbdps、x为溴、r
11
为氢原子、r为ts为例,合成化合物17aab,合成路线为:
[0332][0333]
将化合物15aa(10.00g,12.71mmol,1.0equiv.)、碳酸钾(5.27g,38.13mmol,3.0equiv.) 和tbai(469mg,1.27mmol,0.1equiv.)置于反应瓶,抽换气,氩气保护,加入干燥dmf(180 ml)。于室温搅拌下向其中加入pmbcl(3.45ml,25.42mmol,2.0equiv.)。室温反应约6小时, tlc显示原料消失完全,向反应液中加入二甲胺(1.30ml,25.42mmol,2.0equiv.),室温搅拌 2小时,再加入饱和nh4cl溶液(100ml)淬灭反应,用乙酸乙酯萃取(100ml
×
4),合并有机层,依次用水(100ml
×
1)、饱和氯化钠溶液(100ml
×
2)洗。有机层经无水硫酸镁干燥、过滤,浓缩抽干。所得粗品经硅胶柱层析纯化(石油醚/二氯甲烷/丙酮=100:100:1, v/v,含0.5%氨水;硅胶用含0.5%氨水的石油醚处理后装柱),得白色泡沫状固体16aab(9.9 g,产率86%)。化合物16aab数据:optical rotation:[α]
d25
=
–
77.6(c=1.32,chcl3).1h nmr (400mhz,cdcl3)δ7.77
–
7.70(m,4h),7.49(d,j=8.6hz,2h),7.43
–
7.25(m,9h),6.96(d,j= 8.0hz,2h),6.93(d,j=8.8hz,2h),6.70(s,1h),6.52(s,1h),6.31(s,1h),4.93
–
4.90(m,1h, overlapped),4.90(s,3h),3.87
–
3.85(m,1h),3.83(s,3h,overlapped),3.82(s,3h,overlapped), 3.57(s,3h),3.48
–
3.41(m,1h),2.79
–
2.76(m,2h),2.56
–
2.48(m,1h),2.40
–
2.35(m,1h), 2.28(s,3h),1.12(s,9h).
13
c nmr(100mhz,cdcl3)δ159.4,152.5,149.5,145.1,143.3,142.6, 137.6,135.49,135.47,134.8,133.4,133.4,130.2,130.1,129.7,129.71,129.69,129.1,127.73, 127.68,127.58,127.56,126.9,126.5,125.6,121.2,118.6,113.6,112.2,110.7,74.2,55.9,55.53, 55.48,55.3,42.8,38.7,26.7,26.2,21.4,19.7.ir(neat):ν
max
=2932,1513,1485,1463,1428,1248, 1155,1033,749cm-1
.hrms(m/z):[m h]
calculated for c
49h5379
brno7ssi
,906.2490;found, 906.2494;c
49h5381
brno7ssi
,908.2469;found,908.2481.
[0334]
将化合物16aab(9.00g,9.92mmol,1.0equiv.)溶于ch3cn/h2o混合溶剂(210ml,v/v =20:1),于室温向其中加入kf(1.15g,19.84mmol,2.0equiv.),加热至50℃反应约3小时, tlc显示原料消失完全。冷却至0℃,加入饱和nahco3水溶液(100ml)淬灭反应,混合物经减压蒸馏抽除ch3cn,残余物用乙酸乙酯萃取(100ml
×
3),合并有机层,用饱和氯化钠水溶液洗(100ml
×
2),无水硫酸镁干燥,过滤,减压浓缩。粗品经硅胶柱层析纯化 (石油醚/丙酮=4:1,v/v,含0.5%氨水;硅胶用含0.5%氨水的石油醚处理后装柱),得白色泡沫状固体
17aab(6.04g,产率91%)。
[0335]
化合物17aab数据:optical rotation:[α]
d25
=
–
103.2(c=0.6,chcl3).1h nmr(400mhz, cdcl3)δ7.48(d,j=8.4hz,2h),7.39(d,j=8.4hz,2h),7.03(d,j=8.0hz,2h),6.92-6.90(m, 2h),6.82(d,j=8.4hz,1h),6.74(d,j=8.4hz,1h),6.64(s,1h),6.45(s,1h),5.46(s,1h),5.12 (dd,j=9.6,4.8hz,1h),4.92(s,2h),3.93
–
3.88(m,1h),3.85(s,2h),3.82(s,3h,overlapped), 3.82(s,3h,overlapped),3.61
–
3.53(m,1h),3.17(dd,j=14.0,4.8hz,1h),3.05(dd,j=14.0,9.6 hz,1h),2.80
–
2.71(m,1h),2.57
–
2.51(m,1h),2.30(s,3h).
13
c nmr(100mhz,cdcl3)δ 159.6,152.7,145.8,145.4,143.9,143.0,137.3,130.3,129.3,128.8,127.2,126.8,124.8,121.5, 113.8,112.9,110.9,74.4,56.0,55.4,43.1,39.2,26.9,21.6.ir(neat):ν
max
=1596,1512,1484,1462, 1441,1245,1151,1029,748cm-1
.hrms(m/z):[m h]
calculated for c
33h3579
brno7s
, 668.1312;found,668.1313;c
33h3581
brno7s
,670.1292;found,670.1298.
[0336]
实施例51化合物17的制备(分子内氧化去芳香化heck偶联反应底物的制备)。当化合物15中的r
11
为氢原子时,所述化合物15引入羟基保护基ⅰ(bn)后再进行制备化合物17。
[0337][0338]
以r2为tbdps、x为溴、r
11
为氢原子、r为ts为例,合成化合物17aaa,合成路线参考实施例48。化合物17aaa数据:1h nmr(400mhz,cdcl3)δ7.57(d,j=7.2hz,2h),7.41
–ꢀ
7.37(m,4h),7.34
–
7.31(m,1h),7.03(d,j=8.0hz,2h),6.84(d,j=8.4hz,1h),6.75(d,j= 8.4hz,1h),6.65(s,1h),6.45(s,1h),5.47(s,1h),5.13(dd,j=9.6,4.8hz,1h),4.98(s,2h), 3.94
–
3.89(m,1h),3.85(s,3h),3.82(s,3h),3.61
–
3.54(m,1h),3.17(dd,j=14.0,5.2hz,1h), 3.05(dd,j=14.0,9.6hz,1h),2.79
–
2.71(m,1h),2.57
–
2.51(m,1h),2.30(s,3h).
13
c nmr (100mhz,cdcl3)δ152.7,145.8,145.3,143.9,143.0,137.6,137.3,130.3,129.3,128.7,128.5, 128.4,128.0,127.2,126.8,124.8,121.4,112.9,111.0,110.8,74.6,56.0,43.1,39.2,26.9,21.6.ir (neat):ν
max
=1511,1484,1454,1271,1150,1028,750cm-1
.hrms(m/z):[m h]
calculated for c
32h33
brno6s
,638.1206;found,638.1211;c
33h3581
brno7s
,640.1186;found,640.1196.
[0339]
实施例52化合物17的制备(分子内氧化去芳香化heck偶联反应底物的制备)。当化合物15中的r
11
为羟基保护基ⅰ时,所述化合物15直接制备化合物17。
[0340]
以r2为ac、x为溴、r
11
为me、r为ts为例,合成化合物17aac,合成路线为:
[0341][0342]
将化合物(s)-15cc(1.00g,1.65mmol,1.0equiv.)溶于meoh(10ml),于室温向其中
加入k2co3(0.57g,4.13mmol,2.5equiv.),搅拌反应约0.5小时,tlc显示原料消失完全。冷却至0℃,加入水淬灭反应,用乙酸乙酯萃取(20ml
×
3),合并有机层,无水硫酸镁干燥,过滤,减压浓缩。粗品经硅胶柱层析纯化(石油醚/丙酮=6:1,v/v,),得白色泡沫状固体 (s)-17aac(854mg,产率92%)。optical rotation:[α]
d25
= 83.7(c=0.84,chcl3).1h nmr(400 mhz,cdcl3)δ7.39(d,j=8.0hz,2h),7.02(d,j=8.0hz,2h),6.83(d,j=8.4hz,1h),6.73(d, j=8.8hz,1h),6.66(s,1h),6.45(s,1h),5.48(s,1h),5.12(dd,j=10.0,4.8hz,1h),3.94
–
3.89 (m,1h),3.86(s,3h),3.82(s,6h),3.61
–
3.54(m,1h),3.16(dd,j=14.0,4.8hz,1h),3.04(dd,j =14.0,9.6hz,1h),2.79
–
2.70(m,1h),2.57
–
2.51(m,1h),2.32(s,3h).
13
c nmr(100mhz, cdcl3)δ152.5,146.5,145.8,144.0,143.0,137.4,130.2,129.3,128.8,127.2,126.7,124.8,121.0, 112.9,111.0,56.0,43.0,39.2,26.9,21.6.ir(neat):ν
max
=3428,1512,1487,1449,1265,1149, 1031cm-1
.hrms(m/z):[m h]
calculated for c
26h2979
brno6s
,562.0893;found,562.0893; c
33h3581
brno7s
,564.0873;found,564.0873.
[0343]
实施例53化合物17的制备(分子内氧化去芳香化heck偶联反应底物的制备)。当化合物15中的r
11
为羟基保护基ⅰ时,所述化合物15直接制备化合物17。
[0344]
以r2为tbdps、x为溴、r
11
为me、r为ts为例,合成化合物17aac,合成路线为:
[0345][0346]
将化合物(r)-15ba(10.00g,12.49mmol,1.0equiv.)溶于ch3cn/h2o混合溶剂(210ml, v/v=20:1),于室温向其中加入kf(1.45g,24.97mmol,2.0equiv.),加热至50℃反应约3小时,tlc显示原料消失完全。冷却至0℃,加入饱和nahco3水溶液(100ml)淬灭反应,混合物经减压蒸馏抽除ch3cn,残余物用乙酸乙酯萃取(100ml
×
3),合并有机层,用饱和氯化钠水溶液洗(100ml
×
2),无水硫酸镁干燥,过滤,减压浓缩。粗品经硅胶柱层析纯化(石油醚/丙酮=4:1,v/v,),得白色泡沫状固体(r)-17aac(6.67g,产率95%)。optical rotation:[α]
d25
=
–
96.9(c=0.8,chcl3).
[0347]
实施例54化合物18的制备(分子内氧化去芳香化heck反应)。
[0348]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0349][0350]
将化合物17aac(200mg,0.356mmol,1.0equiv.),氯化钯(6.3mg,0.0356mmol,0.1equiv.)、膦配体(16.8mg,0.0356mmol,0.1equiv.)和碳酸钾(147mg,1.067mmol,3.0equiv.)置于反应容器,抽换气,氩气保护,向其中加入脱气的干燥dmf(4ml,c=0.1mol/
l),置于80℃油浴中反应12小时。tlc监测原料,将反应液冷却至室温,于0℃加水(4ml)淬灭反应,用乙酸乙酯萃取(5ml
×
3),合并有机层,依次用水(10ml
×
1)、饱和氯化钠溶液(10 ml
×
1)洗。有机层经无水硫酸镁干燥,过滤,浓缩,所得粗品经硅胶柱层析纯化(石油醚/二氯甲烷/丙酮=15:15:1,v/v)得类白色泡沫状固体18aac(27mg,产率16%)。18aac数据:optical rotation:[α]
d25
= 4.5(c=0.4,chcl3).1h nmr(400mhz,cdcl3)δ7.66(d,j=8.4 hz,2h),7.27(d,j=4.0hz,2h),7.16(s,1h),6.84
–
6.77(m,2h),6.22(s,1h),4.95(d,j=3.6hz, 1h),3.92(s,3h),3.86(s,3h),3.74(s,3h),3.73-3.68(m,1h),3.28(dd,j=17.6,4.8hz,1h), 3.20(dd,j=17.6,1.6hz,1h),3.04
–
2.96(m,1h),2.41(s,3h),2.22
–
2.19(m,1h),1.40
–
1.26 (m,1h).
13
c nmr(100mhz,cdcl3)δ180.8,157.9,152.2,151.3,147.4,143.9,137.2,130.3, 130.0,127.8,127.1,124.0,122.4,120.0,112.3,56.0,55.0,43.6,40.3,39.0,21.7.ir(neat):ν
max
= 2936,1674,1649,1616,1483,1280,1213,1159cm-1
.hrms(m/z):[m h]
calculated for c
26h28
no6s
,482.1632;found,482.1636.
[0351]
实施例55-58化合物18的制备(分子内氧化去芳香化heck反应溶剂筛选)。
[0352]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0353][0354]
实施例55-58中化合物18aac的合成步骤均与实施例54相同,合成的试剂及其用量等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中使用了不同的溶剂和温度。结果如下表所示:
[0355]
组别溶剂温度t(℃)产率%实施例55toluene11019%实施例56dimethylbezene12555%实施例57phome12562%实施例58dmf12567%
[0356]
实施例59-62化合物18的制备(分子内氧化去芳香化heck反应温度筛选)
[0357]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0358][0359]
实施例59-62中化合物18aac的合成步骤均与实施例58相同,合成的试剂及其用量
等条件均如合成路线中所示;与实施例58的区别仅在于各组实施例的区别仅在于:在由化合物 17aac制备化合物18aac的反应中使用了不同的反应温度。
[0360]
组别温度(℃)产率%实施例5910011%实施例6012561%实施例6113568%实施例6214569%
[0361]
实施例63-67化合物18的制备(分子内氧化去芳香化heck反应碱的筛选)。
[0362]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0363][0364]
实施例63-67中化合物18aac的合成步骤均与实施例62相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中使用了不同的碱。结果如下表所示:
[0365][0366][0367]
实施例68-69化合物18的制备(分子内氧化去芳香化heck反应催化剂和配体当量数筛选)。
[0368]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0369][0370]
实施例68-69中化合物18aac的合成步骤均与实施例62相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中所用氯化钯和配体的当量不同。结果如下表所示:
[0371]
组别pdcl2用量(mol%)配体用量(mol%)产率%实施例687.5%7.5%57%实施例695%5%51%
[0372]
实施例70-74化合物18的制备(分子内氧化去芳香化heck反应浓度筛选)。
[0373]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0374][0375]
实施例70-74中化合物18aac的合成步骤均与实施例62相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应浓度不同。结果如下表所示:
[0376]
组别反应浓度c(mol/l)产率%实施例700.640%实施例710.440%实施例720.251%实施例730.07572%实施例740.0567%
[0377]
实施例75化合物18的制备(分子内氧化去芳香化heck反应优选浓度应用)
[0378]
[0379]
实施例73中,化合物18aac的合成步骤与实施例67相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;与实施例67的区别仅在于:在由化合物17aac制备化合物 18aac的反应浓度不同。结果如下表所示:
[0380]
组别反应浓度c(mol/l)产率%实施例750.07573%
[0381] 实施例76-87化合物18的制备(分子内氧化去芳香化heck反应配体筛选)。
[0382]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0383][0384]
实施例76-87中化合物18aac的合成步骤均与实施例75相同,所用碱为磷酸钾,其他合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中所用配体不同。结果如下表所示:
[0385]
[0386]
实施例88-97化合物18的制备(分子内氧化去芳香化heck反应金属催化剂和配体用量比例筛选)。
[0387]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0388][0389]
实施例88-97中化合物18aac的合成步骤均与实施例75相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中氯化钯和配体用量不同。结果如下表所示:
[0390][0391]
[0392]
实施例98-100化合物18的制备。(分子内氧化去芳香化heck反应优选配体与金属催化剂用量比例筛选)。
[0393]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0394][0395]
实施例98-100中化合物18aac的合成步骤均与实施例81相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中氯化钯和配体用量不同。结果如下表所示:
[0396]
组别pdcl2用量(mol%)配体用量(mol%)产率%实施例985%15%72%实施例997.5%22.5%73%实施例10010%30%79%
[0397]
实施例101-102化合物18的制备(分子内氧化去芳香化heck反应优选配体与金属催化剂用量比例筛选)。
[0398]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0399][0400]
实施例101-102中化合物18aac的合成步骤均与实施例83相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中配体用量不同。结果如下表所示:
[0401]
组别pdcl2用量(mol%)配体用量(mol%)产率%实施例10110%20%74%实施例10210%30%80%
[0402]
实施例103-104化合物18的制备(分子内氧化去芳香化heck反应优选配体与金属催化剂用量比例筛选)。
[0403]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0404][0405]
实施例103-104中化合物18aac的合成步骤均与实施例84相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中配体用量不同。结果如下表所示:
[0406]
组别pdcl2用量(mol%)配体用量(mol%)产率%实施例10310%20%75%实施例10410%30%81%
[0407]
实施例105-106化合物18的制备(分子内氧化去芳香化heck反应配体与金属催化剂用量优选比例应用)。
[0408]
以x为溴、r1为me、r为ts为例,合成化合物18aac,合成路线为:
[0409][0410]
实施例105-106中化合物18aac的合成步骤均与实施例89相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中所用配体不同。结果如下表所示:
[0411][0412]
实施例107化合物18aac的精制
[0413]
将上述实施例54-106的产物(r)-18aac用乙醇重结晶,重结晶收率80%,产物ee值提高至99.9%(r),m.p.:162
–
164℃.optical rotation:[α]
d25
= 11.9(c=0.52,chcl3).hplc条件: ad-h柱,hexane:i-proh=60:40,流速1ml/min,柱温25℃,检测波长254nm,t
major
=16.632 min,t
minor
=9.754min。
[0414]
将(s)-18aac用异丙醇重结晶,重结晶收率93%,产物ee值提高至99.9(s),m.p.:162
ꢀ–
164℃.optical rotation:[α]
d25
=
–
11.3(c=0.68,chcl3).hplc条件:ad-h柱,hexane: i-proh=60:40,流速1ml/min,柱温25℃,检测波长254nm,t
major
=9.888min,t
minor
=16.453 min。
[0415]
实施例108化合物18的制备。
[0416]
以x为溴、r1为pmb、r为ts为例,合成化合物18aab,合成路线为:
[0417][0418]
将化合物17aab(4.00g,5.98mmol,1.0equiv.),氯化钯(106mg,0.598mmol,0.1equiv.)、膦配体(847mg,1.794mmol,0.3equiv.)和磷酸钾(3.81g,17.94mmol,3.0equiv.)置于反应容器,抽换气,氩气保护,向其中加入脱气的干燥dmf(80ml,c=0.075mol/l),置于145 ℃油浴中反应40min。tlc监测原料,将反应液冷却至室温,于0℃加水(40ml)淬灭反应,用乙酸乙酯萃取(60ml
×
3),合并有机层,依次用水(50ml
×
1)、饱和氯化钠溶液(50 ml
×
1)洗。有机层经无水硫酸镁干燥,过滤,浓缩,所得粗品经硅胶柱层析纯化(石油醚/ 二氯甲烷/丙酮=15:15:1,v/v)得类白色泡沫状固体18aab(2.07g,产率72%)。18aab数据: optical rotation:[α]
d25
= 57.1(c=0.8,chcl3).1h nmr(400mhz,cdcl3)δ7.65(d,j=8.0 hz,2h),7.37(d,j=8.4hz,2h),7.26(d,j=8.4hz,2h),7.20(s,1h),6.92
–
6.79(m,4h),6.17 (s,1h),5.26(d,j=11.2hz,1h),4.94
–
4.92(m,2h),3.88(s,3h),3.82(s,3h),3.69(dd,j=13.6, 3.6hz,1h),3.40(s,3h),3.31
–
3.19(m,2h),3.06-2.99(m,1h),2.40(s,3h),2.14(d,j=12.8 hz,1h),1.33
–
1.25(m,1h).
13
c nmr(100mhz,cdcl3)δ180.8,159.6,157.7,152.0,151.2, 146.3,143.9,137.2,130.3,130.0,129.5,129.1,128.0,127.1,124.0,122.4,120.3,114.1,112.4, 74.2,56.0,55.4,54.9,43.6,40.3,39.2,21.6.ir(neat):ν
max
=1673,1648,1613,1513,1480,1277, 1248,1215,1202,1157,718cm-1
.hrms(m/z):[m h]
calculated for c
33h34
no7s
,588.2050;found,588.2051.
[0419]
实施例109-110化合物18的制备。
[0420]
以x为溴、r1为pmb、r为ts为例,合成化合物18aab,合成路线为:
[0421][0422]
实施例109-110中化合物18aab的合成步骤均与实施例108相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示;各组实施例的区别仅在于:在由化合物17aac制备化合物18aac的反应中所用配体不同。结果如下表所示:
[0423][0424]
实施例111化合物18的制备。
[0425]
以x为溴、r1为bn、r为ts为例,合成化合物18aaa,合成路线为:
[0426][0427]
18aab的合成步骤与实施例83相同,合成的试剂及其用量、反应温度等条件均如合成路线中所示。1h nmr(400mhz,cdcl3)δ7.65(d,j=8.4hz,2h),7.46-7.45(m,2h),7.41
–
7.32 (m,3h),7.25(d,j=8.0hz,2h),7.15(s,1h),6.88
–
6.81(m,2h),6.18(s,1h),5.30(s,1h, overlapped),5.28(d,j=12.4hz,1h,overlapped),5.07(d,j=11.6hz,1h),4.93(d,j=3.6hz, 1h),3.87(s,3h),3.69(dd,j=14.0,4.0hz,1h),3.34(s,3h),3.28
–
3.20(m,1h),3.07
–
3.00(m, 1h),2.40(s,3h),2.16(d,j=12.4hz,1h),1.31(dd,j=13.2,5.2hz,1h).
13
c nmr(100mhz, cdcl3)δ180.8,157.7,152.1,151.3,146.2,143.9,137.5,137.2,130.4,123.0,128.8,128.2,128.1, 127.3,127.1,124.2,122.5,120.1,112.5,74.3,56.0,54.9,43.7,40.3,39.2,21.7.ir(neat):ν
max
= 1673,1647,1615,1480,1433,1278,1215,1158,747cm-1
.ir(neat):ν
max
=1673,1647,1615,1480, 1433,1278,1215,1158,747cm-1
.hrms(m/z):[m h]
calculated for c
32h32
no6s
,558.1945;found,558.1940.
[0428]
实施例112化合物19的制备
[0429]
以r1为pmb、r为ts为例,合成化合物19,合成路线为:
[0430][0431]
将化合物18aab(100.0mg,0.170mmol,1.0equiv.)溶于ch2cl2(4ml),冷却至-40℃,加入三氟乙酸(65ul,0.851mmol,5.0equiv.),反应17小时后,升至于0℃继续反应7小时, tlc显示原料消失完全。于0℃加饱和nahco3水溶液(2ml)淬灭反应,用ch2cl2萃取 (5ml
×
3),合并有机层,经无水硫酸镁干燥,过滤,浓缩,所得粗品经硅胶柱层析纯化 (石油醚/丙酮=3:1,v/v)得白色泡沫状固体19(56.0mg,产率70%)。optical rotation:[α]
d25
= 13.8(c=1.44,chcl3).1h nmr(400mhz,cdcl3)δ7.67(d,j=8.2hz,2h),7.45(s,1h), 7.28(s,1h),6.76(d,j=8.4hz,1h),6.60(d,j=8.4hz,1h),6.23(d,j=15.6hz,2h),4.96(d, j=
3.3hz,1h),3.89(s,3h),3.74
–
3.71(m,1h,overlapped),3.71(s,3h),3.30
–
3.18(m,2h), 3.03(td,j=13.2,3.2hz,1h),2.41(s,3h),2.41
–
2.36(m,1h,overlapped),1.31(td,j=12.8,4.8 hz,1h).
13
c nmr(100mhz,cdcl3)δ180.9,157.8,151.3,145.7,143.9,143.5,137.3,129.9, 128.2,127.1,122.5,119.7,110.0,56.4,55.0,43.4,40.5,38.9,37.6,21.7.ir(neat):ν
max
=3350, 2929,1670,1640,1484,1219,1158,1054cm-1
.hrms(m/z):[m h]
calculated for c
25h26
no6s
,468.1475;found,468.1477.
[0432]
实施例113化合物19的制备
[0433]
以r1为pmb、r为ts为例,合成化合物19,合成路线为:
[0434][0435]
将化合物18aab(200.0mg,0.34mmol,1.0equiv.)溶于dmf(3.5ml),于室温向其中滴加氢溴酸(48%水溶液,0.7ml),加毕升至45℃反应20小时。随后将反应液降至室温,补加氢溴酸(48%水溶液,0.3ml),加毕再升至45℃反应15小时。将反应液再次降至室温,补加氢溴酸(48%水溶液,0.3ml),加毕再升至45℃反应5小时,tlc显示原料消失完全。于0℃加饱和nahco3水溶液至不再产生气体,用乙酸乙酯萃取(8ml
×
3),合并有机层,依次用水(5ml
×
1)、饱和氯化钠(5ml
×
1)洗,有机层经无水硫酸镁干燥,过滤,浓缩,所得粗品经硅胶柱层析纯化(石油醚/丙酮=4:1,v/v)得白色泡沫状固体19(137mg, 产率86%)。氢谱数据同实施例112。
[0436]
实施例114化合物19的制备
[0437]
以r1为me、r为ts为例,合成化合物19,合成路线为:
[0438][0439]
将化合物18aac(100.0mg,0.208mmol,1.0equiv.)溶于干燥n,n-二甲基乙酰胺(dmac, 7ml),加入硫氢化钠(68%-72%纯度,66.4mg,0.83mmol,4.0equiv.),于125℃反应1 小时,tlc显示原料消失完全。冷却至0℃,加0.5m hcl水溶液淬灭反应,用乙酸乙酯萃取(5ml
×
4),合并有机层,依次用水(5ml
×
2)、饱和nahco3水溶液(5ml
×
1)、饱和nacl水溶液(5ml
×
1)洗。有机层经无水硫酸镁干燥,过滤,浓缩,所得粗品经硅胶柱层析纯化(石油醚/丙酮=4:1,v/v)得白色固体19(69.0mg,产率71%)。氢谱数据同实施例112。
[0440]
实施例115化合物19的制备
[0441]
以r1为me、r为ts为例,合成化合物19,合成路线为:
[0442]
[0443]
将化合物18aac(100mg,0.208mmol,1.0equiv.)、碳酸铯(102mg,0.312mmol,1.5equiv.) 装入反应试管,抽换气,氩气保护。向其中加入干燥脱气的二甲亚砜(dmso,2ml),苯硫酚(29.0μl,0.281mmol,1.35equiv.),置于150℃油浴反应1小时,tlc显示原料消失完全。冷却至室温,加水淬灭反应,分层,水层用乙酸乙酯萃取(3ml
×
5),合并有机层,依次用水(5ml
×
2)、饱和氯化钠溶液(5ml
×
1)洗。有机层经无水硫酸镁干燥,过滤,浓缩,所得粗品经硅胶柱层析纯化(石油醚/二氯甲烷/丙酮=15:15:1到10:10:1,v/v)得白色固体19(83mg,产率85%)。氢谱数据同实施例112。
[0444]
实施例116化合物19的制备
[0445]
以r1为me、r为ts为例,合成化合物19,合成路线为:
[0446][0447]
将化合物18aac(100mg,0.208mmol,1.0equiv.)、碳酸钾(43mg,0.312mmol,1.5equiv.) 装入反应试管,抽换气,氩气保护。向其中加入干燥脱气的二甲亚砜(dmso,4ml),苯硫酚(32.0μl,0.312mmol,1.5equiv.),置于150℃油浴反应1.5小时,tlc显示原料消失完全。冷却至室温,加水淬灭反应,分层,水层用乙酸乙酯萃取(3ml
×
5),合并有机层,依次用水(5ml
×
2)、饱和氯化钠溶液(5ml
×
1)洗。有机层经无水硫酸镁干燥,过滤,浓缩,所得粗品经硅胶柱层析纯化(石油醚/二氯甲烷/丙酮=15:15:1到10:10:1,v/v)得白色固体19(77mg,产率79%)。氢谱数据同实施例112。
[0448]
实施例117中间体ⅰ的制备
[0449]
以r为ts为例,合成化合物21(即中间体ⅰ),合成路线为:
[0450][0451]
将化合物19(510.0mg,1.09mmol,1.0equiv.)溶于ch2cl2/meoh混合溶液(v/v=1:1, 10ml),冷却至0℃,缓慢加入nabh4(82.5mg,2.18mmol,2.0equiv.),随后将反应液升至室温,反应约15min后tlc检测原料消失完全。将反应液冷却至0℃,加水淬灭反应,分出有机层,水层以二氯甲烷萃取(10ml
×
3),合并有机层,用饱和nacl溶液洗(10ml
×ꢀ
1),无水硫酸镁干燥,过滤,浓缩,得白色泡沫状化合物20粗品,不经纯化,直接进行下一步反应。
[0452]
氩气保护下,将化合物20粗品置于反应瓶,抽换气,氩气保护,加入n,n-二甲基甲酰胺二甲基缩醛(2.5ml),加热至60℃反应约40分钟,tlc监测显示原料反应完全。将反应液减压抽除溶剂,所得粗品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,v/v=5:1到3.5:1),得白色泡沫状固体21(418mg,两步收率85%)。optical rotation:[α]
d25
=
–
117.8(c=0.72, chcl3).1h nmr(400mhz,cdcl3)δ7.73(d,j=8.0,2h),7.30(d,j=8.0hz,2h),6.64(d,j= 8.0hz,1h),6.51(d,j=8.0hz,1h),5.60(d,j=6.4hz,1h),5.19(s,1h),4.98(dd,j=13.6,6.4 hz,2h),3.82(s,3h),3.74(dd,j=12.0,5.2hz,1h),3.59(s,3h),3.26(td,j=13.2,
3.6hz,1h), 3.00(dd,j=18.2,6.8hz,1h),2.89(d,j=18.0hz,1h),2.44(s,3h),1.95(td,j=12.8,5.4hz, 1h),1.74
–
1.70(m,1h).
13
c nmr(100mhz,cdcl3)δ153.0,144.8,143.4,143.1,137.3,132.1, 129.7,129.0,127.4,126.1,119.5,113.2,112.5,95.4,88.6,56.4,55.0,54.4,45.9,38.9,37.1,36.0, 21.6.ir(neat):ν
max
=2922,1603,1502,1234,1155,725cm-1
.hrms(m/z):[m h]
calculated for c
25h26
no5s
,452.1526;found,452.1519.
[0453]
以上所述仅是本发明的优选实施方式,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
