1.本发明涉及生物化学检测领域,尤其涉及一种检测阿尔茨海默症标志物的纳米金生物芯片及其制备方法与应用。
背景技术:
2.阿尔茨海默症(ad)是一种复杂的持续周期非常长的神经退行性疾病,血液标志物的检测对于实现ad早期诊断和普遍筛查具有重要意义。然而,ad血液标志物的含量较低,已经超出了传统检测方法(elisa)的检测范围,因此需要发展高灵敏、高特异性的检测方法来实现ad血液标志物超灵敏检测。
3.研究者们建立了比色法、荧光法、电化学法、电化学发光法等方法进行检测。在这些研究方法中,比色法的结果肉眼直观可见,但灵敏度较低;荧光法虽然灵敏度较比色法略高,但仍达不到皮克级别,且检测真实血液样品时易受血液中自发荧光的干扰,使得结果不准确;电化学发光的灵敏度是几种方法中最高的,但电化学发光需要专业的检测仪器,花费较高。
4.因此,现有技术还存在不足。
技术实现要素:
5.鉴于上述现有技术的不足,本发明的目的在于提供一种检测阿尔茨海默症标志物的纳米金生物芯片及其制备方法与应用,旨在通过金纳米颗粒的引入,利用近红外荧光检测降低背景噪音以及金颗粒放大荧光输出信号的效应,建立高灵敏、高特异性的检测方法来实现ad血液标志物超灵敏检测。
6.本发明的技术方案如下:
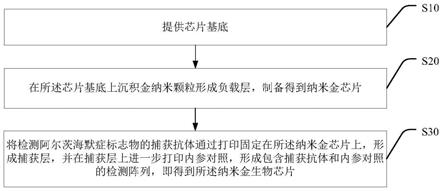
7.第一方面,本发明提供一种检测阿尔茨海默症标志物的纳米金生物芯片的制备方法,其中,包括步骤:
8.提供芯片基底;
9.在所述芯片基底上沉积金纳米颗粒形成负载层,制备得到纳米金芯片;
10.将检测阿尔茨海默症标志物的捕获抗体通过打印固定在所述纳米金芯片上,形成捕获层,并在捕获层上进一步打印内参对照,形成包含捕获抗体和内参对照的检测阵列,即得到所述纳米金生物芯片。
11.所述的检测阿尔茨海默症标志物的纳米金生物芯片的制备方法,其中,所述纳米金芯片表面的金纳米颗粒组成多个非连续的、间距均匀的金岛,所述金岛结构可产生等离子体共振。
12.所述的检测阿尔茨海默症标志物的纳米金生物芯片的制备方法,其中,所述金岛的面积为100-100000nm2,相邻两个金岛之间的距离为5-50nm。
13.所述的检测阿尔茨海默症标志物的纳米金生物芯片的制备方法,其中,所述检测
阿尔茨海默症标志物的捕获抗体可形成直径为300-500μm的捕获圆斑。
14.所述的检测阿尔茨海默症标志物的纳米金生物芯片的制备方法,其中,所述检测阿尔茨海默症标志物的捕获抗体包括aβ40抗体或aβ42抗体中的其中一种。
15.第二方面,本发明提供一种检测阿尔茨海默症标志物的纳米金生物芯片,其中,所述纳米金生物芯片包括芯片基底、负载层和捕获层,按照上述任一制备方法制备而成。
16.第三方面,本发明提供一种检测阿尔茨海默症标志物的纳米金生物芯片的应用,其中,将如前所述纳米金生物芯片应用于阿尔茨海默症标志物的检测。
17.所述的检测阿尔茨海默症标志物的纳米金生物芯片的应用,其中,将所述纳米金生物芯片应用于阿尔茨海默症标志物检测的方法包括步骤:
18.将检测阿尔茨海默症标志物的捕获抗体与荧光分子进行偶联;
19.将所述纳米金生物芯片放置于芯片槽中,并向反应孔中加入封闭液,室温封闭;
20.将待测的阿尔茨海默症标志物与已偶联荧光分子的捕获抗体混合后,加入到所述反应孔中,37℃震荡孵育1h;
21.反应完成后,清洗反应孔并去除杂质,之后放入荧光扫描仪中扫描荧光图像;
22.计算扫描得到的荧光图像的荧光数值,并基于所述荧光数值计算待测的阿尔茨海默症标志物浓度。
23.所述的检测阿尔茨海默症标志物的纳米金生物芯片的应用,其中,所述将检测阿尔茨海默症标志物的捕获抗体与荧光分子进行偶联包括步骤:
24.将所述检测阿尔茨海默症标志物的捕获抗体和荧光分子按照1:10的摩尔比混合后进行反应;
25.反应完成后,用nap-5柱分离未与捕获抗体偶联的荧光分子;
26.去除未与捕获抗体偶联的荧光分子之后,再向nap-5柱中加入溶剂,并收集滴落的溶液,即得到与荧光分子偶联的捕获抗体。
27.所述的检测阿尔茨海默症标志物的纳米金生物芯片的应用,其中,待测的阿尔茨海默症标志物包括aβ40蛋白或aβ42蛋白。
28.有益效果:本发明提供了一种检测阿尔茨海默症标志物的纳米金生物芯片的制备方法,将金纳米颗粒沉积在芯片基底上,使所述芯片表面分布着许多非连续的、间距均匀的金纳米颗粒,并将金纳米颗粒的大小控制在20-50nm,间距控制在5-50nm,在基底上形成肉眼可见的金膜,构建纳米金芯片。再将检测阿尔茨海默症标志物的捕获抗体通过打印固定在所述纳米金芯片上,形成捕获层,得到纳米金生物芯片。其中,金纳米颗粒间隙导致产生局部电场,使金纳米颗粒上的荧光分子发射强度提高,且金纳米颗粒表面等离子体与荧光分子发生共振,实现荧光放大,提高检测信号。另外,金纳米颗粒还可以增加比表面积,增加检测阿尔茨海默症标志物的捕获抗体的结合位点。不仅如此,本发明采用的近红外荧光分子,能够有效避开基底材料的本底荧光信号,提高信噪比。最终,本发明提供的纳米金生物芯片,通过检测近红外荧光降低背景噪音、增加抗体结合位点以及金纳米颗粒增强荧光输出信号,提高了阿尔茨海默症生物标志物检测的灵敏度,实现了ad标志物的超灵敏检测。
附图说明
29.图1为本发明实施例中一种检测阿尔茨海默症标志物的纳米金生物芯片的制备方
法的流程示意图。
30.图2为本发明实施例中制备得到的纳米金芯片的示意图。
31.图3为本发明实施例中在纳米金芯片上通过打印固定捕获抗体的示意图。
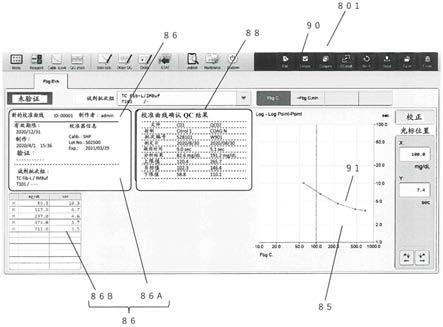
32.图4为本发明实施例中aβ40的荧光图像以及标准曲线。
33.图5为本发明实施例中aβ42的荧光图像以及标准曲线。
具体实施方式
34.本发明提供一种检测阿尔茨海默症标志物的纳米金生物芯片及其制备方法与应用,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
35.本发明实施例提供一种检测阿尔茨海默症标志物的纳米金生物芯片的制备方法,如图1所示,包括步骤:
36.s10、提供芯片基底;
37.s20、在所述芯片基底上沉积金纳米颗粒形成负载层,制备得到纳米金芯片;
38.s30、将检测阿尔茨海默症标志物的捕获抗体通过打印固定在所述纳米金芯片上,形成捕获层,并在捕获层上进一步打印内参对照,形成包含捕获抗体和内参对照的检测阵列,即得到所述纳米金生物芯片。
39.在一些实施方式中,所述芯片基底包括玻璃基底、硅片或塑料基底,但不限于此。
40.在一些实施方式中,在所述芯片基底上沉积金纳米颗粒的方法包括湿法、电化学方法,但不限于此。
41.优选的,采用湿法在所述芯片基底上沉积金纳米颗粒。这是因为湿法沉积制粒能形成具有特定性质的颗粒,有利于金纳米颗粒组成相应的金岛。
42.在一些实施方式中,步骤s20制备得到的纳米金芯片如图2所示。
43.在一些实施方式中,金纳米颗粒的大小控制在20-50nm。
44.在一些实施方式中,所述纳米金芯片表面的金纳米颗粒组成多个非连续的、间距均匀的金岛,所述金岛结构可产生等离子体共振。
45.在一些实施方式中,所述金岛的面积为100-100000nm2,相邻两个金岛之间的距离为5-50nm。这种金岛结构能够产生等离子体共振特性,能够增强近红外的荧光效应和拉曼散射效应。这是因为,金纳米颗粒间隙导致产生局部电场,使金颗粒上的荧光分子发射强度提高,且金纳米颗粒表面等离子体与荧光分子发生共振,实现荧光放大的效果。
46.将金纳米颗粒的大小控制在20-50nm,间距控制在5-50nm,可以在基底上形成肉眼可见的金膜,其分布更为均匀。
47.在一些实施方式中,在所述纳米金芯片上通过打印固定检测阿尔茨海默症标志物的捕获抗体的示意图如图3所示。所述检测阿尔茨海默症标志物的捕获抗体可形成直径为300μm-500μm的捕获圆斑。进行检测时,待测的阿尔茨海默症标志物与捕获抗体在捕获圆斑处发生反应,避免了与内参对照以及所述阿尔茨海默症标志物自身之间的干扰。
48.在一些具体的实施方式中,利用微量点样仪将检测阿尔茨海默症标志物的捕获抗体打印固定在所述纳米金芯片上。通过微量点样仪的微针(孔径40-400μm)将抗体溅射到纳米金芯片表面,液滴体积可以通过电流调节。其中,检测阿尔茨海默症标志物的捕获抗体的
浓度为0.1-1.0μg/ml。
49.在一些具体的实施方式中,在捕获层上打印鸡igy抗体作为内参对照。
50.在一些实施方式中,所述检测阿尔茨海默症标志物的捕获抗体包括aβ40抗体或aβ42抗体中的其中一种,但不限于此,还可以为其他的阿尔茨海默症标志物的抗体。
51.阿尔茨海默症患者的病理特征之一是大脑中存在老年斑。老年斑中含有不同淀粉样蛋白,其中最丰富的是β淀粉样蛋白(1-42)和β淀粉样蛋白(1-40)即aβ42和aβ40。与脑脊液(csf)中的对照组相比,aβ42在ad患者降低,而aβ40呈上升的趋势。因此aβ40与aβ42被认为是诊断阿尔茨海默症的有用生物标志物。
52.本发明实施例还提供一种检测阿尔茨海默症标志物的纳米金生物芯片,所述纳米金生物芯片包括芯片基底、负载层和捕获层,按照如前任一所述制备方法制备而成。
53.纳米金生物芯片由芯片基底、负载层、捕获层三个部分组成。负载层由等离子体纳米金颗粒组成,这些金纳米颗粒组成岛面积为100-100000nm2的非连续金岛,相邻两个金岛之间的距离为5-50nm。多个非连续的金岛在基底的表面均匀分布。这种结构产生的等离子体共振特性,能够增强近红外的荧光效应和拉曼散射效应。而捕获层是由目标抗原的捕获抗体组成,是在等离子体纳米金芯片上利用微量点样仪将抗体溶液打印而形成。打印形成的捕获圆斑直径为300μm-500μm。之后,在捕获层上进一步打印鸡igy抗体作为内参对照。即将目标蛋白的捕获抗体和内参抗体同时固定在纳米金生物芯片上,形成检测阵列。
54.所述的纳米金生物芯片是基于荧光强弱确定待检测生物标志物浓度的一类检测装置,其采用的近红外荧光分子,能够有效避开基底材料的本底荧光信号,提高信噪比。目前主流的荧光检测的局限性在于波长范围通常在300nm到700nm之间,这一区间范围内,样品和所需耗材如nc膜、微孔板、玻璃等基底材料有自发荧光,检测背景噪音大。而本发明采用的近红外荧光,波长范围在700nm到800nm之间,能有效避免基底材料的本底荧光,提高信噪比;并且这一波段的荧光穿透性强,能够大大降低荧光散射效应,提高检测灵敏度。
55.其次,金纳米颗粒之间存在间隙,导致产生局部电场,提高金颗粒上的荧光分子发射强度,且金颗粒表面等离子体与荧光分子发生共振,具有放大荧光强度,提高检测信号的效果。另外,所述纳米金生物芯片表面的金纳米颗粒还可以增加比表面积,增加捕获抗体的结合位点。
56.本发明实施例还提供一种检测阿尔茨海默症标志物的纳米金生物芯片的应用,其中,将如上所述纳米金生物芯片应用于阿尔茨海默症标志物的检测。
57.在一些实施方式中,将所述纳米金生物芯片应用于阿尔茨海默症标志物的检测包括步骤:
58.s100、将检测阿尔茨海默症标志物的捕获抗体与荧光分子进行偶联;
59.s200、将所述纳米金生物芯片放置于芯片槽中,并向反应孔中加入封闭液,室温封闭;
60.s300、将待测的阿尔茨海默症标志物与已偶联荧光分子的捕获抗体混合后,加入到所述反应孔中,37℃震荡孵育1h;
61.s400、反应完成后,清洗反应孔并去除杂质,之后放入荧光扫描仪中扫描荧光图像;
62.s500、计算扫描得到的荧光图像的荧光数值,并基于所述荧光数值计算待测的阿
尔茨海默症标志物浓度。
63.在一些实施方式中,步骤s100具体包括:
64.将所述检测阿尔茨海默症标志物的捕获抗体和荧光分子按照1:10的摩尔比混合后进行反应;
65.反应完成后,用nap-5柱分离未与捕获抗体偶联的荧光分子;
66.去除未与捕获抗体偶联的荧光分子之后,再向nap-5柱中加入溶剂,并收集滴落的溶液,即得到与荧光分子偶联的捕获抗体。
67.在一些具体的实施方式中,将检测阿尔茨海默症标志物的捕获抗体与荧光分子irdye800进行偶联。
68.在一些具体的实施方式中,捕获抗体通过1-乙基-3(3-二甲基氨基丙基)碳二亚胺/n-羟基共价偶联荧光分子irdye800,然后用nap-5柱分离未标记的荧光分子irdye800。
69.在一些具体的实施方式中,步骤s200中,所述封闭液为bsa或者酪蛋白,浓度为1%-5%。
70.优选的,所述封闭液浓度为1%。
71.在一些具体的实施方式中,步骤s200中,室温封闭10-40min。
72.在一些具体的实施方式中,步骤s300中,将待测的阿尔茨海默症标志物与已偶联荧光分子的捕获抗体混合之前还包括步骤:将已偶联荧光分子的捕获抗体进行稀释。
73.优选的,将已偶联荧光分子的捕获抗体稀释50-200倍。
74.在一些具体的实施方式中,步骤s300中,室温震荡孵育之前还包括步骤:在震荡仪上震荡30s,将反应孔中的反应液混匀。
75.在一些具体的实施方式中,步骤s400中,清洗反应孔并去除杂质具体包括:用1%-5%的bsa或者酪蛋白清洗反应孔两次,再用pbs清洗一次,最后将所述芯片从反应槽中取出,置于去离子水中清洗,去除杂质。最后用小型离心机将所述芯片甩干备用。
76.在一些具体的实施方式中,步骤s500中,荧光数值与目标蛋白的浓度成正比。
77.在一些实施方式中,待测的阿尔茨海默症标志物包括aβ40蛋白或aβ42蛋白。
78.下面通过具体实施例对本发明一种检测阿尔茨海默症标志物的纳米金生物芯片及其制备方法与应用做进一步的解释说明:
79.实施例1
80.aβ40纳米金生物芯片的制备以及蛋白检测
81.1、纳米金生物芯片的制备
82.(1)在玻璃基底上通过湿法沉积金纳米颗粒,得到纳米金芯片;
83.(2)利用微量点样仪将浓度为1.0μg/ml的aβ40的捕获抗体打印在纳米金芯片上;
84.(3)在芯片上进一步打印鸡igy抗体作为内参对照,即得到纳米金生物芯片;
85.2、捕获抗体与荧光分子irdye800的偶联
86.(4)将aβ40的捕获抗体和荧光分子irdye800按照1:10的摩尔比混合,反应半小时,再混合均匀,继续反应半小时;
87.(5)反应完成后,加入适量pbs使反应体系体积达到500μl;
88.(6)用10ml的pbs加入nap-5柱中,清洗柱子,当柱子中溶液自由滴落完全后,将步骤(5)的混合溶液加入柱子中;
89.(7)待滴落完全后,再加入500μl的pbs,此时开始收集,即获得irdye800标记的aβ40的捕获抗体,将其分装后避光储存在-20℃冰箱备用;
90.3、获得标准曲线
91.(8)将制备的纳米金生物芯片置于芯片槽中,在反应孔中加入100μl的1%的bsa,室温封闭40min,倒去封闭液;
92.(9)将aβ40蛋白标准品稀释成20ng-0.1ng浓度梯度的蛋白溶液,将步骤(7)得到的irdye800标记的aβ40的捕获抗体稀释100倍(稀释50-200倍均可),并将不同浓度梯度的蛋白溶液与已稀释的捕获抗体混合,之后滴加100μl的混合溶液在反应孔中,在震荡仪上震荡30s,混匀,然后放置于孵育仪中37℃震荡混匀1h;
93.(10)反应完成后,用1%的bsa清洗反应孔两次,再用pbs清洗一次,最后将芯片从反应槽中取出,放于去离子水中清洗,去除杂质,最后用小型离心机甩干芯片,将其放入芯片扫描仪中扫描荧光图像;
94.(11)基于荧光图像分析计算出荧光数值,荧光数值与目标蛋白的浓度成正比,获得aβ40的标准曲线;
95.4、阿尔茨海默症标志物的检测
96.(12)将制备的纳米金生物芯片置于芯片槽中,在反应孔中加入100μl的1%的bsa,室温封闭40min,倒去封闭液;
97.(13)取待测的aβ40蛋白,与经过稀释的步骤(7)得到的irdye800标记的aβ40的捕获抗体混合,之后滴加100μl的混合溶液在反应孔中,在震荡仪上震荡30s,混匀,然后放置于孵育仪中37℃震荡混匀1h;
98.(14)反应完成后,用1%的bsa清洗反应孔两次,再用pbs清洗一次,最后将芯片从反应槽中取出,放于去离子水中清洗,去除杂质,最后用小型离心机甩干芯片,将其放入芯片扫描仪中扫描荧光图像;
99.(15)基于荧光图像分析计算出荧光数值,代入标准曲线计算待测aβ40蛋白的浓度。
100.aβ40的荧光图像以及标准曲线如图4所示,其中,y=0.39x 0.51,r2=0.9658。
101.实施例2
102.aβ42纳米金生物芯片的制备以及蛋白检测
103.aβ42纳米金生物芯片的制备与实施例1中aβ40纳米金生物芯片的制备方法的区别是将aβ42的捕获抗体打印在纳米金芯片上,得到aβ42纳米金生物芯片;
104.aβ42蛋白检测与实施例1中aβ40蛋白检测的区别是采用aβ42蛋白标准品获得aβ42的标准曲线,且待测蛋白为aβ42蛋白。
105.aβ42的荧光图像以及标准曲线如图5所示,其中,y=0.55x 0.34,r2=0.994。
106.综上所述,本发明提出了一种检测阿尔茨海默症标志物的纳米金生物芯片的制备方法,将金纳米颗粒沉积在芯片基底上,使所述芯片表面分布着许多非连续的、间距均匀的金纳米颗粒,并将金纳米颗粒的大小控制在20-50nm,间距控制在5-50nm,在基底上形成肉眼可见的金膜,构建纳米金芯片。再将检测阿尔茨海默症标志物的捕获抗体通过打印固定在所述纳米金芯片上,形成捕获层,得到纳米金生物芯片。其中,金纳米颗粒间隙导致产生局部电场,使金纳米颗粒上的荧光分子发射强度提高,且金纳米颗粒表面等离子体与荧光
分子发生共振,实现荧光放大,提高检测信号。另外,金纳米颗粒还可以增加比表面积,增加检测阿尔茨海默症标志物的捕获抗体的结合位点。不仅如此,本发明采用的近红外荧光分子,能够有效避开基底材料的本底荧光信号,提高信噪比。最终,本发明提供的纳米金生物芯片,通过检测近红外荧光降低背景噪音、增加抗体结合位点以及金纳米颗粒增强荧光输出信号,提高了阿尔茨海默症生物标志物检测的灵敏度,实现了ad标志物的超灵敏检测。
107.应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。