1.本发明涉及一种耐水解型亚磷酸酯配体及其制备方法,还涉及其在烯烃氢甲酰化制备线性醛中的应用。
背景技术:
2.氢甲酰化是一种以烯烃为原料来制备多一个碳原子醇的合成方法,在工业化生产中有着巨大的应用。目前羰基合成过程中主要的攻克方向为得到高产率的线性醛/醇。
3.目前已有工业化的催化剂体系中以rh为活性金属、双齿亚磷酸酯配体的体系利用大咬合角,能提高直连醛的选择性,但是在微量水含量的体系中由于亚磷酸酯基团暴露在水中易水解,从而增加生产成本,同时水解而成的三价磷仍可催化氢甲酰化反应,导致体系的选择性变差,同时会使二缩醛的量增加。
4.专利cn1072691c提出了一种添加有机胺与金属盐的方法来提高亚磷酸酯的稳定性,但有机胺会使氢甲酰化反应中产物醛进行进一步缩聚;专利cn103702758a通过添加环氧化合物来提高亚磷酸酯的稳定性,但在实际操作中仍有可能被氧化。
5.因此,亟需开发一种经济、稳定性好的配体来制造线性醛。
技术实现要素:
6.为克服现有技术中存在的上述缺陷,本发明的目的是提供一种耐水解亚磷酸酯配体,所述配体耐水解稳定性好,且具有高反应活性。
7.本发明的另一个目的在于提供所述配体的制备方法。
8.本发明的再一个目的是提供一种所述配体在烯烃氢甲酰化制备线性醛中的应用,具有高反应活性和线性选择性。
9.为实现上述目的,本发明采用如下技术方案:
10.本发明提供一种耐水解亚磷酸酯配体,其结构如式1所示:
[0011][0012]
本发明所述耐水解亚磷酸酯配体,耐水解性经30次循环套用后小于0.3%。
[0013]
本发明还提供了一种上述式1所示耐水解亚磷酸酯配体的制备方法,步骤包括:
[0014]
1)将2-氨基苯酚、六甲基亚磷酸三酰胺、催化剂1、溶剂1混合,反应生成中间体m1,然后向体系中加入n-溴代琥珀酰亚胺(nbs)反应生成中间体m2;
[0015]
2)将双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦、2-羟基吡咯、催化剂2、溶剂2混合,反应生成中间体m3,然后向体系中加入液溴反应生成中间体m4;
[0016]
3)将中间体m4、联硼酸频哪醇酯、磷酸钾、催化剂3、溶剂3混合,反应生成中间体m5;
[0017]
4)将中间体m2、中间体m5、磷酸钾、催化剂4、溶剂4混合,反应生成式1所示耐水解亚磷酸酯配体。
[0018]
本发明步骤1)中,所述2-氨基苯酚与六甲基亚磷酸酰胺的摩尔比为3.0-10.0:1,优选3.5-4.5:1;
[0019]
所述n-溴代琥珀酰亚胺与六甲基亚磷酸三酰胺的摩尔比为1.0-3.0:1,优选1.2-1.5:1
[0020]
所述催化剂1选自有机胺类化合物,优选三乙胺、三甲胺,更优选三乙胺;优选地,所述催化剂1用量为2-氨基苯酚摩尔量的1-4%,优选1.5-2.5%;
[0021]
所述溶剂1选自含氯有机溶剂、呋喃类溶剂,优选四氢呋喃、氯仿、二氯甲烷、氯苯中的任意一种或至少两种的组合,更优选二氯甲烷和/或四氢呋喃;优选地,所述溶剂用量为六甲基亚磷酸三酰胺摩尔量的3.0-6.0倍,优选4.0-6.0倍。
[0022]
本发明步骤1)中,所述生成中间体m1的反应,反应温度为80-140℃,优选90-110℃,反应时间为1.0-5.0h,优选2.5-3.5h;
[0023]
所述生成中间体m2的反应,反应温度为(室温)20-30℃,优选25-30℃,反应时间为0.5-3.0h,优选0.5-1.0h;
[0024]
本发明步骤1)中,所述反应完成后,还包括分离、精制等后处理过程,为本领域常规操作,本发明不做特别要求。
[0025]
本发明步骤1)中所述反应,以中间体m2计总收率可达80%以上,反应过程可表示如下:
[0026][0027]
本发明步骤2)中,所述双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦结构如式2所示:
[0028][0029]
所述双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦技术人员可采用现有技术中已公开的任意可实现方法制备得到,在一些具体实施方案中,优选采用的制备方法步骤包括:将3-(2-乙氧基乙氧基)丙醇、三氯化磷溶解到溶剂中,在催化剂条件下反应制得;
[0030]
优选地,所述3-(2-乙氧基乙氧基)丙醇与三氯化磷的摩尔比为2.2-4.0:1,优选
2.2-2.5:1;
[0031]
优选地,所述催化剂为碱金属磷酸盐,更优选为磷酸钾和/或磷酸钠;优选地,所述催化剂加入量为3-(2-乙氧基乙氧基)丙醇摩尔量的1.0-3.0倍,优选1.0-1.5倍;
[0032]
优选地,所述溶剂为氯代烷烃,优选为二氯甲烷;优选地,所述溶剂加入量为3-(2-乙氧基乙氧基)丙醇摩尔量的1.0-3.0倍,优选1.0-2.0倍;
[0033]
优选地,所述反应在冰水浴下进行;反应时间为1.0-3.0h,优选1.0-2.0h。
[0034]
本发明步骤2)中,所述2-羟基吡咯与双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦的摩尔比为1.0-5.0:1,优选1.0-2.0:1;
[0035]
所述液溴与双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦的摩尔比为1.0-3.0:1,优选的为1.0-1.5:1;
[0036]
所述催化剂2选自有机胺类化合物,优选三乙胺、三甲胺,优选三乙胺;优选地,所述催化剂2用量为双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦摩尔量的1.0-2.0倍,优选1.0-1.2倍;
[0037]
所述溶剂2为苯及其衍生物、烷基氯类溶剂,优选苯、甲苯、氯仿中的任意一种或至少两种的组合,更优选氯仿;优选地,所述溶剂用量为p1摩尔量的3.0-6.0倍,优选4.5-5.0倍。
[0038]
本发明步骤2)中,所述生成中间体m3的反应,反应温度为40-130℃,优选60-80℃;反应时间为1.0-10h,优选1.0-2.0h;
[0039]
所述生成中间体m4的反应,反应温度为25-60℃,优选35-45℃;反应时间为0.5-3.0h,优选1.0-1.5h;
[0040]
本发明步骤2)中,所述反应完成后,还包括分离、精制等后处理过程,为本领域常规操作,本发明不做特别要求。
[0041]
本发明步骤2)中所述反应,以中间体m4计总收率可达80%以上,反应过程可表示如下:
[0042][0043]
本发明步骤3)中,所述联硼酸频哪醇酯与中间体m4的摩尔比为1.0-5.0:1,优选1.0-1.5:1;
[0044]
所述磷酸钾与中间体m4的摩尔比为1.0-5.0:1,优选1.0-1.5:1;
[0045]
所述催化剂3选自金属钯有机催化剂,优选1,1'-双二苯基膦二茂铁二氯化钯、四三苯基膦钯,更优选1,1'-双二苯基膦二茂铁二氯化钯;优选地,所述催化剂3与中间体m4的摩尔比为0.001-0.01:1,优选的为0.001-0.003:1;
[0046]
所述溶剂3选自苯及其衍生物、含氯有机溶剂,优选苯、甲苯、二氯甲烷中的任意一种或至少两种的组合,更优选二氯甲烷;优选地,所述溶剂用量为联硼酸频哪醇酯摩尔量的8.0-10.0倍,优选8.0-9.0倍。
[0047]
本发明步骤3)中,所述反应,反应温度为50-100℃,优选75-85℃;反应时间为0.5-3.0h,优选1.0-1.5h。
[0048]
本发明步骤3)中,所述反应完成后,还包括分离、精制等后处理过程,为本领域常规操作,本发明不做特别要求,优选采用重结晶纯化中间体m5。
[0049]
本发明步骤3)中所述反应,收率可达90%以上,反应过程可表示如下:
[0050][0051]
本发明步骤4)中,所述中间体m5与中间体m2的摩尔比为1.0-5.0:1,优选1.0-1.5:1;
[0052]
所述磷酸钾与中间体m2的摩尔比为0.01-0.1:1,优选0.02-0.05:1;
[0053]
所述催化剂4选自溴化烷基胺类化合物,优选四丁基溴化铵、四甲基溴化铵等,更优选四丁基溴化铵;优选地,所述催化剂4与中间体m2的摩尔比为1.0-5.0:1,优选2.0-3.0:1;
[0054]
所述溶剂4为水和/或二氯甲烷,优选水;优选地,所述溶剂加入量为m2摩尔量的40-80倍,优选40-60倍。
[0055]
本发明步骤4)中,所述反应,反应温度为50-100℃,优选60-70℃;反应时间为1.0-10.0h,优选8.0-10.0h。
[0056]
本发明步骤4)中,所述反应完成后,还包括分离、精制等后处理过程,为本领域常规操作,本发明不做特别要求,优选采用重结晶纯化耐水解亚磷酸酯配体
[0057]
本发明步骤4)中所述反应,收率可达95%以上,反应过程可表示如下:
[0058][0059]
本发明所述的耐水解亚磷酸酯配体可用于催化烯烃氢甲酰化反应制备线性醛;
[0060]
优选地,适用本发明耐水解亚磷酸酯配体的所述烯烃为c2-c10的单烯烃或二烯烃,优选为丙烯、1-丁烯、1,3-丁二烯、戊烯、辛烯、庚烯。
[0061]
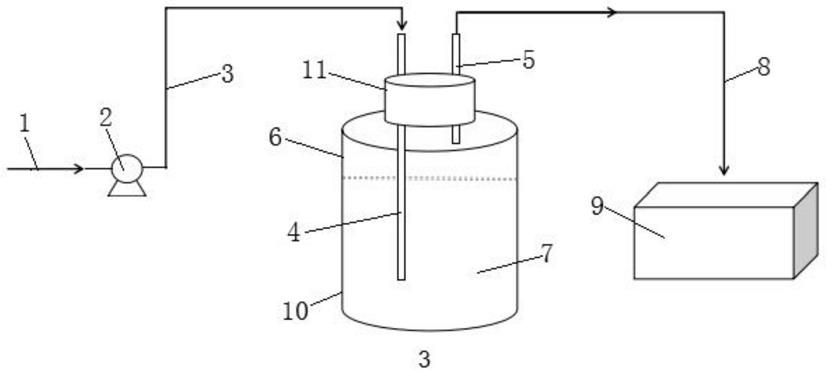
一种烯烃氢甲酰化制备线性醛的方法,步骤包括:
[0062]
将催化剂、所述耐水解亚磷酸酯配体溶解于溶剂中,随后加入烯烃,并通入合成
气,升温至反应温度进行氢甲酰化反应,反应过程通过合成气控制反应压力,反应一定时间得到线性醛;
[0063]
本发明所述催化剂选自过渡金属化合物,所述过渡金属化合物选自醋酸铑、辛酸铑、乙酰丙酮铑、乙酰丙酮羰基铑、二羰基乙酰丙酮铑、三苯基膦乙酰丙酮铑、醋酸钴、辛酸钴、乙酰丙酮钴、乙酰丙酮羰基钴、三苯基膦乙酰丙酮钴中的任意一种或至少两种的组合,优选为二羰基乙酰丙酮铑和/或三苯基膦乙酰丙酮钴;
[0064]
优选地,所述催化剂与烯烃的摩尔比为0.001-0.03:1,优选0.005-0.01:1。
[0065]
本发明所述耐水解亚磷酸酯配体与催化剂的摩尔比为30-100:1,优选40-70:1。
[0066]
本发明所述溶剂为苯及其衍生物,优选苯和/或甲苯;
[0067]
优选地,所述溶剂与催化剂的摩尔比为100-500:1,优选200-400:1。
[0068]
优选地,所述合成气中co/h2摩尔比为1:0.5-2.0,优选1:0.5-1.0。
[0069]
本发明所述氢甲酰化反应,反应压力为1.0-10.0mpag,优选1.0-6.0mpag;反应温度为80-200℃,优选90-120℃,反应时间为1.0-5.0h,优选2.0-3.0h。
[0070]
本发明所述氢甲酰化反应,转化率可达98%以上,选择性达98%以上,二缩醛选择性降低至0.5%以下。耐水解性经30次循环套用后,水解性仍低于0.4%。
[0071]
本发明所述耐水解亚磷酸酯配体,同时含有长醚链和含氮芳环的结构,具有耐水解性好,反应活性高的优点,将其用于催化端烯烃氢甲酰化制备线性醛,反应过程中亚磷酸酯配体与金属配位时长醚链中的o原子可以与苯环上的nh原子形成氢键,使得柔性醚链包裹住磷原子与苯环之间的空隙,在反应过程中阻碍水分子、氧分子的进入,提升催化剂的耐水解性,从而延长亚磷酸配体的寿命,减少了其他杂质尤其是二缩醛对后期精馏提纯的影响;同时苯环的大位阻使羰基倾向于在位阻小的端基插入,提高了反应选择性。
[0072]
本发明使用该配体催化烯烃氢甲酰化制备线性醛的方法,具有水解稳定性好、催化活性高、线性选择性好(选择性可以达90~95%),催化剂寿命长的优点,尤其是副产物二缩醛选择性显著降低,后期精馏产品纯度提高。本发明制备线性醛的方法具有工艺简便、成本与能耗低、生产安全性好、所得产品质量高等多重优点,特别适用于大规模的工业化生产。
具体实施方式
[0073]
以下结合具体实施例对本发明的技术方案做进一步详细说明。
[0074]
本发明实施例和对比例中使用的主要原料来源如下:
[0075]
1,1'-双二苯基膦二茂铁二氯化钯、联硼酸频哪醇酯、2-羟基吡咯、n-溴代琥珀酰亚胺(nbs)、六甲基亚磷酸酰胺、2-氨基苯酚、二羰基乙酰丙酮铑、三苯基膦乙酰丙酮钴购自百灵威试剂公司;
[0076]
三乙胺、br2、二氯甲烷、甲醇、甲醛购自上海国药试剂有限公司;
[0077]
其余试剂原料如无特别说明,均为普通市售产品;以上试剂均购买后直接使用。
[0078]
本发明实施例和对比例中使用的测试方法如下:
[0079]
产物结构由元素分析仪器测定,仪器为德国elementar公司vario el cube分析仪;
[0080]
色谱分析为agilent 7890b气相色谱仪:安捷伦db-5色谱柱,进样口温度:220℃;
检测器温度:250℃;h2流量:40/min;空气流量:360ml/min。柱箱升温程序为:初始温度20℃,升温速率为20℃/min,保持4min;100-250℃,升温速率15℃/min,保持10min。
[0081]
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
[0082]
实施例1
[0083]
(1)制备耐水解亚磷酸酯配体,步骤为:
[0084]
1)中间体m2的制备:
[0085]
将六甲基亚磷酸三酰胺(1632.0g,10mol)、2-氨基苯酚(3819.5g,35mol)、三乙胺(52.6g,0.52mol)溶于3l二氯甲烷(3975g,46.8mol)中,升温至90℃反应2.5h生成中间体m1,随后向体系中加入n-溴代琥珀酰亚胺nbs(2135.8g,12mol),室温25℃反应0.5h,过滤、40℃加热1.0h烘干后,得到中间体m2(3691.0g,8.5mol),总收率85.0%。
[0086]
元素分析:c:49.82;h:3.92;n:9.71;p:7.18;o:11.04;br:18.33
[0087]
中间体m1结构为:
[0088]
核磁分析数据:1h nmr(500mhz,chloroform-d)δ7.06(dd,3h),7.01(ddd,3h),6.85
–
6.77(m,6h),4.30(d,3h),4.15(d,3h).
[0089]
中间体m2结构为:
[0090]
核磁分析数据:1h nmr(500mhz,chloroform-d)δ7.20(dd,1h),7.07(dd,2h),7.06
–
6.93(m,4h),6.85
–
6.77(m,4h),4.38(s,2h),4.30(d,2h),4.15(d,2h).
[0091]
2)中间体m4的制备:
[0092]
制备双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦(表示为p1):
[0093]
将pcl3(274.7g,2.0mol)与3-(2-乙氧基乙氧基)丙醇(652.1g,4.4mol)溶解到二氯甲烷500ml(662.5g,7.8mol)中,加入催化剂k3po4(934.0g,4.4mol)混合后,在冰水浴中0℃反应1.0h,蒸馏除去溶剂及高沸点原料,得到p1(649.5g,1.8mol)。
[0094]
p1的结构为:
[0095]
核磁分析数据:1h nmr(500mhz,chloroform-d)δ3.98(dt,4h),3.56(s,8h),3.53(q,4h),3.47(t,4h),1.94
–
1.85(m,4h),1.18(t,6h).
[0096]
将p1(3608.1g,10mol)、2-羟基吡咯(830.9g,10mol)、三乙胺(1011.9g,10mol)加入到3.6l氯仿(5372.1g,45mol)中,60℃反应1.0h生成中间体m3;随后将体系降温至35℃,
向其中加入液溴(1598.1g,10mol),保温反应1.0h,经蒸馏除去溶剂后,用二氯甲烷将剩余产品重新溶解,在0℃重结晶得到中间体m4(3890.7g,8.0mol),总收率80%。
[0097]
中间体m3结构为:
[0098]
核磁分析数据:1h nmr(500mhz,chloroform-d)δ9.95(d,1h),6.96(ddd,1h),6.40(dd,1h),6.35(dd,1h),3.91(dt,4h),3.56(s,8h),3.53(q,4h),3.47(t,4h),1.90
–
1.81(m,4h),1.18(t,6h).
[0099]
中间体m4结构为:
[0100]
核磁分析数据:1h nmr(500mhz,chloroform-d)δ8.25(s,1h),6.94(d,1h),6.42(d,1h),3.91(dt,4h),3.56(s,8h),3.53(q,4h),3.47(t,4h),1.90
–
1.81(m,4h),1.18(t,6h).
[0101]
3)中间体m5的制备:
[0102]
将中间体m4(3890.7g,8.0mol)、联硼酸频哪醇酯(2031.5g,8.0mol)碳酸钾(1105.6g,8.0mol)1,1'-双二苯基膦二茂铁二氯化钯(5.85g,0.008mol)混合溶于4.1l二氯甲烷(5435.52g,64mol)中,升温至75℃反应1.0h,过滤除去催化剂后,蒸馏脱除溶剂,得到中间体m5(4631.8g,7.5mol),收率93.7%。
[0103]
元素分析:c:54.01;h:8.52;n:2.58;p:5.84;o:26.95;b:2.10
[0104]
中间体m5结构为:
[0105]
核磁分析数据:1h nmr(500mhz,chloroform-d)δ8.09(s,1h),7.15(d,1h),6.62(d,1h),3.91(dt,4h),3.56(s,8h),3.53(q,4h),3.47(t,4h),1.90
–
1.81(m,4h),1.24
–
1.15(m,18h).
[0106]
4)配体的制备:
[0107]
将中间体m2(4342.3g,10mol)、中间体m5(6175.7g,10mol)、磷酸钾(44.3g,0.2mol)、四丁基溴化铵(6447.4g,20mol)加入到8l水(8000g,444mol)中,升温至60℃反应8.0h,蒸馏除去溶剂,用二氯甲烷加热30℃溶解后降温到10℃重结晶、过滤,得到耐水解亚磷酸酯配体(7227.2g,9.5mol),收率95.0%
[0108]
元素分析:c:56.81;h:6.68;n:7.30;p:8.15;o:21.06
[0109]
催化剂结构为:
[0110]
核磁分析数据:1h nmr(500mhz,chloroform-d)δ9.20(s,1h),7.51(d,1h),7.29(dd,1h),7.16(d,1h),7.07(dd,2h),7.01(ddd,2h),6.85
–
6.77(m,5h),6.64(d,1h),4.26(d,3h),4.14(dd,3h),3.91(dt,4h),3.56(s,8h),3.53(q,4h),3.47(t,4h),1.90
–
1.81(m,4h),1.18(t,6h).
[0111]
(2)丙烯氢甲酰化制备正丁醛,步骤为:
[0112]
将三苯基膦乙酰丙酮钴、上述步骤(1)制备的耐水解亚磷酸酯配体溶于苯溶剂中,随后加入丙烯混合均匀,丙烯、三苯基膦乙酰丙酮钴、配体、苯摩尔比为1:0.005:0.2:1,加入到反应釜中,并通入合成气(co/h2摩尔比为1:1)控制体系压力为1.0mpag,在合成气氛围、温度90℃下反应1.0h,由气相色谱分析得到正丁醛;丙烯转化率为99.3%,正丁醛选择性为96.7%,副产二缩醛选择性为0.2%。
[0113]
反应液放置48h后,检测其中水含量为0.55wt%,测试配体含量较反应前配体初始加入量降低为0.12%,亚磷酸酯配体水解率为0.08%。
[0114]
实施例2
[0115]
(1)制备耐水解亚磷酸酯配体,步骤为:
[0116]
1)中间体m2的制备:将六甲基亚磷酸酰胺(1632.0g,10mol)、2-氨基苯酚(4910.8g,45mol)、三乙胺(114.3g,1.13mol)溶于3.2l二氯甲烷(4240g,49.9mol)中,升温至110℃反应3.5h生成中间体m1,随后向体系中加入n-溴代琥珀酰亚胺nbs(2669.8g,15mol),室温30℃反应1.0h,过滤、40℃加热1.0h烘干后,得到中间体m2(3777.8g,8.7mol),总收率87%。
[0117]
2)中间体m4的制备:
[0118]
制备双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦(表示为p1):
[0119]
将pcl3(274.7g,2.0mol)与3-(2-乙氧基乙氧基)丙醇(1185.6g,8.0mol)溶解到二氯甲烷500ml(662.5g,7.8mol)中,加入催化剂k3po4(2802.0g,12mol)混合后,在冰水浴中0℃反应1.0h,蒸馏除去溶剂及高沸点原料,得到p1(606.2g,1.68mol)。
[0120]
将p1(3608.1g,10mol)、2-羟基吡咯(1661.8g,20mol)、三乙胺(1214.3g,12mol)加入到4.0l三氯甲烷(5969g,50mol)中,80℃反应2.0h生成中间体m3;随后将体系降温至45℃,向其中加入液溴(2397.2g,15mol),保温反应1.0h,经蒸馏除去溶剂后,用二氯甲烷将剩余产品重新溶解,在0℃重结晶得到中间体m4(3890.7g,8.0mol),总收率80%。
[0121]
3)中间体m5的制备:
[0122]
将中间体m4(3890.7g,8.0mol)、联硼酸频哪醇酯(2285.4g,9.0mol)、碳酸钾
(1243.8g,9.0mol)、1,1'-双二苯基膦二茂铁二氯化钯(17.55g,0.024mol)混合溶解到4.6l二氯甲烷(6115g,72mol)中,升温至85℃反应1.5h,过滤除去催化剂后,蒸馏除去溶剂即可用于下一步中间体m5(4817.1g,7.8mol),收率97.5%。
[0123]
4)配体的制备:
[0124]
将中间体m2(4342.3g,10mol)、中间体m5(9263.6g,15mol)、磷酸钾(110.8g,0.5mol)、四丁基溴化铵(9671.1g,30mol)加入到10l水中(10000g,555mol),升温至60℃反应8.0h,蒸馏除去溶剂,用二氯甲烷加热30℃溶解后降温到10℃重结晶、过滤得到耐水解亚磷酸酯配体(7303.3g,9.6mol),收率95%。
[0125]
(2)1,3-丁二烯氢甲酰化制备己二醛,步骤为:
[0126]
将三苯基膦乙酰丙酮钴、上述步骤(1)制备的耐水解亚磷酸酯配体溶于甲苯溶剂中,随后加入辛烯混合均匀,辛烯与rh(acac)(co)2、配体、甲苯的摩尔比1:0.01:0.7:4加入到反应釜中,并通入合成气(co/h2摩尔比为2:1)控制体系压力为5.0mpag,在合成气氛围、温度110℃下反应2.0h,由气相色谱分析得到线性产物己二醛;辛烯转化率为98.9%,己二醛选择性为97.4%,副产二缩醛选择性为0.23%。
[0127]
反应液放置48h后,检测其中水含量为0.65wt%,测试配体含量较反应前配体初始加入量降低为0.15%,亚磷酸酯配体水解率为0.1%。
[0128]
实施例3
[0129]
(1)制备耐水解亚磷酸酯配体,步骤为:
[0130]
1)中间体m2的制备:将六甲基亚磷酸酰胺(1632.0g,10mol)、2-氨基苯酚(3395.1g,40mol)、三乙胺(80.9g,0.8mol)溶于3l二氯甲烷(3975g,46.8mol)中,升温至100℃反应3.0h生成中间体m1,随后向体系中加入n-溴代琥珀酰亚胺nbs(2313.8g,13mol),室温30℃反应0.5h,过滤、40℃加热1.0h烘干后得到中间体m2(3691.0g,8.5mol),总收率98.9%。
[0131]
2)中间体m4的制备:
[0132]
制备双(3-(4-丙氧基丁氧基)丙基)次氯酸化膦(表示为p1):
[0133]
将pcl3(274.7g,2.0mol)与3-(2-乙氧基乙氧基)丙醇(889.2g,6.0mol)溶解到二氯甲烷400ml(530g,6.24mol)中,加入催化剂k3po4(1821.3g,7.8mol)混合后,在冰水浴中0℃反应1.0h,蒸馏除去溶剂及高沸点原料,得到p1(627.8g,1.74mol)。
[0134]
将p1(3608.1g,10mol)、2-羟基吡咯(1246.3g,15mol)、三乙胺(1113.1g,11mol)加入到4.0l三氯甲烷(5969g,50mol)中,70℃反应1.5h生成中间体m3;随后将体系降温至45℃,向其中加入液溴(1917.8g,12mol),保温反应1.0h,经蒸馏除去溶剂后,用二氯甲烷将剩余产品重新溶解,在0℃重结晶得到中间体m4(3988.0g,8.2mol),总收率为98.3%。
[0135]
3)中间体m5的制备:
[0136]
将中间体m4(3890.7g,8.0mol)、联硼酸频哪醇酯(3047.2g,12.0mol)、碳酸钾(1658.4g,12.0mol)、1,1'-双二苯基膦二茂铁二氯化钯(11.74g,0.016mol)混合溶解到4.6l二氯甲烷(6115g,72mol)中,升温至85℃反应1.5h,过滤除去催化剂后,蒸馏除去溶剂,得到中间体m5(4817.1g,7.8mol),收率97.5%。
[0137]
4)配体的制备:
[0138]
将中间体m2(4342.3g,10mol)、中间体m5(7410.8g,12mol)、磷酸钾(66.48g,
0.3mol)、四丁基溴化铵(9671.1g,30mol)加入到10l水中(10000g,555mol),升温至60℃反应8.0h,蒸馏除去溶剂,用二氯甲烷加热30℃溶解后降温到10℃重结晶、过滤,得到耐水解亚磷酸酯配体(7455.4,9.8mol),收率98%。
[0139]
(2)辛烯氢甲酰化制备正壬醛,步骤为:
[0140]
将三苯基膦乙酰丙酮钴、上述步骤(1)制备的耐水解亚磷酸酯配体溶于甲苯溶剂中,随后加入辛烯混合均匀,辛烯、三苯基膦乙酰丙酮钴、配体、苯摩尔比为1:0.007:0.35:2,加入到反应釜中,并通入合成气(co/h2摩尔比为2:1)控制体系压力为4.0mpag,在合成气氛围、温度110℃下反应2.5h,由气相色谱分析得到正壬醛;辛烯转化率为98.1%,正壬醛选择性为98.0%,副产二缩醛选择性为0.25%。
[0141]
反应液放置48h后,检测其中水含量为0.50wt%,测试配体含量较反应前配体初始加入量降低为0.14%,亚磷酸酯配体水解率为0.09%。
[0142]
实施例4
[0143]
(1)辛烯氢甲酰化制备正壬醛的循环套用
[0144]
采用实施例3制备的配体,参照实施例3反应条件,即按辛烯、三苯基膦乙酰丙酮钴、配体、苯摩尔比为1:0.007:0.35:2加入到反应釜中,在co/h2质量比为2:1,压力为4.0mpa,温度110℃,反应2.5小时,反应结束后,仅精馏脱去产物醛,反应液循环套用30次,详情如下表:
[0145]
循环次数水含量%转化率%选择性%二缩醛%水解率%50.298.898.60.250.04100.2598.598.60.280.05150.498.398.40.320.08200.6298.198.30.330.15250.6997.998.10.350.22300.797.598.00.380.25
[0146]
对比例1
[0147]
参照实施例1氢甲酰化反应,不同之处仅在于:将本发明耐水解亚磷酸酯配体替换为同摩尔量的中间体m5配体,其它操作步骤及反应条件与实施例1相同。测试反应结果为:转化率20%,选择性30%。
[0148]
反应液放置48h后,检测其中水含量为0.08wt%,测试配体含量较反应前配体初始加入量降低为70.2%,亚磷酸酯配体水解率为29.8%。
[0149]
对比例2
[0150]
参照实施例1氢甲酰化反应,不同之处仅在于:将本发明耐水解亚磷酸酯配体替换为同摩尔量的磷酸三甲酯配体,其它操作步骤及反应条件与实施例1相同。测试反应结果为:转化率60%,选择性50%。
[0151]
反应液放置48h后,检测其中水含量为0.1wt%,测试配体含量较反应前配体初始加入量降低为84.2%,亚磷酸酯配体水解率为15.8%。
[0152]
对比例3
[0153]
参照实施例1氢甲酰化反应,不同之处仅在于:将本发明耐水解亚磷酸酯配体替换为同摩尔量的下式配体(购自sigma-aldrich公司),其它操作步骤及反应条件与实施例1相
同。测试反应结果为:转化率57%,选择性52%。配体结构如下:
[0154][0155]
反应液放置48h后,检测其中水含量为0.20wt%,测试配体含量较反应前配体初始加入量降低为82.5%,亚磷酸酯配体水解率为17.5%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。