一种gpd1l缺失人胚胎干细胞细胞株及其构建方法和应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一种gpd1l缺失人胚胎干细胞细胞株及其构建方法和应用。
背景技术:
2.伴随精准医学(precision medicine)这一概念的提出,开启了人类后基因组医学时代,构建起人类基因突变数据库(hgmd),从分子生物学层面上揭示基因功能与突变后的致病机制,提出科学合理的个性化治疗方案。gpd1l表达的蛋白质为glycerol phosphate dehydrogenase 1
‑
like,主要分布在细胞质与细胞膜下,其参与对心肌细胞膜蛋白nav1.5功能调控,在人类心肌细胞中呈现高表达。在hgmd中,记录gpd1l点突变导致的疾病有brugada综合征、心源性猝死、新生儿猝死综合征等,对人类生命健康构成严重威胁,但对其致病机制仍不十分清楚,深入了解gpd1l功能及突变导致的心脏疾病显得尤为重要,同时也为临床预防治疗提供依据与手段。
3.而目前研究面临的主要问题是缺少有效的人源心肌模型,无法分析心肌从相对正常状态到发生表型改变过程中的病理生理进程,而常规病理学手段只能通过对比正常心肌和病变心肌来推测可能的发病机制。少数研究从术中分离获取病变心肌细胞,对其进行检测,但原代心肌细胞分离时经过长时间酶处理和人工培养后,其生理活性不能维持超过48小时,无法呈现疾病发展进程。以往心脏疾病研究主要采用携带致病基因的动物模型,然而动物心肌细胞与人类心肌细胞相比存在较大的种属和生理差异,例如小鼠心率可达600次/分,而人类则为60~100次/分,种属差异使得心肌细胞间的电生理活动也截然不同,因此不能有效的模拟人类心脏疾病的病理过程。实验模型迫切需求人源心肌细胞,人胚胎干细胞恰恰可以解决这一问题,其具有多项分化潜能,可以通过分化得到大量人源心肌细胞用于研究。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种gpd1l缺失人胚胎干细胞细胞株及其构建方法和应用,为后续研究提供了理想材料。
5.本发明提供了一种gpd1l缺失人胚胎干细胞细胞株,在人胚胎干细胞的基础上,利用crispr/cas9技术敲除gpd1l基因。
6.优选的,敲除gpd1l基因包括在gpd1l双等位基因4号外显子中进行插入突变。
7.优选的,所述人胚胎干细胞包括人胚胎干细胞h9系。
8.本发明提供了所述gpd1l缺失人胚胎干细胞细胞株的构建方法,包括以下步骤:
9.1)设计靶向gpd1l基因的sgrna,克隆至crispr/cas9质粒中,构建靶向gpd1l基因敲除质粒;
10.2)将步骤1)中靶向gpd1l基因敲除质粒转入人胚胎干细胞细胞中,经筛选,得到gpd1l缺失人胚胎干细胞细胞株。
11.优选的,步骤1)中sgrna的核苷酸序列如seq id no:1所示。优选的,所述筛选后,包括验证;
12.所述验证包括dna测序和蛋白质印迹法检测。
13.本发明提供了所述gpd1l缺失人胚胎干细胞细胞株或所述方法构建得到的gpd1l缺失人胚胎干细胞细胞株在研究gpd1l缺失对分化心肌细胞的功能影响中的应用。
14.本发明提供了所述gpd1l缺失人胚胎干细胞细胞株或所述方法构建得到的gpd1l缺失人胚胎干细胞细胞株在gpd1l突变导致的心肌疾病治疗的药物的筛选中的应用。
15.优选的,所述疾病包括gpd1l突变所致心脏病。
16.本发明提供的gpd1l缺失人胚胎干细胞细胞株,在人胚胎干细胞的基础上敲除gpd1l基因。gpd1l缺失人胚胎干细胞具有向心肌细胞分化的能力,具有gpd1l蛋白完全缺失的性质,具有稳定的细胞核型,其干细胞多能性标志物阳性正常,可在scid鼠体内形成三胚层畸胎瘤,且无支原体污染,连续传代稳定性好。鉴于gpd1l缺失人胚胎干细胞细胞株的性能,可以作为生物材料在研究gpd1l缺失对分化心肌细胞的功能影响及疾病治疗药物的筛选中的应用。
附图说明
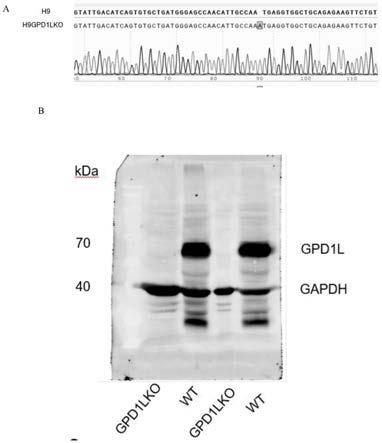
17.图1为gpd1l缺失人胚胎干细胞构建成功验证结果;
18.图2为gpd1l缺失人胚胎干细胞核型鉴定结果;
19.图3为gpd1l缺失人胚胎干细胞多能性标志物免疫荧光鉴定结果;
20.图4为gpd1l缺失人胚胎干细胞在小鼠皮下形成畸胎瘤结果;
21.图5为gpd1l缺失人胚胎干细胞无支原体污染结果;
22.图6为gpd1l缺失人胚胎干细胞分化结果,其中a.在光镜下观察gpd1l缺失人胚胎干细胞来源的心肌细胞形态;b.心肌特异性标志物tnnt2和a
‑
actinin激光共聚焦染色结果。
具体实施方式
23.本发明提供了一种gpd1l缺失人胚胎干细胞细胞株,在人胚胎干细胞的基础上,利用crispr/cas9技术敲除gpd1l基因。
24.在本发明中,敲除gpd1l基因优选包括在gpd1l双等位基因4号外显子中进行插入突变。在本发明实施例中,所述敲除gpd1l基因在gpd1l双等位基因4号外显子中进行插入碱基a,使gpd1l表达后在其蛋白质第157氨基酸位置出现终止密码子tga,导致蛋白质翻译提前终止。所述人胚胎干细胞优选包括人胚胎干细胞h9系。
25.本发明提供了所述gpd1l缺失人胚胎干细胞细胞株的构建方法,包括以下步骤:
26.1)设计靶向gpd1l基因的sgrna,克隆至crispr/cas9质粒中,构建靶向gpd1l基因敲除质粒;
27.2)将步骤1)中靶向gpd1l基因敲除质粒转入人胚胎干细胞中,经筛选,得到gpd1l缺失人胚胎干细胞细胞株。
28.本发明设计靶向gpd1l基因的sgrna,克隆至crispr/cas9质粒中,构建靶向gpd1l基因敲除质粒。
29.在本发明中,sgrna的核苷酸序列优选如seq id no:1(gggagccaacattgccaatg)所示。本发明对所述crispr/cas9质粒的种类没有特殊限制,采用本领域所熟知的crispr/cas9质粒即可。在本发明实施例中,所述crispr/cas9质粒采用pspcas9(bb)
‑
2a
‑
gfp(px458)质粒完成。
30.得到靶向gpd1l基因敲除质粒后,本发明将所述靶向gpd1l基因敲除质粒转入人胚胎干细胞细胞中,经筛选,得到gpd1l缺失人胚胎干细胞细胞株。
31.本发明对所述转入人胚胎干细胞的方法没有特殊限制,采用本领域所熟知的转入方法即可。在本发明实施例中,所述转入的方法包括电转法。所述筛选优选采用抗性药物筛选。所述抗性药物优选包括puro药物筛选。所述puro的浓度包括0.3~0.8μg/ml,或者采用逐渐增加药物浓度(如0.3μg/ml、0.5μg/ml、1.0μg/ml、2.0μg/ml)达到细胞纯化的目的。所述筛选后,优选包括验证。所述验证包括dna测序鉴定和蛋白质印迹法检测。dna水平鉴定包括pcr扩增gpd1l基因后测序,分析测序结果,选择3n 1/
‑
1或者3n 2/
‑
2的序列的细胞株进行蛋白质印迹法检测。所述dna测序鉴定所用的扩增gpd1l基因的引物优选为f(gggagccaacattgccaatg,seq id no:2)和r(cattggcaatgttggctccc,seq id no:3)。扩增得到的pcr产物经过dna测序分析结果提示pam区前方第2个碱基前插入一个a。经过蛋白质印迹法检查gpd1l蛋白发生缺失,表明本发明成功构建了gpd1l缺失人胚胎干细胞细胞株。
32.gpd1l缺失胚胎干细胞能分化为心肌细胞,因此本发明提供了所述gpd1l缺失人胚胎干细胞细胞株或所述方法构建得到的gpd1l缺失人胚胎干细胞细胞株在心肌细胞分化中的应用。
33.鉴于gpd1l突变导致心脏疾病的发生,同时本发明构建的gpd1l缺失胚胎干细胞具有核型正常、干细胞多能性标志物正常、连续传代稳定性好,动物体内可形成三胚层畸胎瘤、无支原体污染等优点,因此本发明提供的所述gpd1l缺失人胚胎干细胞细胞株或所述方法构建得到的gpd1l缺失人胚胎干细胞细胞株在研究gpd1l缺失对分化后心肌细胞的功能影响中的应用,同时本发明提供了所述gpd1l缺失人胚胎干细胞细胞株或所述方法构建得到的gpd1l缺失人胚胎干细胞细胞株在gpd1l突变导致的疾病治疗药物的筛选中的应用。所述疾病优选包括gpd1l突变所致心脏病及相关疾病。所述心脏病相关疾病包括brugada综合征、心源性猝死、新生儿猝死综合征。
34.下面结合实施例对本发明提供的一种gpd1l缺失人胚胎干细胞细胞株及其构建方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
35.实施例1
36.一种gpd1l缺失的人胚胎干细胞细胞株的构建方法,包括如下内容:
37.1、人胚胎干细胞维持培养与传代,
38.(1).生物安全柜中,弃掉旧培养液,pbs缓冲液清洗一次,更换新的e8培养液。
39.(2).细胞生长汇合达到70%~80%时可传代。pbs缓冲液清洗一次,加入0.05mm edta,37℃消化5分钟,轻柔吸掉消化液,加入新的e8培养液,吹打使细胞脱落,传代比例可以根据实验情况决定,一般比例为1:6。
40.2、gpd1l基因敲除sgrna设计,
41.(1)gpd1l的cds序列下载保存:运行snapgene软件,创建新dna文件,将gpd1l的cds区序列粘贴到new dnafile中,命名保存备用;
42.(2)gpd1l基因序列下载保存:打开ncbi网站,搜索gpd1l,下载基因组序列,snapgene保存gpd1l基因组序列并标记外显子,gpd1l基因公共外显子为exon4;
43.(3)sgrna设计:选用外显子为exon4,应用zhang lab网站设计sgrna5'~3'(gggagccaacattgccaatg,seq id no:1);
44.3、gpd1l基因敲除质粒构建,
45.(1)crispr/cas9质粒线性化
46.(质粒为pspcas9(bb)
‑
2a
‑
gfp(px458)购置于addgene)
47.1μg plasmid
48.1μl fastdigestbbsi(fermentas)
49.1μl fastap(fermentas)
50.2μl 10
×
fastdigestbuffer
51.ddh2o补至20μl。
52.应用琼脂糖凝净化消化产物,凝胶回收试剂盒回收线性化质粒。
53.(2)sgrna双链化(sgrna由北京诺赛生物合成,sgrna
‑
f的5端添加cacc,sgrna
‑
r的5端添加aaac),整个反应体系放入95℃水域中,关闭水域电源自然冷却后,反应体系
‑
20℃冻存备用。
54.1μl sgrna
‑
f(100μm)
55.1μl sgrna
‑
r(100μm)
56.1μl 10
×
t4 ligation buffer(neb)
57.6.5μl ddh2o
58.0.5μl t4 pnk(neb)
59.总计10μl。
60.(3)线性质粒和双链sgrna连接,反应体系如下:
61.50ng bbsi digestedplasmid from step 1
62.1μl phosphorylated and annealed oligo duplex from step 2(1:200dilution)
63.1μl t4 dna ligase(neb)
64.1μl t4 dna ligase buffer(neb)
65.ddh2o补充至10μl。
66.室温下孵育30分钟。
67.(4)将步骤(3)中产物转化感受态大肠杆菌,完成重组质粒大肠杆菌转化。重组质粒提取使用无内毒素质粒小提中量试剂盒(endofree mini plasmid kitⅱ,dp118)tiangen。
68.(5)重组质粒的sgrna序列鉴定,测序鉴定引物f:gactatcatat gcttaccgt(seq id no:4)。测序鉴定工作由北京诺赛基因组研究中心有限公司完成。
69.4、gpd1l基因敲除质粒电转入人胚胎干细胞
70.(1).生物安全柜中,无菌1.5ml ep管中,加入100μl电转工作液(cellapy:ca3012040),再加入2.5μg质粒,混匀备用;
71.(2).培养箱中取出胚胎干细胞,消化成细胞悬液移至15ml离心管中,1000rpm离心
3min,弃去上清液,并依次用黄色枪头和白色枪头将上清液吸净;
72.(3).电转杯中电转工作液加入细胞悬液混匀,设定程序后电转;
73.(4).电转结束后,将细胞悬液移至预制培养板中,入培养箱培养,一般电转3天后可以进行抗性药物筛选;
74.(5).0.3μg/ml puro药物筛选1周左右,光镜下可见明显透亮的小阳性克隆出现,也可以逐渐增加药物浓度如0.3μg/ml、0.5μg/ml、1.0μg/ml、2.0μg/ml,使细胞纯化,通常药物筛选7
‑
10天,puro0.8μg/ml,可纯化阳性克隆。
75.5、阳性克隆pcr产物测序与鉴定
76.(1).pcr引物设计:crispr基因敲除系统在对基因进行编辑时,indel通常发生在pam区附近,因此设计pcr引物必须包含产生indel的这段dna序列,所以pcr引物设计必须符合上述规则,同时为了测序结果的可靠稳定,一般上游引物应在pam区上游60bp以外,上游引物必须要设计在该外显子的上游内含子序列上,下游引物在pam区的下游60bp以外;根据设计原则对pam区附近的dna序列设计引物。gpd1l引物5'~3'(f:gggagccaacattgccaatg,seq id no:2;r:cattggcaatgttggctccc,seq id no:3);
77.(2).目标克隆dna提取:克隆细胞悬液50μl转移至pcr管中,设置pcr仪程序:95℃10min;25℃保温,pcr管中加入proteinase k 2μl,再次放入pcr仪,设置pcr仪程序:58℃30min;95℃10min;4℃保温。dna提取完成后
‑
20℃冻存备用;
78.(3).pcr引物tm值:引物设计完成后,需确定引物的最佳tm值。在8联排pcr管中配制20μl pcr体系,包括:10μl 2
×
taq酶mix、1μl f、1μl r、1μl目标克隆dna、7μl ddh2o,pcr程序如下:95℃3min;95℃30s;温度50~65℃30s;72℃30s(38个循环);72℃5min;4℃保温。pcr产物电泳后,选择单一条带且亮度最强,其所对应的tm值即为最佳tm值;
79.(4).目标克隆测序pcr反应体系:25μl 2
×
taq酶mix、2μl f、2μl r、2μl dna、19μl ddh2o,设置pcr程序:95℃3min;95℃30s;tm值30s;72℃30s(38个循环);72℃5min;4℃保温。pcr产物测序分析;
80.(5).测序结果分析:利用snapgene软件,测序结果与gpd1l ccds对比,结合网站https://ice.synthego.com/#/评分,当出现3n 1/
‑
1或者3n 2/
‑
2等情况时,我们会选择这样的克隆,我们经过dna测序分析结果提示pam区前方第2个碱基前插入一个a,结合gpd1l的wb检测,确定gpd1l缺失人胚胎干细胞系建立成功。
81.实施例2
82.gpd1l缺失人胚胎干细胞系中gpd1l蛋白缺失鉴定方法,具体方法为
83.1、gpd1l缺失胚胎干细胞分化为心肌细胞
84.(1).6孔板每孔gpd1l缺失胚胎干细胞加入4ml心肌分化培养液1,培养48小时后,再加入4ml心肌分化培养液2,培养48小时后,加入4ml心肌分化培养液3,此后每2天更换一次心肌分化培养液3;
85.(2).以加入心肌分化培养液1为第一天计算,一般心肌分化第8~10天,显微镜下可见跳动的心肌细胞团,gpd1l缺失胚胎干细胞可以分化心肌细胞。
86.2、gpd1l缺失人胚胎干细胞来源心肌细胞总蛋白提取
87.(1).细胞裂解液制备:m
‑
per mammalian protein extraction reagent 970μl,proteinase inhibitor(100
×
)10μl,phosphatase inhibitors(100
×
)10μl,edta(100
×
)
10μl,ep管中震荡混匀,4℃预冷贮存,6孔板1个孔心肌,需加入30~50μl细胞裂解工作液即可;
88.(2).细胞准备:4℃预冷pbs清洗3次,然后加入4℃预冷细胞裂解液;刮取孔板内所有细胞,细胞悬液转移至ep管中。超声破碎仪冰上破碎至肉眼不见细胞沉淀即可,
‑
80℃短期保存;
89.3、蛋白质变性处理
90.(1).根据总蛋白的体积量,按照说明书比例将蛋白质上样缓冲液与细胞总蛋白混匀备用;
91.(2).在金属浴中,蛋白变性温度可60℃、65℃或者100℃,变性时间一般5min。20μl/管分装后,
‑
20℃可长期保存。
92.4、gpd1l缺失人胚胎干细胞来源心肌细胞蛋白质印迹法
93.(1).分离胶配制:分离胶浓度8%,依次加入30%acr/bis 2.7ml,4
×
分离胶buffer 2.5ml,ddh2o 4.7ml,10%aps 100μl,temed,混匀灌胶,静置约20
‑
30min后凝固,可以准备灌浓缩胶;
94.(2).浓缩胶配制:浓缩胶浓度4%,依次加入30%acr/bis 0.65ml,4
×
浓缩胶buffer 1.25ml,ddh2o 3.05ml,10%aps 50μl,temed 5μl,混匀灌胶,插入齿梳,75%酒精消泡,室温静置20~30min,浓缩胶凝固;
95.(3).电泳液配制:10
×
电泳液用ddh2o稀释至1
×
即可;
96.(4).gpd1l缺失人胚胎干细胞来源心肌细胞蛋白质样品上样:上样孔依次加入蛋白质marker和样品,marker通常可加3~5μl,样品通常每孔加10~20μl,样品孔尽量保证体积一致;
97.(5).电泳:恒压模式,浓缩胶电压为50~80v,分离胶电压为80~120v,根据蛋白质marker判断目标蛋白已经展开停止电泳。
98.(6).电转液配制:按照说明书要求,100ml 10
×
浓储电转液、200ml无水甲醇和700ml ddh2o配制1l电转工作液;
99.(7).转膜:根据胶的大小剪取近似大小1张pvdf膜和6张滤纸(通常大小为9cm
×
6cm)。pvdf膜无水甲醇中浸泡10秒,电转液中平衡5min。三明治法电转,恒流模式300~400ma,转膜时间120min。
100.(8).封闭:pvdf膜tbst清洗1~2min;用1
×
tbst溶液配制5%脱脂牛奶,室温摇床封闭1h;
101.(9).gpd1l蛋白一抗孵育:pvdf膜tbst清洗3次,5min/次,4℃摇床过夜;
102.(10).二抗孵育:pvdf膜tbst清洗3次,5min/次,goat anti
‑
mouse igg(h l)irdye 800cw二抗摇动孵育1h;
103.(11).pvdf膜,tbst清洗3次,5min/次;
104.(12).gpd1l蛋白检测:使用li
‑
cor
‑
odyssey双色红外荧光成像系统成像分析,判断gpd1l蛋白缺失情况。
105.结果见图1。本技术构建的gpd1l缺失人胚胎干细胞来源的心肌细胞未检测到gpd1l蛋白表达,而野生型人胚胎干细胞来源的心肌细胞能够正常表达gpd1l蛋白,这表明所述gpd1l缺失人胚胎干细胞构建成功。
106.实施例3
107.gpd1l缺失人胚胎干细胞核型鉴定试验,具体方法为
108.(1).gpd1l缺失人胚胎干细胞传代至6孔板中,汇合度达到50%左右进行核型分析;
109.(2).更换含100ng/ml colcemid(gibco#15210040)的e8培养液2h;
110.(3).pbs清洗一次,加入0.05mm edta,消化5min,细胞悬液以1000rpm,离心3min,保留细胞沉淀;
111.(4).细胞沉淀中加入37℃0.075mol/l氯化钾3ml混匀,37℃低渗处理20min;
112.(5).加入1ml新近配制的固定液(甲醇:冰醋酸=3:1,体积比)预固定,混匀细胞悬液,1000rpm,离心3min,弃上清;
113.(6).加入步骤(5)固定液3ml,轻柔混匀,室温静置固定20min;
114.(7).1000rpm,离心3min,弃上清,再固定1次;
115.(8).弃上清,加入适量数滴新鲜固定液,轻柔混匀,悬液呈毛玻璃样;
116.(9).取悬液1~2滴,滴至沾有冰水或干燥的洁净载玻片上,高处滴加,尽量分散液滴,载玻片过火,空气干燥,载玻片70℃烘烤2h老化处理;
117.(10).45ml 0.9%生理盐水中加入3ml 0.25%胰蛋白酶溶液,调整溶液ph值至6.8~7.2,37℃预温;
118.(11).胰蛋白酶消化:将需消化处理的玻片放入胰蛋白酶溶液中消化2
‑
3min;
119.(12).0.9%生理盐水漂洗,停止胰蛋白酶消化;
120.(13).吉姆萨工作液染色10
‑
15min,自来水轻洗玻片背面,干燥。光镜观察分析核型并拍照。
121.gpd1l缺失人胚胎干细胞染色体核型46,xx,无缺失和畸形(附图2)。
122.实施例4
123.gpd1l缺失人胚胎干细胞多能性标志物免疫荧光鉴定正常
124.具体方法为
125.(1).固定:选择合适状态的24孔板细胞爬片,pbs清洗后,4%pfa固定30min
126.(2).吸掉4%pfa,pbs洗3次,5min/次;
127.(3).加入0.3%trion x
‑
100,室温打孔8min;
128.(4).pbs,清洗3次,5min/次;
129.(5).3%bsa,室温封闭30min;
130.(6).一抗小鼠单克隆抗体ssea4、一抗小鼠单克隆抗体tra
‑1‑
60、兔多克隆抗体oct4、兔多克隆抗体nanog,比例1:100,3%bsa稀释混匀,覆盖细胞爬片,4℃湿盒中避光孵育过夜;
131.(7).二抗alexa594鸡抗兔igg和alexa488鸡抗鼠,比例1:100,3%bsa稀释混匀,覆盖细胞爬片,室温下避光孵育2h,操作过程需要避光;
132.(8).pbs清洗3次,5min/次;
133.(9).用含dapi的抗荧光衰减封片剂封片,4℃湿盒中保存,共聚焦显微镜下观察拍照。
134.gpd1l缺失人胚胎干细胞ssea4、oct4、tra
‑1‑
60、nanog呈现阳性(附图3)。
135.实施例5
136.gpd1l缺失人胚胎干细胞畸胎瘤形成实验,具体方法如下:
137.(1).将5
×
106个gpd1l缺失人胚胎干细胞悬液接种于scid鼠皮下、腹股沟或后肢肌,注射后1个月左右可见注射部位出现明显瘤状物,8~12周后手术取出瘤体;
138.(2).4%pfa固定瘤状物,经过组织脱水、石蜡包埋、组织切片,he染色,显微镜下发现形成的畸胎瘤有明显外胚层、中胚层、内胚层结构(图4)。可见gpd1l缺失人胚胎干细胞使小鼠皮下形成三胚层畸胎瘤。
139.实施例6
140.gpd1l缺失人胚胎干细胞污染检测,具体方法如下:
141.(1).琼脂糖凝胶浓度1%,溴化乙锭(eb)替代物goldview(翊圣10201es03)对dna染色。
142.(2).pcr法检测支原体,20μl体系:1μl支原体引物f,1μl支原体引物r,1μl gpd1l缺失人胚胎干细胞培养液上清,10μl 2
×
taq酶,7μl ddh2o,pcr程序:94℃2min;94℃30s;55℃30s;72℃30s;38个循环;72℃2min;12℃保温。
143.(3).制胶上样,电泳槽加入1
×
tae电泳缓冲液,液面覆盖过胶面;
144.电泳仪恒压120v,根据ladder,判断目的条带展开情况,电泳时长约为30min,电泳结束后,凝胶放入紫外观察仪中观察拍照。
145.结果表明,gpd1l缺失人胚胎干细胞中并未扩增得到支原体的特异性片段,而阳性对照(pos
‑
ctrl)能够成功扩增支原体特异性片段(附图5)。这表明gpd1l缺失人胚胎干细胞未受支原体污染。
146.实施例7
147.应用gpd1l缺失人胚胎干细胞,小分药方法将其直接分化为gpd1l缺失人心肌细胞
148.(1).gpd1l缺失人胚胎干细胞汇合度达到80%~90%时开始进行心肌分化。
149.(2).吸掉培养液,pbs清洗一次,6孔板每孔加入4ml心肌分化培养液1(北京赛贝生物有限公司),培养48小时。
150.(3).吸掉废液,pbs清洗一次,每孔加入4ml心肌分化培养液2(北京赛贝生物有限公司),培养48小时。
151.(4).吸去废液,pbs清洗一次,每孔加入4ml心肌分化培养液3(北京赛贝生物有限公司),此后每2天更换一次新心肌分化培养液3。
152.(5).以加入心肌分化培养液1为心肌龄第1天计算,一般心肌分化第8~10天,显微镜观察。
153.(6).常规制作心肌细胞爬片,进行心肌细胞特异性标志物tnnt2和α
‑
actinin激光共聚焦染色观察。
154.结果见图6。在显微镜下可以看到跳动的心肌细胞群体,激光共聚焦染色观察心肌细胞特异性标志物阳性。
155.由上述实施例结果可知,本发明构建的gpd1l缺失人胚胎干细胞系,其gpd1l蛋白缺失,核型正常,干细胞多能性标志物正常,连续传代稳定性好,动物体内可形成三胚层畸胎瘤,无支原体污染。可以利用gpd1l缺失人胚胎干细胞h9系研究gpd1l缺失对分化心肌细胞的功能影响及治疗药物的筛选。
156.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。