一类
β-半乳糖苷酶荧光探针、制备方法及其应用
技术领域
1.本发明涉及一类β-半乳糖苷酶荧光探针、制备方法及其应用,具体地说,涉及在检测β-半乳糖苷酶领域的生物用途,尤其是在作为一种衰老诊断工具分子方面的应用。
背景技术:
2.β-半乳糖苷酶(β-gal)是一种糖苷水解酶,能够将半乳糖水解成半乳糖和葡萄糖,同时也能水解其它多种具有β-半乳糖苷键的生物化学分子。β-半乳糖苷酶是一种在细菌、真菌、哺乳动物等多种生物体普遍存在的一种水解酶,具有广泛的生物学用途。β-半乳糖苷酶是一种重要的生物标志物,其活性的异常与某些病理过程及环境因素密切相关。通过检测样本中细菌β-半乳糖苷酶含量,可以检测环境中的细菌密度。在某些癌症发病中,比如原发性卵巢癌,肿瘤细胞相较于正常细胞β-半乳糖苷酶表达量增强,因此β-半乳糖苷酶可以作为卵巢癌的诊断标志物。随着生物体衰老,衰老细胞内β-半乳糖苷酶表达量不断增加,称为衰老相关β-半乳糖苷酶(sa-β-gal)。衰老相关β-半乳糖苷酶是监测衰老过程与研究衰老的重要生物标志物。因此,开发β-半乳糖苷酶的检测方法具有重要意义。酶活性检测方法包括荧光法、比色法、酶联免疫吸附法、电化学法等,其中荧光探针检测法具有高选择性、高灵敏性、实时检测、易于操作、无损检测以及良好的生物样品兼容性等优点,已经成为生物酶检测的一种重要手段。β-半乳糖苷酶荧光检测探针的基本设计原理是将荧光团与β-d-半乳糖残基通过糖苷键连接,探针分子在结合β-半乳糖苷酶后,在酶催化水解作用下β-半乳糖苷键将被切断,暴露出荧光团分子,从而产生荧光变化,通过荧光变化来定性定量的检测β-半乳糖苷酶。
3.衰老是生物体发育达到成熟以后出现的机体功能逐渐衰退、下降的过程。衰老是一种复杂的生理、病理过程,受多种机制影响,主要表现为随着年龄的不断增长机体各组织器官的功能开始出现损伤、代谢及应激反应能力下降,并伴有多种衰老相关疾病的发生,包括糖尿病、肿瘤、心血管疾病、神经退行性疾病等。衰老及衰老相关疾病严重威胁着人类生命健康和生活质量,并加重社会医疗负担。因此,衰老的精准检测对于衰老相关研究具有重要意义。衰老相关β-半乳糖苷酶是目前公认的最经典的衰老相关生物标志物。然而,目前已报道β-半乳糖苷酶探针均不能区分检测不同种属的β-半乳糖苷酶。须知不同种属来源的β-半乳糖苷酶具有一定差异,无差别识别可能带来假阳性结果。细菌是大自然环境中无处不在的原核生物,细菌感染是常见的一种病理状态,这就存在细菌分泌的细菌属β-半乳糖苷酶对人体样品检测结果带来的干扰。因此,开发具有种属选择性的β-半乳糖苷酶荧光探针,排除细菌β-半乳糖苷酶带来的干扰,具有重要研究意义。
4.目前,尚未有文献公开报道具有种属选择性的β-半乳糖苷酶荧光探针。
技术实现要素:
5.本发明的目的在于提供一类β-半乳糖苷酶荧光探针、其制备方法,以及用于衰老相关β-半乳糖苷酶的检测等用途。
6.本发明的第一方面,提供一种荧光探针,其结构如式a所示:
[0007][0008]
式中,x为s、o或nh;
[0009]
y为或不存在;
[0010]
r
a
、r
b
、r
c
、r
d
各自独立地为h、c
1-c4烷基、-cho、-cooh、-cn、-no2、-cooc
1-c4烷基、-ch=ch(n-甲基吡啶盐)、甲基吡啶盐)、
[0011]
在另一优选例中,r
a
、r
b
、r
c
各自独立地为h或c
1-c4烷基,r
d
为-cho、-cooh、-cn、-no2、-cooc
1-c4烷基、-ch=ch(n-甲基吡啶盐)、甲基吡啶盐)、
[0012]
在另一优选例中,r
a
、r
c
、r
d
各自独立地为h或c
1-c4烷基;r
b
为-cho、-cooh、-cn、-no2、-cooc
1-c4烷基、-ch=ch(n-甲基吡啶盐)、甲基吡啶盐)、
[0013]
在另一优选例中,所述荧光探针具有下式i或ii所示的结构:
[0014]
[0015]
其中,x为s、o或nh;
[0016]
r为-cho、-cooh、-cn、-no2、-cooc
1-c4烷基、-ch=ch(n-甲基吡啶盐)、
[0017]
在另一优选例中,r选自下组:
[0018][0019]
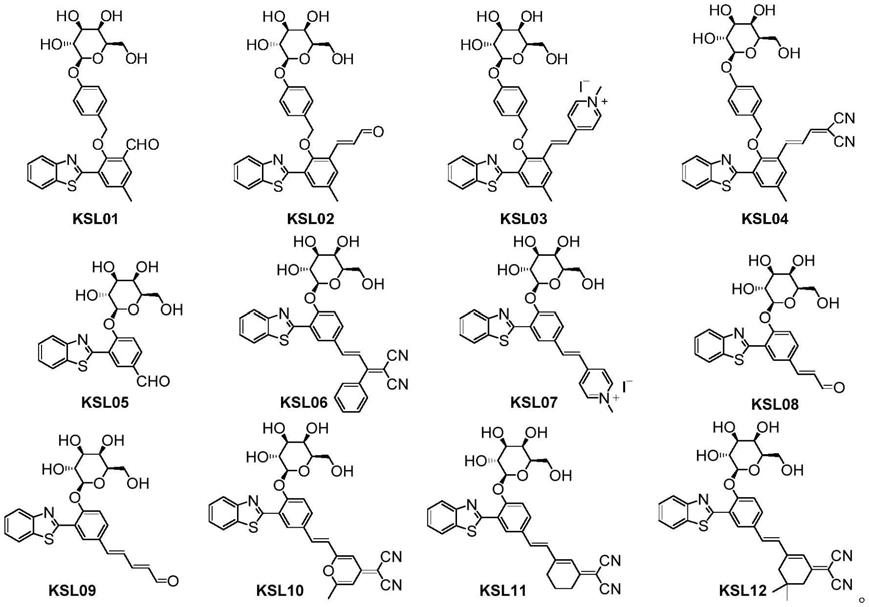
在另一优选例中,所述荧光探针选自下组:
[0020][0021]
本发明的第二方面,提供第一方面所述的荧光探针的制备方法,所述制备方法包括如下路线:
[0022][0023]
路线一:以2-氨基苯硫醇和5-甲基水杨醛为起始原料,在浓盐酸和双氧水条件下反应生成中间体m1,m1经duff反应生成中间体ksloh01,再与中间体m2发生亲核取代反应得关键中间体m3,m3在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl01;
[0024][0025]
路线二:以ksloh01为原料,经wittig反应得中间体ksloh02,再与m2发生亲核取代反应得中间体m4,m4在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl02;
[0026][0027]
路线三:以探针ksl01为原料,与1,4-二甲基碘化吡啶盐经knoevenagel缩合反应制备得探针ksl03;
[0028][0029]
路线四:中间体m4与丙二腈经knoevenagel缩合反应得关键中间体m5,m5在甲醇钠
条件下脱去半乳糖残基上的乙酰保护基得探针ksl04;
[0030][0031]
路线五:以苯并噻唑和3-溴-4-甲氧基苯甲醛为起始原料,经suzuki反应得中间体m6,再在氢溴酸水溶液中脱去甲基保护基得中间体ksloh05,与2,3,4,6-四乙酰氧基-α-d-吡喃糖溴化物发生亲核取代反应得关键中间体m7,m7在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl05;
[0032][0033]
路线六:中间体m7与2-(1-苯基亚乙基)丙二腈经knoevenagel缩合反应得中间体m8,m8在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl06;
[0034][0035]
路线七:以探针ksl05为原料,与1,4-二甲基碘化吡啶盐经knoevenagel缩合反应制备得探针ksl07;
[0036][0037]
路线八:以中间体ksloh05为原料,经wittig反应得中间体ksloh08,再与2,3,4,6-四乙酰氧基-α-d-吡喃糖溴化物发生亲核取代反应得关键中间体m10,m10在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl08;
[0038][0039]
路线九:以中间体ksloh08为原料,经wittig反应延长醛基共轭链得中间体ksloh09,再与2,3,4,6-四乙酰氧基-α-d-吡喃糖溴化物发生亲核取代反应得关键中间体m11,m11在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl09;
[0040][0041]
路线十:中间体m7与中间体m12(2-(2,6-二甲基-4h-吡喃-4-亚烷基)丙二腈)经knoevenagel缩合反应得中间体m13,m13在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl10;
[0042][0043]
路线十一:中间体m7与中间体m15(2-(3-甲基环己-2-烯-1-亚烷基)丙二腈)经knoevenagel缩合反应得中间体m16,m16在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl11;
[0044][0045]
或路线十二:中间体m7与中间体m18(2-(3,5,5-三甲基环己-2-烯-1-亚烷基)丙二腈)丙经knoevenagel缩合反应得中间体m19,m19在甲醇钠条件下脱去半乳糖残基上的乙酰保护基得探针ksl12。
[0046]
上述所有化学反应条件的参数具有一定程度可调节性和可替换性,即一般化学反应指导原则下的反应溶剂替换、酸碱替换、反应温度调整、反应时间调整等不足以跳出本专利权利要求保护范围。
[0047]
在另一优选例中,各反应步骤所采用的反应溶剂取自甲醇、乙醇、乙腈、四氢呋喃、二氯甲烷、乙酸乙酯、正丁醇、乙醚、甲苯等常规化学溶剂。
[0048]
在另一优选例中,各反应步骤采用的反应温度为-20~150℃,反应时间为0.5~48h。
[0049]
本发明的第三方面,提供第一方面所述的荧光探针的用途,用于检测β-半乳糖苷酶;或用于制备检测β-半乳糖苷酶的试剂。
[0050]
在另一优选例中,所述的荧光探针用于检测体外、细胞、组织器官β-半乳糖苷酶活性。在另一优选例中,所述的荧光探针用于检测肿瘤细胞β-半乳糖苷酶中的应用。在另一优选例中,所述肿瘤细胞为卵巢癌细胞。
[0051]
在另一优选例中,所述的荧光探针用于检测不同种属β-半乳糖苷酶的应用,所述不同种属选自细菌属、真菌属、哺乳动物属β-半乳糖苷酶;或用于制备种属特异性检测β-半乳糖苷酶的试剂。
[0052]
在另一优选例中,所述的不同种属β-半乳糖苷酶,包括大肠杆菌β-半乳糖苷酶(e.coliβ-gal)、米曲霉菌β-半乳糖苷酶(a.oryzβ-gal)、小鼠源β-半乳糖苷酶(mouseβ-gal)、人源β-半乳糖苷酶(humanβ-gal)。
[0053]
在另一优选例中,种属特异性检测β-半乳糖苷酶,即能够正常识别检测人源β-半乳糖苷酶,不能识别检测大肠杆菌β-半乳糖苷酶。
[0054]
在另一优选例中,种属特异性荧光探针包括ksl08
–
ksl12。
[0055]
在另一优选例中,所述的荧光探针用作制备检测衰老的诊断工具分子。
[0056]
在另一优选例中,所述衰老包括机体衰老、组织器官衰老、细胞衰老。
[0057]
在另一优选例中,所述的荧光探针用于荧光成像或用作制备荧光成像的试剂。
[0058]
在另一优选例中,所述的探针可以应用于β-半乳糖苷酶含量的检测。
[0059]
本发明具有以下明显优点:(1)该系列基于hbt估计结构的荧光探针具有较大的斯托克位移。(2)该系列荧光探针对β-半乳糖苷酶具有良好的选择性与检测灵敏度。(3)该系列荧光探针具有良好生物相容性,无明显细胞毒性,可应用与活细胞检测。(4)该系列荧光探针具有较宽发光谱,从绿光到近红外光,可以满足不同成像条件的需求。(5)该系列探针可以用于精准检测衰老细胞及判断衰老程度。(6)该系列探针部分具有种属特异性,可以特异性识别人源β-半乳糖苷酶,但是不受细菌种属β-半乳糖苷酶的干扰,可以排除细菌感染情况导致的假阳性。
[0060]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。说明书中所揭示的各个特征,可以被任何提供相同、均等或相似目的的替代性特征取代。限于篇幅,在此不再一一累述。
附图说明
[0061]
图1为荧光探针ksl01-ksl12溶液中加入a.oryzaeβ-gal后的紫外-可见吸收光谱。
[0062]
图2为荧光探针ksl01-ksl12溶液中加入a.oryzaeβ-gal后的荧光光谱。
[0063]
图3为荧光探针ksl01-ksl12溶液中加入e.coliβ-gal后的荧光光谱。
[0064]
图4为荧光探针ksl01-ksl12随a.oryzaeβ-gal浓度升高荧光光谱的变化及荧光强
度与酶浓度的线性关系。
[0065]
图5为荧光探针ksl01-ksl12溶液中加入a.oryzaeβ-gal后荧光强度的时间动力学变化。
[0066]
图6为荧光探针ksl04和ksl11的选择性实验结果。
[0067]
图7为荧光探针ksl01-ksl12对mrc5细胞的存活率。
[0068]
图8为荧光探针ksl01-ksl12对skov3细胞的存活率。
[0069]
图9为荧光探针ksl01-ksl12对hepg2细胞的存活率。
[0070]
图10为荧光探针ksl01-ksl12对衰老mrc5细胞和skov3细胞的细胞成像图。
[0071]
图11为荧光探针ksl04检测不同代数mrc5细胞衰老的结果图。
[0072]
图12为荧光探针ksl04和ksl11检测不同年龄小鼠肾脏组织切片衰老程度的结果图。
具体实施方式
[0073]
本技术的发明人经过广泛而深入地研究,基于hbt骨架结构构建了一系列β-半乳糖苷酶荧光探针,并提供了其制备方法,及其在衰老检测中的应用。在此基础上,完成了本发明。
[0074]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件(如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件)或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0075]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
[0076]
实施例1
[0077]
探针ksl01及水解产物ksloh01的制备
[0078][0079]
(1)化合物m1的合成:
[0080]
2-氨基苯硫醇(1.25g,10mmol),5-甲基水杨酸(1.36g,10mmol)溶于无水乙醇中,于0℃下,边搅拌边缓慢滴加浓hcl(2.5ml,30mmol),继续搅拌10min后,缓慢滴加质量浓度
为30%的h2o2溶液(6.8ml,60mmol),转为室温搅拌1h,有黄色晶体析出。抽滤,收集固体,并用少量无水乙醇洗涤,干燥得到1.31g化合物m1,产率为54%。1h nmr(400mhz,dmso-d6)δ11.38(br,1h),8.14(d,j=7.6hz,1h),8.06(d,j=8.0hz,1h),7.98(d,j=1.4hz,1h),7.58
–
7.51(m,1h),7.49
–
7.42(m,1h),7.23(dd,j=8.3,1.8hz,1h),6.99(d,j=8.3hz,1h),2.33(s,3h).
13
c nmr(101mhz,dmso-d6)δ165.74,154.67,151.89,134.73,133.71,128.87,128.73,126.91,125.49,122.50,122.45,118.38,117.34,20.50.esi-hrms:m/z calc.for c
14
h
12
nos[m h]
:242.0640,found:242.0641.
[0081]
(2)化合物ksloh01的合成
[0082]
将化合物m1(1.11g,4.6mmol),六亚甲基四胺(733mg,5.52mmol)溶于10ml三氟乙酸中,70℃搅拌10h后,将反应液冷却至室温,加入3m naoh溶液调节至碱性,有黄色固体析出。抽滤,收集固体,并用少量无水乙醇洗涤,干燥得到粗产物,柱层析分离得到780mg黄色固体ksloh01,收率为63%。1h nmr(600mhz,dmso-d6)δ12.75(s,1h),10.33(s,1h),8.23
–
8.19(m,2h),8.12(d,j=8.1hz,1h),7.72(d,j=1.6hz,1h),7.62
–
7.58(m,1h),7.54
–
7.50(m,1h),2.39(s,3h).
13
c nmr(151mhz,dmso-d6)δ192.29,165.66,157.51,151.46,135.74,134.02,133.56,129.76,127.42,126.31,123.70,122.77,122.74,119.57,20.20.esi-hrms:m/z calc.for c
15
h
12
no2s[m h]
:270.0589,found:270.0590.
[0083]
(3)化合物m3的合成
[0084]
将化合物m2(234mg,0.454mmol),化合物ksloh01(122mg,0.454mmol)溶于2ml四氢呋喃中,并加入k2co3(75mg,0.545mmol),室温搅拌过夜后,用饱和nh4cl溶液中和,然后用乙酸乙酯萃取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到264mg白色固体m3,产率为84%。1h nmr(400mhz,cdcl3)δ10.20(s,1h),8.49(d,j=1.8hz,1h),8.17(d,j=8.1hz,1h),7.95(d,j=7.8hz,1h),7.78(d,j=1.9hz,1h),7.56(dd,j=11.3,4.1hz,1h),7.46(t,j=7.2hz,1h),7.34(d,j=8.6hz,2h),7.00(d,j=8.6hz,2h),5.54
–
5.45(m,2h),5.13(dd,j=10.5,3.4hz,1h),5.06(d,j=7.9hz,1h),4.99(s,2h),4.28
–
4.13(m,2h),4.08(t,j=6.7hz,1h),2.49(s,3h),2.19(s,3h),2.10(s,3h),2.06(s,3h),2.03(s,3h).
13
c nmr(151mhz,cdcl3)δ189.10,170.35,170.25,170.13,169.42,161.95,157.27,157.19,152.36,136.65,136.05,135.24,131.72,130.21,130.16,130.13,128.15,126.43,125.50,123.25,121.57,117.06,99.53,79.06,71.07,70.81,68.60,66.85,61.33,20.77,20.73,20.67,20.59.ei-hrms:m/z calc.for c
36
h
35
no
12
s[m]
:705.1880,found:705.1882.
[0085]
(4)化合物ksl01的合成
[0086]
将化合物m3(130mg,0.184mmol)置于烧瓶中,加入无水甲醇使其溶解,-20℃搅拌片刻。同时将甲醇钠(70mg,1.29mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到36mg白色固体ksl01,产率为45%。1h nmr(600mhz,dmso-d6)δ10.14(s,1h),8.48(d,j=1.8hz,1h),8.18(d,j=7.9hz,1h),8.12(d,j=8.1hz,1h),7.77(d,j=1.8hz,1h),7.59(t,j=7.6hz,1h),7.49(t,j=7.5hz,1h),7.41(d,j=8.5hz,2h),7.04(d,j=8.5hz,2h),5.19(d,j=5.1hz,1h),5.06(s,2h),4.90
–
4.82(m,2h),4.66(t,j=5.2hz,1h),4.52(d,j=4.5hz,1h),3.72(t,j=3.6hz,1h),3.62
–
3.54(m,3h),3.53
–
3.47(m,1h),3.44
–
3.40(m,1h),2.47(s,3h).
13
c nmr(151mhz,
dmso-d6)δ189.45,161.67,158.24,157.01,152.19,136.04,136.01,135.30,132.29,130.88,130.49,129.07,128.02,127.07,126.08,123.33,122.70,116.60,101.32,79.20,75.97,73.76,70.74,68.57,60.80,20.67.esi-hrms:m/z calc.c
28
h
27
nnao8s[m na]
:560.1355,found 560.1354.
[0087]
实施例2
[0088]
探针ksl02及其水解产物ksloh02的制备
[0089][0090]
(1)化合物ksloh02的合成
[0091]
将(甲酰基亚甲基)三苯基膦(304mg,1mmol),化合物ksloh01(269mg,1mmol)置于烧瓶中,加入10ml无水四氢呋喃,氮气保护下回流过夜。反应结束后,冷却,旋干除去溶剂,再柱层析分离得到236mg黄色固体ksloh02,产率为80%。1h nmr(400mhz,cdcl3)δ13.24(br,1h),9.74(d,j=7.8hz,1h),8.00(d,j=8.1hz,1h),7.98
–
7.89(m,2h),7.59
–
7.50(m,2h),7.48
–
7.40(m,2h),6.88(dd,j=16.1,7.8hz,1h),2.38(s,3h).
13
c nmr(101mhz,cdcl3)δ194.51,168.77,155.11,151.52,147.41,132.55,132.07,131.53,129.30,128.70,126.95,125.92,122.90,122.27,121.59,117.28,20.50.ei-hrms:m/z calc.for c
17
h
13
no2s[m]
:295.0667,found:295.0664.
[0092]
(2)化合物m4的合成
[0093]
将化合物m2(142mg,0.249mmol),化合物ksloh02(73mg,0.249mmol),k2co3(41mg,0.299mmol)加入烧瓶中,加入2ml dmf溶剂,室温反应过夜。反应结束后,用饱和nh4cl溶液中和,然后用乙酸乙酯萃取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到169mg白色固体m4,产率为88%。
[0094]1h nmr(400mhz,cdcl3)δ9.54(d,j=7.7hz,1h),8.29(s,1h),8.13(d,j=8.1hz,1h),7.95(d,j=7.8hz,1h),7.64(d,j=16.1hz,1h),7.58
–
7.50(m,2h),7.44(t,j=7.5hz,1h),7.33(d,j=8.5hz,2h),7.00(d,j=8.5hz,2h),6.65(dd,j=16.1,7.7hz,1h),5.50(dd,j=10.4,8.0hz,2h),5.14(dd,j=10.4,3.4hz,1h),5.04(d,j=7.9hz,1h),4.91
–
4.82(m,2h),4.29
–
4.13(m,3h),2.47(s,3h),2.19(s,3h),2.11(s,3h),2.06(s,3h),2.03(s,3h).
13
c nmr(151mhz,cdcl3)δ193.45,170.37,170.26,170.14,169.48,162.75,157.24,153.74,151.82,146.56,135.82,135.28,133.64,130.54,130.49,130.22,129.51,129.00,
127.61,126.56,125.60,123.08,121.57,117.14,99.48,77.87,71.03,70.82,68.57,66.84,61.30,20.91,20.76,20.69,20.60.ei-hrms:m/z calc.for c
38
h
37
no
12
s[m]
:731.2036,found:731.2039.
[0095]
(3)化合物ksl02的合成
[0096]
将化合物m4(100mg,0.137mmol)置于烧瓶中,加入无水甲醇使其溶解,-20℃搅拌片刻。同时将甲醇钠(52mg,0.96mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到40mg白色固体ksl02,产率为52%。1h nmr(400mhz,dmso-d6)δ9.68(d,j=7.7hz,1h),8.28(d,j=1.6hz,1h),8.18(d,j=7.8hz,1h),8.11(d,j=8.1hz,1h),7.91(d,j=1.7hz,1h),7.86(d,j=16.0hz,1h),7.61
–
7.55(m,1h),7.51
–
7.48(m,1h),7.46(d,j=8.5hz,2h),7.06(d,j=8.6hz,2h),6.92(dd,j=16.0,7.7hz,1h),5.19(d,j=5.1hz,1h),4.92
–
4.83(m,4h),4.66(t,j=5.4hz,1h),4.52(d,j=4.6hz,1h),3.74
–
3.70(m,1h),3.62
–
3.54(m,3h),3.53
–
3.47(m,1h),3.47
–
3.39(m,1h).
13
c nmr(151mhz,dmso-d6)δ195.07,162.26,158.18,153.87,152.25,146.74,136.02,135.26,132.88,131.66,130.78,130.36,129.37,129.24,127.56,127.01,125.98,123.26,122.67,116.65,101.34,78.10,75.95,73.75,70.73,68.56,60.78,20.78.esi-hrms:m/z calc.for c
30
h
29
nnao8s[m na]
:586.1512,found 586.1513.
[0097]
实施例3
[0098]
探针ksl03及其水解产物ksloh03的制备
[0099][0100]
(1)化合物ksl03的合成
[0101]
将化合物ksl01(120mg,0.223mmol),1,4-二甲基碘化吡啶盐(53mg,0.223mmol)加至烧瓶中,加入无水乙醇,边搅拌边滴加哌啶(20μl,0.223mmol),升温至回流温度,搅拌过夜。反应液中有黄色固体析出,抽滤收集固体,并用少量无水乙醇洗涤,干燥后获得122.2mg黄色固体ksl03,产率为73%。1h nmr(400mhz,dmso-d6)δ8.83(d,j=6.7hz,2h),8.27(d,j=1.6hz,1h),8.19(d,j=7.8hz,1h),8.12(d,j=8.1hz,1h),7.98(d,j=6.7hz,2h),7.84(d,j=1.7hz,1h),7.77(d,j=16.4hz,1h),7.62
–
7.56(m,1h),7.53
–
7.47(m,1h),7.43(d,j=16.4hz,1h),7.36(d,j=8.6hz,2h),6.96(d,j=8.6hz,2h),5.21(d,j=5.0hz,1h),4.93(d,j=4.3hz,3h),4.76(d,j=7.7hz,1h),4.69(t,j=5.3hz,1h),4.59(d,j=4.5hz,1h),3.74
–
3.70(m,1h),3.62
–
3.53(m,3h),3.53
–
3.45(m,1h),3.45
–
3.38(m,1h),2.47(s,3h).
13
c nmr(101mhz,dmso-d6)δ162.41,158.01,154.03,152.38,152.24,145.64,136.04,135.10,134.76,131.97,130.92,130.87,130.70,129.55,127.51,127.03,125.99,125.24,124.08,123.27,122.66,116.54,101.06,78.09,75.99,73.75,70.65,68.60,60.89,47.53,
hrms:m/z calc.for c
41
h
37
n3o
11
s[m]
:779.2149,found 779.2152.
[0110]
(2)化合物ksl04的合成
[0111]
将化合物m5(123mg,0.158mmol)置于烧瓶中,加入无水甲醇使其溶解,-20℃搅拌片刻。同时将甲醇钠(60mg,1.104mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到30.5mg黄色固体ksl04,产率为31%。1h nmr(600mhz,dmso-d6)δ8.43(d,j=11.3hz,1h),8.28(s,1h),8.15(d,j=7.9hz,1h),8.10(d,j=8.1hz,1h),7.99(s,1h),7.76(d,j=15.2hz,1h),7.59
–
7.55(m,1h),7.49
–
7.45(m,1h),7.42(d,j=8.6hz,2h),7.34(dd,j=15.2,11.4hz,1h),7.03(d,j=8.6hz,2h),5.19(d,j=4.4hz,1h),4.89
–
4.82(m,4h),4.65(s,1h),4.51(s,1h),3.72(s,1h),3.58(d,j=2.7hz,4h),3.52
–
3.48(m,1h),3.45
–
3.41(m,1h),2.45(d,j=8.3hz,4h).
13
c nmr(151mhz,dmso-d6)δ162.88,162.14,158.23,154.28,152.25,144.73,136.00,135.51,133.47,131.64,131.04,129.56,129.15,127.71,127.02,126.01,124.52,123.27,122.64,116.51,114.69,112.64,101.44,82.08,78.49,76.00,73.74,70.73,68.55,60.79,20.71.esi-hrms:m/z calc.for c
33
h
29
n3nao7s[m na]
:634.1624,found 634.1623.
[0112][0113]
(3)化合物ksloh04的合成
[0114]
将化合物ksloh02(50mg,0.169mmo),丙二腈(12μl,0.186mmol)至于烧瓶中,加入无水乙醇使其溶解,氮气保护下,边搅拌边滴加哌啶(17μl,0.169mmol),室温反应10min,有黄色固体析出,抽滤收集固体,并用少量无水乙醇洗涤,获得ksloh04共40mg,产率为69%。1h nmr(600mhz,cdcl3)δ8.04(d,j=8.1hz,1h),7.94(d,j=7.6hz,1h),7.72(d,j=15.3hz,1h),7.66(d,j=11.7hz,1h),7.60(d,j=1.2hz,1h),7.58
–
7.43(m,4h),2.41(s,j=9.9hz,3h).
13
c nmr(151mhz,cdcl3)δ168.52,161.21,156.08,151.44,145.49,132.53,132.39,129.06,127.08,126.08,123.36,122.92,122.35,121.63,117.52,113.85,112.06,81.87,20.46.ei-hrms:m/z calc.for c
20
h
13
n3os[m]
:343.0779,found343.0781.
[0115]
实施例5
[0116]
探针ksl05及其水解产物ksloh05的制备
[0117][0118]
(1)化合物m6的合成
[0119]
将3-溴-4-甲氧基苯甲醛(6.820g,30mmol),醋酸钯(674mg,3mmol),三苯基膦(3.934g,15mmol),一水合醋酸铜(1.198g,6mmol),k2co3(8.292g,60mmol),苯并噻唑(10ml,90mmol)加至250ml烧瓶中,加入甲苯作为溶剂,氮气保护下回流反应12h。反应结束后,冷却至室温,过滤除去不溶固体,旋干后柱层析分离得到产物m6共16g,产率为99%。1h nmr(400mhz,cdcl3)δ10.06(s,1h),9.05(d,j=2.1hz,1h),8.13(d,j=8.2hz,1h),8.04(dd,j=8.6,2.1hz,1h),7.95(d,j=7.9hz,1h),7.55
–
7.50(m,1h),7.44
–
7.38(m,1h),7.20(d,j=8.6hz,1h),4.16(s,3h).
13
c nmr(151mhz,cdcl3)δ190.72,161.59,161.33,151.78,135.95,133.34,131.71,130.16,126.30,125.14,122.99,122.61,121.31,112.09,56.22.ei-hrms:m/z calc.for c
15
h
11
no2s[m] :269.0510,found 269.0513.
[0120]
(2)化合物ksloh05的合成
[0121]
将化合物m6(6.3g,23.39mmol)加至烧瓶中,加入40%hbr水溶液(60ml),回流反应2天,tlc监测,底物反应完全后,冷却至室温,用2n naoh中和至中性,再用乙酸乙酯萃取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到白色固体ksloh05共3.11g,产率为52%。1h nmr(400mhz,cdcl3)δ13.35(s,1h),9.95(s,1h),8.25(d,j=1.9hz,1h),8.03(d,j=8.1hz,1h),7.96(d,j=8.0hz,1h),7.92(dd,j=8.6,1.9hz,1h),7.59
–
7.52(m,1h),7.50
–
7.44(m,1h),7.23(d,j=8.6hz,1h).
13
c nmr(151mhz,cdcl3)δ189.93,168.26,163.11,151.36,133.95,132.59,130.70,128.85,127.07,126.17,122.37,121.74,118.72,117.13.ei-hrms:m/z calc.for c
14
h9no2s[m]
:255.0354,found 255.0356.
[0122]
(3)化合物m7的合成
[0123]
准备一干燥的烧瓶,加入化合物ksloh05(2g,7.83mmol),碳酸铯(12g,36.83mmol)和少量无水na2so4,然后加入二氯甲烷作为溶剂,室温搅拌片刻后,加入2,3,4,6-四乙酰氧基-alpha-d-吡喃糖溴化物(4.9g,11.88mmol),氮气保护下,室温反应过夜。待底物反应完全后,过滤除去不溶固体,旋干,柱层析分离获得m7共3.8g,为白色固体,产率82%。1h nmr(400mhz,cdcl3)δ10.10(s,1h),9.13(d,j=1.7hz,1h),8.18(d,j=8.1hz,1h),8.04(dd,j=8.7,1.9hz,1h),,3.4hz,1h),4.28
–
4.17(m,3h),2.24(s,3h),2.10(s,3h),2.04(s,7.97(d,j=7.9hz,1h),7.56(t,j=7.7hz,1h),7.45(t,j=7.6hz,1h),7.36(d,j=8.7hz,1h),5.78(dd,j=10.1,8.0hz,1h),5.52(d,j=3.4hz,1h),5.46(d,j=8.0hz,1h),5.18(dd,j=10.2 3h),1.88(s,3h).
13
c nmr(101mhz,dmso-d6)δ192.18,170.46,170.34,170.01,169.53,160.94,157.88,151.94,135.89,133.10,131.86,131.76,127.16,126.19,123.41,122.85,122.04,116.23,97.30,71.54,71.12,68.71,67.70,61.77,21.00,20.98,20.93,20.81.esi-hrms:m/z calc.for c
28
h
28
no
11
s[m h]
:586.1383,found:586.1384.
[0124]
(4)化合物ksl05的合成
[0125]
将化合物m7(215mg,0.37mmol)置于烧瓶中,加入无水甲醇使其溶解,-20℃搅拌片刻。同时将甲醇钠(139mg,2.57mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到68mg白色固体ksl05,产率为44%。1h nmr(600mhz,dmso-d6)δ10.07(s,1h),9.00(d,j=2.0hz,1h),8.14(t,j=7.2hz,2h),8.07(dd,j=8.7,2.0hz,1h),7.58(dd,j=8.1,5.8hz,2h),7.49(t,j=7.5hz,1h),5.37(d,j=7.7hz,1h),5.29(d,j=5.7hz,1h),5.04(d,j=5.7hz,1h),4.75
–
4.68(m,2h),3.99(dd,j=
14.8,7.9hz,1h),3.81
–
3.75(m,2h),3.63
–
3.50(m,3h).
13
c nmr(151mhz,dmso-d6)δ192.20,161.77,159.33,151.92,136.37,133.06,131.46,130.89,126.89,125.77,123.15,122.61,122.32,116.04,101.27,76.41,73.97,70.56,68.49,60.75.esi-hrms:m/z calc.for c
20
h
20
no7s[m h]
:418.0960,found:418.0953.
[0126]
实施例6
[0127]
探针ksl06及其水解产物ksloh06的制备
[0128][0129]
(1)化合物m8的合成
[0130]
将化合物m7(600mg,1.02mmol),2-(1-苯基亚乙基)丙二腈(344mg,2.04mmol)加至烧瓶中,加入无水乙醇作为溶剂,边搅拌边滴加哌啶(94μl,1.18mmol),升温至回流,反应过夜,待底物反应完全后,旋干,柱层析分离得到浅黄色固体m8共294mg,产率为39%。1h nmr(400mhz,cdcl3)δ8.69(s,1h),8.18(d,j=8.0hz,1h),7.96(d,j=7.9hz,1h),7.80(d,j=9.0hz,1h),7.68
–
7.51(m,5h),7.48
–
7.43(m,1h),7.40(d,j=6.6hz,2h),7.29(d,j=9.0hz,1h),7.01(d,j=15.5hz,1h),5.80
–
5.71(m,1h),5.52(d,j=3.2hz,1h),5.43(d,j=8.0hz,1h),5.18(dd,j=10.2,3.3hz,1h),4.23(t,j=8.8hz,3h),2.23(s,3h),2.11(s,3h),2.04(s,3h),1.86(s,3h).
13
c nmr(151mhz,cdcl3)δ171.12,170.31,170.16,170.08,169.25,161.07,156.01,151.88,147.75,136.11,132.99,132.07,131.26,130.07,129.72,129.16,128.85,126.40,125.39,124.49,124.05,123.07,121.39,115.70,113.33,112.84,98.78,82.51,71.72,71.21,68.49,66.77,61.40,20.74,20.72,20.56.esi-hrms:m/z calc.for c
39
h
34
n3o
10
s[m h]
:736.1965,found:736.1960.
[0131]
(2)化合物ksl06的合成
[0132]
将化合物m8(100mg,0.14mmol)置于烧瓶中,加入无水甲醇使其溶解,-20℃搅拌片刻。同时将甲醇钠(51mg,0.95mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到36mg黄色固体ksl06,产率为45%。1h nmr(600mhz,dmso-d6)δ8.64(s,1h),8.12(d,j=7.9hz,1h),8.07(d,j=8.1hz,1h),7.98(d,j=8.7hz,1h),7.69
–
7.62(m,4h),7.57
–
7.52(m,4h),7.47(dd,j=7.8,5.2hz,2h),7.06(d,j=15.5hz,1h),5.31(d,j=7.6hz,1h),5.25(d,j=5.6hz,1h),5.02(d,j=5.8hz,1h),4.71(t,j=5.4hz,1h),4.67(d,j=4.2hz,1h),3.96(dd,j=14.6,8.0hz,1h),3.78
–
3.72(m,2h),3.60
–
3.49(m,4h).
13
c nmr(151mhz,dmso-d6)δ171.58,161.91,157.45,151.85,148.52,136.35,133.54,132.50,131.63,130.58,129.58,129.43,128.61,126.84,125.70,124.00,123.05,122.69,122.27,116.38,114.51,113.75,101.20,81.40,76.35,73.95,70.57,68.49,60.76.esi-hrms:m/z calc.for c
31
h
25
n3nao6s[m na]
:590.1362,found:590.1365.
[0133][0134]
(3)化合物m9的合成
[0135]
将化合物m6(1.16g,4.31mmol),2-(1-苯基亚乙基)丙二腈(1.3g,7.72mmol)加至烧瓶中,加入无水乙醇作为溶剂,边搅拌边滴加哌啶(473μl,5.17mmol),升温至回流,反应过夜,待底物反应完全后,旋干,柱层析分离得到浅黄色固体m9共145mg,产率为8%。1h nmr(400mhz,cdcl3)δ8.70(s,1h),8.18(d,j=8.2hz,1h),7.94(d,j=7.9hz,1h),7.84(d,j=8.6hz,1h),7.65
–
7.51(m,5h),7.47
–
7.37(m,3h),7.16(d,j=8.8hz,1h),7.01(d,j=15.5hz,1h),4.16(s,3h).
13
c nmr(101mhz,cdcl3)δ171.41,161.73,159.50,148.42,135.71,133.13,132.01,131.17,130.79,129.11,128.87,127.75,126.47,125.27,123.59,122.70,122.42,121.33,113.56,113.04,112.51,81.63,56.22.esi-hrms:m/z calc.for c
26
h
18
n3os[m h]
:420.1171,found:420.1170.
[0136]
(4)化合物ksloh06的合成
[0137]
准备干燥的二口烧瓶,加入m9(100mg,0.24mmol),加入无水二氯甲烷作为溶剂,氮气保护下,0℃下缓慢加入c2h6bbr3s(1m in ch2cl2,715μl,0.72mmol),搅拌1h后,转为室温反应再继续搅拌23h。tlc监测,底物反应完全后,将反应液倒入50ml冰水中,然后用二氯甲烷萃取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到浅黄色固体ksloh06共25mg,产率为26%。
[0138]1h nmr(400mhz,dmso-d6)δ12.21(s,1h),9.11(s,1h),8.33(d,j=8.7hz,1h),8.25(s,1h),8.17(t,j=7.0hz,2h),7.80(d,j=3.5hz,2h),7.65
–
7.60(m,3h),7.57(t,j=7.6hz,1h),7.48(t,j=7.5hz,1h),7.24(d,j=8.8hz,1h).
13
c nmr(151mhz,dmso-d6)δ164.05,159.24,159.08,156.55,151.87,144.85,135.90,135.34,132.18,130.85,129.36,128.61,127.54,126.97,125.66,122.88,122.51,119.97,119.46,118.07,117.10,109.33,65.53.esi-hrms:m/z calc.for c
25
h
16
n3os[m h]
:406.1014,found:406.1016.
[0139]
实施例7
[0140]
探针ksl07及其水解产物的制备
[0141][0142]
(1)探针ksl07的合成
[0143]
将化合物ksl05(120mg,0.29mmol),1,4-二甲基碘化吡啶盐(68mg,0.29mmol)加至烧瓶中,加入无水乙醇作为溶剂,边搅拌边滴加哌啶(26μl,0.29mmol),升温至回流,反应过夜,有浅黄色固体析出,抽滤收集固体,并用少量无水乙醇洗涤,共获得浅黄色固体ksl07共50mg,产率为27%。1h nmr(400mhz,dmso-d6)δ8.85(d,j=6.5hz,2h),8.80(d,j=1.9hz,1h),8.25(d,j=6.6hz,2h),8.15(t,j=11.2hz,2h),8.09(d,j=8.1hz,1h),7.96(dd,j=
8.9,1.8hz,1h),7.58(t,j=7.3hz,1h),7.50(dd,j=17.6,8.7hz,3h),5.33(d,j=7.7hz,1h),5.29(d,j=5.6hz,1h),5.06(d,j=5.8hz,1h),4.73(dd,j=10.8,5.0hz,2h),4.25(s,3h),3.98(dd,j=14.3,8.3hz,1h),3.82
–
3.74(m,2h),3.62
–
3.50(m,3h).
13
c nmr(101mhz,dmso-d6)δ162.23,156.54,153.02,151.89,145.38,140.19,136.37,131.58,129.53,129.48,126.84,125.62,123.81,122.93,122.75,122.50,122.29,116.18,101.18,76.36,74.01,70.62,68.55,60.85,47.31.esi-hrms:m/z calc.for c
27
h
27
n2o6s[m-i]
:507.1584,found:507.1591.
[0144][0145]
(2)化合物ksloac07的合成
[0146]
将化合物ksloh05(255mg,1mmol),1,4-二甲基碘化吡啶盐(235mg,1mmol),naoac(246mg,3mmol)加至烧瓶中,加入15ml醋酸酐,90℃搅拌36h。底物反应完后,向反应液中加入10ml乙醚,有棕色固体析出,抽滤收集固体,并用少量的水洗涤,共得到ksloac07固体145mg,产率为28%。1h nmr(600mhz,dmso-d6)δ8.92(d,j=6.6hz,2h),8.67(s,1h),8.29(d,j=6.6hz,2h),8.24
–
8.18(m,2h),8.14(d,j=8.1hz,1h),8.05(dd,j=8.5,1.9hz,1h),7.68
–
7.60(m,2h),7.55(dd,j=14.6,7.7hz,2h),4.29(s,3h),2.53(s,3h).
13
c nmr(151mhz,dmso-d6)δ169.45,161.64,152.66,152.54,149.56,145.72,139.30,135.40,134.20,130.88,129.91,127.39,126.51,126.42,125.74,124.99,124.23,123.48,122.82,47.52,22.04.esi-hrms:m/z calc.for c
23
h
19
n2o2s[m-i]
:387.1162,found:387.1166.
[0147]
(3)化合物ksloh07的合成
[0148]
将化合物ksloac07(43mg,0.08mmol)置于烧瓶中,加入无水甲醇使其溶解,室温搅拌,同时将nh4oac(51mg,0.66mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌3h,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到39mg黄色固体ksloh07,产率为99%。1h nmr(600mhz,dmso-d6)δ12.26(s,1h),8.86(d,j=6.7hz,2h),8.64(d,j=2.1hz,1h),8.23(d,j=6.8hz,2h),8.20
–
8.12(m,2h),8.08(d,j=8.1hz,1h),7.87(dd,j=8.6,2.1hz,1h),7.60
–
7.55(m,1h),7.50
–
7.41(m,2h),7.30(t,j=6.3hz,1h),4.25(s,3h).
13
c nmr(151mhz,dmso-d6)δ163.80,158.64,153.34,151.87,145.42,140.87,135.47,131.65,129.89,127.42,126.97,125.58,123.61,122.68,122.56,121.61,119.90,118.36,47.22.esi-hrms:m/z calc.for c
21
h
17
n2os[m-i-]
:345.1056,found:345.1063.
[0149]
实施例8
[0150]
探针ksl08及其水解产物ksloh08的制备
[0151][0152]
(1)化合物ksloh08的合成
[0153]
将化合物ksloh05(1g,3.92mmol)溶于25ml四氢呋喃中,0℃下边搅拌边加入(1,3-二恶烷-2-甲基)三苯基溴化磷(3.363g,7.84mmol),氢化钠(60%油分散)(784mg,19.6mmol),18-冠醚(100mg,25mg/mmol),继续搅拌10min后,升温至50~60℃,反应过夜。次日,向反应液中加入少量的水淬灭,然后加入1m hcl溶液至反应液中搅拌。tlc监测,反应结束后,用氨水调ph至7,混合物用乙酸乙酯萃取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到ksloh08共782mg,为浅黄色固体,产率为71%。1h nmr(400mhz,cdcl3)δ13.01(s,1h),9.70(d,j=7.7hz,1h),8.01(d,j=8.1hz,1h),7.94(d,j=8.0hz,1h),7.85(d,j=2.1hz,1h),7.61(dd,j=8.7,2.1hz,1h),7.57
–
7.51(m,1h),7.49
–
7.41(m,3h),7.16(d,j=8.7hz,1h),6.67(dd,j=15.9,7.7hz,1h).
13
c nmr(101mhz,cdcl3)δ193.43,168.23,160.57,151.55,151.52,132.49,132.25,129.23,127.04,127.03,126.08,125.80,122.36,121.69,119.00,117.22.esi-hrms:m/z calc.for c
16
h
12
no2s[m h]
:282.0589,found:282.0591.
[0154]
(2)化合物m10的合成
[0155]
准备一干燥的烧瓶,加入化合物ksloh08(400mg,1.422mmol),碳酸铯(2.316g,7.108mmol)和少量无水na2so4,然后加入二氯甲烷作为溶剂,室温搅拌片刻后,加入2,3,4,6-四乙酰氧基-alpha-d-吡喃糖溴化物(880mg,1.939mmol),氮气保护下,室温反应过夜。待底物反应完全后,过滤除去不溶固体,旋干,柱层析分离获得m10共700mg,为黄色固体,产率81%。1h nmr(600mhz,cdcl3)δ9.74(d,j=7.6hz,1h),8.80(d,j=2.2hz,1h),8.15(d,j=8.1hz,1h),7.96(d,j=7.7hz,1h),7.69(dd,j=8.7,2.3hz,1h),7.58
–
7.53(m,2h),7.46
–
7.42(m,1h),7.29(d,j=8.7hz,1h),6.80(dd,j=15.9,7.6hz,1h),5.76(dd,j=10.2,8.0hz,1h),5.52(d,j=3.2hz,1h),5.43
–
5.39(m,1h),5.17(dd,j=10.2,3.5hz,1h),4.27(dd,j=13.2,9.2hz,1h),4.22
–
4.18(m,2h),2.24(s,3h),2.10(s,3h),2.04(s,3h),1.85(s,3h).
13
c nmr(151mhz,cdcl3)δ193.42,170.30,170.19,170.11,169.28,161.38,155.79,151.59,150.92,135.98,130.97,130.89,129.53,128.77,126.49,125.47,123.79,123.05,121.40,115.51,98.88,71.62,71.25,68.51,66.75,61.33,20.76,20.73,20.69,20.57.esi-hrms:m/z calc.for c
30
h
30
no
11
s[m h]
:612.1540,found:612.1539.
[0156]
(3)化合物ksl08的合成
[0157]
将化合物m10(300mg,0.491mmol)置于烧瓶中,加入无水甲醇使其溶解,0℃搅拌片
刻,缓慢滴加甲醇钠溶液(30%in meoh,546μl,2.946mmol),继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到130mg黄色固体ksl08,产率为60%。1h nmr(400mhz,dmso-d6)δ9.69(d,j=7.8hz,1h),8.72(d,j=2.2hz,1h),8.12(dd,j=10.6,8.0hz,2h),8.02(dd,j=8.9,2.2hz,1h),7.91(d,j=15.8hz,1h),7.60
–
7.53(m,1h),7.51
–
7.44(m,2h),6.88(dd,j=15.9,7.8hz,1h),5.32(d,j=7.7hz,1h),5.25(d,j=5.7hz,1h),5.03(d,j=5.9hz,1h),4.72(t,j=5.5hz,1h),4.68(d,j=4.5hz,1h),4.00
–
3.91(m,1h),3.76(t,j=5.7hz,2h),3.62
–
3.47(m,3h).
13
c nmr(101mhz,dmso-d6)δ194.72,162.11,157.13,152.95,151.94,136.39,131.88,130.67,128.49,128.30,126.80,125.64,123.06,122.53,122.28,116.23,101.23,76.36,73.99,70.58,68.54,60.82.esi-hrms:m/z calc.for c
22
h
22
no7s[m h]
:444.1117,found:444.1118.
[0158]
实施例9
[0159]
探针ksl09及其水解产物ksloh09的制备
[0160][0161]
(1)化合物ksloh09的合成
[0162]
将化合物ksloh08(2g,7.11mmol)溶于50ml四氢呋喃中,0℃下边搅拌边加入(1,3-二恶烷-2-甲基)三苯基溴化磷(6.104g,14.228mmol),氢化钠(60%油分散)(1.422g,35.55mmol),18-冠醚(178mg,25mg/mmol),继续搅拌10min后,升温至50~60℃,反应过夜。次日,向反应液中加入少量的水淬灭,然后加入1m hcl溶液至反应液中搅拌。tlc监测,反应结束后,用氨水调ph至7,混合物用乙酸乙酯萃取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到ksloh09共2g,为黄色固体,产率为92%。1h nmr(400mhz,cdcl3)δ9.63(d,j=7.9hz,1h),8.02(d,j=8.1hz,1h),7.94(d,j=7.7hz,1h),7.79(d,j=2.0hz,1h),7.58(dd,j=8.7,2.1hz,1h),7.56
–
7.52(m,1h),7.49
–
7.42(m,1h),7.32
–
7.24(m,1h),7.13(d,j=8.7hz,1h),6.97(m,2h),6.29(dd,j=15.1,7.9hz,1h).
13
c nmr(101mhz,cdcl3)δ193.61,168.53,159.31,152.19,151.63,141.19,132.52,131.35,131.07,127.98,127.46,126.98,125.95,124.69,122.33,121.64,118.77,117.07.esi-hrms:m/z calc.for c
18
h
14
no2s[m h]
:308.0745,found:308.0746.
[0163]
(2)化合物m11的合成
[0164]
准备一干燥的烧瓶,加入化合物ksloh09(500mg,1.361mmol),碳酸铯(2.65g,8.133mmol)和少量无水na2so4,然后加入二氯甲烷作为溶剂,室温搅拌片刻后,加入2,3,4,
6-四乙酰氧基-alpha-d-吡喃糖溴化物(1g,2.424mmol),氮气保护下,室温反应过夜。待底物反应完全后,过滤除去不溶固体,旋干,柱层析分离获得m11共830mg,为黄色固体,产率96%。1h nmr(400mhz,cdcl3)δ9.69(d,j=7.9hz,1h),8.74(s,1h),8.18(d,j=8.1hz,1h),8.01(d,j=7.9hz,1h),7.76
–
7.55(m,3h),7.52
–
7.45(m,1h),7.38
–
7.26(m,1h),7.16
–
7.12(m,2h),6.37(dd,j=15.1,7.9hz,1h),5.83
–
5.75(m,1h),5.56(d,j=2.8hz,1h),5.43(d,j=8.0hz,1h),5.21(dd,j=10.2,3.2hz,1h),4.36
–
4.28(m,1h),4.27
–
4.21(m,2h),2.28(s,3h),2.15(s,3h),2.08(s,4h),1.88(s,3h).
13
c nmr(101mhz,cdcl3)δ193.49,170.28,170.18,170.09,169.26,161.71,154.74,151.95,151.65,140.58,136.14,132.13,132.04,131.80,131.14,130.30,129.17,128.55,128.43,126.49,126.29,125.25,123.87,123.03,121.35,115.43,99.01,71.52,71.27,68.58,66.80,61.34,20.69,20.54.esi-hrms:m/z calc.for c
32
h
32
no
11
s[m h]
:638.1696,found:638.1697.
[0165]
(3)化合物ksl09的合成
[0166]
将化合物m11(300mg,0.470mmol)置于烧瓶中,加入无水甲醇使其溶解,0℃搅拌片刻。同时将甲醇钠(177.7mg,3.29mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到196.2mg白色固体ksl09,产率为89%。1h nmr(400mhz,dmso-d6)δ9.61(d,j=8.1hz,1h),8.11(t,j=8.6hz,2h),7.85(dd,j=8.8,2.2hz,1h),7.58
–
7.52(m,2h),7.51
–
7.40(m,3h),7.34
–
7.29(m,2h),6.35(dd,j=15.0,8.1hz,1h),5.28(d,j=7.7hz,1h),5.23(d,j=5.7hz,1h),5.02(d,j=5.9hz,1h),4.72(t,j=5.5hz,1h),4.67(d,j=4.4hz,1h),3.95(m,1h),3.78
–
3.70(m,2h),3.62
–
3.46(m,3h).
13
c nmr(101mhz,dmso-d6)δ194.50,162.39,156.02,153.33,151.96,141.62,136.40,131.67,131.28,130.11,128.56,126.73,126.59,125.54,122.98,122.52,122.22,116.08,101.31,76.34,74.05,70.66,68.54,60.83.esi-hrms:m/z calc.for c
24
h
24
no7s[m h]
:470.1273,found:470.1274.
[0167]
实施例10
[0168]
探针ksl10的合成
[0169][0170]
(1)化合物m13的合成
[0171]
将化合物m7(600mg,1.02mmol),化合物m12(440mg,2.56mmol)加至烧瓶中,加入无水乙醇作为溶剂,边搅拌边滴加哌啶(94μl,1.18mmol),升温至回流,反应过夜,待底物反应完全后,旋干,柱层析分离得到浅黄色固体m13共153mg,产率为23%。1h nmr(600mhz,cdcl3)δ8.72(d,j=2.1hz,1h),8.12(d,j=8.1hz,1h),7.96(d,j=7.9hz,1h),7.66
–
7.62(m,1h),7.56
–
7.50(m,2h),7.43(t,j=7.6hz,1h),7.31
–
7.27(m,1h),6.78(d,j=16.0hz,1h),6.72(d,j=1.9hz,1h),6.54(d,j=0.8hz,1h),5.76(dd,j=10.1,8.0hz,1h),5.53(d,j=
3.4hz,1h),5.43(d,j=8.0hz,1h),5.19(dd,j=10.2,3.4hz,1h),4.28(dd,j=8.6,4.6hz,1h),4.25
–
4.19(m,2h),2.42(s,3h),2.24(s,3h),2.11(s,3h),2.04(s,3h),1.86(s,3h).
13
c nmr(151mhz,cdcl3)δ170.32,170.20,170.13,169.29,162.04,161.41,158.82,156.26,155.22,151.95,136.42,136.17,130.13,129.94,129.88,126.40,125.35,124.00,123.08,121.41,118.24,115.58,114.97,107.50,106.53,98.92,71.60,71.28,68.55,66.77,61.37,59.71,20.77,20.73,20.58,20.01.esi-hrms:m/z calc.for c
38
h
34
n3o
11
s[m h]
:740.1914,found:740.1908.
[0172]
(2)化合物ksl10的合成
[0173]
将化合物m13(228mg,0.35mmol)置于烧瓶中,加入无水甲醇使其溶解,-20℃搅拌片刻。同时将甲醇钠(132mg,2.44mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到ksl10共70mg,为深黄色固体,产率为35%。1h nmr(600mhz,dmso-d6)δ8.74(s,1h),8.13(d,j=7.8hz,1h),8.09(d,j=8.0hz,1h),7.90(d,j=8.0hz,1h),7.70(d,j=16.1hz,1h),7.57(t,j=7.4hz,1h),7.47(t,j=9.0hz,2h),7.41(d,j=16.1hz,1h),7.00(s,1h),6.70(s,1h),5.31(d,j=7.6hz,1h),5.26(br,1h),5.06(br,1h),4.79
–
4.68(m,2h),3.97(t,j=8.0hz,1h),3.82
–
3.74(m,2h),3.62
–
3.50(m,3h),2.49(s,3h).
13
c nmr(151mhz,dmso-d6)δ164.67,162.30,160.39,157.29,156.45,151.96,137.11,136.42,131.71,129.26,129.08,126.78,125.58,122.95,122.60,122.27,118.74,116.14,115.96,107.44,106.32,101.27,76.34,74.03,70.63,68.52,60.81,56.15,19.87.esi-hrms:m/z calc.for c
30
h
26
n3o7s[m h]
:572.1491,found:572.1490.
[0174][0175]
(3)化合物m14的合成
[0176]
将化合物m6(225mg,0.84mmol),化合物m12(288mg,1.67mmol)加至烧瓶中,加入无水乙醇作为溶剂,边搅拌边滴加哌啶(114μl,1.24mmol),升温至回流,反应过夜,待底物反应完全后,旋干,柱层析分离得到m14共186mg,为深黄色固体,产率为54%。1h nmr(600mhz,cdcl3)δ8.75(s,1h),8.13(d,j=8.1hz,1h),7.95(d,j=7.9hz,1h),7.66(d,j=7.4hz,1h),7.56
–
7.49(m,2h),7.42(t,j=7.5hz,1h),7.14(d,j=8.5hz,1h),6.74(d,j=16.0hz,1h),6.68(d,j=1.7hz,1h),6.55
–
6.51(m,1h),4.14(s,3h),2.40(s,3h).
13
c nmr(101mhz,cdcl3)δ162.02,159.18,158.60,156.36,136.91,130.96,129.58,127.90,126.49,125.25,122.65,122.32,121.38,117.28,115.13,115.09,112.34,107.06,106.42,77.24,56.13,19.99.esi-hrms:m/z calc.for c
25
h
18
n3o2s[m h]
:424.1120,found:424.1121.
[0177]
(4)化合物ksloh10的合成
[0178]
准备干燥的二口烧瓶,加入m14(186mg,0.44mmol),加入无水二氯甲烷作为溶剂,氮气保护下,0℃下缓慢加入bbr3(1m in ch2cl2,2.1ml,2.1mmol),搅拌1h后,转为室温反应再继续搅拌过夜。tlc监测,底物反应完全后,将反应液倒入50ml冰水中,然后用二氯甲烷萃
取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到浅黄色固体ksloh10共38mg,产率为21%。1h nmr(600mhz,dmso-d6)δ12.09(s,1h),8.56(s,1h),8.17(d,j=7.9hz,1h),8.08(d,j=8.1hz,1h),7.80(d,j=7.1hz,1h),7.66(d,j=16.1hz,1h),7.57(t,j=7.5hz,1h),7.47(t,j=7.4hz,1h),7.32(d,j=16.1hz,1h),7.17(d,j=8.5hz,1h),6.95(s,1h),6.69(s,1h),2.48(s,3h).
13
c nmr(151mhz,dmso-d6)δ164.60,164.28,160.63,158.34,157.29,151.85,137.54,135.23,131.93,129.37,127.28,127.02,125.67,122.69,122.54,119.69,118.23,117.58,116.03,107.04,106.26,55.88,19.86.esi-hrms:m/z calc.for c
24
h
16
n3o2s[m h]
:410.0963,found:410.0964.
[0179]
实施例11
[0180]
探针ksl11及其水解产物的制备
[0181][0182]
(1)化合物m16的合成
[0183]
将化合物m7(500mg,0.85mmol),化合物m15(202mg,1.27mmol)加至烧瓶中,加入无水乙醇作为溶剂,边搅拌边滴加哌啶(78μl,0.85mmol),升温至回流,反应过夜,待底物反应完全后,旋干,柱层析分离得到m16共145mg,为深黄色固体,产率为23%。1h nmr(400mhz,cdcl3)δ8.69(d,j=2.1hz,1h),8.15(d,j=8.1hz,1h),7.96(d,j=7.8hz,1h),7.63(dd,j=8.7,2.1hz,1h),7.57
–
7.51(m,1h),7.45
–
7.40(m,1h),7.27(d,8.8hz,1h),7.15(d,j=16.1hz,1h),7.03(d,j=16.2hz,1h),6.89(s,1h),5.76(dd,j=10.2,8.0hz,1h),5.52(d,j=3.3hz,1h),5.40(d,j=8.0hz,1h),5.17(dd,j=10.2,3.4hz,1h),4.31
–
4.17(m,4h),2.84
–
2.79(m,2h),2.66(t,j=5.9hz,2h),2.24(s,3h),2.11(s,3h),2.04(s,3h),1.98(dd,j=12.2,6.0hz,2h),1.85(s,3h).
13
c nmr(101mhz,cdcl3)δ170.35,170.23,170.13,169.69,169.32,161.68,155.38,154.79,151.80,136.07,135.46,131.13,129.89,129.67,129.10,126.38,125.32,124.84,123.73,123.01,121.38,115.52,113.42,112.74,98.92,78.07,77.36,77.25,77.05,76.73,71.57,71.29,68.56,66.81,61.42,29.48,25.10,21.23,20.77,20.75,20.74,20.58.esi-hrms:m/z calc.for c
38
h
36
n3o
10
s[m h]
:726.2121,found:726.2123.
[0184]
(2)化合物ksl11的合成
[0185]
将化合物m16(237mg,0.33mmol)置于烧瓶中,加入无水甲醇使其溶解,-20℃搅拌片刻。同时将甲醇钠(124mg,2.30mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到ksl11共81mg,为深黄色固体,产率为44%。1h nmr(600mhz,dmso-d6)δ8.69(d,j=1.6hz,1h),8.11(dd,j=13.7,8.0hz,2h),7.97
–
7.91(m,1h),7.57(t,j=7.6hz,1h),7.47(dd,j=9.3,5.4hz,1h),7.45
–
7.38(m,3h),6.92(s,1h),5.30(d,j=7.7hz,1h),5.23(d,j=5.7hz,1h),5.01(d,j=5.8hz,1h),4.73(t,j=5.4hz,1h),4.67(d,j=4.3hz,1h),3.96(dd,j=14.5,8.3hz,1h),
3.79
–
3.73(m,2h),3.62
–
3.49(m,3h),2.78(t,j=6.2hz,2h),2.71(t,j=5.6hz,2h),1.93
–
1.85(m,2h).
13
c nmr(151mhz,dmso-d6)δ171.71,162.43,158.49,156.09,151.97,137.38,136.40,131.26,130.43,129.31,129.10,126.75,125.54,124.08,122.98,122.47,122.24,116.04,114.48,113.66,101.23,76.33,75.62,74.02,70.63,68.57,60.85,29.63,24.98,21.32.esi-hrms:m/z calc.for c
30
h
26
n3o6s-[m-h]-:556.1548,found:556.1544.
[0186][0187]
(3)化合物m17的合成
[0188]
将化合物m6(705mg,2.62mmol),化合物m15(620mg,3.92mmol)加至烧瓶中,加入无水乙醇作为溶剂,边搅拌边滴加哌啶(360μl,3.93mmol),升温至回流,反应过夜,待底物反应完全后,旋干,柱层析分离得到m17共95mg,为深黄色固体,产率为9%。1h nmr(400mhz,cdcl3)δ8.76(s,1h),8.18(d,j=8.2hz,1h),7.95(d,j=8.0hz,1h),7.67(dd,j=8.7,2.0hz,1h),7.54(t,j=7.6hz,1h),7.42(t,j=7.5hz,1h),7.14(dd,j=16.8,12.4hz,2h),7.01(d,j=16.1hz,1h),6.86(s,1h),4.13(s,3h),2.82
–
2.77(m,2h),2.65(t,j=6.0hz,2h),2.02
–
1.93(m,2h).
13
c nmr(101mhz,cdcl3)δ169.78,158.20,155.79,136.12,130.47,129.46,129.06,128.18,126.36,125.10,124.36,122.73,121.33,112.31,56.08,29.71,25.15,21.27,14.25.esi-hrms:m/z calc.for c
25
h
20
n3os[m h]
:410.1327,found:410.1325.
[0189]
(4)化合物ksloh11的合成
[0190]
准备干燥的二口烧瓶,加入m17(95mg,0.23mmol),加入无水二氯甲烷作为溶剂,氮气保护下,0℃下缓慢加入bbr3(1m in ch2cl2,1.15ml,1.15mmol),搅拌1h后,转为室温反应再继续搅拌过夜。tlc监测,底物反应完全后,将反应液倒入50ml冰水中,然后用二氯甲烷萃取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到浅黄色固体ksloh11共78mg,产率为85%。1h nmr(600mhz,dmso-d6)δ12.02(s,1h),8.49(d,j=2.1hz,1h),8.17(d,j=7.8hz,1h),8.09(d,j=8.1hz,1h),7.85(dd,j=8.6,2.1hz,1h),7.59
–
7.54(m,1h),7.49
–
7.45(m,1h),7.42(d,j=16.1hz,1h),7.32(d,j=16.1hz,1h),7.14(d,j=8.6hz,1h),6.88(s,1h),2.77(t,j=6.4hz,2h),2.69(t,j=5.9hz,2h),1.91
–
1.84(m,2h).
13
c nmr(151mhz,dmso-d6)δ171.69,164.56,158.73,157.97,151.86,137.85,135.12,131.63,129.47,128.47,128.06,127.00,125.65,123.63,122.70,122.53,119.47,118.17,114.55,113.74,75.17,29.62,24.99,21.34.esi-hrms:m/z calc.for c
24
h
18
n3os[m h]
:396.1171,found:396.1172.
[0191]
实施例12
[0192]
探针ksl12及其水解产物ksloh12的制备
[0193][0194]
(1)化合物m19的合成
[0195]
将化合物m7(530mg,0.91mmol),化合物m18(185mg,1mmol)加至烧瓶中,加入无水乙醇作为溶剂,边搅拌边滴加哌啶(72μl,0.78mmol),升温至回流,反应过夜,待底物反应完全后,旋干,柱层析分离得到m19共232mg,为黄色固体,产率为34%。1h nmr(600mhz,dmso-d6)δ8.66(d,j=2.1hz,1h),8.11(d,j=8.1hz,1h),8.05(d,j=8.0hz,1h),8.01(dd,j=8.9,2.0hz,1h),7.62
–
7.56(m,1h),7.50(dd,j=11.5,4.4hz,1h),7.47(s,2h),7.42(d,j=8.9hz,1h),6.96(s,1h),5.95(d,j=8.0hz,1h),5.50(dd,j=10.1,8.1hz,1h),5.42(d,j=3.4hz,1h),5.32(dd,j=10.2,3.6hz,1h),4.59(t,j=6.4hz,1h),4.14(d,j=6.3hz,2h),2.62(d,j=21.3hz,4h),2.18(s,3h),2.05(s,3h),1.96(s,3h),1.90(s,3h),1.04(s,6h).
13
c nmr(151mhz,dmso-d6)δ170.48,170.35,170.02,169.52,161.63,156.44,154.68,152.05,136.92,135.94,131.56,131.31,129.89,129.71,127.04,126.00,123.28,122.79,122.00,116.27,114.37,113.58,97.43,76.82,71.41,71.17,68.75,67.77,61.88,32.16,31.43,27.95,22.54,21.05,21.00,20.94,20.82.esi-hrms:m/z calc.for c
40
h
40
n3o
10
s[m h]
:754.2434,found:754.2435.
[0196]
(2)化合物ksl12的合成
[0197]
将化合物m19(220mg,0.29mmol)置于烧瓶中,加入无水甲醇使其溶解,-20℃搅拌片刻。同时将甲醇钠(110mg,2.04mmol)溶于无水甲醇中,缓慢滴加至烧瓶中,继续搅拌,tlc监测,待底物反应完后,加入amberlite ir-120plus(h
)调节ph至中性。过滤除去amberlite ir-120plus(h
),收集滤液后旋干,柱层析分离得到ksl12共38mg,为红色固体,产率为22%。1h nmr(600mhz,dmso-d6)δ8.70(d,j=2.2hz,1h),8.13(d,j=7.9hz,1h),8.09(d,j=8.1hz,1h),7.95(dd,j=8.9,2.2hz,1h),7.59
–
7.55(m,1h),7.50
–
7.41(m,4h),6.96(s,1h),5.29(d,j=7.7hz,1h),5.23(d,j=5.5hz,1h),5.01(d,j=4.6hz,1h),4.73(s,1h),4.67(d,j=4.3hz,1h),3.96(dd,j=13.1,9.0hz,1h),3.76(dd,j=12.3,5.4hz,2h),3.61
–
3.49(m,3h),2.64(s,2h),2.61(s,2h),1.04(s,6h).
13
c nmr(151mhz,dmso-d6)δ170.92,162.43,156.67,156.11,151.98,137.42,136.40,131.25,130.42,129.34,129.24,126.75,125.55,122.98,122.48,122.25,116.06,114.44,113.62,101.27,76.47,76.33,74.03,70.64,68.55,60.84,42.82,38.69,32.16,27.96,27.94.esi-hrms:m/z calc.for c
32
h
31
n3nao6s[m na]
:608.1831,found:608.1833.
[0198][0199]
(3)化合物m20的合成
[0200]
将化合物m6(610mg,2.26mmol),化合物m18(540mg,3.42mmol)加至烧瓶中,加入无
水乙醇作为溶剂,边搅拌边滴加哌啶(210μl,2.29mmol),升温至回流,反应过夜,待底物反应完全后,旋干,柱层析分离得到m20共750mg,为红色固体,产率为80%。1h nmr(400mhz,cdcl3)δ8.73(s,1h),8.14(d,j=8.0hz,1h),7.95(d,j=8.0hz,1h),7.66(dd,j=8.7,1.8hz,1h),7.53(t,j=7.6hz,1h),7.41(t,j=7.4hz,1h),7.14(t,j=13.4hz,2h),7.03(d,j=16.1hz,1h),6.87(s,1h),4.12(s,3h),2.61(s,2h),2.48(s,2h),1.09(s,6h).
13
c nmr(101mhz,cdcl3)δ169.32,162.28,158.18,154.01,136.09,135.95,130.37,129.45,129.03,128.32,126.30,125.05,123.28,122.80,122.49,121.32,113.63,112.87,112.29,78.33,56.06,43.00,39.22,32.05,28.06.esi-hrms:m/z calc.for c
27
h
24
n3os[m h]
:438.1640,found:438.1641.
[0201]
(4)化合物ksloh12的合成
[0202]
准备干燥的二口烧瓶,加入m20(300mg,0.69mmol),加入无水二氯甲烷作为溶剂,氮气保护下,0℃下缓慢加入bbr3(1m in ch2cl2,3.43ml,3.43mmol),搅拌1h后,转为室温反应再继续搅拌过夜。tlc监测,底物反应完全后,将反应液倒入50ml冰水中,然后用二氯甲烷萃取三次,合并有机相,用无水na2so4干燥后,旋干,柱层析分离得到ksloh12共121mg,为红色固体,产率为29%。1h nmr(600mhz,dmso-d6)δ12.05(s,1h),8.49(d,j=2.1hz,1h),8.17(d,j=7.9hz,1h),8.08(d,j=8.1hz,1h),7.85(dd,j=8.6,2.1hz,1h),7.59
–
7.54(m,1h),7.49
–
7.46(m,1h),7.45
–
7.39(m,1h),7.35(d,j=16.1hz,1h),7.14(d,j=8.6hz,1h),6.90(s,1h),2.62(s,2h),2.58(s,2h),1.03(s,7h).
13
c nmr(151mhz,dmso-d6)δ170.87,164.64,157.99,156.90,151.85,137.86,135.08,131.61,129.54,128.47,128.22,127.03,125.68,122.68,122.54,119.42,118.19,114.51,113.69,76.01,42.80,38.69,32.15,27.94.esi-hrms:m/z calc.for c
26
h
22
n3os[m h]
:424.1484,found:424.1485.
[0203]
实施例13
[0204]
检测荧光探针在加入米曲霉β-半乳糖苷酶(a.oryzaeβ-gal)、大肠杆菌β-半乳糖苷酶(e.coliβ-gal)前后的紫外-可见吸收光谱和荧光光谱的变化。
[0205]
取荧光探针溶于二甲基亚砜(dmso)中,配置成1mmol/l储备液。从储备液中取40μl加入到5ml离心管中,用pbs缓冲溶液(10mmol/l,a.oryzaeβ-gal测试使用ph=4.5的pbs缓冲液,e.coliβ-gal测试使用ph=7.4的pbs缓冲液)稀释至3ml,再加入1ml浓度为40u/ml的β-半乳糖苷酶标准溶液,37℃孵育10min作为实验组。空白组取40μl上述探针储备液至5ml离心管中,直接用pbs稀释至4ml,不加β-半乳糖苷酶,37℃孵育10min。测量实验组和空白组样品紫外吸收及荧光光谱性质。
[0206]
如图1所示,荧光探针ksl01-ksl12溶液在加入a.oryzaeβ-gal后发生显著的紫外-可见吸收光谱变化,其变化趋势趋向于荧光探针水解产物ksloh01-ksloh12的紫外-可见吸收光谱,说明a.oryzaeβ-gal将探针底物糖苷键切断,释放出荧光团。
[0207]
如图2所示,荧光探针ksl01-ksl12溶液在加入a.oryzaeβ-gal后发生显著的荧光光谱变化,发生显著的红移,其变化趋势趋向于荧光探针水解产物ksloh01-ksloh12的荧光光谱,说明a.oryzaeβ-gal将探针底物糖苷键切断,释放出荧光团。探针ksl01-ksl12溶液与a.oryzaeβ-gal共孵育后的最大发射波长如表1所示。
[0208]
表1.探针ksl01-ksl12溶液与a.oryzaeβ-gal共孵育后的最大发射波长
[0209][0210]
如图3所示,荧光探针ksl01-ksl12溶液在加入e.coliβ-gal后,探针ksl01-ksl06发生显著的荧光光谱变化,发生显著的红移,其变化趋势趋向于荧光探针水解产物ksloh01-ksloh06的荧光光谱,说明e.coliβ-gal能将探针ksl01-ksl06中的糖苷键切断,释放出荧光团。探针ksl07溶液在加入e.coliβ-gal后荧光光谱也发生变化,其在探针本身及荧光团(ksloh07)最大发射波长处均有荧光发生,说明探针ksl07被e.coliβ-gal不完全水解。探针ksl08-ksl12溶液在加入e.coliβ-gal后荧光光谱基本没有发生变化,其与荧光探针水解产物ksloh08-ksloh12的荧光光谱完全不同,说明e.coliβ-gal不能将探针ksl08-ksl12中的糖苷键切断。综合图2实验结果,说明探针ksl08-ksl12具有种属特异性,能够识别真核来源的a.oryzaeβ-gal,但是不识别细菌来源的e.coliβ-gal。
[0211]
实施例14
[0212]
荧光探针随a.oryzaeβ-gal浓度升高荧光光谱图的变化及线性关系。
[0213]
取荧光探针ksl01-ksl12溶于二甲基亚砜(dmso)中,配置成1mmol/l储备液。从储备液中取40μl加入到5ml离心管中,用pbs缓冲溶液(10mmol/l,ph=4.5)稀释,再加入不同单位浓度的a.oryzaeβ-gal标准溶液(终浓度为0-1u/ml不等),样品总体积为4ml。上述样品在37℃下进行孵育,并保持同一探针不同酶浓度下孵育时间相同,然后测量其荧光光谱性质。
[0214]
如图4所示,荧光探针ksl01-ksl12溶液与不同浓度a.oryzaeβ-gal标准溶液共孵育后发生显著的荧光光谱变化。随着酶浓度的增加,探针所释放荧光团的最大发射波长处荧光均逐渐增强,其中探针ksl04、ksl06、ksl07、ksl10、ksl11、ksl12发射波长具有逐渐红移的现象此外,在一定a.oryzaeβ-gal浓度范围内,探针最大发射波长处荧光强度与酶浓度呈现出良好的线性关系,其中探针ksl11在662nm处荧光强度与570nm处荧光强度成良好的比率线性关系。
[0215]
根据公式检测限(lod)=3σ/k可以计算出探针ksl01-ksl12对a.oryzaeβ-gal浓度的最低检出范围,其中σ是10次空白对照组的标准偏差,k是线性方程的斜率。
[0216]
根据公式计算得12个探针分子的检测限,如表2所示。
[0217]
表2.探针ksl01-ksl12对a.oryzaeβ-gal的检测限
[0218][0219]
实施例15
[0220]
荧光探针加入a.oryzaeβ-gal后荧光光谱随时间变化的关系。
[0221]
考察荧光探针ksl01-ksl12(10μm)与a.oryzaeβ-gal(10u/ml)在ph=4.5的pbs缓冲溶液中的荧光强度随时间的变化,测试温度为37℃。探针分子的时间动力学曲线如图5所示,当加入a.oryzaeβ-gal后,荧光光谱发生显著的荧光增强和/或最大发射波长红移,并在40s-20min内达到最大值。
[0222]
实施例16
[0223]
荧光探针对β-gal的选择性实验。
[0224]
考察荧光探针对a.oryzaeβ-gal、e.coliβ-gal,与其它生物酶、小分子的选择性问题,验证探针分子是否会受其它生物、化学分子的干扰。代表性探针分子ksl04(10μm)和ksl11(10μm),与a.oryzaeβ-gal、e.coliβ-gal、esterase、pepsin、trypsin、cellulase等生物酶(均10u/ml),及lzm、dtt、gsh、l-cys、hcy、h2o2等小分子(10μm)孵育20min,结果如图6所示,显示探针ksl04选择性响应a.oryzaeβ-gal和e.coliβ-gal,其最大发射波长处荧光有显著增强现象,而不受其它分析物的干扰。探针ksl11选择性响应a.oryzaeβ-gal,其最大发射波长处荧光有显著增强现象,而不受e.coliβ-gal及其它分析物的干扰。
[0225]
实施例17
[0226]
荧光探针的细胞毒性实验。
[0227]
采用cck-8法检测荧光探针对3种细胞系的细胞毒性,考察探针分子的生物相容性。荧光探针ksl01-ksl12在5-100μm浓度下与mrc5细胞于37℃孵育48h,如图7所示,其中探针ksl01、ksl02、ksl04在50μm和100μm高浓度下出现明显细胞死亡,其余探针分子未出现显著细胞毒性。但是在荧光探针实验浓度下(10μm)均未出现细胞死亡现象。荧光探针ksl01-ksl12在5-100μm浓度下与skov3细胞于37℃孵育48h,如图8所示,所有探针分子在实验浓度下(10μm)均未出现细胞死亡现象,其中探针ksl01、ksl02、ksl04、ksl12在50μm和100μm高浓度下出现明显细胞死亡,其余探针分子均未出现显著细胞毒性。荧光探针ksl01-ksl12在5-100μm浓度下与hepg2细胞于37℃孵育48h,如图9所示,所有探针分子在实验浓度下(10μm)均未出现细胞死亡现象,其中探针ksl01、ksl02、ksl04在100μm高浓度下出现明显细胞死亡,其余探针分子均未出现显著细胞毒性。综合分析,本发现提供的基于hbt骨架的β-gal荧光探针分子细胞毒性低,具有良好的生物兼容性。
[0228]
实施例18
[0229]
荧光探针在活细胞荧光成像中的应用。
[0230]
使用10μm浓度的荧光探针ksl01-ksl12分别与衰老的mrc5细胞(人胚肺成纤维细胞)和skov3细胞(人卵巢癌细胞)在37℃下孵育30min,用荧光共聚焦显微镜观察成像效果,结果如图10所示。荧光探针ksl01-ksl12的激发波长及发射波长范围如表3所示。mrc5和skov3都是高表达β-半乳糖苷酶的细胞,其中mrc5是人源正常细胞,随着细胞衰老,sa-β-gal过量表达,而skov3是高表达β-gal的肿瘤细胞。由图10可知,探针ksl01-ksl12与两种细胞孵育后均有显著荧光产生,发射荧光从绿光到近红外光。
[0231]
表3.荧光探针ksl01-ksl12共聚焦显微镜的拍摄条件
[0232][0233]
实施例19
[0234]
荧光探针在检测衰老细胞和细胞衰老程度中的应用。
[0235]
用荧光探针检测正常细胞随着衰老荧光强度的变化。将代表性荧光探针ksl04与连续培养的mrc5细胞孵育,mrc5细胞从22代连续培养到29代,代表了正常细胞从年轻到衰老的自然过程。取10μm浓度的ksl04与不同代数mrc5细胞在37℃下孵育20min,用荧光共聚焦显微镜观察成像效果。如图11中a所示,随着细胞培养代数增多,细胞逐渐衰老,荧光强度逐渐增强。由图11中b中的细胞荧光强度定量结果可以直观看出荧光强度随细胞培养代数逐渐增强的变化趋势。说明随着细胞衰老β-gal表达量逐渐上升,本发明提供的荧光探针分子可以准确定性定量检测细胞衰老。用抗衰老药物雷帕霉素(rapa,10nm,25nm)提前3天与29代(p29)mrc5细胞孵育,结果如图11所示,相较于未给药的p29空白组,p29 rapa组荧光强度显著下降,通过荧光定量方法证明了雷帕霉素的抗衰老药效,表明本发明提供的荧光探针分子能够作为一种工具分子检测抗衰老药效,建立一种基于荧光可视化的抗衰老药效评价方法。
[0236]
实施例20
[0237]
荧光探针在检测组织器官衰老中的应用。
[0238]
取不同年龄小鼠的组织器官制备冷冻切片,与荧光探针孵育后检测荧光强度,考察探针分子在检测组织器官衰老中的应用。将1月龄,13月龄,23月龄的c57bl/6j小鼠取肾脏制备冷冻切片,然后与代表性探针分子ksl04(10μm)和ksl11(10μm)在37℃下孵育1h,用荧光共聚焦显微镜观察成像效果。如图12中a所示,与探针分子ksl04和ksl11共孵育之后,
随着年龄增长肾脏切片荧光强度逐渐增强,即荧光强度23月龄>13月龄>1月龄。图12中b所述的切片荧光强度定量结果柱状图可以直观得出上述结论。结果证明随着年龄增长肾脏组织中β-gal含量逐渐增多,本发明提供的荧光探针能够检测组织器官水平的衰老。
[0239]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。