1.本发明涉及生物技术领域,更具体地涉及一种赖脯胰岛素衍生物及其应用。
背景技术:
2.糖尿病是全球范围内威胁人类健康的一大疾病。在中国,随着人民生活方式的改变和老龄化进程的加快,糖尿病的患病率呈快速上升趋势。糖尿病的急慢性并发症,尤其是慢性并发症累计多个器官,致残、致死率高,严重影响患者的身心健康,并给个人、家庭和社会带来沉重的负担。
3.赖脯胰岛素为第一个速效人胰岛素的类似物,属于第三代胰岛素,是人胰岛素b链的28位、29位脯氨酸和赖氨酸的顺序换位。这种互换改变了b链末端的空间结构,减少了二聚体内胰岛素单体间的非极性接触和β片层间的相互作用,使胰岛素的自我聚合特性发生改变,易于解离,注射后能较快分解,从而加速皮下注射后的吸收,有利于控制进餐后迅速升高的高血糖。它能很好地模拟人胰岛素的分泌模式,其药代动力学特性是常规人胰岛素的一半左右,其起效时间是10~15分钟,达峰时间为1~1.5小时,作用持续时间缩短至4~6小时,使患者在获得良好的血糖控制的同时不易与餐前或者夜间胰岛素作用发生叠加,显著减少了夜间低血糖的发生率。此外,与人胰岛素相比,它具有安全性高和患者依从性好等优点。
4.目前,现有技术中的赖脯胰岛素制备工艺较为复杂,产量也不高,影响其进一步地推广和应用。因此,本领域迫切需要开发工艺简单、环境友好、收率高、产量高的赖脯胰岛素的制备及纯化方法。
技术实现要素:
5.本发明的目的在于提供一种赖脯胰岛素衍生物及其应用。
6.在本发明的第一方面,提供了一种重组赖脯胰岛素融合蛋白,具有式i所示的结构:
7.a-fp-tev-r-g
ꢀꢀꢀ
(i)
8.式中,
9.“-”
代表肽键;
10.a为无或前导肽,
11.fp为绿色荧光蛋白折叠单元,
12.tev为酶切位点,较佳地为tev酶酶切位点;
13.r为用于酶切的精氨酸或赖氨酸;
14.g为赖脯胰岛素或其活性片段;
15.其中,所述的绿色荧光蛋白折叠单元包含2-6个,较佳地2-3个选自下组的β-折叠单元:
16.β-折叠单元氨基酸序列
u1vpilveldgdvng(seq id no:11)u2hkfsvrgegegdat(seq id no:12)u3kltlkfictt(seq id no:13)u4yvqertisfkd(seq id no:14)u5tyktraevkfegd(seq id no:15)u6tlvnrielkgidf(seq id no:16)u7hnvyitadkq(seq id no:17)u8gikanfkirhnved(seq id no:18)u9vqladhyqqntpig(seq id no:19)u10hylstqsvlskd(seq id no:20)u11hmvllefvtaagi(seq id no:21)。
17.在另一优选例中,其特征在于,所述的绿色荧光蛋白折叠单元为u8-u9、u9-u10-u11、或u10-u11。
18.在另一优选例中,其特征在于,所述的g为boc修饰的赖脯胰岛素前体,具有式ii所示的结构:
19.gb-x-ga
ꢀꢀꢀ
(ii)
20.式中,
21.gb为第28位boc修饰的赖脯胰岛素b链,氨基酸序列如seq id no:5的第1-30位所示,
22.x为连接肽,较佳地,x的氨基酸序列为r、rr、rrr,或如seq id no:6-9所示(rrgskr,rraakr,rrypgdvkr或rreaedlqvgqvelgggpgagslqplalegslqkr);
23.ga为赖脯胰岛素a链,氨基酸序列如seq id no:5的第32-52位所示。
24.在另一优选例中,所述的r用于胰蛋白酶和羧肽酶酶切。
25.在另一优选例中,g为序列如seq id no:5所示的boc修饰的赖脯胰岛素。
26.在另一优选例中,gb-x-ga之间存在链内二硫键。
27.在另一优选例中,所述的重组赖脯胰岛素融合蛋白的序列如seq id no:1、22、23所述。
28.在另一优选例中,所述赖脯胰岛素b链第7位与a链第7位(a7-b7)、b链第19位与a链第20位(a20-b19)之间形成链间二硫键。
29.在另一优选例中,所述赖脯胰岛素a链第6位与a链第11位(a6-a11)之间形成链内二硫键。
30.在另一优选例中,所述gb的第28位为nε-(叔丁氧羰基)-赖氨酸。
31.在本发明的第二方面,提供了双链赖脯胰岛素融合蛋白,具有式iii所示的结构:
32.a-fp-tev-r-d
ꢀꢀꢀ
(iii)
33.式中,
34.“-”
代表肽键;
35.a为无或前导肽,较佳地为序列如seq id no:2所示的前导肽,
36.fp为绿色荧光蛋白折叠单元,
37.tev为酶切位点,较佳地为tev酶酶切位点(序列为enlyfqg,seq id no:4);
38.r为用于酶切的精氨酸或赖氨酸;
39.d为boc修饰的双链赖脯胰岛素,所述主链具有下式iv的结构;
[0040][0041]
式中,
[0042]
“║”
代表二硫键;
[0043]
ga为赖脯胰岛素a链,氨基酸序列如seq id no:5的第32-52位所示,
[0044]
x为无或为连接肽;
[0045]
gb为第28位boc修饰的赖脯胰岛素b链,氨基酸序列如seq id no:5的第1-30位所示;
[0046]
其中,所述的绿色荧光蛋白折叠单元包含2-6个,较佳地2-3个选自下组的β-折叠单元:
[0047]
β-折叠单元氨基酸序列u1vpilveldgdvng(seq id no:11)u2hkfsvrgegegdat(seq id no:12)u3kltlkfictt(seq id no:13)u4yvqertisfkd(seq id no:14)u5tyktraevkfegd(seq id no:15)u6tlvnrielkgidf(seq id no:16)u7hnvyitadkq(seq id no:17)u8gikanfkirhnved(seq id no:18)u9vqladhyqqntpig(seq id no:19)u10hylstqsvlskd(seq id no:20)u11hmvllefvtaagi(seq id no:21)。
[0048]
在另一优选例中,所述的绿色荧光蛋白折叠单元为u8-u9、u9-u10-u11、或u10-u11。
[0049]
在另一优选例中,所述的绿色荧光蛋白折叠单元的氨基酸序列如seq id no:3、24、25所示。
[0050]
在另一优选例中,所述赖脯胰岛素b链的c端通过连接肽与赖脯胰岛素a链的n端相连。
[0051]
在另一优选例中,所述的x为连接肽,较佳地,x的氨基酸序列为r、rr、rrr,或如seq id no:6-9所示(rrgskr,rraakr,rrypgdvkr或rre aedlqvgqvelgggpgagslqplalegslqkr)。
[0052]
在本发明的第三方面,提供了一种boc修饰的赖脯胰岛素前体,具有式ii所示的结构:
[0053]
gb-x-ga
ꢀꢀꢀ
(ii)
[0054]
式中,
[0055]
gb为第28位boc修饰的赖脯胰岛素b链,氨基酸序列如seq id no:5的第1-30位所
示,
[0056]
x为连接肽,较佳地,x的氨基酸序列为r、rr、rrr,或如seq id no:6-9所示(rrgskr,rraakr,rrypgdvkr或rreaedlqvgqvelgggpgagslqplalegslqkr);
[0057]
ga为赖脯胰岛素a链,氨基酸序列如seq id no:5的第32-52位所示。
[0058]
在另一优选例中,所述的保护赖氨酸为nε-(叔丁氧羰基)-赖氨酸。
[0059]
在本发明的第四方面,提供了一种boc修饰的赖脯胰岛素,具有式iv所示的结构:
[0060][0061]
式中,
[0062]
“║”
代表二硫键;
[0063]
ga为赖脯胰岛素a链,氨基酸序列如seq id no:5的第32-52位所示,
[0064]
gb为赖脯胰岛素b链,氨基酸序列如seq id no:5的第1-30位所示,且所述b链第28位的赖氨酸为nε-(叔丁氧羰基)-赖氨酸。
[0065]
在本发明的第五方面,提供了一种制备赖脯胰岛素的方法,所述方法包括步骤:
[0066]
(i)利用重组菌进行发酵,制备重组赖脯胰岛素融合蛋白(第一蛋白)发酵液;
[0067]
(ii)对所述重组赖脯胰岛素融合蛋白(第一蛋白)进行酶切,从而获得含boc修饰的赖脯胰岛素(第二蛋白)的混合液i;
[0068]
(iii)对所述的boc修饰的赖脯胰岛素(第二蛋白)进行脱保护处理,从而获得含脱保护的赖脯胰岛素(第三蛋白)的混合液ii;
[0069]
(iv)对混合液ii进行纯化处理,从而获得赖脯胰岛素。
[0070]
在另一优选例中,在步骤(ii)中,所述酶切的温度为32-42℃,较佳地为36-38℃。
[0071]
在另一优选例中,制得的赖脯胰岛素纯度高于99%。
[0072]
在另一优选例中,制得的赖脯胰岛素具有赖脯胰岛素活性。
[0073]
在另一优选例中,所述的保护赖氨酸为带有保护基团的赖氨酸。
[0074]
在另一优选例中,所述的保护赖氨酸为nε-(叔丁氧羰基)-赖氨酸。
[0075]
在另一优选例中,在步骤(i)中,利用重组菌进行重组赖脯胰岛素融合蛋白的发酵生产。
[0076]
在另一优选例中,所述的重组菌中包含或整合有表达重组赖脯胰岛素融合蛋白的表达盒。
[0077]
在另一优选例中,在步骤(i)中,从所述重组菌的发酵液中分离获得重组赖脯胰岛素融合蛋白包涵体。
[0078]
在另一优选例中,在步骤(i)中,还包括对所述包涵体进行变性和复性,从而获得蛋白折叠正确的重组赖脯胰岛素融合蛋白(第一蛋白)的步骤。
[0079]
在另一优选例中,所述的蛋白折叠正确的重组赖脯胰岛素融合蛋白中的赖脯胰岛素a链和b链间包含链内二硫键。
[0080]
在另一优选例中,所述的重组赖脯胰岛素融合蛋白如本发明第一方面所述。
[0081]
在另一优选例中,在步骤(ii)中,利用胰蛋白酶进行所述酶切。
[0082]
在另一优选例中,在步骤(ii)中,所述的胰蛋白酶为重组的猪胰蛋白酶。
[0083]
在另一优选例中,在步骤(ii)中,所述胰蛋白酶与重组赖脯胰岛素前体的质量比为1:1000-40000,较佳地为1:3000-30000。
[0084]
在另一优选例中,在步骤(ii)中,所述酶切的时间为10-30h,较佳地为14-20h。
[0085]
在另一优选例中,在步骤(ii)中,所述酶切的ph为7.0-9.5,较佳地为8.0-9.0.。
[0086]
在另一优选例中,在步骤(iii)中,向反应体系中加入酸性溶剂,如盐酸,进行所述脱保护处理。
[0087]
在另一优选例中,在步骤(iii)中,搅拌条件下加酸至ph1.0~2.5。
[0088]
在另一优选例中,在步骤(iii)中,所述脱保护反应的温度为4-37℃,较佳地为18-25℃。
[0089]
在另一优选例中,在步骤(iii)中,所述脱保护反应的时间为0.5-8h,较佳地为0.5-3h。
[0090]
在另一优选例中,所述的boc-赖脯胰岛素是nε-(叔丁氧羰基)-赖氨酸赖脯胰岛素。
[0091]
在本发明的第六方面,提供了一种赖脯胰岛素制剂,所述的赖脯胰岛素制剂使用本发明第五方面所述的方法制备的。
[0092]
在另一优选例中,所述的赖脯胰岛素制剂中包含的赖脯胰岛素纯度高于99%。
[0093]
在另一优选例中,所述的赖脯胰岛素制剂中包含的赖脯胰岛素具有天然赖脯胰岛素活性。
[0094]
本发明的第七方面,提供了一种分离的多核苷酸,所述多核苷酸编码本发明第一方面所述的重组赖脯胰岛素融合蛋白、本发明第二方面所述的赖脯胰岛素主链融合蛋白、本发明第三方面所述的boc修饰的赖脯胰岛素前体、或本发明第四方面所述的boc修饰的赖脯胰岛素主链。
[0095]
本发明的第八其方面,提供了一种载体,所述载体包括本发明第七方面所述的多核苷酸。
[0096]
在另一优选例中,所述的载体选自下组:dna、rna、质粒、慢病毒载体、腺病毒载体、逆转录病毒载体、转座子、或其组合。
[0097]
本发明的第九方面,提供了一种宿主细胞,所述的宿主细胞含有本发明第八方面所述的载体、或染色体中整合有外源的本发明第七方面所述的多核苷酸、或表达本发明第一方面所述的重组赖脯胰岛素融合蛋白、本发明第二方面所述的赖脯胰岛素主链融合蛋白、本发明第三方面所述的boc修饰的赖脯胰岛素前体、或本发明第四方面所述的boc修饰的赖脯胰岛素主链。
[0098]
在另一优选例中,所述的宿主细胞为大肠杆菌、枯草芽孢杆菌、酵母细胞、昆虫细胞、哺乳动物细胞或其组合。
[0099]
本发明的第十方面,提供了一种制剂或药物组合物,所述制剂包含本发明第一方面所述的重组赖脯胰岛素融合蛋白、本发明第二方面所述的赖脯胰岛素主链融合蛋白、本发明第三方面所述的boc修饰的赖脯胰岛素前体、或本发明第四方面所述的boc修饰的赖脯胰岛素主链,以及药学上可接受的载体。
[0100]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具
体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
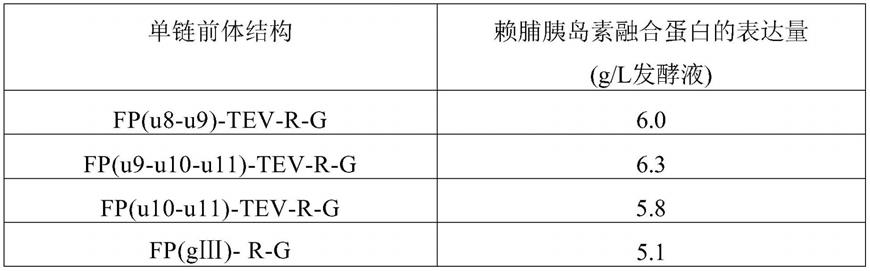
[0101]
图1显示了质粒pbad-fp-tev-r-g图谱。
[0102]
图2显示了质粒pevol-pylrs-pylt图谱。
[0103]
图3显示了包涵体变复性后赖脯胰岛素融合蛋白的sds-page电泳图。
[0104]
图4显示了第三次层析后赖脯胰岛素的hplc检测图谱。
具体实施方式
[0105]
本发明人经过广泛而深入地研究,发现了一种赖脯胰岛素衍生物及其制备方法。具体地,本发明提供了包含绿色荧光蛋白折叠单元和赖脯胰岛素或其活性片段的融合蛋白。本发明的融合蛋白表达量显著提高,融合蛋白中的赖脯胰岛素蛋白折叠正确,具有生物活性。并且,本发明融合蛋白中的绿色荧光蛋白折叠单元可以被蛋白酶消化成小片段,和目的蛋白相比分子量差别大,容易分离。本发明还提供了利用该融合蛋白制备赖脯胰岛素的方法及制备中间体。
[0106]
术语
[0107]
为了可以更容易地理解本公开,首先定义某些术语。如本技术中所使用的,除非本文另有明确规定,否则以下术语中的每一个应具有下面给出的含义。在整个申请中阐述了其它定义。
[0108]
术语“约”可以是指在本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其将部分地取决于如何测量或测定值或组成。
[0109]
赖脯胰岛素
[0110]
胰岛素类产品是糖尿病市场第一大用药品种,占据53%左右市场份额,其中又以三代重组胰岛素为主。赖脯胰岛素属于第三代重组胰岛素,是一种速效胰岛素(或称餐时胰岛素),皮下注射后10~15分钟起效,1~1.5小时达到峰值,作用持续时间为4~6小时。
[0111]
赖脯胰岛素表达质粒的构建
[0112]
合成fp-tev-r-g目的基因,该基因两端具有限制性内切酶ncoⅰ和xhoⅰ的识别位点,含有赖脯胰岛素的编码基因a。该序列进行了密码子优化,可以实现功能蛋白在大肠杆菌中的高水平表达。表达后使用限制性内切酶ncoⅰ和xhoⅰ酶切表达载体“pbad/his a(kana
r
)”和含有“fp-tev-r-g”目的基因的质粒,酶切产物通过琼脂糖电泳进行分离,再使用琼脂糖凝胶dna回收试剂盒进行提取,最后使用t4 dna连接酶将两个dna片段连接起来。将所述连接产物以化学法转化至大肠杆菌top10细胞,将所述转化的细胞培养在含有50μg/ml卡那霉素的lb琼脂培养基(10g/l酵母蛋白胨,5g/l酵母浸粉,10g/l nacl,1.5%琼脂)上过夜。挑取3个活菌落,在5ml含有50μg/ml卡那霉素的液体lb培养基(10g/l酵母蛋白胨,5g/l酵母浸粉,10g/l nacl)中过夜培养,使用质粒小量提取试剂盒进行质粒提取。然后,将所述提取的质粒使用测序寡核苷酸引物5
’-
atgccatagcatttttatcc-3’进行测序,以确认正确插入。最终得到的质粒被命名为“pbad-fp-tev-r-g”。
[0113]
融合蛋白
[0114]
利用绿色荧光蛋白折叠单元,本发明构建了两种融合蛋白,即本发明第一方面所述的包含单链赖脯胰岛素前体的重组赖脯胰岛素融合蛋白和本发明第二方面所述的包含双链赖脯胰岛素的双链赖脯胰岛素融合蛋白。事实上,本发明的两种融合蛋白的保护范围可能部分重叠,例如融合蛋白中包含的双链形式的赖脯胰岛素,其b链的c端也可以连接肽与a链的n端相连,也可以被认定为包含链内二硫键的单链。
[0115]
本发明的融合蛋白中包含的绿色荧光蛋白折叠单元fp包含2-6个,较佳地2-3个选自下组的β-折叠单元:
[0116] 氨基酸序列u1vpilveldgdvng(seq id no:11)u2hkfsvrgegegdat(seq id no:12)u3kltlkfictt(seq id no:13)u4yvqertisfkd(seq id no:14)u5tyktraevkfegd(seq id no:15)u6tlvnrielkgidf(seq id no:16)u7hnvyitadkq(seq id no:17)u8gikanfkirhnved(seq id no:18)u9vqladhyqqntpig(seq id no:19)u10hylstqsvlskd(seq id no:20)u11hmvllefvtaagi(seq id no:21)。
[0117]
在另一优选例中,所述的绿色荧光蛋白折叠单元fp可以选自:u8、u9、u2-u3、u4-u5、u8-u9、u1-u2-u3、u2-u3-u4、u3-u4-u5、u5-u6-u7、u8-u9-u10、u9-u10-u11、u3-u5-u7、u3-u4-u6、u4-u7-u10、u6-u8-u10、u1-u2-u3-u4、u2-u3-u4-u5、u3-u4-u3-u4、u3-u5-u7-u9、u5-u6-u7-u8、u1-u3-u7-u9、u2-u2-u7-u8、u7-u2-u5-u11、u3-u4-u7-u10、u1-i-u2、u1-i-u5、u2-i-u4、u3-i-u8、u5-i-u6、或u10-i-u11。
[0118]
在另一优选例中,所述的绿色荧光蛋白折叠单元为u8-u9、u9-u10-u11、或u10-u11。
[0119]
在另一优选例中,本发明所述的具有式i所示结构的融合蛋白:
[0120]
fp-tev-r-g
ꢀꢀꢀ
(i)
[0121]
“-”
代表肽键;
[0122]
fp为绿色荧光蛋白折叠单元;
[0123]
tev为酶切位点,较佳地为tev酶酶切位点(识别序列为enlyfqg,seq id no:4);
[0124]
r为酶切位点,较佳地为胰蛋白酶酶切位点(识别位点为r或者k);
[0125]
a为boc修饰的赖脯胰岛素前体,具有式ⅱ所示的结构:
[0126]
(b1f~b28boc-k~b29p~b30t)-x-(a1g~a21n)
ꢀꢀꢀ
(ⅱ)
[0127]
式中,
[0128]
x为连接肽,较佳地,x的氨基酸序列为r、rr、rrr,或如seq id no:6-9所示(rrgskr,rraakr,rrypgdvkr或
[0129]
rreaedlqvgqvelgggpgagslqplalegslqkr)。
[0130]
在另一优选例中,本发明的重组赖脯胰岛素前体的序列如seq id no:22所示,序
列为:
[0131]
vqladhyqqntpighylstqsvlskdhmvllefvtaagienlyfqgrfvnqhlcgshlvealylvcgergffytk(boc)ptrgiveqcctsicslyqlenycn其中k(boc)为boc修饰的赖氨酸。
[0132]
如本文所用,术语“融合蛋白”还包括具有上述活性的变异形式。这些变异形式包括(但并不限于):1-3个(通常为1-2个,更佳地1个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加或缺失一个或数个(通常为3个以内,较佳地为2个以内,更佳地为1个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加或缺失一个或数个氨基酸通常也不会改变蛋白质的结构和功能。此外,所述术语还包括单体和多聚体形式的本发明多肽。该术语还包括线性以及非线性的多肽(如环肽)。
[0133]
本发明还包括上述融合蛋白的活性片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明融合蛋白的功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或几个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合于此多肽序列而形成的多肽(与前导序列、分泌序列或6his等标签序列融合而形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
[0134]
一类优选的活性衍生物指与本发明的氨基酸序列相比,有至多3个,较佳地至多2个,更佳地至多1个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。
[0135]
表a
[0136]
最初的残基代表性的取代优选的取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;lys;argglnasp(d)gluglucys(c)sersergln(q)asnasnglu(e)aspaspgly(g)pro;alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;pheleuleu(l)ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)leu;val;ile;ala;tyrleupro(p)alaalaser(s)thrthr
thr(t)sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;alaleu
[0137]
本发明还提供本发明融合蛋白的类似物。这些类似物与本发明的多肽的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的多肽并不限于上述例举的代表性的多肽。
[0138]
此外,还可以对本发明融合蛋白进行修饰。修饰(通常不改变一级结构)形式包括:体内或体外的多肽的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在多肽的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的多肽。这种修饰可以通过将多肽暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的多肽。
[0139]
术语“编码本发明融合蛋白的多核苷酸”可以是包括编码本发明融合蛋白的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0140]
本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽或融合蛋白的片段、类似物和衍生物。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的融合蛋白的功能。
[0141]
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件(或严紧条件)下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。
[0142]
本发明的融合蛋白和多核苷酸优选以分离的形式提供,更佳地,被纯化至均质。
[0143]
本发明多核苷酸全长序列通常可以通过pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
[0144]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
[0145]
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
[0146]
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和
细胞中。
[0147]
应用pcr技术扩增dna/rna的方法被优选用于获得本发明的多核苷酸。特别是很难从文库中得到全长的cdna时,可优选使用race法(race-cdna末端快速扩增法),用于pcr的引物可根据本文所公开的本发明的序列信息适当地选择,并可用常规方法合成。可用常规方法如通过凝胶电泳分离和纯化扩增的dna/rna片段。
[0148]
表达载体
[0149]
本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或本发明融合蛋白编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽的方法。
[0150]
通过常规的重组dna技术,可利用本发明的多聚核苷酸序列可用来表达或生产重组的融合蛋白。一般来说有以下步骤:
[0151]
(1).用本发明的编码本发明融合蛋白的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
[0152]
(2).在合适的培养基中培养的宿主细胞;
[0153]
(3).从培养基或细胞中分离、纯化蛋白质。
[0154]
本发明中,编码融合蛋白的多核苷酸序列可插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其他载体。只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
[0155]
本领域的技术人员熟知的方法能用于构建含本发明融合蛋白编码dna序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;λ噬菌体pl启动子;真核启动子包括cmv立即早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、反转录病毒的ltrs和其他一些已知的可控制基因在原核或真核细胞或其病毒中表达的启动子。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
[0156]
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(gfp),或用于大肠杆菌的四环素或氨苄青霉素抗性。
[0157]
包含上述的适当dna序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0158]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母、植物细胞(如人参细胞)。
[0159]
本发明的多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列时将会使转录得到增强。增强子是dna的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。可举的例子包括在复制起始点晚期一侧的100到270个碱基对的sv40增强子、在复制起始点晚期一侧的多瘤增强子以及腺病毒增强子等。
[0160]
本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。
[0161]
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原
核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
[0162]
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0163]
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0164]
本发明的主要优点包括:
[0165]
(1)本发明的方法不需要对发酵液上清中过量的无机盐采用稀释、超滤换液等方法去除,获得的包涵体纯度较高,并且色素比较少,为后续纯化减少分离物质,降低纯化成本。且本方法中的阳离子层析分离赖脯胰岛素,一步收率达80%以上。
[0166]
(2)由于b
28
位boc赖氨酸的保护,胰蛋白酶酶切时不会识别b
28
位赖氨酸,不产生某些副产物,能够提升酶切收率,并且减少赖脯胰岛素类似物杂质,为后续纯化分离提供方便。
[0167]
(3)在酶切过程中,通过优化胰蛋白酶比例、控制酶切温度及添加酶切辅助剂,从而提高酶切收率。
[0168]
(4)脱保护步骤中boc-赖脯胰岛素转变为赖脯胰岛素,无需在有机体系下进行,减少工艺步骤,环境污染小,成本更低。
[0169]
(5)本发明共采用两步离子交换层析与一步反相层析进行分离纯化,替代常规的四步层析,较少了生产周期,并减少有机溶剂的使用,节约成本。
[0170]
(6)本发明的融合蛋白中包含赖脯胰岛素的比重高(融合比增加),融合蛋白中的绿色荧光蛋白包含精氨酸或赖氨酸,可以被蛋白酶消化成小片段,和目的蛋白相比分子量差别大,容易分离。
[0171]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0172]
实施例1赖脯胰岛素表达菌株的构建及表达
[0173]
赖脯胰岛素表达质粒的构建参照专利申请号201910210102.9中实施例的记载。将含有融合蛋白fp-tev-r-g的dna片段,克隆至表达载体质粒pbad/his a(购自ntcc公司,卡那霉素抗性)的arabad启动子下游ncoi-xhoi位点,得到质粒pbad-fp-tev-r-g。质粒图谱如图1所示。
[0174]
再将pylrs的dna序列,克隆至表达载体质粒pevol-pbpf(购自ntcc公司,氯霉素抗性)的arabad启动子下游spei-sali位点,同时在prok启动子下游,以pcr方法插入赖氨酰-trna合成酶的trna(pyltcua)的dna序列。该质粒命名为pevol-pylrs-pylt。质粒图谱如图2所示。
[0175]
将构建的质粒pbad-fp-tev-r-g和pevol-pylrs-pylt共同转化至大肠杆菌top10菌株,筛选获得表达赖脯胰岛素融合蛋白fp-tev-r-g的重组大肠杆菌菌株。其中fp的序列为u8-u9,融合蛋白的氨基酸序列如seq id no:1。
[0176]
gikanfkirhnvedvqladhyqqntpigenlyfqgrfvnqhlcgshlvealylvcgergffytk(boc)ptrgiveqcctsicslyqlenycn(seq id no:1)使用相同的方法,构建出下列表达质粒:
[0177]
pbad-fp(u9-u10-u11)-tev-r-g,融合蛋白的氨基酸序列
[0178]
vqladhyqqntpighylstqsvlskdhmvllefvtaagienlyfqgrfvnqhlcgshlvealylvcgergffytk(boc)ptrgiveqcctsicslyqlenycn(seq id no:22)。
[0179]
pbad-fp(u10-u11)-tev-r-g,融合蛋白的氨基酸序列
[0180]
hylstqsvlskdhmvllefvtaagienlyfqgrfvnqhlcgshlvealylvcgergffytk(boc)ptrgiveqcctsicslyqlenycn(seq id no:23)。
[0181]
pbad-fp(gⅲ)-r-g,融合蛋白的氨基酸序列
[0182]
kkllfaiplvvpfyshstmeleicswyhmgirsfleqkliseedlnsavdrfvnqhlcgshlvealylvcgergffytk(boc)ptrgiveqcctsicslyqlenycn(seq id no:10)。其中,fp(gⅲ)表示来源绿色荧光蛋白的gⅲ信号肽。
[0183]
使用本领域常规方法,构建对应的表达菌株,对发酵液中的赖脯胰岛素融合蛋白的表达量进行电泳检测。
[0184][0185]
配制种子液培养基,接种,经过两级培养制得二级种子液,培养20h,od
600
达到180左右,发酵结束,得到约3l发酵液,离心得到约130g/l的湿菌体。发酵液离心后,加入破碎缓冲液,利用高压均质机破菌两次,离心后加入一定浓度吐温80和edta-2na等洗涤,接着水洗一次,离心收集沉淀得到包涵体。每升发酵液最终可获得约40g湿重包涵体。
[0186]
实施例2包涵体的溶解和复性
[0187]
向所得的包涵体中加入8mol/l脲溶解液,氢氧化钠调节ph至9.0~10.0,室温搅拌1-3h,控制蛋白浓度为10~20mg/ml,补加β-巯基乙醇至终浓度为15-20m mol/l,继续搅拌0.5~1.0h。
[0188]
将包涵体溶解液滴加至复性缓冲液,5-10倍稀释复性,维持复性液ph9.0-10.0,搅拌复性时间10~20h。
[0189]
复性20h后,hplc检测复性折叠正确的赖脯胰岛素融合含量,复性率达75%以上。图3显示了包涵体变复性后赖脯胰岛素融合蛋白的sds-page电泳图。
[0190]
实施例3融合蛋白的酶切
[0191]
向复性液中加入稀盐酸调节ph至8.0-9.5,按1:3000加入重组胰蛋白酶,1:15000加入羧肽酶b,酶切温度为18-25℃,酶切时间为14-20h,酶切后获的boc-赖脯胰岛素。
[0192]
酶切16h后,用hplc检测酶切液中boc-赖脯胰岛素含量,当连续两小时检测的boc-赖脯胰岛素浓度相差小于3%,酶切完成。最终,酶切液中boc-赖脯胰岛素浓度为0.4-0.6g/l,酶切率为80%以上。
[0193]
实施例4第一次层析
[0194]
根据蛋白质等电点的差异,选用阴离子交换填料对boc-赖脯胰岛素进行粗提取。以5-20mmol/l碳酸钠,ph8.0-9.0的缓冲液平衡层析柱3-5个柱体积,使boc-赖脯胰岛素与阴离子填料充分结合,上样载量低于45g/l,上样结束后以100-500mmol/l氯化钠线性洗脱15个柱体积,收集洗脱蛋白溶液,boc-赖脯胰岛素收率在90%以上,纯度在70%以上。
[0195]
实施例5脱保护
[0196]
向boc赖脯胰岛素溶液中加入2%-3%盐酸,室温下搅拌反应3-5h,反应结束后加入naoh调节蛋白溶液ph至2.5以上终止脱保护反应,最终获得赖脯胰岛素,hplc测定脱保护收率在85%以上,纯度在75%以上。
[0197]
实施例6第二次层析
[0198]
根据物质带电荷的差异,采用阴离子交换层析技术对赖脯胰岛素进行纯化,以除去部分杂质。以20mmol/l甘氨酸,ph9.0的缓冲液平衡离子柱3-5个柱体积,赖脯胰岛素蛋白溶液与阳离子填料结合,控制赖脯胰岛素的上样载量不超过10mg/ml,最后以含有0.27mol/l氯化钠溶液等度洗脱,收集赖脯胰岛素样品。收集液中赖脯胰岛素纯度为97.83%,收率为87.96%。
[0199]
实施例7第三次层析
[0200]
根据物质疏水性的差异,采用反相层析柱技术对赖脯胰岛素进行精细纯化。将二次层析获得的赖脯胰岛素溶液以纯水稀释4倍以上,与c8反相填料结合。控制赖脯胰岛素上样载量不高于5mg/ml,以含有200mmol/l醋酸钠,26%乙腈等度洗脱10cv。结果显示:赖脯胰岛素收率为93.8%,纯度为99.70%。图4显示了第三次层析后赖脯胰岛素的hplc检测图谱。
[0201]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。