本公开内容涉及通过与Ang-2特异性结合来抑制血管生成素-2(Ang-2)的功能的抗体,以及涉及抗Ang2抗体、编码该抗体的核酸、包含该核酸的载体、用该载体转化的细胞、制备其的方法、包含其的血管生成抑制剂、用于治疗与血管生成素-2激活和/或过量产生相关的疾病的组合物、用于诊断与血管生成素-2激活和/或过量产生相关的疾病的组合物、用于治疗眼病的组合物或用于预防或治疗癌症的组合物,以及用于将与Ang2结合的抗体和除与Ang2结合的抗体外的药物结合的组合物。
背景技术:
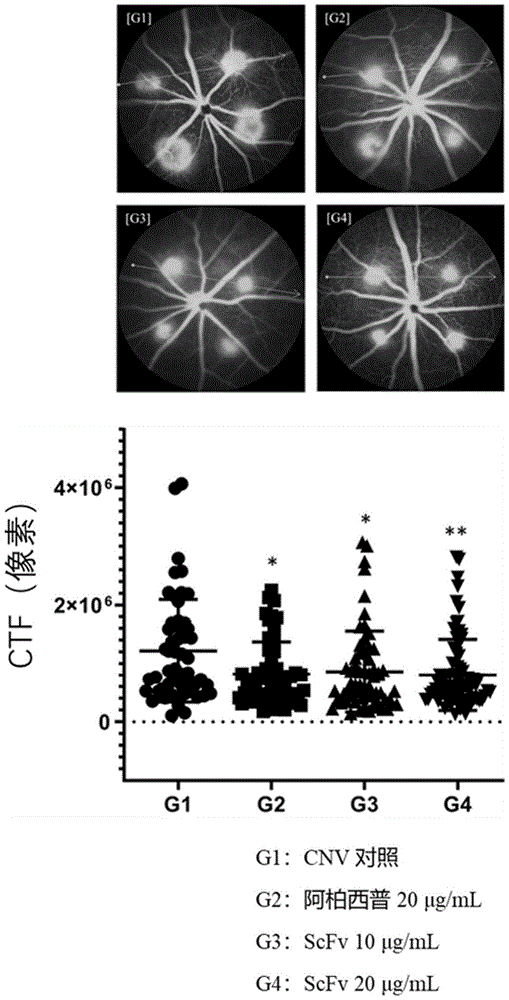
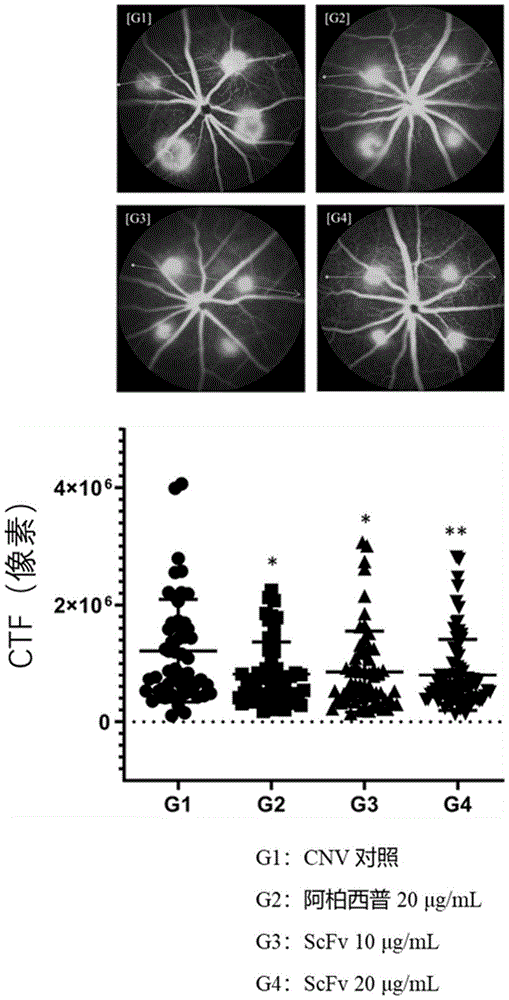
血管生成(angiogenesis)是指涉及从预先存在的血管生长新血管的机制,并且已知在器官形成、正常生物生长、伤口愈合等方面发挥重要作用。还已知其在肿瘤生长和转移中起重要作用,并且已知异常血管生成在诸如肿瘤生长和转移、年龄相关性黄斑变性、糖尿病性视网膜病变、银屑病、类风湿性关节炎和慢性炎症等疾病中起关键作用。因此,涉及血管生成的因素已经成为开发用于诸如癌症等疾病的新治疗剂的重要靶标,并且随着糖尿病患者的数量由于衰老和西方化的饮食习惯而快速增加,患有新生血管性眼病的患者数量正在快速增加。主要眼病的实例包括年龄相关性黄斑变性(AMD,age-relatedmaculardegeneration)、糖尿病性视网膜病变(DR,diabeticretinopathy)和糖尿病性黄斑水肿(DME,diabeticmacularedema)。特别是,黄斑变性和糖尿病性视网膜病变是全世界失明的主要原因。有许多因素与年龄相关性黄斑变性的进展相关,但已知其与氧化应激、炎症反应和血管生成相关。然而,血管内皮生长因子(VEGF)被广泛认为是主要因素。已经尝试使用单克隆抗体、抗体片段或融合蛋白来开发VEGF抑制剂作为治疗剂,并且阿柏西普(aflibercept)和雷珠单抗(ranibizumab)被用作代表性药物。已知这些药物的作用机制是通过抑制VEGF信号传导来诱导血管生成抑制。然而,已知10-15%使用这些药物的患者对现有治疗没有反应。这是因为已知现有的抗VEGF治疗仅抑制病理性血管生成,而血管生成因子的其它途径影响疾病进展。血管生成素2(ANG2)被称为与血管壁内皮细胞中存在的Tie2受体结合并促进血管生成的细胞因子。通过先前的动物实验和临床试验,已知通过抑制对ANG2信号传导的抑制,肿瘤中血管的形成被抑制,因此表现出抗癌效果。此外,已知在年龄相关性黄斑变性患者眼球的防水液体中ANG表达很高。因此,预计抗ANG2治疗剂、抗VEGF治疗剂和联合疗法的开发将有助于黄斑变性的治疗。因此,本公开内容的申请人专注于Ang-2,以开发用于年龄相关黄斑变性和糖尿病视网膜病变的治疗剂。血管生成素-2(Angiopoietin-2,Ang2)是Tie2受体的拮抗性配体(antagonisticligand),存在于血管内皮细胞中,通过与血管生成素-1(Angiopoietin-1,Ang1)(其为Tie2的激动剂(agonist))竞争Tie2结合来通过抑制Tie2的信号转导,并且Ang1(其为用于激活Tie2受体的配体)通过维持血管内皮细胞的屏障功能(barrierfunction),作为维持血管稳定(stabilization)的关键调节剂(keyregulator)。在VEGF过表达或炎症(inflammation)状态下,血管内皮细胞被激活,血管通透性(vascularpermeability)增加。在这方面,Ang1促进血管内皮细胞的连接完整性(junctionalintegrity),从而诱导血管内皮细胞的稳定并降低血管通透性,而活化的血管内皮细胞中增加的Ang2与Tie-2结合,从而参与血管内皮细胞的迁移和尖端形成(tipformation)。因此,促进了新血管的形成。在糖尿病性视网膜病变的情况下,已发现PDGF信号传导(signaling)对通过调节血管外周细胞进行的血-视网膜屏障的形成和成熟至关重要,并且已经证明成人视网膜血管中血管外周细胞的损失增加了血管内皮细胞对VEGF-A的反应,从而激活FOXO1-Ang2环,导致糖尿病性视网膜病变恶化。换句话说,确定诱导Ang2阻断和Tie2激活将使得开发糖尿病性视网膜病变的新治疗成为可能。另外,Ang-2还有助于癌症组织中新血管的形成。为了在癌组织中形成新的血管,发生了其中癌细胞选择现有的血管的共同选择(cooption)。此后,发生血管变性,其通过Ang-2途径破坏现有血管的功能。由于现有血管的变性,癌组织中的环境变成了缺氧环境(hypoxic),为新血管的形成提供了条件。在上述条件下,诱导血管内皮细胞生长因子(VEGF)的过表达,并且如上所述,诱导血管生成。因此,Ang-2已成为用于开发通过血管生成抑制剂的抗癌药物的主要靶点。在上述技术背景下,本申请的发明人努力开发抗Ang2抗体。因此,本发明人开发了表现出与Ang2结合的所需能力的抗Ang2抗体,并证实这种抗Ang2抗体可用作靶向免疫抗癌剂或眼科疾病的治疗剂,从而完成了本公开内容。技术实现要素:技术问题因此,鉴于上述问题而做出了本公开内容,并且本公开内容的目的是提供针对Ang2或其抗原结合片段的新型抗体。本公开内容的另一个目的是提供编码抗体或其抗原结合片段的核酸。本公开内容的又一目的是提供包含核酸的载体、用该载体转化的细胞及其构建方法。本公开内容的又一目的是提供包括抗体或其抗原结合片段在内的血管生成抑制剂,以及用于治疗与血管生成素-2激活和/或过量产生相关的疾病的组合物。本公开内容的又一目的是提供包括抗体或其抗原结合片段在内的血管生成抑制剂,以及用于诊断与血管生成素-2激活和/或过量产生相关的疾病的组合物。本公开内容的又一目的是提供用于预防或治疗眼病的组合物,其包含抗体或其抗原结合片段。本公开内容的又一目的是提供包含抗体或其抗原结合片段的用于预防或治疗肿瘤或癌症的组合物。本公开内容的又一目的是提供与抗Ang2抗体(包括抗体或其抗原结合片段)共施用的组合物。技术解决方案根据本公开内容的方面,上述和其它目的可通过提供与血管生成素-2(Ang2)结合的抗体或其抗原结合片段来实现,所述抗体或其抗原结合片段包含:重链可变区,其包含选自由SEQIDNOS:1、7、13、19和25组成的组的重链CDR1、选自由SEQIDNOS:2、8、14、20和26组成的组的重链CDR2和选自由SEQIDNOS:3、9、15、21、27、51、52和53组成的组的重链CDR3;和轻链可变区,其包含选自由SEQIDNOS:4、10、16、22和28组成的组的轻链CDR1、选自由SEQIDNOS:5、11、17、23和29组成的组的轻链CDR2和选自由SEQIDNOS:6、12、18、24和30组成的组的轻链CDR3。根据本公开内容的另一方面,提供了编码抗体或其抗原结合片段的核酸。根据本公开内容的又一方面,提供了包含核酸的载体。根据本公开内容的又一方面,提供了用载体转化的细胞。根据本公开内容的又一方面,提供了产生抗体或其抗原结合片段的方法,所述方法包括以下过程:(a)培养细胞;以及(b)从培养的细胞中回收抗体或其抗原结合片段。本公开内容还提供了包括抗体或其抗原结合片段在内的血管生成抑制剂,以及用于治疗与血管生成素-2激活和/或过量产生相关的疾病的组合物。本公开内容还提供了包括抗体或其抗原结合片段在内的血管生成抑制剂,以及用于诊断与血管生成素-2激活和/或过量产生相关的疾病的组合物。本公开内容还提供了包含抗体或其抗原结合片段的用于预防或治疗肿瘤或癌症的组合物。本公开内容还提供了与包括抗体或其抗原结合片段在内的抗Ang2抗体共施用的组合物。附图说明根据与以下附图结合的详细描述中,将更清楚地理解本公开内容的上述和其它目的、特征和其它有利方面,其中:图1示出了证实所选单克隆scFv噬菌体具有抑制Ang2/Tie2结合的能力的结果;图2示出了在还原和非还原条件下,在暂时表达和纯化选定的抗Ang2抗体后获得的产物的SDS-PAGE结果;图3示出了通过评估暂时表达和纯化的抗Ang2抗体与人和小鼠Ang2及Ang1的结合而获得的ELISA结果;图4示出了显示所选抗Ang2抗体中和人和小鼠Ang2/Tie2结合的能力的结果;图5示出了显示所选抗Ang2抗体中和Ang2/整联蛋白结合的能力的结果;图6示出了显示所选抗Ang2抗体可以抑制Ang2/Tie2信号传导的结果;图7示出了根据纯化过程证实在大肠杆菌(E.coli)中表达的所选抗Ang2scFv抗体的纯度的结果;图8示出了通过评估在大肠杆菌中表达的抗Ang2scFv抗体与人Ang2蛋白的结合而获得的ELISA结果;图9至图11示出了在CNV小鼠模型中确认所选抗Ang2ScFv抗体的体内功效的结果;和图12示出了使用人来源的三阴性乳腺癌模型显示抗Ang2抗体的抗肿瘤作用的结果。具体实施方式和示例性实施例现将详细参考本公开内容的优选实施方案,其实例在附图中示出。在可能的情况下,在所有附图中将使用相同的标号来指代相同或相似的部件。除非另有定义,本文使用的所有技术和科学术语具有与本公开内容所属领域的普通技术人员通常理解的相同的含义。一般来说,本文使用的命名法和下面描述的实验方法是公知的,并且在本领域中是普遍使用的。本公开内容的实施方案涉及与血管生成素-2(Ang2)结合的抗体或其抗原结合片段,其包含:重链可变区,其包含选自由SEQIDNOS:1、7、13、19和25组成的组的重链CDR1、选自由SEQIDNOS:2、8、14、20和26组成的组的重链CDR2和选自由SEQIDNOS:3、9、15、21、27、51、52和53组成的组的重链CDR3;和轻链可变区,其包含选自由SEQIDNOS:4、10、16、22和28组成的组的轻链CDR1、选自由SEQIDNOS:5、11、17、23和29组成的组的轻链CDR2和选自由SEQIDNOS:6、12、18、24和30组成的组的轻链CDR3。如本文中所用,术语“抗体”是指与Ang2特异性结合的抗Ang2抗体。不仅与Ang2特异性结合的完整抗体形式,而且抗体分子的抗原结合片段也在本公开内容的范围内。完整的抗体是具有两条全长轻链和两条全长重链的结构,其中每条轻链通过二硫键与重链连接。重链恒定区是伽玛(γ)、缪(μ)、阿尔法(α)、徳尔塔(δ)或艾普西隆(ε)型,其可进一步分为伽玛1(γ1)、伽玛2(γ2)、伽玛3(γ3)、伽玛γ4(γ4)、阿尔法1(α1)或阿尔法2(α2)。轻链恒定区是卡帕(κ)型或兰姆达(λ)型。抗体的抗原结合片段或抗体片段是指具有抗原结合功能的片段,包括Fab、Fab’、F(ab’)2和Fv。在抗体片段当中,Fab是具有轻链和重链可变区、轻链恒定区和重链第一恒定区CH1的结构,并且具有一个抗原结合位点。Fab’与Fab的不同之处在于,Fab’在重链CH1结构域的C末端具有包括至少一个半胱氨酸残基的铰链区。其中Fab’的半胱氨酸残基通过铰链区处的二硫键连接,产生F(ab’)2片段。Fv是仅有重链可变区和轻链可变区的最小抗体片段。双链Fv可具有这样的结构,在所述结构中重链可变区通过非共价键连接至轻链可变区,并且单链Fv(scFv)通常具有二聚体结构,如在双链Fv中,其中重链可变区通过肽接头共价结合至轻链可变区,或者重链和轻链可变区在其C末端处直接彼此连接。抗原结合片段可使用蛋白酶获得(例如,用木瓜蛋白酶限制性消化完整抗体以获得Fab,用胃蛋白酶消化完整抗体以获得F(ab’)2片段),也可通过基因重组技术制备。在一个实施方案中,根据本公开内容的抗体呈Fv形式(例如,scFv)或完全抗体形式。另外,重链恒定区可以是选自伽玛(γ)、缪(μ)、阿尔法(α)、徳尔塔(δ)或艾普西隆(ε)的任何同型。例如,恒定区是γ1(IgG1)、γ3(IgG3)或γ4(IgG4)。轻链恒定区可以是κ型或λ型。本文使用的术语“重链”包括全长重链及其片段,所述全长重链包含可变区VH和三个恒定区CH1、CH2和CH3,所述可变区VH包含具有可变区序列以允许抗原具有特异性的氨基酸序列。本文所用的术语“轻链”包括全长轻链及其片段,所述全长轻链包含可变区VL和恒定区CL,所述可变区VL包含具有可变区序列以允许抗原具有特异性的氨基酸序列。本公开内容的抗体可以是单克隆抗体、双特异性抗体、人抗体、人源化抗体、嵌合抗体、单链Fvs(scFV)片段、单链抗体、Fab片段、F(ab’)片段、二硫键Fvs(sdFV)片段、抗独特型(抗-Id)抗体以及这些抗体的表位结合片段,但是本公开内容不限于此。单克隆抗体是指从基本上同质的抗体群体中获得的抗体,即除可能的天然发生的突变之外的相同抗体,其中群体中的个体抗体可以以痕量存在。单克隆抗体对单一抗原位点具有高度特异性。与包含针对不同决定簇(表位)的不同抗体的常规(多克隆)抗体制剂不同,每种单克隆抗体是针对抗原上的单个表位诱导的。“表位”是指抗体可与其特异性结合的蛋白质决定簇。表位通常由一组化学活性表面分子(例如氨基酸或糖侧链)组成,并且通常具有特定的三维结构特征以及特定的电荷性质。构象表位和非构象表位的区别在于:在变性溶剂存在的情况下,与前者的结合丢失,而与后者的结合没有丢失。“人源化”形式的非人(例如,鼠)抗体是含源自非人免疫球蛋白的最小序列的嵌合抗体。在大多数情况下,人源化抗体是对来自受体的高变区的残基保持所需的特异性、亲和力和能力的非人种类(供体抗体),例如,被来自小鼠、大鼠、兔或非人的高变区的残基取代的人免疫球蛋白(受体抗体)。“人抗体”是源自人免疫球蛋白的分子,并且意味着构成抗体的所有氨基酸序列,包括互补决定区和框架区,都由人免疫球蛋白组成。人抗体不仅包括“嵌合”抗体,其中重链和/或轻链的一部分具有与源自特定物种或属于特定抗体类别或亚类的抗体的相应序列相同或同源的序列,而其余的一条或多条链与源自另一物种或属于另一抗体类别或亚类的抗体相同或同源,而且还包括其表现出所需生物活性的片段。如本文中所用,“抗体可变区”是指抗体分子的轻链和重链部分,包括互补决定区(CDR;CDR1、CDR2和CDR3)和框架区(FR)的氨基酸序列。VH指的是重链的可变域。VL指的是轻链的可变域。“互补性决定区域”(CDR;CDR1、CDR2和CDR3)是指抗体可变结构域的氨基酸残基,其是抗原结合所必需的。每个可变结构域通常有标识为CDR1、CDR2和CDR3的三个CDR区域。本公开内容包括包含SEQIDNO:1的重链CDR3的重链可变区和含有SEQIDNO:2的轻链CDR3的轻链可变区。在本公开内容中,与Ang2结合的抗体或其抗原结合片段可包含:重链可变区,其包含SEQIDNO:1的重链CDR1、SEQIDNO:2的重链CDR2和SEQIDNO:3的重链CDR3,和轻链可变区,其包含SEQIDNO:4的轻链CDR1、SEQIDNO:5的轻链CDR2和SEQIDNO:6的轻链CDR3;重链可变区,其包含SEQIDNO:7的重链CDR1、SEQIDNO:8的重链CDR2和SEQIDNO:9的重链CDR3,和轻链可变区,其包含SEQIDNO:10的轻链CDR1、SEQIDNO:11的轻链CDR2和SEQIDNO:12的轻链CDR3;重链可变区,其包含SEQIDNO:13的重链CDR1、SEQIDNO:14的重链CDR2和SEQIDNO:15的重链CDR3,和轻链可变区,其包含SEQIDNO:16的轻链CDR1、SEQIDNO:17的轻链CDR2和SEQIDNO:18的轻链CDR3;重链可变区,其包含SEQIDNO:19的重链CDR1、SEQIDNO:20的重链CDR2和SEQIDNO:21的重链CDR3,和轻链可变区,其包含SEQIDNO:22的轻链CDR1、SEQIDNO:23的轻链CDR2和SEQIDNO:24的轻链CDR3;重链可变区,其包含SEQIDNO:25的重链CDR1、SEQIDNO:26的重链CDR2和SEQIDNO:27的重链CDR3,和轻链可变区,其包含SEQIDNO:28的轻链CDR1、SEQIDNO:29的轻链CDR2和SEQIDNO:30的轻链CDR3;重链可变区,其包含SEQIDNO:13的重链CDR1、SEQIDNO:14的重链CDR2和SEQIDNO:51的重链CDR3,和轻链可变区,其包含SEQIDNO:16的轻链CDR1、SEQIDNO:17的轻链CDR2和SEQIDNO:18的轻链CDR3;重链可变区,其包含SEQIDNO:13的重链CDR1、SEQIDNO:14的重链CDR2和SEQIDNO:52的重链CDR3,和轻链可变区,其包含SEQIDNO:16的轻链CDR1、SEQIDNO:17的轻链CDR2和SEQIDNO:18的轻链CDR3;或重链可变区,其包含SEQIDNO:13的重链CDR1、SEQIDNO:14的重链CDR2和SEQIDNO:53的重链CDR3,和轻链可变区,其包含SEQIDNO:16的轻链CDR1、SEQIDNO:17的轻链CDR2和SEQIDNO:18的轻链CDR3。“框架区(FR)”是不同于CDR残基的可变结构域残基。每个可变域通常有标识为FR1、FR2、FR3和FR4的4个FR。“Fv”片段是包含完整抗体识别和结合位点的抗体片段。该区域由通过紧密共价结合的一个重链可变结构域和一个轻链可变结构域(例如,scFv)形成的二聚体组成。“Fab”片段包含轻链的可变结构域和恒定结构域以及重链的可变结构域和第一恒定结构域(CH1)。F(ab’)2抗体片段通常包括一对Fab片段,所述Fab片段通过其间的铰链半胱氨酸在其羧基末端附近共价连接。“单链Fv”或“scFv”抗体片段包含抗体的VH和VL结构域,所述VH和VL结构域存在于单个多肽链中。Fv多肽还可在VH结构域与VL结构域之间包含多肽接头,其允许scFv形成抗原结合所需的结构。抗Ang2抗体可包含单链或双链。在功能上,抗Ang2抗体的结合亲和力在10-5M至10-12M的范围内。例如,抗Ang2抗体的结合亲和力在10-6M至10-12M、10-7M至10-12M、10-8M至10-12M、10-9M至10-12M、10-5M至10-11M、10-6M至10-11M、10-7M至10-11M、10-8M至10-11M、10-9M至10-11M、10-10M至10-11M、10-5M至10-10M、10-6M至10-10M、10-7M至10-10M、10-8M至10-10M、10-9M至10-10M、10-5M至10-9M、10-6M至10-9M、10-7M至10-9M、10-8M至10-9M、10-5M至10-8M、10-6M至10-8M、10-7M至10-8M、10-5M至10-7M、10-6M至10-7M或10-5M至10-6M的范围内。与Ang2结合的抗体或其抗原结合片段可包含选自由以下组成的组的重链可变区:SEQIDNOS:32、36、40、44、48、55、57、59和61。另外,与Ang2结合的抗体或其抗原结合片段可包含选自由以下组成的组的轻链可变区:SEQIDNOS:34、38、42、46和50。特别地,为了开发抗Ang2抗体的生产性和高浓度制剂,在重链可变区的框架部分中诱导突变,以提高生产率和溶解度。通过将缬氨酸(其为重链可变区的第12个氨基酸)转换为丝氨酸来产生突变体。因此,将包含SEQIDNO:61的重链可变区的抗体用于实验。因此,证实了表现出提高的生产率和溶解度。在根据本公开内容的特定实施方案中,与Ang2结合的抗体或其抗原结合片段可包含:SEQIDNO:32的重链可变区和SEQIDNO:34的轻链可变区;SEQIDNO:36的重链可变区和SEQIDNO:38的轻链可变区;SEQIDNO:40的重链可变区和SEQIDNO:42的轻链可变区;SEQIDNO:44的重链可变区和SEQIDNO:46的轻链可变区;SEQIDNO:48的重链可变区和SEQIDNO:50的轻链可变区;SEQIDNO:55的重链可变区和SEQIDNO:42的轻链可变区;SEQIDNO:57的重链可变区和SEQIDNO:42的轻链可变区;SEQIDNO:59的重链可变区和SEQIDNO:42;或SEQIDNO:61的重链可变区和SEQIDNO:42的轻链可变区。“噬菌体展示”是用于将变体多肽在噬菌体(例如,纤维状噬菌体颗粒)表面上展示为与包膜蛋白的至少一部分的融合蛋白。噬菌体展示的有用性在于这样的事实,即其可以靶向随机化蛋白质变体的巨大文库,并快速且高效地对以高亲和力与靶抗原结合的序列进行分类。使用噬菌体展示肽和蛋白质文库已被用于筛选数百万种多肽,以鉴定具有特异性结合特性的多肽。噬菌体展示技术为产生和筛选与特定配体(例如,抗原)结合的新蛋白质提供了强有力的工具。使用噬菌体展示技术,可以产生大的蛋白质变体文库,并且可以快速分选以高亲和力与靶抗原结合的序列。编码变体多肽的核酸与病毒包膜蛋白,诸如编码基因III蛋白或基因VIII蛋白的核酸序列融合。已经开发了单价噬菌体展示系统,其中编码蛋白质或多肽的核酸序列与编码基因III蛋白的一部分的核酸序列融合。在单价噬菌体展示系统中,基因融合以低水平表达,野生型基因III蛋白也表达,从而维持颗粒感染性。证明肽在纤维状噬菌体表面上的表达和功能性抗体片段在大肠杆菌周质中的表达在开发抗体噬菌体展示文库中是重要的。抗体或抗原结合多肽的文库已经以多种方式(例如通过插入随机DNA序列改变单个基因或克隆相关的基因家族)制备。可以筛选所述文库的具有所需特征的抗体或抗原结合蛋白的表达。噬菌体展示技术与常规杂交瘤和重组方法相比,在产生具有所需特性的抗体方面具有几个有利方面。这种技术使得在不使用动物的情况下,在短时间内产生具有各种序列的大型抗体库成为可能。杂交瘤或人源化抗体的生产可能需要几个月。另外,由于不需要免疫,噬菌体抗体库可以产生针对有毒或抗原性低的抗原的抗体。噬菌体抗体库也可用于产生和鉴定新的治疗性抗体。使用噬菌体展示文库技术可用于,从免疫或非免疫的人、种系序列或未致敏的B细胞Ig库中产生人抗体。各种淋巴样组织可用于制备未致敏或非免疫抗原结合文库。从噬菌体展示文库中鉴定和分离高亲和力抗体的技术对于分离新的治疗性抗体是重要的。从文库中分离高亲和力抗体可取决于文库的大小、细菌细胞间的生产效率和文库的多样性。由于存在终止密码子,抗体或抗原结合蛋白折叠不充分和生产效率低下,文库的大小减小。如果抗体或抗原结合结构域未正确折叠,则细菌细胞中的表达可以被抑制。可通过交替突变可变/恒定界面的表面或选定的CDR残基来提高表达。当在细菌细胞中产生抗体噬菌体文库时,框架区的序列是提供适当折叠的一个要素。在高亲和力抗体分离中,生成各种抗体或抗原结合蛋白文库是很重要的。经常发现CDR3区参与抗原结合。重链上的CDR3区在大小、序列和结构构象上差异很大,因此可用于制备各种文库。另外,多样性可通过在每个位置处使用所有20种氨基酸使可变重链和轻链的CDR区随机化来产生。使用所有20种氨基酸可以产生具有巨大多样性的变异抗体序列,并增加鉴定新抗体的机会。本公开内容的抗体或抗体片段在能够特异性识别Ang2的范围内可以包括本文所述的本公开内容的抗Ang2抗体的序列,以及其生物学等同物。例如,可以对抗体的氨基酸序列进行额外的改变,以进一步提高抗体的结合亲和力和/或其它生物学特性。此类修饰包括,例如,抗体氨基酸序列残基的缺失、插入和/或取代。这些氨基酸变化是基于氨基酸侧链取代基的相对相似性(例如疏水性、亲水性、电荷、大小等)产生的。对氨基酸侧链取代基的大小、形状和类型的分析表明,精氨酸、赖氨酸和组氨酸都是带正电荷的残基,丙氨酸、甘氨酸和丝氨酸具有相似的大小,苯丙氨酸、色氨酸和酪氨酸具有相似的形状。因此,基于这些考虑,精氨酸、赖氨酸和组氨酸;丙氨酸、甘氨酸和丝氨酸;以及苯丙氨酸、色氨酸和酪氨酸可以被认为是生物学功能等同物。鉴于上述具有生物等效活性的变化,本公开内容的抗体或编码所述抗体的核酸分子被解释为也包括显示与序列ID号中所示的序列基本相同的序列。当本公开内容的上述序列被比对以尽可能接近地对应于另一个任意序列,并且使用常用算法分析比对的序列时,实质同一性意指具有至少90%同源性,最优选至少95%同源性,至少96%同源性,至少97%同源性,至少98%同源性,或至少99%同源性的序列。序列比较的比对方法是本领域已知的NCBI基本局部比对搜索工具(BLAST)可从NCBI等访问,并可与互联网上的诸如blastp、blasm、blastx、tblastn和tblastx等序列分析程序结合使用。可在www.ncbi.nlm.nih.gov/BLAST/上访问BLAST。如何使用这个程序比较序列同源性可以在www.ncbi.nlm.nih.gov/BLAST/blast_help.html.上得到确认。基于此,与说明书中指定的序列相比,本公开内容的抗体或其抗原结合片段可以具有90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的同源性。这种同源性可通过经由本领域已知的方法进行的序列比较和/或比对来确定。例如,序列比较算法(即,BLAST或BLAST2.0)、手动比对或目视检查可以用于以百分比的形式确定本发明的核酸或蛋白质的序列同源性。本公开内容的另一个实施方案涉及编码抗体或其抗原结合片段的核酸。抗体或其抗原结合片段可以通过分离编码本公开内容的抗体或其抗原结合片段的核酸来重组产生。核酸被分离并插入到可复制的载体中,以用于进一步克隆(DNA的扩增)或进一步表达。基于此,本公开内容的另一个实施方案涉及包含核酸的载体。“核酸”具有全面的含义,包括DNA(gDNA和cDNA)和RNA分子,以及核苷酸,所述核苷酸是核酸中的基本结构单元,其不仅包括天然核苷酸,还包括具有经修饰的碱基位点的糖或类似物。编码本公开内容的重链和轻链可变区的核酸的序列可被修饰。此类修饰包括核苷酸的添加、缺失或非保守或保守取代。在根据本公开内容的具体实施方案中,核酸可包括编码选自由以下组成的组的重链可变区的核酸:SEQIDNOS:31、35、39、43、47、54、56、58和60。另外,所述核酸可包括编码选自由以下组成的组的轻链可变区的核酸:SEQIDNOS:33、37、41、45和49。具体而言,所述核酸可包含:编码重链可变区的SEQIDNO:31的核酸和编码轻链可变区SEQIDNO:33的核酸;编码重链可变区的SEQIDNO:35的核酸和编码轻链可变区的SEQIDNO:37的核酸;编码重链可变区的SEQIDNO:39的核酸和编码轻链可变区的SEQIDNO:41的核酸;编码重链可变区的SEQIDNO:43的核酸和编码轻链可变区的SEQIDNO:45的核酸;编码重链可变区的SEQIDNO:47的核酸和编码轻链可变区的SEQIDNO:49的核酸;编码重链可变区的SEQIDNO:54的核酸和编码轻链可变区的SEQIDNO:41的核酸;编码重链可变区的SEQIDNO:56的核酸和编码轻链可变区的SEQIDNO:41的核酸;编码重链可变区的SEQIDNO:58的核酸和编码轻链可变区的SEQIDNO:41的核酸;或者编码重链可变区的SEQIDNO:60的核酸和编码轻链可变区的SEQIDNO:41的核酸。使用常规方法(例如,通过使用能够与编码抗体重链和轻链的DNA特异性结合的寡核苷酸探针)可以容易地分离或合成编码抗体的DNA。有许多载体可用。载体组件通常包括但不限于以下一种或多种:信号序列、复制起始点、一种或多种标记基因、增强子元件、启动子和转录终止序列。如本文中所用,术语“载体”旨在包括质粒载体、粘粒载体、噬菌体载体、腺病毒载体、逆转录病毒载体、腺相关病毒载体等作为在宿主细胞中表达靶基因的手段。在载体中,编码抗体的核酸与启动子可操作地连接。“可操作地连接的”意指核苷酸表达调控序列(例如,启动子、单个序列或转录调节因子结合位点阵列)与其它核苷酸序列之间的功能性键联,因此核苷酸表达调控序列可以调控另外的核苷酸序列的转录和/或翻译。当原核细胞用作宿主时,载体通常包括能够启动转录的强启动子(例如,tac启动子、lac启动子、lacUV5启动子、lpp启动子、pLλ启动子、pRλ启动子、rac5启动子、amp启动子、recA启动子、SP6启动子、trp启动子或T7启动子)、用于启动翻译的核糖体结合位点和转录/翻译终止序列。另外,例如,当真核细胞用作宿主时,载体可包含源自哺乳动物基因组的启动子(例如,金属硫蛋白启动子、β-肌动蛋白启动子、人血红蛋白启动子和人肌肉肌酸启动子)或源自哺乳动物病毒的启动子(例如,腺病毒晚期启动子、痘苗病毒7.5K启动子、SV40启动子、巨细胞病毒(CMV)启动子、HSV的tk启动子、小鼠乳腺肿瘤病毒(MMTV)启动子,HIVLTR启动子、莫洛尼病毒启动子、爱泼斯坦巴尔病毒(EBV)启动子和劳斯肉瘤病毒(RSV)启动子),并且通常具有多聚腺苷酸化序列作为转录终止序列。在一些情况下,载体可以与其它序列融合,以促进从中表达的抗体的纯化。融合序列包括,例如,谷胱甘肽S转移酶(Pharmacia,USA)、麦芽糖结合蛋白(NEB,USA)、FLAG(IBI,USA)和6xHis(六组氨酸;Qiagen,USA)。载体包括本领域通常用作选择标记的抗生素抗性基因,例如氨苄青霉素、庆大霉素、羧苄西林、氯霉素、链霉素、卡那霉素、遗传霉素、新霉素和四环素的抗性基因。本公开内容的另一个实施方案涉及用前述载体转化的细胞。用于产生本公开内容的抗体的细胞可以是但不限于原核细胞、酵母细胞或高等真核细胞。可使用原核宿主细胞诸如大肠杆菌、芽孢杆菌属的菌株诸如枯草芽孢杆菌(Bacillussubtilis)和苏云金芽孢杆菌(Bacillusthuringiensis)、链霉菌属(Streptomyces)、假单胞菌(Pseudomonas)(例如,恶臭假单胞菌(Pseudomonasputida))、奇异变形杆菌(Proteusmirabilis)和葡萄球菌属(Staphylococcus)(例如,肉葡萄球菌(Staphylococcuscarnosus))。然而,对动物细胞的兴趣是最大的,有用的宿主细胞系的实例包括COS-7、BHK、CHO、CHOK1、DXB-11、DG-44、CHO/-DHFR、CV1、COS-7、HEK293、BHK、TM4、VERO、HELA、MDCK、BRL3A、W138、HepG2、SK-Hep、MMT、TRI、MRC5、FS4、3T3、RIN、A549、PC12、K562、PER.C6、SP2/0、NS-0、U20S和HT1080,但是本公开内容不限于此。本公开内容的另一个实施方案涉及产生抗体或其抗原结合片段的方法,其包括:(a)培养细胞;以及(b)从培养的细胞中回收抗体或其抗原结合片段。细胞可以在各种培养基中培养。任何商购可得的培养基都可以无限制地用作培养基。也可以以合适的浓度包含本领域普通技术人员已知的所有其它必需补充剂。培养条件,诸如温度和pH,已经用于被选择用于表达的宿主细胞,这对本领域普通技术人员来说是显而易见的。抗体或其抗原结合片段的回收可以通过例如离心或超滤除去杂质,并使用例如亲和色谱等纯化结果来进行。可以另外使用其它纯化技术,诸如阴离子或阳离子交换色谱、疏水相互作用色谱、羟基磷灰石色谱等。本公开内容的另一个实施方案涉及包含抗体作为活性成分的用于预防或治疗肿瘤的组合物。抗体可以是包含IgG或可变区的片段,即ScFv或Fab。此外,重链的可变区可以是IgG1、IgG2、IgG3或IgG4。本公开内容提供了用于预防或治疗眼病的药物组合物,其包含:(a)根据本公开内容的药学有效量的抗Ang2抗体或其抗原结合片段;和(b)药学上可接受的载体。本公开内容还提供了预防或治疗眼病的方法,包括向患有肿瘤的患者施用抗体或其抗原结合片段。本公开内容还提供了抗体或其抗原结合片段用于抑制Ang2机制的用途以及其用于预防或治疗眼病的用途。关于眼病,角膜是无血管组织,必须始终保持透明以保持视力。然而,已知血管生成也发生在眼睛中,引起眼睛的血管生成相关疾病。换句话说,角膜中新血管的形成降低了眼睛的透明度,导致视力丧失,视网膜中新血管的产生导致异常血管的形成,导致血液渗出,从而通过视网膜细胞的变性诱发失明。基于此,本公开内容可用于预防或治疗眼病,诸如早产儿视网膜病、角膜血管生成、糖尿病性视网膜病变、脉络膜新生血管疾病和黄斑变性(例如,年龄相关性黄斑变性)。本公开内容提供了用于预防或治疗肿瘤的药物组合物,其包含:(a)根据本公开内容的药学有效量的抗Ang2抗体或其抗原结合片段;和(b)药学上可接受的载体。本公开内容还提供了预防或治疗肿瘤的方法,包括向肿瘤患者施用抗体或其抗原结合片段。本公开内容还提供了抗体或其抗原结合片段用于抑制Ang2机制的用途以及其用于预防或治疗肿瘤的用途。所述组合物所适用的肿瘤通常包括过表达Ang2的肿瘤或癌症,以及不过表达Ang2的肿瘤或癌症。适合作为治疗靶标的肿瘤或癌症的非限制性实例包括黑色素瘤(例如,转移性恶性黑色素瘤)、肾癌(例如,透明细胞癌)、前列腺癌(例如,激素难治性前列腺腺癌)、胰腺癌、乳腺癌(在一些情况下,三阴性乳腺癌)、结肠癌、肺癌(例如,非小细胞肺癌)、食道癌、头颈鳞状细胞癌、肝癌、卵巢癌、宫颈癌、甲状腺癌、胶质母细胞瘤、神经胶质瘤、白血病、淋巴瘤和其它肿瘤性癌。另外,本公开内容包括可使用本公开内容的抗体治疗的难治性或复发性癌症。本公开内容的另一个实施方案涉及用于抑制血管生成的药物组合物,其包含抗Ang2抗体或其抗原结合片段作为活性成分。另一个实施方案提供了用于预防和/或治疗与血管生成素-2激活和/或过量产生相关的疾病的药物组合物,其包含抗Ang2抗体或其抗原结合片段作为活性成分。本公开内容提供了例如抑制血管生成的方法,其包括向需要血管生成抑制的患者施用治疗有效量的抗Ang2抗体或其抗原结合片段。抑制血管生成的方法还可包括在施用前鉴定需要血管生成抑制的患者。另一个实施方案提供了预防和/或治疗与血管生成素-2激活和/或过量产生相关的疾病的方法,其包括向需要预防和/或治疗与血管生成素-2激活和/或过量产生相关的疾病的患者施用治疗有效量的抗Ang2抗体或其抗原结合片段。所述方法还可包括,在施用前,鉴定需要预防和/或治疗与血管生成素-2激活和/或过量产生相关的疾病的患者。药物组合物还可包含药学上可接受的载体,并且载体可以是通常用于配制药物的载体,并且可以是选自由以下组成的组的一种或多种:乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油,但是本公开内容不限于此。药物组合物还可包含选自由以下组成的组的一种或多种:稀释剂、赋形剂、润滑剂、润湿剂、甜味剂、调味剂、乳化剂、助悬剂和防腐剂,它们通常用于药物组合物的制备。有效量的药物组合物或抗体或其抗原结合片段可以口服或肠胃外施用。对于肠胃外施用,可以使用静脉注射、皮下注射、肌内注射、腹膜内注射、内皮施用、局部施用、鼻内施用、肺内施用、直肠内施用等。对于口服施用,由于蛋白质或肽被消化,因此可以配制口服组合物,使得活性成分被包衣或配制以防止在胃中分解。另外,所述组合物可以通过使得能够将活性物质递送至靶细胞的任何装置施用。药物组合物中抗Ang2抗体或其抗原结合片段的含量可以根据诸如配制方法、施用方法、患者的年龄、体重和性别、病理状况、饮食、施用时间、施用间隔、施用途径、排泄率和反应敏感性等因素进行不同的规定。例如,抗Ang2抗体或其抗原结合片段的日剂量可以在0.001mg/kg至1000mg/kg的范围内,特别是0.01mg/kg至100mg/kg,更特别是0.1mg/kg至50mg/kg,进一步特别是0.1mg/kg至20mg/kg,但本公开内容不限于此。日剂量可被配制成呈单位剂型的单剂量形式,或者可以配制在适当的部分中,或者可以通过装入多剂量容器来制备。所述药物组合物可以与其它药物(诸如其它血管生成抑制剂或与血管生成素-2激活和/或过量产生相关的疾病的治疗剂)联合施用,并且其施用量和施用方法以及另外的药物的类型可以根据患者的状况适当地开出处方。药物组合物可被配制成油或水介质中的溶液、混悬液、糖浆、乳液、提取物、粉末、颗粒、片剂、胶囊等形式,并且可以进一步包括用于配制的分散剂或稳定剂。特别地,由于包含抗Ang2抗体或其抗原结合片段的药物组合物包含抗体或抗原结合片段,因此其可被配制成免疫脂质体。包含抗体的脂质体可以根据本领域公知的方法制备。免疫脂质体是包括磷脂酰胆碱、胆固醇和聚乙二醇衍生的磷脂酰乙醇胺的脂质组合物,并且可以通过反相蒸发制备。(公开专利第10-2015-0089329号)。例如,抗体的Fab’片段可通过二硫键置换反应与脂质体缀合。同时,由于抗Ang2抗体或其抗原结合片段与血管生成素-2特异性结合,该特征可用于确认是否发生血管生成素-2的激活和/或过量产生。因此,本公开内容的另一个实施方案提供了用于检测血管生成素-2激活和/或过量产生和/或用于诊断与血管生成素-2激活和/或过量产生相关的疾病的药物组合物,其包含抗Ang2抗体或其抗原结合片段。另一个实施方案提供了诊断方法或提供诊断信息的方法,所述方法包括:用抗Ang2抗体或其抗原结合片段处理从患者获得的生物样品;确认是否发生抗原-抗体反应;以及确定当检测到抗原-抗体反应时,患者具有血管生成素-2激活和/或过量产生的症状,或患有与血管生成素-2激活和/或过量产生相关的疾病。生物样品可选自从患者获得的细胞、组织和体液组成的组。抗原-抗体反应是否发生的确认可以通过本领域已知的各种方法进行。例如,可以通过常规的酶反应、荧光、发光和/或辐射检测来确认反应,特别地,可以使用选自由以下组成的组的方法来测量反应:免疫色谱法、免疫组织化学、酶联免疫吸附测定(ELISA)、放射免疫测定(RIA)、酶免疫测定(EIA)、荧光免疫测定(FIA)、发光免疫测定(LIA)和蛋白质印迹,但是本公开内容不限于此。用药物组合物施用或诊断的患者可以是哺乳动物,包括灵长类动物(包括人、猴子等)以及啮齿类动物(包括小鼠、大鼠等)。与血管生成素-2激活和/或过量产生相关的疾病可以是癌症;转移性癌症;眼病,诸如早产儿视网膜病、角膜血管生成、糖尿病性视网膜病、脉络膜新生血管疾病和黄斑变性(例如,年龄相关性黄斑变性);哮喘;类风湿性关节炎;银屑病;诸如肺炎和慢性炎症等的炎性疾病;诸如高血压或动脉硬化等心血管疾病;或败血症。所述癌症可以过表达血管生成素-2,可以是实体癌或血癌,并且可以是但不限于选自由以下组成的组一种或多种癌症:鳞状细胞癌、小细胞肺癌、非小细胞肺癌、肺腺癌、肺鳞状细胞癌、腹膜癌、皮肤癌、皮肤或眼睛黑色素瘤、直肠癌、肛门癌、食道癌、小肠癌、内分泌腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、慢性或急性白血病,淋巴细胞淋巴瘤、肝细胞癌、胃肠癌、胰腺癌、胶质母细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝肿瘤、乳腺癌(在一些情况下,三阴性乳腺癌)、结肠癌、大肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌、头颈癌、脑癌和骨肉瘤。癌症可能是原发性癌症或转移性癌症。实施例在下文中,将参考以下实施例来进一步详细描述本公开内容。提供这些实施例仅仅是为了说明的目的,对于本领域普通技术人员来说显而易见的是,这些实施例不应被解释为限制本公开内容的范围。实施例1与Ang2结合的抗体的选择为了制备抗体文库和用于选择与Ang2结合的抗体的文库,使用了韩国专利申请(专利公布第10-2008-0109417号)中使用的人致敏scFv(人原初scFv)文库。向96孔免疫板中加入2g/ml(100μl/孔)抗原(hAng2-his:RNDsystems.目录号623-AN/CF,hAng2-Fc:PharmAbcine),并使其在4℃静置过夜。第二天,将抗原包被的板用5mMCaCl2TBS洗涤3次,然后加入200μl的2%BSA封闭缓冲液,并在室温下反应2小时。将50μl的XL1-Blue原液加入2ml的2xYT-TET(四环素10μg/ml)生长培养基中,并将其在37℃和200rpm下生长约2小时,然后再向其中加入13ml原液,生长至OD600达到0.5。封闭2小时后,将产物用1X5mMCaCl2TBS洗涤三次。将噬菌体文库组与每个洗涤过的孔组合,并将噬菌体文库和4%BSA以相同的量混合,然后向每个孔中加入200μl混合物,随后在室温下摇动30分钟并反应2小时。当噬菌体文库反应完成时,弃去上清液,所得溶液用0.1%TBST(5mMCaCl2)洗涤5次,用TBS(5mM氯化钙)洗涤5次,向每个孔中加入100μl的100mM三甲胺(TEA),然后在室温下振荡10分钟。10分钟后,向每个孔中加入50μl的1MTris(pH7.5)并混合。将上清液加入10mlOD600为0.5的XL1-blue中,在37℃下感染30分钟。感染后,使用100μl作为输出滴度,剩余部分以6,000rpm离心10分钟。弃去上清液,将沉淀物铺在大的方形板(34μg/mlofCM 1%葡萄糖)上并在30℃孵育过夜。将剩余的100μl作为输出滴度稀释至1/10、1/100或1/1000,铺在CM板上,并使其在37℃静置过夜。第二天,将生长在方形板上的菌落放入50ml的2xYT培养基中,使用环刮拭,然后以6000rpm离心10分钟以丢弃上清液,并将沉淀物制备成初级淘选原液,将100ml的2xYT生长培养基(34μg/ml的CM 1%葡萄糖)放入500ml锥形烧瓶中,然后向其中加入细胞,使得OD600变为0.2,并在200rpm和37℃下生长,直至OD600变为0.5。在培养细胞直至OD600值变为0.5之后,以细胞的OD600值20倍的量添加辅助噬菌体(M13KO7突变体)。加入辅助噬菌体并使感染在37℃下发生30分钟后,以6000rpm离心10分钟。弃去上清液,向细胞中加入100ml2xYT培养基(34μg/ml的CM 70μg/ml的卡那霉素 1mMIPTG 5mMMgCl2),然后让所述细胞在200rpm和30℃下放置过夜。第二天,将生长的细胞以7000rpm钟离心10分钟,并使用相同的方法再次离心。从收集的上清液中向1/5(v/v)的上清液中加入20%PEG/2.5mNaCl,并在冰上沉淀1小时。沉淀后,以9000rpm离心1小时。弃去上清液,用3mlTBS释放沉淀物,用0.45μm过滤器过滤,并在4℃下储存,用于随后的淘选过程。将这些过程重复三至四次,通过ELISA鉴定与抗原结合的抗体。实施例2与Ang2特异性结合并中和与Tie2的结合的单克隆ScFv噬菌体的筛选(结合ELISA/竞争性ELISA)淘选过程完成后,稀释并铺展最终的细胞原液,以便在CM琼脂平板上形成200至500个菌落,然后使其在37℃静置过夜。第二天,当菌落生长时,将200μl的2xYT培养基(34μg/ml的CM 1%葡萄糖)加入96孔深孔板中,将菌落逐个加入每个孔中,并在37℃和3000rpm下静置过夜。第二天,将200μl的2xYT培养基(34μg/ml的CM 1%葡萄糖)加入到新的96孔深孔平板中,并将20ml前一天生长的细胞加入到每个孔中,然后在37℃和3000rpm下生长1小时10分钟。向每个孔中加入100μl的50%甘油,剩余的细胞储存在-70℃。当细胞生长时,将1μl辅助噬菌体和19μl的2xYT培养基混合,然后向每个孔中加入20μl所得混合物,随后在37℃孵育30分钟。培养完成后,以3000rpm离心10分钟。弃去上清液,并加入200μl的2xYT培养基(34μg/ml的CM Kan.70μg/ml 1mMIPTG 5mMMgCl2),并使其在30℃和3000rpm下于Megagrow中静置过夜。为了选择与Ang2特异性结合的噬菌体,将1μg/ml(100μl/孔)的Ag(hAng2-Fc,hAng1-his:RNDsystems.目录号923-AN/CF或mAng1-Fc,PharmAbcine)加入到96孔免疫板中,并使其在4℃静置过夜。第二天,将前一天生长的细胞以3000rpm离心10分钟,并在4℃储存。将涂布的Ag用0.1%TBST(5mMCaCl2)洗涤三次,然后加入200μl的2%BSA封闭缓冲液,随后在25℃孵育2小时。封闭完成后,用0.1%TBST(5mMCaCl2)洗涤三次。将50μl的4%BSA和50μl旋转并在4℃下储存的噬菌体在每个孔中混合,并在室温下振荡1小时以允许反应发生。噬菌体结合后,用0.1%TBST(5mMCaCl2)洗涤三次,然后加入100μl缀合有HRP的小鼠抗M13Ab1:3000(Sino,11973-MM05),并使反应在25℃下进行1小时。反应完成后,用0.1%TBST(5mMCaCl2)洗涤三次,加入100μl的TMB(#BDTMB底物试剂组555214)显色3-5分钟,然后向每个孔中加入50μl终止溶液,随后用ELISA读数器进行分析。[表1]与Ang2抗原特异性结合的单克隆scFv噬菌体的ELISA测量结果所选抗体的碱基序列如下表2和表3所示。[表2]与Ang2抗原特异性结合的抗体的CDR序列[表3]与Ang2抗原特异性结合的抗体的可变区序列为了选择在竞争性ELISA中的中和Ang2/Tie2的结合的噬菌体,将1μg/ml(100μl/孔)的Ag(hTie2-Fc:PharmAbcine)添加到96孔免疫板中,并4℃下静置过夜。将铺展的Ag用1XPBS洗涤两次,然后加入200μl的3%BSA封闭缓冲液,随后在25℃孵育2小时。封闭完成后,用0.1%PBST洗涤两次。在每个孔中,将20μl(5μg/ml)的hAng2-his(RND,623-AN/CF)与噬菌体(其已被冷却并储存在4℃下)按不同的体积(80μl,40μl 1XPBS40μl,20μl 1XPBS60μl)混合,在室温下振荡1小时以允许反应发生。噬菌体结合后,用0.05%PBST洗涤三次,然后在室温下与0.5g/ml抗Ang2小鼠抗体反应1小时。抗体结合完成后,用0.05%PBST洗涤三次,然后加入100μl缀合有辣根过氧化物酶的小鼠抗-IgGAb1:2000(RND,HAF007),并使反应在25℃下进行1小时。反应完成后,用0.05%PBST洗涤三次,加入00μlTMB(#BDTMB底物试剂组555214)显色3-5分钟,然后向每个孔中加入50μl终止溶液,随后使用ELISA读取器进行分析。其结果如图1所示。如图1所示,证实所选噬菌体具有中和Tie2/Ang2的结合的能力。实施例3对血管生成素2具有高亲和力的抗体的选择(解离速率筛选)使用Octet(Fortebio)测量所选抗体对抗原的结合亲和力。为此,将Ang2固定在生物传感器上,然后加入以scFv形式表达的候选抗体并使之与其结合,随后测量离解速率常数。其结果如表4所示。[表4]与Ang2抗原特异性结合的抗体的离解速率常数克隆Kdis(1/s)3号6.42E-044号2.12E-048号<1.0E-0741号1.08E-0546号6.14E-05实施例4抗Ang2抗体的表达使用分子生物学技术将所选scFv噬菌体转换为IgG形式。从所选大肠杆菌克隆中提取噬菌粒,并使用PCR技术扩增可变区。将扩增的重链可变区插入含有重链恒定区的表达载体(Invivogen,pfusess-hchg1),并将扩增的轻链可变区插入含有轻链恒定区的表达载体(Invivogen,pfuse2s-hclk),从而完成IgG型DNA的克隆。使用Expi293F表达系统试剂盒(ThermoFisherScientific,US)进行IgG的瞬时表达。将试剂盒中包含的Expi293细胞悬浮,并在125rpm的轨道振荡器上,在37℃和5%CO2环境中,使用专用培养基培养。每三天一次,将细胞传代至3×105个细胞/ml的浓度,并且当引入表达载体时,在使用前将细胞数量调整至3×106个细胞/ml。对于基因引入,使用专用试剂Expifectamine,并且产生每1ml细胞悬浮液含有1μg表达载体DNA和2.7l1μlExpifectamine的脂质-DNA复合物,并将其添加到细胞悬浮液中,并且在引入后16-18小时,添加增强剂(enhancer)1/2以诱导表达。此后,所得悬浮液在相同条件下培养3-4天,然后离心收集含IgG的上清液。实施例5抗Ang2抗体的纯化将收集的上清液注射到蛋白A柱(GEHealthcare)中以通过亲和色谱纯化IgG。用20mMTris-HCl、50mMNaCl和5mMEDTA(pH7.0)平衡柱子,然后注入上清液,用50mMTris-HCl,500mMNaCl,5mMEDTA,0.2%聚山梨酯20(pH7.0)进行洗涤,然后用50mMNaCl,0.1M甘氨酸-HCl(pH3.5)进行洗脱,接着用1MTris中和。对于洗脱的蛋白质,通过使用MWCO10,000光谱/por透析膜(SpectrumLabs,US)透析,用PBS替换溶剂。此后,使用Vivaspin(Satorius,DE)将蛋白质浓缩至所需浓度,分配,然后储存在-80℃下。纯化后,在非还原性和还原性LDS样品缓冲液(ThermoFisherScientific)中处理每种抗体,并使用NuPAGE系统(ThermoFisherScientific)进行电泳。结果,获得了包含50kDa重链和25kDa轻链且总分子量约为150kDa的IgG(图2)。实施例6抗Ang2抗体的结合特异性分析对于结合特异性分析,使用ELISA法和BiacoreT200系统(GEHealthcareLifeSciences)测量结合常数。将1μg/ml(100μl/孔)的带His标签的人(R&Dsystems,623-AN/CF)或小鼠(sino,50298-M07H)Ang2溶液或带His标签的人(R&Dsystems,923-AN/CF)或小鼠(sino,50300-M07H)Ang1溶液加入到96孔免疫板(Nunc,US)中,并在4℃静置过夜以进行吸附。第二天,将溶液用含有0.05%Tween-20的PBS(以下称为PBST)洗涤三次,向每个孔中加入200μl的2%BSA/PBST溶液,然后在室温下静置2小时以进行封闭。在用PBST洗涤三次后,将100μl的每种测试抗体溶液按浓度加入到每个孔中以在室温下引起结合1小时,然后用PBST洗涤三次,加入100μl稀释至1:2000的缀合有HRP的山羊抗人IgG(κ)(bethyllab#A80-115P)并使其在室温下反应1小时,从而诱导结合,在用PBST洗涤三次后,使用100μlTMB底物试剂进行显色。通过加入50μl2NH2SO4停止显色反应,并用Sunrise微孔板读数器(TECAN,CH)测量比吸光度OD450-630(图3)。如图3所示,所选抗体与人和小鼠Ang2特异性结合,不与人和小鼠Ang1结合。为了分析所选抗Ang2抗体的结合亲和力,使用T200(GEHealthcare)对人Ang2和小鼠Ang2进行了亲和力分析。使用蛋白A传感器芯片,并按照制造商手册进行实验。详细分析条件如下。固定2000个蛋白A的反应单位(RU),将25RU的抗Ang2抗体候选物用于结合,并允许不同浓度的人Ang2和小鼠Ang2结合。分析的起始浓度分别为100nM和150nM。分析以30μl/min的流速进行,人Ang2的结合和离解时间分别测量为300秒和2000秒,小鼠Ang2的结合和离解时间分别分析为300秒和1000秒。使用1∶1结合模型作为分析模型进行分析。其分析结果如表5所示。[表5]实施例7抗Ang2抗体(Ang2/Tie2,Ang2/整联蛋白)中和能力的确认将1μg/ml(100μl/孔)的人Ti32-FcR&DSystems,313-TI)或小鼠Tie2-Fc(R&DSystems,762-T2-100)溶液、整联蛋白α3/β1溶液(R&Dsystems,2840-A3-050)或整联蛋白α5/β1溶液(R&Dsystems,3230-A5-050)加入96孔免疫板(Nunc,US)中,然后在4℃静置过夜以进行吸附。第二天,将平板用含有0.05%Tween-20的PBS(以下称为PBST)洗涤四次,向每个孔中加入200μl2%BSA/PBST溶液,然后在室温下静置1小时以进行封闭。将抗Ang2候选抗体以最大1000nM进行连续4倍稀释,并使生物素化的人Ang2蛋白最终浓度为100ng/mL或625ng/mL,然后在室温下进行先前的结合1小时。用PBST洗涤已经封闭的平板四次,然后将先前诱导抗原-抗体反应的样品加入平板,并允许结合在室温下进行1小时。用PBST洗涤平板三次,加入稀释至1∶200的100μl缀合有辣根过氧化物酶的链霉抗生物素蛋白(R&DSystems,DY998),使反应在室温下进行1小时,从而诱导结合,并将平板用PBST洗涤四次,然后使用100μl的TMB底物试剂显色。通过加入50μl的2NH2SO4停止显色反应,并用Sunrise微孔板读数器(TECAN,CH)测量比吸光度OD450(图4和5)。如图4所示,所选抗体中和了人和小鼠中的Ang2/Tie2结合。中和能力通过获得IC50值来定量,如表6所示。另外,如图5所示,所选抗体也中和了整联蛋白/Ang2的结合。使用IC50值定量检测整联蛋白/Ang2的中和能力,并且其结果如表7所示。[表6]编号样品IC50(hAng2竞争)(pM)IC50(mAng2竞争)(pM)13号491.4502124号461.6454438号495.54830441号475.53985546号336.652556REGN910458.610445[表7]实施例8抗Ang2抗体抑制Ang2/Tie2信号传导的效果分析(p-Tie2测定)将过表达人Tie2的细胞(1x105)置于96孔板中,并在37℃于供应二氧化碳的培养箱中生长过夜。细胞在无血清培养基中生长过夜,形成血清剥夺条件。使人Ang2(5μg/ml)和各种浓度的抗Ang2预先在室温下反应1小时,然后将其置于含有细胞的平板中,并使反应进行20分钟。在这一点上,平板中包含不含抗体且仅含Ang2蛋白的孔,并将所述孔用作分析信号传导抑制效果的参考值。用裂解缓冲液裂解细胞,然后定量。为了测量磷酸化反应,使用了可从R&DSystems获得的人Phospho-Tie2DuosetICELISA(R&DSystems,DYC2720-5)。将4μg/ml人Tie2捕获蛋白加入96孔免疫板(Nunc,US)的每个孔中,然后在4℃静置过夜以进行吸附。第二天,向每个孔中加入200μl稀释剂,并在室温下静置2小时以进行封闭。加入50μg细胞裂解物,并使结合在室温下进行2小时。反应完成后,将抗磷酸酪氨酸抗体稀释至2700:1,并使结合在室温下进行2小时。对于反应完成的平板,使用TMB底物试剂进行显色。通过加入50μl2NH2SO4停止显色反应,并用Sunrise微孔板读数器(TECAN,CH)测量比吸光度OD450(图6)。如图6所示,可以证实,随着抗体浓度的增加,磷酸化减少。磷酸化程度通过获得IC50值来定量,其结果如表8所示。[表8]编号样品克隆IC50(pM)13号1D10852824号2D81231238号3A1020169441号2B210962546号3C6101226REGN910REGN9105424实施例9亲和力增强的变体的构建和选择进行抗体优化以增强抗Ang2抗体克隆8的亲和力。通过使用保存和随机化70%的8号原始DNA序列的软随机化方法,制备了具有引入8号的轻链CDR3和重链CDR3的随机突变的引物。通过使用引物的PCR,获得了编码引入突变的轻链可变区和重链可变区的DNA片段。这些片段分别被8号scFv噬菌粒的轻链可变区和8号scFv噬菌粒的重链可变区取代,从而完成了轻链CDR3和重链CDR3变体的scFv噬菌体DNA文库的构建。用苯酚-氯仿纯化scFv噬菌体DNA文库,然后使用电穿孔法将其转化到大肠杆菌菌株XL-1Blue中。在通过转化效率分析和DNA测序确认获得多样性后,培养500ml该菌株以诱导噬菌体表达,并使用PEG沉淀构建轻链和重链CDR3变体的scFv噬菌体文库。使用每种突变scFv噬菌体文库,使用根据实施例1的方法进行生物淘选。此后,在筛选过程中,测量离解速率常数kdis作为维持结合的能力的定量评价指标。显示了三个选择和优化的克隆的氨基酸序列(表9和表10)和离解速率常数测量结果(表11)。[表9][表10][表11]实施例10优化的抗Ang2抗体的ScFv产生优化的抗Ang2抗体(O4号)被克隆到用于在大肠杆菌中表达的pET-22b载体(Novagen)中。选择通过将载体转化到BL21(De3)中产生的菌落,将100μg/ml氨苄青霉素加入到LB(溶源性肉汤)培养基中,并将1%的在37℃和200rpm下预培养的大肠杆菌接种到含有100μg/ml氨苄青霉素作为抗生素的LB培养基中。将大肠杆菌在37℃和200rpm下孵育,将培养箱的温度降至20℃,加入0.5mMIPTG,然后孵育16小时。通过以8000rpm离心10分钟收集孵育的大肠杆菌。移出培养基后,使用10ml(按细胞重量(g)计)含有50mMTris-HClpH7.4,150mMNaCl和1mM苯基甲基磺酰氟(PMSF)的裂解缓冲液进行重悬浮。使用超声波处理器在以下功率条件下破碎细胞:20W,静息:3秒,工作:3秒,以及时间:5分钟。将破碎的细胞以11000rpm离心1小时,以分离上清液和沉淀物。ScFv以不溶性形式表达,并进行沉淀洗涤以进行重折叠。在使用50mMTris-HClpH7.4,150mMNaCl缓冲液用均化器均化后,通过以11000rpm离心1小时洗涤沉淀两次。将沉淀中残留的大肠杆菌来源的物质用50mMTris-HClpH7.4,150mMNaCl,2M尿素,0.5%TritonX-100缓冲液去除,并用50mMTris-HClpH7.4、150mMNaCl缓冲液重复洗涤三次。将包涵体用50mMTris-HClpH7.4,150mMNaCl,8M尿素,10mMDTT缓冲液重新悬浮,然后使反应进行约30分钟以产生呈未折叠形式的scFv,随后以11000rpm离心1小时以分离沉淀。对scFv抗体进行分步透析以除去尿素,从而诱导重折叠。通过将尿素浓度降低1/2,使用基本上含有50mMTris-HClpH7.4和150mMNaCl的透析缓冲液进行透析。通过向4-2-1M尿素浓度级分中加入0.1ML-精氨酸抑制聚集来进行重折叠,在4-2-1m尿素浓度级分中最容易形成适当的蛋白质折叠。用HisTrap和CapoL柱分离并纯化重折叠的scFv抗体。按照以下顺序进行分离和纯化。使用AKTAPrime(GEHealthcare)System进行纯化,并使用5ml的HisTrap填充柱。将10柱体积的50毫米磷酸钠、400毫米氯化钠、10毫米的pH7.4的咪唑缓冲液流入HisTrap柱中进行平衡,并使单链抗体样品以5毫升/分钟的流速流入HisTrap柱中,使抗体样品与柱内的树脂结合。为了除去树脂中存在的非特异性结合物质,使约10倍柱体积的50mM磷酸钠、400mMNaCl、10mM咪唑pH7.4的缓冲液流动,然后使50mM磷酸钠、400mMNaCl、300mM的pH7.4的咪唑缓冲液以浓度梯度流动,从而洗脱scFv抗体。使用5ml的CaptoL柱对洗脱的抗体样品进行以下纯化。用pH7.4的磷酸盐缓冲盐水(PBS)缓冲液平衡CaptoL柱,然后使样品以5ml/min的流速流入CaptoL柱,以除去非特异性结合物质。使10倍柱体积的0.1M柠檬酸、0.2MNa2HPO4pH2.6缓冲液流动,以便洗脱scFv抗体。图7示出了纯化后最终获得的蛋白质的SDS-PAGE结果。因此,获得的单链抗体显示出高纯度。实施例11优化的抗Ang2ScFv抗体的结合特异性分析对于结合特异性分析,结合常数是使用ELISA法和Octet系统(PallForteBioLLC,US)测量的。将1μg/ml(100μl/孔)的带His标签的人Ang2蛋白R&Dsystems,623-AN/CF)溶液加入96孔免疫板(Nunc,US)中,并在4℃静置过夜以进行吸附。第二天,将溶液用含有0.05%Tween-20的PBS(以下称为PBST)洗涤三次,向每个孔中加入200μl的2%BSA/PBST溶液,然后在室温下静置2小时以进行封闭。在用PBST洗涤三次后,将100μl的每种测试抗体溶液按浓度加入到每个孔中,以在室温下引起结合1小时,然后用PBST洗涤三次,加入100μl稀释至1∶1000的缀合有辣根过氧化物酶的抗His标签单克隆抗体MAB050H,R&DSystems,US),并使其在室温下反应1小时,从而诱导结合,在用PBST洗涤三次后,使用100μlTMB底物试剂进行显色。通过加入50μl2NH2SO4停止显色反应,并用Sunrise微孔板读数器(TECAN,CH)测量比吸光度OD450(图8)。如图8所示,纯化的抗体与人Ang2结合。使用Octet系统(ForteBioInc.,US)测量纯化的scFv抗体对人Ang2的结合亲和力。为此,将抗Ang2抗体固定在生物传感器上,并测量人Ang2根据浓度的结合动力学,以计算结合速率常数(ka)、离解速率常数(kdis)和结合常数(KD)(表12)。[表12]样品ka(1/Ms)kd(1/s)KD(M)O4号scFv9.4E 042.54E-052.8E-10实施例12所选抗Ang2ScFv抗体的体内功效分析(CNV小鼠模型)为了证实抗Ang2scFv抗体是否具有抑制血管生成的功效,在激光诱导的脉络膜新生血管形成小鼠模型中进行了药效测试。使用市售药物阿柏西普作为对照来测试功效。一般用氯胺酮麻醉小鼠,然后在眼球上滴麻醉眼药水进行额外的局部麻醉,并在眼睛上涂散瞳剂诱导散瞳。将每只小鼠放在台上,并使用Micron-IV在CNV诱导条件(波长:532nm,直径:50μm,持续时间:80mS,功率水平:200mW)使用Micron-IV诱导激光烧伤,从而破坏布鲁赫膜(Bruch'smembrane)。在激光烧伤诱导过程中,将未观察到起泡的损伤归类为不成功的激光烧伤,并基于通过修改GongY.等人提出的标准而获得的排除标准将其排除在结果分析和统计处理之外。为了证实CNV诱导和药物的血管生成抑制作用,通常在CNV诱导后第10天用氯胺酮麻醉小鼠,然后将荧光造影剂腹膜内注射到每只小鼠中。将麻醉滴眼液用于眼球以进行额外的局部麻醉,并将散瞳剂用于眼睛以诱导散瞳。将每只小鼠置于台上,使用Micron-IV的成像照相机进行眼底图像对准,然后将润滑凝胶施加到相应的眼睛上,并使OCT透镜与每只小鼠的角膜接触。FFA/OCT成像后,将1滴抗生素滴眼液涂在小鼠的眼睛上。使用“图像-J”程序对FFA和OCT图像进行分析。在这一点上,与GongY.等人提出的排除标准相对应的CNV病变被排除在最终结果和统计分析之外。为了证实视神经的恢复效果,进行了视网膜电图(ERG)测试。在视网膜电图评估前12小时,将小鼠置于暗室中,以诱导黑暗适应。在评估日(CNV诱导后第11天),小鼠通常用和麻醉,然后将涂于眼以进行额外的局部麻醉,并将散瞳剂用于眼睛以诱导散瞳。将每只小鼠放在ERG台上,并将ERG的探针分别与尾部、头部和角膜接触。ERG测量为单一闪光刺激下视网膜电位的变化(0.9logcds/m2(10个反应/强度))。当ERG评估完成时,将1滴托百士(tobrex)涂于小鼠的眼睛。ERG分析是使用LabScribeERG(iWorx数据采集软件)程序进行的。在这一点上,与GongY.等人提出的排除标准相对应的眼睛被排除在最终结果和统计分析之外。证实抗Ang2scFv抗体在CNV小鼠模型中减少血管生成的功效的结果如图9所示。在被施予10μg/μLscFv的实验组中,观察到在FFA上观察到的CNV损伤的尺寸在统计学上显著减小(P<0.01),显示出相较于被施予阿柏西普的实验组的更强效的效果。根据图10,证实了即使在与通过OCT测量的CNV对照相比时,所有被施予scFv的实验组都以浓度依赖的方式显示出损伤体积的统计学上显著的减少(分别为P<0.01、P<0.0001、P<0.05)。另外,如图11所示,当通过暗视-ERG将视网膜电位与CNV对照的视网膜电位进行比较时,观察到B波振幅有统计学上显著的增加(分别为P<0.0001)。实施例13抗Ang2抗体的抗肿瘤功能分析(TNBC模型)为了证实抗Ang2抗体是否具有抑制血管生成的功效,在人三阴性乳腺癌(TNBC)模型(MDA-MB-231)中进行了抗肿瘤功效测试。为了确定抗Ang2抗体的抗肿瘤活性,评价了通过注射到NSG小鼠的尾静脉中的同种型对照、奈斯伐单抗和抗Ang2抗体的抗癌功效,所述小鼠具有移植在其左侧胁腹的人来源的乳腺癌细胞系MDA-MB-231。ChampionsOncology,Inc.(US)被要求进行该实验。将人乳腺癌细胞系MDA-MB-231(乳腺癌细胞系)解冻,并在CO2培养箱(Forma,USA)中于37℃的温度和5%的CO2浓度下进行培养。在培养的最后一天,收集并计数所有癌细胞,并使用无血清培养基将细胞浓度调整到1×108个细胞/ml。将调整后的细胞培养液以0.1ml(1×107个细胞/小鼠)注射到每只小鼠的左胁腹。以之字形方式将小鼠分成每治疗组8只小鼠,直至肿瘤体积达到100-150mm3。分组后,立即开始药物施用。作为阴性对照的10mg/kg同种型对照、3mg/kg或10mg/kg的抗Ang2抗体和3mg/kg或10mg/kg奈斯伐单抗通过静脉注射施用,每周两次,持续3周。施药后,每周测量肿瘤体积两次,持续20天。在测量过程中,小鼠未表现出临床毒性反应。用10mg/kg抗Ang2抗体治疗的组显示出抑制肿瘤生长约70%的效果,这大约是用10mg/kg的奈斯伐单抗(Nesvacumab)治疗的组的两倍。使用以下方程式计算肿瘤体积:肿瘤体积(TV)=宽度2x长度x0.52。每个个体的重量显示出平均约5%的均匀增加,由此证实没有特别的毒性反应(图12)。[表13]通过施用抗Ang2抗体抑制肿瘤生长的效果(mm3)[表14]小鼠体重(g)随日期的变化工业适用性根据本公开内容的抗Ang2抗体或其抗原结合片段表现出与Ang2结合的期望能力,并且可以有效地用于癌症/肿瘤或血管生成的抑制剂以及预防或治疗与血管生成素-2激活和/或过量产生相关的疾病。根据本公开内容,通过开发具有与现有Ang2靶向治疗剂的靶点不同的靶点的治疗剂,可以为肿瘤的治疗提供与现有治疗剂的组合治疗和单一治疗。虽然已经详细描述了本公开内容的具体实施方案,但对于本领域普通技术人员来说,这些详细描述仅仅是示例性实施方案,并不旨在限制本公开内容的范围。因此,本公开内容的实质范围应当由所附权利要求及其等同物来限定。序列自由格式文本(SequenceFreeText)附上电子文件。序列表<110>药物抗体公司<120>抗Ang2抗体及其用途<130>0165-PA-014CN<150>KR10-2019-0021812<151>2019-02-25<160>61<170>PatentInversion3.5<210>1<211>8<212>PRT<213>人工序列<220><223>合成序列<400>1GlyPheSerPheAspAspTyrAla15<210>2<211>8<212>PRT<213>人工序列<220><223>合成序列<400>2IleLysAspAspGlySerGlnThr15<210>3<211>13<212>PRT<213>人工序列<220><223>合成序列<400>3ThrThrGluGlyLeuMetAsnGlyLeuHisPheAspMet1510<210>4<211>9<212>PRT<213>人工序列<220><223>合成序列<400>4SerSerAsnIleGlyAlaGlyTyrAsp15<210>5<211>3<212>PRT<213>人工序列<220><223>合成序列<400>5GlyAsnAsn1<210>6<211>10<212>PRT<213>人工序列<220><223>合成序列<400>6GlnSerTyrAspSerArgLeuGlyValVal1510<210>7<211>8<212>PRT<213>人工序列<220><223>合成序列<400>7GlyTyrSerPheThrSerTyrTrp15<210>8<211>8<212>PRT<213>人工序列<220><223>合成序列<400>8IleTyrProGlyAsnSerAspThr15<210>9<211>13<212>PRT<213>人工序列<220><223>合成序列<400>9ThrThrGluGlyLeuMetAsnGlyLeuHisPheAspMet1510<210>10<211>11<212>PRT<213>人工序列<220><223>合成序列<400>10GlnSerLeuLeuHisSerLeuGlyAspAsnTyr1510<210>11<211>3<212>PRT<213>人工序列<220><223>合成序列<400>11LeuGlySer1<210>12<211>10<212>PRT<213>人工序列<220><223>合成序列<400>12MetGlnSerLeuGlnThrProProTyrThr1510<210>13<211>8<212>PRT<213>人工序列<220><223>合成序列<400>13GlyPheThrPheSerSerTyrSer15<210>14<211>8<212>PRT<213>人工序列<220><223>合成序列<400>14IleSerAlaSerAspGlyAlaThr15<210>15<211>16<212>PRT<213>人工序列<220><223>合成序列<400>15AlaLysIleLeuAlaGlyTyrSerGlyProMetGlyGlyMetAspVal151015<210>16<211>6<212>PRT<213>人工序列<220><223>合成序列<400>16ArgAspIleSerAsnTyr15<210>17<211>3<212>PRT<213>人工序列<220><223>合成序列<400>17GlyAlaSer1<210>18<211>9<212>PRT<213>人工序列<220><223>合成序列<400>18GlnGlnTyrTyrSerTyrProLeuThr15<210>19<211>8<212>PRT<213>人工序列<220><223>合成序列<400>19GlyPheAlaPheGlyArgTyrGlu15<210>20<211>8<212>PRT<213>人工序列<220><223>合成序列<400>20IleAspThrGlyGlyGlyAlaLys15<210>21<211>13<212>PRT<213>人工序列<220><223>合成序列<400>21ThrThrGluGlyLeuMetAsnGlyLeuHisPheAspMet1510<210>22<211>6<212>PRT<213>人工序列<220><223>合成序列<400>22GlnAlaIleSerThrTrp15<210>23<211>3<212>PRT<213>人工序列<220><223>合成序列<400>23ThrAlaSer1<210>24<211>9<212>PRT<213>人工序列<220><223>合成序列<400>24GlnGlnLeuAsnSerTyrProTyrThr15<210>25<211>8<212>PRT<213>人工序列<220><223>合成序列<400>25GlyPheThrPheAspAspCysAla15<210>26<211>8<212>PRT<213>人工序列<220><223>合成序列<400>26IleSerGlyAsnSerLysAsnVal15<210>27<211>11<212>PRT<213>人工序列<220><223>合成序列<400>27AlaArgAspProAlaTyrSerGlnPheAspTyr1510<210>28<211>8<212>PRT<213>人工序列<220><223>合成序列<400>28SerSerAsnValGlyGlyTyrPro15<210>29<211>3<212>PRT<213>人工序列<220><223>合成序列<400>29ThrAspTyr1<210>30<211>11<212>PRT<213>人工序列<220><223>合成序列<400>30AlaThrTrpAspAspAsnLeuAsnGlyTyrVal1510<210>31<211>360<212>DNA<213>人工序列<220><223>合成序列<400>31cagatgcagctggtgcagtctgggggaggcttggtacagcctggcaggtccctcaaactc60tcctgcgcagcctctggattctcctttgatgattatgccatgcactgggtccggcaagct120ccagggaaggggctggagtgggtggccaccataaaggacgatggaagtcagacatactat180gtggactctgtgaagggccgattcaccatctccagagacaacgccaagagctcactgttt240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtaccacagaagga300ttaatgaatggacttcattttgatatgtggggccaagggacaatggtcaccgtctcctca360360<210>32<211>120<212>PRT<213>人工序列<220><223>合成序列<400>32GlnMetGlnLeuValGlnSerGlyGlyGlyLeuValGlnProGlyArg151015SerLeuLysLeuSerCysAlaAlaSerGlyPheSerPheAspAspTyr202530AlaMetHisTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045AlaThrIleLysAspAspGlySerGlnThrTyrTyrValAspSerVal505560LysGlyArgPheThrIleSerArgAspAsnAlaLysSerSerLeuPhe65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095ThrThrGluGlyLeuMetAsnGlyLeuHisPheAspMetTrpGlyGln100105110GlyThrMetValThrValSerSer115120<210>33<211>333<212>DNA<213>人工序列<220><223>合成序列<400>33cagctcgtgctgactcagccgccctcagtgtctggggccccagggcagggggtcaccatc60tcctgcactgggagcagctccaacatcggggcaggttatgatgtacactggtaccagcag120tttccaggaacagcccccaaactcctcatctctggtaacaataatcggccctcagggctc180cctgaccgattctctggctccaagtctggcacctcagcctccctggccatcactggactc240caggctgaggatgaggctgattattactgccagtcctatgacagcaggctgggtgtggtc300ttcggcggagggaccaagctgaccgtcctaggt333<210>34<211>110<212>PRT<213>人工序列<220><223>合成序列<400>34LeuValLeuThrGlnProProSerValSerGlyAlaProGlyGlnGly151015ValThrIleSerCysThrGlySerSerSerAsnIleGlyAlaGlyTyr202530AspValHisTrpTyrGlnGlnPheProGlyThrAlaProLysLeuLeu354045IleSerGlyAsnAsnAsnArgProSerGlyLeuProAspArgPheSer505560GlySerLysSerGlyThrSerAlaSerLeuAlaIleThrGlyLeuGln65707580AlaGluAspGluAlaAspTyrTyrCysGlnSerTyrAspSerArgLeu859095GlyValValPheGlyGlyGlyThrLysLeuThrValLeuGly100105110<210>35<211>360<212>DNA<213>人工序列<220><223>合成序列<400>35caggtgcagctggtggagtctggagcagaggtgaaaagacccggggagtctctgaggatc60tcctgtaagacttctggatacagctttaccagctactggatccactgggtgcgccagatg120cccgggaaagaactggagtggatggggagcatctatcctgggaactctgataccagatac180agcccatccttccaaggccacgtcaccatctcagccgacagctccagcagcaccgcctac240ctgcagtggagcagcctgaaggcctcggacaccgccatgtattactgtaccacagaagga300ttaatgaatggacttcattttgatatgtggggccaagggacaatggtcaccgtctcctca360360<210>36<211>120<212>PRT<213>人工序列<220><223>合成序列<400>36GlnValGlnLeuValGluSerGlyAlaGluValLysArgProGlyGlu151015SerLeuArgIleSerCysLysThrSerGlyTyrSerPheThrSerTyr202530TrpIleHisTrpValArgGlnMetProGlyLysGluLeuGluTrpMet354045GlySerIleTyrProGlyAsnSerAspThrArgTyrSerProSerPhe505560GlnGlyHisValThrIleSerAlaAspSerSerSerSerThrAlaTyr65707580LeuGlnTrpSerSerLeuLysAlaSerAspThrAlaMetTyrTyrCys859095ThrThrGluGlyLeuMetAsnGlyLeuHisPheAspMetTrpGlyGln100105110GlyThrMetValThrValSerSer115120<210>37<211>342<212>DNA<213>人工序列<220><223>合成序列<400>37gatattgtgatgacccagactccactctccctgcccgtcacccctggagagccggcctcc60atctcctgtaggtcaagtcagagcctcctgcatagtcttggagacaattatttggattgg120tatctacagaagccagggcagtctccgcaactcctgatctatttgggttctaagcgggcc180gccggggtccccgacaggttcagtggcagtggctcaggcacagactttacactcaaaatc240agcagagtggaggctgaggatgttggagtttattattgcatgcaatctctacaaactccc300ccgtacacttttggccaggggaccaagctggagatcaaacgt342<210>38<211>114<212>PRT<213>人工序列<220><223>合成序列<400>38AspIleValMetThrGlnThrProLeuSerLeuProValThrProGly151015GluProAlaSerIleSerCysArgSerSerGlnSerLeuLeuHisSer202530LeuGlyAspAsnTyrLeuAspTrpTyrLeuGlnLysProGlyGlnSer354045ProGlnLeuLeuIleTyrLeuGlySerLysArgAlaAlaGlyValPro505560AspArgPheSerGlySerGlySerGlyThrAspPheThrLeuLysIle65707580SerArgValGluAlaGluAspValGlyValTyrTyrCysMetGlnSer859095LeuGlnThrProProTyrThrPheGlyGlnGlyThrLysLeuGluIle100105110LysArg<210>39<211>369<212>DNA<213>人工序列<220><223>合成序列<400>39caggtgcagctggtagagtctgggggaggcctggtcaagcctggggggtccctgagactc60tcctgtgcagcctctggattcaccttcagtagctatagcatgaactgggtccgccaggct120ccagggaaggggctggagtgggtctcatccattagtgctagtgatggtgccacatactac180gcagactccgtgaggggccggttcaccatctccagagacaattccaggagcacactgtat240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtgcgaaaattctc300gcgggatatagtggcccaatgggcggaatggacgtctggggccaagggaccacggtcacc360gtctcctca369<210>40<211>123<212>PRT<213>人工序列<220><223>合成序列<400>40GlnValGlnLeuValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuArgLeuSerCysAlaAlaSerGlyPheThrPheSerSerTyr202530SerMetAsnTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerSerIleSerAlaSerAspGlyAlaThrTyrTyrAlaAspSerVal505560ArgGlyArgPheThrIleSerArgAspAsnSerArgSerThrLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaLysIleLeuAlaGlyTyrSerGlyProMetGlyGlyMetAspVal100105110TrpGlyGlnGlyThrThrValThrValSerSer115120<210>41<211>324<212>PRT<213>人工序列<220><223>合成序列<400>41GlyAlaCysAlaThrCysCysAlaGlyAlaThrGlyAlaCysCysCys151015AlaGlyThrCysThrCysCysAlaThrCysCysThrCysAlaCysThr202530GlyThrCysThrGlyCysAlaThrCysThrGlyThrAlaGlyGlyAla354045GlyAlaCysAlaGlyAlaGlyThrCysAlaCysCysAlaThrCysAla505560CysThrThrGlyThrCysGlyGlyGlyCysGlyAlaGlyThrCysGly65707580GlyGlyAlaCysAlaThrThrAlaGlyCysAlaAlaCysThrAlaThr859095ThrThrAlaGlyCysCysThrGlyGlyThrAlaThrCysAlaGlyCys100105110AlaGlyAlaAlaAlaCysCysAlaGlyGlyGlyAlaAlaAlaGlyCys115120125CysCysCysThrAlaAlaGlyThrCysCysCysThrGlyAlaThrCys130135140ThrAlaThrGlyGlyAlaGlyCysAlaThrCysCysAlaAlaThrThr145150155160ThrAlaCysAlaAlaAlaGlyThrGlyGlyGlyGlyThrCysThrCys165170175AlaThrCysAlaCysAlaGlyThrThrCysAlaGlyCysGlyGlyCys180185190AlaGlyThrGlyGlyAlaThrCysCysGlyGlyGlyAlaCysAlaGly195200205AlaThrThrThrCysAlaCysCysCysThrCysAlaCysCysAlaThr210215220CysAlaAlaCysAlaGlyCysCysThrGlyCysAlaGlyCysCysThr225230235240GlyAlaAlaGlyAlaThrThrCysThrGlyCysAlaAlaCysThrThr245250255AlaThrThrAlaCysThrGlyThrCysAlaAlaCysAlaGlyThrAla260265270CysThrAlaThrAlaGlyThrThrAlaCysCysCysGlyCysThrCys275280285AlaCysThrThrThrThrGlyGlyCysGlyGlyAlaGlyGlyGlyAla290295300CysCysAlaAlaGlyGlyThrGlyGlyAlaThrAlaThrCysAlaAla305310315320AlaCysGlyThr<210>42<211>108<212>PRT<213>人工序列<220><223>合成序列<400>42AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerArgAspIleSerAsnTyr202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysSerLeuIle354045TyrGlyAlaSerAsnLeuGlnSerGlyValSerSerGlnPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleAsnSerLeuGlnPro65707580GluAspSerAlaThrTyrTyrCysGlnGlnTyrTyrSerTyrProLeu859095ThrPheGlyGlyGlyThrLysValAspIleLysArg100105<210>43<211>360<212>DNA<213>人工序列<220><223>合成序列<400>43caggtgcagctggtggagtctgggggaggcttggtacagcctggagggtccctgagactc60tcctgtgaagcctctggattcgccttcggtcgttatgagatgaattgggtccgccaggct120ccagggaaggggctggagtggattgcatatattgatactggtggtggtgccaaagtctat180gcagactctgtgaagggccgattcaccatctccagagacgacagcaaaaactccctgtat240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtaccacagaagga300ttaatgaatggacttcattttgatatgtggggccaagggacaatgatcaccgtctcctca360360<210>44<211>120<212>PRT<213>人工序列<220><223>合成序列<400>44GlnValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyGly151015SerLeuArgLeuSerCysGluAlaSerGlyPheAlaPheGlyArgTyr202530GluMetAsnTrpValArgGlnAlaProGlyLysGlyLeuGluTrpIle354045AlaTyrIleAspThrGlyGlyGlyAlaLysValTyrAlaAspSerVal505560LysGlyArgPheThrIleSerArgAspAspSerLysAsnSerLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095ThrThrGluGlyLeuMetAsnGlyLeuHisPheAspMetTrpGlyGln100105110GlyThrMetIleThrValSerSer115120<210>45<211>324<212>DNA<213>人工序列<220><223>合成序列<400>45gacatccagatgacccagtctccttccaccctgtctgcatctgtaggagacagagtcgcc60atcacttgccgggccagtcaggctattagtacctggttggcctggtatcagcagaaacct120ggtaaagcccctaaactcctgatctatacggcgtctactttagaaagtggggtcccatca180aggttcagcggcagtggatctgggacagatttcactctcaccatcaacagcctgcagcct240gatgattttgcaacttattactgtcaacagcttaatagttacccttacactttcggcgga300gggaccaaggtggagatcaaacgt324<210>46<211>108<212>PRT<213>人工序列<220><223>合成序列<400>46AspIleGlnMetThrGlnSerProSerThrLeuSerAlaSerValGly151015AspArgValAlaIleThrCysArgAlaSerGlnAlaIleSerThrTrp202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrThrAlaSerThrLeuGluSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleAsnSerLeuGlnPro65707580AspAspPheAlaThrTyrTyrCysGlnGlnLeuAsnSerTyrProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLysArg100105<210>47<211>354<212>DNA<213>人工序列<220><223>合成序列<400>47caggtgcagctggtggagtctgggggaggcttggtacagcctggcaggtccctgagactc60tcctgtgcagcctctggattcacctttgatgattgtgccatgcactgggtccgacaagct120ccagggaagggcctggagtgggtctcaggtattagtgggaatagtaaaaacgtagcctat180gcggactctgtgaagggccgattcagcatctccagagacgacgccaagaactccctgtat240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtgcgagagatccg300gcatacagccagtttgactactggggccagggaaccctgatcaccgtctcctca354<210>48<211>118<212>PRT<213>人工序列<220><223>合成序列<400>48GlnValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyArg151015SerLeuArgLeuSerCysAlaAlaSerGlyPheThrPheAspAspCys202530AlaMetHisTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerGlyIleSerGlyAsnSerLysAsnValAlaTyrAlaAspSerVal505560LysGlyArgPheSerIleSerArgAspAspAlaLysAsnSerLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaArgAspProAlaTyrSerGlnPheAspTyrTrpGlyGlnGlyThr100105110LeuIleThrValSerSer115<210>49<211>333<212>DNA<213>人工序列<220><223>合成序列<400>49cagtctgccctgactcagcctccctcactgtctgcgacccccgggcagagggtcaccatc60tcttgctctggaagcagctccaacgtcggaggatatcctgtcaactggtaccagcaggtc120ccaggagcggcccccaaactcctcatgtatactgattataagcggccctcaggtgtccct180gaccgattctttggctccaagtctggcacttcagcctccctggccatcagtggcctccag240tctgaagatgaggctgattattactgtgctacatgggacgacaacctgaatggctatgtc300ttcggaactgggaccaaggtcaccgtcctaggt333<210>50<211>111<212>PRT<213>人工序列<220><223>合成序列<400>50GlnSerAlaLeuThrGlnProProSerLeuSerAlaThrProGlyGln151015ArgValThrIleSerCysSerGlySerSerSerAsnValGlyGlyTyr202530ProValAsnTrpTyrGlnGlnValProGlyAlaAlaProLysLeuLeu354045MetTyrThrAspTyrLysArgProSerGlyValProAspArgPhePhe505560GlySerLysSerGlyThrSerAlaSerLeuAlaIleSerGlyLeuGln65707580SerGluAspGluAlaAspTyrTyrCysAlaThrTrpAspAspAsnLeu859095AsnGlyTyrValPheGlyThrGlyThrLysValThrValLeuGly100105110<210>51<211>16<212>PRT<213>人工序列<220><223>合成序列<400>51AlaLysThrLeuAlaGlyTyrSerGlyProMetGlyGlyMetAspVal151015<210>52<211>16<212>PRT<213>人工序列<220><223>合成序列<400>52AlaLysIleLeuValGlyTyrSerGlyProMetGlyGlyMetAspVal151015<210>53<211>16<212>PRT<213>人工序列<220><223>合成序列<400>53AlaLysSerLeuAlaSerTyrSerGlyProMetGlyGlyMetAspVal151015<210>54<211>369<212>DNA<213>人工序列<220><223>合成序列<400>54caggtgcagctggtagagtctgggggaggcctggtcaagcctggggggtccctgagactc60tcctgtgcagcctctggattcaccttcagtagctatagcatgaactgggtccgccaggct120ccagggaaggggctggagtgggtctcatccattagtgctagtgatggtgccacatactac180gcagactccgtgaggggccggttcaccatctccagagacaattccaggagcacactgtat240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtgcgaaaactctc300gcgggatatagtggcccaatgggtggcatggacgtctggggccaagggaccacggtcacc360gtctcctca369<210>55<211>123<212>PRT<213>人工序列<220><223>合成序列<400>55GlnValGlnLeuValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuArgLeuSerCysAlaAlaSerGlyPheThrPheSerSerTyr202530SerMetAsnTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerSerIleSerAlaSerAspGlyAlaThrTyrTyrAlaAspSerVal505560ArgGlyArgPheThrIleSerArgAspAsnSerArgSerThrLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaLysThrLeuAlaGlyTyrSerGlyProMetGlyGlyMetAspVal100105110TrpGlyGlnGlyThrThrValThrValSerSer115120<210>56<211>369<212>DNA<213>人工序列<220><223>合成序列<400>56caggtgcagctggtagagtctgggggaggcctggtcaagcctggggggtccctgagactc60tcctgtgcagcctctggattcaccttcagtagctatagcatgaactgggtccgccaggct120ccagggaaggggctggagtgggtctcatccattagtgctagtgatggtgccacatactac180gcagactccgtgaggggccggttcaccatctccagagacaattccaggagcacactgtat240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtgcgaaaatcctc300gtaggatacagtggcccaatgggcggaatggacgtctggggccaagggaccacggtcacc360gtctcctca369<210>57<211>123<212>PRT<213>人工序列<220><223>合成序列<400>57GlnValGlnLeuValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuArgLeuSerCysAlaAlaSerGlyPheThrPheSerSerTyr202530SerMetAsnTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerSerIleSerAlaSerAspGlyAlaThrTyrTyrAlaAspSerVal505560ArgGlyArgPheThrIleSerArgAspAsnSerArgSerThrLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaLysIleLeuValGlyTyrSerGlyProMetGlyGlyMetAspVal100105110TrpGlyGlnGlyThrThrValThrValSerSer115120<210>58<211>369<212>DNA<213>人工序列<220><223>合成序列<400>58caggtgcagctggtagagtctgggggaggcctggtcaagcctggggggtccctgagactc60tcctgtgcagcctctggattcaccttcagtagctatagcatgaactgggtccgccaggct120ccagggaaggggctggagtgggtctcatccattagtgctagtgatggtgccacatactac180gcagactccgtgaggggccggttcaccatctccagagacaattccaggagcacactgtat240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtgcgaaaagcctt300gccagctatagtggcccaatgggcggcatggacgtctggggccaagggaccacggtcacc360gtctcctca369<210>59<211>123<212>PRT<213>人工序列<220><223>合成序列<400>59GlnValGlnLeuValGluSerGlyGlyGlyLeuValLysProGlyGly151015SerLeuArgLeuSerCysAlaAlaSerGlyPheThrPheSerSerTyr202530SerMetAsnTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerSerIleSerAlaSerAspGlyAlaThrTyrTyrAlaAspSerVal505560ArgGlyArgPheThrIleSerArgAspAsnSerArgSerThrLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaLysSerLeuAlaSerTyrSerGlyProMetGlyGlyMetAspVal100105110TrpGlyGlnGlyThrThrValThrValSerSer115120<210>60<211>369<212>DNA<213>人工序列<220><223>合成序列<400>60caggtgcagctggtagagtctgggggaggcctgttcaagcctggggggtccctgagactc60tcctgtgcagcctctggattcaccttcagtagctatagcatgaactgggtccgccaggct120ccagggaaggggctggagtgggtctcatccattagtgctagtgatggtgccacatactac180gcagactccgtgaggggccggttcaccatctccagagacaattccaggagcacactgtat240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtgcgaaaactctc300gcgggatatagtggcccaatgggtggcatggacgtctggggccaagggaccacggtcacc360gtctcctca369<210>61<211>123<212>PRT<213>人工序列<220><223>合成序列<400>61GlnValGlnLeuValGluSerGlyGlyGlyLeuSerLysProGlyGly151015SerLeuArgLeuSerCysAlaAlaSerGlyPheThrPheSerSerTyr202530SerMetAsnTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerSerIleSerAlaSerAspGlyAlaThrTyrTyrAlaAspSerVal505560ArgGlyArgPheThrIleSerArgAspAsnSerArgSerThrLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaLysThrLeuAlaGlyTyrSerGlyProMetGlyGlyMetAspVal100105110TrpGlyGlnGlyThrThrValThrValSerSer115120当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。