蛋白酶体19s调节性颗粒亚基psmd11作为靶点用于预防或治疗癌症
技术领域
1.本发明属于分子生物学和生物医药领域,具体地,本发明涉及蛋白酶体19s调节性颗粒亚基psmd11作为靶点用于预防或治疗癌症。
背景技术:
2.恶性肿瘤是一种复杂的、严重威胁人类健康和生命的一类疾病。它是由有分裂潜能的细胞,在遗传和致癌因素的作用下,引起正常细胞遗传物质dna的损伤、突变,使多种癌基因激活和抑癌基因失活,导致癌细胞不受控制得生长和增殖,侵犯临近正常组织,并转移到远端的组织器官。
3.胰腺导管腺癌(pancreatic ductal adenocarcinoma,pdac),简称胰腺癌,是临床常见的高度恶性的消化系统肿瘤。据美国癌症学会(acs)统计,2018年美国新发胰腺癌病例将达55440例,其中44330人将会死于胰腺癌,占癌症死亡原因的第四位。在我国,据2015年估计有90100人会被诊断患有胰腺癌,其中79400人会死于胰腺癌,占癌症死亡原因的第六位。在过去的几十年中,尽管我们对胰腺癌的发病机制有了更深的理解,但是目前胰腺癌仍然缺乏有效的治疗措施。国内外资料显示,胰腺癌患者的中位生存期仅3~6个月,5年生存率小于5%。因此,发现新的更为有效的靶向治疗手段,是防治胰腺癌的重大策略。
4.研究表明,在超过95%的临床胰腺癌病例癌组织中都可检测到kras(kirsten rat sarcoma viral oncogene)基因突变。kras基因是ras基因家族的一员,ras基因家族包括h
‑
ras、k
‑
ras和n
‑
ras,分别定位在11、12和1号染色体上。k
‑
ras基因编码21kd的ras蛋白。kras蛋白是一种gtp酶(gtpase),当与gtp结合时其处于活性状态,其会裂解gtp末端的磷酸基团将gtp转换为gdp,从而使kras蛋白被灭活。通常情况下kras蛋白将gtp转换为gdp的速率是缓慢的,而gtp酶激活性蛋白家族(gtpase
‑
activating protein(gap)class)蛋白,如rasgap可明显加快这个过程。相反,鸟核苷酸交换因子家族蛋白(guanine nucleotide exchange factor(gef)class)如sos1可通过与kras蛋白结合促使其释放gdp,然后与gtp结合,使kras蛋白被重新激活,kras蛋白活性就是通过这种方式得到有效的控制。然而当k
‑
ras基因第12位密码子发生突变时,如g12s或g12d突变,可导致kras蛋白的gtp酶活性减弱,从而使kras蛋白处于持续激活状态。持续激活的kras蛋白可通过激活raf/mek/erk、pi3k/akt/m
‑
tor、ralgef/ral和tiam1/rac等信号通路诱导细胞持续增生,从而诱导肿瘤发生。
5.近年来多项研究证明,在三分之一的人类的癌症中都存在着激活性kras突变(activating ras mutation),突变激活的kras蛋白在癌症的起始和维持中都起着至关重要的作用,并被普遍认为是癌细胞中成瘾的癌基因及理想的治疗靶点。然而近年来所有靶向kras癌基因的努力均以失败告终,现在仍然没有有效的手段靶向抑制突变激活的kras癌基因。因此目前急需发现新的和有效的治疗靶标用于与kras基因突变有关的癌症的预防或靶向治疗。
技术实现要素:
6.本发明的目的在于提供一种针对由突变激活的kras癌基因引起的癌症的靶向治疗方法以及将psmd11作为靶点进行癌症预防或治疗。
7.在本发明的一个方面,提供一种psmd11蛋白或psmd11基因的下调剂的用途,用于制备药物或组合物,所述药物或组合物用于预防或治疗人体内kras突变激活所引起的癌症。
8.在另一优选例中,所述psmd11蛋白表达或活性的下调剂选自下组:
9.(a)、降低psmd11活性的物质;
10.(b)、下调psmd11的蛋白表达水平、稳定性或有效作用时间的物质;
11.在另一优选例中,所述psmd11蛋白或基因来源于哺乳动物(包括人)。
12.在另一优选例中,所述psmd11蛋白的下调剂包括但不限于:psmd11的结合多肽、psmd11的化学下调剂、psmd11修饰多肽修饰酶或其组合。
13.在另一优选例中,所述psmd11基因的下调剂包括但不限于:抑制psmd11基因启动子驱动表达能力的下调剂、psmd11基因特异性的过表达多肽、psmd11基因特异性的基因组编辑或mrna分子下调剂或其组合,如crispr/cas9分子,sirna分子、crispr/casrx分子等。
14.在另一优选例中,所述的肿瘤包括但不限于:乳腺癌、肺癌、结肠癌、胰腺癌、胃癌、肝癌、前列腺癌、淋巴癌、甲状腺癌。
15.在另一优选例中,所述的肿瘤为胰腺癌,所述的肿瘤细胞为胰腺癌细胞。
16.在另一优选例中,所述的psmd11蛋白选自下组:
17.(a)、氨基酸序列如seq id no.2所示的多肽;
18.(b)、氨基酸序列如seq id no.2所示的多肽的截短体;
19.(c)、将(a)或(b)所示的氨基酸序列经过一个或多个(通常为1
‑
60个,较佳地1
‑
30个,更佳地1
‑
20个,更佳地1
‑
10个,更佳地1
‑
5个)氨基酸残基的取代、缺失或添加而形成的具有(a)或(b)多肽功能的psmd11衍生物,或其活性片段。
20.(d)、序列与seq id no.2所示的氨基酸序列相比,同源性≥90%(较佳地≥95%,更佳地≥98%,最佳地≥99%)的psmd11衍生物,或其活性片段。
21.在本发明的第二方面,提供了一种药物组合物,包括药学上可接受的载体和有效量的活性成分,其中所述的活性成分为psmd11蛋白下调剂或psmd11基因的下调剂。
22.在另一优选例中,所述的药物组合用于预防或治疗肿瘤。
23.在另一优选例中,所述psmd11的下调剂包括但不限于:psmd11的结合多肽、psmd11的化学小分子下调剂、psmd11修饰多肽修饰酶或其组合。
24.在另一优选例中,所述psmd11基因的下调剂包括但不限于:下调psmd11基因启动子驱动表达能力的下调剂、psmd11基因特异性的过表达多肽、psmd11基因特异性的基因组编辑或mrna分子下调剂或其组合,如crispr/cas9分子,sirna分子、crispr/casrx分子等。
25.在另一优选例中,所述的psmd11的衍生物包括但不限于:psmd11多肽的活性片段、psmd11多肽的截短形式。
26.在另一优选例中,所述的组合物包括药物组合物。
27.在另一优选例中,所述下调剂包括psmd11的衍生多肽。
28.本发明的第三方面,提供了一种治疗或预防kras突变激活所引起的癌症的方法,
包括步骤:抑制psmd11的活性或表达水平。
29.在另一优选例中,所述方法包括步骤:给需要的对象施用本发明第二方面所述psmd11的下调剂。
30.在另一优选例中,抑制psmd11的的活性或表达水平的步骤。
31.在另一优选例中,所述psmd11的下调剂抑制肿瘤细胞中psmd11活性或psmd11的表达或稳定性。
32.在另一优选例中,所述的抑制肿瘤细胞为通过诱导肿瘤细胞凋亡抑制肿瘤细胞存活。
33.在另一优选例中,与对照肿瘤细胞相比,所述肿瘤细胞中psmd11的活性降低20%以上,较佳地降低50%以上,更佳地降低80%以上。
34.在另一优选例中,与对照肿瘤细胞相比,所述肿瘤细胞中psmd11的基因表达水平降低20%以上,较佳地降低50%以上,更佳地降低80%以上。
35.psmd11多肽或其编码基因的用途,用于制备对肿瘤进行预防或治疗的药物;较佳地,所述的肿瘤包括但不限于:乳腺癌、肺癌、结肠癌、胰腺癌、胃癌、肝癌、前列腺癌、淋巴癌;更佳地,所述的肿瘤为胰腺癌。
36.本发明的第四方面,提供特异性识别psmd11多肽或其编码基因的试剂的用途,用于制备诊断或预后肿瘤的试剂或试剂盒;较佳地,所述的肿瘤包括但不限于:乳腺癌、肺癌、结肠癌、胰腺癌、胃癌、肝癌、前列腺癌、淋巴癌、甲状腺癌;更佳地,所述的肿瘤为胰腺癌。
37.在另一优选例中,所述的特异性识别psmd11多肽或其编码基因的试剂包括但不限于:特异性扩增psmd11基因的引物;特异性识别psmd11基因的探针;或特异性结合psmd11多肽的抗体或配体。
38.应理解,在本发明范围内中本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
39.有益效果:
40.1、本发明首次证明psmd11对于kras癌基因诱导的胰腺癌细胞是一个重要的存活因子。在胰腺癌小鼠模型中psmd11单等位基因或双等位基因条件性敲除可完全阻断胰腺癌的发生和进展,并显著延长胰腺癌小鼠的生存期。急性敲除psmd11可在体内外诱导大量胰腺癌细胞凋亡和肿瘤消退。并且psmd11单等位基因敲除后未发现对小鼠有明显的毒副作用,证实psmd11是胰腺癌或其他癌症治疗和预防的有效靶点。
41.2、本发明首次揭示了psmd11在胰腺癌发生发展中的重要作用,首次揭示了靶向psmd11潜在的毒副作用,首次揭示了靶向psmd11诱导癌细胞凋亡的分子机制,首次揭示了抑制psmd11表达可完全阻断胰腺癌的发生发展。
附图说明
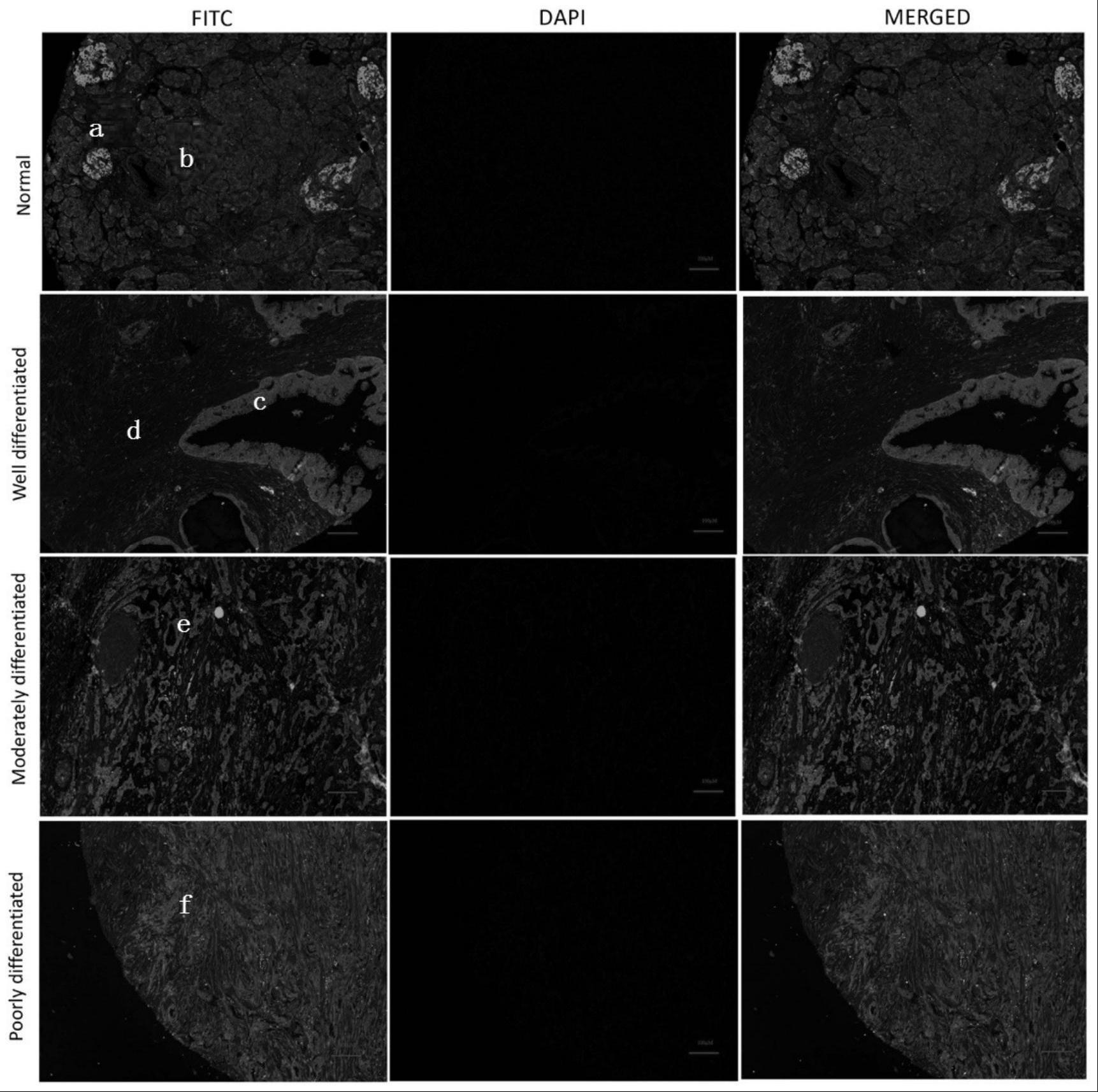
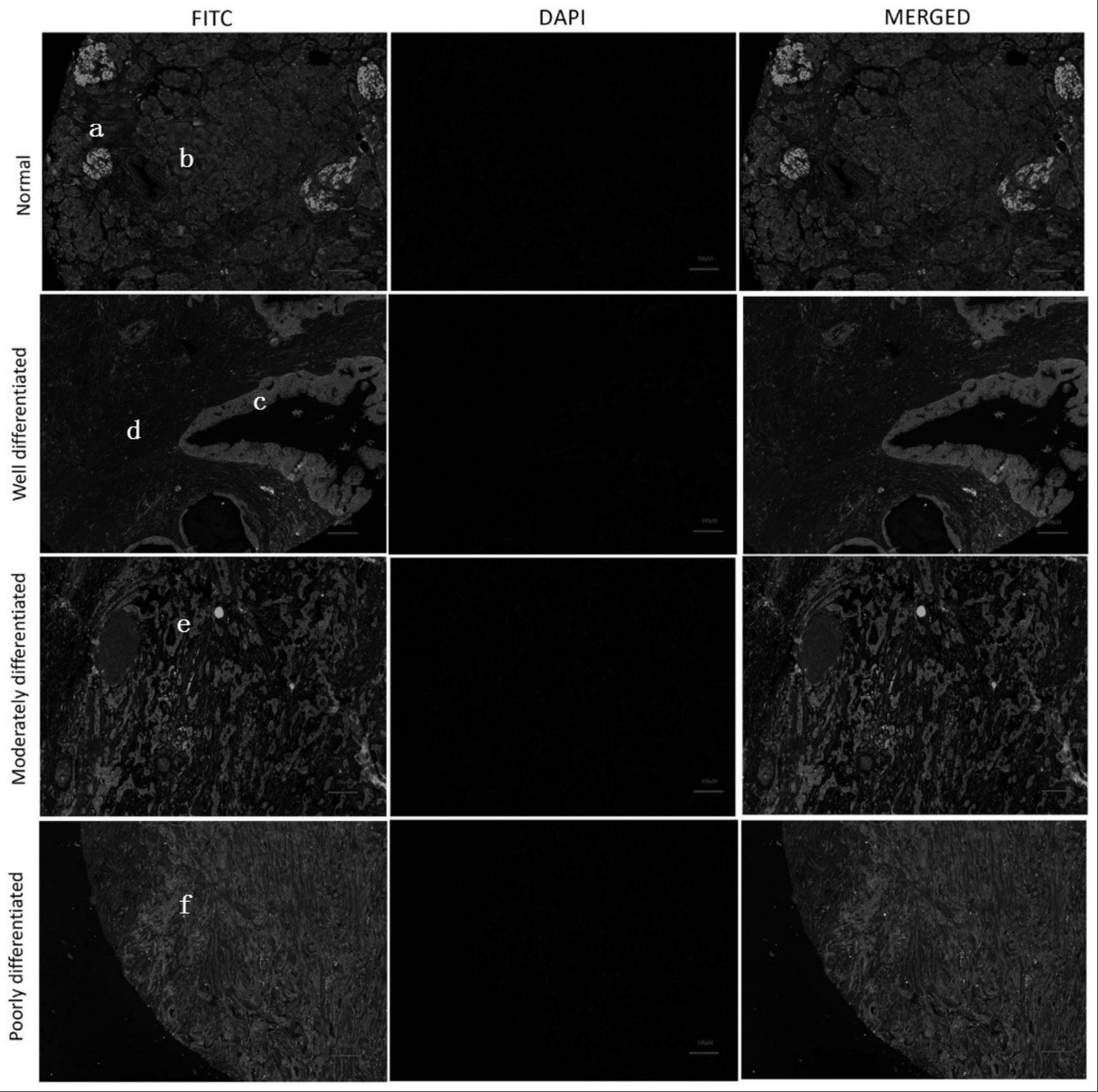
42.图1为胰腺导管腺癌组织和正常胰腺组织中psmd11表达的免疫荧光分析图。
43.图中:a为psmd11、b为星状细胞、c为高分化胰腺导管腺癌组织、d为小导管细胞、e为中分化胰腺导管腺癌组织、f为低分化胰腺导管腺癌组织。
44.图2为敲除psmd11能够完全阻断肿瘤起始和进展并且能够明显延长胰腺癌小鼠寿
命分析图。
45.图中:a为在已经生成的胰腺上皮内瘤变组织中通过时间特异性他莫昔芬介导的creert2激活诱导psmd11基因敲除的遗传学策略。b(上)为他莫昔芬处理路线图。b(下)为代表性的来自他莫昔芬处理的psmd11条件性敲除小鼠pkcp
flx/flx
和pkcp
flx/
和年龄和性别匹配的pk和野生型对照小鼠的肉眼胰腺图片(左)和重量(右)比较。c为具有代表性的他莫昔芬处理的psmd11条件性敲除小鼠pkcpflx/flx and pkcpflx/ 和年龄和性别匹配的pk对照小鼠的h&e和alcian blue(ab)染色的胰腺切片。d为9月龄他莫昔芬处理的psmd11条件性敲除小鼠pkcp
flx/flx
和pkcp
flx/
和年龄和性别匹配的pk对照小鼠胰腺中不同等级的胰腺上皮内瘤变组织的绝对定量分析。(mean and s.e.m.;n=5雌性小鼠/组;3切片/小鼠;
***
p<0.001,
**
p<0.01,
*
p<0.05,student
′
s t test)。e为具有代表性的他莫昔芬处理的psmd11条件性敲除小鼠pkcp
flx/flx
和pkcp
flx/
和年龄和性别匹配的pk对照小鼠胰腺上皮内瘤变组织中psmd11(绿色)免疫荧光染色,细胞核应用dapi(blue)复染;f(上)为检测psmd11等位基因的基因型鉴定策略。f(下)为pcr分析来自非重组的纯合子psmd11
flx/flx
小鼠鼠尾组织dna,单等位基因组成性重组的psmd11
δ/
小鼠鼠尾组织dna,以及来自他莫昔芬处理的pkcp
flx/flx and pkcp
flx/
小鼠微切割的胰腺上皮内瘤变组织dna。g为所示3月龄pk、pkcp
flx/
和pkcp
flx/flx
基因型小鼠经他莫昔芬诱导psmd11敲除后kaplan
‑
meier生存分析。
46.图3为体内急性敲除psmd11能够诱导胰腺癌细胞恶性表型回归和凋亡分析图。
47.图中:a为代表性的h&e染色的他莫昔芬处理的pkcp
flx/flx
小鼠( tam)和arcturus histogene
tm
染色和激光纤维切割的pkcp
flx/flx
小鼠pdac组织胰腺组织切片。b为pcr在他莫昔芬处理5天后微切割的胰腺上皮内瘤变组织dna中检测psmd11重组的等位基因(psmd11
δ
643bp)。psmd11
δ/
表示dna来自单等位基因组成性重组的小鼠。c为免疫荧光染色检测psmd11
δ
阳性的胰腺上皮内瘤变组织中psmd11表达缺失。细胞核应用dapi(blue)复染。d为代表性的他莫昔芬处理5
‑
28天后的psmd11条件性敲除小鼠pkcp
flx/flx
和pkcp
flx/
和pk小鼠的胰腺组织切片h&e染色。e为代表性的他莫昔芬处理5
‑
28天后的psmd11条件性敲除小鼠pkcp
flx/flx
和pkcp
flx/
和pk小鼠的胰腺组织切片tunel染色。箭头所示为凋亡细胞。
48.图4为全身性双等位基因敲除psmd11可导致成年小鼠死亡分析图。
49.图中:a为电影显示fcp
flx/flx
小鼠喂食他莫昔芬3天后小鼠死亡之前的行为异常。b为fcp
flx/flx
小鼠喂食他莫昔芬前及3天后死亡前外周血生化分析(n=3,
*
p<0.05,student
′
s t test)。c为比较年龄相匹配的野生型和喂食他莫昔芬导致fcp
flx/flx
小鼠死亡后的脾脏。d为fcp
flx/flx
小鼠喂食他莫昔芬30后,收集小鼠胰腺、肝脏和肾脏,然后应用western blotting检测psmd11和p53表达,β
‑
actin为内参。
50.图5条件性敲除psmd11可诱导原代小鼠胰腺癌细胞大量凋亡分析图。
51.图中:a为pkcp
flx/flx
小鼠原代胰腺癌细胞经0.5μm 4
‑
hydroxytamoxifen处理后的凋亡过程。b为pcr检测pkcp
flx/flx
小鼠原代胰腺癌细胞经0.5μm 4
‑
hydroxytamoxifen处理后重组的psmd11等位基因(psmd11
δ
643bp)。c为pkcp
flx/flx
小鼠原代胰腺癌细胞经0.5μm4
‑
hydroxytamoxifen处理4天后qrt
‑
pcr检测psmd11 mrna的表达变化。d为pkcp
flx/flx
小鼠原代胰腺癌细胞经0.5μm 4
‑
hydroxytamoxifen处理8天后应用western blot检测psmd11和cleaved
‑
caspase 3蛋白表达变化,内参为panceau s染色的蛋白条带。e为pkcp
flx/flx
小鼠原代胰腺癌细胞经0.5μm 4
‑
hydroxytamoxifen处理5天后,应用1μg/ml hoechst 33342染
色20min后,医院激光共聚焦显微镜观察细胞凋亡的发生。箭头所示为凋亡细胞。
52.图6为应用定量蛋白质组学技术分析psmd11基因敲除诱导kcpflx/flx小鼠原代胰腺癌细胞急性凋亡的分子机制分析图。
53.图中:a为聚类分析热图、b为火山图,显示pkcp
flx/flx
小鼠原代胰腺癌细胞经0.5μm4
‑
hydroxytamoxifen或乙醇处理4天后差异表达蛋白。c为选择psmd11,morf4l1,fosl1,ddx49,gap43,wdr19和rpp38蛋白应用western blot进一步验证,β
‑
actin为内参。d
‑
g为pkcp
flx/flx
小鼠原代胰腺癌细胞经0.5μm 4
‑
hydroxytamoxifen或乙醇处理4天后差异表达蛋白的gene ontology(go)分析和功能富集分析。h和i为pkcp
flx/flx
小鼠原代胰腺癌细胞经0.5μm4
‑
hydroxytamoxifen或乙醇处理4天后差异表达蛋白的kegg(kyoto encyclopedia of genes and genomes)通路分析和富集分析。
具体实施方式
54.本发明人首次应用psmd11条件性敲除小鼠及胰腺癌小鼠模型发现单等位基因或双等位基因敲除psmd11基因可完全阻断kras癌基因诱导的胰腺癌发生与发展,并且可明显延长psmd11双等位基因敲除胰腺癌小鼠pkcp
flx/flx
的生存期,急性敲除psmd11可在胰腺癌小鼠体内及体外胰腺癌细胞中诱导大量胰腺癌细胞发生凋亡及肿瘤回归。在正常成年小鼠体内,psmd11单等位基因全身性敲除未发现对小鼠有明显的毒副作用,但是psmd11双等位基因全身性敲除可通过引起肝、心脏及脾脏等功能损伤而导致小鼠在3~5天内死亡。定量蛋白质组学分析发现在psmd11敲除诱导胰腺癌细胞凋亡前有134个蛋白包括p53蛋白明显上调,28个蛋白包括psmd11蛋白明显下调,提示一些关键的细胞存活因子上调或丢失可能是psmd11基因敲除诱导kras癌基因诱导的胰腺癌细胞凋亡的直接原因。这些研究提示psmd11对于kras癌基因诱导的胰腺癌细胞来说是一个非常关键的存活因子,是一个癌症治疗靶点。
55.近年来,多个研究小组证明kras基因突变的癌症常常对蛋白酶体活性显示选择性成瘾,该现象被称为“非癌基因成瘾”的现象(luo et al.,2009;steckel et al.,2012)。然而临床上蛋白酶体抑制剂对于实体肿瘤包括胰腺癌却没有明显的效果(alberts et al.,2005;ryan et al.,2006),胰腺癌小鼠模型研究也证明蛋白酶体抑制剂对于已经形成的胰腺癌早期病变胰腺上皮内瘤变没有明显的作用,原因不明。由于目前临床常用的蛋白酶体抑制剂的作用位点为蛋白酶体20s催化核心的β5亚单位糜蛋白酶样位点,我们推测该作用靶点对于实体肿瘤可能并不是一个适宜的作用靶点,因此蛋白酶体中其他组份是否能作为治疗靶点用于癌症靶向治疗需要进一步深入研究。
56.26s蛋白酶体是一个多蛋白复合体,它可通过降解错误折叠或受损的蛋白,或者功能不再需要的蛋白在维持蛋白稳态中发挥重要的作用。同时由于所调节的蛋白众多,从而在多个生物学过程如细胞周期调节、凋亡、dna损伤修复和抗原提呈中发挥重要的作用(bochtler et al.,1999;hershko and ciechanover,1998)。26s蛋白酶体由20s蛋白裂解核心颗粒和19s调节性颗粒组成。19s调节性颗粒由一个由9个亚单位包括psmd11(proteasome 26s subunit,non
‑
atpase,11)构成的盖子和由6个atp酶(atpases)和几个其他组份构成的底座组成(hoffman and rechsteiner,1997;saito et al.,1997)。19s调节性颗粒负责识别和结合泛素
‑
蛋白结合物,并将其运送到20s蛋白裂解核心颗粒进行降解
(kohler et al.,2001;thrower et al.,2000)。psmd11(proteasome 26s subunit,non
‑
atpase,11)蛋白是19s调节性颗粒中盖子的组份之一,其过表达(vilchez et al.,2012)或磷酸化(lokireddy et al.,2015)可促进26s蛋白酶体组装和活性。
57.本发明涉及psmd11蛋白作为靶点用于预防或治疗癌症。具体地,本发明公开了psmd11在胰腺癌发生发展中的重要作用,发现抑制psmd11表达可完全阻断胰腺癌的发生发展。虽然psmd11双等位基因全身性敲除可通过引起肝、心脏及脾脏等功能损伤而导致小鼠在3
‑
5天内死亡,但是单等位基因全身性敲除未发现对小鼠有明显的毒副作用。因此psmd11可以作为癌症的治疗的靶点。
58.如本文所用,术语“psmd11基因”、“psmd11编码基因”、“psmd11的编码序列”可以互换使用,都是指编码psmd11蛋白的多核苷酸序列。本领域的普通技术人员可以使用常规方法获得psmd11基因的序列,如从ncbi获取。
59.在本发明优选例中,编码psmd11的dna序列如seq id no.1所示。
60.在本发明的一个优选的实施方式中,所述psmd11的氨基酸序列如seq id no.2所示,共422个氨基酸残基。
61.本发明的可以是重组多肽、天然多肽或合成多肽。本发明的psmd11可以是天然纯化的产物或是化学合成的产物,或使用重组技术从原核或真核宿主中产生。根据重组生产方案所用的宿主,本发明的psmd11可以是糖基化的或非糖基化的。本发明的psmd11还可包括或不包括起始的甲硫氨酸残基。本发明还包括具有psmd11或psmd11活性的psmd11多肽片段和类似物。
62.此外,所述术语“psmd11的衍生蛋白”还包括具有psmd11功能的seq id:1序列的变异形式。这些变异形式包括(但并不限于):1
‑
3个(通常为1
‑
2个,更佳地1个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加或缺失一个或数个(通常为3个以内,较佳地为2个以内,更佳地为1个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加或缺失一个或数个氨基酸通常不会改变蛋白质的结构和功能。此外,所述术语还包括单体和多聚体形式的本发明多肽。该术语还包括线性以及非线性的多肽(如环肽)。
63.本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的;或(ii)在一个或多个氨基酸残基中具有取代基团的多肽;或(iii)成熟多肽与另一化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽;或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或融合蛋白)。根据本文的定义这些片段、衍生物和类似物术语本领域熟练技术人员公知的范围。
64.本发明还包括与本发明的psmd11具有50%或以上(优选60%以上,70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如99%)同源性的具有相同或相似功能的多肽或蛋白。在蛋白质变体可以经过若干个(通常为1
‑
60个,较佳地1
‑
30个,更佳地1
‑
20个,最佳地1
‑
10个)取代、缺失或添加至少一个氨基酸所得的衍生序列,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在所述蛋白中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的
功能,在c末端和/或n末端添加一个或数个氨基酸通常不会改变蛋白质的功能。本发明包括psmd11类似物与天然psmd11的差别可以是氨基酸序列上的差别,也可以是不影响序列的修饰形式上的差别,或者兼而有之。这些蛋白的类似物包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可以通过定点诱变法或其他已知分子生物学技术。类似物还包括具有不同于天然l
‑
氨基酸的残基(如d
‑
氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ
‑
氨基酸)的类似物。应理解,本发明的蛋白并不限于上述列举的代表性蛋白。
65.修饰(通常不改变一级结构)形式包括:体内或体外蛋白的化学衍生形式如乙酸化或羧基化。修饰还包括糖基化,如那些在蛋白合成和加工中进行糖基化修饰而产生的多肽。这种修饰可以通过将多肽暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高其抗蛋白水解性能或优化了溶解性能的多肽。
66.本发明还提供了编码psmd11的多核苷酸序列。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括:dna、基因组dna或人工合成的dna,dna可以是单链的或是双链的。编码成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。
67.根据本文所述的核苷酸序列,本技术领域人员可方便地用各种已知方法制得本发明的编码核苷酸。这些方法例如但不限于:pcr、dna人工合成等。具体的方法可参见j.萨姆布鲁克,《分子克隆实验指南》。作为本发明的一种实施方式,可通过分段合成核苷酸序列再进行重叠延伸pcr的方法来构建本发明的编码核苷酸序列。
68.psmd11的下调剂
69.如本文所用,术语“psmd11蛋白的下调剂”包括了抑制剂和灭活剂。所述的“抑制”、“灭活”包括了蛋白活性的“抑制”、“灭活”或蛋白表达的“抑制”、“灭活”。任何可降低psmd11的活性、降低psmd11的稳定性、下调psmd11的表达、减少psmd11有效作用时间的物质,这些物质均可用于本发明,作为对于下调psmd11有用的物质,从而可用于发挥调控作用或治疗疾病。它们可以是化合物、化学小分子、生物分子。所述的生物分子可以是核酸水平(包括dna、rna)的,也可以是蛋白水平的。
70.psmd11多肽的下调剂选自:psmd11的结合蛋白、psmd11的化学下调剂、psmd11修饰蛋白修饰酶、衍生蛋白、化合物或其组合。
71.如本文所用,术语“psmd11基因的下调剂”是指抑制psmd11基因复制或转录的物质,或减少psmd11基因表达(表达产物如mrna)的物质,psmd11基因的下调剂包括(但不限于):抑制psmd11基因启动子驱动表达能力的下调剂、psmd11基因特异性的过表达多肽、psmd11基因特异性的基因组编辑或mrna分子下调剂或其组合,如crispr/cas9分子,sirna
分子、crispr/casrx分子等。
72.药物组合物
73.本发明的药物组合物包含安全、有效量范围内的本发明psmd11或衍生物、下调剂及药理上可以接受的赋形剂或载体。
74.如本文所用,术语“安全、有效量”是指可对人和/或动物产生功能或活性的且被人和/或动物所接受的量。
75.如本文所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
76.本发明的药物组合物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂与给药方式匹配,本发明的药物组合物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。
77.本发明所述的活性成分可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各因素来确定(例如通过临床试验)。所述的因素包括(但不限于):所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病严重程度、患者体重、患者的免疫状况、给药的途径等。通常,当本发明的活性成分每天以0.00001mg
‑
50mg/kg动物体重(较佳的0.0001mg
‑
10mg/kg动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
78.本发明组合物可以单独用药,或者与其他药学上可接受的化合物联合用药。
79.本发明所述的药学上可接受的载体包括(但不限于):脂质体、纤维素、纳米凝胶、水、盐水、蛋白、肽类物质、蛋白
‑
抗体缀合物、或其组合。载体的选择应与给药方式相匹配,这些都是本领域普通技术人员所熟知的。
80.应用
81.本发明提供了一种抑制肿瘤细胞的方法。包括步骤:在psmd11蛋白下调剂或psmd11基因下调剂存在的条件下,处理肿瘤细胞,从而抑制肿瘤细胞。所述的肿瘤包括但不限于:乳腺癌、肺癌、结肠癌、胰腺癌、胃癌、肝癌、前列腺癌、淋巴癌;更佳地,所述的肿瘤为胰腺癌。
82.在本发明的优选实施方式中,所述的抑制肿瘤细胞为诱导肿瘤细胞凋亡。
83.在本发明的优选实施方式中,与对照肿瘤细胞相比,所述肿瘤细胞中psmd11的活性降低20%以上,较佳地降低50%以上,更佳地降低80%以上。
84.在本发明的优选实施方式中,与对照肿瘤细胞相比,所述肿瘤细胞中psmd11的基因表达降低20%以上,较佳地降低50%以上,更佳地降低80%以上。
85.可采用各种本领域已知的技术来检测psmd11基因的存在与否以及表达情况。这些技术均包含在本发明中。例如可用已有的技术如southern印迹法、western印迹法、dna序列分析、pcr等,这些方法可结合使用。
86.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明
而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
87.实施例中所使用的材料与方法如下:
88.1、试剂
89.所有的细胞培养试剂均购自invitrogen(groningen,the netherlands)公司。pcr引物由生工生物工程(上海)股份有限公司合成,限制性内切酶购自new england biolabs公司(mannheim,germany),他莫昔芬和4
‑
羟基
‑
他莫昔芬购自selleck chemicals公司(上海,中国)。胰腺导管腺癌组织芯片pa483购自西安艾丽娜生物科技有限公司,放大倍数为100倍。
90.2、鼠系
91.psmd11
flx/flx
小鼠由本实验室自行构建,pdx1
‑
flp、fsf
‑
kras
g12d/
、fsf
‑
r26
cag
‑
creert2
小鼠由德国慕尼黑大学dieter saur教授赠送,human beta
‑
actin flpe deleter strain of mice(b6;sjl
‑
tg(actflpe)9205dym/j,the jackson laboratory,stock number:003800)购自美国jackson实验室。所有小鼠的遗传背景均为混合c57bl/6;129s6/svev。所有小鼠均饲养在spf环境中。所有实验操作均由山东大学伦理委员会批准。
92.3、dna抽提和基因型鉴定
93.小鼠尾或细胞dna用一管式通用样品dna提取试剂盒(上海生工)根据试剂说明书提取,基因型鉴定pcr所用引物由已知序列合成,pcr片段用1%琼脂糖凝胶电泳分离。
94.4、蛋白抽提和免疫印迹(western blot)
95.收集组织或细胞,应用含有1%蛋白酶抑制剂混合物(sigma
‑
aldrich,上海,中国)和1%pmsf的ripa细胞裂解液提取蛋白,超声并13,000g离心15min后,应用bca测定试剂盒测定蛋白浓度,取30
‑
50μg蛋白用10%sds
‑
page胶分离后,将蛋白转到硝酸纤维素膜(millipore)上,应用含有5%奶粉和0.1%tween 20的tbs缓冲液封闭,然后分别应用兔抗psmd11抗体(14786
‑1‑
ap),兔抗morf4l1抗体(55257
‑1‑
ap),兔抗ddx49抗体(20523
‑1‑
ap),兔抗rpp38抗体(12874
‑1‑
ap),兔抗gap43抗体(16971
‑1‑
ap),兔抗wdr19抗体(13647
‑1‑
ap)(proteintech group),兔抗parp抗体,兔抗cleaved
‑
caspase 3(#9664s)(cell signaling technology),鼠抗p53抗体(sc
‑
55476)(santa cruz biotechnology),兔抗fosl1抗体(a5372)(ab clonal),鼠抗β
‑
actin和辣根酶标记羊抗小鼠和抗兔igg(中杉金桥)检测相应蛋白表达。蛋白条带采用immobilon western chemiluminescent hrp substrate试剂盒显色。图像用fluorchem q(proteinsimple,santa clara,ca,usa)采集,分辨率为300dpi。
96.5、实时rt
‑
pcr检测psmd11 mrna的表达
97.实时rt
‑
pcr根据试剂盒说明书所述进行。简而言之,总rna用trizol试剂盒(invitrogen)制备,在100个单位的m
‑
mlv逆转录酶和40个单位的rnase抑制剂(invitrogen)和oligo(dt)15引物存在下,使用等量(5μg)的rna合成cdna(invitrogen)。使用quantstudio 3(thermo fisher scientifics,中国上海),用sybr green master mix(applied biosystems)一式三份进行定量rt
‑
pcr。psmd11的相对表达使用2
‑
δδct
方法计算,gapdh rna作为内部对照。
98.psmd11和gapdh的引物序列为:
99.psmd11
‑
f:5
′‑
tatgtctgtgagggtgttggatac
‑3′
;
100.psmd11
‑
r:5
′‑
cagggatccaacatttctga
‑3′
;
101.gapdh
‑
f:5
′‑
tagatagtgcttccagttatgggag
‑3′
;
102.gapdh
‑
r:5
′‑
gactgttacctacaccatactgctg
‑3′
。
103.6、激光捕获显微切割和dna提取
104.将8μm厚福尔马林固定、石蜡包埋的小鼠胰腺组织切片脱蜡,用histogenetm染色溶液(applied biosystems by thermo fisher scientific,lithuania)染色,用arcturus xt激光捕获显微切割系统进行显微切割(applied biosystems by thermo fisher scientific,lithuania)。微切割的组织dna用一管式通用样品dna提取试剂盒(上海生工)根据试剂说明书提取。
105.7、通过激光共聚焦扫描显微镜用hoechst 33342染色检测细胞凋亡
106.将由pkcp
flx/flx
小鼠建立的原代pdac细胞系用0.5μm 4
‑
hydroxytamoxifen或乙醇处理5天,然后用1μg/ml hoechst 33342染细胞20分钟,应用激光共聚焦扫描显微镜zeiss lsm 800 with airyscan technology(carl zeiss,jena,germany)采集图像,并应用zen 2009软件进行合并和转换。
107.8、原代小鼠pdac细胞系的建立和培养
108.原代小鼠胰腺癌细胞由常规方法建立和培养,小鼠pdac细胞培养在补充有10%fcs的dmem中。为了诱导敲除psmd11,小鼠pdac细胞用0.5μm 4
‑
hydroxytamoxifen或乙醇处理5天,以在体外删除两侧带有loxp序列的dna片段。细胞系通过基因分型进行鉴定并测试支原体污染。
109.9、他莫昔芬处理小鼠
110.用含他莫昔芬的食物(每公斤食物含有400毫克他莫昔芬)喂养小鼠2或4周以激活creert2。
111.10、组织化学和免疫荧光染色
112.为了进行组织病理学诊断,将小鼠组织标本固定在4%缓冲福尔马林中过夜,包埋在石蜡中并切片(4μm)。根据小鼠胰腺腺管内上皮瘤(pancreatic intraepithelial neoplasia,panin)病变分级的既定命名法,对每只小鼠的三张切片和每个时间点5只小鼠进行小鼠adm和panin病变的定量和分级,检查员对动物的基因型不知情。阿利新蓝染色使用阿利新蓝水溶液(ph 2.5)对石蜡包埋的组织切片进行染色。切片用核固红进行复染。对于免疫荧光染色,将福尔马林固定、石蜡包埋的组织切片脱蜡、再水化并置于微波炉中(10分钟,600w)以修复抗原。用pbs洗涤三次后用含有3%(w/v)牛血清白蛋白(bsa)、1%(w/v)saponin和1%(v/v)triton x
‑
100的pbs中孵育1小时,应用兔抗psmd11抗体(14786
‑1‑
ap,proteintech group)在4℃孵育过夜。二抗采用fitc标记的山羊抗兔igg(h l)(1:100;#zf
‑
0311,中杉金桥)在黑暗中孵育1小时,细胞核在室温下用dapi(1:1,000,beyotime)复染5分钟。pbs冲洗3次后,加入抗荧光淬灭封片液封片(beyotime,上海,中国)。使用mantra perkinelmer cls140089/b荧光显微镜观察所有切片,并使用inform 2.2软件合并和转换图像。
113.11、tdt
‑
utp缺口末端标记(tunel)
114.小鼠组织切片用二甲苯脱蜡,乙醇再水化,然后加入20μg/ml蛋白酶k处理组织30
分钟,用pbs彻底清洗后,应用一步法tunel细胞凋亡检测试剂盒(beyotime)中含有末端脱氧核苷酸转移酶(tdt)和fitc标记的dutp的tunel检测溶液在37℃下标记凋亡细胞1小时,fitc标记的tunel阳性细胞使用荧光显微镜采集图像,激发波长为488nm,发射波长为530nm。具有绿色荧光的细胞为凋亡细胞。
115.12、血液学分析
116.通过切尾从小鼠身上采集血液,按照制造商的说明,使用sd1自动干化学分析仪和综合i生化测定试剂板(szh
‑
14a)和心肌酶谱测定板(aw00722)进行血清分析。
117.13、用于蛋白质组学分析的蛋白质提取和tmt标记
118.用乙醇(control)和tam处理pkcp
flx/flx
小鼠原代pdac细胞4天后(每组n=3,分别命名为control
‑
1、control
‑
2、control
‑
3、tam
‑
1、tam
‑
2和tam
‑
3)用sdt(4%sds,100mm tris
‑
hcl,1mm dtt,ph7.6)缓冲液裂解样品提取蛋白质,用bca蛋白测定试剂盒(bio
‑
rad,美国)测定蛋白浓度。根据matthias mann报道的过滤辅助样品制备(fasp)程序,用胰蛋白酶进行蛋白质消化。简而言之,将每个样品的200μg蛋白质掺入30μl sdt缓冲液(4%sds、100mm dtt、150mm tris
‑
hcl ph 8.0)中。使用ua缓冲液(8m尿素,150mm tris
‑
hcl ph 8.0)通过重复超滤(microcon units,10kd)去除去垢剂、dtt和其他低分子量组分。然后加入100μl碘乙酰胺(ua缓冲液含100mm iaa)以阻断还原的半胱氨酸残基,样品在黑暗中孵育30分钟。过滤器用100μl ua缓冲液洗涤3次,然后用100μl 25mm nh4hco3缓冲液洗涤两次。最后,在37℃下用4μg胰蛋白酶(promega)在40μl 25mm nh4hco3缓冲液中过夜消化蛋白质悬浮液,并收集所得肽。每个样品的肽在c18 cartridges(empore
tm spe cartridges c18,standard density,bed i.d.7mm,volume 3ml,sigma)上脱盐,通过真空离心浓缩并用40μl 0.1%(v/v)甲酸中重新溶解。肽含量通过280nm处的紫外光光谱密度使用消光系数为1.1的0.1%(g/l)溶液进行估计,该系数是根据脊椎动物蛋白质中色氨酸和酪氨酸的频率计算的。对于每个样品,根据制造商的说明(thermo scientific),用tmt试剂标记100μg肽混合物。
119.14、强阳离子交换(scx)分级。
120.使用akta purifier系统通过scx色谱分离标记的肽。干燥的肽混合物用缓冲液a(10mm kh2po4溶于25%乙腈,ph3.0)重新溶解并酸化,并加载到polysulfoethyl 4.6x100mm柱(5μm,polylc inc,maryland,u.s.a.)上。肽以1ml/min的流速用0%缓冲液b(500mm kcl、10mm kh2po4溶于25%乙腈,ph 3.0)的梯度洗脱25分钟,0
‑
10%缓冲液b 25
‑
32分钟,10%
‑
20%缓冲液b 32
‑
42分钟,20
‑
45%缓冲液b 42
‑
47分钟,45%
–
100%缓冲液b 47
‑
52分钟,100%缓冲液b 52
‑
60分钟,缓冲液b在60分钟后重置为0%。通过214nm处的吸光度监测洗脱,每1分钟收集一次。收集的组份用c18 cartridges上脱盐,通过真空离心浓缩。
121.15、lc
‑
ms/ms分析
122.lc
‑
ms/ms分析在与easy nlc(proxeon biosystems,现为thermo fisher scientific)耦合的q exactive质谱仪(thermo scientific)上进行60/90分钟。在缓冲液a(0.1%formic acid)中将肽加载到与c18反相分析柱(thermo scientific easy column,10cm长,75μm内径,3μm树脂)相连接的反相捕获柱(thermo scientific acclaim pepmap100,100μm*2cm,nanoviper c18)上,用线性梯度的缓冲液b(84%乙腈和0.1%甲酸)分离,流速为300nl/min,由intelliflow技术控制。质谱仪在正离子模式下操作。ms数据用
数据依赖的top10方法从hcd碎裂测绘扫描(survey scan,300
–
1800m/z)动态选择最丰富的母离子进行获取。自动获取增益控制(agc)目标设置为3e6,最大进样时间设置为10毫秒。动态排除持续时间为40.0秒。测绘扫描在m/z 200时以70,000的分辨率采集,hcd谱的分辨率在m/z 200时设置为17,500,隔离宽度为2m/z。归一化碰撞能量为30ev,未满率(指在最大填充时间可能达到的目标值的最小百分比)定义为0.1%。仪器在启用肽识别模式的情况下运行。
123.16、蛋白质的鉴定和定量
124.使用嵌入proteome discoverer 1.4软件的mascot引擎(matrix science,london,uk;2.2版)搜索每个样品的ms原始数据,以进行识别和定量分析。相关参数和说明如下:enzyme设置为trypsin,max missed cleavages设置为2,fixed modifications to carbamidomethyl(c),plex(n
‑
term)and plex(k),variable modifications to oxidation(m)and plex(y),肽质量耐受为
±
20ppm,片段质量耐受为0.1da,数据库模式为诱饵(decoy),肽fdr≤0.01,蛋白质比率计算为仅蛋白独特肽的中间值,所有肽比率通过蛋白质比率中间值进行标准化。标准化后的蛋白比率中间值应为1。
125.17、生物信息学分析
126.使用cluster 3.0和java treeview软件进行层次聚类分析。对于go注释,使用ncbi blast client software(ncbi
‑
blast
‑
2.2.28
‑
win32.exe)和interproscan在本地搜索所选差异表达蛋白的蛋白质序列以找到同源序列,然后基因本体(gene ontology,go)术语用软件blast2go进行绘图和序列注释。go注释结果由r脚本绘制。对于kegg注释,将研究的蛋白与在线kyoto encyclopedia of genes and genomes(kegg)database(http://geneontology.org/)数据库进行对比,以检索其kegg直系同源学鉴定,并随后绘制到kegg通路中。基于fisher精确检验应用富集分析,将整个定量的蛋白质作为背景数据集。进一步应用针对多重检验的benjamini
‑
hochberg校正来调整派生的p值。并且只有p值低于0.05阈值的功能类别和途径才被认为是显著的。
127.18、统计分析
128.所有数据均来自至少三个独立的测定,并表示为平均值
±
sem。prism5.0(graphpad)用于创建图形和进行统计。student
′
s t
‑
test t检验或方差分析(anova)以检测差异的显著性,p<0.05被认为具有统计学意义。仅显示具有代表性的结果。
129.实施例1、psmd11在胰腺癌组织中适度表达
130.为了研究psmd11在pdac癌变中的作用,本发明人首先在包含61个pdac标本和8个正常胰腺组织的组织微阵列中应用免疫荧光技术检测了其表达情况,结果如图1所示。
131.由图1可知,在正常胰腺组织中,可见psmd11在胰岛细胞中呈高表达,但是星状细胞和小导管细胞中(结果未显示)仅可见有中等程度的表达。在胰腺导管腺癌组织中,在高分化胰腺导管腺癌组织、中分化胰腺导管腺癌组织及低分化胰腺导管腺癌组织都呈中等强度表达。在非肿瘤基质组织中表达呈阴性。提示psmd11或蛋白酶体的功能在胰岛细胞中高度活跃以支持其生理功能。星状细胞和小导管仅在细胞质中显示psmd11呈中度表达,表明它可能在外分泌胰腺中也有重要作用。在所有高、中、低分化pdac组织中的癌细胞胞浆中,psmd11仅可见中度表达,psmd11表达与部分临床病理特征无明显相关性。
132.实施例2、删除psmd11可以完全阻止肿瘤的发生和进展并提高小鼠的存活率
133.为了测试体内pdac的启动和进展是否需要psmd11,本发明人将具有psmd11基因条件性敲除等位基因(psmd11
flx/flx
)的小鼠与具有双重组酶系统(drs)的胰腺癌小鼠模型杂交以产生基因型为pdx1
‑
flp;fsf
‑
kras
g12d/
;fsf
‑
r26
cag
‑
creert2
;psmd11
flx/flx
(pkcp
flx/flx
)和pdx1
‑
flp;fsf
‑
kras
g12d/
;fsf
‑
r26
cag
‑
creert2
;psmd11
flx/
(pkcp
flx/
),其中他莫昔芬可在krasg12d诱导的胰腺癌组织中条件性地诱导psmd11敲除(图2a)。给已经形成胰腺上皮内瘤变组织(panin)的3月龄pkcp
flx/flx
和pkcp
flx/
小鼠喂食他莫昔芬激活creert2 9个月后,分析胰腺组织,结果如图2所示。
134.由图2可以发现,psmd11单等位基因或双等位基因敲除小鼠胰腺大小和重量与正常野生型小鼠胰腺相似,而对照pdx1
‑
flp;fsf
‑
kras
g12d/
(pk)小鼠胰腺重量和大小明显增加,并可见有肉眼可见的肿瘤发生(图2b)。组织病理学分析表明,psmd11单等位基因或双等位基因敲除小鼠胰腺均具有正常的胰腺组织结构,仅显示散发性panin,而对照pk小鼠的胰腺可发现有大量的低或高等级的panin肿瘤组织(图2c和图2d)。值得注意的是,在他莫昔芬处理的pkcp
flx/flx
和pkcp
flx/
小鼠中存在的少数panin中仍然可以看到psmd11表达(图2e),提示psmd11基因重组失败。panin的激光捕获显微切割和基因分型pcr进一步证实了这一点,其显示完整的floxed psmd11带和缺少重组带(图2f)。kaplan
‑
meier生存分析表明(图2g),与pk小鼠相比,psmd11的双等位基因敲除可显著延长pkcp
flx/flx
小鼠的生存期(从745天到556天)。虽然psmd11单等位基因敲除小鼠的存活时间没有达到统计学意义,但与pk小鼠相比,它们的中位存活时间也延长了38天(从556天到594天)。因此,可以得出结论,krasg12d驱动的pdac启动和进展需要psmd11表达。
135.实施例3、体内急性敲除psmd11可诱导胰腺癌细胞恶性表型的逆转和凋亡
136.为了研究靶向psmd11是否可诱导胰腺癌细胞凋亡,本发明人在9月龄的pkcp
flx/flx
和pkcp
flx/
小鼠中激活creert2,并在他莫昔芬给药5
‑
28天后分析小鼠胰腺组织。发现在用他莫昔芬治疗5天后的小鼠胰腺中,激光捕获显微切割panin和基因分型pcr显示在收集的约50%的panin中可检测到重组的等位基因(psmd11
δ
,643bp)(图3a和b),在这些psmd11
δ
阳性的panins中可以看到psmd11的表达缺失(图3c),证明他莫昔芬可以通过激活体内creert2诱导psmd11有效敲除。在用他莫昔芬治疗25
‑
28天后的pkcp
flx/flx
和pkcp
flx/
小鼠胰腺中,都可以看到pdac细胞恶性表型的逆转(图3d)。在这些小鼠中,pdac细胞及其细胞核变小,它们的形状从鹅卵石状变为扁平状,pdac细胞核/浆比例变小,pdac组织腺腔内分泌的粘蛋白减少或消失,部分由无色变为粉红色,提示有出血现象。在他莫昔芬治疗25
‑
28天后的双等位基因敲除的pdac组织中变化更为明显。值得注意的是,在一些pdac组织中,可见管状腺体周围的pdac细胞已经消失,只剩下粘蛋白,提示灭活psmd11可诱导pdac细胞死亡。tdt
‑
utp缺口末端标记(tunel)细胞凋亡实验表明,在psmd11单等位基因或双等位基因敲除小鼠胰腺pdac组织中都可以看到大量fitc标记的细胞(图3e),表明psmd11的敲除可诱导pdac细胞通过凋亡而死亡,这与我们之前的发现一致。
137.实施例4、在成年小鼠中全身性psmd11单等位基因敲除没有发现明显的表型,但是全身性psmd11双等位基因敲除会导致成年小鼠在3
‑
5天内死亡
138.由于上述结果提示psmd11可能是kras驱动的胰腺癌的一个有效治疗靶点,下一个需要解决的问题是全身性psmd11敲除是否有潜在的毒副作用。为了避免由组成型全身psmd11敲除引起的胚胎致死性,本发明人通过将the human beta
‑
actin flpe deleter小
鼠、fsf
‑
r26
cag
‑
creert2/
小鼠和psmd11
flx/flx
小鼠杂交,构建了具有基因型flp;fsf
‑
r26
cag
‑
creert2/
;psmd11
flx/flx
(fcp
flx/flx
)和flp;fsf
‑
r26
cag
‑
creert2/
;psmd11
flx/
(fcp
flx/
)的条件性psmd11全身性单或双等位基因敲除小鼠。在该小鼠中,全身性表达的flp重组酶可特异性敲除终止子frt
‑
stop
‑
frt(fsf),诱导creert2表达(creert2是cre重组酶与突变的雌激素受体ert2配体结合区的融合蛋白,当其与他莫昔芬结合时会进入细胞核,使cre重组酶活性得以发挥,可特异性敲除两端带有loxp位点的基因),然后喂食他莫昔芬诱导psmd11全身性敲除,fcp
flx/flx
和fcp
flx/
小鼠均表现正常且具有生育能力。这些小鼠在3月龄时喂食他莫昔芬,以诱导psmd11基因敲除。与我们之前的发现一致,psmd11单等位基因敲除具有良好的耐受性,与wt对照小鼠相比,没有显示任何明显的表型。然而,psmd11双等位基因敲除可导致成年小鼠(n=5)在施用他莫昔芬后3
‑
5天内死亡(图4a),表明psmd11的完全缺失具有致死毒性。血液学分析显示,这些小鼠死亡之前血清总胆红素(tbil)、天冬氨酸转氨酶(ast)、丙氨酸转氨酶(alt)、尿酸、乳酸脱氢酶(ldh)、肌酸激酶(ck)、
ɑ
‑
羟基丁酸脱氢酶(
ɑ
‑
hbdh)显著升高(图4b)。而甘油三酯(tg)显著下降,提示肝脏和心脏功能受损,可能是psmd11敲除导致死亡的主要原因。另外小鼠尸检发现,与对照小鼠相比,他莫昔芬处理的小鼠的脾脏显著变小(图4c),表明脾细胞对psmd11敲除高度敏感。其他器官未见明显异常。因为已经发现在成年fcp
flx/flx
小鼠的胰腺、肝脏和肾脏中敲除psmd11后p53蛋白会明显上调,本发明人还检测了3月龄fcp
flx/
小鼠在喂食他莫昔芬30天后p53的表达。如图4d所示,psmd11表达仅在胰腺中被发现明显下调,而在肝脏和肾脏中未发现明显变化,但在胰腺、肝脏和肾脏中均可发现p53明显上调,表明p53表达对psmd11敲除高度敏感。
139.实施例5、psmd11条件性敲除可诱导小鼠原代pdac细胞大量凋亡
140.为了证明敲除psmd11是否可诱导体外pdac细胞凋亡,本发明人首先从胰腺中具有可见瘤块的pkcp
flx/flx
小鼠建立了一株原代pdac细胞株,该小鼠已经用他莫昔芬处理了一个月以诱导psmd11敲除。该细胞dna基因分型显示psmd11的floxed等位基因仍然保持完整(图5c,对照),进一步证实了在他莫昔芬治疗期间psmd11基因重组失败。如图5a所示,用0.5μm 4
‑
羟基他莫昔芬处理6天可诱导近100%的小鼠原代pdac细胞死亡。在4
‑
羟基他莫昔芬处理2天后,pdac细胞中可检测到psmd11敲除的等位基因(psmd11
δ
,643bp)(图5b),qrt
‑
pcr(图5c)和western blot(图5d)证实psmd11 mrna转录物和蛋白都明显下调。处理4天后可检测到细胞凋亡特异性的cleaved
‑
caspase 3,hoechst 33342染色可发现大量细胞核凝聚和断裂(图5e),表明psmd11敲除可诱导小鼠原代pdac细胞大量凋亡。
141.实施例6、定量蛋白质组学分析探讨psmd11敲除诱导小鼠原代pdac细胞凋亡的分子机制
142.由于26s蛋白酶体的主要功能是通过降解错误折叠或损坏的蛋白或活的哺乳动物细胞中不再需要其功能的蛋白来调节蛋白表达以维持蛋白稳态,并且已经发现psmd11敲除可分别在fcp
flx/flx
和fcp
flx/
小鼠胰腺、肝脏和肾脏中诱导p53蛋白表达上调,我们推测psmd11敲除后诱导kras驱动的pdac细胞凋亡的分子机制可能是由于上调或丢失一些关键的存活因子引起的,为了鉴定这些关键的细胞存活因子,在对照和tam处理4天的pkcp
flx/flx
小鼠(每组n=3/组)的原代pdac细胞之间进行了的定量串联质量标签(tmt)蛋白质组学分析,此时pdac细胞的形状已从鹅卵石状变为成纤维细胞样,但刚刚检测到细胞凋亡的发生(cleaved
‑
caspase 3呈阳性)。两组之间差异表达蛋白的表达变化用k
‑
均值聚类热图和火
山图确定,如图6a和图6b所示。共鉴定出了6303种蛋白,量化了6244种蛋白质。其中,发现162种蛋白(上调的倍数变化>1.2或下调<0.83和p值<0.05)表达有明显差异,134种蛋白包括p53表达上调,28种蛋白包括psmd11表达下调,3种上调蛋白包括morf4l1、fosl1、ddx49和3种下调蛋白包括gap43、wdr19、rpp38的蛋白质印迹分析进一步证实了蛋白质组学分析的可信性(图6c)。
143.为全面了解这162个差异表达蛋白的功能、定位和参与的生物学通路,本发明人应用基因本体(gene ontology analysis,go)分析将这些蛋白标注到10,824个二级go功能条目中,go功能条目被归类为三个主要类别(生物过程、细胞成分和分子功能),每个蛋白至少被分配一个术语。
144.在生物过程类别(图6d)中,超过50%的蛋白可被注释为属于细胞过程(149/162蛋白)、生物调节(108/162蛋白)、代谢过程(107/162蛋白)、调节生物过程(106/162蛋白)和细胞成分组织或生物发生(86/162蛋白)。在分子功能类别中,前三项是结合(121/162)、催化活性(47/162)和转录调节活性(22/162)。在细胞成分类别中前五个术语是细胞部分(156/162蛋白)、细胞(156/162蛋白)、细胞器(136/162蛋白)、细胞器部分(111/162蛋白)和含有蛋白的复合物(83/162)。
145.进一步的go功能富集分析发现,生物过程中的一些术语如rna聚合酶ii启动子响应应激的转录调控、响应应激的以dna为模板的转录调控、响应应激的rna聚合酶ii启动子转录的正调控,基于微管的过程,基于微管的运动(图6e);分子功能类别中的微管结合、微管蛋白结合、转录调节活性、泛素结合酶活性、硫氧还蛋白活性(图6f);细胞成分类别中的浓缩染色体外着丝粒、染色体、染色体部分、核质部分、细胞核显著富集(图6g)。
146.kegg(kyoto encyclopedia of genes and genomes)通路分析表明,差异蛋白数量最多的前5条通路是核糖体、泛素介导的蛋白水解、帕金森病、肌萎缩侧索硬化、卡波西肉瘤相关疱疹病毒感染(图6h)。kegg通路富集分析显示,前5条最富集的通路是线粒体自噬、泛素介导的蛋白水解、卡波西肉瘤相关疱疹病毒感染、基础转录因子、p53信号通路(图6i)。
147.更重要的是,在这些差异表达的蛋白中,多种蛋白已被证明在细胞存活(calvo et al.,2015;vallejo et al.,2017;zou et al.,2015)、增殖(pike et al.,2018;zhang et al.,2019)、细胞周期进程和细胞凋亡(baldeyron et al.,2015;cha et al.,2013;wang et al.,2014)、衰老(bainor et al.,2017)、癌细胞铁死亡(sun et al.,2015)、化疗耐药(chen et al.,2019)、转移(yang et al.,2019;zhang et al.,2018)、癌细胞的迁移和侵袭(ha et al.,2008;muhammad et al.,2018;pongrakhananon et al.,2018;xiao et al.,2019)、以及肿瘤的发生和发展中(ban et al.,2020;vila et al.,2017;xu et al.,2019)发挥重要作用,进一步证实了psmd11敲除后kras致癌基因驱动的pdac细胞细胞凋亡的分子机制是由于一些关键存活因子的上调或丢失的推测。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。