1.本发明涉及生物技术领域,更具体地涉及一种利用卷曲螺旋结构域tdot作为融合标签制备过氧化氢酶活性包涵体与应用。
背景技术:
2.过氧化氢作为氧化剂、漂白剂、消毒剂、脱氧剂、聚合物引发剂和交联剂,已在化工、纺织、造纸、军工、电子、医药、环境保护和食品等领域中得到了广泛应用。如在纺织工业中,通常在50℃以上高温和碱性溶液中(ph 9及以上)使用过氧化氢对织物进行漂白。由于残留的过氧化氢会严重影响织物的染色,造成染色不充分、色泽不均匀、批次间色泽差异较大等问题,同时废水中残留的过氧化氢也会带来严重的环境污染,因此去除织物和漂白用水中残留的过氧化氢至关重要。
3.目前去除过氧化氢的方法主要包括传统的水洗法和化学还原剂法,以及生物酶催化法。其中,水洗法不仅需要消耗大量水及能源,而且去除过氧化氢不彻底。化学还原剂法主要使用如保险粉、大苏打等试剂去除过氧化氢。但是,由于该法难以精确评估试剂的加入量,不仅带来了活性染料被添加剂还原分解的风险,同时会产生高盐废水。综上所述,传统过氧化氢去除方法存在去除效率低、能耗高、可控性差、带来额外污染物等缺点,而生物酶催化法主要采用过氧化氢酶分解去除过氧化氢。过氧化氢酶(catalase,简称cat,ec 1.11.1.6)能够催化h2o2分解生成o2和h2o。过氧化氢酶存在于大多数动植物和微生物体内,可以降解过氧化氢使细胞免受氧化损伤,同时可用于工业中分解去除过氧化氢。相比传统的过氧化氢去除方法,生物催化法具有去除效率高、能耗低、易控制、环保安全等优势。当前工业中对过氧化氢酶的需求量较大,但天然过氧化氢酶产量低,游离过氧化氢酶难以回收再利用,并且一些过氧化氢酶在碱性溶液环境下易失活,造成过氧化氢酶相关的生产和使用成本较高,这限制了其实际应用。选取具有优良催化性能的过氧化氢酶进行异源表达,同时结合酶固定化技术能够提高其重复利用率,降低工业生产和使用成本。利用原核生物异源表达重组蛋白经常容易形成不溶性包涵体。近年来对于包涵体结构和功能活性的研究进展表明,将一些重组蛋白与特定标签序列融合表达,能够在包涵体中形成正确折叠的构象,从而表现出功能活性,被称为活性包涵体。由于将酶蛋白表达为活性包涵体是一种稳定可重复利用的固定化酶,无需载体材料和额外的固定化反应,并且表达和固定化同步进行,可以通过离心方便的回收再利用,因此表现出巨大的应用前景。
技术实现要素:
4.本发明的目的是提供一种利用卷曲螺旋结构域tdot作为融合标签制备过氧化氢酶活性包涵体的方法,从而解决纺织工业中过氧化氢酶生产和使用成本高等问题。
5.为了解决上述技术问题,本发明采用以下技术方案:
6.根据本发明的第一方面,提供一种基因,核苷酸序列如seq id no.1所示。
7.根据本发明的第二方面,提供一种上述基因编码的含有kata
‑
linker
‑
tdot的融合
蛋白,氨基酸序列如seq id no.2所示。
8.根据本发明的第三方面,提供一种含有上述基因的重组工程菌。
9.根据本发明的第四方面,提供一种过氧化氢酶活性包涵体,由所述重组工程菌诱导融合蛋白表达,菌体破碎、分离、纯化所得。
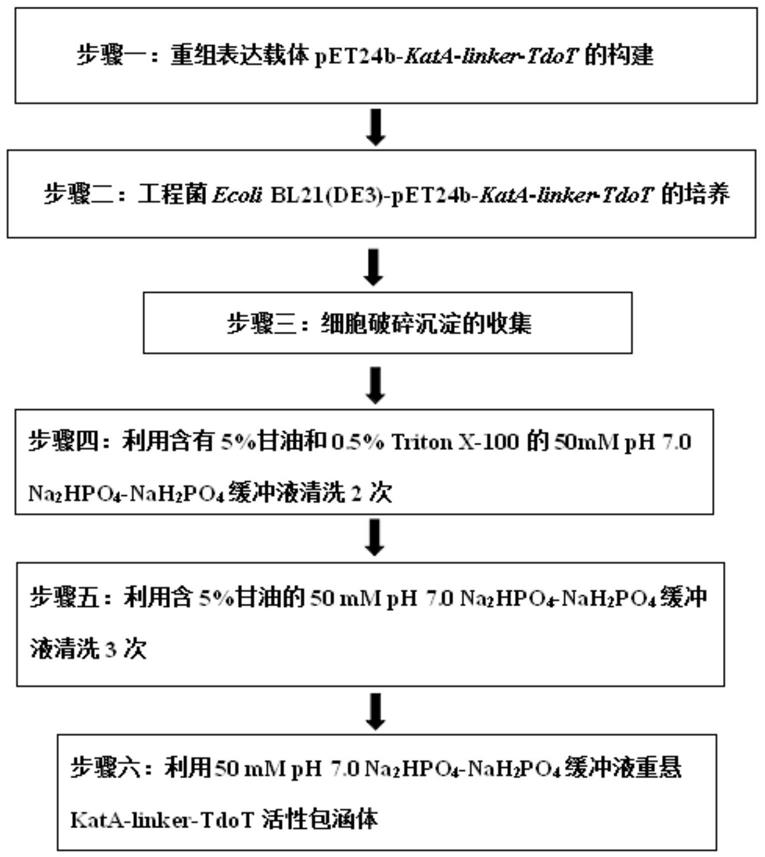
10.具体地,所述过氧化氢酶活性包涵体的制备方法,包括以下步骤:利用卷曲螺旋结构域tdot作为融合标签将过氧化氢酶kata制备成活性包涵体,具体包括以下步骤:
11.(1)构建含有kata
‑
linker
‑
tdot融合蛋白的编码基因的重组表达载体,将该重组表达载体转入表达宿主细胞,获得重组工程菌;
12.(2)培养所述重组工程菌,诱导融合蛋白表达;
13.(3)收集菌体细胞并进行细胞破碎,分离细胞破碎上清液和含有包涵体的沉淀样品,将沉淀样品通过缓冲液洗涤进行纯化得到活性包涵体。
14.优选地,所述过氧化氢酶kata基因为枯草芽孢杆菌bacillus subtilis 168来源,该基因具有seq id no.3所示的核苷酸序列。
15.优选地,所述tdot基因来自海葡萄嗜热菌(staphylothermus marinus),该基因具有seq id no.4所示的核苷酸序列。
16.优选地,所述kata
‑
linker
‑
tdot融合蛋白的基因从5’端至3’端依次包括:过氧化氢酶kata的编码基因、linker的编码基因(ggatcc)、tdot的编码基因;所述kata
‑
linker
‑
tdot融合蛋白的编码基因的核苷酸序列如seq id no.1所示。
17.作为举例而非限制,所述表达宿主细胞优选为大肠杆菌e.coli bl21(de3)。
18.所述步骤(3)中洗涤所用的缓冲液为含有5%甘油的50mm ph 7.0 na2hpo4
‑
nah2po4缓冲液和含有5%甘油和0.5%triton x
‑
100的50mm ph 7.0 na2hpo4
‑
nah2po4缓冲液。
19.根据本发明的第五方面,提供一种过氧化氢酶活性包涵体在工业领域中用于去除残留的过氧化氢中的应用。
20.进一步地,所述工业领域包括纺织行业、环保行业、军工行业、化工行业、电子行业、制药业、造纸行业。
21.进一步地,所述包涵体催化过氧化氢的ph为5.0~11.0,温度为30~60℃。
22.与现有技术相比,本发明具有以下有益效果:
23.根据本发明提供的方法,利用tdot作为融合标签,通过异源表达首次制备出过氧化氢酶活性包涵体,该方法与传统的过氧化氢酶提取和制备方法相比,异源表达量大、分离纯化无需色谱填料和色谱柱、分离操作简单。同时,活性包涵体作为一种新型固定化酶,具有表达和固定化同步进行,无需载体材料和额外的固定化反应等优势,因此将过氧化氢酶表达为活性包涵体,不仅容易回收再利用,而且能够有效降低规模化生产和使用的成本,并且环保安全,具有重要的实用价值。
24.根据本发明提供的方法,kata
‑
linker
‑
tdot编码基因序列位于环状质粒载体上,易于保存和分子克隆操作。
25.总之,本发明提供了一种以tdot为融合标签,通过异源表达制备过氧化氢酶活性包涵体的方法,该方法表达量大,活性包涵体易纯化,适合工业上规模化制备生产,并且可以重复利用,降低了使用成本,节约了大量人力、物力和时间。
附图说明
26.图1是本发明制备过氧化氢酶活性包涵体的流程示意图。
27.图2是本发明制备的过氧化氢酶活性包涵体经分离纯化后的蛋白电泳图。m:蛋白分子量标准品;1:纯化后的活性包涵体。
28.图3(a)和(b)分别是kata
‑
linker
‑
tdot活性包涵体的最适ph和最适温度。
29.图4(a)和(b)分别是kata
‑
linker
‑
tdot活性包涵体的ph稳定性和温度稳定性。
30.图5是kata
‑
linker
‑
tdot活性包涵体的操作稳定性。
具体实施方式
31.以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。
32.本发明所用的试剂或原料,若无特殊声明,均为市售可得。
33.下列实施例中未注明具体条件的实验方法,通常按照常规条件,如《分子克隆实验指南:第4版》中所述的条件进行,或按照试剂生产厂商所建议的条件。
34.实施例中用到的试剂、缓冲液和培养基如下:
35.主要试剂的配制:
36.氨苄青霉素:利用灭菌双蒸水配制100mg/ml的氨苄青霉素溶液,使用0.22μm灭菌滤膜过滤除菌,除菌后的氨苄青霉素溶液置于
‑
20℃保存。
37.卡那霉素:利用灭菌双蒸水配制100mg/ml的卡那霉素溶液,使用0.22μm灭菌滤膜过滤除菌,除菌后的卡那霉素溶液置于
‑
20℃保存。
38.10
×
tbe:tris:108g、na2edta
·
2h2o:7.44g、硼酸:55g,去离子水溶解定容至1000ml。
[0039]5×
蛋白电泳缓冲液:tris:15.1g、甘氨酸:94g、sds:5g,去离子水溶解定容至1000ml。
[0040]5×
loading buffer:ph 6.8的1m tris
‑
hcl:1.25ml、sds:0.5g、溴酚蓝:25mg、甘油2.5ml,去离子水溶解定容至5ml,以0.5ml分装一管,使用前加入25μl巯基乙醇。
[0041]
sds
‑
page染色液:考马斯亮蓝r
‑
250:1g、异丙醇:250ml、冰乙酸:100ml,去离子水定容至1000ml。
[0042]
sds
‑
page脱色液:无水乙醇:50ml、冰乙酸:100ml,去离子水定容至1000ml。
[0043]
lb培养基配方:蛋白胨:10g、酵母粉:5g、nacl:10g,溶于600ml去离子水后将ph调至7.2,定容至1000ml,121℃灭菌20min。
[0044]
tb培养基配方:溶液1:蛋白胨:12.0g、酵母粉:24.0g、甘油:4.0ml,用去离子水定容至900ml;溶液2:kh2po4:2.31g、k2hpo4·
3h2o:16.4g溶于100ml去离子水;溶液1和溶液2在使用前以9:1(v/v)混合。
[0045]
含5%甘油的50mm ph 7.0 na2hpo4‑
nah2po4缓冲液:分别称取0.62gnah2po4·
2h2o和16.937g na2hpo4·
12h2o,取甘油50ml,加入去离子水定容至1l。
[0046]
含有5%甘油和0.5%triton x
‑
100的50mm ph 7.0 na2hpo4‑
nah2po4缓冲液:分别称取0.62g nah2po4·
2h2o和16.937g na2hpo4·
12h2o,量取甘油50ml,量取5ml triton x
‑
100,加入去离子水定容至1l。
[0047]
质粒提取试剂盒和dna胶回收试剂盒均购自生工生物工程(上海)股份有限公司。
[0048]
实施例1 pet24b
‑
kata
‑
linker
‑
tdot表达载体的构建
[0049]
分别合成以下引物:
[0050]
引物p1:seq id no.5:
[0051]5’‑
agttcaaataaactgacaactagctggggcgctc
‑3’
[0052]
引物p2:seq id no.6:
[0053]5’‑
agaatcttttttaatcggcaatccaaggccttctgc
‑3’
[0054]
引物p3:seq id no.7:
[0055]5’‑
aagaaggagatatacatatgagttcaaataaactgacaactagctggggcgctc
‑3’
[0056]
引物p4:seq id no.8:
[0057]5’‑
gcagtttcgttaatgatggatccagaatcttttttaatcggcaatccaaggccttctgc
‑3’
[0058]
在上述p1和p2引物的引导下,以含有过氧化氢酶kata的编码基因的pet22b
‑
kata质粒为模板进行pcr扩增出kata基因,利用1%琼脂糖凝胶电泳和胶回收试剂盒回收上述基因片段,进一步克隆于t
‑
vector pmd
tm
19(simple)上;在上述p3和p4引物的引导下,以t
‑
vector pmd
tm
19(simple)
‑
kata质粒为模板进行pcr反应扩增出带有同源臂序列的kata基因,利用1%琼脂糖凝胶电泳和胶回收试剂盒回收上述基因片段。将回收的基因片段以pet24b
‑
linker
‑
tdot为模板,利用rf克隆(restriction
‑
free cloning)技术构建得到重组质粒,之后利用电转化法转入大肠杆菌e.coli dh10b感受态细胞,用含50μg/ml卡那霉素的lb固体培养基进行筛选,挑取单菌落利用菌落pcr法鉴定阳性克隆。将阳性克隆利用摇瓶进行培养和提取质粒,经基因测序鉴定,获得正确的重组质粒pet24b
‑
kata
‑
linker
‑
tdot。
[0059]
实施例2 kata
‑
linker
‑
tdot的异源表达
[0060]
将实施例1中获得的重组表达质粒pet24b
‑
kata
‑
linker
‑
tdot采用热激法转入大肠杆菌e.coli bl21(de3)感受态细胞中,挑取单菌落在含有50μg/ml卡那霉素的5ml lb培养基中于37℃,200rpm下培养12h,然后按2%(v/v)的比例转接到含50μg/ml卡那霉素的tb培养基中,在37℃继续培养至od
600
为0.8
‑
1.0时,加入iptg至终浓度0.5mm,在16℃下诱导20h。
[0061]
实施例3 kata
‑
linker
‑
tdot活性包涵体的分离纯化
[0062]
收集菌体细胞并重悬于含有5%甘油的50mm ph 7.0 na2hpo4‑
nah2po4缓冲液中进行超声破碎,之后于10000rpm,4℃离心20min,收集沉淀。将沉淀样品先用20ml含有5%甘油和0.5%triton x
‑
100的50mm ph 7.0 na2hpo4‑
nah2po4缓冲液进行重悬和洗涤,之后于10000rpm离心15min收集沉淀,总共洗涤2次。随后用20ml含有5%甘油的50mm ph 7.0 na2hpo4‑
nah2po4缓冲液重悬和洗涤沉淀,于10000rpm离心15min收集沉淀,总共洗涤3次,最后用4ml ph 7.0 50mm na2hpo4‑
nah2po4缓冲液重悬纯化的活性包涵体。
[0063]
以上所述仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是根据本发明申请的权利要求书和说明书内容所作的简单、等效变化与修饰,皆为本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
[0064]
实施例4 kata
‑
linker
‑
tdot活性包涵体的酶学性质表征
[0065]
以10mm过氧化氢为底物,在ph 4.0~12.0下进行酶反应,如图3a所示,活性包涵体
在ph 11.0时达到最大酶活力。在ph 5.0~11.0范围内具有超过50%的催化活性,ph高于11.0后酶活力迅速下降。在最适ph 11.0下,以10mm过氧化氢为底物,在30
‑
70℃下进行酶反应,如图3b所示,kata
‑
linker
‑
tdot活性包涵体在35℃时达到最大酶活力,在30~60℃范围内酶活力均高于60%,高于60℃后酶活力迅速下降。kata
‑
linker
‑
tdot活性包涵体的ph稳定性如图4a所示,该酶在ph 9.0
‑
11.0下,能够保留97%以上的酶活,说明在该ph范围内具有较好的稳定性。kata
‑
linker
‑
tdot活性包涵体的温度稳定性如图4b所示,在30
‑
45℃下孵育30min后的相对活力均高于93%。当温度进一步升高后,酶的温度稳定性有所下降,但在50
‑
55℃下仍具有超过73%的相对活力,温度高于55℃后酶活力快速下降,至60℃时相对活力下降至26.5%。
[0066]
实施例5 kata
‑
linker
‑
tdot活性包涵体的动力学参数
[0067]
以2.25
‑
63mm过氧化氢为底物,在最适反应条件下检测kata
‑
linker
‑
tdot活性包涵体的催化活性,通过graphpad prism非线性拟合,结果得到kata
‑
linker
‑
tdot活性包涵体的动力学参数v
max
为22541μmol/l/min,k
m
为51.29mm。
[0068]
实施例6 kata
‑
linker
‑
tdot活性包涵体的操作稳定性
[0069]
为了评估kata
‑
linker
‑
tdot活性包涵体的操作稳定性,在活性包涵体进行催化反应后,将离心回收的kata
‑
linker
‑
tdot活性包涵体用缓冲液洗涤后继续进行催化反应。结果表明,kata
‑
linker
‑
tdot活性包涵体在连续进行5次催化反应后显示出50.69%的相对酶活力,说明其可重复使用效果较好。
[0070]
以上所述仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是根据本发明申请的权利要求书和说明书内容所作的简单、等效变化与修饰,皆为本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。