本申请要求于2019年4月16日提交的美国临时专利申请序列号62/834592的优先权,该申请通过引用整体并入本文。
背景技术
尽管三聚体在促凋亡和促炎信号级联反应中很重要,但尚未开发出化学诱导的三聚体系统。因此,小分子诱导型三聚体的设计是对具有相当实际相关性的全新蛋白质设计的挑战。
序列表的引用
本申请包含以名称为“19-142-PCT_Sequence-Listing_ST25.txt”的电子文本文件提交的序列表,其字节大小为5kb,创建于2020年4月8日。根据37CFR§1.52(e)(5),该电子文件中包含的信息通过引用整体并入本文。
技术实现要素:
在一方面,本公开提供了包含沿着SEQ ID NO:1的氨基酸序列的全长至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列的多肽,其中基于SEQ ID NO:1中残基的编号,该多肽在位置71处包含选自由S71和T71组成的组中的残基。在一个实施方式中,基于SEQ ID NO:1中残基的编号,该多肽在位置64、67和68的每一个处包含疏水性残基。在另一个实施方式中,基于SEQ ID NO:1中残基的编号,该多肽在位置64、67和68中的一个或多个处包含丙氨酸残基。在另一个实施方式中,基于SEQ ID NO:1中残基的编号,该多肽在位置67和68中的一个或多个处包含丙氨酸残基。在一个实施方式中,基于SEQ ID NO:1中残基的编号,I64、L67、68和S71残基在该多肽中是保守的。在各种实施方式中,该多肽包含沿着SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5的氨基酸序列的氨基酸序列全长至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,其中括号中的残基是可选的。在另一个实施方式中,相对于SEQ ID NO:1的序列,残基6L被修饰为6Q。
在一个实施方式中,相对于SEQ ID NO:1,残基16、17、20、24、27、31、41、42、43、49、51、56、57、58、59和60中的每一个是疏水性残基。在另一个实施方式中,相对于SEQ ID NO:1,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或所有16个以下残基是保守的:A16、L17、L20、L24、L27、L31、A41、L42、V43、L49、V51、I56、I57、V58、V59、L60。在另一个实施方式中,相对于SEQ ID NO:1,残基30、46、47、50、23、53和54中的每一个是亲水性残基。在另一个实施方式中,相对于SEQ ID NO:1,1、2、3、4、5、6或所有7个以下残基是保守的:S30、N46、N47、N50、S23、N53和N54。在一个实施方式中,相对于SEQ ID NO:1,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或所有23个以下残基是保守的:A16、L17、L20、L24、L27、L31、A41、L42、V43、L49、V51、I56、I57、V58、V59、L60、S30、N46、N47、N50、S23、N53和N54。在另一个实施方式中,与参考蛋白质(SEQ ID NO:1)的氨基酸变化是保守氨基酸取代。
在一个实施方式中,本公开提供了融合蛋白,其包含与生物活性多肽遗传性融合的本公开的任何实施方式或实施方式组合的多肽,包括但不限于细胞死亡多肽,例如半胱天冬酶-1、半胱天冬酶-3、半胱天冬酶-8或半胱天冬酶-9。
在另一个实施方式中,本公开提供了与金刚烷胺结合的本公开的任何实施方式或实施方式组合的多肽或融合蛋白。在一个实施方式中,多肽或融合蛋白是单体或同源三聚体。在另一个实施方式中,本公开提供了结合或嵌入脂质膜的本公开的任何实施方式或实施方式组合的多肽或融合蛋白。
本公开还提供了编码本公开的任何实施方式或实施方式组合的多肽或融合蛋白的核酸、包含可操作地连接至合适控制元件的核酸的表达载体,以及包含本公开的任何实施方式或实施方式组合的核酸、表达载体、多肽或融合蛋白的宿主细胞。本公开还提供了药物组合物,其包含本公开的任何实施方式或实施方式组合的多肽、融合蛋白、核酸、表达载体和/或宿主细胞,以及药学上可接受的载体。本公开还提供了将本公开的任何实施方式或实施方式组合的多肽、融合蛋白、核酸、表达载体、宿主细胞或药物组合物用于任何合适的目的的方法,包括但不限于作为安全开关用于细胞或基因治疗。
附图说明
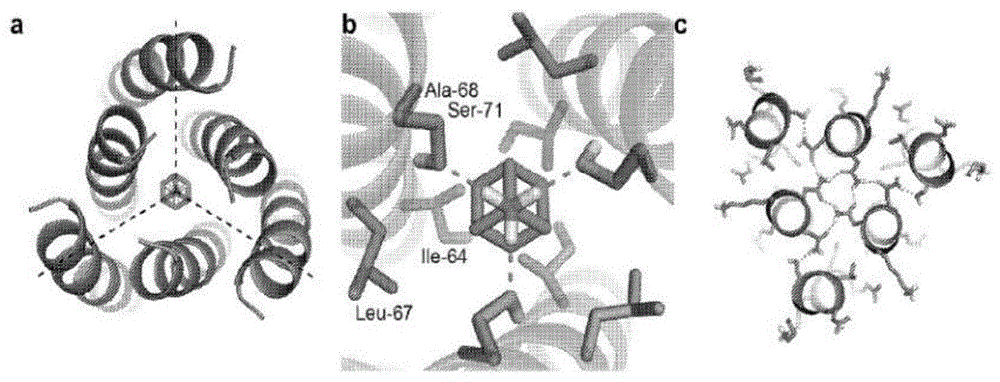
图1中a-c:计算设计方法论。(a)同源三聚体支架设计为结合金刚烷胺,从而使蛋白质和小分子的C3轴对齐。(b)ABP中的结合口袋设计为具有与金刚烷胺和非极性残基(Ile-64、Leu-67和Ala-68)的氨基形成氢键(虚线)的极性丝氨酸残基(Ser-71)以补充金刚烷胺疏水部分的形状。(c)设计模型包含指定ABP三聚体组装的氢键网络。
图2中a-c:金刚烷胺与ABP的结合特性。(a)SEC色谱图监测280nm(mAU)处的吸光度和估计的分子质量(来自MALS)。(b)Apo-ABP(空心圆)表现出高初始荧光信号,在金刚烷胺(实心圆)存在下降低。正如预期的,2LC3H6_13(空心菱形)和2LC3H6_13加金刚烷胺(实心菱形)表现出非常低的初始荧光信号。(c)ABP在25℃、75℃、95℃以及25℃加热和冷却后的CD光谱。ABP在25℃时的CD谱表明全ɑ-螺旋结构在75℃前仍保持相当稳定。
图3中a-d:ABP-金刚烷胺相互作用的结构表征。(a)与金刚烷胺复合的ABP的高分辨率X射线结构(白色)非常接近计算模型(灰色)(RMSD分别为和)。(b)在配体建模之前,可以在ABP的结合位点内观察到与金刚烷胺相对应的正电子密度(3.0σ处显示的Fo-Fc图)。(c)在模型构建和细化中添加配体导致与金刚烷胺相对应的清晰可观察电子密度(1.0σ处显示的2Fo-Fc图)。(d)金刚烷胺和有序水分子在ABP结合位点可以观察到清晰的电子密度(1.0σ处显示的2Fo-Fc图。在Ser-71和金刚烷胺的氨基之间观察到水介导的氢键(黑色虚线)。
图4:存在金刚烷胺时ABP的CD谱。ABP在5mM金刚烷胺存在下在25℃、75℃、95℃以及25℃加热和冷却后的CD谱表明ABP的热稳定性不受金刚烷胺存在的显著影响。
图5:ABP代表性区域的电子密度图的立体图像。1.0σ处显示的2Fo-Fc电子密度图。
图6:ABP_L6Q的代表性Thermofluor熔解曲线。与ABP一样,ABP_L6Q表现出高初始荧光信号(透明圆圈),在金刚烷胺(黑色圆圈)存在下会降低。
图7:ABP_L6Q与金刚烷胺复合物的X射线晶体结构。ABP_L6Q 金刚烷胺()的X射线晶体结构与ABP 金刚烷胺结构非常相似。结晶水分子显示为球体。
具体实施方式
引用的所有参考文献通过引用整体并入本文。如本文所用,单数形式“一个”、“一种”和“该”包括复数所指对象,除非上下文另有明确规定。
如本文所用,氨基酸残基缩写如下:丙氨酸(Ala;A)、天冬酰胺(Asn;N)、天冬氨酸(Asp;D)、精氨酸(Arg;R)、半胱氨酸(Cys;C)、谷氨酸酸(Glu;E)、谷氨酰胺(Gln;Q)、甘氨酸(Gly;G)、组氨酸(His;H)、异亮氨酸(Ile;I)、亮氨酸(Leu;L)、赖氨酸(Lys;K)、蛋氨酸(Met;M)、苯丙氨酸(Phe;F)、脯氨酸(Pro;P)、丝氨酸(Ser;S)、苏氨酸(Thr;T)、色氨酸(Trp;W)、酪氨酸(Tyr;Y)和缬氨酸(Val;V)。
除非上下文另有明确规定,否则本公开的任何方面的所有实施方式都可以组合使用。
除非上下文另有明确要求,否则在整个说明书和权利要求书中,词语“包括”、“包含”等应被解释为包含性意义,而不是排他性或穷尽性意义;也就是说是以“包括但不限于”的意义。使用单数或复数的词还分别包括复数和单数。此外,在本申请中使用的“在此”、“以上”和“以下”以及类似含义的词语均指本申请的整体,而不是指本申请的任何特定部分。
本公开的实施方式的描述并非旨在穷举或将本公开限制为所公开的精确形式。虽然本文为了说明的目的描述了本公开的具体实施方式和示例,但是如相关领域的技术人员将认识到的,在本公开的范围内各种等效修改是可能的。
在一方面,本公开提供了包含沿着SEQ ID NO:1的氨基酸序列的全长具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列的多肽,其中基于SEQ ID NO:1中残基的编号,该多肽在位置71处包含选自由S71和T71组成的组中的残基。
>ABP_设计序列
DAQDKLKYLVKQLERALRELKKSLDELERSLEELEKNPSEDALVENNRLNVENNKIIVEVLRIILELAKASAKLA(SEQ ID NO:1)
如本文示例所示,本发明人已证明本文公开的多肽能够结合金刚烷胺,因此可用作例如细胞或基因治疗的安全开关。例如,多肽可以与细胞死亡蛋白(促凋亡蛋白等)连接并在用于细胞治疗的细胞中表达;然后可以将金刚烷胺施用于受试者以促进用于细胞疗法的细胞的细胞死亡。本文公开的多肽构成结合C3对称小分子的同源三聚体蛋白的首次成功全新设计。
在一个实施方式中,基于SEQ ID NO:1中残基的编号,该多肽在位置64、67和68处包含疏水残基。疏水性残基在本文中定义为Ala、Cys、Gly、Pro、Met、Sce、Sme、Val、Ile和Leu。在另一个实施方式中,基于SEQ ID NO:1中残基的编号,该多肽在位置64、67和68中的一个或多个处包含丙氨酸残基。在另一个实施方式中,基于SEQ ID NO:1中残基的编号,该多肽在位置67和68中的一个或多个处包含丙氨酸残基。在又一个实施方式中,基于SEQ ID NO:1中残基的编号,残基I64、L67、A68和S71在多肽中是保守的。位置64、67、68和71存在于金刚烷胺结合界面。如本文所用,“保守”是指相同。
在一个实施方式中,该多肽包含沿着SEQ ID NO:2的氨基酸序列的氨基酸序列全长至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,其中括号中的残基是任选的。
SEQ ID NO:2
(MGSSHHHHHH)(SSGLVPRGSHMG)DAQDKLKYLVKQLERALRELKKSLDELERSLEELEELEKNPSEDALVENNRLNVENNKIIVEVLRIILELELAKASAKLA(ABP_全_ORF序列)
在一个实施方式中,多肽包含沿着SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5的氨基酸序列的氨基酸序列全长至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,其中括号中的残基是任选的。
SEQ ID NO:3
(SSGLVPRGSHMG)DAQDKLKYLVKQLERALRELKKSLDELERSLEELEKNPSEDALVENNRLNVENKIIVEVLRIILELAKASAKLA(ABP_全_ORF序列包括一些可选的残基)
SEQ ID NO:4
(SSGLVPR)GSHMGDAQDKLKYLVKQLERALRELKKSLDELERSLEELEKNPSEDALVENNRLNVENKIIVEVLRIILELELAKASAKLA(ABP_全_ORF序列包括一些可选的残基)
SEQ ID NO:5
GSHMGDAQDKLKYLVKQLERALRELKKSLDELERSLEELEKNPSEDALVENNRLNVENKIIVEVLRIILELELAKASAKLA(ABP_全_ORF序列)
在一个实施方式中,残基6L(相对于SEQ ID NO:1)可以修饰为6Q,如以下实施方式中所述。在另一个实施方式中,残基16、17、20、24、27、31、41、42、43、49、51、56、57、58、59和60中的每一个是疏水性残基。据信这些残基位于多肽和/或其同源三聚体的内部,并且可能参与同源三聚体的形成。在另一个实施方式中,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或所有16个以下残基相对于SEQ ID NO:1是保守的:A16、L17、L20、L24、L27、L31、A41、L42、V43、L49、V51、I56、I57、V58、V59、L60。
在一个实施方式中,残基30、46、47、50、23、53和54中的每一个是亲水性残基。据信这些残基位于多肽的内部,并且可能参与有助于同源三聚体形成的氢键网络。在另一个实施方式中,1、2、3、4、5、6或所有7个以下残基相对于SEQ ID NO:1是保守的:S30、N46、N47、N50、S23、N53和N54。
在另一个实施方式中,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或以下所有23个残基相对于SEQ ID NO:1是保守的:A16、L17、L20、L24、L27、L31、A41、L42、V43、L49、V51、I56、I57、V58、V59、L60、S30、N46、N47、N50、S23、N53和N54。
在另一个实施方式中,与参考蛋白质的氨基酸变化是保守氨基酸取代。
如此处所用,“保守氨基酸取代”是指:
○疏水性氨基酸(Ala、Cys、Gly、Pro、Met、Sce、Sme、Val、Ile、Leu)只能被其他疏水性氨基酸取代;
○具有庞大侧链的疏水性氨基酸(Phe、Tyr、Trp)只能被其他具有庞大侧链的疏水性氨基酸取代;
○具有带正电侧链的氨基酸(Arg、His、Lys)只能被其他具有带正电侧链的氨基酸取代;
○具有带负电侧链的氨基酸(Asp、Glu)只能被其他具有带负电侧链的氨基酸取代;以及
○带有极性不带电荷侧链的氨基酸(Ser、Thr、Asn、Gln)只能被带有极性不带电荷侧链的其他氨基酸取代。
在另一个实施方式中,本公开提供了融合蛋白,其包含与生物活性多肽遗传性融合的本文公开的任何实施方式或实施方式组合的多肽,包括但不限于细胞死亡多肽,例如半胱天冬酶-1、半胱天冬酶-3、半胱天冬酶-8或半胱天冬酶-9。生物活性多肽是具有适合预期目的的任何活性的多肽。在一个非限制性实例中,生物活性多肽可包括细胞死亡多肽。任何合适的细胞死亡多肽都可以与本公开的多肽连接,包括但不限于半胱天冬酶。本文公开的多肽能够结合金刚烷胺。因此,例如,多肽可以在用于细胞治疗的细胞中表达;然后可以将金刚烷胺施用于受试者以促进主治医务人员认定合适的用于细胞治疗的细胞的细胞死亡。本公开的多肽和生物活性多肽可以通过任何合适长度或氨基酸组成的氨基酸接头连接,如认定适合于预期用途。
在一个实施方式中,本文任何实施方式或实施方式组合的多肽或融合蛋白结合或嵌入脂质膜。在一个这样的实施方式中,多肽或融合蛋白在细胞表面表达。该实施方式可用于如上所述的细胞疗法。
在另一个实施方式中,本公开提供了本文公开的任何实施方式或实施方式组合的多肽或融合蛋白,其中所述多肽或融合蛋白是单体或同源三聚体。如示例中所述,本公开的多肽结合金刚烷胺并可形成同源三聚体。
在另一个实施方式中,本公开提供了与金刚烷胺结合的本文公开的任何实施方式或实施方式组合的同源三聚体多肽或融合蛋白。此类结合复合物可以例如在如上所述的细胞治疗过程中形成。用于检测这种结合的结合特征和测定法在所附实施例中详细举例说明。在各种非限制性实施方式中,结合的检测可以通过差示扫描荧光法、核磁共振、X射线和中子散射研究进行。
在另一方面,本公开提供了编码本公开的任何实施方式或实施方式组合的多肽或融合蛋白的核酸。核酸序列可包含基因组或cDNA形式的单链或双链RNA或DNA,或DNA-RNA杂交体,其各自可包括化学或生物化学修饰的、非天然的或衍生的核苷酸碱基。此类核酸序列可包含用于促进编码多肽的表达和/或纯化的额外序列,包括但不限于polyA序列、修饰的Kozak序列和编码表位标签、输出信号和分泌信号、核定位信号以及质膜定位信号的序列。基于本文的教导,什么核酸序列将编码本公开的多肽或融合蛋白对于本领域技术人员将是显而易见的。
在另一方面,本公开提供了包含与合适的控制序列可操作地连接的本公开的任何方面的核酸的表达载体。“表达载体”包括将核酸编码区或基因可操作地连接到能够影响基因产物表达的任何控制序列的载体。与本公开的核酸序列可操作地连接的“控制序列”是能够影响核酸分子表达的核酸序列。控制序列不需要与核酸序列相邻,只要它们起到指导其表达的作用。因此,例如,插入的未翻译但转录的序列可以存在于启动子序列和核酸序列之间,并且启动子序列仍然可以被认为与编码序列“可操作地连接”。其他此类控制序列包括但不限于聚腺苷酸化信号、终止信号和核糖体结合位点。这种表达载体可以是任何类型,包括但不限于质粒和基于病毒的表达载体。用于在哺乳动物系统中驱动所公开的核酸序列表达的控制序列可以是组成型的(由多种启动子中的任一种驱动,包括但不限于CMV、SV40、RSV、肌动蛋白、EF)或诱导型(由许多诱导型启动子中的任一种驱动,包括但不限于四环素、蜕皮激素、类固醇反应性启动子)。表达载体必须可在宿主生物体中作为附加体或通过整合到宿主染色体DNA中进行复制。在各种实施方式中,表达载体可以包括质粒、基于病毒的载体或任何其他合适的表达载体。
在另一方面,本公开提供了包含本文公开的多肽、融合蛋白、核酸、表达载体(即:附加型或染色体整合)、多肽或融合蛋白的宿主细胞,其中宿主细胞可以是原核或真核的。可以使用包括但不限于细菌转化、磷酸钙共沉淀、电穿孔或脂质体介导的、DEAE葡聚糖介导的、聚阳离子介导的或病毒介导的转染。在一个实施方式中,宿主细胞在细胞表面表达多肽或融合蛋白。
在另一方面,本公开提供了药物组合物,其包含本文公开的任何实施方式或实施方式组合的多肽、融合蛋白、核酸、表达载体和/或宿主细胞,以及药学上可接受的载体。本公开的药物组合物可用于例如下文所述的本公开的方法中。除了本公开的多肽之外,药物组合物可以包含:(a)冻干保护剂;(b)表面活性剂;(c)填充剂;(d)张力调节剂;(e)稳定剂;(f)防腐剂和/或(g)缓冲剂。在一些实施方式中,药物组合物中的缓冲液是Tris缓冲液、组氨酸缓冲液、磷酸盐缓冲液、柠檬酸盐缓冲液或乙酸盐缓冲液。药物组合物还可包含冻干保护剂,例如蔗糖、山梨糖醇或海藻糖。在某些实施方式中,药物组合物包含防腐剂,例如苯扎氯铵、苄索氯铵、氯己定、苯酚、间甲酚、苯甲醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯丁醇、邻甲酚、对甲酚、氯甲酚、硝酸苯汞、硫柳汞、苯甲酸及其各种混合物。在其他实施方式中,药物组合物包含填充剂,如甘氨酸。在其他实施方式中,药物组合物包含表面活性剂,例如聚山梨醇酯-20、聚山梨醇酯-40、聚山梨醇酯-60、聚山梨醇酯-65、聚山梨醇酯-80、聚山梨醇酯-85、泊洛沙姆-188、脱水山梨糖醇单月桂酸酯、脱水山梨糖醇单棕榈酸酯、脱水山梨糖醇单硬脂酸酯、脱水山梨糖醇单油酸酯、脱水山梨糖醇三月桂酸酯、脱水山梨糖醇三硬脂酸酯、脱水山梨糖醇三油酸酯或其组合。药物组合物还可包含张力调节剂,例如使制剂与人血基本等渗或等渗的化合物。示例性张力调节剂包括蔗糖、山梨糖醇、甘氨酸、甲硫氨酸、甘露糖醇、右旋糖、肌醇、氯化钠、精氨酸和精氨酸盐酸盐。在其他实施方式中,药物组合物另外包含稳定剂,例如当与感兴趣的蛋白质组合时基本上防止或降低冻干或液体形式的感兴趣蛋白质的化学和/或物理不稳定性的分子。示例性稳定剂包括蔗糖、山梨糖醇、甘氨酸、肌醇、氯化钠、甲硫氨酸、精氨酸和精氨酸盐酸盐。
多肽、融合蛋白、核酸、表达载体和/或宿主细胞可以是药物组合物中唯一的活性剂,或者组合物可以进一步包含一种或多种适用于预期用途的其他活性剂。本公开的多肽、融合蛋白、核酸、表达载体、宿主细胞和药物组合物可用于任何合适的目的,如本文中详细描述的。
在另一方面,本公开提供了本文公开的多肽、融合蛋白、核酸、表达载体、宿主细胞或药物组合物用于任何合适目的的用途,包括但不限于作为细胞或基因治疗的安全开关。
如本文实施例所示,本发明人已证明本文公开的多肽能够结合金刚烷胺,因此可用作例如细胞或基因治疗的安全开关。例如,多肽可以与细胞死亡蛋白(促凋亡蛋白等)连接并在用于细胞治疗的细胞中表达;然后可以将金刚烷胺施用于受试者以促进用于细胞疗法的细胞的细胞死亡。在一个实施方式中,多肽或融合蛋白存在于细胞表面。
实施例
我们使用全新蛋白质设计来创建与小分子药物金刚烷胺结合的同源三聚体蛋白质。X射线结构与设计模型非常接近,中子结构概括了设计的氢键网络(数据未显示),溶液NMR数据显示金刚烷胺结合引起局部结构变化(数据未显示)。C3对称蛋白质界面处的小分子结合是计算机蛋白质设计的进步。
尽管三聚体在促凋亡和促炎信号级联反应中很重要,但尚未开发出化学诱导的三聚体系统。因此,小分子诱导型三聚体的设计是对具有相当实际相关性的全新蛋白质设计的挑战。
我们着手设计三聚体蛋白质,这些蛋白质在其对称轴上以三重对称性结合小分子。我们专注于C3对称化合物金刚烷胺,因为它是FDA批准的具有低副作用的药物9。为了全新设计蛋白质三聚体C3轴上的金刚烷胺结合位点,我们从参数化生成的C3对称螺旋束主链开始,该主链由两个同心环组成,每个环具有三个螺旋。蛋白质支架和金刚烷胺的对称轴对齐,其余两个自由度(沿对称轴放置,并绕该轴旋转)通过网格搜索采样(图1中的a)。对于每个位置,RosettaDesignTM用于优化金刚烷胺内残基的身份和构象以实现高亲和力结合,以及超过的残基构象距离以保留由Rosetta HBNetTM识别的氢键网络(图1中的b-c)。我们发现了一种特别低能量的溶液,从先前具有高分辨率晶体结构(2L6HC3_13)10的特征设计开始。(图1中的a)。我们将这种溶液称为ABP(金刚烷胺结合蛋白),它包含从Ser-71到金刚烷胺极性氨基的氢键以及由Ile-64、Leu-67和Ala-68组成的形状互补结合袋(图1中的b)。
获得了编码ABP的合成基因,并在大肠杆菌中表达了蛋白质。该设计在可溶性部分中以高水平表达,并且被SEC-MALS发现在存在和不存在金刚烷胺的情况下是三聚体(图2中的a)。使用热荧光染料结合测定(差示扫描荧光法)探测与金刚烷胺的相互作用。apo-ABP的热荧光熔解曲线在25℃下显示出高初始荧光信号(图2中的b),表明蛋白质核心中的疏水残基暴露于溶剂。当蛋白质加热到95℃时,荧光信号降低,对应于更高温度下的蛋白质聚集。在金刚烷胺(1mM)存在下,初始荧光信号低得多,这是正确折叠的蛋白质的特征(图2中的b),表明金刚烷胺结合可能导致局部排序并排除溶剂。相比之下,2L6HC3_13具有相同的骨架参数但缺乏金刚烷胺结合位点,通过热荧光测定是热稳定的,仅在~80℃时才开始变性(图2中的b)。正如预期的,金刚烷胺对2L6HC3_13的熔解曲线没有影响,表明与ABP的相互作用是通过设计的结合位点(图2中的b)。ABP在25℃的CD光谱表明全ɑ-螺旋结构,在222nm和208nm处具有负谱带,在190nm处具有正谱带(图2中的c)。当样品加热到95℃时,观察到CD信号的损失,这在1mM金刚烷胺存在下没有显著改变(图2中的c、图4)。
我们进行了晶体学研究来表征ABP和金刚烷胺之间的相互作用。结晶筛托盘设置有相同的蛋白质样品,有或没有约五倍摩尔过量的金刚烷胺(7.5mM)。在存在而非不存在金刚烷胺的情况下获得晶体,这与金刚烷胺结合时的排序一致。ABP 金刚烷胺的X射线晶体结构解析为,提供了ABP-金刚烷胺复合结构的高分辨率视图(图3中的a)。晶体结构与设计模型很好地重叠,RMSD为(TMAlign11)(图3中的a)。设计模型和晶体结构之间的主要区别在于金刚烷胺结合区域中螺旋的紧凑性(图3中的a)。对于具有有序水分子的金刚烷胺观察到清晰的电子密度,其介导与ABP中Ser-71残基的氢键合(图3中的b-d)。
我们的结果是蛋白质设计的进步,据我们所知,这是结合C3对称小分子的同源三聚体蛋白质的首次成功全新设计。设计的蛋白质包含氢键网络,其指定三聚体状态和水介导的与金刚烷胺的结合。溶液NMR数据(数据未显示)表明ABP采用稳定、对称的结构并容易与金刚烷胺结合。与金刚烷胺复合的设计蛋白质的高分辨率X射线晶体结构与计算模型非常接近,中子结构(数据未显示)证明了设计的氢键网络的存在。
ABP的突变变体ABP_L6Q以与ABP所述相同方式表达和纯化。ABP_L6Q通过热荧光分析显示出与ABP相似的特征(图6)。与ABP一样,apo-ABP_L6Q的热荧光熔解曲线在25℃时显示出高初始荧光信号,表明蛋白质核心中的疏水残基暴露于溶剂中。当蛋白质加热到95℃时,荧光信号降低,对应于更高温度下的蛋白质聚集。在金刚烷胺(1mM)存在下,初始荧光信号要低得多,这是正确折叠蛋白质的特征,表明金刚烷胺结合可能导致局部排序并排除溶剂(图6)。
在约5倍摩尔过量金刚烷胺(7.5mM)存在下,用ABP_L6Q设置结晶筛盘。ABP_L6Q 金刚烷胺的X射线晶体结构解析为(图7)。观察到Ser-71残基的两种替代构象:一组构象异构体与金刚烷胺形成氢键相互作用,另一组Ser-71残基现在与该突变体中的Q6形成次优氢键。
参考文献
1.Spencer,D.M.等人,Functional analysis of Fas signaling in vivo using synthetic inducers of dimerization.Curr.Biol.6,839–847(1996).
2.Spencer,D.M.,Wandless,T.J.,Schreiber,S.L.&Crabtree,G.R.Controlling signal transduction with synthetic ligands.Science 262,1019–1024(1993).
3.Clackson,T.等人,Redesigning an FKBP–ligand interface to generate chemical dimerizers with novel specificity.
4.Mallet,V.O.等人,Conditional cell ablation by tight control of caspase-3dimerization in transgenic mice.Nat.Biotechnol.20,1234–1239(2002).
5.Guerrero,A.D.,Chen,M.&Wang,J.Delineation of the caspase-9signaling cascade.Apoptosis 13,177–186(2008).
6.Nyanguile,O.,Uesugi,M.,Austin,D.J.&Verdine,G.L.A nonnatural transcriptional coactivator.Proc.Natl.Acad.Sci.U.S.A.94,13402–13406(1997).
7.Stankunas,K.等人,Conditional Protein Alleles Technique Using Knockin Mice and a Chemical Inducer of Dimerization.Mol.Cell 12,1615–1624(2003).
8.Miyamoto,T.等人,Rapid and orthogonal logic gating with a gibberellin-induced dimerization system.Nat.Chem.Biol.8,465–470(2012).
9.Perez-Lloret,S.&Rascol,O.Efficacy and safety of amantadine for the treatment of L-DOPA-induced dyskinesia.J.Neural Transm.125,1237–1250(2018).
10.Boyken,S.E.等人,De novo design of protein homo-oligomers with modular hydrogen-bond network-mediated specificity.Science 352,680–687(2016).
11.Zhang,Y.&Skolnick,J.TM-align:a protein structure alignment algorithm based on the TM-score.Nucleic Acids Res.33,2302–2309(2005).
12.Thomaston,J.L.等人,Inhibitors of the M2 Proton Channel Engage and Disrupt Transmembrane Networks of Hydrogen-Bonded Waters.J.Am.Chem.Soc.140,15219–15226(2018).
13.Wang,J.等人,Molecular dynamics simulation directed rational design of inhibitors targeting drug-resistant mutants of influenza A virus M2.J.Am.Chem.Soc.133,12834–12841(2011).
补充方法:
RosettaDesignTM
使用RosettaDesignTM进行设计计算。RosettaTM软件套件可供学术用户免费使用,并可从RosettaTM Commons网站下载。
最初的2LC3H6_13支架是以前使用参数化设计生成的。简而言之,参数化生成的骨架在RosettaTM中使用笛卡尔空间最小化进行正则化,且HBNetTM协议的一个特殊实例HBNetStapleInterfaceTM用于识别氢键网络的组合。单体亚基的螺旋连接成单链,在C3对称中使用对称RosettaTM序列设计计算设计组装的蛋白质。
为了创建金刚烷胺结合位点,使用RosettaScriptsTM方案和用户定义的配体(.xml)范围内的残基位置设计。RosettaTM约束(.cst)文件用于指定金刚烷胺中的原子对约束。在RosettaDesignTM中为金刚烷胺生成了一个分子参数(.params)文件。金刚烷胺被分裂成三分之一,旋转轴上的氮和碳原子被虚拟化。旋转异构体用LayerDesignTM重新包装,并使用resfile类型(in.res)指定与金刚烷胺氢键合的残基位置处的Ser/Thr。
克隆、蛋白质表达和纯化
ABP在NdeI和XhoI限制性位点被克隆到pET28b( )载体中。将构建体转化到BL21-Star(DE3)感受态细胞中(Life Technologies)。携带质粒的细胞在含有0.05mg/ml卡那霉素终浓度的Terrific BrothTM II培养基中于37℃生长。一旦细胞达到0.6-0.8的OD600,将细胞冷却至18℃并用0.25mM IPTG诱导过夜。在此期间之后,通过在4℃以4000rpm离心10分钟收集细胞。每1L Terrific BrothTM II培养基将细胞沉淀重悬在60ml 25mM Tris(pH 8.0)、300mM NaCl、20mM咪唑(pH 8.0)和1mM PMSF中,并储存在-80℃。
在存在0.25mg/ml溶菌酶的情况下解冻细胞,并在冰上超声破碎60秒。通过在4℃下以13000rpm离心30分钟获得细胞提取物,并将其施加到用洗涤缓冲液(25mM Tris(pH 8.0)、300mM NaCl和20mM咪唑(pH 8.0))平衡的Ni-NTA琼脂糖珠(Qiagen)上。洗涤缓冲液用于以五倍柱体积洗涤镍柱3次。洗涤后,用五倍柱体积的洗脱缓冲液(含有300mM咪唑的洗涤缓冲液)洗脱蛋白质。
洗脱液用SAXS缓冲液(25mM Tris(pH 8.0)、150mM NaCl和2%甘油)进行缓冲液交换,以将咪唑浓度从~300mM降低到<20mM,并用限制级凝血酶(EMD Millipore 69671-3)在20℃过夜。过夜裂解后,将样品流过平衡的Ni-NTA琼脂糖珠并捕获流出物。
通过凝胶色谱法使用用SAXS缓冲液平衡的SuperdexTM 75Increase 10/300GL柱(GE Healthcare)进一步纯化蛋白质样品。使用3K MWCO AmiconTM离心过滤器(Millipore)合并和浓缩含有目标蛋白质的级分。
热荧光测定
在SAXS缓冲液中使用CFX96 TouchTM实时PCR仪(Bio-Rad)进行热荧光测定。使用45μL 5μM蛋白质(含或不含1mM金刚烷胺)和5μL新制备的200X SYPROTM橙(Thermo-Fisher)在SAXS缓冲液中的溶液进行热稳定性测定。温度以0.5℃的增量从25℃升高到95℃,间隔为5s。在FRET扫描模式下读取荧光。从每个样品的三个重复的平均值中减去缓冲液 SYPRO橙色溶液(无蛋白质对照)的三个重复的平均值。
圆二色性
使用JASCOTM J-1500或AVIVTM 420型CD光谱仪测量CD波长扫描(260至195nm)和温度熔解(25至95℃)。温度熔解监测222nm处的吸收信号,并以4℃/min的加热速率进行。在0.1cm比色皿中以0.25mg/mL制备在磷酸盐缓冲盐水(PBS)pH 7.4中的蛋白质样品。
ABP的结晶
将纯化的ABP样品在SAXS缓冲液中浓缩至约13mg/ml,并与7.5mM金刚烷胺(约5倍摩尔过量)一起温育。使用稀疏矩阵方法(Jancarik and Kim,1991)与Phoenix Robot(Art Robbins Instruments,Sunnyvale,CA)利用以下结晶屏幕筛选样品:Morpheus(Molecular Dimensions)、JCSG (Qiagen)和Index(Hampton Research)。在结晶条件JCSG B9下获得晶体:0.1M柠檬酸(4.0),20%w/v PEG 6000(最终pH 5.0)。在1至14天后通过坐滴蒸气扩散法获得晶体,液滴由0.2μL蛋白质溶液和0.2μL储液溶液的1:1混合物组成。
ABP的X射线衍射采集和结构测定
将ABP晶体置于含有20%(v/v)甘油的储存溶液中,然后在液氮中快速冷却。X射线数据集是在阿贡国家实验室(ANL)的高级光子源(APS)的光束线19-ID处以的波长收集的。使用HKL200018对数据集进行索引和缩放。所有的设计结构都是通过分子置换法用PhenixTM套件20中的程序PHASERTM19确定的,使用设计模型作为初始搜索模型。从分子置换中获得的原子位置和由此产生的电子密度图用于构建设计结构并启动晶体学细化和模型重建。使用phenix.refine21程序进行结构精修。使用COOT22手动重建和添加水分子允许构建最终模型。使用PhenixTM20计算键长、角度和二面角与理想几何形状的均方根偏差差异。使用程序MOLPROBITYTM23评估所有最终模型的整体立体化学质量。该模型在拉马钱德兰图的有利区域显示100%的残基,具有0%的异常值。图是用PymolTM(Pymol Molecular graphics System,2.0版;Schrodinger,LLC)制作的。图5显示了电子密度图代表性区域的立体图像。
序列表
<110> 华盛顿大学
<120> 金刚烷胺结合蛋白
<130> 19-142-PCT (UW 48521.02WO2)
<150> US 62/834,592
<151> 2019-04-16
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 75
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 1
Asp Ala Gln Asp Lys Leu Lys Tyr Leu Val Lys Gln Leu Glu Arg Ala
1 5 10 15
Leu Arg Glu Leu Lys Lys Ser Leu Asp Glu Leu Glu Arg Ser Leu Glu
20 25 30
Glu Leu Glu Lys Asn Pro Ser Glu Asp Ala Leu Val Glu Asn Asn Arg
35 40 45
Leu Asn Val Glu Asn Asn Lys Ile Ile Val Glu Val Leu Arg Ile Ile
50 55 60
Leu Glu Leu Ala Lys Ala Ser Ala Lys Leu Ala
65 70 75
<210> 2
<211> 97
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<220>
<221> 尚未归类的特征
<222> (1)..(10)
<223> 可选的残基
<220>
<221> 尚未归类的特征
<222> (11)..(21)
<223> 可选的残基
<400> 2
Met Gly Ser Ser His His His His His His Ser Ser Gly Leu Val Pro
1 5 10 15
Arg Gly Ser His Met Gly Asp Ala Gln Asp Lys Leu Lys Tyr Leu Val
20 25 30
Lys Gln Leu Glu Arg Ala Leu Arg Glu Leu Lys Lys Ser Leu Asp Glu
35 40 45
Leu Glu Arg Ser Leu Glu Glu Leu Glu Lys Asn Pro Ser Glu Asp Ala
50 55 60
Leu Val Glu Asn Asn Arg Leu Asn Val Glu Asn Asn Lys Ile Ile Val
65 70 75 80
Glu Val Leu Arg Ile Ile Leu Glu Leu Ala Lys Ala Ser Ala Lys Leu
85 90 95
Ala
<210> 3
<211> 87
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<220>
<221> 尚未归类的特征
<222> (1)..(12)
<223> 可选的残基
<400> 3
Ser Ser Gly Leu Val Pro Arg Gly Ser His Met Gly Asp Ala Gln Asp
1 5 10 15
Lys Leu Lys Tyr Leu Val Lys Gln Leu Glu Arg Ala Leu Arg Glu Leu
20 25 30
Lys Lys Ser Leu Asp Glu Leu Glu Arg Ser Leu Glu Glu Leu Glu Lys
35 40 45
Asn Pro Ser Glu Asp Ala Leu Val Glu Asn Asn Arg Leu Asn Val Glu
50 55 60
Asn Asn Lys Ile Ile Val Glu Val Leu Arg Ile Ile Leu Glu Leu Ala
65 70 75 80
Lys Ala Ser Ala Lys Leu Ala
85
<210> 4
<211> 87
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<220>
<221> 尚未归类的特征
<222> (1)..(7)
<223> 可选的残基
<400> 4
Ser Ser Gly Leu Val Pro Arg Gly Ser His Met Gly Asp Ala Gln Asp
1 5 10 15
Lys Leu Lys Tyr Leu Val Lys Gln Leu Glu Arg Ala Leu Arg Glu Leu
20 25 30
Lys Lys Ser Leu Asp Glu Leu Glu Arg Ser Leu Glu Glu Leu Glu Lys
35 40 45
Asn Pro Ser Glu Asp Ala Leu Val Glu Asn Asn Arg Leu Asn Val Glu
50 55 60
Asn Asn Lys Ile Ile Val Glu Val Leu Arg Ile Ile Leu Glu Leu Ala
65 70 75 80
Lys Ala Ser Ala Lys Leu Ala
85
<210> 5
<211> 80
<212> PRT
<213> 人工序列
<220>
<223> 合成多肽
<400> 5
Gly Ser His Met Gly Asp Ala Gln Asp Lys Leu Lys Tyr Leu Val Lys
1 5 10 15
Gln Leu Glu Arg Ala Leu Arg Glu Leu Lys Lys Ser Leu Asp Glu Leu
20 25 30
Glu Arg Ser Leu Glu Glu Leu Glu Lys Asn Pro Ser Glu Asp Ala Leu
35 40 45
Val Glu Asn Asn Arg Leu Asn Val Glu Asn Asn Lys Ile Ile Val Glu
50 55 60
Val Leu Arg Ile Ile Leu Glu Leu Ala Lys Ala Ser Ala Lys Leu Ala
65 70 75 80
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
