1.本技术涉及微藻生物领域,尤其涉及一种高密度高产率的紫球藻培养方法。
背景技术:
2.紫球藻(porphyridium)是一种在不同生长阶段呈现紫红色或深红色的单细胞微藻,属红藻门、原红藻纲、紫球藻目、紫球藻科、紫球藻属。它具有极强的环境适应性和快速繁殖能力,广泛分布于世界各地水域及潮湿的土壤中,有较强的抗盐性,对盐度适应范围较宽,35
‰
~46
‰
间对生长无显著影响。藻细胞常不规则聚集在一起,外被一层薄胶膜,干时呈皮壳状。紫球藻以细胞分裂营无性生殖,细胞通常呈球形,细胞直径5~24μm,血红色或暗紫红色,具1个轴生星状或不规则形状的色素体及1个无鞘的蛋白核。紫球藻生长适宜温度13~31℃,最适温度21~26℃,低温胁迫可促进长链脂肪酸合成,但会降低生物量。紫球藻在ph 5.3~8.3之间均可生长,7.5最适宜。在黑暗条件下几乎不生长,对光暗循环无特别要求,持续光照有利于生长,一定范围内光强增加可促进生长。
3.紫球藻具有较高的培养价值,在生长过程中能合成许多生物活性物质,如藻胆蛋白、多不饱和脂肪酸(pufa)及胞外多糖物质,蛋白质最高约占生物量50%,其中84%为藻胆蛋白,特别是b
‑
藻胆蛋白性质稳定;可积累20~50%生物量的多糖,其中部分分泌至胞外,它由木糖,葡萄糖,半乳糖等构成;脂肪酸约占生物量9.5%,50%以上为不饱和脂肪酸,其中花生四烯酸(ara)约占总脂36%。在医药、化妆品、食品、保健品、饲料、精细化工、纺织印染、石油等领域均展现出广阔的应用前景和巨大的市场空间。
4.虽然紫球藻具有极高的价值,但其大规模培养及产业化应用仍未实现。传统上紫球藻培养采用开放型跑道式大池、平板式光生物反应器、薄膜吊袋式光生物反应器培养等,光照强度和温度完全依赖大自然,生产受季节影响大,生长慢,易被蓝藻、颤藻等杂藻污染,反应器清洗困难,操作繁琐,成本高,基础投入大,产量低,产品质量差。
5.在实现本发明的过程中,发明人发现现有技术中至少存在如下问题:
6.(1)细胞密度低、产率低
7.紫球藻生长会经过延滞期、对数生长期、稳定期以及衰亡期等四个时期,培养中后期细胞外形成一层厚厚的粘性鞘膜,尤其是当细胞进入生长稳定期后,能大量的向胞外分泌藻多糖,平均分子量200~700万道尔顿,它相对于其他多糖具有更高的粘度,且与培养基互溶,使得培养液呈现高度粘稠状。高粘度不利于营养物质传递交换和代谢废物(如氧气)的排出,这进一步导致细胞分泌更多粘性多糖进行自我保护。因此紫球藻的培养密度都比较低,尤其在低接种量、长延滞期的条件下。经过1~2个月胞外多糖含量达到稳定,这种低效率的培养方式难以用于规模化生产。
8.另一方面,虽然可以通过优化培养基组成配比或者加入能诱导特定产物积累的培养基成分,并综合其他手段(如缺氮、缺磷、强光胁迫等)诱导产物合成,提高产物质量百分含量。但另一方面,通常在胁迫条件下,细胞生长受到抑制,细胞产率会有所降低。因此综合来看,产物的产率并不能显著提升。
9.(2)无法兼顾目标产物
10.目前普遍认为“紫球藻细胞进入生长稳定期后,向胞外分泌多糖并形成胶质鞘”,此处指的生长稳定期相对模糊,其实质是细胞进入衰退期的开始,细胞活力下降,细胞分裂速率及胞内蛋白等主成分的合成能力下降,多糖分泌是细胞自我保护的机制,满足最低保护需求后,便不再持续分泌。因此通常可以观察到长达1~2个月的培养只能产生0.2~0.6g l
‑1的胞外多糖含量。
11.由上述可知,紫球藻胞外多糖的生产与高藻红蛋白含量的紫球藻生物质的生产不能同时兼顾。现有技术在培养紫球藻生产胞外多糖的同时,细胞分裂减慢或停止,细胞藻红蛋白含量会急剧降低,因此,无法获取高藻红蛋白含量的紫球藻生物质。相反,当利用较优条件培养紫球藻时,可以获得高藻红蛋白含量的紫球藻生物质,但此时紫球藻却分泌极少的胞外多糖或者不分泌胞外多糖。
12.(3)无法循环利用培养液,浪费大、污染大
13.传统的一步法(批次)培养工艺中,培养基难以循环利用,造成原料浪费。不经处理排放则会造成受纳水体污染,对培养液进行水处理则会大幅增加生产成本,制约产业化发展。
14.(4)单位能耗高、成本高
15.无论采用批次培养还是半连续培养,一般采用高速离心的方式进行藻细胞的采收,由于培养密度低、水体体积大,因此能耗极高,极大地推高了成本。尤其是批次采收时,生产负荷较大,高速离心设备需要长时间高负荷运行,人员需要长时间加班,存在无法及时采收而浪费藻液的情况。这些都导致培养效率较低,成本较高。
技术实现要素:
16.本技术实施例的目的是提供一种高密度高产率的紫球藻培养方法,以解决背景技术中存在的问题。
17.根据本技术实施例的一种高密度高产率的紫球藻连续培养方法,包括:
18.步骤一:在光生物反应器中将紫球藻高密度培养至对数期的中后期;
19.步骤二:对高密度藻液中的藻细胞部分进行连续采收;
20.步骤三:对连续采收所得的上清液中的可溶性胞外多糖进行采收,并将采收后的清液回补至所述光生物反应器中;
21.步骤四:控制向所述光生物反应器流加培养基浓缩液的速度;
22.重复以上步骤二~四直至培养终止。
23.可选的,所述光生物反应器为平板式反应器、水平管式反应器、柱式鼓泡反应器或其他用于微藻培养的反应容器;优选为柱式鼓泡反应器或水平管式反应器。
24.可选的,所述高密度培养包括以下步骤:
25.配制培养基、灭菌或除菌、接种、培养盐浓度检测、生长指标及产物检测。
26.可选的,所述的将紫球藻高密度培养至对数期中后期具体为:将紫球藻接种到光生物反应器中已经无菌化的微藻培养基中,初始接种藻细胞量2.5
×
107ml
‑1,连续鼓入含有二氧化碳的气体,在温度15~30℃、自然光照条件下培养或者光照强度400μe m
‑2s
‑1条件下培养,至对数期中后期。
27.可选的,所述的含有二氧化碳的气体中二氧化碳的浓度优选为2~5%。
28.可选的,所述的高密度培养的培养基为海水培养基或asw培养基,优选为asw培养基,每升asw培养基中含有硝酸钠0.5~2.0g、磷酸二氢钾0.05~0.3g、三氯化铁1~4mg,余量为海水,优选每升asw培养基中含有硝酸钠1.5g、磷酸二氢钾0.1g、三氯化铁2.4mg,余量为海水。
29.可选的,所述紫球藻包括紫球藻目海洋和淡水微藻,更优选为紫球藻属的微藻,更优选为血色紫球藻(porphyridium cruentum)。
30.可选的,所述接种的初始接种量为0.8g l
‑1以上,优选2g l
‑1以上。
31.可选的,所述对数期的中后期是指培养细胞密度超过10g l
‑1,更特别地,超过20g l
‑1。
32.可选的,所述连续采收为浓缩、离心、过滤、絮凝中的一种或者几种组合,优选低速离心配合膜过滤的方法。
33.可选的,所述低速离心是指离心力不超过5000
×
g,特别地,不超过3000
×
g;所述的膜过滤为微滤,膜孔径1~100μm,更优选地,2~10μm。
34.所述的低速离心采用包括蝶式离心机、卧式螺旋离心机、三足式离心机、吊袋式离心机等,可以采用连续出料或者间隙式出料方式;
35.所述过滤用的设备包括隔膜压滤机、凹盖袋式过滤器、刮刀自清洗过滤器、转鼓微滤机等,孔径小于10μm。
36.所述离心和膜过滤获得的藻泥利用无菌水进行清洗脱除表面的盐分,减少杂质。
37.所述过滤的设备为市售,特别地,本实施例中相关膜设备购自浙江澳尔特机械有限公司。所述实验室离心设备购自sigma公司,中试离心设备购自江苏华大离心机制造有限公司。
38.可选的,采收上清液中的可溶性胞外多糖,包括:
39.将上清液用超滤膜进行过滤脱盐并浓缩,超滤膜孔径50~200nm,操作压力为2~5bar,温度为30~90℃,回收超滤膜多糖浓缩液和透析液;利用无菌水对多糖浓缩液进行洗涤再浓缩,获得不含盐分的多糖浓缩液;超滤膜过滤后所获透析液回流到所述光生物反应器。
40.具体地,所述超滤截留紫球藻多糖的步骤包括选取超滤膜,例如陶瓷膜过滤,包括将上清液用50~200nm的陶瓷膜对其进行脱盐并浓缩,操作压力为2~5bar,温度为30~90℃,回收陶瓷膜浓缩液(多糖浓缩液)和陶瓷膜透析液(培养清液);此外还包括利用无菌水对多糖浓缩液进行1~3次洗涤再浓缩,获得不含盐分的多糖浓缩液。所获透析液合并回流到光生物反应器。
41.可选的,控制向所述光生物反应器流加培养基浓缩液的速度,包括:
42.配置培养基的5~30倍浓缩液,根据离线检测的结果,培养基浓度的偏离度超过设定值的
‑
10%,则流加相应的浓缩液,使得培养基的终浓度维持在设定值的
±
5%以内。
43.在步骤三中在收集完清液中的可溶性胞外多糖后,上清中仍含有氮、磷、硫、铁及微量元素等营养成分,因此无需补充营养成分,亦即无需检测上清中含量及衡算、称量、配置培养基的操作,便可使其成为可以重复利用的培养基。
44.本技术围绕高产率的目标,基于紫球藻生长的特殊性,提出有针对性的可应用的
培养方法。营养充足且高接种密度条件下,紫球藻细胞可以快速分裂,在非常短的时间内达到较高的细胞密度,细胞高密度是胞外多糖分泌的基础,同时,由于藻红蛋白是藻细胞光合作用的主要元器件,生长状态较好的藻细胞内,藻红蛋白也处于较高水平。因此,本发明首先利用较优的培养条件,培养紫球藻,使其快速增殖,足够的细胞数量,即使产物含量适中,也可以保证高产率。因此高密度是高产率的前提和基础,而且高密度细胞是具有活力的细胞,细胞产率相应地也高。针对胞外多糖对细胞生长的影响,创造性提出在培养过程中及时采收胞外多糖的组分,并实现培养液的回用。一方面维持了高密度的培养体系,另一方面实现了产物的高产率收获。从而实现了紫球藻的高密度高产率连续培养。
45.本技术的实施例提供的技术方案可以包括以下有益效果:
46.(1)本发明可以连续、高效、低成本地同步生产紫球藻胞外多糖与含有藻红蛋白和不饱和脂肪酸的紫球藻生物质。弥补了批次培养后期营养物质容易缺乏、藻细胞的生长和增殖受到限制的缺点。连续培养使反应器内的细胞生长环境处于恒定状态,使培养液中营养盐浓度维持在合适水平,既能减轻较高初始营养盐浓度引起的抑制和毒害作用,使藻体生长的延滞期大大缩短,又能有效解决批次培养中营养盐限制问题,保证营养盐的持续供给使微藻长时间处于对数生长期,提高了增殖效率。由于是连续回流且流加补充营养液,因此对藻细胞培养环境的影响最小,培养条件稳定,ph、盐度、营养盐浓度的变化微小。对培养条件无需适应过程,从而提高了生产效率。本技术公开的方法具有较高的细胞密度及产物产率。
47.(2)本发明可以完全利用人工光或者自然光进行生产,整个培养工艺对能耗的需求极低,放大容易,非常适用于规模化生产。
48.(3)培养基可以部分循环利用,减少原料投入,可以达标排放以降低对环境的污染。
49.连续培养保证了紫球藻对营养盐中必需养分的充分摄取,而且操作简单、方便、易行。使得紫球藻细胞生长过程中始终保持合适的营养盐浓度,
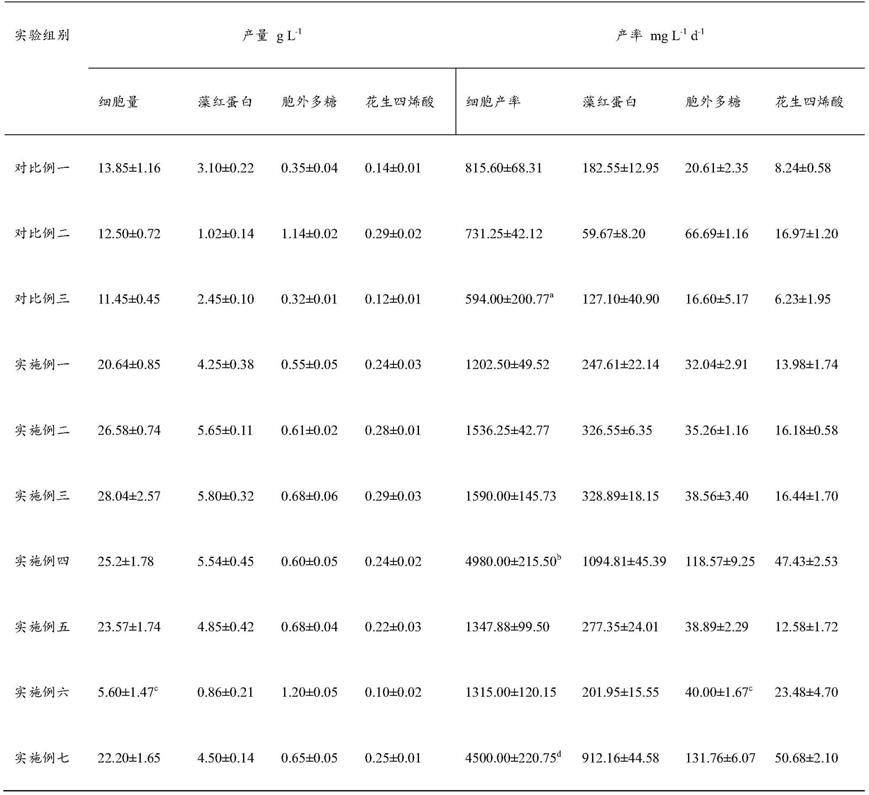
50.(4)降低生产负荷。培养同步耦合了采收、产物分离操作。提高了采收单元的利用率,减少了工作强度,减少了批次培养对下游工序的冲击。尤其是紫球藻液特性(粘度大、分离系数小、密度低、剪切敏感)所导致的采收困难和处理周期长等巨大挑战得以解决。
51.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本技术。
附图说明
52.此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本技术的实施例,并与说明书一起用于解释本技术的原理。
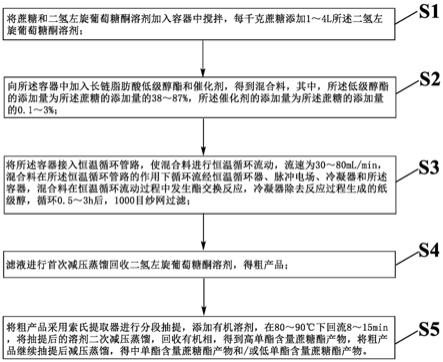
53.图1为本发明实施例提供的一种高密度高产率连续培养紫球藻的流程示意图;
54.图2为本发明对比例1~3培养过程曲线图;
55.图3为本发明实施例提供的一种高密度培养紫球藻的培养过程曲线对比图;
56.图4为本发明实施例提供的高密度高产率连续培养紫球藻的培养过程曲线对比图;
57.图5为本发明实施例提供的高密度高产率培养紫球藻的连续放大培养过程曲线对
比图;
58.图6为本发明实施例提供高的密度高产率连续培养紫球藻的细胞干重及产物含量对比图;
59.图7为本发明实施例提供的一种高密度高产率培养紫球藻的连续培养细胞及藻红蛋白产率对比图;
60.图8为本发明实施例提供的一种高密度高产率培养紫球藻的连续培养胞外多糖及花生四烯酸产率对比图。
具体实施方式
61.下面将结合本发明的实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
62.下面结合流程图(附图1)对本发明的反应器进行进一步的说明:
63.一种高密度高产率的紫球藻的连续培养法,包括以下步骤:
64.步骤一:在光生物反应器中将紫球藻高密度培养至对数期的中后期;
65.步骤二:对高密度藻液中的藻细胞部分进行连续采收;
66.步骤三:对连续采收所得的上清液中的可溶性胞外多糖进行采收,并将采收后的清液回补至所述光生物反应器中;
67.步骤四:控制向所述光生物反应器流加培养基浓缩液的速度;
68.重复以上步骤二~四直至培养终止。
69.其中,步骤一:在光生物反应器中将紫球藻高密度培养至对数期的中后期。该步骤的目的是使紫球藻快速分裂,迅速进入生长对数期并达到较高的细胞密度,并基于细胞量产生较高的胞内蛋白、多不饱和脂肪酸及胞外多糖浓度,即达到符合经济性的采收浓度。培养条件包括:初始接种量细胞浓度、培养基种类、营养盐浓度、温度、光照,可在室内或户外培养,任何单一培养条件或者几种培养条件的组合,尤其是提高初始细胞接种量,除了显著缩短培养延滞期,另一意料之外的效果是产生细胞群体效应,能提高培养的终密度并利用本技术说明书公开的实施例中的方法稳定维持。一般地,适合于培养单细胞藻类的培养基都可用于紫球藻的培养,这些培养基包括人工海水培养基asw、koch培养基、harder
‑
bederke培养基、pringshein i培养基和pringsheinii培养基等。特别的,连续培养周期不少于3个月。
70.其中,步骤二,对高密度藻液中的藻细胞部分进行连续采收。连续采收使用低速离心配合膜过滤法,获得藻红蛋白含量高、中等及以上含量的不饱和脂肪酸的藻细胞。该步骤的目的为采收含有目标产物的藻细胞,实现对藻红蛋白、不饱和脂肪酸尤其是花生四烯酸的收获。充分利用离心与膜过滤的各自优点,实现对上述藻细胞的采收。低速离心(≤3000
×
g)减小了剪切对细胞的损伤作用防止细胞破碎和胞内物质外流对上清液的品质及其进一步下游处理流程的影响。微滤方法保证了上清液中不含有藻细胞,方便下一步骤中对上清液中多糖的收获,最大限度地减少了多糖中的杂质。
71.其中,步骤三,对连续采收所得的上清液中的可溶性胞外多糖进行采收,并将采收
后的清液回补至所述光生物反应器中。采用陶瓷膜超滤过滤方法,获得紫球藻胞外多糖。该步骤的主要目的在于收获胞外多糖,并对其进行脱盐处理,减少多糖对盐分的吸附,从而提高多糖的纯度,方便进一步的多糖纯化的操作。而且采用更换陶瓷膜孔径的方式,可以获得不同分子量的胞外多糖。同时获得可以回流至培养系统的可供藻细胞培养使用的含有营养元素的清液。
72.其中,步骤四,控制向所述光生物反应器流加培养基浓缩液的速度。流加浓缩培养基维持培养液中氮、磷等含量稳定。配置培养基的5~30倍浓缩液,根据离线检测的结果,偏离度超过设定值的
‑
10%,则流加相应的浓缩液,使得培养液中终浓度维持在设定值的
±
5%以内。5~30倍浓缩培养基采用海水配置并进行高压蒸汽灭菌或过滤除菌。流加方式包括滴加、蠕动泵、注射等方式,控制方式包括手动控制及自控控制。
73.本实施例中,所述光生物反应器为平板式反应器、水平管式、柱式及其他用于微藻培养的反应容器。优选为柱式鼓泡反应器和水平管式反应器。
74.本发明所述的一种微藻培养过程,主要包括按照配方进行特定体积的培养基的配制、高压蒸汽灭菌或者过滤除菌、接种、过程检测、藻液采收、清液回用等步骤。
75.本说明书所述细胞干重、胞外多糖、藻红蛋白含量及脂肪酸的测定方法详见相关教科书及公开的文献材料。更具体地,细胞干重通过重量差法测定;胞外多糖的含量通过苯酚
‑
硫酸法测定;提取纯化后的藻红蛋白用bradford试剂盒定量测定;脂肪酸通过索氏提取法甲酯化后利用气相色谱方法进行测定,对照标准出峰确定并计算相应的脂肪酸含量。
76.表1对比例及实施例培养实验的产量及产率结果
[0077][0078]
注:a:以半连续阶段(16~26天)计;b:以连续培养阶段(12~90天)计;c:以培养结束时(30天)计;d:以连续阶段(12~90天)计。
[0079]
对比例一(常规培养)
[0080]
在小试1l玻璃鼓泡柱式反应器中开展对比实验,反应器规格尺寸如下;内径46mm,壁厚2mm,高度600mm。装液量700ml。双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2mm的不锈钢管伸入反应器底部进行鼓泡通气。
[0081]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为700ml,接种密度为0.8g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为0.14l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。藻细胞终密度达到13.85g l
‑1,体积产率为0.82g l
‑1d
‑1。测定获得藻红蛋白含量3.10g l
‑1,体积产率182.55mg l
‑1d
‑1。胞外多糖含量0.35g l
‑1,体积产率20.61mg l
‑1d
‑1。花生四烯酸含量140.10mg l
‑1,体积产率8.24mg l
‑1d
‑1。
[0082]
对比例二(两步法培养)
[0083]
在与对比例相同的1l玻璃鼓泡柱式小试反应器中开展对比实验。双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2mm的不锈钢管伸入反应器底部进行鼓泡通气。
[0084]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为700ml,接种密度为0.8g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为0.14l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。藻细胞终密度达到13.75g l
‑1,此时将藻液离心并用不含硝酸钾的asw培养基悬浮细胞,置于反应器表面光照强度800μe m
‑2s
‑1处。继续进行强光缺氮胁迫诱导10天。
[0085]
培养26天,藻细胞体积产率为0.73g l
‑1d
‑1。测定获得藻红蛋白含量1.02g l
‑1,体积产率59.67mg l
‑1d
‑1。胞外多糖含量显著提高,至1.14g l
‑1,体积产率66.69mg l
‑1d
‑1。花生四烯酸含量0.29g l
‑1,体积产率16.97mg l
‑1d
‑1。
[0086]
对比例三(半连续培养)
[0087]
在与对比例相同的1l玻璃鼓泡柱式小试反应器中开展对比实验。双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2mm的不锈钢管伸入反应器底部进行鼓泡通气。
[0088]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为700ml,接种密度为1.4g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为0.14l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。藻细胞终密度达到13.68g l
‑1,采收约1/5体积的藻液并补加新鲜asw培养基后继续培养。后又重复两次。
[0089]
以半连续阶段(10天)计算平均体积产率为0.59g l
‑1d
‑1。测定获得藻红蛋白含量2.45g l
‑1,体积产率127.10mg l
‑1d
‑1。胞外多糖含量0.32g l
‑1,体积产率16.60mg l
‑1d
‑1。花生四烯酸含量0.12g l
‑1,体积产率6.23mg l
‑1d
‑1。
[0090]
实施例一(提高接种密度)
[0091]
在与对比例相同的1l玻璃鼓泡柱式小试反应器中开展对比实验。双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2mm的不锈钢管伸入反应器底部进行鼓泡通气。
[0092]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为700ml,接种密度提高到1.4g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为0.14l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。培养16天藻细胞终密度达到20.64g l
‑1,体积产率为1202.5mg l
‑1d
‑1。测定获得藻红蛋白含量4.25g l
‑1,体积产率247.61mg l
‑1d
‑1。胞外多糖含量0.55g l
‑1,体积产率32.04mg l
‑1d
‑1。花生四烯酸含量0.24g l
‑1,体积产率13.98mg l
‑1d
‑1。
[0093]
实施例二(提高接种密度2)
[0094]
在与对比例相同的1l玻璃鼓泡柱式小试反应器中开展对比实验。双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2mm的不锈钢管伸入反应器底部进行鼓泡通气。
[0095]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为700ml,接种密度为2g l
‑1。通入含co2体积分数为5%的空气
二氧化碳混合气,通气量为0.14l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。培养16天藻细胞终密度达到26.58g l
‑1,体积产率为1536.25mg l
‑1d
‑1。测定获得藻红蛋白含量5.65g l
‑1,体积产率326.55mg l
‑1d
‑1。胞外多糖含量0.61g l
‑1,体积产率35.26mg l
‑1d
‑1。花生四烯酸含量0.28g l
‑1,体积产率16.18mg l
‑1d
‑1。
[0096]
实施例三(提高接种密度)
[0097]
在与对比例相同的1l玻璃鼓泡柱式小试反应器中开展对比实验。双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2mm的不锈钢管伸入反应器底部进行鼓泡通气。
[0098]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为700ml,接种密度为2.6g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为0.14l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。培养16天藻细胞终密度达到28.04g l
‑1,体积产率为1590.00mg l
‑1d
‑1。测定获得藻红蛋白含量5.80g l
‑1,体积产率328.89mg l
‑1d
‑1。胞外多糖含量0.68g l
‑1,体积产率38.56mg l
‑1d
‑1。花生四烯酸含量0.29g l
‑1,体积产率16.44mg l
‑1d
‑1。
[0099]
实施例四(一步法连续)
[0100]
在与对比例相同的1l玻璃鼓泡柱式小试反应器中开展对比实验。双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2mm的不锈钢管伸入反应器底部进行鼓泡通气。
[0101]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为700ml,接种密度为2.0g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为0.14l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。培养至12天藻细胞终密度达到25.64g l
‑1,开始连续培养过程,连续流出流量为140ml d
‑1,即维持每天的稀释率约为0.2,该藻液使用低速离心(3000
×
g)并利用微滤膜过滤后,用实验室超滤设备过滤后获得清液,将清液转入1l柱式反应器继续培养。每天测定培养液浓度,及时流加10倍浓缩培养基至培养基初始浓度值。整个培养过程再维持60天以上。细胞产率为4980mg l
‑1d
‑1,测定获得藻红蛋白含量5.54g l
‑1,体积产率1094.81mg l
‑1d
‑1。胞外多糖含量0.60g l
‑1,体积产率118.57mg l
‑1d
‑1。花生四烯酸含量0.24g l
‑1,体积产率47.43mg l
‑1d
‑1。
[0102]
实施例五(体积放大)
[0103]
在200l水平管式反应器中开展培养实验。单管外径65mm,壁厚4mm,长度2.8m,约每根6l,双排共12层,总容积约150l,外置交换柱50l,led光,亮度可调,双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2cm的不锈钢通气盘伸入中转罐底部进行鼓泡通气。
[0104]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为200l,接种密度为2.0g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为40l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。藻细胞终密度达到23.57g l
‑1,体积产率为1347.88mg l
‑1d
‑1。测定获得藻红蛋白含量4.85g l
‑1,体积产率
277.35mg l
‑1d
‑1。胞外多糖含量0.68g l
‑1,体积产率38.89mg l
‑1d
‑1。花生四烯酸含量0.22g l
‑1,体积产率12.58mg l
‑1d
‑1。
[0105]
实施例六(不采收多糖)
[0106]
在200l水平管式反应器中开展培养实验。单管外径65mm,壁厚4mm,长度2.8m,约每根6l,双排共12层,总容积约150l,外置交换柱50l,led光,亮度可调,双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2cm的不锈钢通气盘伸入中转罐底部进行鼓泡通气。
[0107]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为200l,接种密度为2.0g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为40l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。培养至12天藻细胞终密度达到21.60g l
‑1,开始连续培养过程,连续流出流量为40l d
‑1,即维持每天的稀释率约为0.2,该藻液使用离心机低速离心(3000
×
g)并利用微滤设备过滤采收藻泥后,上清液不经过陶瓷膜超滤采收胞外多糖,而是将清液直接转入200l水平管式反应器继续培养。每天测定培养液浓度,及时流加10倍浓缩培养基至培养基初始浓度值。由于多糖的持续累积,影响紫球藻生长,在保持恒定稀释率的条件下,洗出效果显著,培养至30天,细胞干重仅为5.6g l
‑1。培养结束时测定获得藻红蛋白含量0.86g l
‑1,胞外多糖含量1.20g l
‑1,花生四烯酸含量0.10g l
‑1。藻液极其粘稠,流动性较差。
[0108]
从12天到30天的培养阶段计算细胞平均产率为1315mg l
‑1d
‑1,藻红蛋白体积产率912.16mg l
‑1d
‑1,花生四烯酸体积产率50.68mg l
‑1d
‑1。由于此阶段未采收到多糖,因此计算整个培养周期的多糖体积产率为40.00mg l
‑1d
‑1。
[0109]
实施例七(放大连续培养)
[0110]
在200l水平管式反应器中开展培养实验。单管外径65mm,壁厚4mm,长度2.8m,约每根6l,双排共12层,总容积约150l,外置交换柱50l,led光,亮度可调,双侧光照射,反应器表面光照强度400μe m
‑2s
‑1。通过直径为2cm的不锈钢通气盘伸入中转罐底部进行鼓泡通气。
[0111]
在该反应器中培养海洋微藻紫球藻porphyridium cruentum,培养液是以硝酸钾为氮源的asw培养基。装液量为200l,接种密度为2.0g l
‑1。通入含co2体积分数为5%的空气二氧化碳混合气,通气量为40l min
‑1,控制培养温度为25
±
1℃。过程监测硝酸钾及磷酸二氢钾的含量,当含量降为初始值的1/2,则补加上述营养盐含量至初始值。培养至12天藻细胞终密度达到22.64g l
‑1,开始连续培养过程,连续流出流量为40l d
‑1,即维持每天的稀释率约为0.2,该藻液使用离心机低速离心(3000
×
g)并利用微滤设备过滤采收藻泥后,上清液用定制的超滤设备陶瓷膜脱盐过滤设备过滤后获得清液,将清液转入200l水平管式反应器继续培养。每天测定培养液浓度,及时流加10倍浓缩培养基至培养基初始浓度值。整个培养过程再维持60天以上。细胞产率为4500mg l
‑1d
‑1,测定获得藻红蛋白含量4.50g l
‑1,体积产率912.16mg l
‑1d
‑1。胞外多糖含量0.65g l
‑1,体积产率131.76mg l
‑1d
‑1。花生四烯酸含量0.25g l
‑1,体积产率50.68mg l
‑1d
‑1。
[0112]
通过对比例1~3可以看出(图2),目前已经报道的批次培养、两步法及半连续方法均可应用于紫球藻的培养,通过强光、缺氮胁迫可以提高多糖以及胞内花生四烯酸的含量,胁迫后胞外多糖的含量可以达到细胞干重的9.12%,是常规培养所含的2.52%的3.62倍。花生四烯酸的含量可以达到细胞干重的2.32%,是常规培养所含的1.01%的2.3倍。但胁迫
造成细胞干重下降,由胁迫开始前的13.75g l
‑1降为培养结束时的12.50g l
‑1,降幅9.1%。而且胞内藻红蛋白的含量下降尤为明显,由胁迫开始前的占细胞干重的22.38%降为培养结束时的8.16%。因此两步法可以提高部分产物的含量,但对产率的增加有限。半连续培养并不能显著提高反应器中紫球藻的产率。究其原因可能是批次性地更换培养液,使得藻细胞频繁适应培养环境,生长速率下降。尤其需要注意的是,对比例1~3即采用了相对较高的初始接种密度,达到0.8g l
‑1,细胞数目为1
×
107ml
‑1,这达到或超出了文献及公开资料中的采收密度。因此即使是对比例,培养终密度均超过10g l
‑1。因此初始细胞接种量对培养效率及终密度的影响是巨大的。
[0113]
基于上述对比例1~3中发现的初始接种细胞量对培养具有的令人惊讶的影响,进一步提高初始接种密度并开展实验,结果详见实施例1~3(图3),其初始接种密度分别为1.4g l
‑1、2g l
‑1及2.6g l
‑1,结果表明,随着接种密度提高,生长速率增加且终密度提高。实施例1~3的终密度分别达到20.64g l
‑1、26.58g l
‑1及28.04g l
‑1,相对应地,细胞产率分别为1202.50mg l
‑1、1536.25mg l
‑1及1590.00mg l
‑1。随着初始接种密度的增加,藻红蛋白、胞外多糖及花生四烯酸的产率也同步提高(见表1)。与实施例1相比,实施例2与实施例3之间相差较少,表明随着初始接种密度达到2g l
‑1并进一步提高,其带来的影响开始变小。考虑到种子制备的过程,因此选择2g l
‑1的初始细胞密度开展后续的实施例实验。
[0114]
通过实施例1~3实现了紫球藻的高密度培养,这使得高产藻红蛋白、胞外多糖及花生四烯酸成为可能。考虑到紫球藻培养对数期的最大生长速率接近0.2d
‑1。因此考虑连续培养方式,即保持适当的稀释率,从而实现对紫球藻的采收和连续培养。通过实验摸索,获得了实施例4中说明的连续培养方法,即培养12天细胞密度超过25g l
‑1即开始连续流出藻液采收并对清液离心、微滤及超滤后回流培养体系,并补充培养基浓缩液及无菌水保持培养液组成在合理的范围。通过实施例4与实施例2的对比可以看出,连续培养使得产率进一步提高,细胞产率由1536.25mg l
‑1提高到4980.00mg l
‑1,是前者的3.24倍。相应地,藻红蛋白及胞外多糖的产率也均提高超过3倍,花生四烯酸的产率提高2.93倍。通过高密度连续培养的方式,实现了紫球藻及其重要产物的高产率(图4)。
[0115]
基于小试反应器中的重要发现,将该培养方法放大到已工业化应用的水平管式反应器,具体实验结果详见图5,基于实施例1~3的发现,在实施例5~7中采用2g l
‑1的初始接种密度。通过对比实施例2与5可以发现,水平管式反应器内可以实现紫球藻高密度培养,终细胞密度23.57g l
‑1,说明将本说明书公开的高密度培养方法放大到200l反应器培养是可行的。
[0116]
通过对比实施例4与7可以发现,水平管式反应器内可以实现紫球藻高产率连续培养,实施例7中细胞产率达到4500mg l
‑1d
‑1,较实施例4中虽然略有下降,但仍然非常高,后期通过进一步优化可望进一步提高产率。以上对比说明将本说明书公开的高产率连续培养方法放大到200l反应器培养是可行的(图4及图5)。
[0117]
实施例6与7的结果对比表明,如果仅采收藻细胞而步采收多糖并不能达到连续培养的效果,会产生洗出效应(图5)。因此连续培养时需要及时移除胞外多糖,以免对生长培养产生不利影响,另一方面也提高胞外多糖的产率和产量。
[0118]
通过实施例4、7与对比例1~3的对比分析(图6)可以看出,本发明申请公开的连续培养方法显著提高了细胞干重,并因此显著提高了细胞及产物的产率。藻红蛋白、胞外多糖
及花生四烯酸的含量虽未显著提高,但含量值也相对较高,因此保证了高产率(详见表1、图7及图8)。因此本方法可以实现一步法高产所需的产物,而省去了复杂的产物诱导积累的操作。
[0119]
综上所述,通过系列的对比研究,并与已有的可公开获取的数据相比,本发明申请创新了紫球藻培养方法,该方法具有细胞密度高、产率高、连续化生产的特点。说明了本发明申请可以工业化实施,因此具有极广泛的实用价值。
[0120]
以上实施例仅用以说明本发明的技术方案而非对其限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员依然可以对本发明的具体实施方式进行修改或者等同替换,这些未脱离本发明精神和范围的任何修改或者等同替换,均在申请待批的本发明的权利要求保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。