对癌症的电与化学组合治疗
1.本技术是作为pct国际专利申请于2020年4月16日以波士顿科学光学有限公司(boston scientific scimed,inc.一家美国国营公司,作为所有指定国家的申请人)以及美国公民brian l.schmidt、美国公民benjamin keith stein、美国公民keith r.maile、美国公民ron a.balczewski、以及美国公民aleksandra kharam(所有指定国家的发明人)的名义提交的。本技术要求于2019年4月22日提交的美国临时申请号62/837,130的优先权,该临时申请的全部内容通过援引并入本文。
技术领域
2.本文的实施例涉及使用一种或多种电疗和/或化学治疗形式来治疗癌性肿瘤的方法、装置、以及系统。
背景技术:
3.根据美国癌症协会,癌症占美国每年死亡人数的将近25%。癌性肿瘤的当前救护标准可以包括比如手术、放射疗法和化学疗法的一线疗法。另外的二线疗法可以包括放射性播种、冷冻疗法、激素或生物疗法、消融等。如果一种特定疗法本身无效,则一线疗法和二线疗法的组合也可能对患者有益。
4.如果人体的任何部位中的一个正常细胞发生突变然后开始生长并繁殖得过多和过快,就可能形成癌性肿瘤。癌性肿瘤可能是细胞分裂过程中细胞dna或rna发生基因突变、比如电离或非电离辐射的外部刺激、暴露于致癌物的结果或者是遗传基因突变的结果。无论病因如何,许多癌性肿瘤都是未受抑制的快速细胞分裂的结果。
5.所有活跃分裂的体细胞(包括许多类型的癌性细胞)都通过细胞周期进行细胞分裂。活跃分裂的细胞经历细胞周期的两个主要阶段:间期和m期。在间期(细胞周期的最长阶段)期间,单个细胞的大小开始加倍并复制其dna,为细胞分裂做准备。间期可以按以下顺序分解为三个不连续的阶段:间隙期1,或g1期;合成期,或s期;以及间隙期2或g2期。在g1期,除染色体外的所有细胞内容物都被复制,细胞的大小开始加倍。在s期期间,dna合成复制染色体,为细胞中的每条染色体形成两个姐妹染色单体。在g2期期间,细胞继续生长并为m期准备细胞和染色体。
6.在m期期间,细胞退出间期并开始有丝分裂或核分裂过程,该过程包括姐妹染色单体的分离。m期以胞质分裂或细胞质分裂结束。有丝分裂包括四个基本阶段:前期、中期、后期和末期。在前期过程中,染色体开始凝集并且围绕细胞核的核膜消失。在前期过程中有丝分裂纺锤体也开始形成。有丝分裂纺锤体包括微管和中心体的自组织双极阵列。微管通常由高极性α
‑
微管蛋白和β
‑
微管蛋白的聚合形成。中心体类似地是基于蛋白质的细胞器,其中两个在该阶段迁移至分裂细胞的相反侧。微管的带负电的端部附着到中心体。微管的带正电的端部朝向分裂细胞的中纬线辐射,它们最终附着到每个姐妹染色单体的动粒。中期可以定义为所有染色体在分裂细胞的中纬线处对准并结合在有丝分裂纺锤体中。然后在后期过程中相等数量的姐妹染色单体被拉向细胞的相反端部。一旦所有染色体都已分离,末
期的过程就开始,其中细胞膜开始在两个新形成的姐妹细胞之间形成卵裂沟,并且一旦细胞在被称为胞质分裂的过程中彼此物理地分离,细胞分裂就完成。
技术实现要素:
7.在第一方面,包括一种用于治疗受试者体内的癌性肿瘤的方法。该方法可以包括在癌性肿瘤的部位处或附近施加一个或多个电场,其中癌性肿瘤可以包含癌性细胞群。所施加的一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。该方法可以包括:去除该一个或多个电场以允许癌性细胞群内进行有丝分裂。该方法可以包括:在已经去除该一个或多个电场之后对受试者施用化学治疗剂。
8.在第二方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,对所述癌性肿瘤施加所述一个或多个电场包括:在选自从1分钟至24小时的时间段范围内的时间段上施加一个或多个电场。
9.在第三方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,该方法可以包括:当癌性细胞群的至少5%响应于该一个或多个电场而被有丝分裂同步化时,对受试者施用化学治疗剂。
10.第四方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,以选自在100khz至300khz之间的范围内的频率来对所述癌性肿瘤施加所述一个或多个电场。
11.在第五方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,所述一个或多个电场的电场强度选自在3v/cm至5v/cm之间的电场强度范围。
12.在第六方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,将化学治疗剂以治疗有效剂量施用至受试者。
13.在第七方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,对受试者施加一个或多个电场包括将该一个或多个电场从受试者的体外施加至癌性肿瘤的部位处或附近。
14.在第八方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,对癌性肿瘤施加一个或多个电场包括将该一个或多个电场至少部分地从所述受试者的体内施加至癌性肿瘤的部位处或附近。
15.在第九方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,对癌性肿瘤施加一个或多个电场包括将该一个或多个电场至少部分地从受试者的体外施加至癌性肿瘤的部位处或附近。
16.在第十方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,该医疗装置进一步包括与电场产生电路电连通的一个或多个电引线。
17.在第十一方面,包括一种用于治疗癌性肿瘤的方法。该方法可以包括将一个或多个可植入电极植入患有癌性肿瘤的受试者的体内。该方法可以包括将一个或多个外部电极置于受试者的身体的外表面上。该方法可以包括:根据预定义时间表来在至少一对电极之间产生电场,其中该电场的频率在10khz至1mhz的范围内。该方法可以包括去除该一个或多个电场;以及在已经去除该一个或多个电场之后在癌性肿瘤的部位处或附近施用化学治疗
剂。
18.在第十二方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,所施加的一个或多个电场有效地延迟有丝分裂、并且在一定比例的所述癌性细胞群内引起有丝分裂同步化。
19.在第十三方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,去除一个或多个电场以允许癌性细胞群内进行有丝分裂。
20.在第十四方面,包括一种用于治疗癌性肿瘤的医疗装置。该医疗装置可以包括电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,其中癌性肿瘤可以包含癌性细胞群。该医疗装置可以包括与该电场产生电路连通的控制电路,其中该控制电路可以被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近。该控制电路可以使电场产生电路在位于身体组织内的癌性肿瘤的部位处以选自在10khz至1mhz之间的范围内的频率来产生一个或多个电场,其中该一个或多个电场有效地延迟有丝分裂、并且在一定比例的所述癌性细胞群内引起有丝分裂同步化。
21.在第十五方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,该医疗装置可以进一步包括与电场产生电路电连通的一个或多个电引线。
22.在第十六方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,该医疗装置可以进一步包括用于递送一种或多种化学治疗剂的一个或多个药物递送插管;光引线,这些光引线可以包括用于递送光活化光能的一个或多个光发射器;活检设备,该活检设备用于从癌性肿瘤获得活检样本;以及灌洗插管,该灌洗插管用于冲洗废物或体液。
23.在第十七方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,化学治疗剂包括抗有丝分裂剂。
24.在第十八方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,化学治疗剂包括以下中的至少一种:长春地辛、长春新碱、长春碱、紫杉醇、多西紫杉醇、2
‑
甲氧基雌二醇、帕妥匹隆、曲妥珠单抗、及其衍生物。
25.在第十九方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,化学治疗剂包括光活化的化学治疗剂。
26.在第二十方面,除了前述或以下方面中的一个或多个方面之外、或者在某些方面的替代方案中,其中,化学治疗剂包括纳米颗粒。
27.本发明内容是对本技术的一些传授内容的综述并且并不旨在是对本发明主题的排他性或穷尽性处理。进一步细节存在于具体实施方式和所附权利要求中。通过阅读并理解下面的具体实施方式并且查看形成具体实施方式的一部分的附图(其中的每一者均不应被认为具有限制意义),其他方面对于本领域技术人员而言将是明显的。本文的范围由所附权利要求及其法律等效物来限定。
附图说明
28.结合以下附图可以更全面地理解各方面,在附图中:
29.图1是根据本文的各种实施例的示例性细胞周期的示意图。
30.图2是根据本文的各种实施例的健康真核细胞的m期的示意图。
31.图3是根据本文的各种实施例的癌性真核细胞的m期的示意图。
32.图4是根据本文的各种实施例的活跃分裂细胞的百分比与时间的示意性曲线图。
33.图5是根据本文的各种实施例的方法的示意图。
34.图6是根据本文的各种实施例的方法的示意图。
35.图7是根据本文的各种实施例的方法的示意图。
36.图8是根据本文的各种实施例的方法的示意图。
37.图9是根据本文的各种实施例的方法的示意图。
38.图10是根据本文的各种实施例的方法的示意图。
39.图11是根据本文的各种实施例的医疗装置的示意图。
40.图12是根据本文的各种实施例的医疗装置的示意图。
41.图13是根据本文的各种实施例的医疗装置的示意图。
42.图14是根据本文的各种实施例的医疗装置的示意图。
43.图15是根据本文的各种实施例的医疗装置的示意性截面视图。
44.图16是根据本文的各种实施例的医疗装置的部件的示意图。
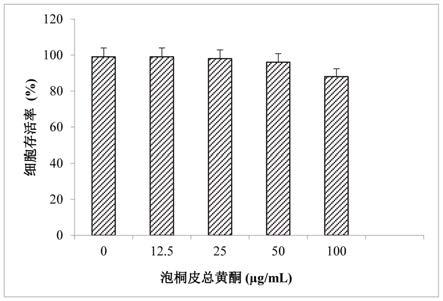
45.图17是根据本文的各种实施例的示例性电场的曲线图。
46.图18是根据本文的各种实施例的示例性电场的曲线图。
47.虽然实施例易于经历各种修改和替代形式,但是已经通过示例和附图的方式示出了其细节并且将对其进行详细描述。然而,应理解,本文的范围不限于所描述的特定实施例。与此相反,本发明将覆盖落在本文的精神和范围内的修改、等效物、以及替代方案。
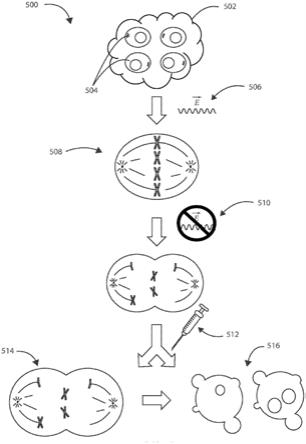
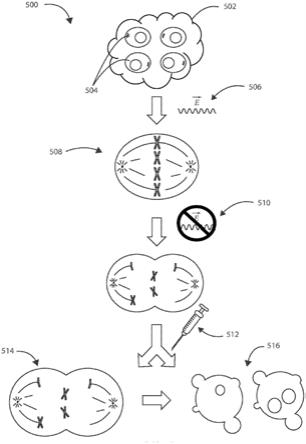
具体实施方式
48.如上所述,许多癌性肿瘤可能是由未受抑制的快速细胞分裂引起的。用于治疗癌性肿瘤的一些传统一线疗法可以包括手术、放射疗法和化学疗法。然而,许多一线疗法伴随有不良的副作用,比如疲劳、脱发、免疫抑制和较长的手术恢复时间,这里仅举几例。
49.虽然不旨在受到理论束缚,但是据信,交变电场可以通过干扰参与细胞分裂的关键蛋白(特别是微管蛋白和隔膜蛋白)的偶极排列来破坏癌性肿瘤内的有丝分裂。形成微管纺锤丝的微管蛋白的聚合可以被破坏,从而防止形成染色体分离所需的纺锤丝。这可以在有丝分裂的中期阶段停止细胞分裂。在一些情况下,交变电场可以停止已经生长的纺锤丝的聚合,从而导致纺锤体不完整并且在后期导致不均等的染色体分离(如果细胞存活那么长时间的话)。在每种情况下,在后期由于微管不完全聚合而引起停止微管纺锤体形成和不均等的染色体分离都可能导致细胞凋亡(即,程序性细胞死亡)。应进一步了解的是,在一些实施例中,交变电场可以通过干扰参与收缩环形成的蛋白质来破坏有丝分裂,收缩环负责在两个子细胞分离时产生收缩力。参与收缩环形成的各种蛋白质可以包括但不限于:f
‑
肌动蛋白、肌球蛋白
‑
2、anillin、一种或多种隔膜蛋白、rho、抑制蛋白、丝切蛋白、以及男性生殖细胞ras相关的c3肉毒杆菌毒素底物gtpase激活蛋白(mgcracgap)。
50.还据信,交变电场可以使细胞群(包括癌性细胞)内的有丝分裂同步化。据信,由于化学治疗剂更有效地靶向有丝分裂同步的活性细胞群,因此使癌性细胞群同步化可以使癌性细胞群在更短的时间段内对一种或多种化学治疗剂高度敏感。
51.此外,在一些实施例中,可以将光活化的化学治疗剂与电刺激疗法结合施用。在一些实施例中,可以将纳米颗粒与电刺激疗法来施用。
52.现在参见图1,示出了根据本文实施例的示例性真核细胞周期100的示意图。真核细胞周期可以分为两个主要阶段,包括间期102和m期104。间期包括三个关键期,即为:g1期106(即,间隙期1);s期108(即合成期);以及g2期110(即,间隙期2)。在g1期106期间,细胞通过开始复制其所有细胞内容物(不包括染色体)的过程为自身倍增做准备。在s期108期间,细胞通过dna复制过程合成新的dna,为细胞中的每条染色体形成两条姐妹染色单体。在g2期110期间,细胞继续生长并合成细胞在m期所需的蛋白质。
53.细胞周期100的m期由两个关键阶段构成:有丝分裂112和胞质分裂114。有丝分裂112是核分裂的过程,而胞质分裂114是细胞质分裂的过程。现在参见图2,示出了根据本文实施例的示例性真核细胞周期中的m期104的示意图。对于健康的示例性细胞200,有丝分裂从前期202过程开始,其中染色体204开始凝集形成一对相同的姐妹染色单体(姐妹染色单体215将在下文讨论),细胞核周围的核被膜206消失,并且纺锤体(包括纺锤丝208)开始形成。前期202之后是中期210,其中染色体204在分裂细胞的赤道面上排列并在每条染色体的动粒处被纺锤丝208结合。然后在后期212期间,通过纺锤丝208将每个姐妹染色单体215拉向每个中心体214和分裂细胞的相反两极的作用,染色体204被分离。在末期216期间,核膜218在分裂细胞的相反两极处围绕每组染色体204重新形成,并且在分裂细胞的两半之间开始形成卵裂沟220。细胞周期的最后一步是胞质分裂步骤114,使得形成两个遗传上相同的子细胞222,它们可以退出该细胞周期或重新进入随后的细胞周期过程224。
54.许多癌性细胞具有高代谢活性并且具有与细胞分裂相关的高有丝分裂速率。本文描述的用于治疗癌性肿瘤的方法和医疗装置可以针对快速分裂的癌性细胞的有丝分裂。不受任何特定理论的束缚,化学治疗剂的施加和/或所施加的抗有丝分裂疗法可以以多种方式来改变癌性细胞内的有丝分裂阶段。
55.现在参见图3,示出了根据本文实施例的示例性癌性细胞301的m期300的示意图,所述癌性细胞已经被化学治疗剂和/或所施加的抗有丝分裂疗法破坏。癌性细胞301内的有丝分裂类似于如图2所示的健康的示例性细胞200而开始。癌性细胞301内的有丝分裂过程从前期302开始,其中癌性细胞301的染色体304开始凝集,细胞核周围的核被膜306消失,纺锤体(包括纺锤丝308)开始形成。对癌性细胞301施用的抗有丝分裂剂和/或施加的抗有丝分裂疗法可以使纺锤丝308的形成不稳定,使得在中期310期间,并非所有染色体都被纺锤丝308结合。在一些实施例中,化学治疗剂是抗有丝分裂剂。
56.不稳定纺锤丝的后果可能包括有丝分裂停滞或延迟,这可能导致细胞死亡(即,细胞凋亡)或有丝分裂滑移311。分裂的癌性细胞还可能通过异常细胞分裂进行有丝分裂。如果通过异常细胞分裂继续有丝分裂并且染色体304不能均匀分离,则姐妹染色单体315和/或复制的染色体304可能被拉向中心体314到分裂细胞的相反两极,并在后期312期间变得不均匀分布。然后细胞可以进行到末期316,其中核膜318可以在分裂细胞的相反两极处的每组染色体304周围重新形成,并且可以在细胞的两半之间形成卵裂沟320。癌性细胞301的细胞周期的最后一步是胞质分裂步骤114,导致形成第一遗传上不同的子细胞322和第二遗传上不同的子细胞324。在一些实施例中,遗传上不同的子细胞可以通过细胞凋亡而死亡,重新进入随后细胞周期的间期并死亡,或重新进入有丝分裂326。
57.给定细胞群可以包括在任何给定时刻,活跃分裂细胞的基线百分比。现在参见图4,示出了根据本文的各种实施例的活跃分裂细胞百分比与时间的示例性曲线图400。曲线402示出了随时间而变的癌性肿瘤的癌性细胞群中活跃分裂细胞的平均基线百分比。曲线404示出了在经历用于治疗癌性肿瘤的方法后,癌性肿瘤的示例性癌性细胞群中活跃分裂细胞的百分比。癌性细胞群表现出在时间406期间活跃分裂细胞的基线百分比。当对癌性细胞群施加电场时408,此百分比活跃分裂细胞在时间410期间停止并减少。不受任何特定理论的束缚,据信,所施加的电场可以有效地延迟给定细胞群内的有丝分裂、并且在至少一定比例的给定细胞群内引起有丝分裂同步化。在一些实施例中,所施加的电场可以有效地延迟健康细胞群内的有丝分裂、并且在至少一定比例的健康细胞群内引起有丝分裂同步化。在一些实施例中,所施加的电场可以有效地延迟癌性细胞群内的有丝分裂、并且在至少一定比例的癌性细胞群内引起有丝分裂同步化。
58.在预定的时间量之后,去除所施加的电场412。释放电场以允许癌性细胞群的细胞开始活跃地分裂并且继续同步进行有丝分裂。在释放电场412之后,可以对癌性细胞群施用化学治疗剂414。在释放电场412与施用化学治疗剂414之间的时间量可以变化,如下文描述的。应注意的是,在一些实施例中,可以在释放电场之前对癌性细胞群施用化学治疗剂。
59.不受任何特定理论的束缚,当癌性细胞群内的细胞处于有丝分裂同步化的状态时,据信,施用化学治疗剂可以有效地减少或破坏癌性肿瘤中存在的存活癌性细胞的数量。虽然释放电场允许细胞进行有丝分裂,但是最终在时间414期间,施加电场和/或施用化学治疗剂可以减少活跃分裂细胞的数量。最终,在时间416期间,电场和化学治疗剂的组合治疗可以有效地减少癌性肿瘤中的存活细胞数量。
60.一种用于治疗癌性肿瘤的示例性方法可以包括在癌性肿瘤的部位处或附近施加一个或多个电场,然后施用化学治疗剂。现在参见图5,示出了根据本文的各种实施例的用于治疗受试者体内的癌性肿瘤502的示例性方法500的示意性流程图。方法500可以包括在癌性肿瘤502的部位处或附近施加一个或多个电场506。癌性肿瘤502可以包含癌性细胞群504。所施加的一个或多个电场可以有效地延迟癌性细胞群504中的有丝分裂、并且在癌性细胞群内至少一定比例的细胞内引起有丝分裂同步化508。方法500可以包括去除该一个或多个电场以允许癌性细胞群内进行有丝分裂510。方法500可以包括在已经去除该一个或多个电场之后,在癌性肿瘤的部位处或附近施用化学治疗剂512。在一些实施例中,化学治疗剂可以通过身体外部的静脉端口、或者经由可植入装置全身递送,该可植入装置具有植入全身脉管系统内、比如植入胸腔中的可植入导管。施用化学治疗剂可以中断癌性细胞群内的有丝分裂514并且最终使得癌性细胞群内的细胞死亡516。在一些实施例中,方法500可以包括在癌性肿瘤的部位处或附近插入经皮进入端口。
61.本文的方法可以包括使用一个或多个可植入电极来治疗癌性肿瘤。现在参见图6,示出了根据本文各种方法的用于治疗癌性肿瘤的方法600。方法600包括将一个或多个可植入电极植入患有癌性肿瘤的受试者的体内602。方法600包括将一个或多个外部电极置于受试者的身体的外表面上604。该方法包括:根据预定义时间表来在至少一对电极之间产生电场606,该电场的频率在10khz至1mhz的范围内。方法600包括去除该一个或多个电场608。该方法包括在已经去除该一个或多个电场之后,在癌性肿瘤的部位处或附近、或全身地施用化学治疗剂610。在一些实施例中,方法600的施加的一个或多个电场有效地延迟有丝分裂、
并且在一定比例的癌性细胞群内引起有丝分裂同步化。在一些实施例中,方法600中去除一个或多个电场允许癌性细胞群内进行有丝分裂。
62.为了优化给定细胞群内的有丝分裂延迟并在较大比例的给定细胞群内引起有丝分裂同步化,可以在施用化学治疗剂之前多次施加一个或多个电场,如参见图7和图8所讨论的。现在参见图7,示出了根据本文的各种实施例的用于治疗受试者体内的癌性肿瘤的方法700。方法700可以包括在癌性肿瘤的部位处或附近施加具有第一电场强度的第一电场702,其中癌性肿瘤包含癌性细胞群。第一电场可以有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。方法700可以包括:去除第一电场以允许癌性细胞群内进行有丝分裂704。方法700可以包括:已经去除第一电场之后,在癌性肿瘤的部位处或附近施用化学治疗剂706。
63.现在参见图8,示出了根据本文的各种实施例的用于治疗受试者体内的癌性肿瘤的方法800。方法800可以包括在癌性肿瘤的部位处或附近施加具有第一电场强度的第一电场802,其中癌性肿瘤包含癌性细胞群。第一电场可以有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。方法800可以包括:去除第一电场以允许癌性细胞群内进行有丝分裂804。方法800可以包括:在已经去除第一电场之后并且在施加化学治疗剂之前,对癌性肿瘤的部位处或附近施加具有第二电场强度的第二电场806。第二电场可以有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。方法800可以包括:已经去除第一电场之后,在癌性肿瘤的部位处或附近施用化学治疗剂808。在一些实施例中,方法800可以包括:在癌性肿瘤的部位处或附近施加具有第三电场强度的第三电场。在一些实施例中,方法800可以包括:在癌性肿瘤的部位处或附近施加具有第四电场强度的第四电场。在一些实施例中,方法800可以包括:在癌性肿瘤的部位处或附近施加第五电场、第六电场、第七电场、第八电场、第九电场或第十电场。在还又其他实施例中,方法800可以包括:在癌性肿瘤的部位处或附近施加大于第十电场的电场。
64.施加具有第二或更大电场强度的第二或更大电场的方法可以包括:在相继电场的施加之间等待预定的时间量。举例而言,方法800可以包括在去除第一电场之后、在施加第二电场之前,等待预定的时间量。类似地,在施加具有第三电场强度的第三电场时,可以通过在去除第二电场之后、在施加第三电场之前等待预定的时间量来延迟第三电场的施加。然而,在一些实施例中,施加具有第二或更大电场强度的第二或更大电场可以包括:在施加前一个电场之后立即施加第二或更大的电场。
65.在一些实施例中,第二电场强度小于第一电场强度。在一些实施例中,第二电场强度大于第一电场强度。在其他实施例中,第二电场强度与第一电场强度相同。在一些实施例中,相继施加的具有独特电场强度的每个额外电场可以包括电场强度小于、大于、或等于前一个电场或相继电场的额外电场。
66.在本文的方法中,可以在时间上控制一个或多个电场的施加。现在参见图9,示出了根据本文的实施例的用于治疗受试者体内的癌性肿瘤的方法900。方法900可以包括根据预定义时间表来在癌性肿瘤的部位处或附近施加一个或多个电场902。癌性肿瘤包含癌性细胞群。预定义时间表可以使电场强度和频率中的至少一者在至少六小时的限定时间段过程上变化。方法900的施加的一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。在一些实施例中,方法900可以包括去除该一个或多个电场
以允许癌性细胞群内进行有丝分裂904。在其他实施例中,方法900可以包括在已经去除该一个或多个电场之后,在癌性肿瘤的部位处或附近施用化学治疗剂906。在一些实施例中,方法900可以进一步包括:从受试者接收暂停命令,其中暂停命令中止电场的施加。
67.对一个或多个电场的施加的时间控制可以包括:使得一个或多个电场的强度和频率中的至少一者根据预定义时间表随时间变化。在一些实施例中,对一个或多个电场的施加的时间控制可以包括:与初始强度或频率相比,使一个或多个电场的强度和频率中的至少一者根据预定义时间表随时间变化。在一些实施例中,预定义时间表包括一个或多个停工期,其中所施加的一个或多个电场的强度或频率降低至少50%而持续至少4小时。在一些实施例中,预定义时间表包括一个或多个停工期,其中所施加的一个或多个电场的强度或频率降低至少75%而持续至少4小时。在一些实施例中,预定义时间表包括一个或多个停工期,其中所施加的一个或多个电场的强度或频率降低了一定量,该量大于或等于25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%、或100%,或者可以是落在任何前述范围内的量。
68.本文的各种方法可以包括:在治疗癌性肿瘤的过程中从受试者和/或护理提供者接收命令。现在参见图10,示出了根据本文的实施例的用于治疗癌性肿瘤的方法1000。方法1000可以包括将一个或多个可植入电极植入患有癌性肿瘤的受试者的体内1002。方法1000可以包括将一个或多个外部电极置于受试者的身体的外表面上1004。方法1000可以包括:根据预定义时间表来在至少一对电极之间产生电场1006,该电场的频率在10khz至1mhz之间的范围内。方法1000可以包括:从受试者和/或护理提供者接收暂停命令,其中暂停命令中止产生电场1008。在一些实施例中,方法1000可以包括:在从受试者和/或护理提供者接收暂停命令过去一定时间段之后,根据预定义时间表来重新在至少一对电极之间产生电场。在一些实施例中,方法1000可以包括:从受试者和/或护理提供者接收启动命令,其中启动命令重新产生电场。在其他实施例中,其中方法1000的预定义时间表可以包括电场的强度和频率中的至少一者的随时间变化,如本文其他地方描述的。在一些实施例中,方法1000可以包括在已经暂停一个或多个电场的时间段之后,在癌性肿瘤的部位处或附近施用化学治疗剂。
69.在用本文的各种方法治疗癌性肿瘤的过程中,可以从受试者和/或护理提供者接收各种命令。在一些实施例中,从受试者和/或护理提供者接收到的命令可以包括暂停命令。当受试者经历一种或多种副作用时,可以从受试者和/或护理提供者接收暂停命令以暂停第一电场的施加,所述副作用包括头晕、恶心、疲劳、头晕、头痛或局部疼痛。从受试者和/或护理提供者接收到的暂停命令可以包括以下中的至少一者:关停命令、关停设定时间的命令、关停按钮下压命令、或关停状态提醒命令。关停命令可以暂时暂停产生电场。关停设定时间的命令可以暂时暂停产生电场预定时间段。举例而言,关停设定时间的命令可以暂时暂停产生电场至少1小时。在一些实施例中,关停设定时间的命令可以暂时暂停产生电场至少6小时。在一些实施例中,关停设定时间的命令可以暂时暂停产生电场至少10小时。在一些实施例中,关停设定时间的命令可以暂时暂停产生电场一定时间段,该时间段大于或等于1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、或12小时,或者可以是落在任何前述范围内的量。
70.在本文描述的各种方法中,施加该一个或多个电场可以至少包括以各种电场强度
来施加电场。举例而言,该一个或多个电场可以以选自在0.25v/cm至500v/cm之间的电场强度范围内的电场强度施加至癌性肿瘤。在一些实施例中,该一个或多个电场可以以选自在1v/cm至10v/cm之间的电场强度范围内的电场强度施加至癌性肿瘤。在一些实施例中,该一个或多个电场可以以选自在1v/cm至5v/cm之间的电场强度范围内的电场强度施加至癌性肿瘤。在一些实施例中,该一个或多个电场可以以选自在3v/cm至5v/cm之间的电场强度范围内的电场强度施加至癌性肿瘤。在一些实施例中,电场强度可以大于或等于0.25v/cm、0.50v/cm、0.75v/cm、1.00v/cm、1.25v/cm、1.50v/cm、1.75v/cm、2.00v/cm、2.25v/cm、2.50v/cm、2.75v/cm、3.00v/cm、3.25v/cm、3.50v/cm、3.75v/cm、4.00v/cm、4.25v/cm、4.50v/cm、4.75v/cm、5.00v/cm、5.25v/cm、5.50v/cm、5.75v/cm、6.00v/cm、6.25v/cm、6.50v/cm、6.75v/cm、7.00v/cm、7.25v/cm、7.50v/cm、7.75v/cm、8.00v/cm、8.25v/cm、8.50v/cm、8.75v/cm、9.00v/cm、9.25v/cm、9.50v/cm、9.75v/cm、10v/cm、20v/cm、30v/cm、40v/cm、50v/cm、60v/cm、70v/cm、80v/cm、90v/cm、100v/cm、150v/cm、200v/cm、250v/cm、300v/cm、350v/cm、400v/cm、450v/cm、或500v/cm,或者可以是落在任何前述范围内的量。
71.在本文描述的各种方法中,施加该一个或多个电场可以至少包括以各种频率来施加电场。该一个或多个电场可以以选自在10千赫(khz)至1兆赫(mhz)的范围内的频率施加至癌性肿瘤。在一些实施例中,该一个或多个电场可以以选自在100khz至500khz的范围内的频率施加至癌性肿瘤。在一些实施例中,该一个或多个电场可以以选自在100khz至300khz的范围内的频率施加至癌性肿瘤。在一些实施例中,施加的一个或多个电场的频率可以大于或等于10khz、20khz、30khz、40khz、50khz、60khz、70khz、80khz、90khz、100khz、125khz、150khz、175khz、200khz、225khz、250khz、275khz、300khz、325khz、350khz、375khz、400khz、425khz、450khz、475khz、500khz、525khz、550khz、575khz、600khz、625khz、650khz、675khz、700khz、725khz、750khz、775khz、800khz、825khz、850khz、875khz、900khz、925khz、950khz、975khz、或1mhz,或者可以是落在任何前述范围内的量。
72.在本文的各种实施例中,可以释放(停止)电场,然后可以施用化学治疗剂。在各种实施例中,释放电场与施用化学治疗剂之间的时间量可以为约0分钟、5分钟、10分钟、15分钟、20分钟、25分钟、30分钟、40分钟、50分钟、60分钟、90分钟、120分钟、或180分钟,或者是落在任何前述范围之间的量。
73.在本文描述的各种方法中,施加该一个或多个电场可以至少包括持续多个不同的预定时间段地施加电场。该一个或多个电场可以在选自从1分钟至24小时的预定时间段范围内的预定时间段上施加至癌性肿瘤的部位处或附近。在一些实施例中,该一个或多个电场可以在预定时间段上施加至癌性肿瘤的部位处或附近,该预定时间段可以大于或等于1分钟、10分钟、20分钟、30分钟、40分钟或50分钟,或1.0小时、1.5小时、2.0小时、2.5小时、3.0小时、3.5小时、4.0小时、4.5小时、5.0小时、5.5小时、6.0小时、6.5小时、7.0小时、7.5小时、8.0小时、8.5小时、9.0小时、9.5小时、10.0小时、10.5小时、11.0小时、11.5小时、12.0小时、12.5小时、13.0小时、13.5小时、14.0小时、14.5小时、15.0小时、15.5小时、16.0小时、16.5、17.0小时、17.5小时、18.0小时、18.5小时、19.0小时、19.5小时、20.0小时、20.5小时、21.0小时、21.5小时、22.0小时、22.5小时、23.0小时、23.5小时、24.0小时、或48小时、或者可以是落在任何前述范围内的量。
74.在本文描述的各种方法中,施用化学治疗剂可以包括:当至少一定比例的细胞群
有丝分裂同步时,施用化学治疗剂。在一些实施例中,对癌性肿瘤施用化学治疗剂可以包括:当癌性细胞群的至少5%响应于该一个或多个电场而被有丝分裂同步化时,施用化学治疗剂。在一些实施例中,对癌性肿瘤施用化学治疗剂可以包括:当癌性细胞群的至少25%响应于该一个或多个电场而被有丝分裂同步化时,施用化学治疗剂。在一些实施例中,对癌性肿瘤施用化学治疗剂可以包括:当癌性细胞群的至少50%响应于该一个或多个电场而被有丝分裂同步化时,施用化学治疗剂。在一些实施例中,对癌性肿瘤施用化学治疗剂可以包括:当癌性细胞群的至少75%响应于该一个或多个电场而被有丝分裂同步化时,施用化学治疗剂。在一些实施例中,呈有丝分裂被延迟和有丝分裂同步化的状态的细胞百分比可以大于或等于5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、或95%,或者可以是落在任何前述范围内的量。
75.在本文描述的各种方法中,施用化学治疗剂可以包括持续多个不同的预定时间段地施用化学治疗剂。化学治疗剂可以在选自从少于1分钟至600分钟的预定时间段范围内的预定时间段上被施用在癌性肿瘤的部位处或附近。在一些实施例中,化学治疗剂可以在预定时间段上被施用在癌性肿瘤的部位处或附近,该预定时间段可以大于或等于1秒、5秒、10秒、15秒、20秒、25秒、30秒、35秒、40秒、45秒、50秒、55秒、或60秒、5分钟、10分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、60分钟、120分钟、180分钟、240分钟、300分钟、360分钟、420分钟、480分钟、540分钟、或600分钟、或者可以是落在任何前述范围内的量。应了解的是,化学治疗剂还可以被施用在远离癌性肿瘤的全身部位处。
76.在一些实施例中,在去除电场之后的12小时时间段内向受试者施用化学治疗剂。在一些实施例中,在去除电场之后的6小时时间段内向受试者施用化学治疗剂。在一些实施例中,在去除电场之后的3小时时间段内向受试者施用化学治疗剂。在一些实施例中,在去除电场之后的1小时时间段内向受试者施用化学治疗剂。下文更详细地讨论化学治疗剂的施用。
77.在本文描述的各种方法中,将该一个或多个电场施加在癌性肿瘤的部位处或附近可以包括:将该一个或多个电场施加至受试者的体外或体内。在一些实施例中,将该一个或多个电场施加至癌性肿瘤可以包括:将该一个或多个电场完全从受试者的体外施加至癌性肿瘤的部位处或附近。在一些实施例中,将该一个或多个电场施加至癌性肿瘤可以包括:将该一个或多个电场完全从受试者的体内施加至癌性肿瘤的部位处或附近。在一些实施例中,将该一个或多个电场施加至癌性肿瘤可以包括:将该一个或多个电场至少部分地从受试者的体外施加至癌性肿瘤的部位处或附近。在一些实施例中,将该一个或多个电场施加至癌性肿瘤可以包括:将该一个或多个电场至少部分地从受试者的体内施加至癌性肿瘤的部位处或附近。在其他实施例中,将该一个或多个电场施加至癌性肿瘤可以包括:将该一个或多个电场部分地从受试者的体外以及部分地从受试者的体内施加至癌性肿瘤的部位处或附近。应了解的是,从受试者体外施加电场可以使电场传播到受试者体内。
78.可以使用各种各样的医疗装置来对患有癌性肿瘤的受试者递送本文的各种方法。现在参见图11和图12,示出了根据本文的实施例的具有癌性肿瘤1110的受试者1101的示意图。在图11中,受试者1101具有在位于身体组织内的癌性肿瘤的部位处或附近完全植入受试者1101体内的医疗装置1100。可以使用各种植入部位,包括比如肢体、上部躯干、腹部区域、头部等中的区域。在图12中,受试者1101具有在位于身体组织内的癌性肿瘤的部位处或
附近至少部分地植入受试者1101体内的医疗装置1200。在一些实施例中,医疗装置可以完全在受试者体外。在一些实施例中,医疗装置可以部分地在受试者体外。在一些实施例中,医疗装置可以部分地植入受试者体内并且部分地在受试者体外。在其他实施例中,部分植入的医疗装置可以包括布置在身体内部与身体外部的部件之间的经皮连接。部分植入的医疗装置可以通过无线连接与医疗装置的部分外部分进行无线通信。
79.在一些实施例中,医疗装置的一部分可以完全植入,并且医疗装置的一部分可以完全在外部。例如,在一些实施例中,一个或多个电极或引线可以完全植入身体内,而医疗装置的产生电场的部分(比如电场产生器)可以完全在身体外。应了解的是,在本文描述的一些实施例中,所描述的电场产生器可以包括与脉冲产生器相同的许多部件,并且可以配置为执行与脉冲产生器相同的许多功能。在医疗装置的一部分被完全植入以及医疗装置的一部分完全在体外的实施例中,医疗装置的完全在体外的部分可以与医疗装置的完全在体内的部分无线通信。然而,在其他实施例中,可以使用有线连接。
80.医疗装置1100可以包括外壳1102和联接至外壳1102的头部1104,并且医疗装置1200可以包括外壳1102。可以使用各种材料。然而,在一些实施例中,外壳1102可以由比如金属、陶瓷、聚合物、复合材料等的材料形成。在一些实施例中,外壳1102或其一个或多个部分可以由钛形成。头部1104可以由各种材料形成,但是在一些实施例中,头部1104可以由比如环氧材料的半透明聚合物形成。在一些实施例中,头部1104可以是中空的。在其他实施例中,头部1104可以填充有部件和/或结构材料,比如环氧化物或另一种材料,使其并非中空的。
81.在医疗装置1100或1200的一部分部分地在体外的一些实施例中,头部1104和外壳1102可以被由耐用聚合物材料制成的保护性壳体包围。在其他实施例中,在医疗装置1100或1200的一部分部分在体外的情况下,头部1104和外壳1102可以被由聚合物材料、金属材料和/或玻璃材料的组合制成的保护性壳体包围。
82.头部1104可以联接到一个或多个引线1106。头部1104可以用于提供一个或多个引线1106的近端的固定,并且将一个或多个引线1106电联接到外壳1102内的一个或多个部件。一个或多个引线1106可以包括沿电引线1106的长度布置的一个或多个电极1108。在一些实施例中,电极1108可以包括电场产生电极,并且在其他实施例中,电极1108可以包括电场感测电极。在一些实施例中,引线1106可以包括电场产生电极和电场感测电极两者。在其他实施例中,引线1106可以包括电场感测和电场产生两者的任何数量的电极。应了解的是,尽管本文的医疗装置的许多实施例被设计成利用引线起作用,但是本文还设想产生电场的无引线医疗装置。在一些实施例中,电极1108可以是在引线1106的最远端上的尖端电极。
83.现在参见图13,示出了根据本文的实施例的医疗装置1300的示意图。医疗装置1300可以包括外壳1102和头部1104以及一个或多个引线1106。引线1106可以包括一个或多个电极,比如沿引线1106的长度布置的电极1304、1306、1308或1310。在一些实施例中,电极1304、1306、1308或1310可以包括电场产生电极,并且在其他实施例中,电极1304、1306、1308或1310可以包括电场感测电极。在一些实施例中,引线1106可以包括电场产生电极和电场感测电极两者。
84.引线1106的近端被布置在头部1104内。电引线1106的远端可以包围癌性肿瘤1110,使得电极1304、1306、1308或1310被带到癌性肿瘤1110附近。在一些实施例中,引线
1106可以定位在脉管系统内,使得电极1304、1306、1308或1310与癌性肿瘤1110相邻或者定位在癌性肿瘤内。然而,应了解的是,引线1106可以布置在癌性肿瘤1110内或周围的各种地方。在一些实施例中,引线1106可以直接穿过癌性肿瘤1110。
85.在一些实施例中,引线1106可以沿引线的长度包括一个或多个跟踪标记1316或1318,以用于确定电极相对于肿瘤的精确位置。在一些实施例中,一个或多个跟踪标记可以被布置在引线上所布置的一个或多个电极的直接远侧或直接近侧。在一些实施例中,跟踪标记可以由磁性材料形成。在一些实施例中,跟踪标记可以由放射照相材料形成。在一些实施例中,跟踪标记可以由荧光照相材料形成。
86.在一些实施例中,引线1106可以包括一个或多个光发射器1320,用于将光能递送至癌性肿瘤的部位处。光发射器可以沿着引线1106的长度定位或者定位在引线1106的最远端处。在本文的一些实施例中,化学治疗剂可以包括光活化的化学治疗剂,如下文更详细讨论的。在一些实施例中,引线1106可以包括一个或多个光纤以将光能递送至癌性肿瘤的部位。光发射器可以包括但不限于:发光二极管(led)或激光二极管。在一些实施例中,引线1106可以包括一个或多个光纤以将光能递送至癌性肿瘤的部位。本文使用的适合于活化光活化的化学治疗剂的光发射器的最大发射波长可以大于或等于350nm、400nm、450nm、500nm、550nm、600nm、650nm、700nm、750nm、800nm、或850nm,或者可以是落在任何前述范围内的量的那些光发射器。应了解的是,适合于本文使用的光发射器可以包括在发射最大值的任一侧具有
±
10nm的发射最大值的那些光发射器。应了解的是,适合于本文使用的光发射器可以包括在发射最大值的任一侧具有
±
20nm的发射最大值的那些光发射器。
87.应了解的是,可以在沿引线1106布置以产生电场的电极1304、1306、1308或1310的各种组合之间产生多个电场矢量。例如,可以在电极1304和1308之间产生一个或多个电场矢量。类似地,可以在电极1304和1310之间产生一个或多个电场矢量。还应了解的是,可以在电极1304、1306、1308或1310的任何组合之间产生一个或多个电场矢量。在一些实施例中,可以在电极1304、1306、1308或1310的任何组合与医疗装置的外壳1102之间产生一个或多个电场矢量。应了解的是,根据本文的实施例,可以使用一个或多个单极或多极引线。在一些实施例中,可以使用单极和多极引线的组合。在其他实施例中,可以使用圆形引线、夹持引线、套囊引线、桨形引线或贴片引线。
88.现在参见图14,示出了根据本文的实施例的医疗装置1400的示意图。医疗装置1400可以包括在受试者身体的内侧1450处的内部分和在受试者身体的外侧1452处的外部分。医疗装置1400的内部分可以包括内部电引线1401,而外部分可以包括外壳1102和外部电引线1402。医疗装置1400还可以包括经皮进入端口1416,该端口在癌性肿瘤的部位处或附近横跨受试者身体的外表面1418、适合于接纳插管的一个或多个引线。举例而言,经皮进入端口1416可以被配置用于接纳以下中的至少一者:内部电引线1401;递送一种或多种化学治疗剂的药物递送插管;光引线,该光引线包括用于递送光能的一个或多个光发射器;活检设备,该活检设备用于从癌性肿瘤获得活检样本;或用于冲洗癌性肿瘤的部位或废物或体液的灌洗插管。
89.内部电引线1401可以包括一个或多个电极,比如沿内部引线1106的长度布置的电极1404、1406或1408。外部电引线1402可以包括沿着外部电引线1402的长度布置的电极1410、1412或1414。在一些实施例中,电极1404、1406、1408、1410、1412或1414可以包括电场
产生电极,并且在其他实施例中,电极1404、1406、1408、1410、1412或1414可以包括电场感测电极。在一些实施例中,内部电引线1401或外部电引线1402可以包括电场产生电极和电场感测电极。
90.内部电引线1401或外部电引线1402的近端布置在外壳1102内。内部电引线1401的远端可以包围癌性肿瘤1110,使得电极1404、1406或1408被带到癌性肿瘤1110附近。外部电引线1402可以置于受试者身体外部上、靠近癌性肿瘤部位,使得电极1410、1412、以及1414与内部电引线1106上的电极1404、1406、和1408电连通。在一些实施例中,内部电引线1401可以定位在脉管系统内,使得电极1404、1406或1408与癌性肿瘤1110相邻或者定位在癌性肿瘤内。然而,应了解的是,内部电引线1401可以布置在癌性肿瘤1110内或周围的各种地方。在一些实施例中,内部电引线1401可以直接穿过癌性肿瘤1110。
91.在一些实施例中,内部电引线1401可以沿内部电引线1401的长度包括一个或多个跟踪标记1316,以用于确定电极相对于肿瘤的精确位置。在一些实施例中,一个或多个跟踪标记可以被布置在内部电引线1401上所布置的一个或多个电极的直接远侧或直接近侧。在一些实施例中,跟踪标记可以由磁性材料形成。在一些实施例中,跟踪标记可以由放射摄影材料形成。在一些实施例中,跟踪标记可以由荧光照相材料形成。
92.应理解的是,可以在沿着内部电引线1401和外部电引线1402布置以产生电场的电极1404、1406、1408、1410、1412或1414的各种组合之间产生多个电场矢量。例如,可以在电极1404和1410之间产生一个或多个电场矢量。类似地,可以在电极1406和1412之间产生一个或多个电场矢量。还应了解的是,可以在电极1404、1406、1408、1410、1412或1414的任何组合之间产生一个或多个电场矢量。在一些实施例中,可以在电极1404、1406、1408、1410、1412或1414的任何组合与医疗装置1400的外壳1102之间产生一个或多个电场矢量。应了解的是,根据本文的实施例,可以使用一个或多个单极或多极引线。在一些实施例中,可以使用单极和多极引线的组合。在其他实施例中,可以使用圆形引线、夹持引线、套囊引线、桨形引线或贴片引线。
93.现在参见图15,示出了根据本文的各种实施例的图11的医疗装置1100的示意性截面视图。应了解的是,本文描述的任一医疗装置中可以包括医疗装置1100的特征。外壳1102可以限定内部体积1502,该内部体积可以是中空的,并且在一些实施例中与医疗装置1100外部的区域1504气密密封分开。在其他实施例中,外壳1102可以填充有部件和/或结构材料,使其并非中空的。医疗装置1100可以包括控制电路1506,该控制电路可以包括布置在外壳1102内的各种部件1508、1510、1512、1514、1516和1518。在一些实施例中,这些部件可以是集成的,而在其他实施例中,这些部件可以是分开的。在另外的其他实施例中,可以存在集成部件和分开部件两者的组合。医疗装置1100还可以包括天线1524,以便允许单向或双向无线数据通信。在一些实施例中,医疗装置1100的部件可以包括通信地联接或附接到其上的感应能量接收器线圈(未示出),以促进经由再充电电路对医疗装置进行经皮再充电。
94.控制电路1506的各种部件1508、1510、1512、1514、1516和1518可以包括但不限于微处理器、存储器电路(比如随机存取存储器(ram)和/或只读存储器(rom))、记录器电路、控制器电路、遥测电路、电源电路(比如电池)、计时电路和专用集成电路(asic)、再充电电路等等。控制电路1506可以与电场产生电路1520连通,该电场产生电路可以被配置用于产生电流以形成一个或多个场。电场产生电路1520可以与控制电路1506集成,或者可以是与
控制电路1506分开的部件。控制电路1506可以被配置用于控制来自电场产生电路1520的电流的递送。在一些实施例中,电场产生电路1520可以存在于医疗装置在身体外部的一部分中。
95.在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用选自10khz到1mhz的范围内的一个或多个频率来递送电场。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520以选自100khz到500khz的范围内的一个或多个频率来递送电场。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520以选自100khz到300khz的范围内的一个或多个频率来递送电场。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用大于1mhz的一个或多个频率来周期性地递送电场。
96.在一些实施例中,电场可以有效地破坏癌性细胞中的细胞有丝分裂。电场可以沿一个以上矢量递送到癌性肿瘤的部位。在一些实例中,电场可以沿至少一个矢量(包括引线电极中的至少一个)递送。在一些实施例中,可以使用在两个矢量之间具有空间多样性的至少两个矢量。矢量可以在空间上分开(例如,矢量可以相对于彼此成角度地布置)至少约10度、20度、30度、40度、50度、60度、70度、80度或90度。
97.可以通过在两个电极之间递送电流来实现期望的电场强度。递送电场的具体电流和电压可以变化,并且可以调节以便在将要治疗的组织部位处实现期望的电场强度。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用在1mamp至1000mamp范围内的电流来将电场递送到癌性肿瘤的部位。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用在20mamp至500mamp范围内的电流来将电场递送到癌性肿瘤的部位。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用在30mamp至300mamp范围内的电流来将电场递送到癌性肿瘤的部位。
98.在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用包括以下各项的电流来递送电场:1mamp、2mamp、3mamp、4mamp、5mamp、6mamp、7mamp、8mamp、9mamp、10mamp、15mamp、20mamp、25mamp、30mamp、35mamp、40mamp、45mamp、50mamp、60mamp、70mamp、80mamp、90mamp、100mamp、125mamp、150mamp、175mamp、200mamp、225mamp、250mamp、275mamp、300mamp、325mamp、350mamp、375mamp、400mamp、425mamp、450mamp、475mamp、500mamp、525mamp、550mamp、575mamp、600mamp、625mamp、650mamp、675mamp、700mamp、725mamp、750mamp、775mamp、800mamp、825mamp、850mamp、875mamp、900mamp、925mamp、950mamp、975mamp或1000mamp。应了解的是,控制电路可以被配置用于引导电场产生电路1520以落入一定范围内的电流来递送电场,其中前述电流中的任一者可以用作该范围的下限或上限,前提是该范围的下限是小于该范围的上限的值。
99.在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用在1v
rms
至50v
rms
范围内的电压将电场递送到癌性肿瘤的部位。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用在5v
rms
至30v
rms
范围内的电压将电场递送到癌性肿瘤的部位。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用在10v
rms
至20v
rms
范围内的电压将电场递送到癌性肿瘤的部位。
100.在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用包括以下各项的一个或多个电压来递送电场:1v
rms
、2v
rms
、3v
rms
、4v
rms
、5v
rms
、6v
rms
、7v
rms
、8v
rms
、
9v
rms
、10v
rms
、15v
rms
、20v
rms
、25v
rms
、30v
rms
、35v
rms
、40v
rms
、45v
rms
或50v
rms
。应了解的是,控制电路可以被配置用于引导电场产生电路1520使用落入一定范围内的电压来递送电场,其中前述电压中的任一者可以用作该范围的下限或上限,前提是该范围的下限是小于该范围的上限的值。
101.在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520使用包括以下各项的一个或多个频率来递送电场:10khz、20khz、30khz、40khz、50khz、60khz、70khz、80khz、90khz、100khz、125khz、150khz、175khz、200khz、225khz、250khz、275khz、300khz、325khz、350khz、375khz、400khz、425khz、450khz、475khz、500khz、525khz、550khz、575khz、600khz、625khz、650khz、675khz、700khz、725khz、750khz、775khz、800khz、825khz、850khz、875khz、900khz、925khz、950khz、975khz、1mhz。应了解的是,电场产生电路1520可以使用落入一定范围内的频率来递送电场,其中前述频率中的任一者可以用作该范围的上限或下限,前提是该上限大于该下限。
102.在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520产生选自0.25v/cm至1000v/cm的范围内的一个或多个所施加电场强度。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520产生大于3v/cm的一个或多个所施加电场强度。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520产生选自1v/cm至10v/cm的范围内的一个或多个所施加电场强度。在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520产生选自3v/cm至5v/cm的范围内的一个或多个所施加电场强度。
103.在其他实施例中,控制电路1506可以被配置用于引导电场产生电路1520产生包括以下各项的一个或多个所施加电场强度:0.25v/cm、0.5v/cm、0.75v/cm、1.0v/cm、2.0v/cm、3.0v/cm、5.0v/cm、6.0v/cm、7.0v/cm、8.0v/cm、9.0v/cm、10.0v/cm、20.0v/cm、30.0v/cm、40.0v/cm、50.0v/cm、60.0v/cm、70.0v/cm、80.0v/cm、90.0v/cm、100.0v/cm、125.0v/cm、150.0v/cm、175.0v/cm、200.0v/cm、225.0v/cm、250.0v/cm、275.0v/cm、300.0v/cm、325.0v/cm、350.0v/cm、375.0v/cm、400.0v/cm、425.0v/cm、450.0v/cm、475.0v/cm、500.0v/cm、600.0v/cm、700.0v/cm、800.0v/cm、900.0v/cm、1000.0v/cm。应了解的是,电场产生电路1520可以在治疗部位处产生具有落入一定范围内的电场强度的电场,其中前述场强度中的任一者可以用作该范围的上限或下限,前提是该上限大于该下限。
104.在一些实施例中,控制电路1506可以被配置用于引导电场产生电路1520经由引线1106将电场递送至位于身体组织内的癌性肿瘤的部位。在其他实施例中,控制电路1506可以被配置用于引导电场产生电路1520经由医疗装置1100的外壳1102将电场递送至位于身体组织内的癌性肿瘤的部位。在其他实施例中,控制电路1506可以被配置用于引导电场产生电路1520在引线1106与医疗装置1100的外壳1102之间递送电场。在一些实施例中,一个或多个引线1106可以与电场产生电路1520电连通。在一些实施例中,一个或多个引线1106可以包括沿引线1106的长度布置的一个或多个电极1108,其中电极1108可以与电场产生电路1520电连通。
105.在一些实施例中,医疗装置1100内的各种部件可以包括被配置用于产生与感测到的电场相对应的信号的电场感测电路1522。电场感测电路1522可以与控制电路1506集成,或者它可以与控制电路1506分开。
106.感测电极可以布置在医疗装置的外壳上或附近、在连接到外壳的一个或多个引线上、在肿瘤附近或肿瘤中植入的单独装置上、或者这些位置的任意组合。在一些实施例中,电场感测电路1522可以包括第一感测电极1532和第二感测电极1534。在其他实施例中,外壳1102本身可以用作用于电场感测电路1522的感测电极。电极1532和1534可以与电场感测电路1522连通。电场感测电路1522可以测量第一电极1532与第二电极1534之间的电势差(电压)。在一些实施例中,电场感测电路1522可以测量第一电极1532或第二电极1534与沿一个或多个引线1106的长度布置的电极之间的电势差(电压)。在一些实施例中,电场感测电路可以被配置用于测量感测到的电场并且以v/cm来记录电场强度。
107.应了解的是理解,电场感测电路1522可以额外地测量第一电极1532或第二电极1534与外壳1102本身之间的电势差。在其他实施例中,医疗装置可以包括第三电极1536,该第三电极可以是电场感测电极或电场产生电极。在一些实施例中,一个或多个感测电极可以沿引线1106布置并且可以用作用于感测电场的额外位置。根据本文的实施例,可以想到许多组合以用于测量沿一个或多个引线1106的长度布置的电极与外壳1102之间的电势差。
108.在一些实施例中,一个或多个引线1106可以与电场产生电路1520电连通。一个或多个引线1106可以包括一个或多个电极1108,如图11所示。在一些实施例中,各种电导体(比如电导体1526和1528)可以从头部1104穿过馈通结构1530并进入医疗装置1100的内部体积1502中。这样,电导体1526和1528可以用于提供一个或多个引线1106与布置在外壳1102的内部体积1502内的控制电路1506之间的电连通。
109.在一些实施例中,记录器电路可以被配置用于记录由电场感测电路1522产生的数据并且记录关于该数据的时间戳。在一些实施例中,控制电路1506可以被硬连线以执行各种功能,而在其他实施例中,控制电路1506可以被引导来实现在微处理器或其他外部计算装置上执行的指令。还可以提供遥测电路以用于与外部计算装置进行通信,比如编程器、安装在房间内的单元和/或移动单元(例如,蜂窝电话,个人计算机、智能电话、平板计算机等)。
110.在此描述的医疗装置的各种实施例的元件在图16中示出。然而,应了解的是,一些实施例可以包括除了图16所示的那些元件之外的额外元件。另外,一些实施例可能缺少图16所示的一些元件。本文体现的医疗装置可以通过一个或多个感测通道来收集信息,并且可以通过一个或多个场产生通道来输出信息。微处理器1602可以经由双向数据总线与存储器1604通信。微处理器1602可以与电源电路1620电连通。存储器1604可以包括用于程序存储的只读存储器(rom)或随机存取存储器(ram)和用于数据存储的ram。微处理器1602还可以连接到遥测接口1618,以便与比如编程器、安装在房间内的单元和/或移动单元(例如,蜂窝电话、个人计算机、智能电话、平板计算机等)的外部装置通信,或者直接连接到云或者如由蜂窝或其他数据通信网络促进的另一通信网络。在一些实施例中,医疗装置可以包括通信地联接或附接到其上的感应能量接收器线圈接口(未示出),以促进对医疗装置进行经皮再充电。
111.医疗装置可以包括一个或多个电场感测电极1608以及可以与微处理器1602的端口进行通信的一个或多个电场传感器通道接口1606。医疗装置还可以包括一个或多个电场产生电极1612、以及可以与微处理器1602的端口进行通信的一个或多个电场产生通道接口1610和一个或多个电场产生电路1609。医疗装置还可以包括一个或多个其他传感器1616,
比如生理传感器、呼吸传感器或化学传感器;以及可以与微处理器1602的端口进行通信的一个或多个其他传感器通道接口1614。通道接口1606、1610和1614可以包括各种部件,比如用于将信号输入数字化的模数转换器、感测放大器、可以被控制电路写入以便调节感测放大器的增益和阈值的寄存器、源驱动器、调制器、解调器、多路复用器等等。
112.在一些实施例中,生理传感器可以包括监测温度、血流、血压等的传感器。在一些实施例中,呼吸传感器可以包括监测呼吸速率、呼吸峰值幅值等的传感器。在一些实施例中,化学传感器可以测量传感器周围的治疗区域中存在的分析物的量,包括但不限于比如血尿素氮、肌酸酐、纤维蛋白、纤维蛋白原、免疫球蛋白、脱氧核糖核酸、核糖核酸、钾、钠、氯化物、钙、镁、锂、水合氢、磷酸氢盐、碳酸氢盐等的分析物。然而,在此也可以设想许多其他的分析物。示例性化学/分析物传感器在授予凯恩(kane)等人的共同拥有的美国专利号7,809,441号中披露,并且该申请的全部内容通过援引并入本文。
113.虽然其他传感器1616被示出为图16中的医疗装置的一部分,但是应认识到,在一些实施例中,其他传感器中的一个或多个可以与医疗装置物理地分开。在各种实施例中,其他传感器中的一个或多个可以在经由遥测接口1618通信地联接至医疗装置的另一植入的医疗装置内。在另外的其他实施例中,其他传感器中的一个或多个可以在身体的外部,并且经由遥测接口1618联接到医疗装置。在一些实施例中,其他传感器可以包括药物递送传感器、活检设备传感器、光学传感器、或灌洗传感器。
114.在一些实施例中,本文的医疗装置可以包括电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场。本文的医疗装置可以包括与该电场产生电路连通的控制电路,该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近。该控制电路可以使电场产生电路在位于身体组织内的癌性肿瘤的部位处以选自在10khz至1mhz之间的范围内的频率来产生一个或多个电场,该一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。在一些实施例中,该医疗装置可以进一步包括与电场产生电路电连通的一个或多个电引线。
115.在一些实施例中,本文的医疗装置包括用于治疗癌性肿瘤的医疗装置系统。医疗装置外壳可以包括电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤包含癌性细胞群。该医疗装置系统可以包括与电场产生电路连通的控制电路,其中该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近。该医疗装置系统可以包括:用于将一种或多种化学治疗剂递送至癌性肿瘤的部位处或附近的药物递送插管。该医疗装置系统的控制电路可以使电场产生电路在位于身体组织内的癌性肿瘤的部位处以选自在10khz至1mhz之间的范围内的频率来产生一个或多个电场,该一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。
116.在一些实施例中,本文的医疗装置可以包括用于治疗受试者体内的癌性肿瘤的医疗装置。该医疗装置可以包括电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤包含癌性细胞群。该医疗装置可以包括与电场产生电路连通的控制电路。医疗装置的控制电路在预定义时间表之后,控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近,该预定义时间表使电场的强度和频
率中的至少一者在至少六小时的限定时间段过程上变化。
117.本文的医疗装置可以包括一种用于治疗癌性肿瘤的医疗装置,该医疗装置包括一个或多个可植入电极,这些可植入电极被配置为置于患有癌性肿瘤的受试者的体内。该医疗装置可以包括一个或多个外部电极,这些外部电极被配置为置于受试者的身体的外表面上。该医疗装置可以包括电场产生电路,该电场产电路被配置用于根据预定义时间表来在至少一对电极之间产生电场,该电场的频率在10khz至1mhz之间的范围内。该医疗装置可以包括控制电路,该控制电路被配置用于从受试者接收暂停命令,其中暂停命令中止产生电场。
118.化学治疗剂
119.一种或多种化学治疗剂可以适合用于本文描述的方法和装置。在一些实施例中,适合本文使用的治疗剂可以包括抗有丝分裂剂。抗有丝分裂剂可以包括作用于在有丝分裂期间存在的微管(即纺锤丝)上的抗有丝分裂剂。适合的抗有丝分裂剂可以包括具有微管稳定特性的那些或具有微管去稳定特性的那些。不希望受任何特定理论的束缚,据信,包括具有微管稳定特性的那些抗有丝分裂剂或具有微管去稳定特性的那些抗有丝分裂剂将作用于构成微管结构的α
‑
微管蛋白或β
‑
微管蛋白的多个不同结构域上。
120.在一些实施例中,本文的抗有丝分裂剂可以包括作用于收缩环上的抗有丝分裂剂,其可以包括但不限于f
‑
肌动蛋白、肌球蛋白
‑
2、苯胺林、一种或多种隔膜蛋白、rho、抑制蛋白、丝切蛋白、以及男性生殖细胞ras相关的c3肉毒杆菌毒素底物gtpase激活蛋白(mgcracgap)。在其他实施例中,抗有丝分裂剂可以包括作用于核酸、比如dna和rna上的抗有丝分裂剂。适合的抗有丝分裂剂可以包括具有收缩环稳定特性的那些或具有收缩环去稳定特性的那些。不希望受任何特定理论的束缚,据信,包括具有收缩环稳定特性的那些抗有丝分裂剂或具有收缩环去稳定特性的那些抗有丝分裂剂作用于形成收缩环的蛋白的多个不同结构域上。
121.适合于本文使用的化学治疗剂可以包括但不限于以下中的至少一种:长春地辛、长春新碱、长春碱、紫杉醇、多西紫杉醇、2
‑
甲氧基雌二醇、帕妥匹隆、曲妥珠单抗、及其衍生物。在一些实施例中,本文的化学治疗剂包括治疗半衰期小于24小时的药剂。在一些实施例中,本文的化学治疗剂包括治疗半衰期小于48小时的药剂。在一些实施例中,本文的化学治疗剂包括治疗半衰期小于60小时的药剂。
122.本文的化学治疗剂可以以治疗有效剂量施用在癌性肿瘤的部位处或附近。在一些实施例中,本文的化学治疗剂以治疗有效剂量远离癌性肿瘤的部位施用到体循环中。化学治疗剂可以穿过经皮进入端口而施用,该经皮进入端口与受试者身体上任何地方的全身静脉系统流体连通。
123.在一些实施例中,治疗有效剂量的化学治疗剂包括在去除电场之后的6小时时间段内对受试者递送的浓缩剂量,其中该浓缩剂量等于在24小时时间段上递送的常规非浓缩剂量。在一些实施例中,浓缩剂量的化学治疗剂可以在一小时或两小时内递送至受试者,在一些实施例中,可以在一小时或两小时内将浓缩剂量的化学治疗剂递送至受试者,然后施用稀释剂量的化学治疗剂而持续预定时间段,该预定时间段可以包括6小时、12小时、24小时、48小时、72小时或更长,其中浓缩剂量等于在24小时时间段至72小时时间段范围内递送的常规非浓度剂量。
124.本文的化学治疗剂可以包括光活化的化学治疗剂。该光活化的化学治疗剂可以包括但不限于光活化铂化合物或光活化光抑制素化合物。在一些实施例中,光活化光抑制素化合物包括光活化的考布他汀a
‑
4及其类似物和衍生物。在一些实施例中,光活化的化学治疗剂可以被由存在于本文描述的各种引线上的光发射器发射的、在350nm至850nm范围内的可见光而光活化。在一些实施例中,光活化的化学治疗剂可以被在450nm至650nm范围内的可见光而光活化。本文的光活化的化学治疗剂可以包括被一定波长光活化的的那些光活化的化学治疗剂,该波长可以大于或等于350nm、400nm、450nm、500nm、550nm、600nm、650nm、700nm、750nm、800nm、或850nm,或者可以是落在任何前述范围内的量。在一些实施例中,本文的光活化的化学治疗剂可以被在350nm至850nm范围内的可见光而光灭活。在一些实施例中,本文的光活化的化学治疗剂可以被在350nm至850nm范围内的可见光而光灭活、可以进一步被在350nm至850nm范围内的可见光而光活化持续多个循环。
125.适合的光活化的化学治疗剂包括但不限于光活化铂化合物或光活化光抑制素化合物。在一些实施例中,光活化光抑制素化合物包括光活化的考布他汀a
‑
4及其类似物和衍生物。
126.本文的方法可以包括一种用于治疗受试者体内的癌性肿瘤的方法,该方法包括在癌性肿瘤的部位处或附近施加一个或多个电场,癌性肿瘤包含癌性细胞群。该方法可以包括去除该一个或多个电场;以及在已经去除该一个或多个电场之后对癌性肿瘤的部位处或附近施用光活化的化学治疗剂。该方法可以包括通过向癌性肿瘤的部位处或附近递送光活化光能来照射光活化的化学治疗剂。在一些实施例中,光活化的化学治疗剂以治疗有效剂量的光活化的化学治疗剂施用以释放在癌性肿瘤的部位处或附近。在一些实施例中,治疗有效剂量包括在去除电场之后的6小时时间段内对受试者递送的浓缩剂量,其中该浓缩剂量等于在24小时时间段上递送的常规非浓缩剂量。
127.本文的医疗装置可以包括治疗受试者体内的癌性肿瘤,包括电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤包含癌性细胞群。该医疗装置可以包括与该电场产生电路连通的控制电路,该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近。该医疗装置可以包括插管,该插管被配置用于将光活化的化学治疗剂施用至癌性肿瘤的部位处或附近。该医疗装置可以包括一个或多个光发射器,这些光发射器被配置用于通过向癌性肿瘤的部位处或附近递送光活化光能来照射光活化的化学治疗剂。
128.本文的化学治疗剂可以包括纳米颗粒。在一些实施例中,纳米颗粒由聚合物、比如可生物降解聚合物制成。在一些实施例中,纳米颗粒可以包括释放在癌性肿瘤的部位处或附近的有效量的化学治疗剂。在一些实施例中,纳米颗粒包括以下中的至少一种:长春地辛、长春新碱、长春碱、紫杉醇、多西紫杉醇、2
‑
甲氧基雌二醇、帕妥匹隆、曲妥珠单抗、及其衍生物。纳米颗粒可以在癌性肿瘤的部位处或附近释放以递送治疗有效剂量的光活化的化学治疗剂。在一些实施例中,治疗有效剂量包括在去除电场之后的6小时时间段内对受试者递送的浓缩剂量,其中该浓缩剂量等于在24小时时间段上递送的常规非浓缩剂量。在一些实施例中,纳米颗粒可以包括本文其他地方描述的有效量的光活化的化学治疗剂。
129.本文的方法可以包括一种用于治疗受试者体内的癌性肿瘤的方法,该方法包括在癌性肿瘤的部位处或附近施加一个或多个电场,癌性肿瘤包含癌性细胞群。该方法可以包
括在癌性肿瘤的部位处或附近施用包含化学治疗剂的纳米颗粒。在一些实施例中,该方法可以包括在癌性肿瘤的部位处或附近施用纳米颗粒之前去除该一个或多个电场。
130.本文的医疗装置可以包括用于治疗受试者体内的癌性肿瘤医疗装置,该医疗装置包括电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤包含癌性细胞群。该医疗装置可以包括与该电场产生电路连通的控制电路,该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近。该医疗装置可以包括插管,该插管被配置用于将纳米颗粒施用至癌性肿瘤的部位处或附近。
131.额外的药剂和形式
132.一种或多种额外的药剂或形式可以适合用于本文描述的方法和装置。举例而言,可以将免疫剂与交变电场疗法组合。适合的免疫剂可以包括但不限于:免疫刺激剂和免疫抑制剂。在一些实施例中,免疫刺激剂可以包括刺激免疫系统的一种或多种药剂。在其他实施例中,免疫抑制剂可以包括抑制免疫系统的一种或多种药剂。在一些实施例中,可以使用免疫刺激剂和免疫抑制剂的组合。在其他实施例中,在给定疗法期间,免疫刺激剂和/或免疫抑制剂可以与化学治疗剂结合使用。
133.示例性免疫刺激剂可以包括细菌疫苗、病毒疫苗、治疗疫苗、干扰素、白介素、集落刺激因子、男性和女性性激素、生长激素、维生素d等。在一些实施例中,免疫刺激剂可以是特异性的,而在其他实施方案中,免疫刺激剂可以是非特异性的。示例性免疫抑制剂可以包括钙调神经磷酸酶抑制剂、白介素抑制剂、tnfα抑制剂、抗体、糖皮质激素、细胞抑制剂、烷化剂、抗代谢物例如核苷酸类似物、蛋白质合成抑制剂、抗排斥剂等。
134.一种或多种额外的形式或药剂也可以适合用于本文描述的方法和装置。举例而言,本文还设想了将放射疗法与交变电场疗法结合使用。在一些实施例中,靶向药物疗法、免疫疗法或激素疗法可以与本文描述的交变电场疗法结合使用。
135.施加的电场
136.使用本文的方法对癌性肿瘤施加的电场可以使用各种各样形式来施加。示例性治疗参数集可以包括实现以下概念的那些参数:扫过一定范围的频率;同时堆叠一个或多个频率;相继地步进通过一个或多个频率;一个或多个电场的空间或时间递送;扫过一定范围的电场强度;施加有效的旋转电场;调制电压控制模式或电流控制模式;实现一个或多个占空比;脉冲宽度调制;操纵电波形形状和/或脉冲序列;以及偶尔使用高频率或高电场强度脉冲。
137.治疗参数集可以被编程到医疗装置中以自主地操作,或者可以由受试者或临床医生使用外部计算装置来查询和操纵,比如编程器、安装在房间内的单元和/或移动单元(例如,蜂窝电话、个人计算机、智能电话、平板计算机等)。在其他实施例中,治疗参数集可以从外部计算装置无线地传送到医疗装置。以上关于电场产生电路讨论了适用于本文的任何治疗参数集的频率和/或电场强度。在一些实施例中,可以同时地实现一个或多个治疗参数集。在其他实施例中,可以以交替的方式实现一个或多个治疗参数集。
138.举例而言,可以通过扫过一定范围的频率将电场施加到癌性肿瘤的部位。现在参见图17,示例性曲线图1702示出了交变电场,其中频率随时间而增加。类似地,图18在示例性曲线图1802中示出了在编程的疗法参数期间频率随时间的变化。在一些实施例中,频率
扫略可以包括从最小频率向上扫略至最大频率。在一些实施例中,频率扫略可以包括从最大频率向下扫略至最小频率。在其他实施例中,在从电场产生电路递送电场的整个持续过程中,从最小频率向上扫略至最大频率和从最大频率向下扫略至最小频率可以根据需要重复许多次。
139.随着疗法在频率扫略期间进行,可能期望在频率范围之间交替,使得在群体中的细胞响应于疗法而改变大小和数量时,可以靶向更多的细胞。例如,在一些实施例中,频率扫略可以包括在覆盖约100khz至300khz的范围的第一频率扫略与覆盖约200khz至500khz的范围的第二频率扫略之间交替。应了解的是,可以在疗法的整个过程中无限期地执行如上所述的扫过第一频率范围和第二频率范围。在一些实施例中,第二频率扫略(范围)可以处于比第一频率扫略(范围)更高的频率。在一些实施例中,第一频率扫略(范围)可以处于比第二频率扫略(范围)更高的频率。
140.用于第一频率范围和第二频率范围的频率范围可以是包括上文关于电场产生电路1609叙述的特定频率的任何范围,前提是每个范围的下端是小于每个范围的上端的值。有时,在第一频率扫略和第二频率扫略的频率范围之间具有一定程度的重叠可能是有益的。
141.引线和电极
142.可以使用多种技术将本文所述的引线在癌性肿瘤部位处或附近置于身体内。放置一个或多个引线可以包括使用比如经血管放置、穿入皮下空间和/或手术放置的技术。在一些实施例中,放置一个或多个引线可以包括经由一个或多个自然身体孔口进行放置。引线可以放置在癌性肿瘤附近或其内。在一些实施例中,可以在癌性肿瘤附近或远离癌性肿瘤处使用多个引线。
143.在一些实施例中,可以将本文所述的一个或多个引线放置在皮下空间中。放置在皮下空间中的引线上的电极可以用作主要的近场产生电极或远场产生电极。在一些实施例中,放置在皮下空间中的引线上的电极可以结合医疗装置的外壳而用作主要的近场产生电极或远场产生电极。同样,一个或多个引线可以经血管放置,以结合癌性肿瘤部位处或附近的电极或者结合医疗装置的外壳来充当远场产生电极。
144.本文所述的引线和电极可以包括额外的功能和结构特征。在一些实施例中,引线可以包括与成像和治疗技术兼容的引线,这些成像和治疗技术包括但不限于mri(磁共振成像)、x射线成像、深部脑刺激技术和/或放射疗法。在一些实施例中,引线可以包括由传导材料制成的一个或多个导体芯。导体芯可以由包括金属和/或其他传导材料的传导材料形成。金属可以包括但不限于钯、铂、银、金、铜、铝、各种合金(包括不锈钢、比如的镍钴合金)等。在一些实施例中,导体芯可以是多绕线圈,包括但不限于双绕线圈、三绕线圈和四绕线圈。
145.在一些实施例中,如本文所述,电极可以沿一个或多个引线的长度布置。适用于本文描述的电极的材料可以包括金属,比如钯,以最小化磁场中的联接和伪影产生。在一些实施例中,电极可以由其他金属和/或其他传导材料制成。金属可以包括但不限于钯、铂、铂合金(比如铂
‑
铱合金)、金、铜、钽、钛、各种合金(包括不锈钢)等。在一些实施例中,电极可以呈缠绕线圈的形式,这些缠绕线圈可以提供增大表面积的额外益处而不损害电极的柔性。在一些实施例中,可植入装置外壳可以用作电极。
146.本文所述的引线还可以包括沿引线的长度布置的一个或多个电极。引线可以包括沿引线的长度布置的两个或更多个电极。在一些实施例中,电极可以是在引线的远端处发现的尖端电极。在其他实施例中,电极可以是沿引线但不是在引线的尖端处发现的环形电极。
147.在一些实施例中,电极可以是线圈电极。在一些实施例中,环形或尖端电极可以定位在肿瘤或癌性组织中或附近,并且线圈电极可以定位成远离肿瘤或癌性组织,以便帮助向所产生的电场提供空间多样性。在一些实施例中,一个或多个电极沿长度方向的轴线(例如,近端至远端的轴线)可以具有以下各项的长度约0.5mm、1mm、1.5mm、2mm、3mm、4mm、5mm、7.5mm、10mm、15mm、20mm、30mm、40mm、50mm、75mm、100mm或更多。在一些实施例中,一个或多个电极的长度可以落入如下范围内,其中前述距离中的任一者都可以用作该范围的上限或下限,前提是上限大于下限。
148.引线可以是单极、双极或多极的。在一些实施例中,单极引线可以包括在一个电极与医疗装置的外壳之间产生电场的引线。在一些实施例中,双极引线可以包括可以在沿引线布置的两个电极之间或两个电极与医疗装置的外壳之间产生电场的引线。在一些实施例中,多极引线可以包括可以在沿引线布置的两个以上电极之间、在两个以上电极与医疗装置的外壳之间、或者在电极的构型的任意数量的组合与医疗装置的外壳之间产生电场的引线。
149.本文的引线可以包括沿引线的长度的一个或多个光发射器。适合于本文使用的光发射器可以包括发射的光落在沿着从约350nm至950nm的可见光谱的任何位置的那些光发射器。适合的光发射器可以包括发光二极管或激光二极管。适合的led可以由以下中的一种或多种制成:砷化镓(gaas)、磷化镓(gap)、磷化砷化镓(gaasp)、碳化硅(sic)、或氮化铟碲(gainn)。在一些实施例中,适合于本文使用的led可以包括能够发射仅一种颜色的led、或单色led;能够发射两种颜色的led、或双色led;能够发射三种颜色的led、或三色led;或能够发射多于三种颜色的led。led可以与本文描述的医疗装置的外壳内的控制电路电连通。在一些实施例中,沿着本文的引线可以包括一个或多个激光二极管,并且激光二极管可以与设置在引线内并用于将光从激光源传输到激光二极管的一个或多个光纤光通信。
150.适用于此的电极可以由导电聚合物制成,比如碳填充的硅酮、聚乙炔、聚吡咯、聚苯胺、聚噻吩、聚呋喃、聚异戊二烯、聚丁二烯、聚对亚苯基等。在其他实施例中,电极可以是绝缘的。在一些实施例中,包围电极的绝缘可以包括微孔绝缘体,以防止细胞附着但仍然允许电流流动。微孔绝缘体可以由本文所述的多种绝缘材料制成,包括但不限于聚四氟乙烯(eptfe)、聚乙烯
‑
四氟乙烯共聚物(etfe)、聚氨酯、硅树脂、聚对二甲苯聚合物(比如聚对二甲苯聚合物)、聚醚嵌段酰胺(比如)、尼龙或它们的衍生物。在一些实施例中,电极可以用各种材料涂覆,包括但不限于水凝胶或分形涂层,比如氧化铱、氧化钛、五氧化二钽、其他金属氧化物、聚对二甲苯聚合物(比如聚对二甲苯)等。
151.根据本文的实施例,可以使用多种引线固定技术和构型。引线固定技术的一些非限制性示例可以包括生物相容性胶固定、爪状物固定、螺旋线圈固定、引线在血管系统中的被动居中、局部血管系统内的齿固定、局部血管系统内的螺旋偏置固定、压缩固定、缝合线套筒固定等。在一些示例中,本文体现的引线可以放置在癌性肿瘤部位周围或附近的血管系统内。在其他实施例中,本文体现的引线可以手术放置在癌性肿瘤的部位处或之内或周
围。
152.适用于本文的引线还可以包括一个或多个开放腔,这些开放腔延伸引线的整个纵向长度或该纵向长度的选定部分。在一些实施例中,开放腔可以包括适用于周期性地从癌性肿瘤部位获得活检样本的集成活检设备,以监测疾病的进展和/或消退。具有开放腔的引线还可以被配置成包括集成的药物递送腔,该药物递送腔可以以单次推注或定期经由计量泵将一种或多种药物(比如类固醇或化学疗法药剂)递送到肿瘤部位。引线可以包括沿引线的长度布置的一个或多个入口,以提供用于在癌性肿瘤的部位处或附近递送药物的出口。
153.在一些实施例中,引线的一部分或整个引线可以包括药物洗脱涂层。在一些实施例中,药物洗脱涂层可以包含抗炎剂,比如类固醇。在一些实施例中,类固醇可以是地塞米松。在其他实施例中,药物洗脱涂层可以包含化学疗法药剂。在一些实施例中,化学疗法药剂可以包括紫杉烷或其衍生物,包括但不限于紫杉醇、多烯紫杉醇等。在其他实施例中,药物洗脱涂层可以被配置用于释放其他种类的化学疗法药剂,包括但不限于烷基化剂、植物生物碱(比如长春花生物碱)、细胞毒性抗生素、拓扑异构酶抑制剂等。在一些实施例中,药物洗脱涂层可以被配置用于以延时释放的方式从涂层释放药物。
154.本文的引线可以采用多种形状或构型。在一些实施例中,引线可以是线性的,而在其他实施例中,引线可以是圆形的。圆形引线可以是完全封闭的环,也可以是半封闭的环。在一些实施例中,引线可以包括可弯曲的芯部,该可弯曲的芯部可以允许将引线成形为许多构型,包括但不限于u形、s形、螺旋形、半圆形、椭圆形等。
155.在另外的其他示例中,适用于本文的引线可以包括荧光标记或磁性标记,其可以帮助临床医生精确地放置在癌性肿瘤部位处或附近。引线还可以包括用于检测癌性肿瘤处或附近的ph变化的集成ph传感器,或者适用于分析感兴趣的化学分析物的浓度的其他化学传感器。
156.电场产生器
157.本文体现的医疗装置可以包括电场产生器,这些电场产生器特别适合于在癌性肿瘤的治疗过程中使用的治疗和诊断技术。在一些实施例中,适用于本文的电场产生器可以包括已经通过辐射硬化处理的那些产生器,以使部件耐受通常被指定为癌性肿瘤的主线治疗的放射疗法治疗的破坏作用。电场产生器可以包括比如以上参见图3和图5描述的那些部件。
158.本文体现的电场产生器可以利用如所描述的任何数量的治疗参数集进行编程。电场产生器可以在植入之前进行编程,或者它们可以由临床医生使用外部计算装置进行编程,比如编程器、安装在房间内的单元和/或移动单元(例如,蜂窝电话、个人计算机、智能电话、平板计算机等)。在一些实施例中,疗法参数可以经由遥测电路递送到电场产生器。在一些实施例中,电场产生器可以包括通信地联接到接收器线圈的再充电电路,以促进医疗装置的经皮再充电。在一些实施例中,电场产生器可以在接收器线圈与外部充电装置之间无线通信。
159.另外的实施例
160.在实施例中,包括一种用于治疗受试者体内的癌性肿瘤的方法,该方法包括:在癌性肿瘤的部位处或附近施加一个或多个电场,癌性肿瘤包含癌性细胞群;其中,所施加的一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步
化;去除该一个或多个电场以允许癌性细胞群内进行有丝分裂;以及在已经去除该一个或多个电场之后对受试者施用化学治疗剂。
161.在实施例中,对癌性肿瘤施加一个或多个电场包括:在选自从1分钟至24小时的时间段范围内的时间段上施加一个或多个电场。
162.在实施例中,方法可以进一步包括:当癌性细胞群的至少5%响应于该一个或多个电场而被有丝分裂同步化时,对受试者施用化学治疗剂。
163.在实施例中,方法可以进一步包括:当癌性细胞群的至少25%响应于该一个或多个电场而被有丝分裂同步化时,对受试者施用化学治疗剂。
164.在实施例中,方法可以进一步包括:当癌性细胞群的至少50%响应于该一个或多个电场而被有丝分裂同步化时,对受试者施用化学治疗剂。
165.在实施例中,方法可以进一步包括:当癌性细胞群的至少75%响应于该一个或多个电场而被有丝分裂同步化时,对受试者施用化学治疗剂。
166.在实施例中,以选自在10khz至1mhz之间的范围内的频率来对癌性肿瘤施加所述一个或多个电场。
167.在实施例中,以选自在100khz至500khz之间的范围内的频率来对癌性肿瘤施加所述一个或多个电场。
168.在实施例中,以选自在100khz至300khz之间的范围内的频率来对癌性肿瘤施加所述一个或多个电场。
169.在实施例中,该一个或多个电场的电场强度选自从0.25v/cm至1000v/cm的电场强度范围。
170.在实施例中,该一个或多个电场的电场强度选自从1v/cm至10v/cm的电场强度范围。
171.在实施例中,该一个或多个电场的电场强度选自从3v/cm至5v/cm的电场强度范围。
172.在实施例中,将化学治疗剂以治疗有效剂量施用至受试者。
173.在实施例中,治疗有效剂量包括在去除电场之后的6小时时间段内对受试者递送的浓缩剂量,该浓缩剂量等于在24小时时间段上递送的常规非浓缩剂量。
174.在实施例中,化学治疗剂包括治疗半衰期小于48小时的药剂。
175.在实施例中,化学治疗剂包括抗有丝分裂剂。
176.在实施例中,化学治疗剂包括以下中的至少一种:长春地辛、长春新碱、长春碱、紫杉醇、多西紫杉醇、2
‑
甲氧基雌二醇、帕妥匹隆、曲妥珠单抗、及其衍生物。
177.在实施例中,化学治疗剂包括光活化的化学治疗剂。
178.在实施例中,光活化的化学治疗剂包括光活化铂化合物或光活化光抑制素化合物。
179.在实施例中,光活化光抑制素化合物包括光活化的考布他汀a
‑
4及其类似物和衍生物。
180.在实施例中,活化的化学治疗剂可以被在350nm至850nm范围内的可见光而光活化。
181.在实施例中,光活化的化学治疗剂可以被在350nm至850nm范围内的可见光而光灭
活。
182.在实施例中,化学治疗剂包括纳米颗粒。
183.在实施例中,纳米颗粒包括释放在癌性肿瘤的部位处或附近的有效量化学治疗剂。
184.在实施例中,方法进一步可以包括在癌性肿瘤的部位处或附近插入经皮进入端口。
185.在实施例中,经皮进入端口被配置用于接纳一个或多个引线。
186.在实施例中,该一个或多个引线包括:药物递送插管,这些药物递送插管具有开放腔以递送一种或多种化学治疗剂;光引线,这些光引线可以包括用于递送光活化光能的一个或多个光发射器;活检设备,该活检设备用于从癌性肿瘤获得活检样本;以及灌洗插管,该灌洗插管用于冲洗废物或体液。
187.在实施例中,对受试者施加一个或多个电场可以包括:将该一个或多个电场从受试者的体外施加至癌性肿瘤的部位处或附近。
188.在实施例中,对癌性肿瘤施加一个或多个电场可以包括:将该一个或多个电场至少部分地从受试者的体内施加至癌性肿瘤的部位处或附近。
189.在实施例中,对癌性肿瘤施加一个或多个电场可以包括:将该一个或多个电场至少部分地从受试者的体外施加至癌性肿瘤的部位处或附近。
190.在实施例中,对癌性肿瘤施加一个或多个电场可以包括:用一个或多个可植入电极来将一个或多个电场从受试者体内植入癌性肿瘤的部位处或附近。
191.在实施例中,产生一个或多个电场的医疗装置可以包括:电场产生电路;以及与该电场产生电路连通的控制电路,该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近。
192.在实施例中,该医疗装置进一步包括与电场产生电路电连通的一个或多个电引线。
193.在实施例中,医疗装置被配置为完全植入受试者体内。
194.在实施例中,医疗装置被配置为完全在受试者体外。
195.在实施例中,医疗装置被配置为部分地植入受试者体内。
196.在实施例中,医疗装置被配置为部分地在受试者体外。
197.在实施例中,包括一种用于治疗癌性肿瘤的方法,该方法包括:将一个或多个可植入电极植入患有癌性肿瘤的受试者的体内;将一个或多个外部电极置于受试者的身体的外表面上;根据预定义时间表来在至少一对电极之间产生电场,该电场的频率在10khz至1mhz之间的范围内;以及去除该一个或多个电场;以及在已经去除该一个或多个电场之后在癌性肿瘤的部位处或附近施用化学治疗剂。
198.在实施例中,所施加的一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。
199.在实施例中,去除该一个或多个电场以允许癌性细胞群内进行有丝分裂。
200.在实施例中,包括一种用于治疗受试者体内的癌性肿瘤的方法,该方法包括:在癌性肿瘤的部位处或附近施加具有第一电场强度的第一电场,癌性肿瘤可以包含癌性细胞群;其中第一电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同
步化;去除第一电场以允许癌性细胞群内进行有丝分裂;以及在已经去除第一电场之后在癌性肿瘤的部位处或附近施用化学治疗剂。
201.在实施例中,该方法可以进一步包括:在已经去除第一电场之后并且在施加化学治疗剂之前,对癌性肿瘤的部位处或附近施加具有第二电场强度的第二电场,其中第二电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。
202.在实施例中,该方法可以进一步包括:在去除第一电场之后、在施加第二电场之前等待预定的时间量。
203.在实施例中,第二电场强度小于第一电场强度。
204.在实施例中,第二电场强度大于第一电场强度。
205.在实施例中,第二电场强度与第一电场强度相同。
206.在实施例中,该方法可以进一步包括:当受试者经历一种或多种副作用时从受试者接收暂停命令以暂停第一电场的施加,所述副作用可以包括头晕、恶心、疲劳、头晕、头痛或局部疼痛。
207.在实施例中,该方法可以进一步包括:从受试者接收启动命令,其中启动命令重新产生第一电场。
208.在实施例中,包括一种用于治疗癌性肿瘤的医疗装置,该医疗装置具有:电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤可以包含癌性细胞群;与该电场产生电路连通的控制电路,该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近;其中,该控制电路使电场产生电路在位于身体组织内的癌性肿瘤的部位处以选自在10khz至1mhz之间的范围内的频率来产生一个或多个电场,该一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。
209.在实施例中,该医疗装置可以包括与电场产生电路电连通的一个或多个电引线。
210.在实施例中,医疗装置可以包括以下中的一者或多者:递送一种或多种化学治疗剂的药物递送插管;光引线,这些光引线可以包括用于递送光活化光能的一个或多个光发射器;活检设备,该活检设备用于从癌性肿瘤获得活检样本;以及灌洗插管,该灌洗插管用于冲洗废物或体液。
211.在实施例中,医疗装置被配置为完全植入受试者体内。
212.在实施例中,医疗装置被配置为部分地植入受试者体内。
213.在实施例中,医疗装置被配置为完全在受试者体外。
214.在实施例中,包括一种用于治疗癌性肿瘤的医疗装置系统,该医疗装置系统具有医疗装置外壳,包括的该医疗装置具有:电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤可以包含癌性细胞群;与该电场产生电路连通的控制电路,该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近;用于将一种或多种化学治疗剂递送至癌性肿瘤的部位处或附近的药物递送插管;并且其中,该控制电路使电场产生电路在位于身体组织内的癌性肿瘤的部位处以选自在10khz至1mhz之间的范围内的频率来产生一个或多个电场。
215.在实施例中,医疗装置可以包括递送端口,该递送端口被配置用于接纳以下中的至少一者:用于递送一种或多种化学治疗剂的药物递送插管;光引线,该光引线可以包括用
于递送光能的一个或多个光发射器;活检设备,该活检设备用于从癌性肿瘤获得活检样本;以及用于冲洗癌性肿瘤的部位的灌洗插管。
216.在实施例中,包括一种用于治疗受试者体内的癌性肿瘤的方法,该方法:根据预定义时间表,在癌性肿瘤的部位处或附近施加一个或多个电场,癌性肿瘤包含癌性细胞群;其中该预定义时间表使电场的强度和频率中的至少一者在至少六小时的限定时间段过程上变化。
217.在实施例中,所施加的一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化。
218.在实施例中,该方法可以进一步包括:去除该一个或多个电场以允许癌性细胞群内进行有丝分裂。
219.在实施例中,方法可以进一步包括:在已经去除该一个或多个电场之后对癌性肿瘤的部位处或附近施用化学治疗剂。
220.在实施例中,方法可以进一步包括:从受试者接收暂停命令,其中暂停命令中止电场的施加。
221.在实施例中,预定义时间表包括该一个或多个电场的强度和频率中的至少一者的随时间变化。
222.在实施例中,预定义时间表包括一个或多个停工期,其中所施加的一个或多个电场的强度或频率降低至少50%持续至少4小时。
223.在实施例中,预定义时间表包括一个或多个停工期,其中所施加的一个或多个电场的强度或频率降低至少75%持续至少4小时。
224.在实施例中,包括一种用于治疗受试者体内的癌性肿瘤的方法,该方法包括:根据预定义时间表,在癌性肿瘤的部位处或附近施加一个或多个电场,癌性肿瘤包含癌性细胞群;其中,所施加的一个或多个电场有效地延迟有丝分裂、并且在一定比例的癌性细胞群内引起有丝分裂同步化;去除该一个或多个电场以允许癌性细胞群内进行有丝分裂。
225.在实施例实施例中,包括一种用于治疗受试者体内的癌性肿瘤的医疗装置,该医疗装置具有:电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤可以包含癌性细胞群;与该电场产生电路连通的控制电路;其中,该控制电路被配置用于在预定义时间表之后,控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近,该预定义时间表使电场的强度和频率中的至少一者在至少六小时的限定时间段过程上变化。
226.在实施例中,包括一种用于治疗癌性肿瘤的方法,该方法包括:将一个或多个可植入电极植入患有癌性肿瘤的受试者的体内;将一个或多个外部电极置于受试者的身体的外表面上;根据预定义时间表来在至少一对电极之间产生电场,该电场的频率在10khz至1mhz之间的范围内;从受试者接收暂停命令,其中暂停命令中止产生电场。
227.在实施例中,方法可以进一步包括:在从受试者接收暂停命令过去一定时间段之后,根据预定义时间表来重新在至少一对电极之间产生电场。
228.在实施例中,预定义时间表包括电场的强度和频率中的至少一者的随时间变化。
229.在实施例中,从患者接收到的暂停命令包括以下中的至少一者:关停命令、关停设定时间的命令、关停按钮下压命令、或关停状态提醒命令。
230.在实施例中,方法可以包括:从受试者接收启动命令,其中启动命令重新产生电场。
231.在实施例中,包括一种用于治疗癌性肿瘤的医疗装置,该医疗装置具有:一个或多个可植入电极,这些可植入电极被配置为置于患有癌性肿瘤的受试者的体内;一个或多个外部电极,这些外部电极被配置为置于受试者的身体的外表面上;电场产生电路,该电场产电路被配置用于根据预定义时间表来在至少一对电极之间产生电场,该电场的频率在10khz至1mhz之间的范围内;以及控制电路,该控制电路被配置用于从受试者接收暂停命令,其中暂停命令中止产生电场。
232.在实施例中,包括一种用于治疗受试者体内的癌性肿瘤的方法,该方法包括:在癌性肿瘤的部位处或附近施加一个或多个电场,癌性肿瘤包含癌性细胞群;去除该一个或多个电场;在已经去除该一个或多个电场之后对癌性肿瘤的部位处或附近施用光活化的化学治疗剂;以及通过向癌性肿瘤的部位处或附近递送光活化光能来照射光活化的化学治疗剂。
233.在实施例中,光活化的化学治疗剂包括释放在癌性肿瘤的部位处或附近的治疗有效剂量的光活化的化学治疗剂。
234.在实施例中,治疗有效剂量包括在去除电场之后的6小时时间段内对受试者递送的浓缩剂量,该浓缩剂量等于在24小时时间段上递送的常规非浓缩剂量。
235.在实施例中,光活化的化学治疗剂包括光活化铂化合物或光活化光抑制素化合物。
236.在实施例中,光活化光抑制素化合物包括光活化的考布他汀a
‑
4及其类似物和衍生物。
237.在实施例中,光活化的化学治疗剂可以被在350nm至850nm范围内的可见光而光活化。
238.在实施例中,光活化的化学治疗剂可以被在450nm至650nm范围内的可见光而光灭活。
239.在实施例中,包括一种用于治疗受试者体内的癌性肿瘤的医疗装置,该医疗装置具有:电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤可以包含癌性细胞群;与该电场产生电路连通的控制电路,该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近;插管,该插管被配置用于将光活化的化学治疗剂施用至癌性肿瘤的部位处或附近;以及一个或多个光发射器,这些光发射器被配置用于通过向癌性肿瘤的部位处或附近递送光活化光能来照射光活化的化学治疗剂。
240.在实施例中,包括一种用于治疗受试者体内的癌性肿瘤的方法,该方法包括:在癌性肿瘤的部位处或附近施加一个或多个电场,癌性肿瘤包含癌性细胞群;以及在癌性肿瘤的部位处或附近施用纳米颗粒,该纳米颗粒可以包括化学治疗剂。
241.在实施例中,方法可以进一步包括在癌性肿瘤的部位处或附近施用纳米颗粒之前去除该一个或多个电场。
242.在实施例中,纳米颗粒包括释放在癌性肿瘤的部位处或附近的治疗有效剂量的化学治疗剂。
243.在实施例中,治疗有效剂量包括在去除电场之后的6小时时间段内对受试者递送的浓缩剂量,该浓缩剂量等于在24小时时间段上递送的常规非浓缩剂量。
244.在实施例中,化学治疗剂包括以下中的至少一种:长春地辛、长春新碱、长春碱、紫杉醇、多西紫杉醇、2
‑
甲氧基雌二醇、帕妥匹隆、曲妥珠单抗、及其衍生物。
245.在实施例中,纳米颗粒包括可生物降解的聚合物。
246.在实施例中,包括一种用于治疗受试者体内的癌性肿瘤的医疗装置,该医疗装置具有:电场产生电路,该电场产生电路被配置用于在癌性肿瘤的部位处或附近产生一个或多个电场,癌性肿瘤可以包含癌性细胞群;与该电场产生电路连通的控制电路,该控制电路被配置用于控制将一个或多个电场从电场产生电路递送至癌性肿瘤的部位处或附近;以及插管,该插管被配置用于将纳米颗粒施用至癌性肿瘤的部位处或附近。
247.应当注意的是,如在本说明书和所附权利要求中所使用的,除非内容另外明确指明,否则单数形式“一个(a)”、“一个(an)”以及“该(the)”均包括复数指示物。因此,例如,引用一种包含“一种化合物”的组合物包括两种或更多种化合物的混合物。还应注意,术语“或者”总体上所使用的意义包括“和/或”,除非内容另外明确指明。
248.还应当注意的是,如在本说明书和所附权利要求中所使用的,短语“被配置”描述的是被构造或配置以便进行特定任务或采用特定配置的系统、设备或其他结构。短语“被配置”可以与其他类似短语(比如“被布置且配置”、“被构造且布置”、“被构造”、“被制造且布置”)等互换使用。
249.本说明书中的所有公开案和专利申请指示本发明所涉及的领域中的普通技术人员的水平。所有公开案和专利申请都通过援引并入本文,如同每个单独的公开案或专利申请被明确且单独地通过援引指明。
250.本文所描述的实施例不旨在是穷尽性的或将本发明限制为以下详细说明中所披露的精确形式。而是,这些实施例被选择和描述成使得本领域技术人员可以了解和明白这些原理和实践。这样,已经参考多个不同的特定和优选的实施例和技术描述了多个方面。然而应理解的是,在留在本文的精神和范围之内的同时可以进行许多变化和修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。