一种vegfr抑制剂在制备抗阿尔兹海默症药物中的应用
技术领域
1.本发明属于生物制药领域,具体涉及一种vegfr抑制剂在制备抗阿尔兹海默症药物中的应用。
背景技术:
2.阿尔兹海默症(alzheimer's disease,ad)是一种进行性发展的神经退行性疾病,主要临床表现为认知功能破坏和执行功能障碍。ad具有高度年龄依赖性,随着年龄增加,ad的发病率也会急剧提高。目前全世界有约500万例ad患者,到2050年这个数字将增加3倍,达到1.52亿。ad的主要病理特征包括淀粉样蛋白沉积,星形胶质细胞增生,tau蛋白过度磷酸化和积累,神经元营养不良、氧化应激、生物金属稳态失调、乙酰胆碱水平下降等。淀粉样蛋白(aβ)聚集形成的淀粉样斑块与tau蛋白高度磷酸化形成的神经纤维缠结作为ad患者脑中的两种特异性病理特征,二者协同参与了ad疾病的发生与发展,但ad真正的病因还不是很清楚。目前临床用于治疗ad的药物主要为fda批准的乙酰胆碱酯酶抑制剂和n
‑
甲基
‑
d
‑
天冬氨酸受体拮抗剂,这两类药物只能改善患者临床症状,不能完全治愈疾病。随着对ad发病机制的深入研究,同时靶向乙酰胆碱酯酶和n
‑
甲基
‑
d
‑
天冬氨酸受体被认为是抗ad药物研究领域中的一个重要策略,临床上已有将多奈哌齐(donepezil,dpz)与美金刚联合用药用于治疗中重度ad患者,效果优于单药治疗。尽管国内外对阿尔茨海默症的发病机制及治疗的研究很多,但仍需要探究对于ad的有效治疗手段。
3.vegf(血管内皮细胞生长因子)是血管生成过程中的一种血管生成因子,是内皮细胞分化的激素调节剂,vegf与特异性高表达在新生血管内皮细胞表面的vegfr(血管内皮生长因子受体)酪氨酸激酶结合,激活酪氨酸激酶从而发挥生物学功能。研究发现,vegfr抑制剂在体外能够阻断vegfr,从而抑制血管内皮细胞生长因子与vegfr结合。阿西替尼(axitinib)是由美国pfizer公司研发的一种小分子酪氨酸激酶抑制剂,主要针对的靶点是vegfr 1,2,3,于2012年1月27日获得fda批准上市。临床上主要用于复发与转移性肾细胞癌的治疗;在非临床模型中,阿西替尼通过干扰结直肠癌、乳腺癌、黑色素瘤及神经胶质瘤的肿瘤血管生成与抗肿瘤细胞生存来实现抑制原发性肿瘤生长。近年来还发现阿西替尼具有治疗非小细胞肺癌和白血病的作用。阿西替尼类似物与阿西替尼都属于小分子酪氨酸激酶抑制剂,作用位点为vegfr,临床上用于抗血管生成及肿瘤的治疗。但阿西替尼及其类似物治疗ad的作用尚没有被报道。
4.血脑屏障是血
‑
脑、脑脊液
‑
脑、血
‑
脑脊液3种屏障的总称,在维持中枢神经系统内环境稳定中起着至关重要的作用。血脑屏障主要由内皮细胞、星形胶质细胞、周细胞、基底膜以及内皮细胞之间的紧密连接组成;可以通过阻止血液中的物质进入脑组织来保护大脑,但同时也阻碍了药物分子的进入,加大了脑部疾病的治疗难度。有研究表明:ad的病理学过程导致血脑屏障的病理性开放,渗透性增加,使得血液中的有毒物质进入大脑,进一步加重疾病的进展。
技术实现要素:
5.本发明的目的是提供一种vegfr抑制剂在制备抗阿尔兹海默症药物中的应用。本发明通过生理性/病理性血脑屏障细胞模型发现,阿西替尼可上调aβ条件下的紧密连接蛋白表达,降低血脑屏障的渗透性;本发明通过ad小鼠模型发现阿西替尼可降低乙酰胆碱酯酶水平、恢复血脑屏障功能、以及改善认知功能障碍,延缓阿尔兹海默症的进程等。因此,本发明提供了一种vegfr抑制剂在制备抗阿尔兹海默症药物的应用。
6.本发明所述的一种vegfr抑制剂为阿西替尼及其类似物。
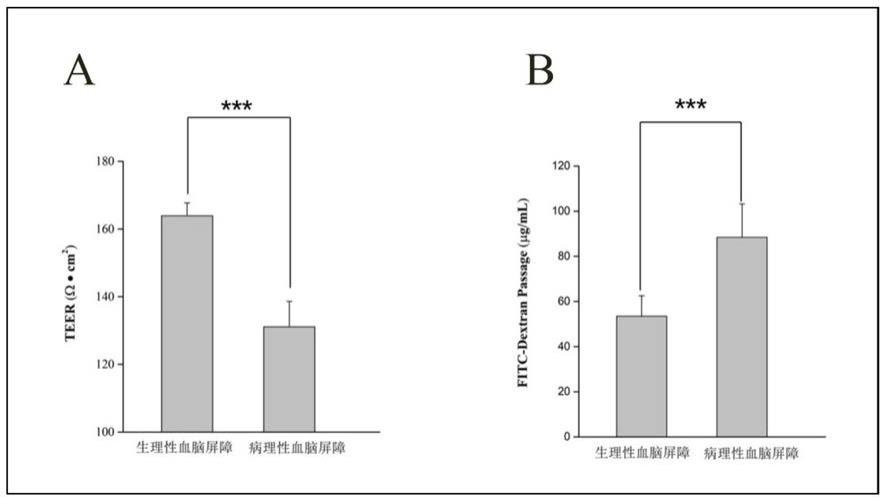
7.在一些可实施方案中,所述的一种vegfr抑制剂可选自尼达尼布(nintedanib)、帕唑帕尼(pazopanib)、索拉非尼(sorafenib)、康尼替尼(kanitinib)、阿帕替尼(apatinib)、帕唑帕尼(pazopanib)、麦他替尼(metatinib)、宁格替尼(ningetinib)、舒尼替尼(sunitinib)或以上药物的药用盐,优选阿西替尼或其药用盐。
8.在一些可实施方案中,所述的阿西替尼及其类似物在制备抗阿尔兹海默病药物可发挥以下作用:(1)降低阿尔兹海默症模型动物脑内β
‑
淀粉样蛋白(aβ)沉积;(2)降低阿尔兹海默症模型动物脑内乙酰胆碱酯酶水平;(3)提高阿尔兹海默症模型动物脑内神经递质水平;(4)减轻阿尔兹海默症模型动物病灶部位的氧化应激水平和减轻大脑神经炎症反应,抑制炎症反应引发的神经元凋亡;(5)提高阿尔兹海默症模型动物对空间和方向的学习记忆能力及学习记忆行为。
9.进一步地,所述的阿西替尼及其类似物在制备抗阿尔兹海默症药物时可以由阿西替尼及其类似物,或者阿西替尼及其类似物和药用可接受的载体制成。
10.进一步地,所述药物的给药途径包括但不局限于静脉注射、腹腔注射、灌胃给药等非颅内注射途径。
11.本发明基于ad的特异性病理特征aβ和tau蛋白会导致血管异常和血脑屏障破坏,发现阿西替尼可以降低ad模型动物的血脑屏障渗透性、降低乙酰胆碱酯酶水平、以及改善ad模型动物认知功能障碍,实现了较好的治疗作用。因此,本发明将阿西替尼及其类似物制备为抗阿尔兹海默症的药物。
12.本发明与现有技术相比,有如下有益效果:(1)相较于现有的疗法,本发明所提出的vegfr抑制剂阿西替尼在制备抗阿尔兹海默症药物的应用,为治疗阿尔兹海默症提供了一种新的治疗手段。(2)本发明所提出的vegfr抑制剂阿西替尼在阿尔兹海默症模型动物中,可以有效减少血脑屏障渗透性,恢复血脑屏障功能,改善阿尔兹海默症模型动物对空间和方向的学习记忆能力及学习记忆行为。(3)相较于已有的抗体疗法,阿西替尼及其类似物为其他疾病的临床在用药物,人体安全性高,价格低廉,易制得。(4)本发明采用非颅内给药的给药方式,安全性高,给药便捷,患者依从性高。
附图说明
13.图1:(a)体外生理性血脑屏障和病理性血脑屏障跨膜电阻值测定。(b)体外生理性血脑屏障和病理性血脑屏障的fitc
‑
右旋糖苷跨膜转运效率(mean
±
s.e.m,n=3,
***
p<0.01)。
14.图2:阿西替尼给药后上调aβ1‑
42
诱导的bend.3细胞紧密连接蛋白claudin
‑
5表达下降。(a)共聚焦激光扫描显微镜观察各实验组的紧密连接蛋白claudin
‑
5荧光表达量结
果。claudin
‑
5(绿色),hoechst(蓝色)。(b)图b为图a的image j的半定量分析结果(mean
±
s.e.m,n=3,
***
p<0.01)。
15.图3:免疫印迹分析结果显示,阿西替尼给药后显著上调aβ1‑
42
诱导的bend.3细胞紧密连接蛋白claudin
‑
5表达下降。(a)normal组、ad组、ad dpz组和ad axitinib组的claudin
‑
5蛋白表达量。(b)各组claudin
‑
5蛋白表达量的半定量图(mean
±
s.e.m,n=3,
***
p<0.01)。
16.图4:阿西替尼调控病理性血脑屏障渗透性减少,治疗阿尔兹海默症。(a)小动物活体成像仪定性观察各组脑组织中伊文思蓝分布强度。(b)图b所示为伊文思蓝荧光信号的半定量结果(mean
±
s.e.m,n=3,***p<0.01,**p<0.05)。
17.图5:阿西替尼治疗改善阿尔兹海默症模型动物病灶部位的aβ沉积。(a)dot blot对各实验组脑组织的aβ蛋白表达量进行分析。(b)各实验组aβ蛋白表达量的半定量图(mean
±
s.e.m,n=3,
***
p<0.01)。
18.图6:阿西替尼治疗改善阿尔兹海默症模型动物病灶部位的乙酰胆碱酯酶表达。(a)数字切片扫描仪观察各实验组脑组织的乙酰胆碱酯酶表达结果。(b)image j对乙酰胆碱酯酶表达的半定量分析结果。(c)紫外分光光度法定量检测各实验组脑组织的乙酰胆碱酯酶含量(mean
±
s.e.m,n=3,***p<0.01)。
19.图7:阿西替尼治疗改善阿尔兹海默症模型细胞与模型动物的氧化应激水平。(a)共聚焦激光扫描显微镜观察各实验组模型细胞的ros含量。(b)image j对a图进行荧光半定量分析结果。(c)数字切片扫描仪观察各实验组脑组织的8
‑
羟基鸟苷(8
‑
ohg)表达结果。(d)image j对c图进行荧光半定量分析结果(mean
±
s.e.m,n=3,***p<0.01)。
20.图8:阿西替尼治疗改善阿尔兹海默症模型细胞的炎症反应,抑制细胞凋亡。(a)各实验组细胞培养液中tnf
‑
α含量。(b)各实验组细胞培养液中il
‑
1β含量(mean
±
s.e.m,n=3,***p<0.01)。
21.图9:阿西替尼治疗后可以改善阿尔兹海默症模型动物对空间和方向的学习记忆能力以及学习记忆行为。(a)各实验组的morris水迷宫逃逸时间记录图(mean
±
s.e.m,n=6)。(b)各实验组的组的代表性morris水迷宫路线记录图。
22.图10:尼达尼布(nintedanib)、帕唑帕尼(pazopanib)、阿西替尼(axitinib)不同的给药方式,减少阿尔兹海默症模型动物的病灶部位的乙酰胆碱酯酶含量。(a)紫外分光光度法定量检测灌胃给药组脑组织的乙酰胆碱酯酶含量。(b)紫外分光光度法定量检测腹腔给药组脑组织的乙酰胆碱酯酶含量。(c)紫外分光光度法定量检测尾静脉给药组脑组织的乙酰胆碱酯酶含量(mean
±
s.e.m,n=3,***p<0.01)。
具体实施方式
23.为了便于理解,以下将通过具体的附图和实施例对本发明所提供的一种vegfr抑制剂阿西替尼在制备抗阿尔兹海默症中的应用进行详细地描述。需要特别指出的是,具体的实施例中选择的阳性对照药物为fda批准的ad治疗药物多奈哌齐(donepezil,dpz),以突出阿西替尼对阿尔兹海默症实现了较好的治疗作用。特别说明的是,本发明选择了不同的vegfr抑制剂尼达尼布(nintedanib)、帕唑帕尼(pazopanib)、阿西替尼(axitinib)作为治疗药物,并对这三种治疗药物的不同给药方式进行了研究,以筛选出较优的给药方式。进一
步指出的是,具体实施例和附图仅是为了说明,显然本领域的技术人员可以根据本文说明,在本发明的范围内对本发明做出各种各样的修正和改变,这些修正和改变也纳入本发明的范围内。
24.实施例一 阿尔兹海默症引起血脑屏障功能性破坏
25.1.1构建生理性血脑屏障细胞模型以鼠源脑微血管内皮细胞bend.3为模型细胞,取0.5ml生长状态良好的bend.3细胞悬液接种于孔径0.4μm的12孔transwell板小室,接种密度为1
×
105个/孔,外室补加1.5ml新鲜培养液,37℃、5%co2条件下连续培养15天,隔天更换新鲜培养液。采用细胞电阻仪测定细胞跨膜电阻值,当跨膜电阻值大于150欧姆
·
平方厘米(ω
·
cm2),即为生理性血脑屏障细胞模型。
26.1.2构建病理性血脑屏障细胞模型以bend.3、pc
‑
12为模型细胞,取1.5ml生长良好的pc
‑
12细胞悬液以2
×
105个/孔的细胞密度接种于12孔板中。37℃、5%co2培养至细胞贴壁。然后将上述生长有bend.3细胞的transwell小室转移至生长有pc
‑
12细胞的12孔板中,继续共培养24h,即可得到病理性bbb细胞模型。
27.1.3阿尔兹海默症下调模型细胞的紧密连接蛋白,增加血脑屏障渗透性以实例一中的方法1.2构建生理性和病理性血脑屏障细胞模型,之后弃去培养液,pbs清洗3次,在transwell小室中加入0.5ml hbss溶液,外室补加1.5ml hbss溶液,细胞置于37℃平衡30min,跨膜电阻仪检测模型细胞的跨膜电阻,结果如图1a所示。以实例一中的方法1.2构建生理性和病理性血脑屏障细胞模型,之后弃去培养液,pbs清洗3次,在transwell小室中加入0.5ml fitc荧光标记的右旋糖苷(分子量为10kda,浓度为0.5mg/ml)hbss溶液,外室补加1.5ml hbss溶液,细胞置于37℃避光孵育4h。之后用荧光分光光度计检测经transwell小室转移至外室的fitc
‑
右旋糖苷的浓度,结果如图1b所示。
28.根据图1所示的结果可知,病理性血脑屏障细胞模型中,pc
‑
12细胞与bend.3细胞共孵育24h后,细胞跨膜电阻值降低,血脑屏障渗透性增加,fitc
‑
右旋糖苷跨膜转运增加。实施例二 阿西替尼上调脑微血管内皮细胞的紧密连接蛋白,恢复血脑屏障功能
29.2.1免疫荧光法检测各组的紧密连接蛋白表达将bend.3细胞以1
×
105个/孔的密度接种于带有细胞爬片的24孔板中,细胞置于37℃、5%co2连续培养7天。实验分组为normal组、ad组、ad dpz组、和ad axitinib组。normal组正常培养细胞;后三组先经aβ1‑
42
孵育24h,之后再加入多奈哌齐或阿西替尼处理24h。之后用pbs清洗细胞3次,4%甲醛固定,10%牛血清白蛋白封闭半小时,加入紧密连接蛋白claudin
‑
5一抗(1:200,单克隆抗体,invitrogen公司)并于4℃孵育过夜。pbs清洗3次,最后加入fitc标记的荧光二抗(1:200,中国上海翊圣公司)室温避光孵育2h,hoechst复染细胞核。共聚焦激光扫描显微镜观察claudin
‑
5的表达情况,结果如图2所示。
30.2.2免疫印迹法观察各组的免疫荧光法检测各组的紧密链接蛋白表达将bend.3细胞以2
×
105个/孔的密度接种于6孔板中,细胞置于37℃、5%co2连续培养7天。实验分组为normal组、ad组、ad dpz组、ad组 axitinib组。normal组正常培养细胞,后三组先经aβ1‑
42
孵育24h,之后再加入多奈哌齐或阿西替尼处理24h。最后将各组细胞弃去培养液,pbs清洗3次,并用含有蛋白抑制剂、pmsf、ripa的蛋白质裂解液提取蛋白,并进行蛋
白质免疫印迹,分析各组的紧密连接蛋白claudinn
‑
5表达量,结果如图3所示。
31.根据图2、图3的结果可知,ad的病理学过程导致bend.3细胞的紧密连接蛋白claudin
‑
5表达下调,经多奈哌齐和阿西替尼治疗后,紧密连接蛋白claudin
‑
5表达增加,渗透性降低;且阿西替尼的治疗效果优于多奈哌齐。
32.实施例三 阿西替尼调控阿尔兹海默症模型动物血脑屏障渗透性
33.3.1构建阿尔兹海默症模型动物选择雄性c57/bl6小鼠(10w
‑
12w)为模型动物,借助脑立体定位仪,将浓度为1mg/ml的aβ1‑
42
低聚体注射到小鼠的海马(注射坐标位于前囟后2.3毫米,右侧1.8毫米,深度为2毫米)区域,注射量为5μl/只,注射时间为5分钟。注射完毕后,在颅骨表面完成缝合,并将手术小鼠置于spf级环境正常饲养一周,以构建阿尔兹海默症模型动物。
34.3.2阿西替尼治疗后,阿尔兹海默症模型动物脑内伊文思蓝渗透量显著降低动物分组如下:normal组、ad组、ad dpz组、ad axitinib组。给药方案如下:ad组按照10mg/kg的给药剂量每天腹腔注射生理盐水,连续注射7天;ad dpz组:将盐酸多奈哌齐溶解于生理盐水中,按照1mg/kg的给药剂量腹腔注射多奈哌齐溶液,连续给药10天;ad axitinib组:将阿西替尼溶解于dmso,并用0.2%注射级吐温80溶液稀释,按照10mg/kg的给药剂量尾静脉注射阿西替尼溶液,连续给药7天。治疗结束后,按照10mg/kg的给药剂量尾静脉注射伊文思蓝溶液,体循环4h后,麻醉小鼠并心脏灌流,取出完整大脑。小动物活体成像仪定性观察伊文思蓝在脑中的分布强度,结果如图4所示。
35.根据图4的结果可知,与阿尔兹海默症脑组织相比,经阿西替尼和多奈哌齐治疗后伊文思蓝入脑含量均有不同程度的降低,但阿西替尼治疗组效果好于优于多奈哌齐组,表明阿西替尼可以降低阿尔兹海默症的血脑屏障渗透性,促进病理性血脑屏障恢复至生理性状态。
36.实施例四 阿西替尼治疗后缓解阿尔兹海默症模型动物病理进程
37.4.1构建阿尔兹海默症模型动物选择雄性c57/bl6小鼠(10w
‑
12w)为模型动物,借助脑立体定位仪,将浓度为1mg/ml的aβ1‑
42
低聚体注射到小鼠的海马(注射坐标位于前囟后2.3毫米,右侧1.8毫米,深度为2毫米)区域,注射量为5μl/只,注射时间为5分钟。注射完毕后,在颅骨表面完成缝合,并将手术小鼠置于spf级环境正常饲养一周,以构建阿尔兹海默症模型动物。
38.4.2阿西替尼治疗后,显著降低阿尔兹海默症模型动物病灶部位的aβ沉积按照实施例三中的方法3.2将模型动物分组并治疗,治疗结束后,随机选取各治疗组模型动物各3只,将小鼠麻醉处死,取全脑,pbs清洗脑部表面残留的血渍,之后取出完整海马匀浆,并用含有蛋白抑制剂、pmsf、ripa的蛋白裂解液提取蛋白,并进行斑点印迹杂交(dot blot),分析各组的淀粉样蛋白aβ表达量。结果如图5所示。
39.根据图5的结果可知,与正常小鼠相比,阿尔兹海默症小鼠病灶部位的aβ蛋白沉积显著增加。经多奈哌齐和阿西替尼治疗后实验组小鼠病灶部位的aβ蛋白沉积均有不同程度的降低,但阿西替尼治疗组效果好于优于多奈哌齐组,表明阿西替尼可以较好地降低阿尔兹海默症的aβ蛋白沉积。
40.4.3阿西替尼治疗后,显著降低阿尔兹海默症模型动物病灶部位的乙酰胆碱酯酶水平
按照实施例三中的方法3.2将模型动物分组并治疗,治疗结束后,随机选取各治疗组模型动物各3只,将小鼠麻醉处死,取全脑,4%甲醛固定过夜,石蜡包埋并切片,免疫组化染色观察脑组织乙酰胆碱酯酶(acetylcholinesterase,ache)表达,荧光显微镜采集图像并拍照,结果如图6a所示。
41.按照实施例三中的方法3.2将模型动物分组并治疗,治疗结束后,随机选取各治疗组模型动物各3只,将小鼠麻醉处死,取全脑,pbs清洗脑部表面残留的血渍,并用30%蔗糖水溶液脱水处理5分钟。之后取出完整海马匀浆,根据乙酰胆碱酯酶试剂盒进行处理,紫外分光光度法测定各组的乙酰胆碱酯酶表达量。结果如图6c所示。
42.根据图6的结果可知,阿尔兹海默症组的乙酰胆碱酯酶表达量较正常组明显升高,造成脑中的乙酰胆碱含量降低。阿西替尼和盐酸多奈哌齐治疗后,可以显著降低乙酰胆碱酯酶的表达,且阿西替尼治疗组效果优于盐酸多奈哌齐组。
43.4.4阿西替尼治疗后,显著降低阿尔兹海默症模型细胞与模型动物的氧化应激水平将pc
‑
12细胞以1
×
104个/孔的密度接种于细胞培养皿中,细胞置于37℃、5%co2连续培养24h。实验分组为normal组、ad组、ad dpz组、ad组 axitinib组,normal组正常培养细胞,后三组先经aβ1‑
42
孵育24h,之后再加入多奈哌齐或阿西替尼处理24h。最后将各组细胞弃去培养液,pbs清洗3次。之后加入活性氧(ros)检测探针继续孵育20分钟,pbs清洗3次。共聚焦激光扫描显微镜观察各实验组的绿色荧光表达量,结果如图7a所示。
44.按照实施例三中的方法3.2将模型动物分组并治疗,治疗结束后,随机选取各治疗组模型动物各3只,将小鼠麻醉处死,取全脑,4%甲醛固定过夜,石蜡包埋并切片,免疫组化染色观察各实验组模型动物海马处的8
‑
羟基鸟苷(8
‑
ohg)表达,荧光显微镜采集图像并拍照,结果如图7c所示。
45.根据图7的结果可知,阿尔兹海默症组的ros和8
‑
ohg表达量较正常组明显增加,造成脑中的氧化应激水平提升。阿西替尼和盐酸多奈哌齐治疗后,明显减少ros和8
‑
ohg表达,降低氧化应激水平,提示阿西替尼和多奈哌齐对阿尔兹海默症所致的神经元氧化应激损伤具有保护作用,且阿西替尼治疗组效果优于盐酸多奈哌齐组。
46.4.5阿西替尼治疗后,显著降低阿尔兹海默症模型细胞的炎症反应,减少细胞凋亡elisa试剂盒测定细胞因子tnf
‑
α、il
‑
1β的分泌,评价阿西替尼治疗后对阿尔兹海默症模型细胞炎症反应的影响。将pc
‑
12以1
×
105个/孔的细胞密度接种于6孔板中,5%co2、37℃条件培养12h,实验分组及给药方式同4.4法。继续孵育24h后收集培养上清液,elisa检测试剂盒测定培养各实验组上清液终细胞因子tnf
‑
α、il
‑
1β含量。
47.根据图8得结果可知,阿尔兹海默症组的tnf
‑
α和il
‑
1β表达量较正常组显著增加,造成脑中的炎症水平升高。阿西替尼和盐酸多奈哌齐治疗后,明显减少tnf
‑
α和il
‑
1β表达,提示阿西替尼和多奈哌齐对阿尔兹海默症所致的炎症反应化具有保护作用,且阿西替尼治疗组效果优于盐酸多奈哌齐组。
48.4.6阿西替尼治疗后,阿尔兹海默症小鼠的空间学习记忆能力明显改善治疗结束后通过morris水迷宫实验分析各组小鼠定位航行和空间探索行为,以判断药物治疗后对提高学习记忆和空间记忆的影响。前5天,每日将小鼠头朝池壁固定从同一象限入水,记录其自入水后至找到平台所需时间。每只小鼠每日进行4次测试,每次测试间
隔至少15分钟,4次测试的平均值作为当天最终成绩。第6天撤除平台,将小鼠面向池壁从同一象限放入水中,记录自入水后至找到原平台所在位置所需时间和距离,即为逃逸时间和逃逸距离。结果如图9所示。
49.结果如图9所示,与阿尔兹海默症组相比,经阿西替尼和多奈哌齐治疗后,可显著提高阿尔兹海默症模型动物的学习记忆能力,且阿西替尼治疗效果优于多奈哌齐。
50.实施例五 阿西替尼及其类似物采用不同的给药方式,减少阿尔兹海默症模型动物病灶部位的乙酰胆碱酯酶含量选择不同的vegfr抑制剂尼达尼布(nintedanib)、帕唑帕尼(pazopanib)、阿西替尼(axitinib)作为治疗药物,并对这三种治疗药物的不同给药方式进行了研究。以评估不同的vegfr抑制剂,不同的给药方式对阿尔兹海默症的治疗效果。动物分组如下:normal组、ad组、ad dpz组、ad nintedanib组、ad panzopanib组、ad axitinib组。给药方案如下:ad组按照10mg/kg的给药剂量每天腹腔注射生理盐水,连续注射7天;ad dpz组:将多奈哌齐溶解于生理盐水中,按照1mg/kg的给药剂量腹腔注射多奈哌齐溶液,连续给药10天;ad nintedanib、ad panzopanib组、ad axitinib组:分别将尼达尼布、帕唑帕尼、阿西替尼溶解于dmso,并用0.2%注射级吐温80溶液稀释,按照10mg/kg的给药剂量灌胃、腹腔、以及尾静脉给药,连续给药7天。
51.治疗结束后,随机选取各治疗组模型动物各3只,将小鼠麻醉处死,取全脑,pbs清洗脑部表面残留的血渍,并用30%蔗糖水溶液脱水处理5分钟。之后取出完整海马匀浆,根据乙酰胆碱酯酶试剂盒进行处理,紫外分光光度法测定各组的乙酰胆碱酯酶表达量。结果如图10所示。
52.根据图10的结果可知,阿尔兹海默症组的乙酰胆碱酯酶表达量较正常组明显升高,造成脑中的乙酰胆碱含量降低。盐酸多奈哌齐治疗后乙酰胆碱酯酶表达降低;经尼达尼布、帕唑帕尼、阿西替尼治疗后,进一步降低乙酰胆碱酯酶的表达,且灌胃给药和尾静脉给药优于腹腔给药。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。