1.本发明涉及一种具有增香功能的乳扇发酵菌株、乳扇发酵剂及其应用,属于生物发酵技术领域。
背景技术:
2.乳扇是我国云南地区特有的发酵乳制品,属于拉伸型酸凝奶酪。其营养丰富,风味独特,在我国西南地区广受消费者喜爱,有助于填补国产奶酪市场份额的空缺。
3.目前乳扇的生产仍存在诸多问题,主要原因是乳扇的生产依然沿袭传统的家庭手工作坊式。生产工艺、设备的落后导致其与工业生产相比产率低下,产量不足;同时由于乳扇多是生产者依靠自身经验制作,没有标准可供参照,生产的产品风味等品质迥异。奶酪制品的感官品质是影响其消费者接受度的重要因素,其中风味属性作为最为直接且重要的感官品质,直接影响到消费者的购买意向。乳扇的风味主要由其中的挥发性化合物赋予,这些化合物主要产生于其中的脂肪、蛋白质水解和乳糖的代谢等微生物代谢反应。乳扇风味品质不稳定、风味物质形成机制不明晰等问题俨然成为产品标准化生产的瓶颈,严重限制了乳扇的工业化生产进程。
4.微生物的活动是奶酪成熟过程中风味形成的关键,且奶酪成熟过程中微生物菌群演替规律和风味物质的代谢变化具有一定的关联性。近年来有不少研究表明通过添加特定菌株可以提高某些特定香气化合物的浓度从而改善奶酪的风味。对于乳扇的发酵剂—酸水而言,最初的微生物组成可以很大程度上影响乳扇产品中微生物的组成,继而对乳扇风味产生影响。但是单一的菌株难以达到良好的香气改善效果,同时也会对乳扇的制作产生影响。
技术实现要素:
5.本发明所要解决的技术问题是:针对现有传统手工奶酪乳扇存在没有固定发酵剂造成的微生物组成不一致,且风味特性不稳定的问题。
6.为了解决上述技术问题,本发明提供了一种具有增香功能的乳扇发酵菌株,为植物乳杆菌ml9和胶红酵母2
‑
3中的至少一种;
7.所述植物乳杆菌ml9的拉丁名为lactiplantibacillus plantarum ml9,保藏编号为cctcc m 2021745,保藏单位为保藏于中国典型培养物保藏中心,保藏地址为湖北省武汉市武昌区八一路珞珈山,保藏日期为2021年6月23日,。
8.所述胶红酵母2
‑
3的拉丁名为rhodotorula mucilaginosa 2
‑
3,保藏编号为cctcc m 2021747,保藏单位为中国典型培养物保藏中心,保藏地址为湖北省武汉市武昌区八一路珞珈山,保藏日期为2021年6月23日。
9.本发明还提供了上述的具有增香功能的乳扇发酵菌株在制备乳扇发酵剂中的应用。
10.本发明还提供了一种具有增香功能的乳扇发酵剂,为一种经权利要求1所述的具
有增香功能的乳扇发酵菌株发酵的酸水。
11.优选地,所述乳扇发酵剂包含经植物乳杆菌ml9发酵的酸水a和经胶红酵母2
‑
3发酵的酸水b。
12.优选地,所述酸水a和酸水b的体积比为1:1。
13.优选地,所述乳扇发酵剂的制备方法包括以下步骤:
14.步骤1:将生牛乳预热后加入传统酸水,持续加热,待牛乳凝固;
15.步骤2:使用滤网过滤掉凝结块,剩下乳清即为新制酸水;
16.步骤3:取新制酸水,接入植物乳杆菌ml9,室温下发酵,制得酸水a;
17.步骤4:取新制酸水,接入胶红酵母2
‑
3,室温下发酵,制得酸水b;
18.步骤5:将酸水a和酸水b混合即得乳扇发酵剂。
19.优选地,所述制备方法的步骤1中预热和持续加热的温度均为65℃;所述生牛乳与传统酸水的质量比为1:1。
20.优选地,所述制备方法的步骤3中植物乳杆菌ml9的接种浓度为2.0~2.8
×
104cfu/ml,所述发酵的时间为5
‑
6天。
21.优选地,所述制备方法的步骤4中胶红酵母2
‑
3的接种浓度为5.2~6.0
×
105cfu/ml,所述发酵的时间为5
‑
6天。
22.本发明还提供了上述的具有增香功能的乳扇发酵剂在制备乳扇中的应用。
23.与现有技术相比,本发明的有益效果在于:
24.1.本发明通过选择合适的产香菌株,以及确定核心产香菌株的比例,获得了一种具有增香功能的人工乳扇发酵剂,有效解决了现有的传统乳扇生产中的由于没有固定发酵剂造成的批次间风味特性不稳定的问题;
25.2.本发明提供的具有增香功能的乳扇人工发酵剂,其组分包含几种完全以乳扇为来源,并对乳扇风味起到重要作用的菌株,使之制备的乳扇能在风味特性上优于传统酸水制备的乳扇,弥补了传统酸水制备乳扇在风味上的不足;
26.3.通过采用电子鼻的技术手段比较本发明的人工乳扇发酵剂发酵的酸水制备的乳扇与传统酸水制得的乳扇的香气轮廓,发现前者中多种香气物质含量及其整体香气强度提高,说明本发明的人工乳扇发酵剂可以有效增强乳扇的整体香气。
附图说明
27.图1显示了乳扇核心菌群与挥发性香气组分(oav≥1)之间的相关性;
28.图2显示了乳扇制作过程中微生物与挥发性化合物相关性分析;
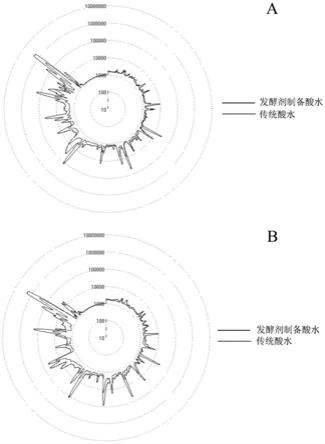
29.图3显示了两种乳扇的电子鼻香气轮廓分析。
30.保藏说明
31.植物乳杆菌ml9(lactiplantibacillus plantarum ml9),保藏于中国典型培养物保藏中心,湖北省武汉市武昌区八一路珞珈山,保藏日期为2021年6月23日,保藏编号为cctcc m 2021745。
32.胶红酵母2
‑
3(rhodotorula mucilaginosa 2
‑
3),保藏于中国典型培养物保藏中心,湖北省武汉市武昌区八一路珞珈山,保藏日期为2021年6月23日,保藏编号为cctcc m 2021747。
具体实施方式
33.为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。
34.以下实施例中对菌种的鉴定采用如下方法:
35.对菌株进行16s rdna/its序列鉴定。在鉴定前,对dna序列进行pcr扩增,其反应体系为:2μl的nl1(5
’‑
gcatatcaataagcggaggaaaag
‑3’
)(seq id no:1);2μl的nl4(5
’‑
ggtccgtgtttcaagacgg
‑3’
)(seq id no:2);2μl dna;19μl的ddh2o;25μl的2
×
gold star best mixed。pcr反应程序为:(1)95℃10min,(2)94℃30s,(3)55℃30s,(4)72℃20s,步骤(2)~(4)重复30个循环,(5)72℃5min,(6)4℃保存。2μl的27f引物(5
’‑
gagagtttgatcctggctcag
‑3’
)(seq id no:3);2μl的1492r引物(5
’‑
tacggctaccttgttacgac
‑3’
)(seq id no:4);2μl dna;19μl的ddh2o;25μl的2
×
gold star best mixed。pcr反应程序为:(1)95℃10min,(2)94℃30s,(3)55℃30s,(4)72℃1.5min,步骤(2)~(4)重复30个循环,(5)72℃5min,(6)4℃保存。然后将pcr产物用1.0%琼脂糖进行凝胶电泳检测,在100v电压下0.5
×
tae电泳液中电泳20min,然后在凝胶成像仪上对提取效果进行检测,若可见到清晰的条带,并且无明显非特异性扩增,即可判断pcr成功。再将菌株进行16s rdna序列与genbank中己知菌株序列进行比对。
36.以下实施例中所用到的传统酸水的制备方法为:未成熟的新鲜青木瓜或干木瓜加水煮沸,小火煮半小时,过滤后得到酸水。
37.实施例1
38.乳扇中的核心菌群分析:
39.对来自云南六个地区(昆明、玉溪、邓川、喜洲、剑川和巍山)的乳扇样品低温运输至实验室,用无菌研钵将样品捣碎,并称取10g研磨成粉末的样品放入90ml无菌生理盐水(0.85g/100ml)中,混合均匀,得到悬浊液备用。将混匀后的悬浊液以5000r/min离心2min,收集离心后的菌体并放置于冰盒中。利用tianamp stool dna kit粪便基因组dna提取试剂盒对收集的菌体进行dna的提取。提取出的dna置于
‑
20℃条件下保存。将提取得到的dna分别用引物nl1(5
’‑
gcatatcaataagcggaggaaaag
‑3’
)(seq id no:1)、nl4(5
’‑
ggtccgtgtttcaagacgg
‑3’
)(seq id no:2)和引物27f(5
’‑
gagagtttgatcctggctcag
‑3’
)(seq id no:3)、1492r(5
’‑
tacggctaccttgttacgac
‑3’
)(seq id no:4)进行pcr反应,pcr反应体系为50.0μl,包括2μl dna,25μl 2
×
goldstar best mastermix,2μl正向引物(100μm),2μl反向引物(100μm),用ddh2o补足50.0μl。pcr反应程序为(引物为nl1和nl4):(1)95℃10min,(2)94℃30s,(3)55℃30s,(4)72℃20s(引物为27f和1492r时,为1.5min),步骤(2)~(4)重复30个循环,(5)72℃5min,(6)4℃保存。然后将pcr产物用1.0%琼脂糖进行凝胶电泳检测,在100v电压下0.5
×
tae电泳液中电泳20min,然后在凝胶成像仪上对提取效果进行检测,若可见到清晰的条带,并且无明显非特异性扩增,即可判断pcr成功。利用细菌16srdna引物338f(5
’‑
actcctacgggaggcagcag
‑3’
)(seq id no:5)和806r(5
’‑
ggactachvgggtwtctaat
‑3’
)(seq id no:6),真菌its引物its1f(5
’‑
cttggtcatttagaggaagtaa
‑3’
)(seq id no:7)和its2r(5
’‑
gctgcgttcatcgatgc
‑3’
)(seq id no:8)进行目标片段pcr扩增。pcr反应体系为20.0μl(引物为338f和806r),包括2μl 2.5mm dntps,4μl 5
×
fastpfu buffer(引物为its1f和its2r时,为2μl 10
×
buffer),0.8μl forward primer(5μm),0.8μl reverse primer(5μm),0.4μl fastpfu polymerase(引物
为its1f和its2r时,为0.2μl rtaq polymerase),0.2μl bsa,10ng template dna,用ddh2o补足20.0μl。pcr反应程序为(引物为338f和806r,its1f和its2r):(1)95℃3min,(2)95℃30s,(3)55℃30s,(94)72℃45s,步骤(2)~(4)重复35个循环,(5)72℃10min,(6)10℃直到停止。产物经胶回收后,参照电泳初步定量结果,将pcr扩增回收产物进行荧光定量,荧光试剂为quant
‑
it picogreen dsdna assay kit,定量仪器为microplate reader(biotek,flx800)。根据荧光定量结果,按照每个样本的测序量需求,对各样本按相应比例进行混合。最后使用miseq平台进行宏基因组测序。
40.通过高通量测序的技术对来自六个地区的乳扇样品(昆明、玉溪、邓川、喜洲、剑川和巍山)的微生物进行了测序分析。得到六个地区乳扇样品中共有的丰度含量大于1%的优势细菌分别是乳球菌属(lactococcus,39.96%)、乳杆菌属(lactobacillus,16.65%)、拉乌尔菌属(raoultella,8.38%)、链球菌属(streptococcus,7.32%)、醋杆菌属(acetobacter,4.99%)、不动杆菌属(acinetobacter,3.44%)、克雷伯氏菌属(klebsiella,2.54%)、明串珠菌属(leuconostoc,2.44%)、金黄杆菌属(chryseobacterium,2.16%)、水栖菌属(enhydrobacter,1.59%)、肠球菌属(enterococcus,1.45%)和假单胞菌属(pseudomonas,1.28%);丰度含量大于1%的优势真菌分别是红酵母属(rhodotorula,36.09%)、孢圆酵母(torulaspora,17,65%)、假丝酵母属(candida,16.61%)、路德酵母属(lodderomyces,7.82%)、长西氏酵母属(naganishia,5.83%)、(cystofilobasidium,2.98%)、丝孢酵母属(trichosporon,2.94%)、毕赤酵母属(pichia,2.85%)、德克酵母属(dekkera,2.55%)和克鲁维酵母属(kluyveromyces,2.52%)。
41.实施例2
42.乳扇中核心菌群与挥发性香气组分(oav≥1)的相关性分析:
43.用spme
‑
gc
‑
ms测定六个地区乳扇样品中的挥发性香气化合物。具体方法如下:精确称量4.0g的发酵样品于15ml的萃取瓶中,加入内标物100μl 20mg/l的2
‑
辛醇,在60℃的恒温水浴锅中平衡5min,将老化20min后的萃取头装置(75μm car/pdms)插入15ml的萃取瓶中,于60℃下萃取40min。
44.然后,萃取完成后,将萃取头推入250℃的气相进样口中解吸5分钟,结合gc
‑
ms对所提取的挥发性化合物进行分析鉴定。气相色谱条件如下:色谱柱:hp
‑
innowax(60m
×
0.25mm
×
0.25μm);进样口温度:250℃;程序升温:40℃保持4min,4℃/min升至100℃,保持2min,3℃/min升至150℃,最后以10℃/min升到230℃,保持5min;载气:氦气(纯度为99.99%);流量:1ml/min;进样方式:不分流进样。质谱条件:电子轰离能:70ev;离子源温度:230℃;四极杆温度:150℃;发射电流:35μa;扫描速度:1.9scans/s;质量扫描范围:30
‑
450amu。每次解吸完成后,均需将萃取头在250℃下的老化仪器中进行老化20min。每个样品重复分析3次。
45.最后经过定性定量分析对香气有贡献的化合物(oav≥1)一共有13种,包括7种酸类、4种酯类、1种醛类和1种酚类物质。计算乳扇样品中13种主要挥发性成分与核心菌群之间的pearson相关性系数,并利用cytoscape软件进行了可视化,结果如图1所示。结果表明,乳杆菌属分别与辛酸、己酸、丁酸、己酸乙酯和辛酸乙酯之间存在显著正相关。优势真菌属红酵母属则分别与庚酸、辛酸、癸酸和丁酸异丁酯之间存在显著正相关。说明这两种菌对乳
扇风味的形成具有较大的贡献。
46.实施例3
47.乳扇及酸水中产香优势菌的筛选及验证:
48.分析乳扇制作过程中变化的挥发性化合物与优势菌属的相关性,通过形态和16s rrna/its基因序列分析鉴定得到的10株乳杆菌和7株红酵母分别添加到传统酸水发酵制作乳扇进行分析,筛选乳扇发酵剂中提升乳扇整体风味的最佳产香优势菌。
49.乳扇制作过程中挥发性化合物变化测定方法,具体步骤如下:
50.1)以从云南省大理州洱源县采集的新鲜酸水和乳扇样品为原料,酸水发酵后的第0、3和6天取样,每个时间点采集五份样本,标记为s0(0
‑
1,0
‑
2,0
‑
3,0
‑
4,0
‑
5)、s3(3
‑
1,3
‑
2,3
‑
3,3
‑
4,3
‑
5)和s6(6
‑
1,6
‑
2,6
‑
3,6
‑
4,6
‑
5)取样时酸水样品充分搅拌后分别从发酵罐的上部、中部和底部取样;乳扇制作完成后的第0和24小时取样,每个时间点采集5份样本,标记为r0(0
‑
1,0
‑
2,0
‑
3,0
‑
4,0
‑
5)和r24(24
‑
1,24
‑
2,24
‑
3,24
‑
4,24
‑
5),每份样品取一块完整的乳扇。采集的样品采用低温真空密封;
51.2)顶空固相微萃取:称量3g的乳扇样品于15ml的萃取瓶中,加入100μl 2
‑
辛醇(13μg/l)作为内标。萃取瓶在60℃恒温水浴锅中平衡5min,将老化20min后的萃取头装置插入其中,在60℃下萃取35min。萃取完成后,将萃取头插入老化过的气相色谱质谱联用仪中进行挥发性化合物的检测分析;
52.3)gc
‑
ms分析样品中挥发性化合物:
53.色谱条件:色谱柱:hp
‑
innowax(60m
×
0.25mm
×
0.25μm);进样口温度:250℃;程序升温:40℃保持4min,3℃/min升至100℃,保持2min,4℃/min升至150℃,最后以10℃/min升到230℃,保持5min:载气:氦气(纯度为99.99%);流量:1ml/min;进样方式:不分流进样;
54.质谱条件:离子源:electron ionization;电离能:70ev;离子源温度:230℃;四极杆温度:150℃;发射电流:35μa;扫描速度:1.9scans/s;质量扫描范围:50
‑
550amu。
55.每个样品重复测定3次,如表1所示,化合物定性定量后计算oav值筛选得到乙酸乙酯等16种化合物。分析乳扇和酸水中优势菌属与16种挥发性化合物的相关性,如图2所示,乳杆菌属和红酵母属与乳扇成熟风味显著相关的醛类物质之间存在强相关性,乳杆菌属和红酵母属对乳扇风味贡献较大。
56.表1乳扇制作过程中挥发性化合物的变化
57.[0058][0059]
表1中的ri表示hp
‑
innowax色谱柱上挥发性化合物的保留指数;a表示保留指数的计算值与文献值一致;b表示鉴定方法:ms,使用nist11.l数据库进行质谱比较;nd表示未在样品中检测到。
[0060]
产香菌产香能力的验证,具体步骤如下:
[0061]
1)分别将鉴定得到的植物乳杆菌和红酵母菌株活化后接种到新制的酸水中,发酵6天得到成熟的酸水;
[0062]
2)将分别添加待验证的产香菌发酵的酸水与传统酸水1:1混合作为制作乳扇的酸水;
[0063]
3)将添加产香菌发酵与传统酸水复配制成的酸水按乳扇制作方法应用于乳扇制作;
[0064]
4)乳扇风味分析:乳扇风味分析方法与实施例2应用spme
‑
gc
‑
ms测定乳扇样品中的挥发性香气化合物方法相同;
[0065]
5)以乳扇制作过程中变化的挥发性化合物及与乳扇中微生物存在相关性的化合物为指标筛选已鉴定17株香气贡献菌中最佳的产香优势菌。
[0066]
结果如表2所示,添加了植物乳杆菌
‑
2、植物乳杆菌
‑
4和干酪乳杆菌
‑
1的乳扇中,检测到的相应的挥发性化合物种类更多,且在这3株菌中,植物乳杆菌
‑
4产生的辛酸乙酯、丁酸、己醛和壬醛等物质显著(p<0.05)高于其它菌株;如表3所示,添加了胶红酵母
‑
3和胶红酵母
‑
4的乳扇中,所有相关的挥发性化合物都被检测到,且多个物质在添加了胶红酵母
‑
3的乳扇中的浓度都要显著(p<0.05)高于胶红酵母
‑
4。因此,植物乳杆菌
‑
4和胶红酵母
‑
3是最佳的产香优势菌。对两株菌株进行16s rdna/its序列鉴定,并与genbank中己知菌株序列进行比对,植物乳杆菌
‑
4为植物乳杆菌ml9,其拉丁名为lactiplantibacillus plantarum ml9,保藏编号为cctcc m 2021745;胶红酵母
‑
3为胶红酵母2
‑
3,其拉丁名为rhodotorula mucilaginosa 2
‑
3,保藏编号为cctcc m 2021747。
[0067]
表2乳杆菌筛选结果
[0068]
[0069][0070]
表2中,nd表示未在样品中检测到该物质,不同的上标字母表示显著性差异(p<0.05)。
[0071]
表3红酵母筛选结果
[0072][0073]
表3中,nd表示未在样品中检测到该物质,不同的上标字母表示显著性差异(p<0.05)。
[0074]
实施例4
[0075]
人工乳扇发酵剂的制备及乳扇的制作:
[0076]
一种具有增香功能的乳扇发酵剂组成(按接种浓度):植物乳杆菌2.42
×
104cfu/ml。接种浓度根据酸水在凝乳过程中的添加量、乳扇中细菌和真菌的菌落总数以及乳扇中核心菌群属水平的丰度来确定。
[0077]
酸水制备方法,具体步骤如下:
[0078]
1)预热:将生牛乳加热至65℃;
[0079]
2)凝乳:以质量比1:1的比例在牛乳中加入传统酸水,持续加热,待牛乳凝固;
[0080]
3)过滤:使用滤网过滤掉凝结块,剩下乳清即为新制酸水;
[0081]
4)发酵:将步骤3制得的酸水收集在容器内,接种植物乳杆菌菌株,室温发酵5
‑
6天,制得酸水。
[0082]
乳扇制备方法,具体步骤如下:
[0083]
1)预热:将生牛乳加热至65℃;
[0084]
2)凝乳:以质量比1:1的比例在牛乳中加入上述的酸水,持续加热,待牛乳凝固;
[0085]
3)热烫:将温度调至50℃,使用滤网滤掉乳清,使用夹具揉捏凝乳使其成块;
[0086]
4)拉伸成型:将凝乳块拿出,拉伸成扇状缠绕于晾晒竿上;
[0087]
5)风干:将晾晒竿挂于室外,自然风干24h,制得乳扇。
[0088]
实施例5
[0089]
人工乳扇发酵剂的制备及乳扇的制作:
[0090]
一种具有增香功能的乳扇发酵剂组成(按接种浓度):胶红酵母5.60
×
105cfu/ml。接种浓度根据酸水在凝乳过程中的添加量、乳扇中细菌和真菌的菌落总数以及乳扇中核心菌群属水平的丰度来确定。酸水制备方法,具体步骤如下:
[0091]
1)预热:将生牛乳加热至65℃;
[0092]
2)凝乳:以质量比1:1的比例在牛乳中加入传统酸水,持续加热,待牛乳凝固;
[0093]
3)过滤:使用滤网过滤掉凝结块,剩下乳清即为新制酸水;
[0094]
4)发酵:将步骤3制得的酸水收集在容器内,加入胶红酵母菌株,室温发酵5
‑
6天,制得酸水。
[0095]
乳扇制备方法,具体步骤如下:
[0096]
1)预热:将生牛乳加热至65℃;
[0097]
2)凝乳:以质量比1:1的比例在牛乳中加入上述的酸水,持续加热,待牛乳凝固;
[0098]
3)热烫:将温度调至50℃,使用滤网滤掉乳清,使用夹具揉捏凝乳使其成块;
[0099]
4)拉伸成型:将凝乳块拿出,拉伸成扇状缠绕于晾晒竿上;
[0100]
5)风干:将晾晒竿挂于室外,自然风干24h,制得乳扇。
[0101]
实施例6
[0102]
人工乳扇发酵剂的制备及乳扇的制作:
[0103]
将实施例4、5所得的酸水以体积比1:1的比例混合,即得人工乳扇发酵剂。
[0104]
乳扇制备方法,具体步骤如下:
[0105]
1)预热:将生牛乳加热至65℃;
[0106]
2)凝乳:以质量比1:1的比例在牛乳中加入上述的酸水发酵剂,持续加热,待牛乳凝固;
[0107]
3)热烫:将温度调至50℃,使用滤网滤掉乳清,使用夹具揉捏凝乳使其成块;
[0108]
4)拉伸成型:将凝乳块拿出,拉伸成扇状缠绕于晾晒竿上;
[0109]
5)风干:将晾晒竿挂于室外,自然风干24h,制得乳扇。
[0110]
对比例1
[0111]
传统酸水制备乳扇:
[0112]
1)预热:将生牛乳加热至65℃;
[0113]
2)凝乳:以质量比1:1的比例在牛乳中加入传统酸水,持续加热,待牛乳凝固;
[0114]
3)热烫:将温度调至50℃,使用滤网滤掉乳清,使用夹具揉捏凝乳使其成块;
[0115]
4)拉伸成型:将凝乳块拿出,拉伸成扇状缠绕于晾晒竿上;
[0116]
5)风干:将晾晒竿挂于室外,自然风干24h,制得乳扇。
[0117]
效果例1
[0118]
分别添加植物乳杆菌和胶红酵母发酵乳扇挥发性化合物种类比较:
[0119]
用spme
‑
gc
‑
ms测定乳扇的挥发性香气组分。具体方法如下:首先进行固相微萃取,取3g乳扇样品置于15ml顶空瓶中,加入100μl内标2
‑
辛醇(13μg/l),将顶空瓶放入60℃水浴锅中,平衡5min,然后将老化20min后的spme萃取头插入顶空瓶萃取乳扇样品35min。gc条件:色谱柱:hp
‑
innowax(60m
×
0.25mm
×
0.25μm);进样口温度:250℃;升温程序:初始温度40℃保持4min,以3℃/min升至100℃后,保持2min,再以4℃/min升至150℃,最后以10℃/min升到230℃,保持5min;载气为氦气(纯度为99.99%),流速1ml/min;进样方式:不分流进样。ms条件:electron ionization离子源;电子能量70ev;离子源温度:230℃;四极杆温度:150℃;发射电流:35μa;扫描速度:1.9scans/s;质量扫描范围:50
‑
550amu。
[0120]
将实施例4、5与对比例1进行挥发性香气种类的比较,如表4所示。
[0121]
表4不同菌株发酵乳扇的gc
‑
ms鉴定结果
[0122][0123]
从表4可以看出,添加了胶红酵母2
‑
3(保藏编号:cctcc m 2021747)的酸水制作的乳扇,乙酸、丁酸、己酸、癸酸、乙醇和戊醇的含量升高。添加了植物乳杆菌ml9(保藏编号:cctcc m 2021745)的酸水制作的乳扇,乙酸乙酯、乙酸异戊酯、己酸乙酯和辛酸乙酯等酯类物质含量升高。
[0124]
效果例2
[0125]
人工乳扇发酵剂制备的乳扇与传统酸水制备的乳扇香气轮廓比较:
[0126]
使用有14个传感器和smart nose智能识别软件系统的电子鼻(supernose,isenso group corporation,new york,usa)对乳扇香气进行分析。将每个乳扇样品于样品瓶中准确称取15.0g,静置30min后进行电子鼻分析,采用顶空吸气法,手动单样品进样,直接将进
样针头插入样品瓶,完成一次检测后系统进行清零和标准化。基于g/go比(g代表监测样气的14个传感器的电导率,go代表清洁空气),所有传感器响应数据都进行了评估。环境室控制如下:室温(25℃);传感器清洗流量6l/min;自动调零时间10s;内部和入口流速均为600ml/min。在样品检测时间的60秒内,每秒测量吸收的气体。每个样品分析三次。
[0127]
将实施例6与对比例1进行电子鼻香气轮廓的比较,如图3(a:非极性柱db
‑
5;b:中极性柱db
‑
1701)所示。
[0128]
结果如下:两种乳扇在整体香气轮廓上呈现出一定的差异性,与传统酸水制成的乳扇相比,使用发酵剂发酵酸水制备的乳扇样品在多个出峰位置峰面积明显增加,表明多种香气物质含量及其整体香气强度提高。结果表明,乳扇发酵剂可以有效增强乳扇的整体香气。
[0129]
上述实施例仅为本发明的优选实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。