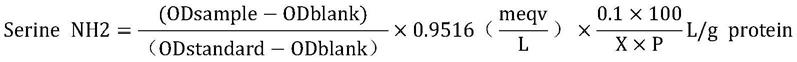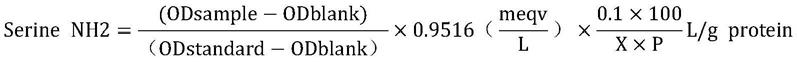
1.本发明涉及大豆多肽,具体涉及一种无苦味、风味良好、且降血脂活性显著的大豆多肽的制备方法,属于功能性食品大豆多肽的制备工艺技术领域。
背景技术:
2.高血脂症是一种血脂代谢紊乱的疾病,主要表现为总胆固醇(total cholesterol,tc)、甘油三酯(triglyceride,tg)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,ldl
‑
c)水平过高,高密度脂蛋白胆固醇(high densitylipopro
‑
tein cholesterol,hdl
‑
c)水平过低。高血脂症通常会引起内皮细胞、血管壁等的功能障碍和结构损伤,直接引发动脉粥样硬化、冠心病等一系列严重危害人类健康的疾病。目前,主要通过降血脂类化学药物来治疗高血脂症,常见的药物包括他汀类、树脂类、烟酸类、胆酸螯合剂等,其治疗成本较高,且毒副作用较大。大量研究表明,食源性天然活性产物包括多糖类、黄酮类、多酚类等对血脂具有一定调节作用,可作为功能性天然活性因子应用于高血脂症等的辅助治疗中。
3.我国是大豆的生产大国和消费大国,大豆中蛋白质含量丰富,氨基酸组成合理,是一种优质的植物蛋白补充剂。大豆提取油脂后的豆粕蛋白质含量进一步得到富集,是理想的大豆蛋白资源。大豆多肽是大豆蛋白经水解作用产生的一类化合物,其平均肽链长度为2~10个氨基酸残基,分子量通常<3000da。与大豆蛋白相比,大豆多肽不仅具有溶解性高、稳定性好等优良的加工特性,同时更易被人体消化吸收,具有抗氧化、抗疲劳、降血压、增强机体免疫力等功能特性,是一类应用广泛的功能性原料。现阶段,大豆多肽的制备主要以酶解法为主,该方法反应条件温和、易于控制、专一性强且产品安全性高,但由于酶促降解会使蛋白质分子结构内部的大量疏水性基团暴露出来,使得多肽往往带有一定的苦味及其它不良风味,且可溶性多肽得率不高,严重限制了其在食品领域的应用,并影响了生产效率和经济效益。因此,开发一款风味良好、功能性突出且得率高的大豆多肽产品是食品、保健品等行业多年来重点关注、亟待解决的重要议题之一。目前,多肽产品主要采用包埋法、发酵法、多种酶复合法等方法制备风味良好的产品,以及通过精制的方法提高多肽的功能特性,但这些方法往往都会增加生产成本,或降低功能成分的含量。
技术实现要素:
4.本发明的目的在于针对现有技术存在的问题,提供一种无苦味、风味良好、降血脂活性显著、工艺简便、易于控制、且适用于工业化生产的大豆多肽的制备方法。
5.本发明先以毛霉和乳酸菌联合发酵法自行制备复合蛋白酶,再采用复合蛋白酶及商业酶制剂联合酶解大豆分离蛋白,制备得到一种无苦味且降血脂活性显著的功能性大豆多肽。本发明的特色之处在于复合蛋白酶的制备。雅致放射毛霉是我国传统发酵食品(如腐乳、霉豆渣)中常用的优势菌种之一,它具有分泌蛋白酶、α
‑
淀粉酶、α
‑
半乳糖酶、脂肪酶等多种酶系的能力,以蛋白酶为主,其它酶的活性相对较低。雅致放射毛霉所产生的丰富酶系
是发酵产品最终风味改善和形成的重要因素之一。乳酸菌是目前乳制品和我国传统发酵植物类食品中最常见的菌种,其蛋白水解作用是乳制品和豆制品等发酵过程中至关重要的生物化学过程,对发酵产品的最终感官品质有很大的影响。不同种属的乳酸菌所分泌的蛋白酶分子量差异很大,介于30~300kda之间,其最适的温度范围一般为40~50℃,最适ph值一般为5~8。本发明将雅致放射毛霉as3.2778分别与从发酵豆制品中分离的植物乳杆菌f8、植物乳杆菌mf3、鼠李糖乳杆菌mf9联合接种至麸皮固体培养基中,于25~35℃的恒温培养箱中培养24~72h后,浸提、过滤并离心后,筛选出高蛋白酶活力的复合蛋白酶制剂。
6.本发明的另一特点在于大豆多肽的制备。目前,大豆多肽的制备主要以商业蛋白酶酶解法为主,其酶解效率高、条件温和、工艺简便。但一方面,由于商业蛋白酶制剂种类不多,作用位点相对单一,因此酶解产生的多肽往往趋于同质化且苦味值较高。另一方面,商业蛋白酶的价格相对昂贵,使得生产成本急剧增加,不适用于工业化的大规模生产。本发明利用自制的复合蛋白酶与商业蛋白酶(包括菠萝蛋白酶和alcalase碱性蛋白酶)联合酶解制备大豆多肽,不仅降低了生产成本,同时,制备得到的大豆多肽无苦味、风味良好、功能性显著、且适用于工业化生产。
7.本发明的目的通过如下技术方案实现:
8.一种具有降血脂活性的无苦味大豆多肽的制备方法:将大豆分离蛋白与水搅拌后,于80~95℃搅拌均匀,冷却至室温并调节ph值为6~8,加入复合蛋白酶制剂和内切型的蛋白酶制剂,在45~60℃水浴中搅拌5~8h后灭酶;离心后取上清液,经真空冷冻干燥,得大豆多肽;
9.所述的复合蛋白酶制剂通过如下方法得到:以千克和升分别作为质量和体积单位计,按照麸皮与水质量体积比为1:0.5~1:1.5的比例混合均匀,灭菌,冷却至室温后,接种毛霉种子液和乳酸菌种子液,于25~35℃的恒温培养箱中培养24~72h;发酵结束后,向发酵后的培养物中添加无菌水,静置过夜,过滤,收集滤液并离心,所得上清液为复合蛋白酶制剂;
10.所述乳酸菌为植物乳杆菌f8(lactobacillus plantarum f8)、植物乳杆菌mf3(lactobacillus plantarum mf3)或鼠李糖乳杆菌mf9(lactobacillus rhamnosus mf9);植物乳杆菌mf3的保藏号为gdmcc 61400;植物乳杆菌mf3的保藏号为gdmcc 61398;鼠李糖乳杆菌mf9的保藏号为gdmcc 61399。
11.乳酸菌为植物乳杆菌f8(lactobacillus plantarum f8)分离自豆腐乳,菌种保藏号gdmcc 61400,保藏于广东省微生物菌种保藏中心,保藏地点为广州市先烈中路100号大院59号楼5楼广东省微生物菌种保藏中心,保藏日期为2020年12月31日。
12.植物乳杆菌mf3(lactobacillus plantarum mf3)分离自豆腐乳,菌种保藏号gdmcc 61398,保藏于广东省微生物菌种保藏中心,保藏地点为广州市先烈中路100号大院59号楼5楼广东省微生物菌种保藏中心,保藏日期为2020年12月31日。
13.鼠李糖乳杆菌mf9(lactobacillus rhamnosus mf9)分离自豆腐乳,菌种保藏号gdmcc 61399,保藏于广东省微生物菌种保藏中心,保藏地点为广州市先烈中路100号大院59号楼5楼广东省微生物菌种保藏中心,保藏日期为2020年12月31日。
14.为进一步实现本发明目的,优选地,所述的毛霉为雅致放射毛霉as3.2778(actinomucor elegans as3.2778),豆腐乳生产菌种,来源于中国工业微生物菌种保藏管
理中心;所述的毛霉种子液的制备方法为:将雅致放射毛霉as3.2778接种于pda斜面试管中,于25~30℃的恒温培养箱中培养24~72h后,向试管中加入无菌水,振荡洗脱培养基表面的雅致放射毛霉孢子,得到孢子悬浮液;显微镜下计数,调节孢子悬浮液的浓度为106~107个/ml,即为毛霉种子液。
15.优选地,所述的乳酸菌种子液的制备方法为:将植物乳杆菌f8、植物乳杆菌mf3或鼠李糖乳杆菌mf9接种于mrs液体培养基中,于28~42℃恒温培养箱中培养12~24h,菌体用无菌水洗涤后,调节其浓度为108~109cfu/ml,得乳酸菌种子液。
16.优选地,所述的毛霉种子液和乳酸菌种子液的接种方式为:将毛霉种子液单独接种至培养基中,或者将毛霉种子液分别与植物乳杆菌f8、植物乳杆菌mf3、鼠李糖乳杆菌mf9联合接种至培养基中,以质量百分比计,接种量为4~7%。
17.优选地,以千克和升分别作为质量和体积单位计,所述培养物与无菌水的质量体积比为1:4~1:8。
18.优选地,步骤1)中所述的离心条件为:温度为4~8℃、转速为6000~10000rpm、时间为5~20min。
19.优选地,所述的内切型的蛋白酶为菠萝蛋白酶或碱性蛋白酶配合酶;内切型的蛋白酶添加量为1000~4000u/g蛋白。
20.优选地,所述的菠萝蛋白酶为南宁庞博生物科技有限公司生产的食品级菠萝蛋白酶;所述的碱性蛋白酶为丹麦诺维信生物技术有限公司生产的食品级alcalase 2.4l碱性蛋白酶。
21.优选地,以千克和升作为质量和体积单位计,所述的将大豆分离蛋白与水搅拌后中大豆分离蛋白与水的质量体积比为1:10~1:20;所述的于80~95℃搅拌均匀是于80~95℃水浴中磁力搅拌15~30min。
22.优选地,以千克和升作为质量和体积单位计,所述的灭酶是在85℃~105℃的温度下灭酶10~30min;所述的静置过夜是在3
‑
4℃冰箱中静置过夜;所述的过滤是用4~8层无菌纱布过滤;所述得离心后取上清液中的离心的温度为4~8℃、转速为6000~10000rpm,时间为5~20min。
23.相对于现有技术,本发明具有以下优点:
24.第一,本发明采用毛霉和乳酸菌联合发酵法制备复合蛋白酶制剂,该酶制剂的酶系丰富,对于多肽产品的苦味修饰、风味改善等效果显著。
25.第二,本发明采用复合蛋白酶及商业酶制剂联合酶解法制备大豆多肽,酶解效率高、工艺简便,所得大豆多肽的无苦味、风味良好、功能性显著,且主要由分子量小于1000da的小分子肽构成,易于消化吸收。
26.第三,本发明所得的大豆多肽具有良好的体外降血脂活性。通过hepg2人肝癌细胞构建高胆固醇细胞模型,以降血脂药物辛伐他汀作为加药组,验证了大豆多肽能够在一定程度上降低细胞内甘油三酯(tg)、总胆固醇(tc)和低密度脂蛋白胆固醇(ldl
‑
c)的含量,同时提高细胞内高密度脂蛋白胆固醇(hdl
‑
c)的含量和超氧化物歧化酶(sod)的活性,其中,10μg/ml大豆多肽mb8对降低细胞内tc、tg、ldl
‑
c的含量,促进hdl
‑
c产生及sod活力的效果与5mg/ml的辛伐他汀相接近,具有很高的应用和开发前景。
附图说明
27.图1为本发明中大豆多肽的sds
‑
page图谱,其中1为大marker、2为大豆蛋白、3为m8(对比实施例4)、6为mb8(实施例1)、10为ma3(实施例2)、11为ma9(实施例3)、12为a、13为b、14为小marker。
28.图2为本发明中大豆多肽对hepg2细胞内总胆固醇(tc)含量的影响情况图(实施例1、实施例2、实施例3、对比实施例5);
29.图3为本发明中大豆多肽对hepg2细胞内甘油三酯(tg)含量的影响情况图(实施例1、实施例2、实施例3、对比实施例5);
30.图4为本发明中大豆多肽对hepg2细胞内低密度脂蛋白胆固醇(ldl
‑
c)含量的影响情况图(实施例1、实施例2、实施例3、对比实施例5);
31.图5为本发明中大豆多肽对hepg2细胞内高密度脂蛋白胆固醇(hdl
‑
c)含量的影响情况图(实施例1、实施例2、实施例3、对比实施例5);
32.图6为本发明中大豆多肽对hepg2细胞内超氧化物歧化酶(sod)活性的影响情况图(实施例1、实施例2、实施例3、对比实施例5)。
具体实施方式
33.为了能够清楚直观地理解本发明,下面结合实施例对本发明作进一步的说明,但本发明的实施方式不限于此。
34.下面实施例中,大豆多肽的水解度采用opa法检测,具体操作为:在待测试管中加入3ml配制好的opa试剂,随后标准管加入400μl的丝氨酸标准溶液,空白管加入400μl的去离子水,待测管加入400μl的待测溶液,并分别做3个平行试验,求平均值,通常情况下odblank≈0.07,odstand≈0.8,否则opa试剂需要重新配制。待去离子水、丝氨酸以及待测溶液加入到3ml的opa试剂时,需要混匀5s,静止反应2min后立即读取340nm的吸光值。水解度按照下面的公式计算:
[0035][0036][0037][0038]
本实验以大豆蛋白为底物,其α为系数,取0.970,β为系数,取0.342,h
tot
取值7.8。,式中,x
‑
样品重量,g;
[0039]
p
‑
样品中的蛋白含量,%;
[0040]
0.1
‑
样品体积转换为l。
[0041]
下面实施例中,大豆蛋白酶解产物冻干粉的总蛋白质含量的检测,采用凯氏定氮法参考标准gb/t 5009.5
‑
2010进行测定,方法如下:称取一定量的样品,倒入消化管,随后在通风橱中加入10ml浓硫酸,加入一平勺的混合催化剂(硫酸铜和硫酸钾)。将消化管放入消化炉中,随后打开冷凝水,加热,至溶液消化至透明澄清后拿出消化管冷却。消化管在连接自动定氮仪后,分别按下加碱以及蒸汽旋钮,同时另一锥形瓶加有25ml 4%的硼酸,滴入
十滴的亚甲基红
‑
绿指示剂。在加碱程序完成后,取下锥形瓶(呈蓝色)进行加酸滴定,并记录结果,按照下述计算蛋白质含量以及蛋白损失率。
[0042][0043][0044]
式中,v1—样品滴定消耗盐酸标准溶液的体积,ml;
[0045]
v2—空白滴定消耗盐酸标准溶液体积,ml;
[0046]
c—盐酸标准滴定溶液浓度,mol/l;
[0047]
m—定氮样品的质量,g;
[0048]
m1—大豆蛋白的蛋白含量;
[0049]
m2—大豆多肽的蛋白含量;
[0050]
下面实施例中,苦味评价方法为:以奎宁作为标准品,将其配成分值分别是0、1、2、3、4、5所对应的浓度,为0、20、40、200、400、800ppm,在此之前,选用2男2女作为本实验的品尝对象,在评价苦味实验之前,先对其进行培训,实验对象要饮食清淡,而且每日让其品尝不同浓度的标准品,并让其打分,直至其打分与理论值的偏差控制在5%左右,随后让其品尝不同的待测样品,并对其打分(0
‑
5分),做三次平行,求其平均值。
[0051]
下面实施例中,sds
‑
page电泳方法为:分别称取适量的大豆多肽配置成一定浓度的溶液,取5μl的溶液与2x的电泳上样缓冲液混合(蛋白总浓度为3mg/ml),在pcr仪中设置95℃加热10min程序后离心。采用15%的分离胶,5%的浓缩胶进行电泳。取6μl混有上样液的样品加样到电泳槽孔中,50mv恒压跑2
‑
3h后,150mv恒压约60min,待样品条带迁移至凝胶底部即可停止电泳。电泳结束后,用0.1%(w/v)考马斯亮蓝r
‑
250染色液染色30min,随后进行脱色至背景为无色,通过凝胶成像系统成像保存。
[0052]
下面实施例中,大豆多肽分子量分布的分析方法为:参考国家标准gb/t 22492
‑
2008的方法并进行适当的改动,采用高效凝胶过滤色谱法测定,多孔性填料为固定相,根据样品相对分子质量大小的差异进行分离,在紫外吸收波长220nm条件下进行检测,随后采用gpc数据处理软件计算大豆多肽的相对分子质量大小及分布范围。
[0053]
下面实施例中,大豆多肽的胰脂肪酶抑制率测定方法如下:将大豆多肽复溶到一定的浓度,在100ml的锥形瓶中加入4ml底物乳液和5ml ph 7.5的磷酸缓冲液,在37℃下恒温机械搅拌5min,再加入1ml胰脂肪酶迅速混匀并在37℃下准确反应30min,以15ml95%的乙醇终止反应。用naoh溶液(0.025mol/l)滴定至中性,记录消耗naoh溶液体积。按下面公式计算脂肪酶活力:
[0054]
胰脂肪酶活力=1000(a-b)m/tw
[0055]
式中,a—样品平行试验组消耗氢氧化钠滴定液的平均体积,ml;
[0056]
b—空白试验消耗氢氧化钠滴定液的体积,ml;
[0057]
m—氢氧化钠滴定液的浓度,mol/l;
[0058]
w—脂肪酶的取样量,g;
[0059]
t—反应时间,min。
[0060]
下面实施例中,甘油三酯、胆固醇含量的测定按照南京建成相试剂盒的说明书操作,具体如下:取96孔板,其中空白管加入2.5μl的蒸馏水,校准管加入2.5μl的标准液,样品
管加入2.5μl的待测溶液,随后均加入工作液250μl,重复三组为平行,用酶标仪测其490nm处的吸光值,其计算公式如下:
[0061]
甘油三酯含量(mmol/l)=(a1
‑
a2)*2.26/((a3
‑
a2)*待测样品的蛋白浓度)
[0062]
总胆固醇含量(mmol/l)=(a1
‑
a2)*5.17/((a3
‑
a2)*待测样品的蛋白浓度)
[0063]
式中,a1—待测样品在490nm处的吸光值;
[0064]
a2—空白管在490nm处的吸光值;
[0065]
a3—标准管在490nm处的吸光值;
[0066]
2.26—甘油三酯标准品的浓度;
[0067]
5.17—胆固醇标准品的浓度。
[0068]
下面实施例中,低密度脂蛋白胆固醇、高密度脂蛋白胆固醇的含量测定按照南京建成试剂盒的说明书操作,具体如下:取96孔板,其中空白管加入2.5μl的蒸馏水,校准管加入2.5μl的标准液,样品管加入2.5μl的待测溶液,随后均加入180μl的工作液r1,37℃孵育10min,测其在490nm处的od值,随后加入60μl的工作液r2,重复三组为平行,用酶标仪测其490nm处的吸光值,其计算公式如下:
[0069]
低密度脂蛋白含量(mmol/l)=(a1
‑
a2)*4.3/((a3
‑
a2)*待测样品的蛋白浓度)
[0070]
高密度脂蛋白含量(mmol/l)=(a1
‑
a2)*1.8/((a3
‑
a2)*待测样品的蛋白浓度)
[0071]
式中,a1—待测样品在490nm处的吸光值;
[0072]
a2—空白管在490nm处的吸光值;
[0073]
a3—标准管在490nm处的吸光值;
[0074]
4.3—低密度脂蛋白标准品的浓度;
[0075]
1.8—高密度脂蛋白标准品的浓度。
[0076]
下面实施例中,超氧化物歧化酶活力的测定按照南京建成试剂盒的说明书操作,具体如下:取96孔板,其中对照孔和对照空白孔加入20μl的蒸馏水,测定孔和测定空白孔加入20μl的待测样本,其中对照孔和测定孔加入20μl的酶工作液,对照空白孔和测定空白孔加入20μl的酶稀释液,每个孔加入200μl的底物应用液,混匀后在37℃孵育20min,重复三组为平行,用酶标仪测其在450nm处的吸光值,其计算公式如下:
[0077]
sod抑制率(%)=(a1
‑
a2
‑
a3 a4)
×
100%/(a1
‑
a2)
[0078]
sod活力(u/mgprot)=sod抑制率
÷
50%
×
n
÷
待测样本浓度
[0079]
式中,a1—对照孔在450nm处的吸光值;
[0080]
a2—对照空白孔在450nm处的吸光值;
[0081]
a3—测定孔在450nm处的吸光值;
[0082]
a4—测定空白孔在450nm处的吸光值;
[0083]
n—反应体系稀释倍数,24。
[0084]
本发明实施例1、2、3主要是筛选出来的酶解方案所制备的多肽功能测试,对照组是阳性对照组,用高胆固醇培养基,药物组是用辛伐他汀降血脂药物。
[0085]
对比例1
[0086]
(1)称取大豆分离蛋白5.0g,溶于100ml水中,于80℃水浴中磁力搅拌15min使溶液分散均匀,冷却至室温并调节其ph值至6.0。添加2000u/g蛋白的alcalase碱性蛋白酶,于55℃水浴中磁力搅拌5h。酶解结束后,置于95℃水浴中灭酶20min,冷却至室温,于8000rpm的
条件下离心10min,所得上清液即为大豆多肽a。
[0087]
(2)经理化分析和感官评价可知,大豆多肽a的水解度为53.85%,sds
‑
page结果显示其蛋白条带已完全消失(图1,泳道12),说明蛋白质已降解成分子量小于3.3kd的多肽;进一步的分析表明该酶法制备大豆多肽蛋白损失率(离心后沉淀中的蛋白质占总蛋白的比例)为11.70%,感官评价的结果为苦味值评分为3.50分。
[0088]
图1为本发明实施例和对比例中大豆多肽的sds
‑
page图谱,表征蛋白质的降解能力,完全没有条带了,就是蛋白质完全降解了。其中1为大marker、2为大豆蛋白、3为m8(对比实施例4)、6为mb8(实施例1)、10为ma3(实施例2)、11为ma9(实施例3)、12为a、13为b、14为小marker。下面实施例和对比例涉及图1的情况相同。
[0089]
(3)经生化分析,结果显示大豆多肽a对胰脂肪酶的抑制率为15.42%(样品浓度为0.01mg/ml)。
[0090]
对比例2
[0091]
(1)称取大豆分离蛋白5.0g,溶于100ml水中,于80℃水浴中磁力搅拌15min使溶液分散均匀,冷却至室温并调节其ph值至6.0。添加2000u/g蛋白的菠萝蛋白酶,于55℃水浴中磁力搅拌6h,酶解结束后,置于95℃水浴中灭酶20min。冷却至室温后,于8000rpm的条件下离心10min,所得上清液即为大豆多肽b。
[0092]
(2)经理化分析和感官评价可知,大豆多肽b的水解度为14.58%,sds
‑
page结果显示其蛋白条带只有轻微的降解(图1,泳道13,与第2泳道的大豆蛋白相比,蛋白质条带都在,但颜色变浅,说明蛋白质有降解,但降解程度不高),进一步的分析表明该酶法制备大豆多肽蛋白损失率为22.56%,感官评价的结果为苦味值评分为2.00分。
[0093]
(3)经生化分析,结果显示大豆多肽b对胰脂肪酶的抑制率为12.17%(样品浓度为0.01mg/ml)。
[0094]
对比例3
[0095]
称取10.0g麸皮置于250ml三角瓶中,加入11ml蒸馏水混合均匀后,于121℃灭菌30min,冷却至室温后,接种1ml雅致放射毛霉as3.2778种子液,于28℃恒温培养箱中培养72h。发酵结束后,向发酵后的培养物中添加100ml无菌水,于4℃冰箱中静置过夜,随后用8层纱布过滤,收集滤液并离心,所得上清液即为粗酶液,其中性蛋白酶活力为28.8u/ml。
[0096]
对比例4
[0097]
称取10.0g麸皮置于250ml三角瓶中,加入10ml蒸馏水混合均匀后,于121℃灭菌30min,冷却至室温后,接种1ml雅致放射毛霉as3.2778种子液和1ml植物乳杆菌f8(gdmcc 61400)种子液,于28℃恒温培养箱中培养72h。发酵结束后,向发酵后的培养物中添加100ml无菌水,于4℃冰箱中静置过夜,随后用8层纱布过滤,收集滤液并离心,所得上清液即为粗酶液,其中性蛋白酶活力为39.0u/ml。经真空冷冻干燥后,即得复合蛋白酶制剂p8。
[0098]
(2)称取大豆分离蛋白5.0g,溶于100ml水中,于80℃水浴中磁力搅拌15min使溶液分散均匀,冷却至室温并调节其ph值至6.0后,添加2000u/g蛋白的复合蛋白酶p8,于55℃水浴中磁力搅拌6h,酶解结束后,置于95℃水浴中灭酶20min。冷却至室温后,于8000rpm的条件下离心10min,所得上清液经真空冷冻干燥后,得大豆多肽m8。
[0099]
(3)经理化分析及感官评价可知,大豆多肽m8的水解度为38.03%,sds
‑
page结果显示其蛋白条带大部分消失,但在25kd处仍有一条明显的条带(图1中泳道3),说明蛋白质
的降解还不完全。进一步的分析表明该酶法制备大豆多肽蛋白损失率为18.01%,苦味值评分为2.40。
[0100]
(4)经生化分析,结果显示大豆多肽m8对胰脂肪酶的抑制率为12.03%(样品浓度为0.01mg/ml)。
[0101]
对比例5
[0102]
(1)取对数期的高胆固醇hepg2模型细胞进行铺板,置于二氧化碳培养箱中培养24h后,加入无血清无血清mem培养基(高糖型,gibco)作为空白组,加入20μg/m l高胆固醇的无血清mem培养基(高糖型,gibco)作为对照组,加入5mg/ml辛伐他汀的无血清mem培养基(高糖型,gibco)作为加药组,于二氧化碳培养箱中继续培养24h。
[0103]
(2)培养结束后,弃上清液,加入0.25%的胰蛋白酶进行消化,离心弃上清液,采用pbs缓冲液重悬并离心,重复三遍后,加入裂解液triton
‑
100,测定其tc、tg、ldl
‑
c、hdl
‑
c的含量和sod活力。结果表明,加药组能够显著降低细胞内tg和ldl
‑
c的浓度,显著增加hdl
‑
c的浓度和sod活力(p<0.05)(图2,图3,图4,图5,图6)。
[0104]
实施例1
[0105]
(1)称取10.0g麸皮置于250ml三角瓶中,加入10ml蒸馏水混合均匀后,于121℃灭菌30min,冷却至室温后,接种1ml雅致放射毛霉as3.2778种子液和1ml植物乳杆菌f8(gdmcc 61400)种子液,于28℃恒温培养箱中培养72h。发酵结束后,向发酵后的培养物中添加100ml无菌水,于4℃冰箱中静置过夜,随后用8层纱布过滤,收集滤液并离心,所得上清液即为粗酶液,其中性蛋白酶活力为39.0u/ml。经真空冷冻干燥后,即得复合蛋白酶制剂p8。
[0106]
(2)称取大豆分离蛋白5.0g,溶于100ml水中,于80℃水浴中磁力搅拌15min使溶液分散均匀,冷却至室温并调节其ph值至6.0后,添加1000u/g蛋白的复合蛋白酶p8和1000u/g蛋白的菠萝蛋白酶,于55℃水浴中磁力搅拌6h,酶解结束后,置于95℃水浴中灭酶20min。冷却至室温后,于8000rpm的条件下离心10min,所得上清液经真空冷冻干燥后,得大豆多肽mb8。
[0107]
(3)经理化分析及感官评价可知,大豆多肽mb8的水解度为55.51%,分子量<1000da的多肽分子占64.9%(见表1),sds
‑
page结果显示其蛋白条带已完全消失(图1泳道6),进一步的分析表明该酶法制备大豆多肽蛋白损失率为9.05%,苦味值评分小于1。
[0108]
(4)经生化分析,结果显示大豆多肽mb8对胰脂肪酶的抑制率为28.83%(样品浓度为0.01mg/ml)。
[0109]
(4)经高胆固醇hepg2模型细胞实验,结果显示大豆多肽mb8对细胞内tc、tg、ldl
‑
c和hdl
‑
c的含量表现出剂量依赖关系,在10、50、100、200、500μg/ml的浓度梯度范围内,随着样品浓度的增加,tc、tg和ldl
‑
c的含量随之降低,且显著高于加药组(辛伐他汀)(p<0.05)(图2,图3,图4);随着样品浓度的增加,hdl
‑
c的含量也随之增加(图5)。
[0110]
5)经高胆固醇hepg2模型细胞实验,结果显示大豆多肽mb8在10
‑
500浓度范围内的细胞sod活力显著高于加药组(辛伐他汀)(p<0.05)(图6),且随着浓度的不断增加,sod活力由4.76
±
0.61u/ml逐渐增加为26.70
±
0.24u/ml,增幅高达82.17%。
[0111]
实施例2
[0112]
(1)称取10.0g麸皮置于250ml三角瓶中,加入10ml蒸馏水混合均匀后,于121℃灭菌30min,冷却至室温后,接种1ml雅致放射毛霉as3.2778种子液和1ml植物乳杆菌mf3
(gdmcc 61398)种子液,于28℃恒温培养箱中培养72h。发酵结束后,向发酵后的培养物中添加100ml无菌水,于4℃冰箱中静置过夜,随后用8层纱布过滤,收集滤液并离心,所得上清液即为粗酶液,其中性蛋白酶活力为34.2u/ml,碱性蛋白酶活力为36.0u/ml。经真空冷冻干燥后,即得复合蛋白酶制剂p3。
[0113]
(2)称取大豆分离蛋白5.0g,溶于100ml水中,于80℃水浴中磁力搅拌15min使溶液分散均匀,冷却至室温并调节其ph值至6.0后,添加1000u/g蛋白的复合蛋白酶p3和1000u/g蛋白的alcalase碱性蛋白酶,于55℃水浴中磁力搅拌6h,酶解结束后,置于95℃水浴中灭酶20min。冷却至室温后,于8000rpm的条件下离心10min,所得上清液即为大豆多肽溶液,真空冷冻干燥后,得大豆多肽ma3。
[0114]
(3)经理化分析及感官评价可知,大豆多肽ma3的水解度为74.67%,分子量<1000da的多肽分子占70.1%(见表1),sds
‑
page结果显示其蛋白条带完全消失(图1泳道10),进一步的分析表明该酶法制备大豆多肽蛋白损失率为8.49%,苦味值评分小于1。
[0115]
(4)经生化分析,结果显示大豆多肽ma3对胰脂肪酶的抑制率为28.42%(样品浓度为0.01mg/ml)。
[0116]
(4)经高胆固醇hepg2模型细胞实验,结果显示大豆多肽ma3对细胞内tg和ldl
‑
c的含量有显著降低的效应,且显著高于加药组(辛伐他汀)(p<0.05)(图3,图4)。
[0117]
(5)经高胆固醇hepg2模型细胞实验,结果显示大豆多肽ma3在100
‑
500浓度范围内的细胞sod活力显著高于加药组(辛伐他汀)(p<0.05)(图6)。
[0118]
实施例3
[0119]
(1)称取10.0g麸皮置于250ml三角瓶中,加入10ml蒸馏水混合均匀后,于121℃灭菌30min,冷却至室温后,接种1ml雅致放射毛霉as3.2778种子液和1ml鼠李糖乳杆菌mf9(gdmcc 61399)种子液,于28℃恒温培养箱中培养72h。发酵结束后,向发酵后的培养物中添加100ml无菌水,于4℃冰箱中静置过夜,随后用8层纱布过滤,收集滤液并离心,所得上清液即为粗酶液,经真空冷冻干燥后,即得复合蛋白酶制剂p9。
[0120]
(2)称取大豆分离蛋白5.0g,溶于100ml水中,于80℃水浴中磁力搅拌15min使溶液分散均匀,冷却至室温并调节其ph值至6.0后,添加1000u/g蛋白的复合蛋白酶p9和1000u/g蛋白的alcalase碱性蛋白酶,于55℃水浴中磁力搅拌6h,酶解结束后,置于95℃水浴中灭酶20min。冷却至室温后,于8000rpm的条件下离心10min,所得上清液即为大豆多肽溶液,真空冷冻干燥后,得大豆多肽ma9。
[0121]
(3)经理化分析和与感官评价结果可知,大豆多肽ma9的水解度为56.85%,分子量<1000da的多肽分子占71.9%(见表1),sds
‑
page结果显示其蛋白条带完全消失(图1泳道11),进一步的分析表明该酶法制备大豆多肽蛋白损失率为6.27%,苦味值评分小于1。
[0122]
(4)经生化分析,结果显示大豆多肽ma9对胰脂肪酶的抑制率为31.08%(样品浓度为0.01mg/ml)。
[0123]
(4)经高胆固醇hepg2模型细胞实验,结果显示大豆多肽ma9对细胞内tg和ldl
‑
c的含量有显著降低的效应(图3,图4)。
[0124]
(5)经高胆固醇hepg2模型细胞实验,结果显示大豆多肽ma9对细胞sod活力有显著影响(图6)。
[0125]
从以上实施例和对比例可知,1)采用商业酶制剂alcalase碱性蛋白酶和菠萝蛋白
酶水解大豆分离蛋白,得到的大豆多肽a和大豆多肽b的水解度分别为53.85%和14.58%,对应的苦味值评分分别为3.50和2.00分,苦味明显,不易被消费者接受(对比实施例1和对比实施例2)。而采用本发明的复合蛋白酶分别与菠萝蛋白酶、alcalase碱性蛋白酶联合酶解大豆分离蛋白,得到的大豆多肽mb8、ma3和ma9苦味值评分均<1,基本无苦味。且与不加商业酶制剂相比(对比实施例1和对比实施例2),其水解度和蛋白质利用率均显著提高。尤其是,采用毛霉和乳酸菌联合发酵能够显著提高产酶能力,毛霉单独培养产酶能力为28.3u/ml粗酶液(对比实施例3),而与乳酸菌联合培养产酶能力提升到近40u/ml粗酶液(参见对比实施例4,实施例1,实施例2,实施例3),极大地提高了生产效率。
[0126]
2)采用本发明复合蛋白酶分别与菠萝蛋白酶、alcalase碱性蛋白酶联合酶解大豆分离蛋白,得到的大豆多肽mb8、ma3和ma9对胰脂肪酶的抑制率分别为28.83%、28.42%和31.08%(实施例1,实施例2,实施例3),与采用商业酶制剂制备的多肽相比(15.42%、12.17%)对胰脂肪酶的抑制率显著提升(对比实施例1和对比实施例2),说明自制复合酶制剂制备的多肽很可能具有很强的降脂活性。
[0127]
3)在一定的浓度范围内,大豆多肽mb8、ma3和ma9均能降低高胆固醇hepg2模型细胞内tc、tg和ldl
‑
c的含量,并提高细胞内hdl
‑
c的含量和sod活力,具有良好的体外降血脂活性(实施例1、实施例2、实施例3、对比实施例5)。其中,大豆多肽mb8的降血脂活性最为显著,10μg/ml大豆多肽mb8对降低细胞内tc、tg、ldl
‑
c的含量,促进hdl
‑
c产生及sod活力的效果与5mg/ml的辛伐他汀相接近,具有很高的应用和开发价值(实施例1)。
[0128]
本发明实施例所得大豆多肽的分子量分布具体情况见表1。
[0129]
表1 大豆多肽的分子量分布
[0130][0131]
本发明的实施方式并不受上述实施案例的限制,其他任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。