山羊副流感病毒3型感染性cdna克隆构建方法及其应用
技术领域
1.本发明属于生物技术领域,具体涉及山羊副流感病毒3型感染性cdna克隆构建方法及其应用。
背景技术:
2.山羊副流感病毒3型(caprine parainfluenza virus 3,cpiv3)是新近鉴定的一种副粘病毒科呼吸道病毒属成员,为有囊膜的单股负链rna病毒,主要感染山羊和绵羊。cpiv3基因组大小为15624bp,与同属的病毒相似,从3’到5’端依次是3’端前导序列、核蛋白(n)基因、磷蛋白(p)基因、基质蛋白(m)基因、融合蛋白(f)基因、血凝素蛋白(hn)基因、大转录蛋白(l)基因和5’端序列。该病毒主要通过呼吸道传播,引起呼吸道疾病,在应激、混合或继发感染其他病原等情况下会导致明显的临床症状,引起严重的呼吸道疾病,导致较高的发病率和死亡率。流行病学研究表明国内羊群存在较高的病毒感染率。该病毒为新近发现的新病原,尽管已经分别围绕病毒感染与i型干扰素反应、细胞凋亡、mirna及外泌体的相互作用开展研究,但目前对其感染和致病机制的研究尚不深入。国内外均无对该病毒有效防控方法的报道,且尚无可以预防山羊副流感病毒3型感染的疫苗。
3.反向遗传技术是新兴的一种定向修饰或改造病毒的重要技术,应用前景非常广阔,该技术已成功广泛应用于多种病毒的疫苗和致病机制研究。但是,现有技术中还未有人构建出山羊副流感病毒3型感染性cdna克隆。
技术实现要素:
4.本发明的目的在于提供山羊副流感病毒3型感染性cdna克隆构建方法及其应用,构建效率高,该感染性cdna克隆拯救的病毒rcpiv3感染mdbk细胞后能够快速产生细胞病变,病毒滴度可达到108tcid
50
/ml以上,且保持稳定。
5.本发明的目的采用如下技术方案实现:
6.山羊副流感病毒3型感染性cdna克隆构建方法,包括以下步骤:
7.(1)将seq id no:1所示序列插入pci
‑
neo质粒,得到重组质粒pci
‑
neo
‑
1;
8.(2)以山羊副流感病毒3型的总rna的反转录产物为模板,用引物af1、af2和ar扩增a片段,用引物bf和br扩增b片段,用引物cf和cr扩增c片段,用引物df、dr1和dr2扩增d片段;将扩增得到的片段a和b插入pci
‑
neo
‑
1载体,得到重组载体pci
‑
a
‑
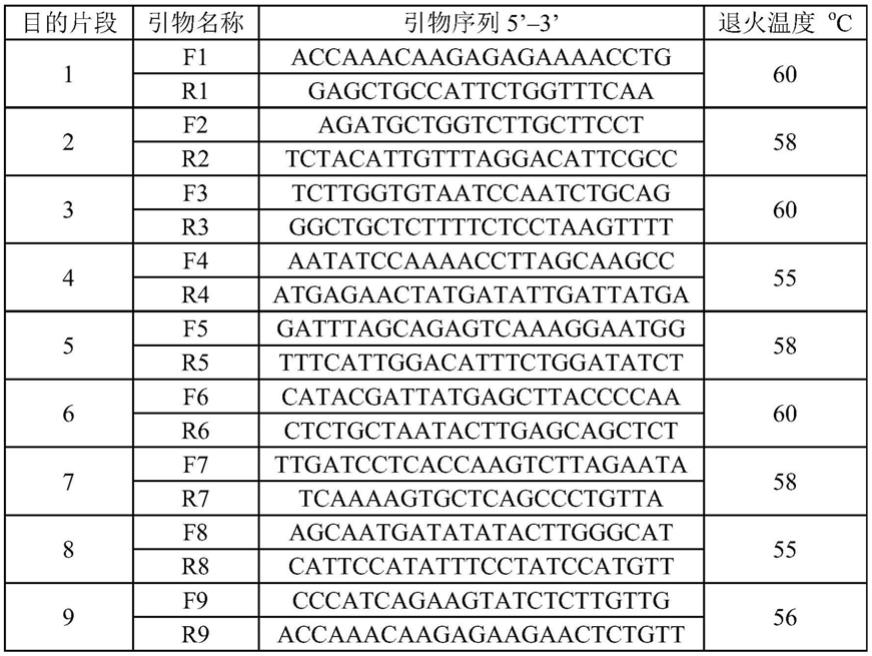
b;将扩增得到的片段c和d插入pci
‑
neo
‑
1载体中,得到重组载体pci
‑
c
‑
d;
9.(3)以pci
‑
a
‑
b为模板,用引物ab
‑
f和ab
‑
r扩增片段a
‑
b;以pci
‑
c
‑
d为模板,用引物cd
‑
f和cd
‑
r,扩增c
‑
d片段;以pyesll质粒为模板,用引物vector
‑
f和vector
‑
r扩增,获得线性化的pyes1l载体;
10.(4)将线性化的pyes1l载体、a
‑
b和c
‑
d片段混和,导入酵母内进行同源重组,得到山羊副流感病毒3型感染性cdna克隆质粒pyes1l
‑
cpiv3。
11.在本发明中,用引物af1、af2和ar扩增a片段,包括两个pcr扩增反应;首先,以af1
和ar为引物进行第一次pcr扩增;然后以第一次pcr扩增产物为模板,以af2和ar为引物,进行第二次pcr扩增,得到a片段。
12.在本发明中,用引物df、dr1和dr2扩增d片段,包括两个pcr扩增反应;首先,以df和dr1为引物进行第一次pcr扩增;然后以第一次pcr扩增产物为模板,以df和dr2为引物,进行第二次pcr扩增,得到d片段。
13.本发明还提供上述方法得到的山羊副流感病毒3型感染性cdna克隆质粒及其在拯救山羊副流感病毒3型中的应用。
14.在本发明中,所述应用包括如下步骤:分别构建表达山羊副流感病毒3型n、p、l蛋白的辅助质粒,利用转染试剂lipofectamine
tm 2000将权利要求4所述感染性cdna克隆质粒和辅助质粒共转染293t细胞,收获细胞培养物并接种mdbk细胞,收获细胞培养物,获得拯救的感染性山羊副流感病毒3型rcpiv3。
15.在本发明中,所述辅助质粒是将通山羊副流感病毒3型n、p和l蛋白的编码基因分别克隆至pcaggs,得到pcaggs
‑
n,pcaggs
‑
p和pcaggs
‑
l三个辅助质粒。
16.优选的技术方案中,感染性cdna克隆质粒、辅助质粒pcaggs
‑
n、pcaggs
‑
p和pcaggs
‑
l的质量比为5:5:2:1。
17.相较于现有技术,本发明的有益效果是:本发明以高效同源重组系统,以pyes1l为骨架载体,利用基于酵母的同源重组技术,率先构建了山羊副流感病毒3型毒株js14
‑
2株全基因组cdna感染性克隆以及3个辅助质粒,建立了山羊副流感病毒3型反向遗传操作系统,利用该系统能够实现重组病毒的稳定高效拯救。本发明构建方法,效率高。拯救的病毒rcpiv3感染mdbk细胞后,于感染后24h
‑
48h产生细胞病变,获得的rcpiv3病毒滴度可达到108tcid
50
/ml以上,病毒增殖速度高于野生型毒株,滴度与野生毒株一致,且保持稳定。为未来山羊副流感病毒3型新型疫苗、羊用多联疫苗研制和山羊副流感病毒3型致病机理研究奠定基础。
附图说明
18.图1山羊副流感病毒3型全长cdna分段扩增策略,其中数字表示病毒基因组位置(bp)。
19.图2山羊副流感病毒3型全长cdna克隆质粒构建策略。
20.图3山羊副流感病毒3型辅助质粒构建的鉴定,其中a图:泳道1为dna marker dl2000,泳道2为bglii酶切后的pcaggs
‑
n,泳道3为bglii酶切后的pcaggs
‑
p,泳道4为dna marker 1kb plus;b图中泳道1为dna marker dl2000,泳道2为hindiii酶切后的pcaggs
‑
l,泳道3为dna marker 1kb plus。
21.图4重组病毒的mdbk细胞病变,其中a图:正常mdbk细胞,b图:接毒2天的细胞病变,c图:接毒3天的细胞病变。
22.图5重组病毒的间接免疫荧光鉴定,a图:正常细胞,b图:接毒细胞。
23.图6重组病毒的生长曲线。
具体实施方式
24.下面结合具体实施例对本发明做进一步说明,应该理解的是,这些实施例仅用于
例证的目的,决不限制本发明的保护范围。
25.实施例1山羊副流感病毒3型js14
‑
2株感染性cdna克隆质粒的构建
26.1.cdv
‑
3株全基因组克隆及序列测定
27.取冻存的山羊副流感病毒3型js14
‑
2株(公开于中国专利zl 201810926226.2中,保藏号为cctcc no:v201832)细胞培养悬液200μl,根据axygen核酸提取试剂盒操作说明,提取总rna。根据cpiv3 js2013株参考序列,将病毒全基因组序列划分为9个目标片段,用软件primer premier 5.0设计了9对特异性引物(如表1)分别扩增目标片段1
‑
9,将引物送南京擎科生物科技有限公司合成。以提取的rna为模板,分别以各对特异性引物用一步法rt
‑
pcr试剂盒(北京全式金生物科技有限公司)进行rt
‑
pcr扩增。rt
‑
pcr总体积20μl,其中2
×
r
‑
mix buffer 10μl,上下游引物各0.5μl,e
‑
mix 0.4μl,rna模板2μl,无rnase水补足至20μl。扩增程序:45℃反转录30min;94℃5min;94℃30s,55
‑
60℃30s(根据不同引物对的tm值调整退火温度),72℃2min,35个循环;72℃10min。对目的片段1
‑
9进行回收纯化,产物送南京擎科生物科技有限公司进行序列测定。根据测序结果,拼接得到病毒全基因组序列,比对发现该序列与已有毒株序列同源性为99.6%
‑
99.9%,与同源性最高的ahqj2015
‑
1株(mf693177.1)相比有15个核苷酸突变(表2)。
28.表1全基因组扩增用引物
[0029][0030]
表2js14
‑
2与ahqj2015
‑
1全基因组序列差异情况
[0031]
[0032]
2.cpiv3全基因组cdna重组质粒的构建
[0033]
利用软件分析js14
‑
2株全基因组序列的单一性酶切位点,选取适当的位置作为衔接点,将全基因组分为四个片段a、b、c、d,具体见图1。首先人工合成序列1(seq id no:1)(tagcctcgagaattcacgcgtggtacctctaggtcgacggtaccgtttaaacgggttattaattaaatcattcgcggccgcttcc),插入pci
‑
neo质粒(购自promega)的xhoi和noti酶切位点之间,得到重组质粒pci
‑
neo
‑
1,其序列中依次包含酶切位点xhoi
‑
sali
‑
pmei
‑
paci
‑
noti。
[0034]
利用primer premier5.0设计特异性引物(如表3)分别扩增a、b、c、d四个片段,其中扩增的a片段的一端连接有锤头状核酶序列,扩增的d片段的一端连接有丁型肝炎核酶序列。
[0035]
以提取的js14
‑
2株病毒的总rna为模板,按照反转录试剂盒(北京全式金生物科技有限公司)说明书制备山羊副流感病毒3型js14
‑
2株cdna。
[0036]
扩增a片段包括两次pcr扩增。第一次pcr扩增,总体积20μl,其中2
×
pcr buffer 10μl,上下游引物(af1、ar)各0.5μl,cdna模板2μl,无rnase水补足至20μl。扩增程序:94℃5min;94℃30s,58℃30s,72℃6min,35个循环;72℃10min。以第一次pcr扩增产物为模板,以af2、ar为引物,进行第二次pcr扩增,得到一端连接有锤头状核酶序列的a片段,pcr体系的构成同第一次pcr扩增,pcr程序同第一次pcr扩增。
[0037]
扩增d片段包括两次pcr扩增。第一次pcr扩增,pcr体系总体积20μl,其中2
×
pcr buffer 10μl,上下游引物(df、dr1)各0.5μl,cdna模板2μl,无rnase水补足至20μl。扩增程序:94℃5min;94℃30s,58℃30s,72℃2min,35个循环;72℃10min。以第一次pcr扩增产物为模板,以df、dr2为引物,进行第二次pcr扩增,得到一端连接有丁型肝炎核酶序列的d片段,pcr体系的构成同第一次pcr扩增,pcr程序同第一次pcr扩增。
[0038]
扩增b片段时,引物为bf和br,pcr总体积20μl,其中2
×
pcr buffer 10μl,上下游引物各0.5μl,cdna模板2μl,无rnase水补足至20μl。扩增程序:94℃5min;94℃30s,58℃30s,72℃2min,35个循环;72℃10min。
[0039]
扩增c片段时,引物为cf和cr,pcr总体积20μl,其中2
×
pcr buffer 10μl,上下游引物各0.5μl,cdna模板2μl,无rnase水补足至20μl。扩增程序:94℃5min;94℃30s,58℃30s,72℃6min,35个循环;72℃10min。
[0040]
将一端连接有锤头状核酶序列的片段a和pci
‑
neo
‑
1分别采用xhoi和sali酶进行双酶切,然后采用t4 dna连接酶进行连接,将片段a插入pci
‑
neo
‑
1中,得到了pci
‑
a。将pci
‑
a和片段b分别采用sali和pmei酶进行双酶切,然后采用t4 dna连接酶进行连接,将片段b插入pci
‑
a中,得到了pci
‑
a
‑
b。
[0041]
将片段c、pci
‑
neo
‑
1分别用pmei和paci酶进行双酶切,然后采用t4 dna连接酶进行连接,将片段c插入pci
‑
neo
‑
1中,得到pci
‑
c。将pci
‑
c和一端连接有丁型肝炎核酶序列的片段d分别采用paci和noti进行双酶切,然后采用t4 dna连接酶进行连接,将连接有丁型肝炎核酶序列的片段d插入pci
‑
neo
‑
1中,获得pci
‑
c
‑
d。
[0042]
以pci
‑
a
‑
b为模板,用引物ab
‑
f和ab
‑
r,扩增片段a
‑
b(片段a和b相连形成的片段)。pcr总体积20μl,其中2
×
pcr buffer 10μl,上下游引物各0.5μl,模板2μl,无rnase水补足至20μl。扩增程序:94℃5min;94℃30s,58℃30s,72℃6min,35个循环;72℃10min。
[0043]
以pci
‑
c
‑
d为模板,用引物cd
‑
f和cd
‑
r,扩增c
‑
d片段(片段c和d相连形成的片段)。
pcr总体积20μl,其中2
×
pcr buffer 10μl,上下游引物各0.5μl,模板2μl,无rnase水补足至20μl。扩增程序:94℃5min;94℃30s,58℃30s,72℃6min,35个循环;72℃10min。
[0044]
以pyesll质粒(购自thermo fisher scientific)为模板,以引物vector
‑
f和vector
‑
r进行pcr扩增,获得线性化的pyes1l载体。
[0045]
将线性化的pyes1l载体、片段a
‑
b和片段c
‑
d混和,加入到mav203酵母感受态(购自thermo fisher scientific)中,利用醋酸锂转化法转化至酵母细胞,然后接种于色氨酸(trp)缺陷型平板(购自thermo fisher scientific)上,在30℃培养3天后,用引物cpiv3
‑
f和cpiv3
‑
r进行菌落pcr鉴定,筛选出阳性克隆(克隆策略如图2所示)。由于线性化的pyes1l载体和片段a
‑
b、片段a
‑
b和片段c
‑
d、线性化的pyes1l载体和片段c
‑
d分别存在着末端同源臂,因此,在宿主细胞酵母内,通过同源重组机制组装成携带cpiv3全长cdna的重组质粒。
[0046]
将菌落pcr筛选阳性的酵母菌落的裂解液电转化dh10b感受态细胞,通过大观霉素抗性筛选阳性重组子,增殖后通过质粒中量提取试剂盒纯化携带cpiv3全长cdna的重组质粒,命名为pyes1l
‑
cpiv3。大量提取重组质粒pyes1l
‑
cpiv3,测定浓度后分装,置
‑
20℃保存。
[0047]
表3病毒cdna克隆构建扩增引物
[0048][0049][0050]
注:表3中下划线为核酶序列,斜体为酶切位点。
[0051]
实施例2辅助质粒的构建与鉴定
[0052]
针对cpiv3中n、p和l基因的开放阅读框区域,利用primer premier5.0设计特异性引物(包含同源臂,见表4),以重组质粒pyes1l
‑
cpiv3为模板,进行pcr扩增,获得n、p和l基因片段。回收纯化后的n、p和l基因片段,分别采用南京诺唯赞生物科技有限公司
clonexpress ii one step cloningkit,通过同源重组的方法(参照试剂盒说明书操作)克隆至pcaggs质粒的xhoi和bglii位点之间,然后将携带各基因的重组质粒分别转化dh5α大肠杆菌感受态细胞,经pcr酶切鉴定的阳性菌落克隆(图3),进一步测序鉴定筛选出正确的重组质粒pcaggs
‑
n(携带n基因的重组质粒),pcaggs
‑
p(携带p基因的重组质粒)和pcaggs
‑
l(携带l基因的重组质粒)。按照无内毒素质粒提取试剂盒的操作说明提取质粒,测定浓度后分装,于
‑
20℃保存。
[0053]
表4n、p、l基因扩增引物
[0054][0055]
注:表4引物中画横线的部分是酶切位点。
[0056]
实施例3山羊副流感病毒3型js14
‑
2株重组病毒的拯救与生物学特性鉴定
[0057]
1.重组病毒的拯救与扩增
[0058]
于24孔板中按照5
×
104个细胞/孔接种293t细胞,待细胞生长至90%汇合度时开始转染,每孔中的质粒用量为:感染性cdna克隆质粒(重组质粒pyes1l
‑
cpiv3)0.5μg,辅助质粒pcaggs
‑
n 0.5μg,pcaggs
‑
p 0.2μg和pcaggs
‑
l 0.1μg,转染试剂(lipofectamine
tm 2000)1.5μl,具体转染方法按照lipofectamine
tm
2000说明书进行操作。
[0059]
将转染后的细胞在37℃、5%co2条件下培养4
‑
5d,收获细胞悬液,冻融三次,2000rpm离心5min,取上清接种mdbk细胞,观察细胞病变。结果:接种后第二天,mdbk细胞即出现山羊副流感病毒3型典型的细胞病变:出现合胞体、融合、脱落(图4)。收获细胞培养物,得到第一代拯救病毒rcpiv3。将拯救病毒rcpiv3连续传代,每一代培养物均置
‑
70℃保存。
[0060]
2.重组病毒的鉴定
[0061]
2.1间接免疫荧光检测
[0062]
将收获的拯救病毒rcpiv3接种至mdbk细胞,培养72h。弃去培养液,使用免疫染色固定液固定细胞15min;再加入免疫染色封闭液37℃通透封闭30min;加入cpiv3特异单克隆抗体,37℃孵育1h;pbs洗涤3次;加入fitc标记羊抗小鼠igg荧光二抗,37℃孵育1h,pbs洗涤3次。在荧光显微镜下观察可见感染病毒的细胞呈现特异的绿色荧光,而未接毒的对照细胞无荧光(图5)。说明重组病毒拯救成功,具有感染性。
[0063]
2.2rt
‑
pcr鉴定
[0064]
分别提取重组病毒(拯救病毒rcpiv3)和亲本病毒(山羊副流感病毒3型js14
‑
2株)rna,用一步法rt
‑
pcr试剂盒(北京全式金生物科技有限公司),使用引物cf和cr进行rt
‑
pcr扩增,rt
‑
pcr总体积20μl,其中2
×
r
‑
mix buffer 10μl,上下游引物各0.5μl,e
‑
mix 0.4μl,rna模板2μl,无rnase水补足至20μl。扩增程序:45℃反转录30min;94℃5min;94℃30s,58℃30s,72℃2min,35个循环;72℃10min。
[0065]
1%琼脂糖凝胶电泳后回收片段,送南京擎科生物科技有限公司测序,比较序列是否与设计的一致。结果:扩增的序列与病毒cdna质粒序列一致。
[0066]
3.生物学特性鉴定
[0067]
3.1tcid
50
测定
[0068]
用细胞维持液(含2%胎牛血清的dmem培养基)将第三代重组病毒(拯救病毒rcpiv3)作10倍梯度稀释。然后将各稀释度的病毒液分别接种于长满单层mdbk细胞的96孔细胞培养板中,每个稀释度病毒液接种4个孔,每孔接种100μl。同时设定不接毒的阴性对照。37℃培养5天,观察细胞病变并按照reed
‑
muench方法计算tcid
50
。结果表明:第三代重组病毒滴度可达108tcid
50
/ml以上。
[0069]
3.2生长曲线测定
[0070]
在长满单层mdbk细胞的24孔细胞培养板中,按感染复数(moi=1)接种重组病毒(拯救病毒rcpiv3)和亲本病毒(山羊副流感病毒3型js14
‑
2株),37℃培养。于感染后24h、48h、72h、96h和120h,分别取细胞培养上清,按照标题3.1中方法测定病毒的tcid
50
,绘制病毒生长曲线。结果表明重组病毒和亲本病毒滴度在24
‑
72h之间处于增长期,72
‑
120h之间达到稳定,重组病毒在24
‑
48h滴度高于亲本病毒(0.5log
10
),说明重组病毒增殖速度高于亲本病毒(图6)。
[0071]
3.3稳定性测定
[0072]
按照标题3.1中方法在mdbk细胞上分别测定不同代次(第三代、第五代、第八代、第十代)重组病毒的滴度,结果表明各代次重组病毒滴度分别为108tcid
50
/ml、10
8.5
tcid
50
/ml、10
8.15
tcid
50
/ml和10
8.25
tcid
50
/ml,病毒生长滴度均可达108tcid
50
/ml以上且保持稳定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。