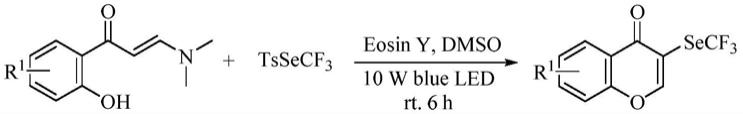一种3
‑
三氟甲硒基色酮化合物的光催化合成方法
技术领域
1.本发明涉及一种3
‑
三氟甲硒基色酮化合物的合成方法;特别涉及一种利用可见光促进邻羟基苯基烯胺酮化合物与对甲苯磺酸三氟甲硒酯通过一锅反应合成3
‑
三氟甲硒基色酮化合物的方法,属于有机中间体合成技术领域。
背景技术:
[0002]3‑
三氟甲硒基色酮化合物具有生物活性基团和可修饰基团,在药物研发领域发挥着重要的作用。根据文献和专利检索,目前还没有制备3
‑
三氟甲硒基色酮类化合物的相关报道。仅在2014年,中国科学院上海药物研究所杨春皓等人(org.lett.2014,16,5686
–
5689)报道了利用3倍化学当量的agscf3和1.5倍化学当量的三氯异氰尿酸(tcca)原位生成亲电的三氟甲硫基阳离子,再进一步与邻羟基苯基烯胺酮化合物发生亲电加成,并通过分子内环化反应得到3
‑
三氟甲硫基色酮化合物。该方法需要使用大量过量的昂贵的agscf3作为三氟甲硫基源,合成成本较高,原子经济性较差,并且该反应是分步进行的,操作相对复杂化。
[0003]
技术实现要素:
[0004]
针对现有技术存在的缺陷,本发明的目的是在于提供一种以邻羟基苯基烯胺酮化合物和对甲苯磺酸三氟甲硒酯通过可见光催化一锅反应合成3
‑
三氟甲硒基色酮化合物的方法,该方法采用的邻羟基苯基烯胺酮化合物和对甲苯磺酸三氟甲硒酯原料成本低,且无需外加过渡金属或贵金属类催化剂,能够在温和条件下高选择性、高收率获得3
‑
三氟甲硒基色酮化合物,该反应原子效率高、成本低、环境友好、分离纯化简单,有利于大规模生产。
[0005]
为了实现上述技术目的,本发明提供了一种3
‑
三氟甲硒基色酮化合物的合成方法,该方法是在可见光照射下将邻羟基苯基烯胺酮化合物和对甲苯磺酸三氟甲硒酯进行一锅反应,即得3
‑
三氟甲硒基色酮化合物;
[0006]
所述邻羟基苯基烯胺酮化合物具有式1结构:
[0007][0008]
所述3
‑
三氟甲硒基色酮化合物具有式2结构:
[0009][0010]
其中,
[0011]
r1为烷基、烷氧基、氰基或卤素取代基。
[0012]
本发明的3
‑
三氟甲硒基色酮化合物中r1是由邻羟基苯基烯胺酮化合物引入的取代基团,r1可以为烷基、烷氧基、氰基或者卤素取代基。所述烷基为c1~c5的烷基,可以为直链烷烃,或者当碳原子数在3以上时,还可以为带支链的烷基,具体例如甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基等。所述烷氧基为c1~c5的烷氧基,具体例如甲氧基、乙氧基、丁氧基等;所述卤素取代基如氟取代基、氯取代基、溴取代基或碘取代基;苯环上所含的取代基可以有一个或多个取代基,一般含有一个或两个取代基,取代基的位置不限。r1取代基的种类及数目对合成3
‑
三氟甲硒基色酮化合物反应的影响并不明显,选择不同取代基时,经过优化其他反应条件,3
‑
三氟甲硒基色酮化合物的收率均可以达到86%以上。
[0013]
作为一个优选的方案,所述对甲苯磺酸三氟甲硒酯与所述邻羟基苯基烯胺酮化合物的摩尔比为1~1.2:1。对甲苯磺酸三氟甲硒酯的用量为邻羟基苯基烯胺酮化合物摩尔量的1.1倍时,达到最佳的反应效果,目标产物的收率最高,对甲苯磺酸三氟甲硒酯的相对用量超过邻羟基苯基烯胺酮化合物摩尔量的1.1时,反应效果增加不明显,而对甲苯磺酸三氟甲硒酯的相对用量低于邻羟基苯基烯胺酮化合物摩尔量的1倍时,目标产物的收率明显下降。本发明只需采用稍过量的三氟甲硒基源就能获得较高的目标产物收率。
[0014]
作为一个优选的方案,所述可见光为蓝光。在黄光、白光、绿光等可见光照射下,反应能够顺利进行,但是目标产物收率相对较低,经过优化其他反应条件,目标产物的收率也均在60%以下,而采用蓝光作为光源时,目标产物收率明显大幅度提高。
[0015]
作为一个优选的方案,所述蓝光由5~15w的led蓝光光源提供,进一步优选的蓝光光源为8~12wled蓝光,最优选为10w led蓝光。蓝光光源的功率为5~15w范围内,目标产物收率随着功率的增加在10w达到最高值,说明适当增加蓝光光源的功率有利于促进反应,进一步增加蓝光光源的功率,目标产物收率会稍有降低,说明副反应可能随着蓝光光源功率增加而产生。
[0016]
作为一个优选的方案,所述一锅反应采用n,n
‑
二甲基甲酰胺和/或二甲基亚砜作为溶剂。该反应使用乙腈、n,n
‑
二甲基甲酰胺、二甲基亚砜等作为反应溶剂,反应均可以顺利进行,但是乙腈作为溶剂时,目标产物收率较低,而n,n
‑
二甲基甲酰胺作为溶剂时,目标产物收率相对较高,dmso是最佳的反应溶剂,而使用四氢呋喃作为反应溶剂时,反应不能顺利进行。
[0017]
作为一个优选的方案,所述一锅反应采用rhodamine b、rose bengal、eosin y中至少一种作为光催化剂。该反应使用rhodamine b、rose bengal、eosin y等作为光催化剂,反应均可以顺利进行,但是rhodamine b和rose bengal作为光催化剂时,目标产物收率较低,而eosin y目标产物收率相对较高,是最佳的反应光催化剂。光催化剂的加入量为邻羟基苯基烯胺酮化合物摩尔量的40~60%。
[0018]
作为一个优选的方案,所述一锅反应的条件为:在室温下反应,反应时间为6~8小
时。该反应可以在室温下反应,无需额外加热。
[0019]
本发明由邻羟基苯基烯胺酮化合物和对甲苯磺酸三氟甲硒酯在可见光照射下的反应路线如下:
[0020][0021]
本发明还提出了光催化合成3
‑
三氟甲硒基色酮化合物的反应机理,以邻羟基苯基烯胺酮和对甲苯磺酸三氟甲硒酯之间的反应为例进行具体说明。对甲苯磺酸三氟甲硒酯在可见光照射下原位生成高活性的三氟甲基硒自由基,进一步形成二三氟甲基二硒醚中间体,接下来二三氟甲基二硒醚中间体与邻羟基苯基烯胺酮发生加成反应生成中间体a,随后中间体a发生分子内亲核环化过程得到中间体b,进一步通过分子内消除得到3
‑
三氟甲硒基色酮并释放出二甲胺分子。
[0022][0023]
相对现有技术,本发明的技术方案带来的有益技术效果:
[0024]
1)本发明采用对甲苯磺酸三氟甲硒酯作为三氟甲硒源,成本较低,且其在可见光照射下原位生成三氟甲基硒自由基活性中间体,从而可以实现可见光催化反应。
[0025]
2)本发明采用的反应原料成本低,原子经济性高,无需额外添加氧化剂、酸碱等添加剂;
[0026]
3)本发明邻羟基苯基烯胺酮化合物的选择性广,官能团兼容性好;
[0027]
4)本发明不使用过渡金属或贵金属催化剂,反应选择性高,产物易分离提纯,收率高;
[0028]
5)本发明的反应步骤简单,一锅反应可以实现,且反应条件温和,在较低的温度条件下可以实现。
附图说明
[0029]
图1为3
‑
三氟甲硒基色酮1h nmr。
[0030]
图2为3
‑
三氟甲硒基色酮
13
c nmr。
具体实施方式
[0031]
以下具体实施例旨在进一步说明本发明内容,而不是限制本发明权利要求的保护范围。
[0032]
以邻羟基苯基烯胺酮和对甲苯磺酸三氟甲硒酯在最佳反应条件下进行的反应作为标准反应,具体反应式如下:
[0033][0034]
具体操作步骤为:在10ml石英反应管中,依次加入对甲苯磺酸三氟甲硒酯(0.44mmol)、邻羟基苯基烯胺酮(0.40mmol)、eosin y(0.20mmol)以及dmso(1.5ml)。所得混合液在可见光照射下室温搅拌反应。薄层层析监测反应进程,反应6小时后,向反应混合物中加入10ml水,并使用乙酸乙酯(5ml
×
2)萃取,合并有机相并使用饱和食盐水洗涤,干燥后真空浓缩并通过色谱柱层析纯化即可得到目标化合物。
[0035]
以下实验组1~14是以上述标准反应作为参考,进行对比说明:
[0036][0037]
上表中实验组1~4考察了不同的可见光光源对反应的影响,实验结果表明:在该反应在使用蓝色、黄色、绿色以及白色可见光进行照射时,反应均可以顺利进行,但该反应对光源较为敏感,只有使用蓝色可见光照射下,能得到理想的产物收率。
[0038]
上表中实验组1、5~6考察了光照功率对反应的影响,通过实验表明:降低光照功率,反应效果受到一定的影响,目标产物产率均会明显降低。提高光照功率,反应的收率没有明显的提高,反而略有降低,可能是受到副反应影响。因此,该反应的最佳光源功率为10w。
[0039]
上表中实验组1、7~8考察了光催化剂对反应的影响,通过实验表明:eosin y、rhodamine b、rose bengal等光催化剂均可以催化反应的顺利进行,但eosin y的催化效果最佳。
[0040]
上表中实验组1、9~10考察了对甲苯磺酸三氟甲硒酯的用量对反应的影响,通过实验表明:增加对甲苯磺酸三氟甲硒酯用量,从0.44mmol增加至0.48mmol时反应的收率没有明显的提升;而当降低用量至0.40mmol时,反应效果受到一定影响,因此反应中三氟甲基苄基硒醚的最佳用量为0.44mmol。
[0041]
上表中实验组1、11~13考察了不同的反应溶剂,通过实验表明使用乙腈或n,n
‑
二甲基甲酰胺代替二甲基亚砜作为溶剂时,反应也可以顺利进行,但产率均有一定程度的降低。而使用四氢呋喃作为溶剂时,未检测到3
‑
三氟甲硒基色酮产物生成,反应无法进行,因此该反应的最佳溶剂为二甲基亚砜。
[0042]
上表中实验组1、14考察了可见光照射对反应的影响,通过实验表明反应在无可见光照射下,无法进行。
[0043]
实施例1~6
[0044]
以下实施例1~6均按最优反应条件下反应,具体反应方程式如下,主要是考察不同底物在最优条件反应的收率情况:
[0045][0046]
具体操作步骤为:在10ml石英反应管中,依次加入对甲苯磺酸三氟甲硒酯(0.44mmol)、邻羟基苯基烯胺酮(0.40mmol)、eosin y(0.20mmol)以及dmso(1.5ml)。所得混合液在可见光照射下室温搅拌反应。薄层层析监测反应进程,反应6h后,向反应混合物中加入10ml水,并使用乙酸乙酯(5ml
×
2)萃取,合并有机相并使用饱和食盐水洗涤,干燥后真空浓缩并通过色谱柱层析纯化即可得到目标化合物。
[0047]
实施例1
[0048]
化合物1:收率98%,3
‑
((trifluoromethyl)selanyl)
‑
4h
‑
chromen
‑4‑
one;
[0049][0050]1h nmr(400mhz,cdcl3)δ8.42(s,1h),8.26(d,j=7.6hz,1h),7.75
–
7.71(m,1h),7.51
–
7.46(m,2h);
[0051]
13
c nmr(100mhz,cdcl3)δ174.2,161.2,156.2,134.5,126.6,126.3,123.5,121.8(q,1j(c,f)=332.5hz),118.2,110.9(q,2j(c,f)=1.5hz).
[0052]
实施例2
[0053]
化合物2:收率96%,6
‑
methyl
‑3‑
((trifluoromethyl)selanyl)
‑
4h
‑
chromen
‑4‑
one;
[0054][0055]1h nmr(400mhz,cdcl3)δ8.39(s,1h),8.03(s,1h),7.53(d,j=8.4hz,1h),7.39(d,j=8.4hz,1h),2.46(s,3h);
[0056]
13
c nmr(100mhz,cdcl3)δ174.3,161.2,154.5,136.5,135.7,125.9,123.2,121.8(q,1j(c,f)=332.5hz),117.9,110.6(q,2j(c,f)=1.5hz),20.9.
[0057]
实施例3
[0058]
化合物3:收率94%,6
‑
chloro
‑3‑
((trifluoromethyl)selanyl)
‑
4h
‑
chromen
‑4‑
one;
[0059][0060]1h nmr(400mhz,cdcl3)δ8.42(s,1h),8.21(d,j=2.4hz,1h),7.68(dd,j=2.4,8.8hz,1h),7.47(d,j=8.8hz,1h);
[0061]
13
c nmr(100mhz,cdcl3)δ173.1,161.2,154.6,134.7,132.4,126.0,124.4,121.7(q,1j(c,f)=332.5hz),120.0,110.9(q,2j(c,f)=1.5hz).
[0062]
实施例4
[0063]
化合物4:收率93%,7
‑
methoxy
‑3‑
((trifluoromethyl)selanyl)
‑
4h
‑
chromen
‑4‑
one;
[0064][0065]1h nmr(400mhz,cdcl3)δ8.34(s,1h),8.17(d,j=8.8hz,1h),7.03(dd,j=2.4,8.8hz,1h),6.87(d,j=2.4hz,1h),3.92(s,3h);
[0066]
13
c nmr(100mhz,cdcl3)δ173.5,164.6,160.6,158.1,128.1,121.8(q,1j(c,f)=332.5hz),117.3,115.4,111.0,100.4,56.0.
[0067]
实施例5
[0068]
化合物5:收率94%,6
‑
bromo
‑3‑
((trifluoromethyl)selanyl)
‑
4h
‑
chromen
‑4‑
one;
[0069][0070]1h nmr(400mhz,cdcl3)δ8.42(s,1h),8.36(d,j=2.4hz,1h),7.81(dd,j=2.4,8.8hz,1h),7.41(d,j=2.4hz,1h);
[0071]
13
c nmr(100mhz,cdcl3)δ173.0,161.2,155.0,137.5,129.2,124.7,121.7(q,1j(c,f)=332.5hz),120.2,119.8,111.0.
[0072]
实施例6
[0073]
化合物6:收率92%,6
‑
methoxy
‑3‑
((trifluoromethyl)selanyl)
‑
4h
‑
chromen
‑4‑
one;
[0074][0075]1h nmr(400mhz,cdcl3)δ8.40(s,1h),7.61(d,j=3.2hz,1h),7.43(d,j=8.8hz,1h),7.30(dd,j=3.2,8.8hz,1h),3.90(s,3h);
[0076]
13
c nmr(100mhz,cdcl3)δ174.1,160.9,157.7,151.1,124.4,124.2,121.8(q,1j(c,f)=332.5hz),119.6,110.0(q,2j(c,f)=1.5hz),105.6,56.0.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。