1.本发明涉及水体污染监测技术领域,尤其涉及一种生物体中内分泌干扰物的测定方法。
背景技术:
2.内分泌干扰物(endocrine disrupting chemicals,edcs)是指一种外源性物质,该物质具有较高雌激素活性,微量暴露即可引起生物体内分泌失衡;此外,edcs还可对水生生物的神经系统、免疫系统等产生毒性效应,引起水生生物种群存活能力下降。由于edcs具有中
‑
强亲脂性特点,使其除了直接对暴露生物产生毒性外,还可在生物体内累积和潜伏,这种累积效应达到一定水平可对生物产生氧化损伤、致癌变等多种毒害作用,其损伤短期无法消除,甚至可能不可逆。这种累积毒性效应还可经生物放大和母系胚胎传递,对高营养级食肉动物产生危害。edcs还可能对特定营养级类群产生选择性影响,导致生态系统营养结构的衰退。由此可见,控制edcs在水生态系统中的含量,对于保障生态安全和人类健康具有重要的意义。
3.一般认为,edss包括:雌酮(estrone,e1)、雌二醇(estradiol,e2)、双酚a(bisphenol,bpa)、辛基酚(octyl phenol,4
‑
t
‑
op)和壬基酚(nonyl phenol,4
‑
np);其中,e1、e2为天然雌激素。其余则主要来源于制造业,如辛基酚和壬基酚主要源于非离子表面活性剂壬基酚聚氧乙烯醚和辛基酚聚氧乙烯醚生产过程的排放。双酚a则主要来源于聚碳酸酯和环氧树脂等的重要原料的生产过程。
4.为了控制水生态系统中edcs的含量,就需要对水生态系统中各种要素中edcs的含量进行准确、快速的分析。水体生物作为水生态系统中的重要组成部分,测定其edcs的含量具有重要的意义。
技术实现要素:
5.本发明所要解决的技术问题在于,提供一种生物体中内分泌干扰物的测定方法,其可同时测定水体生物中多种内分泌干扰物的含量,且该方法测定效率高,测定结果准确。
6.为了解决上述技术问题,本发明提供了一种生物体中内分泌干扰物的测定方法,其包括:
7.(1)取水体生物样品,与内标物混合,得混合物;
8.(2)将所述混合物采用提取溶剂提取,得到提取物;
9.(3)将提取物溶解,并将溶解得到的溶液过滤,得到待测溶液;
10.(4)将待测溶液采用液相色谱串联质谱仪进行测定,得到待测溶液中内分泌干扰物的含量;
11.所述内分泌干扰物包括:雌酮、雌二醇、双酚a、辛基酚、壬基酚、三氯生和三氯卡班。
12.作为上述技术方案的改进,步骤(2)中,所述提取溶剂选用乙酸乙酯、乙腈、乙酸中
的一种或多种;
13.步骤(3)中,采用甲醇和/或乙醇溶解提取物。
14.作为上述技术方案的改进,步骤(2)中,所述提取溶剂选用乙腈和乙酸的混合物,乙腈和乙酸体积比为(95~99):1;
15.步骤(3)中,采用甲醇溶解提取物。
16.作为上述技术方案的改进,步骤(2)包括:
17.(2.1)在混合物中加入提取溶剂,混匀,得到混合液;
18.(2.2)在混合液中加入nacl、mgso4,混合均匀后离心,取上清液;
19.(2.3)将所述上清液加入离心管中,离心静置后取上清液,干燥即得到提取物;
20.其中,所述离心管中含有n
‑
丙基乙二胺、十八烷基键合硅胶、活性硅酸镁。
21.作为上述技术方案的改进,步骤(2.1)中,混合物与提取溶剂的用量比为1g:(0.5~1.2)l;
22.步骤(2.2)中,nacl的用量为所述混合物重量的1.5~3倍,mgso4的用量为所述混合物重量的9~12倍;
23.步骤(2.3)中,所述离心管中,所述n
‑
丙基乙二胺的重量为所述混合物重量的4~5倍,所述十八烷基键合硅胶的重量为所述混合物重量的4~5倍,所述活性硅酸镁的重量为所述混合物重量的4~5倍。
24.作为上述技术方案的改进,步骤(1)中,所述内标物与所述水体生物的重量比为(1~1.5):104。
25.作为上述技术方案的改进,步骤(1)中,所述内标物包括雌酮、雌二醇、双酚a、辛基酚、壬基酚、三氯生和三氯卡班;各内标物的用量相同。
26.作为上述技术方案的改进,步骤(4)中,液相色谱的测定条件为:色谱柱以十八烷基硅烷键合硅胶为填充剂,液相色谱仪以水为流动相a,甲醇为流动相b进行梯度洗脱,柱温为30~40℃,流速为0.4~0.8ml/min,进样量为2~10μl。
27.作为上述技术方案的改进,所述梯度洗脱按下述程序进行:
28.0~5min,流动相a从50%
→
0%,流动相b从50%
→
100%;
29.5~7min,流动相a为0%,流动相b为100%;
30.7~7.1min,流动相a从0%
→
50%,流动相b从50%
→
100%;
31.7.1~10min,流动相a为50%,流动相b为50%。
32.作为上述技术方案的改进,所述质谱的测定条件为:离子源为esi源负离子模式,气帘气压力为30~40psi,离子源电压为
‑
4800~
‑
4000v,干燥气温度为500~550℃,干燥器压力为45~55psi,雾化气压力为50~60psi。
33.作为上述技术方案的改进,所述质谱的测定条件为:离子源为esi源负离子模式,气帘气压力为35psi,离子源电压为
‑
4500v,干燥气温度为500℃,干燥器压力为50psi,雾化气压力为55psi。
34.实施本发明,具有如下有益效果:
35.(1)本发明对水体生物中雌酮、雌二醇、双酚a、辛基酚、壬基酚、三氯生、三氯卡班同时进行测定,拓宽了常规内分泌干扰物的测定范围,为后续有效控制水体生态系统中内分泌干扰物含量提供了良好的数据基础。
36.(2)本发明的测定方法,采用液相色谱
‑
质谱联用的方法进行检测,其检出限低,精确度、灵敏度较高。可同时实现对于雌酮、雌二醇、双酚a、辛基酚、壬基酚、三氯生、三氯卡班含量的精确测定。
37.(3)本发明在充分考虑内分泌干扰物各项性质的基础上,选用提取
‑
溶解
‑
过滤的工艺制备得到待测溶液,并选用特定比例的乙腈、乙酸作为提取溶剂,选用甲醇作为溶解溶剂,可有效地保留水体生物中的各种内分泌干扰物,提升测定准确度。
附图说明
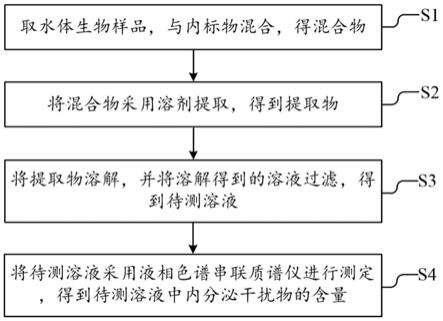
38.图1是本发明中一种生物体中内分泌干扰物的测定方法的流程图。
具体实施方式
39.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图及具体实施方式对本发明作进一步地详细描述。
40.参照图1,本发明提供了一种生物体中内分泌干扰物的测定方法,其包括如下步骤:
41.s1:取水体生物样品,与内标物混合,得混合物;
42.具体的,s1包括:
43.s11:采集水体生物样品;
44.其中,水体生物包括浮游生物、底栖生物和鱼类。其采集分别如下:
45.浮游生物采集方法为:用160μm孔径尼龙网反复拖网采集,并筛滤,用高纯水润洗以去除悬浮物,重复筛滤,直至网袋中收集到足够数量的浮游生物样本。浮游生物经玻璃瓶收集浓缩后冷冻干燥。
46.底栖动物:在溪流、河水中放置虾笼采集虾蟹。采泥器采集拣出活的一定大小的底栖动物,蒸馏水清洗,计数鉴定后选软组织冻干、研磨。
47.鱼类:采用流刺网、定置刺网、定置陷阱网作为被动采集方式,或从采样点附近的渔民处购买。挑选个体、肥满度相似的2
‑
3龄的相同物种鱼类,记录鱼类个体数、体长、体宽、体重,并用甲醇润洗过的手术剪和镊子解剖鱼类,得到其背部白色肌肉组织,并冻干、研磨。
48.s12:将水体生物样品与内标物混合,得到混合物;
49.其中,内标物包括:雌酮(e1)、雌二醇(e2)、双酚a(bpa)、辛基酚(4
‑
t
‑
op)、壬基酚(4
‑
np)、三氯生(tcs)和三氯卡班(tcc),具体的为以上各物质中一种或多种元素被其同位素取代后得到的物质。更具体的,内标物为e1
‑
d4,e2
‑
d4,bpa
‑
d16,
13
c
12
‑
tcs,4
‑
n
‑
np
‑
2,3,5,6
‑
d4(高纯试剂,加拿大cdn公司);tcc
‑
13
c6(高纯试剂,美国cil公司),4
‑
t
‑
op
‑
13
c6(高纯试剂,加拿大trc公司)。
50.其中,混合物中内标物的含量为100~120ng/g(水体生物冻干粉,干重)示例性的为100ng/g、105ng/g、110ng/g、115ng/g或120ng/g,但不限于此。优选的,混合物中内标物的总含量为120ng/g(水体生物冻干粉,干重)。其中,混合物中各内标物的含量相同或不同;优选的,混合物中各内标物的含量相同。
51.s2:将混合物采用溶剂提取,得到提取物;
52.具体的,s2包括:
53.s21:在混合物中加入提取溶剂,混匀,得到混合液;
54.其中,提取溶剂选用乙酸乙酯、乙腈、乙酸中的一种或多种;上述溶剂可较好地保留水体生物样品中的内分泌干扰物。优选的,提取溶剂选用乙腈和乙酸的混合物;其体积比为(95~99):1;示例性的,乙腈和乙酸的体积比为96:1、97:1、98:1、99:1,但不限于此。
55.其中,混合物与提取溶剂的用量比为1g:(0.05~0.2)l,示例性的为1g:0.06l、1g:0.08l、1g:0.1l、1g:0.18l,但不限于此。优选的,混合物与溶剂的用量比为1g:0.1l。
56.具体的,取50~100mg冻干匀浆后的生物样品,放入10~15ml玻璃离心管,加入混内标6~15ng,待溶剂挥发完全后,置于
‑
4℃的冷库中过夜,隔天进行提取。提取时首先加入3~8ml酸化乙腈(1%乙酸),涡旋0.5~2min,然后加入40~500μl超纯水,涡旋0.5~2min,即得混合液。
57.s22:在混合液中加入nacl、mgso4,混合均匀后离心,取上清液;
58.其中,nacl的用量为所述混合物重量的1.5~3倍;示例性的为1.5倍、1.8倍、2倍、2.5倍或2.8倍,但不限于此。mgso4的用量为所述混合物重量的9~12倍,示例性的为9.5倍、10.5倍、11倍或11.5倍,但不限于此。
59.具体的,在50~100mg生物样品制备得到的混合液中加入100~200mg nacl,500~1000mg无水硫酸镁,立即涡旋1~1.5min(及时涡旋,防止无水硫酸镁结块)然后在3000rcf下离心5~6min,取上清液。
60.s23:将上清液加入离心管中,离心静置后取上清液,干燥即得到提取物;
61.其中,离心管内含有n
‑
丙基乙二胺(psa)、十八烷基键合硅胶(c18)、活性硅酸镁(florisil)。其中,n
‑
丙基乙二胺、十八烷基键合硅胶、活性硅酸镁的重量均为混合物重量的4~5倍;三者的含量相同或不同。优选的,三者的含量相同。
62.具体的,将步骤s22得到的上清液转移到含有psa,c18和florisil的玻璃离心管中,涡旋1~2min,静置8~15min,吸取上清液,温和氮气下缓慢吹至近干,即得提取物。
63.s3:将提取物溶解,并将溶解得到的溶液过滤,得到待测溶液;
64.其中,采用甲醇和/或乙醇溶解提取物;优选的,采用甲醇。
65.具体的,将提取物采用甲醇重溶,经0.22μm有机相尼龙滤膜过滤,得到待测溶液。
66.s4:将待测溶液采用液相色谱串联质谱仪进行测定,得到待测溶液中内分泌干扰物的含量;
67.具体的,该步骤包括:
68.s41:获取标准曲线;
69.具体的,取e1、e2、bpa、4
‑
t
‑
op、4
‑
np、tcs、tcc标准品(未经过同位素置换)配制七种不同浓度的混标溶液(每个混标溶液中均含有同浓度的七种标准品,各混标溶液中每个标准品的浓度分别为200μg/l、100μg/l、50μg/l、20μg/l、10μg/l、5μg/l、1μg/l,各混标溶液中标准品的总浓度为1400μg/l、700μg/l、350μg/l、140μg/l、70μg/l、35μg/l、7μg/l);在每个混标溶液中加入七种内标物(e1
‑
d4,e2
‑
d4,bpa
‑
d16,
13
c
12
‑
tcs,4
‑
n
‑
np
‑
2,3,5,6
‑
d4,tcc
‑
13
c6,4
‑
t
‑
op
‑
13
c6),得到待检测混标溶液;每个待检测混标溶液中七种内标物的浓度均相同,均为100μg/l,每个待检测混标溶液中内标物的总浓度均为700μg/l。
70.将待检测混标溶液采用液相色谱串联质谱仪进行测定(测定条件如s42中所示),以标准品浓度/内标浓度为横坐标,以标准品峰面积/内标峰面积为纵坐标,拟合即得标准
曲线。
71.s42:将待测溶液采用液相色谱串联质谱仪进行测定,并代入标准曲线计算,即得到待测溶液中内分泌干扰物的含量。
72.步骤s41和s42中,液相色谱测定条件、质谱色谱条件相同。
73.具体的,液相色谱的测定条件为:色谱柱以十八烷基硅烷键合硅胶为填充剂,液相色谱仪以水为流动相a,甲醇为流动相b进行梯度洗脱,柱温为30~40℃,流速为0.4~0.8ml/min,进样量为2~10μl。
74.具体的,梯度洗脱按下述程序进行:
75.0~5min,流动相a从50%
→
0%,流动相b从50%
→
100%;
76.5~7min,流动相a为0%,流动相b为100%;
77.7~7.1min,流动相a从0%
→
50%,流动相b从50%
→
100%;
78.7.1~10min,流动相a为50%,流动相b为50%。
79.优选的,液相色谱的测定条件为:色谱柱为venusil c18 plus柱,其内径为2.1mm,柱长为100mm,粒径为3μm,填料孔径为柱温为35℃,流速为0.5ml/min,进样量为5μl。
80.具体的,质谱的测定条件为:离子源为esi源负离子模式,气帘气压力为30~40psi,离子源电压为
‑
4800~
‑
4000v,干燥气温度为500~550℃,干燥器压力为45~55psi,雾化气压力为50~60psi。
81.优选的,质谱的测定条件为:离子源为esi源负离子模式,气帘气压力为35psi,离子源电压为
‑
4500v,干燥气温度为500℃,干燥器压力为50psi,雾化气压力为55psi。其中,质谱测试过程中各内分泌干扰物的具体参数参下表1。
82.表1 edcs保留时间、母离子、子离子、解簇电压及碰撞能(表中,i.s.为内标)
[0083][0084]
具体的,发明人在研究过程中发现,在水体生态系统中,往往存在三氯生(tcs)和三氯卡班(tcc),虽然其不属于传统的内分泌干扰物,但其也具有内分泌干扰效应,以上两者主要是作为杀菌剂存在于各种日化护理品中,进而排入了水体生态系统,富集到水体沉积物中。因此,发明人在评价内分泌干扰物的过程中将三氯生、三氯卡班也纳入测定对象,
为全面反应水体生态系统中内分泌干扰物的影响提供了更为全面的数据基础。并且,通过上述色谱条件和质谱条件,可同时实现对雌酮、雌二醇、双酚a、辛基酚、壬基酚、三氯生、三氯卡班的含量的测定。
[0085]
下面以具体实施例对本发明进行说明。
[0086]
实施例1
[0087]
本实施例采用上述的方法对珠江水体生物中内分泌干扰的含量进行测定,具体的包括:
[0088]
(1)在珠江广州区段取样,具体的包括:
[0089]
1)浮游生物:用160μm孔径尼龙网反复拖网采集,并筛滤,用milli
‑
q润洗以去除悬浮物,重复筛滤,直至网袋中收集到足够数量的浮游生物样本。浮游生物经玻璃瓶收集浓缩后冷冻干燥。
[0090]
底栖动物:溪流中的虾蟹在电鱼过程中同步采集,深水河段放置虾笼采集虾蟹。采泥器采集拣出活的一定大小的底栖动物,蒸馏水清洗,计数鉴定后选软组织冻干、研磨。
[0091]
鱼类:在当地渔民协助下,采用流刺网、定置刺网、定置陷阱网作为被动采集方式,或从采样点附近的渔民处购买。挑选个体、肥满度相似的2
‑
3龄的相同物种鱼类,记录鱼类个体数、体长、体宽、体重,并用甲醇润洗过的手术剪和镊子解剖鱼类,得到其背部白色肌肉组织,并冻干、研磨。
[0092]
(2)提取:称取50mg冻干匀浆后的生物样品,放入15ml玻璃离心管,加入混内标6ng(e1
‑
d4,e2
‑
d4,bpa
‑
d16,
13
c
12
‑
tcs,4
‑
n
‑
np
‑
2,3,5,6
‑
d4;tcc
‑
13
c6,4
‑
t
‑
op
‑
13
c6,各内标物加入质量相同),待溶剂挥发完全后,置于
‑
4℃的冷库中过夜,隔天进行提取。提取时首先加入5ml酸化乙腈(1%乙酸),涡旋1min,然后加入400μl超纯水,涡旋1min。然后加入100mg nacl,500mg无水硫酸镁,立即涡旋1min(及时涡旋,防止无水硫酸镁结块)然后在3000rcf下离心6min,并将上清液转移到含有200mg psa,200mg c18和200mg florisil的玻璃离心管中,涡旋1min,静置10min,吸取上清液,温和氮气下缓慢吹至近干。
[0093]
(3)制备待测溶液,将提取物用200μl甲醇重溶,经0.22μm有机相尼龙滤膜过滤,装入含250μl内插管的进样小瓶中,在
‑
20℃保存待上机检测。
[0094]
(3)采用液相色谱串联质谱仪(agilent1100
‑
qtrap4000)对待测溶液进行测定,得到内分泌干扰物的浓度。
[0095]
其中,色谱条件:色谱柱为venusil c18 plus柱(2.1
×
100mm,3μm);柱温35℃;进样量5μl;流动相为水(a)和甲醇(b),流速0.5ml/min。梯度洗脱程序如下:
[0096]
0~5min,流动相a从50%
→
0%,流动相b从50%
→
100%;
[0097]
5~7min,流动相a为0%,流动相b为100%;
[0098]
7~7.1min,流动相a从0%
→
50%,流动相b从50%
→
100%;
[0099]
7.1~10min,流动相a为50%,流动相b为50%。
[0100]
质谱条件:离子源为esi源负离子模式;气帘气压力35psi,离子源电压为
‑
4500v,干燥气温度500℃,压力50psi;雾化气压力55psi。具体仪器参数见表1。
[0101]
通过测定,珠江水体中各种生物的内分泌干扰物的检出率、含量如表2所示。
[0102]
表2 edcs在珠江水体生物的浓度分布特征
[0103][0104]
实施例2
[0105]
对本发明中测定方法的加样回收率以及检出限、定量限进行考察。
[0106]
其中,回收率测定过程中4次平行加标准品,加标沉积物样品为流溪河水库采集罗非鱼的白色肌肉。4
‑
np的加标浓度为1000ng/g,其他edcs的加标浓度为100ng/g。分别测定,计算回收率。
[0107]
检出限(limit of detection,lod)和定量限(limit of quantitation,loq)的计算采用4次加标浓度为5ng/g的罗非鱼样品,计算每种化合物的标准偏差(standard derivation,sd),则3倍的sd为lod,10倍的sd为loq。7种edcs的回收率和检出限如表3所示。
[0108]
表3 edcs在的回收率和检出限
[0109][0110]
以上所述是发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。