双特异性cd123 x cd3双抗体在血液系统恶性肿瘤治疗中的给药方案
1.相关申请的交叉引用
2.本技术要求美国专利申请序列号63/001,388(在2020年3月29日提交;未决的)、62/831,969(在2019年4月10日提交;未决的)、62/831,979(在2019年4月10日提交;未决的)、62/929,381(在2019年11月1日提交;未决的)和62/929,401(在2019年11月1日提交;未决的)的优先权,其中每个申请均通过引用方式全部并入本文。
3.序列表的引用
4.按照37 c.f.r.1.821以及下面条款,本技术包括一个或多个序列表,其以计算机可读介质(文件名:1301_0162p3_pct_st25.txt,创建于2020年3月28日,并且大小为35,519个字节)公开,该文件通过引用方式全部并入本文。
技术领域
5.本发明涉及向具有如急性髓细胞白血病(aml)或脊髓发育不良综合征(mds)的血液系统恶性肿瘤的患者施用cd123 x cd3双特异性双抗体的给药方案。本发明还涉及向具有如急性髓细胞白血病(aml)或脊髓发育不良综合征(mds)的血液系统恶性肿瘤的患者施用cd123 x cd3双特异性双抗体与能够结合pd
‑
1或pd
‑
1的天然配体的分子(“pd
‑
1或pd
‑
1配体结合分子”)的组合的给药方案。本发明特别地涉及用于能够同时结合至cd123和cd3的序列优化的cd123 x cd33双特异性双抗体“dart
‑
a”的这种方案的用途。
6.本发明的背景
7.i.aml和mds
8.aml和mds被认为在小部分的白血病干细胞(lsc)中出现并通过其得以持续,该白血病干细胞通常处于休眠状态(即不是迅速分裂的细胞),因此抵抗细胞死亡(凋亡)和常规化疗剂。lsc的特征在于高水平的cd123表达,其在正常人的骨髓中相应的正常造血干细胞群体中不存在(jin,w.等(2009)“regulation of th17 cell differentiation and eae induction by map3k nik,”blood 113:6603
‑
6610;jordan,c.t.等(2000)“the interleukin
‑
3receptor alpha chain is a unique marker for human acute myelogenous leukemia stem cells,”leukemia 14:1777
‑
1784)。cd123在45%
‑
95%的aml、85%的毛细胞白血病(hcl)和40%的急性b淋巴细胞白血病(b
‑
all)中表达。cd123表达还与多种其他恶性肿瘤/前恶性肿瘤(pre
‑
malignancies)相关:慢性髓细胞白血病(cml)祖细胞(包括急变期(blast crisis)cml)、霍奇金里德斯特恩伯格(hodgkin’s reed sternberg)(rs)细胞、转化的非霍金淋巴瘤(nhl)、一些慢性淋巴细胞性白血病(cll)(cd11c )、急性t淋巴细胞白血病的亚群(t
‑
all)(16%,最不成熟的,大部分是成人的)、浆细胞样树突状细胞(pdc)(dc2)恶性肿瘤和cd34 /cd38
‑
脊髓发育不良综合征(mds)骨髓细胞恶性肿瘤。
9.aml是克隆性疾病,其特征在于在骨髓中转化的髓样祖细胞的增殖和积聚,其最终导致造血功能障碍。aml的发病率随着年龄而增加,并且年长患者通常比年轻患者具有更差
myelogenous leukemia stem cells,”leukemia14:1777
‑
1784;jin,w.等(2009)“regulation of th17 cell differentiation and eae induction by map3k nik,”blood 113:6603
‑
6610)。在人类正常前体群体中,cd123由造血祖细胞(hpc)的亚型表达,而不是由正常造血干细胞(hsc)表达。cd123也由浆细胞样树突状细胞(pdc)和嗜碱性粒细胞表达,并且在较小程度上由单核细胞和嗜酸性粒细胞表达(lopez,a.f.等(1989)“reciprocal inhibition of binding between interleukin 3and granulocyte
‑
macrophage colony
‑
stimulating factor to human eosinophils,”proc.natl.acad.sci.(u.s.a.)86:7022
‑
7026;sun,q.等(1996)“monoclonal antibody 7g3 recognizes the n
‑
terminal domain of the human interleukin
‑
3(il
‑
3)receptor alpha chain and functions as a specific il
‑
3receptor antagonist,”blood 87:83
‑
92;l.等(2001)“interleukin
‑
3 receptor alpha chain(cd123)is widely expressed in hematologic malignancies,”haematologica 86(12):1261
‑
1269;masten,b.j.等(2006)“characterization of myeloid and plasmacytoid dendritic cells in human lung,”j.immunol.177:7784
‑
7793;korpelainen,e.i.等(1995)“interferon
‑
gamma upregulates interleukin
‑
3(il
‑
3)receptor expression in human endothelial cells and synergizes with il
‑
3in stimulating major histocompatibility complex class ii expression and cytokine production,”blood 86:176
‑
182)。
16.已经报道cd123在包括急性髓细胞白血病(aml)和骨髓发育不良综合症(mds)的广泛的血液系统恶性肿瘤中的恶性细胞上过度表达(l.等(2001)“interleukin
‑
3receptor alpha chain(cd123)is widely expressed in hematologic malignancies,”haematologica 86(12):1261
‑
1269)。cd123的过度表达与aml的预后较差有关(tettamanti,m.s.等(2013)“targeting of acute myeloid leukaemia by cytokine
‑
induced killer cells redirected with a novel cd123
‑
specific chimeric antigen receptor,”br.j.haematol.161:389
‑
401)。
17.iii.cd3
18.cd3是由四条不同的链组成的t细胞共受体(wucherpfennig,k.w.等(2010)“structural biology of the t
‑
cell receptor:insights into receptor assembly,ligand recognition,and initiation of signaling,”cold spring harb.perspect.biol.2(4):a005140;第1
‑
14页)。在哺乳动物中,该复合物包含cd3γ链、cd3δ链和两条cd3ε链。这些链与称为t细胞受体(tcr)的分子缔合,以便在t淋巴细胞中产生活化信号。在没有cd3的情况下,tcr无法适当组装并降解(thomas,s.等(2010)“molecular immunology lessons from therapeutic t
‑
cell receptor gene transfer,”immunology129(2):170
–
177)。发现cd3结合所有成熟t细胞的膜,并且几乎不结合其他细胞类型的膜(参见,janeway,c.a.等(2005)in:immunobiology:the immune system in health and disease,”第6版.garland science publishing,ny,第214
‑
216页;sun,z.j.等(2001)“mechanisms contributing to t cell receptor signaling and assembly revealed by the solution structure of an ectodomain fragment of the cd3ε:γheterodimer,”cell 105(7):913
‑
923;kuhns,m.s.等.(2006)“deconstructing the form and function of the tcr/cd3 complex,”immunity.2006年2月;24(2):133
‑
139)。
19.iv.程序性死亡
‑
1(“pd
‑
1”)膜蛋白
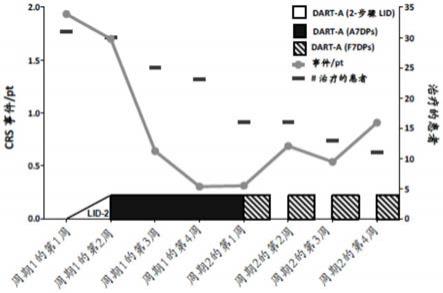
20.程序性死亡
‑
1(“pd
‑
1,”也称为“cd279”)是广泛地负调节免疫应答的t
‑
细胞调节剂的扩增的cd28/ctla
‑
4家族的近似31kd的i型膜蛋白成员(ishida,y.等(1992)“induced expression of pd
‑
1,a novel member of the immunoglobulin gene superfamily,upon programmed cell death,”embo j.11:3887
‑
3895;美国专利申请公开号2007/0202100、2008/0311117、2009/00110667;美国专利号6,808,710、7,101,550、7,488,802、7,635,757、7,722,868;pct公开号wo 01/14557)。
21.pd
‑
1在激活的t细胞、b细胞和单核细胞上表达(agata,y.等(1996)“expression of the pd
‑
1antigen on the surface of stimulated mouse t and b lymphocytes,”int.immunol.8(5):765
‑
772;yamazaki,t.等(2002)“expression of programmed death 1ligands by murine t
‑
cells and apc,”j.immunol.169:5538
‑
5545)并且在天然杀伤(nk)t
‑
细胞中以低水平表达(nishimura,h.等(2000)“facilitation of beta selection and modification of positive selection in the thymus of pd
‑1‑
deficient mice,”j.exp.med.191:891
‑
898;martin
‑
orozco,n.等(2007)“inhibitory costimulation and anti
‑
tumor immunity,”semin.cancer biol.17(4):288
‑
298)。
22.pd
‑
1通过结合b7
‑
h1和b7
‑
dc(也称为pd
‑
l1和pd
‑
l2)介导其抑制免疫系统(flies,d.b.等(2007)“the new b7s:playing a pivotal role in tumor immunity,”j.immunother.30(3):251
‑
260;美国专利号6,803,192、7,794,710;美国专利申请公开号2005/0059051、2009/0055944、2009/0274666、2009/0313687;pct公开号wo 01/39722、wo 02/086083)。
23.b7
‑
h1和b7
‑
dc在许多类型的人和鼠组织如心脏、胎盘、肌肉、胎肝、脾脏、淋巴结和胸腺以及鼠肝脏、肺、肾、胰腺的胰岛细胞和小肠的表面上广泛表达(martin
‑
orozco,n.等(2007)“inhibitory costimulation and anti
‑
tumor immunity,”semin.cancer biol.17(4):288
‑
298)。在人类中,已经在人内皮细胞(chen,y.等(2005)“expression of b7
‑
h1 in inflammatory renal tubular epithelial cells,”nephron.exp.nephrol.102:e81
‑
e92;de haij,s.等(2005)“renal tubular epithelial cells modulate t
‑
cell responses via icos
‑
l and b7
‑
h1”kidney int.68:2091
‑
2102;mazanet,m.m.等(2002)“b7
‑
h1 is expressed by human endothelial cells and suppresses t
‑
cell cytokine synthesis,”j.immunol.169:3581
‑
3588)、心肌(brown,j.a.等(2003)“blockade of programmed death
‑
1 ligands on dendritic cells enhances t
‑
cell activation and cytokine production,”j.immunol.170:1257
‑
1266)和合胞体滋养层(syncyciotrophoblasts)(petroff,m.g.等(2002)“b7 family molecules:novel immunomodulators at the maternal
‑
fetal interface,”placenta 23:s95
‑
s101)中发现b7
‑
h1蛋白表达。分子也由一些组织的驻留型巨噬细胞、已经通过干扰素(ifn)
‑
γ或肿瘤坏死因子(tnf)
‑
α激活的巨噬细胞表达(latchman,y.等(2001)“pd
‑
l2 is a second ligand for pd
‑
1and inhibits t
‑
cell activation,”nat.immunol 2:261
‑
268)以及在肿瘤中表达(dong,h.(2003)“b7
‑
h1 pathway and its role in the evasion of tumor immunity,”j.mol.med.81:281
‑
287)。
24.已经发现b7
‑
h1和pd
‑
1之间的相互作用为t
‑
细胞和b
‑
细胞提供关键的负性共刺激
cells by cytotoxic t
‑
cells mediated by a bispecific diabody,”protein eng.9:299
‑
305)。通过交联肿瘤细胞和效应细胞,双抗体不仅将效应细胞带到肿瘤细胞附近,而且导致有效的肿瘤杀伤(参见例如,cao等(2003)“bispecific antibody conjugates in therapeutics,”adv.drug.deliv.rev.55:171
‑
197)。
29.这种非单特异性双抗体的形成需要成功组装两个或更多个独特的且不同的多肽(即,这种形成需要通过不同多肽链种类的异源二聚化来形成双抗体)。该事实与单特异性双抗体相反,单特异性双抗体是通过相同多肽链的同源二聚化形成。因为必须提供至少两个不同的多肽(即,两个多肽种类)以形成非单特异性双抗体,并且因为这类多肽的同源二聚化导致分子失活(takemura,s.等(2000)“construction of a diabody(small recombinant bispecific antibody)using a refolding system,”protein eng.13(8):583
‑
588),这类多肽的生产必须以防止相同种类的多肽之间共价结合的这类方式完成(即,以防止同源二聚化)(takemura,s.等(2000)“construction of a diabody(small recombinant bispecific antibody)using a refolding system,”protein eng.13(8):583
‑
588)。因此,现有技术已教导这类多肽的非共价缔合(参见,例如,olafsen等(2004)“covalent disulfide
‑
linked anti
‑
cea diabody allows site
‑
specific conjugation and radiolabeling for tumor targeting applications,”prot.engr.des.sel.17:21
‑
27;asano等(2004)“a diabody for cancer immunotherapy and its functional enhancement by fusion of human fc domain,”摘要3p
‑
683,j.biochem.76(8):992;takemura,s.等(2000)“construction of a diabody(small recombinant bispecific antibody)using a refolding system,”protein eng.13(8):583
‑
588;lu,d.等(2005)“a fully human recombinant igg
‑
like bispecific antibody to both the epidermal growth factor receptor and the insulin
‑
like growth factor receptor for enhanced antitumor activity,”j.biol.chem.280(20):19665
‑
19672)。
30.由非共价缔合的多肽组成的双特异性双抗体是不稳定的并且容易解离成非功能性单体(参见,例如,lu,d.等(2005)“a fully human recombinant igg
‑
like bispecific antibody to both the epidermal growth factor receptor and the insulin
‑
like growth factor receptor for enhanced antitumor activity,”j.biol.chem.280(20):19665
‑
19672)。已经描述了稳定的、共价结合的异源二聚化非单特异性双抗体(参见,例如wo 2006/113665、wo/2008/157379、wo 2010/080538、wo 2012/018687、wo/2012/162068;johnson,s.等(2010)“effector cell recruitment with novel fv
‑
based dual
‑
affinity re
‑
targeting protein leads to potent tumor cytolysis and in vivo b
‑
cell depletion,”j.molec.biol.399(3):436
‑
449;veri,m.c.等(2010)“therapeutic control of b cell activation via recruitment of fcgamma receptor iib(cd32b)inhibitory function with a novel bispecific antibody scaffold,”arthritis rheum.62(7):1933
‑
1943;moore,p.a.等(2011)“application of dual affinity retargeting molecules to achieve optimal redirected t
‑
cell killing of b
‑
cell lymphoma,”blood 117(17):4542
‑
4551)。这类双抗体将一个或多个半胱氨酸残基并入到每种采用的多肽种类中。例如,已经显示,半胱氨酸残基添加至这种构建体的c
‑
端以允许多肽链之间的二硫键结合,从而稳定化所得的异源二聚体且不干扰二价分子的结合特征。
31.已经描述了靶向cd123和cd3的双特异性双抗体能够介导表达cd123的恶性细胞的t细胞重定向细胞杀伤(参见,例如,wo 2015/026892)。尽管这样的成功,尚未满足的需求仍需要开发施用cd123 x cd3双特异性双抗体来治疗血液系统恶性肿瘤的给药方案,特别是最小化不良副作用(包括例如细胞因子释放综合征(“crs”))和刺激免疫系统的给药方案。如以下所述,本发明直接解决了这种需求和其他需求。
技术实现要素:
32.本发明涉及向具有如急性髓细胞白血病(aml)或脊髓发育不良综合征(mds)的血液系统恶性肿瘤的患者施用cd123 x cd3双特异性双抗体的给药方案。本发明还涉及向具有如急性髓细胞白血病(aml)或脊髓发育不良综合征(mds)的血液系统恶性肿瘤的患者施用cd123 x cd3双特异性双抗体与能够结合pd
‑
1或pd
‑
1的天然配体的分子(“pd
‑
1或pd
‑
1配体结合分子”)的组合的给药方案。本发明特别地关注这种方案用于能够同时结合至cd123和cd3的序列优化的cd123 x cd33双特异性双抗体“dart
‑
a”的用途。
33.详细地,本发明提供治疗血液系统恶性肿瘤的方法,其包括向需要其的受试者施用cd123 x cd3结合分子,其中:
34.(i)cd123 x cd3结合分子是包含具有seq id no:21的氨基酸序列的第一多肽链和具有seq id no:23的氨基酸序列的第二多肽链的双抗体;以及
35.(ii)方法包括初始7天治疗时期(i7dp),其中:
36.(a)在i7dp的第1天,通过持续静脉内输注以约30ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
37.(b)在i7dp的第2天,通过持续静脉内输注以约60ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
38.(c)在i7dp的第3天,通过持续输注以约100ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
39.(d)在i7dp的第4天,通过持续静脉内输注以约200ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
40.(e)在i7dp的第5天,通过持续静脉内输注以约300ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
41.(f)在i7dp的第6天,通过持续静脉内输注以约300ng/kg/天至约400ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;以及
42.(g)在i7dp的第7天,通过持续静脉内输注以约300ng/kg/天至约500ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
43.本发明另外涉及用于受试者的血液系统恶性肿瘤的治疗的用途的cd123 x cd3结合分子,其中:
44.(i)cd123 x cd3结合分子是包含具有seq id no:21的氨基酸序列的第一多肽链和具有seq id no:23的氨基酸序列的第二多肽链的双抗体;以及
45.(ii)用途包括初始7天治疗时期(i7dp),其中:
46.(a)在i7dp的第1天,通过持续静脉内输注以约30ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
47.(b)在i7dp的第2天,通过持续静脉内输注以约60ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
48.(c)在i7dp的第3天,通过持续输注以约100ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
49.(d)在i7dp的第4天,通过持续静脉内输注以约200ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
50.(e)在i7dp的第5天,通过持续静脉内输注以约300ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;
51.(f)在i7dp的第6天,通过持续静脉内输注以约300ng/kg/天至约400ng/kg/天的剂量向受试者施用cd123 x cd3结合分子;以及
52.(g)在i7dp的第7天,通过持续静脉内输注以约300ng/kg/天至约500ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
53.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中该方法或用途包括一个或多个另外的7天治疗时期(a7dp),其中在一个或多个a7dp中的每个a7dp的第1
‑
7天,通过持续静脉内输注以约300ng/kg/天至约500ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
54.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中在i7dp的第6天和第7天,以约300ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
55.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中在一个或多个a7dp中的至少一个a7dp的第1
‑
7天,以约300ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
56.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中在i7dp的第6天和第7天,以约400ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
57.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中在一个或多个a7dp中的至少一个a7dp的第1
‑
7天,以约400ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
58.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中在i7dp的第6天,以约400ng/kg/天的剂量向受试者施用cd123 x cd3结合分子,并且在i7dp的第7天,以约500ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
59.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中在一个或多个a7dp中的至少一个a7dp的第1
‑
7天,以约500ng/kg/天的剂量向受试者施用cd123 x cd3结合分子。
60.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其包括三个a7dp。
61.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其包括另外的四个、八个、十二个、十六个或二十个a7dp。
62.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中一个或多个a7dp中的至少一个a7dp随后是一个或多个进一步的7天治疗时期(f7dp),其中在一个或多个f7dp中的每个f7dp的第1
‑
4天,向受试者施用cd123 x cd3结合分子,并且在一个或多个f7dp中的每个f7dp的第5
‑
7天,受试者不被提供cd123 x cd3结合分子。
或pd
‑
1的天然配体的结合分子包括pd
‑
1 mab 1的vh结构域和vl结构域。
84.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中能够结合pd
‑
1或pd
‑
1的天然配体的结合分子是pd
‑
1 mab 1igg4。
85.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中以约1 mg/kg至约3mg/kg的剂量施用能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
86.本发明另外涉及所有这类以上所示的方法和用途的实施方式,进一步包括在施用最后剂量的所述cd123 x cd3结合分子之后,施用一种或多种剂量的所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
87.本发明另外涉及所有这类以上所示的方法和用途的实施方式,进一步包括在施用cd123 x cd3结合分子之前、期间和/或之后,通过静脉内输注施用皮质类固醇和/或抗il
‑
6或抗il
‑
6r抗体。特别地,其中皮质类固醇选自由地塞米松(dexamethasone)、甲基泼尼松龙(methylprednisolone)和氢化可的松(hydrocortisone)组成的组。
88.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中预防地施用地塞米松。特别地,其中在施用cd123 x cd3结合分子之前,以约10mg至20mg的剂量施用地塞米松。
89.本发明另外涉及所有这类以上所示的方法和用途的实施方式,进一步包括在施用cd123 x cd3结合分子期间和/或之后,以约4mg的剂量施用地塞米松。
90.本发明另外涉及所有这类以上所示的方法和用途的实施方式,进一步包括在施用cd123 x cd3结合分子之后,施用抗il
‑
6或抗il
‑
6r抗体。特别地,其中抗il
‑
6或抗il
‑
6r抗体是托珠单抗(tocilizumab)或西妥昔单抗(siltuximab),并且更特别地,其中抗il
‑
6r抗体是以约4mg/kg至约8mg/kg的剂量施用的托珠单抗。
91.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中血液系统恶性肿瘤选自以下组成的组:急性髓细胞白血病(aml)、包括cml的原始细胞危象和与cml相关的阿贝尔森(abelson)致癌基因(bcr
‑
abl易位)的慢性髓细胞性白血病(cml)、脊髓发育不良综合征(mds)、急性b淋巴细胞白血病(b
‑
all)、急性t淋巴细胞白血病(t
‑
all)、包括cll的里克特综合征(richter's syndrome)或里克特转化(richter's transformation)的慢性淋巴细胞性白血病(cll)、多毛细胞白血病(hcl)、母细胞性浆细胞样树突状细胞肿瘤(bpdcn)、包括套细胞淋巴瘤(mcl)和小淋巴细胞淋巴瘤(sll)的非霍奇金淋巴瘤(nhl)、霍奇金淋巴瘤(hodgkin's lymphoma)、系统性肥大细胞增生症和伯基特淋巴瘤(burkitt's lymphoma)。
92.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中血液系统恶性肿瘤是急性髓细胞白血病。
93.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中血液系统肿瘤是脊髓发育不良综合征。
94.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中血液系统肿瘤是急性t淋巴细胞白血病。
95.本发明另外涉及所有这类以上所示的方法和用途的实施方式,其中受试者是人。
附图说明
96.图1显示如dart
‑
a的两链cd123 x cd3双特异性双抗体的第一和第二多肽链的整体结构。
97.图2a
‑
2d示出本发明的cd123 x cd3分子对aml患者的pmbc的活性。原代pbmc(包含82%母细胞)用dart
‑
a、fitc x cd3对照分子或磷酸盐缓冲盐水(pbs)处理144小时。在研究的开始,如pbmc中母细胞和t细胞的百分比确定的,e:t细胞比为近似1:300。图2a:白血病母细胞(cd45 /cd33 )的绝对数;图2b:t细胞(cd4 和cd8 )的绝对数;图2c:t
‑
细胞激活(cd25表达);图2d:在培养上清液中测量的细胞因子。
98.图3a
‑
3c示出来自aml患者的pbmc和母细胞的分析。图3a示出在用5、50或500pg/ml dart
‑
a孵育48小时之后的ifn
‑
γ释放。图3b示出在用5、50或500pg/ml dart
‑
a孵育48小时之后cd4
和cd8
t细胞的细胞表面上的pd
‑
1上调。图3c示出在用dart
‑
a孵育48小时之后aml母细胞的表面上的pd
‑
l1上调。
99.图4a
‑
4d分别示出在用具有或不具有抗pd
‑
1 mab(pd
‑
1 mab 1igg4;10μg/ml)的dart
‑
a(8.23、24.69、74.07、222.22、666.67或2000pg/ml)或同种型对照抗体孵育之后,从代表性aml
‑
pmbc样本获得的cd4
t细胞(图4a和图4b)或cd8
t细胞(图4c和图4d)上的pd
‑
1的细胞表面表达和阳性百分比。
100.图5a
‑
5d示出在用具有或不具有抗pd
‑
1 mab(pd
‑
1 mab 1igg4;10μg/ml)的dart
‑
a(8.23、24.69、74.07、222.22、666.67或2000pg/ml)或同种型对照抗体孵育48小时或72小时之后,来自aml
‑
pbmc的代表性样本的gm
‑
csf(图5a)、ifn
‑
γ(图5b)、il
‑
2(图5c)和tnf
‑
α(图5d)的体外释放。
101.图6示出在用具有或不具有抗pd
‑
1 mab(pd
‑
1 mab 1igg4;10μg/ml)的dart
‑
a(8.23、24.69、74.07、222.22、666.67或2000pg/ml)体外处理72小时之后,从aml
‑
pbmc获得的非t细胞杀伤的增强。
102.图7示出使用一步骤(lid
‑
1模式(schema))或两步骤(lid
‑
2模式)导入给药策略施用dart
‑
a的参与者在第一个四周期间表现出的crs等级的概况。
103.图8示出以≥500ng/kg/天治疗的接受至少一个治疗周期并且具有治疗后骨髓活检的14名患者的抗白血病活性(cr,完全响应(complete response);crm,分子cr;cri,具有不完全血液学改善的完全响应;mlf,无形态学白血病状态;pr,部分响应(partial response);sd/ob,稳定疾病/其他抗白血病益处;pd,进行性疾病)。
104.图9示出使用持续剂量方案以500ng/kg/天的目标剂量lid
‑
2治疗的34名可评估响应的患者的抗白血病活性(表7)(cr,完全响应;cri,具有不完全血液学改善的完全响应;mlf=无形态学白血病状态;pr,部分响应;sd,稳定疾病;pd,进行性疾病)。
105.图10显示按等级的crs事件的中值(median)持续时间。crs等级1事件:1天;crs等级2事件:2天;crs等级3事件:2.5天。
106.图11示出使用两步骤导入剂量(即,30ng/kg/天进行3天,随后100ng/kg/天进行4天)的前两周以及另外的7天治疗时期(a7dp)的第一周,每位患者的crs事件数目减少,在此期间剂量维持在500ng/kg/天的目标剂量。在治疗的前八周内,绘制了随时间每位患者的crs事件数目(左轴)和治疗的患者数目(右轴)。
107.图12a
‑
12b示出使用不同的导入给药策略由施用dart
‑
a的参与者展现出的crs等
级的概况。图12a绘制使用多步骤lid
‑
3模式(i7dp,目标剂量500ng/kg/天)随后三周以目标剂量持续给药(a7dp 1
‑
a7dp 3)施用dart
‑
a的8名研究参与者展现出的平均irr/crs等级。图12b还绘制使用多步骤、一步骤(lid
‑
1模式)和两步骤(lid
‑
2模式)导入给药策略展现出的平均irr/crs等级。
108.图13a
‑
13b绘制使用不同导入剂量策略在周期1期间施用的dart
‑
a的平均剂量强度(实线)。图13a绘制使用两步骤lid
‑
2模式向30名患者施用的dart
‑
a的平均剂量强度。图13b绘制使用多步骤lid
‑
3模式向30名患者施用的dart
‑
a的平均剂量强度,并且示出达到平均80.6%的500ng/kg/天的所需峰值剂量强度。每个步骤的目标最大剂量强度由虚线表示。
具体实施方式
109.本发明涉及向具有如急性髓细胞白血病(aml)或脊髓发育不良综合征(mds)的血液系统恶性肿瘤的患者施用cd123 x cd3双特异性双抗体的给药方案。本发明还涉及向具有如急性髓细胞白血病(aml)或脊髓发育不良综合征(mds)的血液系统恶性肿瘤的患者施用cd123 x cd3双特异性双抗体与能够结合pd
‑
1或pd
‑
1的天然配体的分子(“pd
‑
1或pd
‑
1配体结合分子”)的组合的给药方案。本发明特别地关注这种方案用于能够同时结合至cd123和cd3的序列优化的cd123 x cd3双特异性双抗体“dart
‑
a”的用途。
110.i.dart
‑
a的多肽链
111.dart
‑
a是能够同时地和特异性结合cd123的表位和cd3的表位的序列优化的双特异性双抗体(“cd123 x cd3”双特异性双抗体)(us美国专利公开号us 2016
‑
0200827,在pct公开wo 2015/026892中,在al
‑
hussaini,m.等(2016)“targeting cd123 in acute myeloid leukemia using a t
‑
cell
‑
directed dual
‑
affinity retargeting platform”,blood 127:122
‑
131中;在vey,n.等(2017)“a phase 1,first
‑
in
‑
human study of mgd006/s80880(cd123 x cd3)in aml/mds,”2017asco年会,6月2
‑
6日,2017,芝加哥,il:摘要tps7070中,其每个文件通过引用其整体并入本文)。发现dart
‑
a相对于类似组成的其他非序列优化的cd123 x cd3双特异性双抗体展现出增强的功能活性,因此被称为“序列优化的”cd123 x cd3双特异性双抗体。
112.dart
‑
a包括第一多肽链和第二多肽链。双特异性双抗体的第一多肽链在n
‑
端至c
‑
端方向上将包括n
‑
端、能够结合cd3的单克隆抗体的轻链可变结构域(vl结构域)(vl
cd3
)、间插连接体肽(连接体1)、能够结合cd123的单克隆抗体的重链可变结构域(vh结构域)(vh
cd123
)以及c
‑
端,并且具有图1中提供的一般结构。对于这种vl
cd3
结构域优选的序列是seq id no:1:
[0113][0114]
vl
cd3
的抗原结合结构域包括:
[0115]
cdr1(seq id no:2):rsstgavttsnyan;
[0116]
cdr2(seq id no:3):gtnkrap;以及
[0117]
cdr3(seq id no:4):alwysnlwv。
[0118]
对于这种连接体1优选的序列是seq id no:5:gggsgggg。对于这种vh
cd123
结构域优
选的序列是seq id no:6:
[0119][0120]
vh
cd123
的抗原结合结构包括:
[0121]
cdr1(seq id no:7):dyymk;
[0122]
cdr2(seq id no:8):diipsngatfynqkfkg;以及
[0123]
cdr3(seq id no:9):shllraswfay。
[0124]
第二多肽链在n
‑
端至c
‑
端方向上将包括n
‑
端、能够结合cd123的单克隆抗体的vl结构域(vl
cd123
)、间插连接体肽(例如,连接体1)、能够结合cd3的单克隆抗体的vh结构域(vh
cd3
)以及c
‑
端。对于这种vl
cd123
结构域优选的序列是seq id no:10:
[0125][0126]
vl
cd123
的抗原结合结构域包括:
[0127]
cdr1(seq id no:11):kssqsllnsgnqknylt;
[0128]
cdr2(seq id no:12):wastres;以及
[0129]
cdr3(seq id no:13):qndysypyt。
[0130]
对于这种vh
cd3
结构域优选的序列是seq id no:14:
[0131][0132]
vh
cd3
的抗原结合结构包括:
[0133]
cdr1(seq id no:15):tyamn;
[0134]
cdr2(seq id no:16):rirskynnyatyyadsvkd;以及
[0135]
cdr3(seq id no:17):hgnfgnsyvswfay。
[0136]
工程化本发明的序列优化的cd123 x cd3双特异性双抗体,以便这种第一和第二多肽沿着它们的长度通过半胱氨酸残基彼此共价结合。这种半胱氨酸残基可以被引入到使多肽的vl和vh结构域隔开的间插连接体(例如,连接体1)中。可替选地并且更优选地,第二肽(连接体2)被引入到每条多肽链中,例如,在这种多肽链的n
‑
端至vl结构域或c
‑
端至vh结构域的位置。对于这种连接体2优选的序列是seq id no:18:ggcggg。
[0137]
异源二聚体的形成可通过进一步工程化这种多肽链以包含相反电荷的多肽螺旋驱动。因此,在优选的实施方式中,多肽链之一将被工程化以包含“e
‑
螺旋”结构域(seq id no:19:),其残基将在ph 7形成负电荷,而两个多肽链中的另一条将被工程化以包含“k
‑
螺旋”结构域(seq id no:20:),其残基将在ph 7形成正电荷。这种带电的结构域的存在促使第一多肽和第二多肽之间的缔合,从而促进异源二聚化。
[0138]
向第一或第二多肽链提供哪种螺旋是不重要的。然而,本发明的优选的序列优化的cd123 x cd3双特异性双抗体(“dart
‑
a”)具有第一多肽链,其具有序列(seq id no:21):
[0139][0140]
dart
‑
a链1包含:seq id no:1
─
seq id no:5
─
seq id no:6
─
seq id no:18
─
seq id no:19。编码dart
‑
a链1的多核苷酸是seq id no:22:
[0141][0142][0143]
dart
‑
a的第二多肽链具有序列(seq id no:23):
[0144][0145]
dart
‑
a链2包含:seq id no:10
─
seq id no:5
─
seq id no:14
─
seq id no:18
─
seq id no:20。编码dart
‑
a链2的多核苷酸是seq id no:24:
[0146][0147][0148]
ii.dart
‑
a的特性
[0149]
如通过人和食蟹猴细胞所测试的,发现dart
‑
a具有同时结合cd123和cd3的能力。发现提供dart
‑
a会引起t细胞激活、介导母细胞减少、驱动t细胞扩增、诱导t细胞激活以及引起靶癌细胞的重定向杀伤(表1)。
[0150][0151]
更特别地,在具有高cd123表达(kasumi
‑
3(ec50=0.01ng/ml))和中cd123表达(molm13(ec50=0.18ng/ml)和thp
‑
1(ec50=0.24ng/ml))和中低或低cd123表达(tf
‑
1(ec50=0.46ng/ml)和rs4
‑
11(ec50=0.5ng/ml))的靶细胞系中,无论cd3表位结合特异性如何,dart
‑
a被发现在亚
‑
ng/ml范围中以实现50%的最大活性(ec50)所需的浓度展现出强大的重定向杀伤能力。类似地,在具有来自不同供体的t细胞的多个靶细胞系中也观察到了dart
‑
a的重定向杀伤,并且在不表达cd123的细胞系中没有观察到重定向杀伤活性。结果汇总在表2中。
[0152]
[0153][0154]
此外,当将人t细胞和肿瘤细胞(molm13或rs4
‑
11)组合并且皮下注入到nod/scidγ(nsg)敲除的小鼠中,molm13肿瘤在0.16、0.5、0.2、0.1、0.02和0.004mg/kg剂量水平被显著地抑制。在molm13模型中,0.004mg/kg和更高的剂量是有效的(active)。与rs4
‑
11模型相比,molm13模型中与抑制肿瘤生长相关的较低dart
‑
a剂量与体外数据一致,其表明molm13细胞比rs4
‑
11细胞具有更高水平的cd123表达,其与molm13细胞中对在体外dart
‑
a介导的细胞毒性增加的敏感性相关。
[0155]
发现dart
‑
a对来自aml患者的原发性aml标本(骨髓单核细胞(bmnc)和外周血单核细胞(pbmc))有活性。用dart
‑
a孵育原发性aml骨髓样本导致白血病细胞群体随时间耗竭,伴随着残余t细胞(cd4和cd8两者)的相伴扩增以及t细胞激活标志物(cd25和ki
‑
67)的诱导。在cd8和cd4 t细胞两者中均观察到颗粒酶b和穿孔素水平的上调。与未处理对照或对照dart相比,用dart
‑
a孵育原发性aml骨髓样本导致白血病细胞群体随时间的耗竭。当计数t细胞(cd8和cd4染色)和测定激活(cd25染色)时,与未处理或对照dart样本相比,dart
‑
a样品中的t细胞扩增并被激活。还发现dart
‑
a能够介导人和食蟹猴pbmc两者中pdcs细胞的耗竭,食蟹猴pdcs用仅仅10ng/kg dart
‑
a早在输注后4天的时候耗竭。在dart
‑
a处理的动物中,观察到细胞因子干扰素
‑
γ、tnfα、il
‑
6、il
‑
5、il
‑
4和il
‑
2的水平未升高。这些数据表明,dart
‑
a介导的靶细胞杀伤是通过颗粒酶b和穿孔素途径介导的。
[0156]
对cd123阴性靶标(u937细胞)或对照dart没有观察到活性,表明观察到的t细胞激
活严格取决于靶细胞接合(engagement),并且dart
‑
a对cd3的单价接合不足以触发t细胞激活。
[0157]
总而言之,dart
‑
a是基于抗体的分子,其接合tcr的cd3ε亚基以针对表达cd123(在数种血液系统恶性肿瘤中上调的抗原)的细胞重定向t淋巴细胞。dart
‑
a以相似的亲和力结合人和食蟹猴的抗原,并且重定向来自两种物种的t细胞以杀伤cd123 细胞。用每周递增剂量的dart
‑
a一周输注4或7天的猴子,无论给药方案如何,在治疗起始后72小时示出循环的cd123 细胞耗竭,其在整个治疗的4周中持续。也发生循环t细胞的减少,但是在4天剂量方案在猴子中的随后输注之前恢复到基线,与dart
‑
a介导的调动(mobilization)一致。dart
‑
a施用增加了循环的pd1 ,但不增加tim
‑
3 t细胞;此外,对来自处理的猴子的t细胞的离体分析展现出未改变的重定向靶细胞裂解,表明没有衰竭。毒性仅限于dart
‑
a第一输注后细胞因子的最小瞬时释放,而不是在随后的施用之后、甚至在递增剂量时,并且在红细胞团(mass)中最小可逆的减少伴随着在cd123 骨髓祖细胞中的减少。
[0158]
iii.能够结合pd
‑
1或pd
‑
1的天然配体的示例性分子
[0159]
a.pd
‑
1结合分子
[0160]
对pd
‑
1具有免疫特异性的抗体和其他能够结合pd
‑
1的分子是已知的,并且可被采用或适应于用作根据本发明的能够结合pd
‑
1的分子(例如,多特异性结合分子(例如,双抗体、双特异性抗体、三价结合分子等)、抗体的抗原结合片段(例如scfv、fab、f(ab)2等)、scfv融合体等)(参见,例如在以下表3中给出的专利公开)。优选的能够结合pd
‑
1的分子将展现出结合人pd
‑
1(cd279)的连续或不连续(例如,构象的)部分(表位)的能力,并且还将优选地展现出结合一种或多种非人物种,特别是灵长类物种(尤其是如食蟹猴的灵长类物种)的pd
‑
1分子的能力。在某些实施方式中,能够结合pd
‑
1的分子将展现出拮抗pd
‑
1/pd
‑
l1相互作用的能力,例如通过阻断pd
‑
1和pd
‑
1的天然配体之间的结合。另外的所需抗体可通过分离使用pd
‑
1或其肽片段引发的分泌抗体的杂交瘤制备。代表性的人pd
‑
1多肽(ncbi序列np_005009.2;其包括20个氨基酸残基信号序列,以下划线显示)和268个氨基酸残基成熟蛋白)具有氨基酸序列(seq id no:25):
[0161][0162]
抗pd
‑
1抗体可使用具有以上提供的pd
‑
1氨基酸序列的所有或部分的蛋白作为免疫原而获得。可替选地,用于产生能够结合pd
‑
1的分子的抗
‑
pd
‑
1抗体可拥有以下描述的抗人pd
‑
1或表3中列举的抗pd
‑
1抗体的vl和/或vh结构域;并且更优选地拥有这种抗pd
‑
1抗体的vl结构域的cdr
l
中的1个、2个或全部3个和/或vh结构域的cdr
h
中的1个、2个或全部3个。
[0163]
一个这种示例性人源化抗pd
‑
1抗体在本文被命名为“pd
‑
1 mab 1”。以下显示pd
‑
1 mab 1的vh结构域的氨基酸序列(seq id no:26)(cdr
h
残基以下划线显示):
[0164][0165]
以下显示pd
‑
1 mab 1的vl结构域的氨基酸序列(seq id no:27)(cdr
h
残基以下划线显示):
[0166][0167]
用于产生能够结合pd
‑
1的分子的可替选的抗pd
‑
1抗体和pd
‑
1结合分子拥有抗人pd
‑
1抗体尼鲁单抗(cas登记号:946414
‑
94
‑
4,也称为5c4、bms
‑
936558、ono
‑
4538、mdx
‑
1106并且通过bristol
‑
myers squibb以销售);派姆单抗(以前称为兰博单抗(lambrolizumab)),cas登记号:1374853
‑
91
‑
4,也称为mk
‑
3475、sch
‑
900475并且通过merck以销售);西米单抗(cemiplimab)(cas登记号:1801342
‑
60
‑
8,也称为regn
‑
2810、sar
‑
439684并且以销售),eh12.2h7(dana farber)或表3中的任一抗pd
‑
1抗体的vl和/或vh结构域;并且更优选地拥有这类抗pd
‑
1抗体的vl结构域的cdr
l
中的1个、2个或全部3个和/或vh结构域的cdr
h
中的1个、2个或全部3个。尼鲁单抗(who药物信息,2013,推荐的inn:列表69,27(1):68
‑
69)、派姆单抗(who药物信息,2014,推荐的inn:列表75,28(3):407)和西米单抗(who药物信息,2018,建议的inn:列表119)的完整重链和轻链的氨基酸序列在本领域是已知的。最近已经鉴定了用于本发明的方法和组合物的拥有独特的结合特征的另外的抗pd
‑
1抗体(参见,pct公开号wo 2017/019846和表3)。
[0168][0169]
[0170]
[0171]
[0172]
[0173]
[0174][0175]
b.pd
‑
1配体结合分子
[0176]
对pd
‑
1的天然配体(例如,b7
‑
h1(pd
‑
l1,cd274),b7
‑
dc(pd
‑
l2,cd273))具有免疫特异性的抗体和能够结合pd
‑
1的天然配体的分子是已知的并且可以被采用或适于用作根据本发明的能够结合pd
‑
1的天然配体的分子(例如,多特异性结合分子(例如,双抗体、双特
异性抗体、三价结合分子等))、抗体的抗原结合片段(例如,scfv、fab、f(ab)2等、scfv
‑
fc融合体等)(参见例如下表4中列出的专利出版物)。能够结合pd
‑
1的天然配体的优选的分子将展示出结合人b7
‑
h1和/或b7
‑
dc的连续或不连续(例如,构象的)部分(表位)的能力并且将优选地还展现出结合一个或多个非人物种,特别是灵长类物种(尤其是如食蟹猴的灵长类物种)的b7
‑
h1和/或b7
‑
dc分子的能力。在某些实施方式中,能够结合pd
‑
1的天然配体的分子将展现出拮抗pd
‑
1/pd
‑
l1相互作用的能力,例如通过阻断pd
‑
1和pd
‑
1的天然配体之间的结合。另外的所需抗体可通过分离使用b7
‑
h1、b7
‑
dc或其肽片段引发的分泌抗体的杂交瘤制备。
[0177]
代表性的人b7
‑
h1(pd
‑
l1)多肽(ncbi序列np_001254635.1;其包括预测的18氨基酸信号序列)具有氨基酸序列(seq id no:28):
[0178][0179]
代表性的人b7
‑
dc(pd
‑
l2)多肽(ncbi序列np_079515.2;其包括预测的18氨基酸信号序列)具有氨基酸序列(seq id no:29):
[0180][0181][0182]
具体地,抗b7
‑
h1抗体可使用具有以上提供的b7
‑
h1氨基酸序列的部分或全部的蛋白作为免疫原而获得。可替选地,用于产生能够结合b7
‑
h1的分子的抗b7
‑
h1抗体可拥有以下描述的抗人b7
‑
h1或表4中列举的抗b7
‑
h1抗体的vl和/或vh结构域;并且更优选地拥有这种抗b7
‑
h1抗体的vl结构域的cdr
l
中的1个、2个或全部3个和/或vh结构域的cdr
h
中的1个、2个或全部3个。
[0183]
用于产生能够结合pd
‑
1的天然配体的分子的示例性抗b7
‑
h1抗体可拥有抗人b7
‑
h1抗体阿特珠单抗(cas登记号1380723
‑
44
‑
3,也称为mpdl3280a并且作为
销售)、度伐单抗(cas登记号1428935
‑
60
‑
7,也称为medi
‑
4736并且作为销售)、阿维鲁单抗、mdx1105(cas登记号1537032
‑
82
‑
8,也称为bms
‑
936559,5h1并且作为销售)或表4中列举的任何抗b7
‑
h1抗体和结合分子的vl和/或vh结构域;并且更优选地拥有这种抗b7
‑
h1抗体的vl结构域的cdr
l
中的1个、2个或全部3个和/或vh结构域的cdr
h
中的1个、2个或全部3个。阿特珠单抗(who药物信息,2015,推荐的inn:列表74,29(3):387)、度伐单抗(who药物信息,2015,推荐的inn:列表74,29(3):393
‑
394)和阿维鲁单抗(who药物信息,2016,推荐的inn:列表74,30(1):100
‑
101)的完整重链和轻链的氨基酸序列在本领域是已知的。
[0184]
[0185]
[0186]
[0187]
[0188][0189]
c.示例性igg4抗体
[0190]
在某些实施方式中,用于本发明的方法和组合物的抗体(尤其是抗pd
‑
1抗体和抗b7
‑
h1抗体)包括igg4恒定区。示例性igg4抗体包括以上描述的任何抗pd
‑
1抗体或抗b7
‑
h1抗体的vl和vh结构域、igg clκ结构域和igg4 ch1、ch2和ch3结构域。
[0191]
示例性cl结构域是igg clκ结构域。示例性人clκ结构域的氨基酸序列是(seq id no:30):
[0192][0193]
示例性ch1结构域是人igg4 ch1结构域,任选地缺乏c
‑
端赖氨酸残基。示例性人igg4 ch1结构域的氨基酸序列是(seq id no:31):
[0194][0195]
这类抗体将优选地包括igg4 ch1结构域(seq id no:31)和(seq id no:32),其是包括稳定的s228p取代(按照kabat中规定的eu索引进行编号)以减少链交换的igg4铰链变体。
[0196]
示例性人igg4的ch2
‑
ch3结构域的氨基酸序列是(seq id no:33):
[0197][0198]
按照kabat中规定的eu索引进行编号,其中x是赖氨酸(k)或不存在。
[0199]
命名“pd
‑
1 mab 1 igg4”的示例性抗pd
‑
1单克隆抗体是人源化的抗人pd
‑
1抗体。如上所述,pd
‑
1 mab 1包括pd
‑
1 mab 1的vh和vl结构域。
[0200]
pd
‑
1 mab1 igg4的完整重链的氨基酸序列是seq id no:34(cdr
h
残基和s228p残基以下划线显示):
[0201][0202][0203]
在seq id no:34中,残基1
‑
119对应于pd
‑
1 mab 1的vh结构域(seq id no:26),氨基酸残基120
‑
217对应于人igg4 ch1结构域(seq id no:31),氨基酸残基218
‑
229对应于包括s228p取代的人igg4铰链结构域(seq id no:32),氨基酸残基230
‑
245对应于人igg4 ch2
‑
ch3结构域(seq id no:33,其中x不存在)。
[0204]
抗体pd
‑
1 mab 1igg4的完整轻链的氨基酸序列拥有κ恒定区并且是(seq id no:35)(cdr
l
残基以下划线显示):
[0205][0206]
在seq id no:35中,氨基酸残基1
‑
111对应于pd
‑
1 mab 1的vl结构域(seq id no:27),并且氨基酸残基112
‑
218对应于轻链κ恒定区(seq id no:30)。
[0207]
其他具有igg4恒定区的示例性抗pd
‑
1抗体是尼鲁单抗,其是人抗体;以及派姆单抗,其是人源化抗体。每种包括如以上所述的κcl结构域、igg4ch1结构域、稳定的igg4铰链和igg4 ch2
‑
ch3结构域。
[0208]
iv.药物组合物
[0209]
本发明的组合物包括可用于制造组合物的原料药(bulk drug)组合物(例如,不纯的或非灭菌的组合物)和药物组合物(即,适合施用至受试者或患者的纯的和/或灭菌的组合物),两者中任一者可用于制备单位剂型。可用于本发明的方法中的组合物,尤其是药物组合物包括包含dart
‑
a的那些和包含能够结合pd
‑
1或pd
‑
1的天然配体的分子的那些。这类组合物或药物组合物可包含预防或治疗有效量的:dart
‑
a和药学上可接受的载体;pd
‑
1结合分子和药学上可接受的载体;或pd
‑
1配体结合分子和药学上可接受的载体。
[0210]
本发明还涵盖包含dart
‑
a和对特定的癌症抗原特异的第二治疗性抗体(例如,肿瘤特异性单克隆抗体)和药学上可接受的载体的药物组合物。
[0211]
在具体的实施方式中,术语“药学上可接受的”意味着获得联邦或州政府的监管机构的许可或列于美国药典(u.s.pharmacopeia)或其他通常获得认可的药典中,用于动物,更特别是用于人类。术语“载体”指与治疗剂一起施用的稀释剂、佐剂(例如,freund佐剂(完全的和不完全的)、赋形剂或媒介(vehicle)。这种药学上的载体可以为无菌液体如水或油,其包括石油、动物、植物或合成来源的那些油,如花生油、大豆油、矿物油、芝麻油等。当静脉内施用药物组合物静脉内施用时,水是优选的载体。生理盐水溶液和含水右旋糖以及甘油的溶液也可以用作液体载体,特别对于可注射溶液而言。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、脱脂乳粉、甘油、丙烯、乙二醇、水、乙醇等。如果需要,组合物还可以包含少量的润湿剂或乳化剂或ph缓冲剂。这些组合物可以采用溶液、悬液、乳液、片剂、丸剂、胶囊、粉末、缓释制剂等形式。
[0212]
通常,本发明的组合物的组分被单独提供或以单位剂型的形式混合在一起,例如,作为在指示活性剂的量的密封容器如小瓶、安瓿或袋(sachette)中的干燥冻干粉或无水浓
缩物。在通过输注施用组合物的情况下,组合物可以用含有无菌的药物级水或生理盐水的输注瓶或袋分配,以便可以在施用前混合或稀释组分。在通过注射施用组合物的情况下,可以提供注射用无菌水或生理盐水或其他稀释剂的安剖,以便可以在施用前混合组分。
[0213]
本发明也提供包括一个或多个容器的药物包(pack)或试剂盒,所述容器包含单独的dart
‑
a或dart
‑
a与这种药学上可接受的载体。另外,用于疾病的治疗的一种或多种其他预防性或治疗性试剂也可以包括在药物包或试剂盒中。本发明也提供包括一个或多个容器的药物包或试剂盒,所述容器填充有本发明的药物组合物的一种或多种组分。任选地与这类容器关联的可以是以由管理药物或生物制品的制造、使用或销售的政府机构规定的形式的告示(notice),所述告示反映了管理机构批准用于人类施用的制造、使用或销售。
[0214]
本发明提供包括dart
‑
a并且可用在以上方法中的试剂盒。在这种试剂盒中,dart
‑
a优选地被包装在指示分子的量的密封容器如小瓶、安瓿或袋中,并且任选地包括使用说明书。在一个实施方式中,这种试剂盒的dart
‑
a作为干燥无菌冻干粉或无水浓缩物提供在密封容器中,并可以例如用水、生理盐水或其他稀释剂重构(reconstitute)至适当的浓度以施用给受试者。冻干的材料应在其原始容器中在2℃至8℃之间储存,并且材料应在重构后的12小时内,优选地在6小时内、5小时内、3小时内或1小时内施用。在另一个实施方式中,这种试剂盒的dart
‑
a作为水溶液提供在密封容器中,并且可以例如用水、生理盐水或其他稀释剂稀释至合适的浓度以施用给受试者。试剂盒可进一步包括在一个或多个容器中的用于癌症治疗的一种或多种其他的预防性和/或治疗性试剂;和/或试剂盒可进一步包括结合一种或多种与癌症相关的癌症抗原的细胞毒性抗体。在某些实施方式中,其他预防性或治疗性试剂是化学治疗剂。在其他实施方式中,预防性或治疗性试剂是生物或激素治疗剂。在其他实施方式中,预防性或治疗性试剂是pd
‑
1结合分子。在其他实施方式中,预防性或治疗性试剂是pd
‑
1配体结合分子。
[0215]
v.本发明的组合物的用途
[0216]
dart
‑
a可用于治疗与cd123的表达相关的或由cd123的表达表征的任何疾病或病况。具体地,dart
‑
a可用于治疗血液系统恶性肿瘤。因此,在没有限制的情况下,这种分子可用于诊断或治疗血液系统恶性肿瘤:急性髓细胞白血病(aml)、包括cml的原始细胞危象和与cml相关的阿贝尔森致癌基因(bcr
‑
abl易位)的慢性髓细胞性白血病(cml)、脊髓发育不良综合征(mds)、急性b淋巴细胞白血病(b
‑
all)、急性t淋巴细胞白血病(t
‑
all)、包括cll的里克特综合征或里克特转化的慢性淋巴细胞性白血病(cll)、多毛细胞白血病(hcl)、母细胞性浆细胞样树突状细胞肿瘤(bpdcn)、包括套细胞淋巴瘤(mcl)和小淋巴细胞淋巴瘤(sll)的非霍奇金淋巴瘤(nhl)、霍奇金淋巴瘤、系统性肥大细胞增生症和伯基特淋巴瘤。dart
‑
a可另外用于制造用于以上所述的病况的治疗的药物中。
[0217]
在具体的实施方式中,本发明提供治疗aml、mds、bpdcn、b
‑
all和t
‑
all的方法。在一个具体的实施方式中,本发明提供治疗aml的方法。
[0218]
vi.施用方法
[0219]
如以上提供的,本发明的cd123 x cd3双特异性双抗体(例如,dart
‑
a)和包括其的本发明的药物组合物可用于治疗、预防和改善一种或多种与血液系统恶性肿瘤相关的症状。在一些实施方式中,cd123 x cd3双特异性双抗体(或包括其的药物组合物)可与一种或多种另外的治疗剂(例如,本领域技术人员已知的用于治疗或预防血液系统恶性肿瘤的治
疗剂,其包括但不限于当前的标准的和实验性化学治疗剂、激素剂、生物剂、免疫治疗剂或可用于减轻包括但不限于本文所述的那些治疗副作用的试剂)组合使用。在具体的实施方式中,cd123 x cd3双特异性双抗体(或包括其的药物组合物)可与能够结合pd
‑
1或pd
‑
1的天然配体的分子(或包括其的药物组合物)组合使用。
[0220]
如本文使用的,术语“组合(combination)”指使用大于一种的治疗剂。使用术语“组合”不限制向具有障碍的受试者施用治疗剂的顺序,也不意味着在恰好相同时间施用试剂,而是意味着按顺序且以一定时间间隔向人患者或其他哺乳动物施用本发明的cd123 x cd3双特异性双抗体和其他试剂,以便本发明的cd123 x cd3双特异性双抗体和其他试剂提供所需的治疗益处。例如,每种治疗剂(例如,如能够结合pd
‑
1的分子的化学治疗剂、激素剂或生物剂)可在相同时间或在不同时间点以任何顺序依次施用;然而,如果没有在相同时间施用,它们应该在时间上足够近地施用以提供所期望的治疗或预防效果。每种治疗剂可以任何合适的形式和任何合适的途径分开施用,例如,一种通过口服途径和一种通过肠胃外途径等。
[0221]
具体地,本发明提供治疗血液系统恶性肿瘤的方法,其包括向受试者施用有效量的本发明的cd123 x cd3双特异性双抗体(例如,dart
‑
a)或包括本发明的cd123 x cd3双特异性双抗体(例如,dart
‑
a)的药物组合物。本发明进一步提供治疗血液系统恶性肿瘤的方法,其包括向受试者施用有效量的本发明的cd123 x cd3双特异性双抗体(或包括其的药物组合物)与能够结合pd
‑
1或pd
‑
1的天然配体的分子(或包括其的药物组合物)的组合。在具体的方面,这种组合物基本上是纯化的(即,基本上不含限制其作用或产生不良副作用的物质)。在具体的实施方式中,受试者是动物,优选地如非灵长类物种(例如,牛科动物、马科动物、猫科动物、犬科动物、啮齿动物等)的哺乳动物或灵长类物种(例如,如食蟹猴的猴类、人等)。在具体的实施方式中,受试者是人。
[0222]
施用本发明的分子的方法包括但不限于肠胃外施用(例如,皮内、肌内、腹膜内、静脉内和皮下)。在具体的实施方式中,静脉内施用本发明的序列优化的cd123 x cd3双特异性双抗体(例如,dart
‑
a)。静脉内输注是优选的施用途径。具体地,本发明的cd123 x cd3双特异性双抗体通过使用泵介导的连续静脉内输注(“泵输注”)施用。这种连续输注可具有每天约1小时至约24小时的持续时间,但是优选地将具有每天约24小时的持续时间。术语“约”旨在表示为所述持续时间的
±
10%的范围,即使得约24小时的输注的持续时间将在21.6小时和26.4小时之间。在某些实施方式中,具有每天约24小时的持续时间的持续输注将持续约1天至约21天、或约1天至约14天、或约1天至约7天、或约1天至约4天、或约1天至约2天的时期。应当理解,连续施用可能需要暂停短时期(例如改变供应、调整剂量、补充药物供应、控制副作用等等)。具体地,本发明的cd123 x cd3双特异性双抗体的连续施用可被暂停以施用一种或多种另外的治疗剂(例如,能够结合pd
‑
1或pd
‑
1的天然配体的分子)。这种暂停是例行的并且通常不认为终止持续输注的时期。
[0223]
在具体的实施方式中,静脉内施用本发明的能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)。具体地,在约30分钟至约240分钟内间歇地施用且输注能够结合pd
‑
1或pd
‑
1的天然配体的分子。应当理解,这种输注可能需要暂停短时期(例如改变供应、调整剂量、补充药物供应、控制副作用等)。这种暂停是例行的并且通常不认为终止持续输注的时期。在某些实施方式中,本发明的cd123 x cd3双特异性双抗体的连续施用可被暂
停以施用本发明的能够结合pd
‑
1或pd
‑
1的天然配体的分子。
[0224]
可以通过标准临床技术确定在治疗、预防或改善与障碍相关的一种或多种症状中有效的本发明的组合物的量。制剂中采用的精确剂量还将取决于施用途径和病况的严重性,并且应根据医师的判断和每个患者的情况来确定。有效剂量可以从来源于体外或动物模型测试系统的剂量反应曲线中推断。这种剂量可以根据接受受试者的体重(kg)确定或可以是施用的扁平剂量(flat dosage)(即,独立于患者的体重的剂量,其包括待施用的分子的物理离散单元。在利用基于重量的剂量的情况下,将基于在基线处受试者的体重施用所计算的剂量。通常地,来自基线或建立的稳定期体重(plateau weight)的体重的显著变化(≥10%)将提示重新计算剂量。
[0225]
如上所述,dart
‑
a优选地通过具有每天约24小时的持续时间的连续输注施用。因此,剂量优选地基于每天待施用的dart
‑
a的量,例如,每天每千克体重dart
‑
a的纳克数(ng/kg/天)确定。如上所述,本发明的能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)任选地在少于几小时的时间段内间歇地施用。在某些实施方式中,每个剂量基于每千克体重能够结合pd
‑
1或pd
‑
1的天然配体的分子的量确定,例如,基于每千克体重pd
‑
1 m ab 1igg4的毫克数(mg/kg)确定。在其他实施方式中,施用扁平剂量,例如固定毫克数的pd
‑
1 mab 1igg,不考虑体重。关于剂量(dose)或剂量(dosage),术语“约”旨在表示所述剂量的
±
10%的范围,以便例如约30ng/kg/天的基于重量的剂量将为在27ng/kg/天和33ng/kg/天患者体重之间,并且约200mg的扁平剂量将为在180mg和220mg之间。
[0226]
在某些实施方式中,使用1周(7天)“时期”(“p”)施用dart
‑
a。如以下详细讨论的,施用包括初始7天治疗时期(“i7dp”),其随后为一个或多个另外的7天治疗时期(每个为“a7dp”;例如,a7dp 1、a7dp 2等)。治疗周期的最终a7dp可随后为一个或多个进一步的7天治疗时期(每个为“f7dp”;例如,f7dp 1、f7dp 2等)。
[0227]
术语“lid
‑
1模式”指包括一步骤导入给药(lead
‑
in dosing)的给药方案,其中在初始7天治疗时期期间,dart
‑
a以100ng/kg/天施用4天,然后暂停3天。术语“lid
‑
2模式”指包括两步骤导入给药的给药方案,其中在初始7天治疗时期期间,dart
‑
a以30ng/kg/天施用3天,然后以100ng/kg/天施用接下来4天。术语“lid
‑
3模式”指包括多步骤导入给药的给药方案,其中dart
‑
a使用多个递升(step
‑
up)剂量增量(多于两个的步骤)施用,每次持续约24小时直到达到目标剂量,此后,在最初7天治疗时期(i7dp)的剩余时间以目标剂量施用dart
‑
a。
[0228]
在一个实施方式中,在初始7天治疗时期(i7dp)期间,使用包含多个递升给药增量的导入给药策略施用dart
‑
a直到达到目标剂量。在一个实施方式中,起始剂量为约30ng/kg/天且目标剂量为在约300ng/kg/天至约500ng/kg/天之间。在一个实施方式中,目标剂量为约300ng/kg/day且在i7dp期间,通过连续静脉内输注施用dart
‑
a:在第1天以约30ng/kg/天的剂量;在第2天以约60ng/kg/天的剂量;在第3天以约100ng/kg/天的剂量;在第4天以约200ng/kg/天的剂量;并且在第5、6和7天以约300ng/kg/天的剂量。在另一个实施方式中,目标剂量为约400ng/kg/天且在i7dp期间,通过连续静脉内输注施用dart
‑
a:在第1天以约30ng/kg/天的剂量;在第2天以约60ng/kg/天的剂量;在第3天以约100ng/kg/天的剂量;在第4天以约200ng/kg/天的剂量;在第5天以约300ng/kg/天的剂量并且在第6和7天以约400ng/kg/天的剂量。在进一步实施方式中,目标剂量为约500ng/kg/天且在i7dp期间,通过
连续静脉内输注施用dart
‑
a:在第1天以约30ng/kg/天的剂量;在第2天以约60ng/kg/天的剂量;在第3天以约100ng/kg/天的剂量;在第4天以约200ng/kg/天的剂量;在第5天以约300ng/kg/天的剂量;在第6天以约400ng/kg/天的剂量;并且在第7天以约500ng/kg/天的剂量。本发明特别地涵盖治疗血液系统恶性肿瘤的方法,其包括一个根据任一以上实施方式的i7dp。
[0229]
在某些实施方式中,这种i7dp随后为一个或多个另外的7天治疗时期(每个为a7dp),其中dart
‑
a以目标剂量(即,约300ng/kg/天至约500ng/kg/天)通过连续静脉内输注施用7天。在一些实施方式中,施用一个至二十三个a7dp。优选地施用三个a7dp。在某些实施方式中,施用大于三个的a7dp,尤其是在施用三个a7dp后未观察到所期望的应答的情况下。在特定的实施方式中,施用四个、八个、十二个或十六个更多的a7dp(即,总共七个、十一个、十五个、十九个或二十三个a7dp)。在一个实施方式中,目标剂量为约300ng/kg/天并且施用至少三个a7dp。在另一个实施方式中,目标剂量为约400ng/kg/天并且施用至少三个a7dp。在进一步实施方式中,目标剂量为约500ng/kg/天并且施用至少三个a7dp。本发明特别地涵盖治疗血液系统恶性肿瘤的方法,其包括一个或多个根据任一以上实施方式的a7dp。
[0230]
在某些实施方式中,一个或多个a7dp中的最后一个随后为一个或多个进一步的7天治疗时期(每个为f7dp),其中根据4天施用(on)/3天停用(off)的方案(例如,dart
‑
a在f7dp的第1天、第2天、第3天和第4天提供,但是在这种f7dp的第5天、第6天和第7天不提供),通过持续静脉内输注以目标剂量施用dart
‑
a。具体地,这种f7dp可包括通过持续静脉内输注以目标剂量在第1
‑
4天施用dart
‑
a,且在第5
‑
7天不施用dart
‑
a。在一些实施方式中,施用一个至二十四个f7dp。优选地,施用一个、两个、三个、四个、五个、六个、七个或八个这种f7dp。在具体的实施方式中,施用一个至四个这种f7dp。在一个实施方式中,目标剂量为约300ng/kg/天且施用至少四个f7dp。在另一个实施方式中,目标剂量为约400ng/kg/天且施用至少四个f7dp。在进一步实施方式中,目标剂量为约500ng/kg/天且施用至少四个f7dp。本发明特别地涵盖治疗血液系统恶性肿瘤的方法,其包括一个或多个根据任一以上实施方式的f7dp。
[0231]
在某些实施方式中,dart
‑
a与能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)结合施用,其中能够结合pd
‑
1或pd
‑
1的天然配体的分子每两周一次(“q2w”)、每三周一次(“q3w”)或每四周一次(“q4w”)施用。在具体实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子以约1 mg/kg至约10mg/kg的基于重量的剂量或约200mg至约300mg的固定剂量q2w施用。在特定的实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子以约1 mg/kg至约3mg/kg的基于重量的剂量q2w施用。在其他具体的实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子以约200mg至约375mg的固定剂量q3w施用。在特定的实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子以约375mg的固定剂量q3w施用。在其他具体的实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子以约400mg至约500mg的固定剂量q4w施用。在特定的实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子以约500mg的固定剂量q4w施用。
[0232]
在某些实施方式中,q2w、q3w或q4w施用与以上所述的一个或多个7天治疗时期同时进行,其中施用dart
‑
a。因此,在某些实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子q2w、q3w或q4w施用,其中在以上提供的一个或多个7天治疗时期期间发生这种施用。在某些实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子在一个或多个a7dp期间和/或在一
个或多个f7dp期间施用。在具体的实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子在一个或多个a7dp的第1天和/或在一个或多个f7dp的第1天施用。在特定的实施方式中,在能够结合pd
‑
1或pd
‑
1的天然配体的分子的施用期间暂停dart
‑
a的施用。在某些实施方式中,当安排在同一天时,在dart
‑
a之前施用能够结合pd
‑
1或pd
‑
1的天然配体的分子。在某些实施方式中,在两个7天治疗时期后、优选地在第15天施用第一剂量的能够结合pd
‑
1或pd
‑
1的天然配体的分子并且其后q2w、q3w或q4w施用另外的剂量。在某些实施方式中,在施用最后剂量的dart
‑
a之后,继续q2w、q3w或q4w施用能够结合pd
‑
1或pd
‑
1的天然配体的分子。
[0233]
在某些实施方式中,治疗被划分为4周(28天)治疗周期。在一个实施方式中,第一治疗周期(“治疗周期1”)包括一个i7dp,然后三个a7dp以组成4周治疗周期1。在某些实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子也在这类治疗周期1期间施用。在一个实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)在这类治疗周期1的第15天(即,第二a7dp的第1天)以约1 mg/kg至约3mg/kg的剂量施用。
[0234]
在某些实施方式中,任选地施用至少一个第二治疗周期(每个“治疗周期2”)。在施用周期1后未观察到所期望的应答时,尤其优选地施用至少一个治疗周期2。在特定的实施方式中,每个治疗周期2包括四个a7dp以组成4周(28天)治疗周期2。任选地,治疗周期2可重复以基于连续7天方案以目标剂量提供dart
‑
a的另外施用。在某些实施方式中,在这类治疗周期2期间,也施用能够结合pd
‑
1或pd
‑
1的天然配体的分子。在一个实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab1igg4)在每个治疗周期2的第1天和第15天(即,在第一a7dp的第1天和在第三a7dp的第1天)以约1 mg/kg至约3mg/kg的基于重量的剂量施用。
[0235]
在某些实施方式中,施用至少一个第三治疗周期(每个“治疗周期3”)。在特定的实施方式中,治疗周期3包括四个f7dp以组成4周(28天)治疗周期3。在某些实施方式中,在治疗周期1之后施用至少一个治疗周期3。在其他实施方式中,在施用至少一个治疗周期2之后施用至少一个治疗周期3。任选地,治疗周期3可重复以基于4天施用/3天停用(off)的方案以目标剂量提供dart
‑
a的另外施用。在某些实施方式中,在这类治疗周期3期间,也施用能够结合pd
‑
1或pd
‑
1的天然配体的分子。在一个实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)在每个治疗周期3的第1天和第15天(即,在第一f7dp的第1天和在第三f7dp的第1天)以约1 mg/kg至约3mg/kg的剂量施用。
[0236]
在某些实施方式中,dart
‑
a根据治疗周期1施用,然后根据治疗周期2进一步施用,其中治疗周期2可重复,然后根据治疗周期3进一步施用,其中治疗周期3可重复。在其他实施方式中,不施用治疗周期2。因此,在这类实施方式中,dart
‑
a根据治疗周期1施用,然后根据治疗周期3进一步施用,其中治疗周期3可重复。本发明特别地涵盖治疗血液系统恶性肿瘤的方法,其包括根据任一以上实施方式的治疗周期1。本发明进一步涵盖治疗血液系统恶性肿瘤的方法,其包括根据任一以上实施方式的治疗周期1,随后至少一个根据任一以上实施方式的治疗周期2。本发明进一步涵盖治疗血液系统恶性肿瘤的方法,其包括根据任一以上实施方式的治疗周期1,随后至少一个根据任一以上实施方式的治疗周期2,随后至少一个根据任一以上实施方式的治疗周期3。在以下表10b中给出示例性lid
‑
3模式,其包括治疗周期1、治疗周期2和治疗周期3。本发明进一步涵盖治疗血液系统恶性肿瘤的方法,其包括根据任一以上实施方式的治疗周期1,随后至少一个根据任一以上实施方式的治疗周期3。
在以下表10a中给出示例性lid
‑
3模式,其包括治疗周期1和治疗周期3。
[0237]
在具体的实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)在这类治疗周期1的第15天(即,第二a7dp的第1天)施用。如以上提供的,另外剂量的能够结合pd
‑
1或pd
‑
1的天然配体的分子q2w、q3w或q4w施用。因此,这种另外的剂量在每个治疗周期2、每个治疗周期3期间施用,并且可以在施用dart
‑
a的最后剂量之后连续施用。在某些实施方式中,根据治疗周期1,dart
‑
a与能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)结合施用,然后根据治疗周期2进一步施用,其中治疗周期2可重复,然后根据治疗周期3进一步施用。以下表11b中给出dart
‑
a与pd
‑
1 mab 1igg4结合施用的示例性给药方案,其包括治疗周期1、治疗周期2和治疗周期3。在其他实施方式中,不施用治疗周期2。因此,在这类实施方式中,根据治疗周期1,dart
‑
a与能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)组合施用,然后根据治疗周期3进一步施用。在下表11a中给出dart
‑
a与pd
‑
1 mab 1igg4组合施用的示例性给药方案,其包括治疗周期1和治疗周期3。在某些实施方式中,治疗周期3随后q2w、q3w或q4w施用一个或多个另外剂量的能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)。在下表11a
‑
11b中给出dart
‑
a与pd
‑
1 mab 1igg4组合施用的示例性给药方案,其包括在治疗周期3后施用另外剂量的pd
‑
1 mab 1igg4(q2w)。
[0238]
在一个实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子包括:
[0239]
(a)派姆单抗的vh结构域和vl结构域;
[0240]
(b)尼鲁单抗的vh结构域和vl结构域;
[0241]
(c)西米单抗的vh结构域和vl结构域;
[0242]
(c)pd
‑
1 mab 1的vh结构域和vl结构域;
[0243]
(d)阿特珠单抗的vh结构域和vl结构域;
[0244]
(e)阿维鲁单抗的vh结构域和vl结构域;
[0245]
(f)度伐单抗的vh结构域和vl结构域;或
[0246]
(h)表3或表4中提供的抗体的vh结构域和vl结构域。
[0247]
在具体的实施方式中,能够结合pd
‑
1或pd
‑
1的天然配体的分子为pd
‑
1 mab 1igg4。在另一个具体的实施方式中,根据任一以上实施方式施用pd
‑
1 mab 1igg4。
[0248]
在任一以上任何实施方式中,当安排在同一天时,在施用dart
‑
a之前,可通过静脉内输注施用能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)。在任一以上实施方式中,在施用能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)的同时可暂停施用dart
‑
a。可替选地,在施用dart
‑
a的同时,通过静脉内输注施用能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,pd
‑
1 mab 1igg4)。这种施用可发生在不同位置(例如,dart
‑
a通过iv进入患者的左臂并且能够结合pd
‑
1或pd
‑
1的天然配体的分子通过iv进入患者的右臂),或在相同位置(例如,通过单一iv路线)。
[0249]
在某些实施方式中,在dart
‑
a施用之前、期间和/或之后,施用一种或多种另外的/可替选的试剂以控制可能发生的输注相关的反应(“irr”)和/或细胞因子释放综合征(“crs”)。在特定的实施方式中,在施用一种或多种另外的/可替选的试剂以控制irr和/或crs的同时,暂停施用dart
‑
a。在某些实施方式中,可以施用一种剂量或多种剂量的如地塞米松(或等效物)的类固醇以控制irr和/或crs。在某些实施方式中,可以施用一种剂量或多
种剂量的il
‑
6抑制剂、il
‑
6r抑制剂、tnfα抑制剂和/或il
‑
1r抑制剂以控制irr和/或crs。
[0250]
在具体的实施方式中,施用一种剂量或多种剂量的类固醇以控制irr和/或crs。类固醇的剂量将被选择为足够减弱或消除实际或潜在的irr和/或crs。在具体的实施方式中,在i7dp之前、期间和/或之后施用类固醇,在i7dp中根据任一以上实施方式施用dart
‑
a。在另一个具体的实施方式中,在第一(或任何后续的)a7dp之前、期间和/或之后施用类固醇,在a7dp中根据任一以上实施方式施用dart
‑
a。在另一个具体的实施方式中,在第一(或任何后续的)f7dp之前、期间和/或之后施用类固醇,在f7dp中根据任一以上实施方式施用dart
‑
a。在任一以上实施方式中,在施用一种剂量或多种剂量的类固醇以控制irr和/或crs的同时,可以暂停施用dart
‑
a。
[0251]
在一个实施方式中,类固醇为长持续时间的类固醇(具有约48小时或更长的半衰期),如地塞米松(或等效物)。在另一个实施方式中,类固醇为中等持续时间的类固醇(具有约12
‑
36小时的半衰期),如甲基泼尼松龙(或等效物)。在另一个实施方式中,类固醇为短持续时间的类固醇(具有约12小时或更少的半衰期),如氢化可的松(或等效物)。在某些实施方式中,类固醇在dart
‑
a给药之前(例如,达到30分钟之前)施用(例如,通过iv 10
‑
20mg地塞米松),然后在施用dart
‑
a期间和/或之后施用另外的剂量(例如,在已经开始dart
‑
a给药之后,通过iv 4mg 12小时)。如地塞米松(或等效物)的类固醇可在改变dart
‑
a给药之前(例如,达到30分钟之前)施用(例如,通过iv 10
‑
20mg),随后在施用改变的dart
‑
a剂量后施用另外的剂量(例如,在开始dart
‑
a给药后12小时通过iv 4mg)。
[0252]
在具体的实施方式中,施用一种剂量或多种剂量的il
‑
6/il
‑
6r抑制剂以控制irr和/或crs。il
‑
6/il
‑
6r抑制剂的剂量将被选择为足够减弱或消除实际或潜在的irr和/或crs。在具体的实施方式中,在i7dp之前、期间和/或之后施用il
‑
6/il
‑
6r抑制剂,在i7dp中根据任一以上实施方式施用dart
‑
a。在另一个具体的实施方式中,在第一(或任何后续的)a7dp之前、期间和/或之后施用il
‑
6/il
‑
6r抑制剂,在a7dp中根据任一以上实施方式施用dart
‑
a。在另一个具体的实施方式中,在第一(或任何后续的)f7dp之前、期间和/或之后施用il
‑
6/il
‑
6r抑制剂,在f7dp中根据任一以上实施方式施用dart
‑
a。在任一以上实施方式中,在施用一种剂量或多种剂量的il
‑
6/il
‑
6r抑制剂以控制irr和/或crs的同时,可以暂停施用dart
‑
a。
[0253]
在一个实施方式中,il
‑
6/il
‑
6r抑制剂为抗il
‑
6或抗il
‑
6r抗体,例如,托珠单抗(drugbank登记号db06273)、西妥昔单抗(drugbank登记号db09036)或克拉扎珠单抗(clazakizumab)(drugbank登记号db12849)(参见,lee,d.w.等(2014)“current concepts in the diagnosis and management of cytokine release syndrome,”blood 124(2):188
‑
195;shimabukuro
‑
vornhagen,a.等(2018)“cytokine release syndrome,”j.immunother.canc.656,第1
‑
14页)。
[0254]
在一个实施方式中,il
‑
6/il
‑
6r抑制剂为托珠单抗,并且例如通过静脉内输注以约4mg/kg至约12mg/kg的剂量,并且特别地以约4mg/kg至约8mg/kg的剂量施用。在另一个实施方式中,il
‑
6/il
‑
6r抑制剂为西妥昔单抗并且例如通过静脉内输注以约1 mg/kg至约11 mg/kg的剂量,并且特别地以约11 mg/kg的剂量施用。
[0255]
在具体的实施方式中,施用一种剂量或多种剂量的tnfα抑制剂以控制irr和/或crs。tnfα抑制剂的剂量将被选择为足够减弱或消除实际或潜在的irr和/或crs。在具体的
实施方式中,在i7dp之前、期间和/或之后施用tnfα抑制剂,在i7dp中根据任一以上实施方式施用dart
‑
a。在另一个具体的实施方式中,在第一(或任何后续的)a7dp之前、期间和/或之后施用tnfα抑制剂,在a7dp中根据任一以上实施方式施用dart
‑
a。在另一个具体的实施方式中,在第一(或任何后续的)f7dp之前、期间和/或之后施用tnfα抑制剂,在f7dp中根据任一以上实施方式施用dart
‑
a。在任一以上实施方式中,在施用一种剂量或多种剂量的tnfα抑制剂以控制irr和/或crs的同时,可以暂停施用dart
‑
a。
[0256]
在一个实施方式中,tnfα抑制剂为抗tnfα抗体,例如,阿达木单抗(adalimumab)或其生物仿制药(例如,阿达木单抗
‑
阿托(atto)(scheinfeld,n.(2003)“adalimumab(humira):a review,”j.drugs dermatol.2(4):375
‑
377;drugbank登记号db00051);赛妥珠单抗pegol(certolizumab pegol)或其生物仿制药(goel,n.等(2010)“certolizumab pegol”mabs.2(2):137
‑
147;drugbank登记号db08904);戈利木单抗(golimumab)或其生物仿制药(mazumdar,s.等(2009)“golimumab,”mabs.1(5):422
‑
431;drugbank登记号db06674);英利昔单抗(infliximab)或其生物仿制药(例如,sb2等(smolen,j.s.(2011)“infliximab:12years of experience,”arthritis res.ther.13(suppl 1:s2)第1
‑
18页;lamb,y.n.(2017)“sb2:an infliximab biosimilar,”biodrugs.31(5):461
‑
464);drugbank登记号db00065),或为tnfα阻断受体融合蛋白,例如,依那西普(etanercept)或其生物仿制药(例如,依那西普
‑
szzsgp2015等(deeks,e.d.(2017)“gp2015:an etanercept biosimilar,”biodrugs 31:555
‑
558;cantini,f.等(2018)“focus on biosimilar etanercept
–
bioequivalence and interchangeability,”biologics:targets and therapy 2018:12 87
‑
95;drugbank登记号db00005)。
[0257]
在一个实施方式中,使用的tnfα抑制剂为阿达木单抗或其生物仿制药,并且例如通过皮下注射以约40mg的剂量或以约80mg的剂量施用。在一个实施方式中,tnfα抑制剂为赛妥珠单抗pegol或其生物仿制药,并且例如通过皮下注射以约200mg的剂量施用。在一个实施方式中,tnfα抑制剂为戈利木单抗或其生物仿制药,并且例如通过皮下注射以约50mg至约100mg的剂量施用,或者例如通过静脉内注射以约50mg的剂量施用。在一个实施方式中,tnfα抑制剂为英利昔单抗或其生物仿制药,并且例如通过静脉内输注以约100mg的剂量或以约5mg/kg体重的剂量施用。在一个实施方式中,tnfα抑制剂为依那西普或其生物仿制药,并且例如通过皮下注射以约25mg至约50mg的剂量施用。
[0258]
在具体的实施方式中,使用一种剂量或多种剂量的基于il
‑
1r的抑制剂(例如,阿那白滞素(anakinra)(drugbank登记号db00026)以控制irr和/或crs。基于il
‑
1r的抑制剂的剂量将被选择为足够减弱或消除实际或潜在的irr和/或crs。在具体的实施方式中,在i7dp之前、期间和/或之后施用基于il
‑
1r的抑制剂,在i7dp中根据任一以上实施方式施用dart
‑
a。在另一个具体的实施方式中,在第一(或任何后续的)a7dp之前、期间和/或之后施用基于il
‑
1r的抑制剂,在a7dp中根据任一以上实施方式施用dart
‑
a。在另一个具体的实施方式中,在第一(或任何后续的)f7dp之前、期间和/或之后施用基于il
‑
1r的
抑制剂,在f7dp中根据任一以上实施方式施用dart
‑
a。在任一以上实施方式中,在施用一种剂量或多种剂量的il
‑
1r抑制剂以控制irr和/或crs的同时,可以暂停施用dart
‑
a。
[0259]
在一个实施方式中,il
‑
1r抑制剂为阿那白滞素,并且例如通过皮下注射以约100mg至约150mg的剂量施用。
[0260]
vii.本发明的实施方式
[0261]
现在已经大体上描述了本发明,通过参考以下编号的实施方式(“e”)将更容易理解本发明,除非另有说明,否则这些实施方式作为示例提供并且不意欲限制本发明:
[0262]
e1.一种治疗血液系统恶性肿瘤的方法,其包括向需要其的受试者施用cd123 x cd3结合分子,其中:
[0263]
(i)所述cd123 x cd3结合分子是包含具有seq id no:21的氨基酸序列的第一多肽链和具有seq id no:23的氨基酸序列的第二多肽链的双抗体;以及
[0264]
(ii)所述方法包括初始7天治疗时期(i7dp),其中:
[0265]
(a)在所述i7dp的第1天,通过持续静脉内输注以约30ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0266]
(b)在所述i7dp的第2天,通过持续静脉内输注以约60ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0267]
(c)在所述i7dp的第3天,通过持续输注以约100ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0268]
(d)在所述i7dp的第4天,通过持续静脉内输注以约200ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0269]
(e)在所述i7dp的第5天,通过持续静脉内输注以约300ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0270]
(f)在所述i7dp的第6天,通过持续静脉内输注以约300ng/kg/天至约400ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;以及
[0271]
(g)在所述i7dp的第7天,通过持续静脉内输注以约300ng/kg/天至约500ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0272]
e2.一种用于受试者的血液系统恶性肿瘤的治疗的用途的cd123 x cd3结合分子,其中:
[0273]
(i)所述cd123 x cd3结合分子是包含具有seq id no:21的氨基酸序列的第一多肽链和具有seq id no:23的氨基酸序列的第二多肽链的双抗体;以及
[0274]
(ii)所述用途包括初始7天治疗时期(i7dp),其中:
[0275]
(a)在所述i7dp的第1天,通过持续静脉内输注以约30ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0276]
(b)在所述i7dp的第2天,通过持续静脉内输注以约60ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0277]
(c)在所述i7dp的第3天,通过持续输注以约100ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0278]
(d)在所述i7dp的第4天,通过持续静脉内输注以约200ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0279]
(e)在所述i7dp的第5天,通过持续静脉内输注以约300ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;
[0280]
(f)在所述i7dp的第6天,通过持续静脉内输注以约300ng/kg/天至约400ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子;以及
[0281]
(g)在所述i7dp的第7天,通过持续静脉内输注以约300ng/kg/天至约500ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0282]
e3.根据e1所述的方法或根据e2所述的用于所述用途的cd123 x cd3结合分子,其中在所述方法中或所述用途中包括一个或多个另外的7天治疗时期(a7dp),其中在所述一个或多个a7dp中的每个a7dp的第1
‑
7天,通过持续静脉内输注以约300ng/kg/天至约500ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0283]
e4.根据e1或e3中任一项所述的方法或根据e2或e3中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在所述i7dp的第6天和第7天,以约300ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0284]
e5.根据e3或e4中任一项所述的方法或根据e3或e4中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在所述一个或多个a7dp中的至少一个a7dp的第1
‑
7天,以约300ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0285]
e6.根据e1或e3中任一项所述的方法或根据e2或e3中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在所述i7dp的第6天和第7天,以约400ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0286]
e7.根据e3或e6中任一项所述的方法或根据e3或e6中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在所述一个或多个a7dp中的至少一个a7dp的第1
‑
7天,以约400ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0287]
e8.根据e1或e3中任一项所述的方法或根据e2或e3中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在所述i7dp的第6天,以约400ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子,并且在所述i7dp的第7天,以约500ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0288]
e9.根据e3或e8中任一项所述的方法或根据e3或e8中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在所述一个或多个a7dp中的至少一个a7dp的第1
‑
7天,以约500ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0289]
e10.根据e3
‑
e9中任一项所述的方法或根据e3
‑
e9中任一项所述的用于所述用途的cd123 x cd3结合分子,其包括三个所述a7dp。
[0290]
e11.根据e10所述的方法或根据e10所述的用于所述用途的cd123 x cd3结合分子,其包括另外四个、八个、十二个、十六个或二十个所述a7dp。
[0291]
e12.根据e3
‑
e11中任一项所述的方法或根据e3
‑
e11中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述一个或多个a7dp中的至少一个a7dp随后是一个或多个进一步的7天治疗时期(f7dp),其中在所述一个或多个f7dp中的每个f7dp的第1
‑
4天,向所述受试者施用所述cd123 x cd3结合分子,并且在所述一个或多个f7dp中的每个f7dp的第5
‑
7天,所述受试者不被提供所述cd123 x cd3结合分子。
[0292]
e13.根据e12所述的方法或根据e12所述的用于所述用途的cd123 x cd3结合分
子,其中在所述一个或多个f7dp中的至少一个f7dp的第1
‑
4天,通过持续静脉内输注以约300ng/kg/天至约500ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0293]
e14.根据e13所述的方法或根据e13所述的用于所述用途的cd123 x cd3结合分子,其中在所述一个或多个f7dp中的至少一个f7dp的第1
‑
4天,以约300ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0294]
e15.根据e13所述的方法或根据e13所述的用于所述用途的cd123 x cd3结合分子,其中在所述一个或多个f7dp中的至少一个f7dp的第1
‑
4天,以约400ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0295]
e16.根据e13所述的方法或根据e13所述的用于所述用途的cd123 x cd3结合分子,其中在所述一个或多个f7dp中的至少一个f7dp的第1
‑
4天,以约500ng/kg/天的剂量向所述受试者施用所述cd123 x cd3结合分子。
[0296]
e17.根据e12
‑
e16中任一项所述的方法或根据e12
‑
e16中任一项所述的用于所述用途的cd123 x cd3结合分子,其包括四个所述f7dp。
[0297]
e18.根据e17所述的方法或根据e17所述的用于所述用途的cd123 x cd3结合分子,其包括另外四个、八个、十二个、十六个或二十个所述f7dp。
[0298]
e19.根据e1或e3
‑
e18中任一项所述的方法或根据e2
‑
e18中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述方法或用途进一步包括施用能够结合pd
‑
1或pd
‑
1的天然配体的分子,并且其中所述能够结合pd
‑
1的分子包括结合pd
‑
1的抗体的表位结合结构域,并且所述能够结合pd
‑
1的天然配体的分子包括结合pd
‑
1的天然配体的抗体的表位结合结构域。
[0299]
e20.根据e19所述的方法或根据e19所述的用于所述用途的cd123 x cd3结合分子,其中每两周一次(q2w)、每三周一次(q3w)或每四周一次(q4w)施用所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
[0300]
e21.根据e19
‑
e20中任一项所述的方法或根据e19
‑
e20中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在第15天开始施用所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
[0301]
e22.根据e21所述的方法或根据e21所述的用于所述用途的cd123 x cd3结合分子,其中在第15天开始q2w施用所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
[0302]
e23.根据e21所述的方法或根据e21所述的用于所述用途的cd123 x cd3结合分子,其中在第15天开始q3w施用所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
[0303]
e24.根据e21所述的方法或根据e21所述的用于所述用途的cd123 x cd3结合分子,其中在第15天开始q4w施用所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
[0304]
e25.根据e19
‑
e24中任一项所述的方法或根据e19
‑
e24中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在一个或多个所述f7dp的第1天施用所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
[0305]
e26.根据e19
‑
e25中任一项所述的方法或根据e19
‑
e25中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子包括:
[0306]
(a)派姆单抗的vh结构域和vl结构域;
[0307]
(b)尼鲁单抗的vh结构域和vl结构域;
[0308]
(c)西米单抗的vh结构域和vl结构域;
[0309]
(c)pd
‑
1 mab 1的vh结构域和vl结构域;
[0310]
(d)阿特珠单抗的vh结构域和vl结构域;
[0311]
(e)阿维鲁单抗的vh结构域和vl结构域;
[0312]
(f)度伐单抗的vh结构域和vl结构域;或
[0313]
(h)在表3或表4中提供的抗体的vh结构域和vl结构域。e27.根据e26所述的方法或根据e26所述的用于所述用途的cd123 x cd3结合分子,其中所述能够结合pd
‑
1或pd
‑
1的天然配体的分子:
[0314]
(a)包括pd
‑
1 mab 1的vh结构域和vl结构域;或
[0315]
(b)是pd
‑
1 mab 1igg4。
[0316]
e28.根据e19
‑
e27中任一项所述的方法或根据e19
‑
e27中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子以约1 mg/kg至约3mg/kg的剂量施用。
[0317]
e29.根据e19
‑
e28中任一项所述的方法或根据e19
‑
e28中任一项所述的用于所述用途的cd123 x cd3结合分子,进一步包括在施用最后剂量的所述cd123 x cd3结合分子之后,施用一种或多种剂量的所述能够结合pd
‑
1或pd
‑
1的天然配体的结合分子。
[0318]
e30.根据e1、e3
‑
e29中任一项所述的方法或根据e2
‑
e29中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述方法或所述用途进一步包括在所述施用所述cd123 x cd3结合分子之前、期间和/或之后通过静脉内输注施用皮质类固醇和/或抗il
‑
6或抗il
‑
6r抗体。e31.根据e30所述的方法或根据e28所述的用于所述用途的cd123 x cd3结合分子,其中所述皮质类固醇选自由地塞米松、甲基泼尼松龙和氢化可的松组成的组。
[0319]
e32.根据e30所述的方法或根据e29所述的用于所述用途的cd123 x cd3结合分子,其中所述皮质类固醇是地塞米松。
[0320]
e33.根据e30所述的方法或根据e29所述的用于所述用途的cd123 x cd3结合分子,其中所述皮质类固醇是甲基泼尼松龙。
[0321]
e34.根据e30所述的方法或根据e29所述的用于所述用途的cd123 x cd3结合分子,其中所述皮质类固醇是氢化可的松。
[0322]
e35.根据e31
‑
e32中任一项所述的方法或根据e31
‑
e32中任一项所述的用于所述用途的cd123 x cd3结合分子,其中在施用所述cd123 x cd3结合分子之前,以约10mg至约20mg的剂量施用地塞米松。
[0323]
e36.根据e31
‑
e32或e35中任一项所述的方法或根据e31
‑
e32或e35中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述方法和所述用途进一步包括在施用所述cd123 x cd3结合分子期间和/或之后,以约4mg的剂量施用地塞米松。
[0324]
e37.根据e1或e3
‑
e36中任一项所述的方法或根据e2
‑
e36中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述方法和所述用途进一步包括在施用所述cd123 x cd3结合分子之后,施用抗il
‑
6或抗il
‑
6r抗体。
[0325]
e38.根据e37所述的方法或根据e37所述的用于所述用途的cd123 x cd3结合分子,其中所述施用的抗il
‑
6或抗il
‑
6r抗体是托珠单抗或西妥昔单抗。
[0326]
e39.根据e38所述的方法或根据e38所述的用于所述用途的cd123 x cd3结合分
子,其中所述施用的抗il
‑
6r抗体是托珠单抗,并且其中以约4mg/kg至约8mg/kg的剂量施用所述托珠单抗。
[0327]
e40.根据e1或e3
‑
e39中任一项所述的方法或根据e2
‑
e39中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述血液系统恶性肿瘤选自以下组成的组中:急性髓细胞白血病(aml)、包括cml的原始细胞危象和与cml相关的阿贝尔森致癌基因(bcr
‑
abl易位)的慢性髓细胞性白血病(cml)、脊髓发育不良综合征(mds)、急性b淋巴细胞白血病(b
‑
all)、急性t淋巴细胞白血病(t
‑
all)、包括cll的里克特综合征或里克特转化的慢性淋巴细胞性白血病(cll)、多毛细胞白血病(hcl)、母细胞性浆细胞样树突状细胞肿瘤(bpdcn)、包括套细胞淋巴瘤(mcl)和小淋巴细胞淋巴瘤(sll)的非霍奇金淋巴瘤(nhl)、霍奇金淋巴瘤、系统性肥大细胞增生症和伯基特淋巴瘤。
[0328]
e41.根据e40所述的方法或根据e40所述的用于所述用途的cd123 x cd3结合分子,其中所述血液系统恶性肿瘤是急性髓细胞白血病。
[0329]
e42.根据e40所述的方法或根据e40所述的用于所述用途的cd123 x cd3结合分子,其中所述血液系统恶性肿瘤是脊髓发育不良综合征。e43.根据e40所述的方法或根据e40所述的用于所述用途的cd123 x cd3结合分子,其中所述血液系统恶性肿瘤是母细胞性浆细胞样树突状细胞肿瘤。
[0330]
e44.根据e40所述的方法或根据e40所述的用于所述用途的cd123 x cd3结合分子,其中所述血液系统恶性肿瘤是急性t淋巴细胞白血病。
[0331]
e45.根据e40所述的方法或根据e40所述的用于所述用途的cd123 x cd3结合分子,其中所述血液系统恶性肿瘤是急性b淋巴细胞白血病。
[0332]
e46.根据e1或e3
‑
e45中任一项所述的方法或根据e2
‑
e45中任一项所述的用于所述用途的cd123 x cd3结合分子,其中所述受试者是人。
[0333]
实施例
[0334]
现在已经总体上描述了本发明,通过参考下列实施例将更容易理解本发明,下列实施例通过举例提供并且不意欲限制本发明,除非另有说明。
[0335]
实施例1
[0336]
原发性aml患者样品中cd123 x cd3分子的活性
[0337]
研究了dart
‑
a用于杀伤原发性aml患者样本的表达cd123的细胞的能力。aml患者原代pbmc(包含82%母细胞)用cd123 x cd3分子、fitc x cd3对照分子或磷酸盐缓冲盐水(pbs)处理144小时。在研究的开始pbmc中如根据母细胞和t细胞百分比确定的,e:t细胞比为近似1:300。白血病母细胞(cd45 /cd33 )的绝对数在图2a中示出。t细胞(cd4 和cd8 )的绝对数在图2b中示出。图2c示出t细胞激活(cd25表达)。在培养上清液中测量的细胞因子在图2d中示出。
[0338]
实施例2
[0339]
用dart
‑
a处理的样品的特征
[0340]
来自aml患者的pbmc样本从商业来源获得并且用500pg/ml、50pg/ml或5pg/ml的dart
‑
a处理48小时。测量ifn
‑
γ释放,并且对于pd
‑
1、pd
‑
l1、cd3、cd4和cd8对细胞进行染色。如在图3a中示出,用dart
‑
a分子孵育的来自aml患者的pbmc样本中,ifn
‑
γ以剂量依赖性方式被诱导,在cd4
和cd8
t细胞二者上观察到pd
‑
1上调(图3b)和在aml母细胞上观察到
pd
‑
l1上调(图3c)。已经报道,ifn
‑
γ诱导aml母细胞中的pd
‑
l1表达(kronig等(2014)“interferon
‑
induced programmed cell death
‑
ligand 1(pd
‑
l1/b7
‑
h1)expression increases on human acute myeloid leukemia blast cells during treatment,”european journal of haematology,92:195
‑
203))。
[0341]
在单独的研究中,商业化的aml
‑
pbmc样本(在rpmi 1640/10%fbs中)用dart
‑
a分子(以2000pg/ml、666.67pg/ml、222.22pg/ml、74.07pg/ml、24.69pg/ml或8.23pg/ml) /
‑
抗pd
‑
1 mab(pd
‑
1 mab 1igg4;10μg/ml)孵育48小时或72小时。4420x cd3对照双抗体(以2000pg/ml、666.67pg/ml或222.22pg/ml)和抗rsv mab用作同种型(阴性)对照。检查cd4
和cd8
细胞中pd
‑
1的细胞表面表达并且测定共表达pd
‑
1和cd4
或cd8
的细胞的百分比。此外,使用bd
tm
流式微球技术(cba)试剂盒(bd biosciences;san jose,ca)检测细胞因子并且通过检测非t细胞的百分比评估细胞杀伤。对于一种这样的aml
‑
pmbc样品的pd
‑
1表达在cd4
细胞(图4a cd4
细胞中的总增长,图4b%cd4
pd
‑1
细胞)和在cd8
细胞(图4c cd8
细胞中的总增长,图4d%cd8
pd
‑1
细胞)中示出,并且说明在抗pd
‑
1抗体检查点抑制剂存在的情况下,减弱了用dart
‑
a处理造成的cd4
和cd8
细胞上pd
‑
1的增加表达。在图5a
‑
5d中给出的数据(在表5中总结的)示出许多细胞因子的释放在体外通过dart
‑
a分子和抗pd
‑
1抗体检测点抑制剂的组合增强,检测点抑制剂包括gm
‑
csf(图5a)、inf
‑
γ(图5b)、il
‑
2(图5c)和tnf
‑
α((图5d)。这些数据表明,用dart
‑
a分子与能够结合pd
‑
1或pd
‑
1的天然配体的分子(这里是抗pd
‑
1抗体)组合处理aml细胞导致减弱的pd
‑
1表达并且增强的t细胞活性。如在图6中示出,在72小时,在低的dart
‑
a浓度用组合处理的细胞观察到细胞杀伤的增强。鉴于细胞因子释放的增加,预期在以后的时间点细胞杀伤的增强将更大。
[0342]
[0343][0344]
这些研究表明,dart
‑
a处理与增强ifn
‑
γ分泌、以及t细胞上的pd
‑
1表达和由aml母细胞引起的pd
‑
l1表达的上调相关,该上调可导致对dart
‑
a介导的杀伤不太敏感。这些研究进一步表明,将dart
‑
a疗法与结合至pd
‑
1或pd
‑
1的天然配体的分子如抗pd1抗体的组合,增强dart
‑
a分子在介导表达cd123的癌细胞的t细胞重定向杀伤中的效果。在不受任何特定理论束缚的情况下,这种增强可能是由于克服了pd
‑
1检查点的抑制活性而引起。这种组合在具有表达cd123的血液系统恶性肿瘤(例如,复发的或难治的aml、b
‑
all、t
‑
all或mds)的患者中特别地有用。
[0345]
实施例3
[0346]
aml和mds中初始导入给药cd123 x cd3 dart双抗体
[0347]
急性髓细胞白血病(aml)的特征在于具有高水平cd123、白介素3受体(il
‑
3rα)的α链的cd34 、cd38
‑
细胞的扩增。cd123在>90%的aml患者和至少50%的mds患者中高表达。aml母细胞中cd123的表达与高风险疾病和疾病进展相关,从而使利用cd123靶向方法优先消融成为一种有前途的策略。由于aml母细胞和白血病干细胞高表达cd123,其与高风险疾病和疾病进展相关,而正常造血干细胞上cd123的表达最少,因此aml(和脊髓发育不良综合征(mds))是基于cd123的免疫疗法的合理靶标。
[0348]
本发明的dart
‑
a分子对于体外靶向表达cd123的细胞系和原发性aml母细胞以被作为效应细胞的表达cd3的t淋巴细胞识别和消除示出强效的活性,并且能够抑制小鼠中的白血病细胞系的生长且耗竭食蟹猕猴中的cd123阳性的浆细胞样树突状细胞,因此为利用cd123靶向的方法优先消融aml提供了策略。
[0349]
单一患者剂量递增
[0350]
为了确定患者对dart
‑
a的耐受性,进行了“单一患者剂量递增研究”。使用3ng/kg/天、随后10ng/kg/天、随后30ng/kg/天、随后100ng/kg/天的导入给药策略,用持续iv输注(civ)对单一患者微型小组(mini
‑
cohort)给药,其中如果剂量限制毒性(dlt)小于33%,则每次出现这种剂量进展。如果不良作用(ae)≥等级2,则小组增加到4名患者。这个研究的结果表明,以所有测试剂量都耐受dart
‑
a。
[0351]
初始导入剂量优化
[0352]
随后具有细胞因子释放综合征(crs)可能性的细胞因子分泌是t细胞激活固有的,并且在t细胞重定向疗法中具有有限的毒性。在aml和mds的治疗中dart
‑
a介导这种t细胞激活的能力的第1期研究中,结合以托珠单抗的早期干预,对两种导入剂量(“lid”)策略减轻crs的能力进行了比较(maude,s.l.等(2014)“managing cytokine release syndrome associated with novel t cell
‑
engaging therapies.”cancer journal 20:119
–
122)。
[0353]
简言之,在第一lid策略(“lid
‑
1模式”)中,在初始7天治疗时期(“lid
‑
1”)期间以100ng/kg/天施用dart
‑
a 4天,然后暂停3天,并且在第8天开始以小组目标剂量(例如,300ng/kg/天或500ng/kg/天)恢复治疗。第二lid策略(“lid
‑
2模式”),包含在初始7天治疗时期期间的两步骤lid(“lid
‑
2”),其中以30ng/kg/天施用dart
‑
a 3天,随后以100ng/kg天施用接下来4天,随后,三个另外的7天治疗时期(每个为“a7dp”),其中在第2
‑
4周期间使用持续给药方案(即,该周的每一天以目标剂量施用dart
‑
a)以小组目标剂量(例如,300
‑
1000ng/kg/天)施用dart
‑
a,或施用三个进一步的7天治疗时期(每个为“f7dp”),其中使用间歇给药方案(即,以小组目标剂量施用dart
‑
a 4天,随后不施用dart
‑
a暂停3天)以小组目标剂量(例如,300
‑
1000ng/kg/天)施用dart
‑
a。具体地,在第1周期/第1周(“c1w1”)期间,lid
‑
2模式包含两步骤lid(即,初始lid 30ng/kg/天进行3天,随后第二lid 100ng/kg/天进行4天),随后三个7天治疗时期,在此期间在第1周期/第2周
–
第1周期/第4周(c1w2
‑
c1w4)期间,基于给药方案(连续(a7dp)或间歇(f7dp))中的任一者以小组目标剂量(例如,300
‑
1000ng/kg/天)施用dart
‑
a。
[0354]
在第2周期(“c2”),第5周
‑
第8周(w5
–
w8)及以后,基于4天施用/3天停用的间歇给药方案以目标剂量治疗患者最大12个周期,其中2个周期在完全缓解(“cr”)或不完全血细胞计数恢复(“cri”)之后。如果临床上表明,则可使用节制激素的(steriod
‑
sparing)抗细胞因子(托珠单抗)疗法来控制细胞因子释放综合征(“crs”)的症状。疾病状况通过国际工作组(“iwg”)标准评估。收集样本进行药代动力学(“pk”)、抗药物抗体(“pk”)和细胞因子分析,其包括il
‑
2、il
‑
6、il
‑
8、il
‑
10、tnfα、ifn
‑
γ和gm
‑
csf。还可以获得治疗后的骨髓活检。
[0355][0356]
在表6中汇总了用间歇给药方案的lid
‑
2模式并且在表7中汇总了用持续给药方案的lid
‑
2模式。
[0357][0358]
在用间歇给药方案的lid
‑
2模式和用持续给药方案的lid
‑
2模式二者中,持续治疗直至达到以下任一条件:(1)完全响应(complete response)、(2)达到完全响应后的1
‑
2个周期、(3)最多12个周期、(4)剂量限制性毒性(“dlt”),或(5)治疗失败。crs优选地根据lee标准分级(lee,d.w.等(2014).“current concepts in the diagnosis and management of cytokine release syndrome,”blood.124:188
‑
195;shimabukuro
‑
vornhagen,a.等,(2018)“cytokine release syndrome,”j.immunother.canc.656,第1
‑
14页)。响应(完全缓解(cr)、不完全血球计数恢复(cri)、部分缓解(pr)或外周血和骨髓(pb/bm)aml母细胞计数
的改善)优选地通过国际工作组(international working group)iwg(aml)或ipss(mds)标准评估。
[0359]
在导入剂量策略的评估中,测量细胞因子(il
‑
2、il
‑
6、il
‑
8、il
‑
10、tnfα、ifn
‑
γ和gm
‑
csf),并对crs严重程度分级。评估了在第一剂量开始的10天内发生的首次报告的crs事件期间的峰值细胞因子值。比较用lid和不用lid的患者之间的中位峰值细胞因子水平。评估了其他潜在的crs决定因素。
[0360]
患者的(76%)发生了输注相关的反应(irr)/crs,大多数事件(82%)≤等级(gr)2,是可控制的且可逆的。在具有完整细胞因子数据的29名患者中,68%的患者在dart
‑
a疗法开始的2天内经历了crs,另外8%的患者在dart
‑
a疗法开始的10天内经历了crs(14%gr 1、55%gr 2和7%gr 3)。在具有crs的患者中的细胞因子水平总体高于不具有crs的患者(中值il
‑
6,116.2pg/ml对67.9pg/ml;il
‑
8,191.1pg/ml对144.6pg/ml;il
‑
10,867.6pg/ml对348.7pg/ml),并且通常随着crs等级的提高而更高。使用两步骤lid(lid
‑
2)降低了总体细胞因子水平,在第1周lid
‑
2的规则使在周期1期间的严重程度降低了平均0.54等级(平均crs等级,lid
‑
2对lid
‑
1分别为:第1周,1.16对2;第2周,1对1.33;第3周,0.67对0.83;第4周,0.13对0.67)。在第1周期间且达到最大剂量后,用lid
‑
2观察到的中位峰值细胞因子水平较低。初步数据显示第1周期间的基线循环t细胞数量与最大crs等级之间的关系,其中第1周的crs更高等级(≥2)与循环t细胞的更高基线水平相关。评估的其他变量不随crs等级变化。crs等级和频率与响应无关。图7显现了研究参与者展现的crs等级的概况,并示出在施用步进目标剂量(例如,500ng/kg/天)之前,引入两步骤lid
‑
2模式(30ng/kg/天持续3天,随后100ng/kg/天持续接下来的4天),在第一个研究周期(28天)内降低crs。
[0361]
一旦已经确定最大耐受剂量(“mtds”)或最大施用剂量(“mad”),剂量扩大发生在一个扩大小组中展现出复发的/难治的(“r/r”)aml的患者中和在第二扩大小组中具有低甲基化失效mds的患者中。登记的另外的患者用于评估功效。
[0362]
具有r/r aml/mds(89%aml和11%mds)的四十五名(45)患者(平均年龄64(29
‑
84)和44%女性)用dart
‑
a处理。mtds在500ng/kg/天达到。总体来说,dart
‑
a证实,在20/45(44%)患者中观察到可控制的毒性(药物相关的不良事件≥g3;输注相关的反应/细胞因子释放综合征(“irr/crs”)是最常见的毒性,并且在34/45(76%)患者(在6/45中g3,13%)中观察到)。最频繁的crs综合征是发热(15)、寒冷(10)、心跳过速(10)和低血压(4)。十四名(14)以阈值500ng/kg/天剂量小组(cohort)和超过(700ng/kg/天剂量小组)阈值治疗的患者完成至少一个治疗周期和进行治疗后的骨髓活检。57%(8/14)患者中记录抗白血病活性,6/14达到iwg标准(3cr、1cri、1mlf(无形态学白血病)、1pr)的43%的目标响应率(orr),并且2名患者具有稳定的病情且bm母细胞从基线减少20%和25%(图8)。母细胞减少经常在一个周期的治疗内迅速发生,且除了dart
‑
a中止以外继续。
[0363]
另外的患者使用lid
‑
2模式(30ng/kg/天进行3天,随后100ng/kg/天进行4天),随后在第8
‑
28天500ng/kg/天的剂量(持续给药方案(表7))给药。图9示出dart
‑
a抗白血病活性(以25名患者绘图)和表8示出来自使用lid
‑
2以持续给药方案给药的31名患者的患者crs等级(表7)。
[0364][0365]
表9示出来自这些相同患者的事件的crs等级。图10绘制每个等级crs持续时间(天)并且示出crs事件的中值持续时间通常在1
‑
2.5天之间(crs等级1事件:1天;crs等级2事件:2天;crs等级3事件:2.5天)。然而,大多数事件(62.0%,111/179)在第一周内(导入剂量)和在以500ng/kg/天持续施用期间在周期1的第二周内递升至500ng/kg/天期间发生(图11)。这种反应可导致治疗延期或治疗的中止并且可减少剂量强度。
[0366][0367]
实施例4
[0368]
进一步导入剂量优化
[0369]
实施了第三多步骤导入给药策略(“lid
‑
3模式”),用于施用dart
‑
a以进一步减轻crs,尤其是在治疗的前两周期间。
[0370]
在多步骤lid
‑
3模式中,使用多步骤递升剂量增加施用dart
‑
a,每个持续约24小时,直到达到目标剂量(约300ng/kg/天至约500ng/kg/天),此后,在第一周(即,初始7天治疗时期(i7dp))的剩余时间内以目标剂量施用dart
‑
a,随后三个另外的7天治疗时期(每个为“a7dp”),其中使用持续给药方案以目标剂量(例如,约300ng/kg/天、约400ng/kg/天或约500ng/kg/天)施用dart
‑
a。例如,在目标剂量为约500ng/kg/天的情况下,将使用多步骤给药增加以如下剂量给药dart
‑
a:约30ng/kg/天、约60ng/kg/天、约100ng/kg/天、约200ng/kg/天、约300ng/kg/天、约400ng/kg/天,每个24小时。在i7dp的第7天,剂量将增加至约500ng/kg/天,并且作为持续输注施用3个一周的a7dp(即,第2
‑
4周(第8
‑
28天))。i7dp和前三个a7dp一起组成了28天第一个治疗周期(治疗周期1)。在施用治疗周期1后,未达到cr(完全响应)、cri(具有不完全血液学改善的完全响应)、crh(具有部分血液学恢复的完全响应)或mlf(无形态学白血病状态)的患者可使用持续给药方案通过施用一个或多个28天的第二
治疗周期(“治疗周期2”)以目标剂量施用另外的dart
‑
a。四个a7dp,其中使用持续给药方案以小组目标剂量(例如,约300
‑
500ng/kg/天)施用dart
‑
a,组成治疗周期2。治疗周期2可重复达到5次。
[0371]
此后,患者,尤其是施用单独的治疗周期1或治疗周期1与治疗周期2组合施用后达到cr、cri、crh或mlf的那些患者使用进一步的7天治疗时期(f7dp)治疗,其中dart
‑
a以目标剂量施用4天,然后暂停3天,其中不施用dart
‑
a(即基于4天施用/3天停用的方案)。四个f7dp组成了28天的第三治疗周期(治疗周期3)。治疗周期3可重复达到六次。
[0372]
表10a提供了lid
‑
3模式的给药方案,其中i7dp具有约500ng/kg/天、约400ng/kg/天和约300ng/kg/天的目标剂量,随后是以目标剂量的三个a7dp(即,治疗周期1),然后是以目标剂量的四个f7dp(即,治疗周期3)。表10b提供了lid
‑
3模式的给药方案,其中治疗周期1随后是以目标剂量的四个另外的a7dp(即,治疗周期2)并且治疗周期2随后是四个f7dp(即,治疗周期3)。
[0373]
[0374][0375]
≠所有剂量
±
10%
[0376]
[0377][0378]
≠所有剂量
±
10%
[0379]
如地塞米松(或等效物)的类固醇可在dart
‑
a给药之前(例如,达到30分钟之前)施用(例如,通过iv 10
‑
20mg),在施用dart
‑
a后,随后另外的剂量(例如,在开始dart
‑
a给药后12小时通过iv 4mg)。如地塞米松(或等效物)的类固醇也可在改变dart
‑
a给药之前(例如,达到30分钟之前)施用(通过iv 10
‑
20mg),在施用改变的dart
‑
a剂量后,随后另外的剂量(例如,在开始dart
‑
a给药后12小时通过iv 4mg)。
[0380]
如果临床上表明,则使用节制激素的抗细胞因子,尤其是抗il
‑
6/抗il
‑
6r(托珠单抗或西妥昔单抗)疗法来控制crs症状。疾病状况通过iwg标准评估。具体地,可以施用托珠
单抗(通过iv 4
‑
8mg/kg)。
[0381]
可用于控制crs症状,尤其是对于抗il
‑
6/抗il
‑
6r治疗(例如,托珠单抗)难治的crs的其他试剂,包括进一步施用皮质类固醇(例如,地塞米松或等效物),这种施用可以以更高剂量(例如,30mg或更大的地塞米松的剂量)。可以采用抗
‑
tnfα剂,如依那西普(或等效物)。具体地,可施用依那西普(例如,通过皮下注射(sc)50mg)。
[0382]
图12a呈现了使用多步骤lid
‑
3模式(i7dp,目标剂量500ng/kg/天,随后以目标剂量三周持续给药(a7dp1
‑
a7dp3))在施用dart
‑
a治疗的治疗周期1期间,由16名研究参与者展现出的中值irr/crs等级的概况。图12b比较了来自使用多步骤lid
‑
3模式施用dart
‑
a的参与者的irr/crs等级数据,以及使用一步骤lid(lid
‑
1模式)和两步骤lid(lid
‑
2模式)施用dart
‑
a的受试者的irr/crs等级数据。如在图12a
‑
12b中所示,在达到最大剂量后,与用1步骤lid
‑
1和2步骤lid
‑
2观察到的那些相比,在第1周、第2周和第3周期间,用多步骤lid
‑
3观察到的中值irr/crs等级较低。另外,如在图13a
‑
13b中所示,多步骤lid
‑
3模式的使用改善了通过最小化由于irr和/或crs事件引起的剂量中断而获得的平均剂量强度。在周期1期间,在30名患者中,使用2步骤lid
‑
2施用dart
‑
a仅达到目标最大剂量强度(di)的58.8%的平均值(图13a)。相反,在周期1期间,在30名患者中,使用多步骤lid
‑
3模式施用dart
‑
a达到目标最大剂量强度(di)的80.6%的平均值(图13b)。因此,多步骤lid
‑
3模式的使用显著地增加了如通过增加的平均剂量强度所反映的接受目标最大值的患者的安全性特征和数目。
[0383]
总之,crs是t细胞定向疗法的限制因素。采用的两步骤lid
‑
2示出在减少irr和/或crs事件和循环细胞因子的有效性方面超过单步骤lid
‑
1,并且多步骤lid
‑
3在限制irr和/或crs事件和严重性方面提供了进一步改善。此外,当使用多步骤lid
‑
3模式用dart
‑
a治疗时,更多的患者接受500ng/kg/天的期望最高剂量强度。如以下更详细地提供的,多步骤lid
‑
3给药策略可适于包括施用另外的治疗剂。
[0384]
实施例5
[0385]
组合给药方案
[0386]
如以上提供的,dart
‑
a疗法可以与能够结合pd
‑
1或pd
‑
1的天然配体的分子(例如,抗pd
‑
1抗体)组合施用,以增强dart
‑
a分子在介导表达cd123的癌细胞的t细胞重定向杀伤中的作用。因此,根据以下描述的任何给药模式,dart
‑
a可以与能够结合pd
‑
1或pd
‑
1的天然配体的分子如pd
‑
1 mab 1igg4(或本文所述的其他抗体)组合施用,以治疗血液系统恶性肿瘤(例如,复发的或难治的aml、b
‑
all、t
‑
all或mds)。
[0387]
尽管以下方案详述了dart
‑
a与示例性抗pd
‑
1抗体“pd
‑
1 mab 1igg4”组合使用,但根据本文的教导应理解,可使用dart
‑
a与其他能够结合pd
‑
1或pd
‑
1天然配体的分子(例如,本文提供的任何抗pd
‑
1抗体或抗b7
‑
h1抗体)组合设计类似的组合方案。
[0388]
在组合给药治疗方案中,如以上所述,使用多个递升剂量增量施用dart
‑
a,直到达到目标剂量(例如,约300ng/kg/天至约500ng/kg/天),此后,第一周(即,初始7天治疗时期(i7dp))的剩余时间以目标剂量施用dart
‑
a,随后三个另外的7天治疗时期(每个为“a7dp”),其中使用持续给药方案以目标剂量(例如,约300ng/kg/天、约400ng/kg/天或约500ng/kg/天)施用dart
‑
a(即,该周的每一天以目标剂量施用)。例如,在目标剂量约为500ng/kg/天的情况下,将使用多步骤增量以如下剂量给药dart
‑
a:约30ng/kg/天、约60ng/kg/天、约100ng/kg/天、约200ng/kg/天、约300ng/kg/天、约400ng/kg/天,每个24小时。在
i7dp的第7天,剂量将增加至约500ng/kg/天,并且作为持续输注施用3个一周的a7dp(即,第2
‑
4周(第8
‑
28天))。i7dp和前三个a7dp一起组成了28天的第一治疗周期(治疗周期1)。
[0389]
在施用治疗周期1后,未达到cr(完全响应)、cri(具有不完全血液学改善的完全响应)、crh(具有部分血液学恢复的完全响应)或mlf(无形态学白血病状态)的患者可使用持续给药方案通过施用一个或多个28天的第二治疗周期(“治疗周期2”)以目标剂量施用另外的dart
‑
a。四个a7dp,其中使用持续给药方案以小组目标剂量(例如,约300ng/kg/天至约500ng/kg/天)施用dart
‑
a,组成治疗周期2。治疗周期2可重复达到5次。
[0390]
此后,患者,尤其是施用单独的治疗周期1或治疗周期1与治疗周期2组合施用后达到cr、cri、crh或mlf的那些使用进一步的7天治疗时期(f7dp)治疗,其中dart
‑
a以目标剂量施用4天,然后暂停3天,其中不施用dart
‑
a(即基于4天施用/3天停用的方案)。四个f7dp组成了28天的第三治疗周期(治疗周期3)。
[0391]
在治疗周期1
‑
3期间,在第15天(即第3周的第1天)开始,每两周一次(“q2w”)以约3mg/kg的剂量施用pd
‑
1 mab 1igg4。此后,另外的pd
‑
1 mab 1igg4可以基于q2w方案以约3mg/kg的剂量施用。如果确定在用300ng/kg/天dart
‑
a与3mg/kg pd
‑
1 mab 1igg4组合治疗的受试者中超过了最大耐受剂量(“mtd”),则可利用剂量递减(de
‑
escalation)以评估与300ng/kg/天dart
‑
a组合的较低剂量的pd
‑
1 mab 1igg4(约1 mg/kg)。通常,当安排在同一天时,在施用dart
‑
a之前,pd
‑
1 mab 1igg4通过静脉内输注施用。因此,在施用pd
‑
1 mab 1igg4的同时,可暂停dart
‑
a的施用。可替选地,在施用dart
‑
a的同时,通过静脉内输注施用pd
‑
1 mab 1igg4。这种施用可在不同的位置(例如,dart
‑
a通过iv进入患者的左臂并且pd
‑
1 mab 1igg4通过iv进入患者的右臂)或在同一位置(例如,通过单一iv路线)发生。
[0392]
表11a提供了组合给药治疗方案的给药方案,其中具有约500ng/kg/天、约400ng/kg/天和约300ng/kg/天的目标剂量的i7dp,随后是以目标剂量的三个a7dp(即,治疗周期1),然后是以目标剂量的四个f7dp(即,治疗周期3)。在治疗周期1的第15天(即第二个a7dp的第1天)、在治疗周期3的第1和15天(即,第一个f7dp的第1天和第三个f7dp的第1天)开始每两周一次(“q2w”)以约3mg/kg的剂量施用pd
‑
1 mab 1igg4。如所示,此后可基于q2w方案以3mg/kg的其他剂量施用pd
‑
1 mab 1igg4。如上所述,pd
‑
1 mab 1igg4可以以1 mg/kg的递减剂量施用。
[0393]
表11b提供了组合给药治疗方案的给药方案,其中治疗周期1随后以目标剂量的四个另外的a7dp(即,治疗周期2),和治疗周期2随后是四个f7dp(即,治疗周期3)。在包含治疗周期2的给药方案中,在治疗周期1的第15天(即第二个a7dp的第1天)、在每个治疗周期2的第1和15天(即,每个治疗周期2的第一个a7dp的第1天和第三个a7dp的第1天)和在治疗周期3的第1和15天(即,第一个f7dp的第1天和第三个f7dp的第1天)开始每两周一次(“q2w”)以约3mg/kg的剂量施用pd
‑
1 mab 1igg4。如所示,此后可基于q2w方案以3mg/kg的其他剂量施用pd
‑
1 mab 1igg4。如上所述,pd
‑
1 mab 1igg4可以以1 mg/kg的递减剂量施用。
[0394]
[0395][0396]
≠所有剂量
±
10%
[0397]
在治疗周期1的第15天施用pd
‑
1 mab 1igg4
[0398]
**在治疗周期3的第1和15天施用pd
‑
1 mab 1igg4
[0399]
[0400][0401]
≠所有剂量
±
10%
[0402]
在治疗周期1的第15天施用pd
‑
1 mab 1 igg4
[0403]
!!在每个治疗周期2的第1和15天施用pd
‑
1 mab 1 igg4
[0404]
**在治疗周期3的第1和15天施用pd
‑
1 mab 1 igg4
[0405]
在以上提供的给药方案中,应理解,在开始给定的a7dp和/或f7dp中和/或在施用pd
‑
1 mab 1 igg4的剂量中,约1天至约3天(即,
±1‑
3天)的窗口(window)是可接受的,尤其是在第21天之后。
[0406]
如地塞米松(或等效物)的类固醇可在dart
‑
a给药之前(例如,达到30分钟之前)施用(例如,通过iv 10
‑
20 mg),在施用dart
‑
a后,随后另外的剂量(例如,在开始dart
‑
a给药后12小时通过iv 4 mg)。如地塞米松(或等效物)的类固醇可在改变dart
‑
a给药之前(例如,达到30分钟之前)施用(例如,通过iv 10
‑
20 mg),在施用改变的dart
‑
a剂量后,随后另外的剂量(例如,在开始dart
‑
a给药后12小时通过iv 4 mg)。
[0407]
如果临床上表明,则使用节制激素的抗细胞因子,尤其是抗il
‑
6/抗il
‑
6r(托珠单抗或西妥昔单抗)疗法来控制crs症状。疾病状况通过iwg标准评估。具体地,可以施用托珠单抗(通过iv 4
‑
8 mg/kg)。
[0408]
可用于控制crs症状,尤其是抗il
‑
6/抗il
‑
6r治疗(例如,托珠单抗)难治的crs的其他试剂,包括进一步施用皮质类固醇(例如,地塞米松或等效物),这种施用可以以更高剂量(例如,30 mg或更大的地塞米松的剂量)。可以采用抗
‑
tnfα剂,如依那西普(或等效物)。具体地,可施用依那西普(例如,通过皮下注射(sc)50 mg)。
[0409]
如以上提供的,特别地考虑了能够结合pd
‑
1或pd
‑
1的天然配体的其他分子(例如,派姆单抗、尼鲁单抗、阿维鲁单抗、度伐单抗等)可与dart
‑
a组合施用。具体地,这种分子可以与dart
‑
a组合施用,其中dart
‑
a根据表10a
‑
10b或表11a
‑
11b施用,并且能够结合pd
‑
1或pd
‑
1的天然配体的分子根据护理标准或批准的给药方案施用(例如,派姆单抗的批准的给药方案为200mg的静脉内施用,q3w)。
[0410]
本说明书中提及的所有出版物和专利以相同的程度通过引用并入本文,如同每个单独的出版物或专利申请被明确且单独地指出以其全部内容通过引用并入一样。尽管本发明已经结合其具体实施方式进行了描述,但是应当理解它能进一步改变,并且本技术意欲涵盖本发明的任何变化、用途或调整,其总体上遵循本发明的原理并且包括落入本发明所属领域内的已知或惯用实践内的并且可适用于前文所提出的实质特征的这种偏离。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。