1.本发明涉及一种环戊烯类化合物、其制备方法及应用。
背景技术:
2.信号传导与转录激活因子3(stat3)是stat转录因子家族中的一员,存在于细胞质中,在细胞表面受体向细胞核传递信号中起着重要的作用。在正常细胞中stat3受到严格的调控,stat3的持续激活往往与肿瘤的发生、增殖、促进血管生成和抑制细胞凋亡,并且还与抑制抗肿瘤免疫反应等致癌功能相关。所以,通过直接靶向异常激活的stat3信号通路,从而治疗人类癌症和其他人类疾病得到了医药工作者的关注。
3.通常认为,stat3 705位的酪氨酸磷酸化使stat3激活,两个磷酸化的stat3单体通过相互的p-tyr705-sh2作用形成二聚体,最后进入到细胞核内完成细胞核靶基因的转录。因此,设计靶向stat3sh2结构域的抑制剂可以阻止stat3的二聚和转录活性。
4.在过去的二十年中,药物研发人员在开发stat3 sh2结构域的小分子抑制剂方面做了大量的工作(stattic,sta-21,s31-201和bp-1-102等)。然而,化合物母核结构都是基于早期开发的几个母核结构进行改造得到的,很多化合物虽然到达临床研究阶段,却显示出非常有限的临床活性。其主要原因可能是,设计的针对stat3 sh2结构域的抑制剂在抑制stat3 tyr705位点的磷酸化的同时,还会影响ser727的磷酸化水平和lys685的乙酰化水平。另一个原因是,stat3和其他stat家族成员具有高度结构同源的sh2结构域,因此很难获得高选择性的stat3抑制剂。
5.天然产物及其衍生物在药物研发中具有非常重要的作用,并且被广泛用于治疗各种疾病。在过去的二十年中,近一半被批准上市的新药都是基于天然产物或研究开发的。
6.白桦酯酸(betulinic acid)是一种从白桦树皮中分离得到的五环三萜类化合物,最初报道是一种黑色素瘤特异性细胞毒性物质。此外,过去十年的大量研究表明,白桦酯酸可诱导甲状腺、多发性骨髓瘤、结肠癌、肺癌、乳腺癌以及白血病细胞凋亡。pandey等[118]发现白桦酯酸不仅可以抑制stat3(信号传导与活化转录因子3,signal transducers and activators of transcription)、src、jak1和jak2,而且可以诱导蛋白酪氨酸磷酸化酶shp-1的表达。白桦酯酸还下调了stat3调控基因产物的表达,如bcl-xl、bcl-2、cyclin d1和survivin,还能通过增加g1期细胞周期阻滞和增加caspase-3诱导的parp裂解诱导凋亡。此外,白桦酯酸能促进沙利度胺(从10%提高到55%)和硼替佐米(从5%提高到70%)诱导的骨髓瘤细胞凋亡。综上,白桦酯酸通过上调shp-1表达,从而抑制stat3的活化,提示其具有潜在防止癌症发生的效果。
[0007]
没药甾酮(guggulsterone)是一种来源于木糖酵素的物质,用于治疗肥胖、糖尿病、高脂血症、动脉粥样硬化和骨关节炎等。由于其能够抑制多种人类肿瘤细胞的增殖,包括白血病、头颈部癌、多发性骨髓瘤、肺癌、黑色素瘤、乳腺癌、前列腺癌和卵巢癌,所以被证明具有强大的抗癌潜力。ahn等人的研究进一步证明了没药甾酮对多发性骨髓瘤细胞中stat3通路活化的影响,发现没药甾酮能够剂量和时间依赖性的方式抑制u266细胞stat3的
或-n(r
20
)-c(=o)-n(r
19
)-n(r
18
)-c(=o)-;(右侧与环a相连)
[0019]
r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
和r
20
独立地为h或c
1-c4的烷基;
[0020]
r1为h、c
1-c6的烷基、被一个或多个取代基r
a
取代的c
1-c6的烷基、c
3-c
10
的环烷基、被一个或多个取代基r
b
取代的c
3-c
10
的环烷基、c
6-c
10
的芳基、被一个或多个取代基r
c
取代的c
6-c
10
的芳基、5-10元杂环烷基、被一个或多个取代基r
d
取代的5-10元杂环烷基、5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基;所述的5-10元杂环烷基和被一个或多个取代基r
d
取代的5-10元杂环烷基里的5-10元杂环烷基中,杂原子选自n、o、s、s(=o)和s(=o)2中的一种或多种,杂原子数为1-3个;所述的5-10元杂芳基和被一个或多个取代基r
e
取代的5-10元杂芳基里的5-10元杂芳基中,杂原子选自n、o和s中的一种或多种,杂原子数为1-4个;当取代基为多个时,相同或不同;
[0021]
r
a
、r
b
、r
c
、r
d
和r
e
独立地为(r
1a
r
1b
)n-c(=o)-、c
1-c6的烷基-o-、c
1-c6的烷基-c(=o)-n(r
1c
)-、或o=(当-ch
2-上h同时被取代时);
[0022]
r
1a
、r
1b
和r
1c
独立地为h或c
1-c4的烷基;
[0023]
或者,r2与r
1-l1中c或n相连,与环a上相连的原子一起形成4-7元杂环烷基;所述的4-7元杂环烷基中,杂原子选自n、o、s、s(=o)和s(=o)2中的一种或多种,杂原子数为1-3个;所述的4-7元杂环烷基任选被如下取代基取代:c
1-c4的烷基或=o;
[0024]
带“*”碳原子表示为手性碳原子,为s构型、r构型或它们的混合物。
[0025]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0026]
为例如
[0027]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0028]
环a为c
6-c
10
的芳基;例如苯基。
[0029]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0030]
环a为5-6元杂芳基,例如吡啶基。
[0031]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0032]
n为0、1或2。
[0033]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0034]
r
2a
和r
2b
独立地为h。
[0035]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0036]
r2独立地为c
1-c6的烷基、c
1-c6的烷基-o-、c
1-c6的烷基-c(=o)-n(r
2a
)-、或c
1-c6的烷基-s(=o)
2-n(r
2b
)-;
[0037]
例如c
1-c6的烷基、c
1-c6的烷基-o-或c
1-c6的烷基-c(=o)-n(r
2a
)-;
[0038]
再例如c
1-c6的烷基-c(=o)-n(r
2a
)-。
[0039]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0040]
环a上,r
1-l1位于的邻位、间位或对位;例如间位或对位。
[0041]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0042]
l1为-n(r
11
)-c(=o)-n(r
10
)-、-c(=o)-n(r
12
)-、-n(r
13
)-c(=o)-、-c(=o)-n(r
14
)-(c
1-c4亚烷基)-、-o-c(=o)-(ch2)-n(r
15
)-、-c(=o)-n(r
16
)-n(r
17
)-c(=o)-或-n(r
20
)-c(=o)-n(r
19
)-n(r
18
)-c(=o)-;
[0043]
例如-n(r
11
)-c(=o)-n(r
10
)-、-n(r
13
)-c(=o)-或-c(=o)-n(r
14
)-(c
1-c4亚烷基)-;
[0044]
再例如-n(r
13
)-c(=o)-。(右侧与环a相连)
[0045]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0046]
r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
和r
20
独立地为h。
[0047]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0048]
r1为h、c
1-c6的烷基、被一个或多个取代基r
a
取代的c
1-c6的烷基、c
3-c
10
的环烷基、被一个或多个取代基r
b
取代的c
3-c
10
的环烷基、c
6-c
10
的芳基、被一个或多个取代基r
c
取代的c
6-c
10
的芳基、5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基;
[0049]
例如c
1-c6的烷基、被一个或多个取代基r
a
取代的c
1-c6的烷基、5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基;
[0050]
又例如c
1-c6的烷基、或被一个或多个取代基r
e
取代的5-10元杂芳基;
[0051]
再例如被一个或多个取代基r
e
取代的5-10元杂芳基。
[0052]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0053]
r
a
、r
b
、r
c
、r
d
和r
e
独立地为(r
1a
r
1b
)n-c(=o)-、c
1-c6的烷基-o-、或c
1-c6的烷基-c(=o)-n(r
1c
)-;
[0054]
例如(r
1a
r
1b
)n-c(=o)-或c
1-c6的烷基-o-;
[0055]
再例如(r
1a
r
1b
)n-c(=o)-。
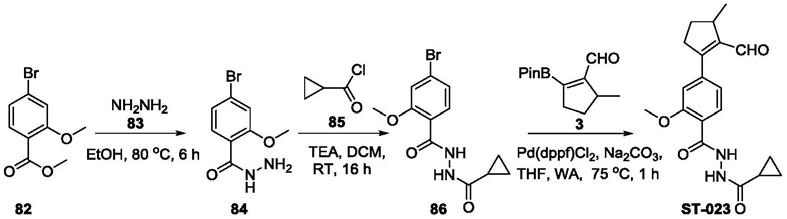
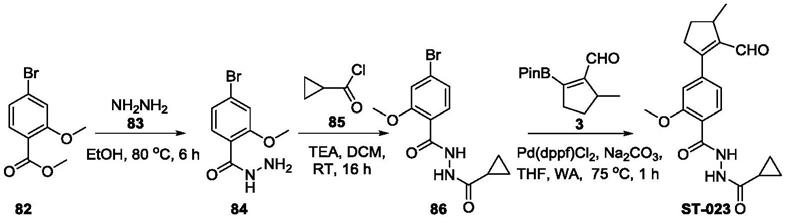
[0056]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0057]
环a为c
6-c
10
的芳基或5-6元杂芳基;
[0058]
n为0、1或2;
[0059]
r2独立地为c
1-c6的烷基、c
1-c6的烷基-o-或c
1-c6的烷基-c(=o)-n(r
2a
)-;
[0060]
l1为-n(r
11
)-c(=o)-n(r
10
)-、-n(r
13
)-c(=o)-或-c(=o)-n(r
14
)-(c
1-c4亚烷基)-;(右侧与环a相连)
[0061]
r1为c
1-c6的烷基、被一个或多个取代基r
a
取代的c
1-c6的烷基、c
3-c
10
的环烷基、被一个或多个取代基r
b
取代的c
3-c
10
的环烷基、c
6-c
10
的芳基、被一个或多个取代基r
c
取代的c
6-c
10
的芳基、5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基;
[0062]
r
a
、r
b
、r
c
和r
e
独立地为(r
1a
r
1b
)n-c(=o)-或c
1-c6的烷基-o-(例如(r
1a
r
1b
)n-c(=o)-);
[0063]
较佳地,环a为c
6-c
10
的芳基;
[0064]
n为0或1(例如0);
[0065]
r2独立地为c
1-c6的烷基-c(=o)-n(r
2a
)-;
[0066]
l1为-n(r
13
)-c(=o)-;
[0067]
r1为c
1-c6的烷基、被一个或多个取代基r
a
取代的c
1-c6的烷基、5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基(例如c
1-c6的烷基、或被一个或多个取代基r
e
取代的5-10元杂芳基;再例如被一个或多个取代基r
e
取代的5-10元杂芳基);
[0068]
例如,r
2a
为h;
[0069]
和/或,r
10
、r
11
、r
13
和r
14
独立地为h;
[0070]
和/或,r
1a
和r
1b
独立地为h。
[0071]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0072]
环a为c
6-c
10
的芳基或5-6元杂芳基;
[0073]
n为0、1或2;
[0074]
r2独立地为c
1-c6的烷基、c
1-c6的烷基-o-、c
1-c6的烷基-c(=o)-n(r
2a
)-、或c
1-c6的烷基-s(=o)
2-n(r
2b
)-;
[0075]
l1为-n(r
11
)-c(=o)-n(r
10
)-、-c(=o)-n(r
12
)-、-n(r
13
)-c(=o)-、-c(=o)-n(r
14
)-(c
1-c4亚烷基)-、-o-c(=o)-(ch2)-n(r
15
)-、-c(=o)-n(r
16
)-n(r
17
)-c(=o)-或-n(r
20
)-c(=o)-n(r
19
)-n(r
18
)-c(=o)-;(右侧与环a相连)
[0076]
r1为h、c
1-c6的烷基、被一个或多个取代基r
a
取代的c
1-c6的烷基、c
3-c
10
的环烷基、被一个或多个取代基r
b
取代的c
3-c
10
的环烷基、c
6-c
10
的芳基、被一个或多个取代基r
c
取代的c
6-c
10
的芳基、5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基(例如c
1-c6的烷基、c
3-c
10
的环烷基、5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基;再例如被一个或多个取代基r
e
取代的5-10元杂芳基);
[0077]
r
a
、r
b
、r
c
、r
d
和r
e
独立地为(r
1a
r
1b
)n-c(=o)-、c
1-c6的烷基-o-、或c
1-c6的烷基-c(=o)-n(r
1c
)-;
[0078]
较佳地,
[0079]
环a为c
6-c
10
的芳基;
[0080]
n为0;
[0081]
l1为-n(r
13
)-c(=o)-;
[0082]
r1为被一个或多个取代基r
e
取代的5-10元杂芳基;
[0083]
r
e
独立地为(r
1a
r
1b
)n-c(=o)-;
[0084]
例如,r
2a
和r
2b
独立地为h;
[0085]
和/或,r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
和r
20
独立地为h;
[0086]
和/或,r
1a
和r
1b
独立地为h。
[0087]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0088]
当环a为c
6-c
10
的芳基时,所述的c
6-c
10
的芳基为苯基或萘基;又例如苯基。
[0089]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0090]
当环a为5-6元杂芳基时,所述的5-6元杂芳基为吡啶基(例如)或呋喃基(例如),a端表示与相连。
[0091]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0092]
当r2独立地为c
1-c6的烷基、c
1-c6的烷基-o-、c
1-c6的烷基-c(=o)-n(r
2a
)-、c
1-c6的烷基-o-c(=o)-、或c
1-c6的烷基-s(=o)
2-n(r
2b
)-时,所述的c
1-c6的烷基、c
1-c6的烷基-o-、c
1-c6的烷基-c(=o)-n(r
2a
)-、c
1-c6的烷基-o-c(=o)-、和c
1-c6的烷基-s(=o)
2-n(r
2b
)-里的c
1-c6的烷基独立地为c
1-c4的烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0093]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0094]
当r
2a
和r
2b
独立地为c
1-c4的烷基时,所述的c
1-c4的烷基独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0095]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0096]
当r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
和r
20
独立地为c
1-c4的烷基时,所述的c
1-c4的烷基独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0097]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0098]
当r1为c
1-c6的烷基、被一个或多个取代基r
a
取代的c
1-c6的烷基时,所述的c
1-c6的烷基、和被一个或多个取代基r
a
取代的c
1-c6的烷基里的c
1-c6的烷基独立地为c
1-c4的烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基、正丙基或正丁基。
[0099]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0100]
当r1为c
3-c
10
的环烷基、被一个或多个取代基r
b
取代的c
3-c
10
的环烷基时,所述的c
3-c
10
的环烷基、和被一个或多个取代基r
b
取代的c
3-c
10
的环烷基里的c
3-c
10
的环烷基为c
3-c7的环烷基,例如环丙基、环丁基、环戊基或环己基;例如环丙基或环丁基。
[0101]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基
团如下定义(未提及的基团同本技术任一方案所述),
[0102]
当r1为c
6-c
10
的芳基、被一个或多个取代基r
c
取代的c
6-c
10
的芳基时,所述的c
6-c
10
的芳基、被一个或多个取代基r
c
取代的c
6-c
10
的芳基里的c
6-c
10
的芳基独立地为苯基或萘基,例如苯基。
[0103]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0104]
当r1为5-10元杂环烷基、被一个或多个取代基r
d
取代的5-10元杂环烷基时,所述的5-10元杂环烷基、和被一个或多个取代基r
d
取代的5-10元杂环烷基里的5-10元杂环烷基为哌嗪基(又例如)、哌啶基(又例如)或吡咯烷基(又例如再例如再例如)。
[0105]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0106]
当r1为5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基时,所述的5-10元杂芳基、或被一个或多个取代基r
e
取代的5-10元杂芳基里的5-10元杂芳基为5-6元杂芳基,其中,杂原子选自n、o和s中的一种或多种,杂原子数为1-2个;例如噻吩基(又例如)、吡唑基(又例如1h-吡唑基,再例如)或异恶唑基(例如)。
[0107]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0108]
当r
a
、r
b
、r
c
、r
d
和r
e
独立地为c
1-c6的烷基-o-、c
1-c6的烷基-c(=o)-n(r
1c
)-时,所述的c
1-c6的烷基-o-、和c
1-c6的烷基-c(=o)-n(r
1c
)-里的c
1-c6的烷基独立地为c
1-c4的烷基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基或正丁基。
[0109]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0110]
当r
1a
、r
1b
和r
1c
独立地为c
1-c4的烷基时,所述的c
1-c4的烷基独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0111]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0112]
当r2与r
1-l1中c或n相连,与环a上相连的原子一起形成4-7元杂环烷基时,所述的4-7元杂环烷基为7元杂环烷基,杂原子选自n、o和s中的一种或多种,杂原子数为1-2个;例如b段表示与环a并环连接。
[0113]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0114]
当r2与r
1-l1中c或n相连,与环a上相连的原子一起形成4-7元杂环烷基、所述的4-7
元杂环烷基任选被c
1-c4的烷基取代时,所述的c
1-c4的烷基独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0115]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0116]
r2独立地为甲基、甲基-o-、-c(=o)-o-ch3、ch
3-c(=o)-nh-或ch
3-s(=o)
2-nh-。
[0117]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0118]
为苯基、为苯基、a端与相连。
[0119]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0120]
l1为-nh-c(=o)-nh-、-c(=o)-nh-、-nh-c(=o)-、-c(=o)-nh-(ch2)-、-o-c(=o)-(ch2)-nh-、-c(=o)-nh-nh-c(=o)-或-nh-c(=o)-nh-nh-c(=o)-。
[0121]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0122]
r
a
、r
b
、r
c
、r
d
和r
e
独立地为正丁基-nh-c(=o)-、nh
2-c(=o)-、甲基-o-、甲基-c(=o)-nh-、ho-c(=o)-、或o=。
[0123]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0124]
r1为h、甲基、正丙基、正丁基、环丙基、
[0125]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0126]
r
1-l1为为为
[0127]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物中的某些基团如下定义(未提及的基团同本技术任一方案所述),
[0128]
当r2与r
1-l1中c或n相连,与环a上相连的原子一起形成4-7元杂环烷基时,所述的4-7元杂环烷基为b段表示与环a并环连接。
[0129]
在本发明某些优选实施方案中,所述的如式i所示的环戊烯类化合物选自如下化合物,
[0130][0131][0132]
本发明中,带“*”碳原子表示当为手性碳原子时,为s构型、r构型或它们的混合物。
[0133]
本发明中,所述的如式i所示的环戊烯类化合物或其药学上可接受的盐具有一个或多个手性碳原子,因此可以分离得到光学纯度异构体,例如纯的对映异构体,或者外消旋体,或者混合异构体。可以通过本领域的分离方法来获得纯的单一异构体,如手性结晶成
盐,或者手性制备柱分离得到。
[0134]
本发明中,所述的如式i所示的环戊烯类化合物或其药学上可接受的盐如存在立体异构体,则可以以单一的立体异构体或它们的混合物(例如外消旋体)的形式存在。术语“立体异构体”是指顺反异构体或旋光异构体。这些立体异构体可以通过不对称合成方法或手性分离法(包括但不限于薄层色谱、旋转色谱、柱色谱、气相色谱、高压液相色谱等)分离、纯化及富集,还可以通过与其它手性化合物成键(化学结合等)或成盐(物理结合等)等方式进行手性拆分获得。术语“单一的立体异构体”是指本发明化合物的一种立体异构体相对于该化合物的所有立体异构体的质量含量不低于95%。
[0135]
本发明中,所述的如式i所示的环戊烯类化合物或其药学上可接受的盐可通过包括与化学领域公知方法相似的方法合成,其步骤和条件可参考本领域类似反应的步骤和条件,特别是根据本文说明进行合成。起始原料通常是来自商业来源,例如aldrich或可使用本领域技术人员公知的方法(通过scifinder、reaxys联机数据库得到)容易地制备。
[0136]
本发明中,所述的如式i所示的环戊烯类化合物或其药学上可接受的盐,也可以通过已制备得到的所述的如式i所示的环戊烯类化合物或其药学上可接受的盐,采用本领域常规方法,经外周修饰进而得到其他所述的如式i所示的环戊烯类化合物或其药学上可接受的盐。
[0137]
一般地,本发明的化合物可以通过本发明所描述的方法制备得到,除非有进一步的说明,其中取代基的定义如式i所示。
[0138]
本发明中,所述的如式i所示的环戊烯类化合物的制备方法,其包括如下步骤:在溶剂中,在碱和金属催化剂存在下,将如式ii所示的化合物与如式iii所示的硼化合物进行如下所示的偶联反应,得到所述的如式i所示的环戊烯类化合物即可;
[0139][0140]
其中,r1、r2、n和l1的定义均同上所述;[b]为r
a1
和r
b1
独立地为h或c
1-c6烷基,或者,r
a1
和r
b1
相连,与一起共同形成未取代或取代的5~6元杂环烷基;所述的取代是指被一个或多个如下取代基取代:c1~c6烷基或苯基;当取代基为多个时,所述的取代基相同或不同。
[0141]
所述的偶联反应的条件和操作可为本领域该类偶联反应中常规的条件和操作。
[0142]
用于制备如式i所示的环戊烯类化合物或其药学上可接受的盐的必要原料或试剂可以商购获得,或者通过本领域已知的合成方法制备。如下实验部分所描述的方法,可以制备游离碱或者其加酸所成盐的本发明的化合物。术语药学上可接受的盐指的是本文所定义的药学上可接受的盐,并且具有母体化合物所有的作用。药学上可接受的盐可以通过在有机碱的合适的有机溶剂中加入相应的酸,根据常规方法处理来制备药学上可接受的盐。
[0143]
成盐实例包括:对于碱加成盐,有可能通过在水性介质中使用碱金属或碱土金属氢氧化物或醇盐(例如乙醇盐或甲醇盐)或适当碱性有机胺(例如二乙醇胺、胆碱或葡甲胺)处理具有适当酸性质子的本发明化合物来制备碱金属(如钠、钾或锂)或碱土金属(如铝、镁、钙、锌或铋)的盐。
[0144]
或者,对于酸加成盐,与无机酸成盐,如盐酸、氢溴酸、硫酸、硝酸、磷酸;和有机酸所形成的盐,如醋酸、苯磺酸、苯甲酸、樟脑磺酸、柃檬酸、乙磺酸、富马酸、葡庚糖酸、谷氨酸、乙醇酸、羟基萘甲酸、2-羟基乙磺酸、乳酸、马来酸、苹果酸、草酸、丙酮酸、丙二酸、扁桃酸、甲磺酸、黏糠酸、2-萘磺酸、丙酸、水杨酸、琥铂酸、酒石酸、柠檬酸、肉桂酸、对甲苯磺酸或三甲基乙酸。
[0145]
本发明提供了一种药物组合物,其包括如上所述的如式i所示的环戊烯类化合物或其药学上可接受的盐、和一种或多种药学上可接受的载体。在所述的药物组合物中,所述的如式i所示的环戊烯类化合物或其药学上可接受的盐的用量可为治疗有效量。
[0146]
所述的药学上可接受的载体(药用辅料)可为药物生产领域中广泛采用的那些辅料。辅料主要用于提供一个安全、稳定和功能性的药物组合物,还可以提供方法,使受试者接受给药后活性成分以所期望速率溶出,或促进受试者接受组合物给药后活性成分得到有效吸收。所述的药用辅料可以是惰性填充剂,或者提供某种功能,例如稳定该组合物的整体ph值或防止组合物活性成分的降解。所述的药用辅料可以包括下列辅料中的一种或多种:粘合剂、助悬剂、乳化剂、稀释剂、填充剂、成粒剂、胶粘剂、崩解剂、润滑剂、抗粘着剂、助流剂、润湿剂、胶凝剂、吸收延迟剂、溶解抑制剂、增强剂、吸附剂、缓冲剂、螯合剂、防腐剂、着色剂、矫味剂和甜味剂。
[0147]
本发明的药物组合物可根据公开的内容使用本领域技术人员已知的任何方法来制备。例如,常规混合、溶解、造粒、乳化、磨细、包封、包埋或冻干工艺。
[0148]
本发明所述的药物组合物可以任何形式给药,包括注射(静脉内)、粘膜、口服(固体和液体制剂)、吸入、眼部、直肠、局部或胃肠外(输注、注射、植入、皮下、静脉内、动脉内、肌内)给药。本发明的药物组合物还可以是控释或延迟释放剂型(例如脂质体或微球)。固体口服制剂的实例包括但不限于粉末、胶囊、囊片、软胶囊剂和片剂。口服或粘膜给药的液体制剂实例包括但不限于悬浮液、乳液、酏剂和溶液。局部用制剂的实例包括但不限于乳剂、凝胶剂、软膏剂、乳膏剂、贴剂、糊剂、泡沫剂、洗剂、滴剂或血清制剂。胃肠外给药的制剂实例包括但不限于注射用溶液、可以溶解或悬浮在药学上可接受载体中的干制剂、注射用悬浮液和注射用乳剂。所述的药物组合物的其它合适制剂的实例包括但不限于滴眼液和其他眼科制剂;气雾剂:如鼻腔喷雾剂或吸入剂;适于胃肠外给药的液体剂型;栓剂以及锭剂。
[0149]
本发明还提供了一种如上所述的如式i所示的环戊烯类化合物或其药学上可接受的盐、或如上所述的药物组合物在制备stat3抑制剂中的应用。
[0150]
在所述的应用中,所述的stat3抑制剂可用于哺乳动物生物体内;也可用于生物体外,主要作为实验用途,例如:作为标准样或对照样提供比对,或按照本领域常规方法制成试剂盒,为stat3的抑制效果提供快速检测。
[0151]
本发明还提供了一种所述的如式i所示的环戊烯类化合物或其药学上可接受的盐或者如上所述的药物组合物在制备药物中的应用。所述的药物可为用于预防和/或治疗细胞增殖性疾病;和/或,所述的药物可为用于预防和/或治疗与stat3相关的疾病或病症的药
物。
[0152]
本发明还提供了一种所述的如式i所示的环戊烯类化合物或其药学上可接受的盐或者如上所述的药物组合物在制备用于预防和/或治疗与stat3相关的疾病或病症的药物中的应用。
[0153]
所述的与stat3相关疾病或病症可为细胞增殖性疾病。所述的药物可通过调节stat3表达和/或活性实现预防和/或治疗细胞增殖性疾病。
[0154]
如上所述的细胞增殖性疾病,包括白血病、头颈部癌、多发性骨髓瘤、肺癌、黑色素瘤、乳腺癌、前列腺癌和卵巢癌等癌症;
[0155]
所述的预防和/或治疗与stat3相关的疾病或病症的药物和所述的预防和/或治疗细胞增殖性疾病的药物优选对人乳腺癌细胞株mda-mb-231,人前列腺癌细胞株pc-3和人前列腺癌细胞株du-145中的一种或多种具有抑制活性的药物。所述的对人乳腺癌细胞株mda-mb-231具有抑制活性的药物为抗乳腺癌的药物。所述的对人前列腺癌细胞株pc-3和/或人前列腺癌细胞株du-145具有抑制活性的药物为抗人宫颈癌的药物。
[0156]
本发明还提供了一种了预防和/或治疗细胞增殖性疾病,例如癌症(例如stat3相关的)的方法,所述方法包括向有需要的个体,如人,施用治疗有效量的所述的如式i所示的环戊烯类化合物或其药学上可接受的盐或者如上所述的药物组合物。
[0157]
本文还提供了一种在体外或体内抑制细胞增殖或癌症的方法,所述方法包括使细胞与有效量的本文所限定的所述的如式i所示的环戊烯类化合物或其药学上可接受的盐或者如上所述的药物组合物接触。
[0158]
当用作药物时,所述的如式i所示的环戊烯类化合物或其药学上可接受的盐可以以药物组合物的形式给药。这些组合物可根据药学领域熟知的方法制备,可以各种途径施用,视需要局部或系统性治疗和要治疗的区域而定。给予可以是局部(包括表皮和透皮,眼部和粘膜,包括鼻内,阴道和直肠递送),肺(例如,通过粉末或气溶胶吸入或吹入,包括通过喷雾器;气管内或鼻内),口服或胃肠外给予形式。口服给药可以包括配制为每日一次或每日两次(bid)给药的剂型。胃肠外给药包括静脉内、动脉内、皮下、腹膜内肌肉内或注射或输液;或颅内如鞘内或心室内给药。胃肠外给药可以单次推注剂量形式,或可以是通过连续灌注泵。外用给药的药物组合物和制剂可包括透皮贴片、油膏剂、乳液、软膏剂、凝胶、滴剂、栓剂、喷剂、液体和粉末。常规药学载体、水、粉末或油状基底、增稠剂等可能是必须或需要的。
[0159]
如本文所用,术语“治疗”是指治疗性或缓解性措施。有益的或期望的临床结果包括但不限于:全部或部分减轻与疾病或紊乱或病症有关的症状,减小疾病程度,稳定(即不恶化)疾病状态,延迟或减缓疾病进展,缓解或减轻疾病状态(例如,疾病的一种或多种症状),以及可检测或不可检测的缓解(无论是部分还是全部)。“治疗”也可以指与不接受治疗的期望存活相比延长生存期。
[0160]
在某些实施方式中,所述的如式i所示的环戊烯类化合物或其药学上可接受的盐或者如上所述的药物组合物可用于预防如本文所限定的疾病和病症(例如,自身免疫性疾病、神经疾病和癌症)。本文使用的术语“预防”意指全部或部分预防本文所述的疾病或病症或其症状的发作、复发或扩散。
[0161]
术语“药用辅料”或“赋形剂”是指药学上可接受的化学物质,例如药学领域的普通技术人员已知的用于帮助给予药用的试剂。它是可以用于制备药物组分的化合物,通常是
安全的、无毒的,且是生物学或者其它方面所不可期望的,其包括对于兽用和人用药物可接受的赋形剂。通常的赋形剂包括粘合剂、表面活性剂、稀释剂、崩解剂和润滑剂。
[0162]
除非另外说明,应当应用本文所使用的下列定义。出于本发明的目的,化学元素与元素周期表cas版,和《化学和物理手册》,第75版,1994一致。此外,有机化学一般原理可参考"organic chemistry",thomas sorrell,university science books,sausalito:1999,和"march's advanced organic chemistry”by michael b.smith and jerry march,john wiley&sons,new york:2007中的描述,其全部内容通过引用并入本文。
[0163]
在本说明书中,可由本领域技术人员选择基团及其取代基以提供稳定的结构部分和化合物。当通过从左向右书写的常规化学式描述取代基时,该取代基也同样包括从右向左书写结构式时所得到的在化学上等同的取代基。
[0164]
在本文中定义的某些化学基团前面通过简化符号来表示该基团中存在的碳原子总数。例如,c
1-c4烷基是指具有总共1、2、3或4个碳原子的如下文所定义的烷基。简化符号中的碳原子总数不包括可能存在于所述基团的取代基中的碳。
[0165]
在本文中,取代基中定义的数值范围如0至4、1-4、1至3等表明该范围内的整数,如1-6为1、2、3、4、5、6。
[0166]
除前述以外,当用于本技术的说明书及权利要求书中时,除非另外特别指明,否则以下术语具有如下所示的含义。
[0167]
术语“一种(个)或多种(个)”或“一种(个)或两种(个)以上”是指即1、2、3、4、5、6、7、8、9或更多。
[0168]
术语“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0169]
术语“被取代的”是指特定原子上的任意一个或多个氢原子被取代基取代,包括重氢和氢的变体,只要特定原子的价态是正常的并且取代后的化合物是稳定的。
[0170]
一般而言,术语“取代的”表示所给结构中的一个或多个氢原子被具体取代基所取代。进一步地,当该基团被1个以上所述取代基取代时,所述取代基之间是相互独立,即,所述的1个以上的取代基可以是互不相同的,也可以是相同的。除非其他方面表明,一个取代基团可以在被取代基团的各个可取代的位置进行取代。当所给出的结构式中不只一个位置能被选自具体基团的一个或多个取代基所取代,那么取代基可以相同或不同地在各个位置取代。
[0171]
在本说明书的各部分,本发明公开化合物的取代基按照基团种类或范围公开。特别指出,本发明包括这些基团种类和范围的各个成员的每一个独立的次级组合。术语“c
x-c
y
烷基"是指含有x至y个碳原子的直链或支链饱和烃。例如,术语“c
1-c6烷基”或“c
1-6
烷基”特别指独立公开的甲基、乙基、c3烷基、c4烷基、c5烷基和c6烷基;“c
1-4
烷基”特指独立公开的甲基、乙基、c3烷基(即丙基,包括正丙基和异丙基)、c4烷基(即丁基,包括正丁基、异丁基、仲丁基和叔丁基)。
[0172]
术语“卤素”选自于f,cl,br或i,尤其指f或cl。
[0173]
术语“烷氧基”是指基团-o-r
x
,其中,r
x
为如上文所定义的烷基。
[0174]
在本技术中,作为基团或是其它基团的一部分(例如用在卤素取代的烷基等基团中),术语“烷基”意指包括具有指定碳原子数目的支链和直链的饱和脂族烃基;,比如含有1
至6个碳原子的直链或支链饱和烃链;又例如,c
1-c4的烷基。如在“c
1-c6烷基”中定义为包括在直链或者支链结构中具有1、2、3、4、5、或者6个碳原子的基团。其中,丙基为c3烷基(包括同分异构体,例如正丙基或异丙基);丁基为c4烷基(包括同分异构体,例如正丁基、仲丁基、异丁基或叔丁基);戊基为c5烷基(包括同分异构体,例如正戊基、1-甲基-丁基、1-乙基-丙基、2-甲基-1-丁基、3-甲基-1-丁基、异戊基、叔戊基或新戊基);己基为c6烷基(包括同分异构体,例如正己基、1-乙基-2-甲基丙基、1,1,2-三甲基丙基、1,1-二甲基丁基、1,2-二甲基丁基、2,2-二甲基丁基、1,3-二甲基丁基、2-乙基丁基、2-甲基戊基、3-甲基戊基、4-甲基戊基、2,3-二甲基丁基)。此外,庚基为c7烷基(包括同分异构体,例如正庚基、2,4-二甲基戊基、2,2-二甲基戊基、3,3-二甲基戊基、2-乙基戊基、3-乙基戊基)。辛基为c8烷基(包括同分异构体,例如正辛基、2,3-二甲基己基、2,4-二甲基己基、2,5-二甲基己基、2,2-二甲基己基、3,3-二甲基己基、4,4-二甲基己基、2-乙基己基、3-乙基己基、4-乙基己基、2-甲基-2-乙基戊基、2-甲基-3-乙基戊基)。壬基为c9烷基(包括同分异构体,例如正壬基、2-甲基-2-乙基己基、2-甲基-3-乙基己基、2,2-二乙基戊基)。奎基为c
10
烷基(包括同分异构体,例如正奎基、3,3-二乙基己基、2,2-二乙基己基)。在某一实施方案中,所述的“烷基”优选含有1至6个碳原子的直链或支链的烷基。在某一实施方案中,所述的“烷基”是指c
1-c6烷基。在某一实施方案中,所述的“烷基”是指c
1-c4烷基。
[0175]
本文所用术语“部分”、“结构部分”、“化学部分”、“基团”、“化学基团”是指分子中的特定片段或官能团。化学部分通常被认为是嵌入或附加到分子上的化学实体。
[0176]
当所列举的取代基中没有指明其通过哪一个原子连接到化学结构通式中包括但未具体提及的化合物时,这种取代基可以通过其任何原子相键合。取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
[0177]
当所列举的基团中没有明确指明其具有取代基时,这种基团仅指未被取代。例如当“c
1-c4烷基”前没有“取代或未取代的”的限定时,仅指“c
1-c4烷基”本身或“未取代的c
1-c4烷基”。
[0178]
在本发明的各部分,描述了连接取代基。当该结构清楚地需要连接基团时,针对该基团所列举的马库什变量应理解为连接基团。例如,如果该结构需要连接基团并且针对该变量的马库什基团定义列举了“烷基”,则应该理解,该“烷基”代表连接的亚烷基基团。
[0179]
在一些具体的结构中,当烷基基团清楚地表示为连接基团时,则该烷基基团代表连接的亚烷基基团,例如,基团“卤代-c
1-c4烷基”中的c
1-c4烷基应当理解为c
1-c4亚烷基。
[0180]
术语“亚烷基”表示从饱和的直链或支链烃基中去掉两个氢原子所得到的饱和的二价烃基基团。亚烷基基团的实例包括亚甲基(-ch
2-),亚乙基{包括-ch2ch
2-或-ch(ch3)-},亚异丙基{包括-ch(ch3)ch
2-或-c(ch3)
2-}等等。
[0181]
术语“环烷基”,指仅由碳原子和氢原子组成的饱和的单环或者多环碳环取代基,且其可经由任何适宜的碳原子通过单键与分子的其余部分连接;当为多环时,可为并环连接、桥环连接或螺环连接(即,碳原子上的两个偕氢被亚烷基取代)的并环体系、桥环体系或螺环体系。在某一方案中,典型的单环环烷基,如环丙基、环丁基、环戊基、环己基或环庚基。
[0182]
术语“杂环烷基”,指具有杂原子的饱和的环状基团,含1个或多个独立选自n、o、s、s(=o)和s(=o)2的杂原子,其余为碳组成的稳定的3-10元饱和杂环系统的基团。除非本说明书中另外特别指明,否则杂环烷基基团可以是单环的(“单环的杂环烷基”),或者是双环、
三环或更多环的环体系,其可包括并环的(稠合的)、桥联的(桥环的)或螺的环系统(例如二环系统(“二环的杂环烷基”)。杂环烷基二环的环系统可以在一个或两个环中包括一个或多个杂原子;并且是饱和的。示例性3-元杂环基基团包括但不限于,氮杂环丙基、环氧乙烷基以及硫杂环丙烷基,或者其立体异构体;示例性4-元杂环基基团包括但不限于,氮杂环丁烷基,环氧丙烷基,硫杂环丁烷基,或者其同分异构体和立体异构体;示例性5-元杂环基基团包括但不限于,四氢呋喃基,四氢噻吩基,吡咯烷基,噻唑烷基,异噻唑烷基,噁唑烷基,异噁唑烷基,咪唑烷基,吡唑烷基,二氧戊环基,氧杂硫呋喃基,二硫呋喃基,或者其同分异构体和立体异构体。示例性6-元杂环基基团包括但不限于,哌啶基,四氢吡喃基,硫化环戊烷基,吗啉基,硫代吗啉基,二噻烷基,二噁烷基,哌嗪基,三嗪烷基,或者其同分异构体和立体异构体;示例性7-元杂环基基团包括但不限于,氮杂环庚烷基,氧杂环庚烷基,硫杂环庚烷基,以及二氮杂环庚基,或者其同分异构体和立体异构体。以及在某一方案中,四氢喹啉基、四氢三唑并吡嗪基或二氮杂环庚烷基。在某一方案中,典型的含1个或多个独立选自n、o和s的杂原子的5-6元单环杂环基。在某一方案中,“杂环烷基”为4-6元杂环烷基,其中杂原子选自n、o和s中的一种或多种,杂原子数为1、2或3个。
[0183]
术语“芳基”,指具有完全共轭的π电子体系的全碳芳香基团,可为单环或稠合环,通常具有6-14个碳原子,优选具有6-12个碳原子,最优选具有6个碳原子。芳基的实例包括但不限于苯基、萘基和蒽基。
[0184]
术语“杂芳基”是指含有杂原子的芳香基团,可为单环或稠合环,优选含有1-4个独立选自n、o和s的5-12元杂芳基,包括但不限于吡咯基、呋喃基、噻吩基、吲哚基、咪唑基、噁唑基、异噁唑基、吡唑基、吡啶基、嘧啶基、吡嗪基、哒嗪基、喹啉基、异喹啉基、(苯并)噁唑基、(苯并)呋喃基、(苯并)噻吩基、(苯并)噻唑基、三唑基。在某一方案中,典型地含1个或多个独立选自n、o和s的杂原子的5-6元单环杂芳基。在某一方案中,“杂芳基”为5-6元杂芳基,其中杂原子选自n、o和s中的一种或多种,杂原子数为1、2或3个。
[0185]
除非另有规定,本文使用的所有技术术语和科学术语具有要求保护主题所属领域的标准含义。倘若对于某术语存在多个定义,则以本文定义为准。
[0186]
应该理解,在本发明中使用的单数形式,如“一种”,包括复数指代,除非另有规定。此外,术语“包括”是开放性限定并非封闭式,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0187]
除非另有说明,本发明采用质谱、元素分析的传统方法,各步骤和条件可参照本领域常规的操作步骤和条件。
[0188]
除非另有指明,本发明采用分析化学、有机合成化学和光学的标准命名及标准实验室步骤和技术。在某些情况下,标准技术被用于化学合成、化学分析、发光器件性能检测。
[0189]
另外,需要说明的是,除非以其他方式明确指出,在本发明中所采用的描述方式
“…
独立地为”应做广义理解,是指所描述的各个个体之间是相互独立的,可以独立地为相同或不同的具体基团。更详细地,描述方式
“…
独立地为”既可以是指在不同基团中,相同符号之间所表达的具体选项之间互相不影响;也可以表示在相同的基团中,相同符号之间所表达的具体选项之间互相不影响。
[0190]
本领域技术人员可以理解,根据本领域中使用的惯例,本技术描述基团的结构式中所使用的是指,相应的基团通过该位点与化合物中的其它片段、基团进行连接。
[0191]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0192]
本发明所用试剂和原料均市售可得。
[0193]
本发明的积极进步效果在于:在初步活性研究中显示本发明提供的化合物具有很强的抑制肿瘤细胞增殖活性、同时对stat3选择性高;可作为一系列新型stat3抑制剂并用于制备相应的疾病的药物。本发明的化合物对人癌细胞,尤其是人乳腺癌细胞株mda-mb-231、人前列腺癌细胞株pc-3和人前列腺癌细胞株du-145,具有明显的杀伤作用而且选择性高,具有制备成为新型抗肿瘤药物的潜力,具有较好的市场化前景。
具体实施方式
[0194]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0195]
仪器与材料:1d和2d nmr在bruker avance 500核磁共振仪上测定,以tms作为内标。esi-ms在agilent lc/msd trap xct质谱仪上测定。薄层色谱(tlc)硅胶板型号为hsgf254;显色用紫外、碘缸显色;快速柱层析的硅胶为h型(颗粒度:10~40μ,ph=6~7)硅胶(100~200,300~400目,薄层色谱硅胶)。所用试剂从acros、tci、alfa、阿拉丁、百灵威和aldrich购买,其余分析纯试剂均为国药集团化学试剂有限公司生产。
[0196]
除非另有特别说明,以下所有实施例中所提到的室温(rt或rt.)是指10℃~30℃。过夜是指8-15小时,例如12小时;eq是指当量;溶剂比例如pe/ea是指体积比。
[0197]
下述实施例中,缩写解释:
[0198]
dcm:二氯甲烷;pe:石油醚;tea:三乙胺;ea:乙酸乙酯;dmf:n,n-二甲基甲酰胺;thf:四氢呋喃;pinb:频哪醇硼酸酯基;wa:水。
[0199]
实施例1化合物2-((r)-3,4-dimethyl-2,5-dioxo-2,3,4,5-tetrahydro-1h-benzo[e][1,4]diazepin-8-yl)-5-methylcyclopent-1-ene-1-carbaldehyde(st-001)的合成
[0200]
中间体的制备化合物5-methyl-2-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)cyclopent-1-ene-1-carbaldehyde(3)的合成
[0201][0202]
量取dmf(2.37ml,30.6mmol)溶解于无水二氯甲烷(35ml)中,冰浴降到0℃时,滴加pbr3(2.42ml,25.5mmol),保持0℃搅拌1小时。随后,将化合物1(1.0g,10.2mmol)溶解于无水二氯甲烷(15ml)中,缓慢滴加到上述反应液中,反应滴完后,慢慢升至室温,搅拌12小时。将反应液降温到0℃时,向反应液中加入水(50ml)淬灭,并且用nahco3固体将溶液中和中性,用二氯甲烷萃取(3
×
50ml),有机层用无水硫酸钠干燥,过滤后浓缩得粗品,并用快速柱层析(pentane/dcm=60/1)纯化,得到黄色液体2(800mg,41%)。
[0203]
称量化合物2(100mg,0.53mmol),b2pin2(400mg,1.57mmol),pd(dppf)cl2(40mg,
0.053mmol)和醋酸钾(200mg,2.12mmol)溶解于四氢呋喃(10ml)中,在氩气的保护下,将反应液温度升至75℃,搅拌1小时,得到化合物3。反应液不需要处理,可以直接用于下一步反应。
[0204][0205]
称量化合物4(1.0g,4.0mmol),化合物5(1.1g,5.6mmol),hatu(2.1g,5.6mmol)和dipea(2.0g,16.0mmol)溶解于二氯甲烷(20ml)中,在常温下搅拌1小时。将上述反应液浓缩得粗品,并用快速柱层析(pe/etoac=5/1)得到白色固体6(1.4g,90%)。esi-ms:[m h]
:387.1.
[0206]
称量化合物6(1.0g,2.6mmol),铁粉(500mg,8.9mmol)和acoh(0.5ml)溶解于etoh(10ml)中,反应液升温至80℃,搅拌6小时。将上述反应液浓缩得粗品,并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体7(0.8g,87%)。esi-ms:[m h]
:357.1.
[0207]
称量化合物7(0.8g,2.25mmol)溶解于二氯甲烷(10ml)中,缓慢滴加三氟乙酸(5ml)至反应液中,得到的混合物继续在常温下搅拌6小时。将上述反应液浓缩得粗品,并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体8(0.5g,79%)。esi-ms:[m h]
:283.0.
[0208]
称量化合物3(100mg,0.53mmol),化合物8(74mg,0.26mmol),pd(dppf)cl2(19mg,0.026mmol)和无水碳酸钠(55mg,0.52mmol)溶解于四氢呋喃(10ml)和水(1ml)中,在氩气的保护下,将反应液温度升至75℃,搅拌1小时。将上述反应液浓缩得粗品,并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-001(20mg,25%)。1hnmr(500mhz,chloroform-d)δ9.80(s,1h),8.70(s,1h),7.99(d,j=8.1hz,1h),7.24(dd,j=8.1,1.6hz,1h),7.02(d,j=1.6hz,1h),4.21(q,j=7.1hz,1h),3.28(s,1h),3.13(s,3h),3.07
–
2.98(m,1h),2.91
–
2.79(m,1h),2.29
–
2.22(m,1h),1.68
–
1.62(m,1h),1.53(s,3h),1.21(dd,j=6.9,1.1hz,3h);
13
cnmr(125mhz,chloroform-d)δ189.97,189.95,159.56,145.18,139.12,135.57,131.84,127.61,125.09,120.60,39.35,37.51,30.69,19.47,19.44;hrms(esi):m/z calcd for c
18
h
21
n2o3[m h]
:313.1547,found 313.1551.
[0209]
实施例2化合物1-3-(2-formyl-3-methylcyclopent-1-en-1-yl)-2-methylphenyl)-3-(isoxazol-3-yl)urea(st-002)的合成
[0210]
[0211]
称取(cocl)3(594mg,2.0mmol)溶解于二氯甲烷(35ml)中,冰浴降到0℃时,将化合物9(925mg,5.0mmol)和三乙胺(3.0g,30mmol)溶解于中二氯甲烷(15ml)的混合溶液滴加至上述反应液中,反应滴完后,慢慢升至室温,搅拌16小时,浓缩反应液得粗品10。粗品不需要处理,可以直接用于下一步反应。
[0212]
称取化合物11(420mg,5.0mmol)溶解于二氯甲烷(20ml)中,冰浴降到0℃时,将上述得到的化合物粗品10滴加到反应液中,反应滴完后,慢慢升至室温,搅拌2小时。将上述反应液浓缩得粗品,并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体12(20mg,25%)。esi-ms:[m h]
:296.0.
[0213]
化合物st-002的合成方法同化合物st-001,反应量按照化合物12(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-002(40mg,50%)。1hnmr(500mhz,chloroform-d)δ9.49(s,1h),8.97(s,2h),8.26(d,j=1.7hz,1h),7.89(d,j=8.1hz,1h),7.24(d,j=7.9hz,1h),6.95(d,j=7.5hz,1h),6.36(s,1h),3.01(s,1h),2.91(dd,j=16.2,8.2hz,1h),2.58
–
2.53(m,1h),2.48(s,1h),2.35(d,j=16.2hz,1h),2.24(s,3h),1.16(d,j=6.8hz,3h);
13
cnmr(125mhz,chloroform-d)δ190.29,163.03,158.48,158.10,152.64,136.51,136.07,127.28,126.25,125.24,123.03,97.87,48.88,37.90,15.19;hrms(esi):m/z calcd for c18h20n3o3[m h] :326.1499,found 326.1509.
[0214]
实施例3化合物(3r)-n1-(4-(2-formyl-3-methylcyclopent-1-en-1-yl)-2-methoxyphenyl)piperidine-1,3-dicarboxamide(st-003)的合成
[0215][0216]
化合物14的合成方法同化合物10,反应量按照化合物13(4.0mmol),得到粗品化合物14。
[0217]
16的合成方法同化合物12,反应量按照化合物15(4.0mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体16(500mg,35%)。1hnmr(500mhz,dmso-d6)δ7.87(s,1h),7.57(d,j=8.6hz,1h),7.46
–
7.36(m,1h),7.14(d,j=2.2hz,1h),7.02(dd,j=8.5,2.2hz,1h),6.92(s,1h),3.91
–
3.84(m,1h),3.80(s,3h),3.78
–
3.71(m,1h),3.02
–
2.90(m,2h),2.32
–
2.26(m,1h),1.83(dq,j=13.7,4.7hz,1h),1.65
–
1.56(m,2h),1.44
–
1.31(m,1h);
13
cnmr(125mhz,dmso-d6)δ175.48,154.90,151.26,128.95,123.60,123.28,114.83,114.44,56.62,46.94,44.49,41.90,27.90,24.50,esi-ms:[m h]
:356.0.
[0218]
化合物st-003的合成方法同化合物st-001,反应量按照化合物16(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-003(30mg,30%)。1hnmr(500mhz,chloroform-d)δ9.86(s,1h),8.13(d,j=8.3hz,1h),7.41(s,1h),6.97(dd,j=8.3,1.8hz,1h),6.83(d,j=1.8hz,1h),6.32(s,1h),5.52(s,1h),3.91(s,3h),3.73(dd,j=9.6,
5.4hz,1h),3.60
–
3.54(m,1h),3.44-3.37(m,1h),3.16
–
3.08(m,1h),2.92(dd,j=16.3,8.2hz,1h),2.65
–
2.56(m,1h),2.56
–
2.44(m,2h),2.37
–
2.33(m,1h),2.09
–
2.00(m,1h),1.99
–
1.90(m,1h),1.80
–
1.67(m,2h),1.66
–
1.60(m,1h),1.14(d,j=6.8hz,3h);
13
cnmr(125mhz,chloroform-d)δ190.50,175.12,161.46,154.47,147.38,138.02,130.11,128.78,122.02,118.47,110.21,55.97,47.42,45.88,45.17,41.52,39.07,30.49,27.43,23.84,21.23;hrms(esi):m/z calcd for c
21
h
28
n3o4[m h]
:386.2074,found 386.2082.
[0219]
实施例4化合物n-(3-(2-formyl-3-methylcyclopent-1-en-1-yl)-4,5-dimethoxybenzyl)cyclobutanecar-boxamide(st-004)的合成
[0220][0221]
称量化合物17(3.32g,20mmol)溶解于acoh(50ml)中,冰浴降到0℃时,将br2(3.2g,20.0mmol)滴加到上述反应液中,反应滴完后,慢慢升至室温,搅拌16小时。将生成的固体过滤烘干,得到白色固体18(2.4g,50%)。esi-ms:[m h]
:345.1.
[0222]
称量化合物18(488mg,2.0mmol),盐酸羟胺(276mg,4.0mmol)和naoh(160mg,4.0mmol)溶解于甲醇(3ml)和水(3ml)中,反应液升温至70℃,搅拌2小时。向反应液中加入水(50ml)淬灭,用etoac(50mlx3)萃取,有机层用无水na2so4干燥,过滤后浓缩得白色固体19(518mg,100%)。
[0223]
称量化合物19(518mg,2.0mmol)和锌粉(160mg,4.0mmol)溶解于甲醇(3ml)和水(3ml)中,反应液升温至70℃,搅拌2小时。向反应液中加入水(50ml)淬灭,用etoac(50mlx3)萃取,有机层用无水硫酸钠干燥,过滤后浓缩得无色油状物20(122mg,25%)。esi-ms:[m h]
:346.0.
[0224]
称量化合物20(122mg,0.5mmol),化合物21(50mg,0.5mmol),hatu(190mg,0.5mmol)和dipea(129mg,1.0mmol)溶解于二氯甲烷(5ml)中,反应液在常温下搅拌1h.将上述反应液浓缩得粗品,并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体22(100mg,61%)。esi-ms:[m h]
:328.1.
[0225]
化合物st-004的合成方法同化合物st-001,反应量按照化合物22(0.26mmol),并用快速柱层析(pe/etoac=1/1)纯化,得到白色固体st-004(8mg,9%)。1hnmr(500mhz,chloroform-d)δ9.49(s,1h),6.86(s,1h),6.59(s,1h),5.48(d,j=6.8hz,1h),4.29(t,j=5.0hz,2h),3.87(d,j=14.2hz,6h),3.01
–
2.93(m,1h),2.90
–
2.83(m,1h),2.54(d,j=7.1hz,1h),2.47(d,j=21.1hz,1h),2.34
–
2.23(m,3h),2.19
–
2.07(m,2h),2.02
–
1.83(m,3h),1.15(d,j=6.9hz,3h);
13
cnmr(125mhz,chloroform-d)δ190.02,174.63,162.14,149.24,148.15,140.88,128.33,126.84,112.16,111.88,56.08,56.03,56.00,49.27,41.06,39.81,37.91,31.14,25.33,21.25,18.13;hrms(esi):m/z calcd for c
21
h
28
no4[m
h]
:358.2013,found 358.2016.
[0226]
实施例5化合物1-(3-(2-formyl-3-methylcyclopent-1-en-1-yl)-4-methylphenyl)-3-(2-methoxyethyl)urea(st-005)的合成
[0227][0228]
化合物24的合成方法同化合物10,反应量按照化合物23(10.0mmol),得到粗品24。
[0229]
化合物26的合成方法同化合物12,反应量按照化合物25(10.0mmol),粗品用(pe/etoac=1/1)重结晶,得到白色固体26(1.43g,50%)。1hnmr(500mhz,dmso-d6)δ8.94(s,1h),7.79(d,j=1.6hz,1h),7.13(d,j=1.7hz,2h),6.38(t,j=5.7hz,1h),3.33(t,j=5.5hz,2h),3.23(s,3h),3.21(q,j=5.5hz,2h);
13
cnmr(125mhz,dmso-d6)δ155.54,140.25,131.24,129.41,124.28,120.88,117.15,71.63,45.89,39.21;esi-ms:[m h]
:287.1.
[0230]
化合物st-005的合成方法同化合物st-001,反应量按照化合物30(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-005(30mg,37%)。1hnmr(500mhz,chloroform-d)δ9.44(s,1h),7.38(s,1h),7.20
–
7.05(m,3h),5.73
–
5.52(m,1h),3.48(t,j=4.8hz,2h),3.41(t,j=5.0hz,2h),3.33(s,3h),2.96(dd,j=18.4,7.8hz,1h),2.84(dd,j=16.1,8.2hz,1h),2.53
–
2.40(m,2h),2.28(dd,j=16.4,5.0hz,1h),2.17(s,3h),1.11(d,j=6.7hz,3h);
13
cnmr(125mhz,chloroform-d)δ190.55,163.70,156.24,139.73,136.82,135.53,130.94,129.69,119.95,119.92,72.13,58.72,48.39,40.16,37.81,31.02,21.33,19.13;hrms(esi):m/z calcd for c
18
h
25
n2o3[m h]
:317.1860,found 317.1869.
[0231]
实施例6化合物methyl3-acetamido-5-(2-formyl-3-methylcyclopent-1-en-1-yl)-2-methylbenzoate(st-006)的合成
[0232][0233]
称量化合物27(2.43g,10.0mmol)和dipea(2.58g,20.0mmol)溶解于二氯甲烷(20ml)中,冰浴降到0℃时,将化合物28(0.78g,10.0mmol)慢慢滴加到上述反应液中,反应滴完后,慢慢升至室温,搅拌1小时。向反应液中加入水(50ml)淬灭,用二氯甲烷(50mlx3)萃取,有机层用无水硫酸钠干燥,过滤后浓缩得黄色固体29(2.5g,88%)。1hnmr(500mhz,dmso-d6)δ9.60(s,1h),7.79(d,j=2.2hz,1h),7.65(d,j=2.2hz,1h),3.82(s,3h),2.26(s,3h),2.08(s,3h);
13
cnmr(125mhz,dmso-d6)δ169.16,166.93,139.53,133.67,131.98,131.24,128.86,117.94,52.86,23.66,15.21;esi-ms:[m h]
:286.0.
[0234]
化合物st-006的合成方法同化合物st-001,反应量按照化合物29(0.26mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到白色固体st-006(41mg,50%)。1hnmr(500mhz,
chloroform-d)δ9.82(s,1h),7.93(s,1h),7.64(s,1h),7.24(s,1h),3.90(s,3h),3.16
–
3.10(m,1h),2.94
–
2.89(m,1h),2.64
–
2.58(m,1h),2.54
–
2.45(m,1h),2.48(s,3h),2.36-2.32(m,1h),2.23(s,3h),1.13(d,j=6.8hz,3h);
13
cnmr(125mhz,chloroform-d)δ190.14,168.62,167.59,159.75,139.44,136.82,132.87,132.17,131.60,127.27,127.17,52.34,47.38,39.01,30.52,21.18,14.71;hrms(esi):m/z calcd for c
18
h
22
no4[m h]
:316.1543,found 316.1551.
[0235]
实施例7化合物(2r)-n-(5-(2-formyl-3-methylcyclopent-1-en-1-yl)-2-methoxyphenyl)-5-oxopyrroli-dine-2-carboxamide(st-007)的合成
[0236][0237]
化合物32的合成方法同化合物6,反应量按照化合物30(1.0mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体32(250mg,80%)。1hnmr(500mhz,dmso-d6)δ9.36(s,1h),8.21(d,j=2.5hz,1h),7.92(s,1h),7.24(dd,j=8.8,2.5hz,1h),7.01(d,j=8.8hz,1h),4.44
–
4.32(m,1h),3.83(s,3h),2.31(d,j=38.9hz,1h),2.20(d,j=33.7hz,1h),2.10(d,j=31.5hz,1h),1.96(d,j=31.1hz,1h);
13
cnmr(125mhz,dmso-d6)δ178.12,172.39,149.12,128.88,127.22,123.99,113.55,111.92,56.53,56.39,29.55,25.93;esi-ms:[m h]
:313.0.
[0238]
化合物st-007的合成方法同化合物st-001,反应量按照化合物32(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-007(50mg,89%)。1hnmr(500mhz,methanol-d4)δ9.77(s,1h),8.14(d,j=8.2hz,1h),7.07(d,j=1.8hz,1h),7.01(dd,j=8.2,1.9hz,1h),4.44(dd,j=8.8,4.5hz,1h),3.93(s,3h),3.22
–
3.17(m,1h),2.91
–
2.87(m,1h),2.68
–
2.63(m,1h),2.59
–
2.42(m,4h),2.38
–
2.28(m,2h),2.22
–
2.16(m,1h),1.15(d,j=6.9hz,3h);
13
cnmr(125mhz,methanol-d4)δ190.38,180.34,171.84,162.21,149.67,138.15,131.75,127.72,121.07,121.04,110.53,57.30,55.17,47.73,47.57,47.39,47.23,47.05,38.53,30.48,29.04,25.54,20.00;hrms(esi):m/z calcd for c
19
h
23
n2o4[m h]
:343.1652,found 343.1658.
[0239]
实施例8化合物n-(5-carbamoyl-2-methoxyphenyl)-4-(2-formyl-3-methylcyclopent-1-en-1-yl)-3-methylbenzamide(st-008)的合成
[0240][0241]
化合物35的合成方法同化合物6,反应量按照化合物33(1.0mmol),并用快速柱层
yl)-3-propylurea(st-010)的合成
[0248][0249]
化合物39的合成方法同化合物10,反应量按照化合物38(10.0mmol),得到粗品39。
[0250]
化合物41的合成方法同化合物12,反应量按照化合物40(10.0mmol),粗品用(pe/etoac=1/1)重结晶,得到白色固体41(2.0g,78%)。1hnmr(500mhz,dmso-d6)δ9.37(s,1h),7.63
–
7.54(m,2h),7.09(dd,j=7.1,1.2hz,2h),3.07(td,j=6.9,5.6hz,2h),1.43(q,j=7.1hz,2h),0.86(t,j=7.4hz,3h);
13
cnmr(125mhz,dmso-d6)δ154.51,154.10,141.40,138.44,120.47,110.62,41.15,23.14,11.69;esi-ms:[m h]
:258.0.
[0251]
化合物st-010的合成方法同化合物st-001,反应量按照化合物41(0.26mmol),并用快速柱层析(pe/etoac=1/4)纯化,得到白色固体st-010(20mg,27%)。1hnmr(500mhz,chloroform-d)δ10.19(s,1h),9.14(d,j=33.9hz,2h),7.63(t,j=7.9hz,1h),6.95(t,j=8.9hz,2h),3.34(q,j=6.7hz,2h),3.18(dd,j=17.8,8.1hz,1h),2.97(dd,j=16.8,8.2hz,1h),2.66(dd,j=17.9,5.7hz,1h),2.62
–
2.49(m,1h),2.40(dd,j=16.8,5.6hz,1h),1.60(h,j=7.3hz,2h),1.15(d,j=6.8hz,3h),0.97(t,j=7.4hz,3h);
13
cnmr(125mhz,chloroform-d)δ190.59,156.05,153.38,141.19,138.46,116.96,112.64,45.97,41.67,39.43,30.35,23.07,21.22,11.53;hrms(esi):m/z calcd for c
16
h
22
n3o2[m h]
:288.1707,found288.1714.
[0252]
实施例11化合物n-(3-acetamidophenyl)-4-(2-formyl-3-methylcyclopent-1-en-1-yl)benzamide(st-011)的合成
[0253][0254]
化合物44的合成方法同化合物29,反应量按照化合物42(1.0mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体44(300mg,90%)。esi-ms:[m h]
:333.0.
[0255]
化合物st-011的合成方法同化合物st-001,反应量按照化合物44(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-011(20mg,21%)。1hnmr(500mhz,dmso-d6)δ10.32(s,1h),9.95(s,1h),9.75(s,1h),8.09(d,j=2.1hz,1h),8.01(d,j=8.0hz,2h),7.62(d,j=8.0hz,2h),7.44
–
7.40(m,1h),7.33(dd,j=8.0,1.8hz,1h),7.23(t,j=8.0hz,1h),3.20(dd,j=18.2,8.0hz,1h),2.84(dd,j=16.3,8.2hz,1h),2.72
–
2.62(m,1h),2.52
–
2.42(m,3h),2.29
–
2.21(m,1h),2.03(s,3h),1.09(d,j=6.8hz,3h);
13
cnmr(125mhz,dmso-d6)δ189.72,168.71,165.32,160.16,139.98,139.74,139.10,137.93,135.78,129.11,129.08,128.34,115.76,115.10,111.79,47.29,39.42,30.42,24.46,21.47;hrms(esi):m/z calcd for c
22
h
23
n2o3[m h]
:363.1703,found 363.1707.
[0256]
实施例12化合物3-acetamido-n-butyl-5-(2-formyl-3-methylcyclopent-1-en-1-yl)benzamide(st-012)的合成
[0257][0258]
化合物46的合成方法同化合物29,反应量按照化合物45(1.0mmol),得到粗品46。esi-ms:[m h]
:257.9.
[0259]
化合物48的合成方法同化合物6,反应量按照化合物46(1.0mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体48(300mg,96%)。1hnmr(500mhz,dmso-d6)δ10.24(s,1h),8.50(t,j=5.6hz,1h),8.09(t,j=1.9hz,1h),7.87(t,j=1.7hz,1h),7.66(t,j=1.7hz,1h),3.21(td,j=7.0,5.5hz,2h),2.04(s,3h),1.50
–
1.44(m,2h),1.34
–
1.24(m,2h),0.87(t,j=7.4hz,3h);
13
cnmr(125mhz,dmso-d6)δ169.27,164.96,141.21,137.67,124.13,123.79,121.78,117.68,31.49,24.43,20.07,14.13;esi-ms:[m h]
:313.0.
[0260]
化合物st-012的合成方法同化合物st-001,反应量按照化合物48(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-012(42mg,47%)。1hnmr(500mhz,chloroform-d)δ9.76(s,1h),8.45(s,1h),7.98(s,1h),7.77(s,1h),7.44(s,1h),6.51(s,1h),3.44(q,j=6.7hz,2h),3.19
–
3.07(m,1h),2.90(dd,j=16.4,8.2hz,1h),2.63
–
2.61(m,1h),2.50(q,j=6.8hz,1h),2.39
–
2.27(m,1h),2.20(s,3h),1.63
–
1.56(m,2h),1.40(p,j=7.4hz,2h),1.12(d,j=6.8hz,3h),0.94(t,j=7.3hz,3h);
13
cnmr(125mhz,chloroform-d)δ190.26,169.16,160.81,139.58,138.94,136.11,135.87,122.36,122.17,118.74,47.63,40.06,38.98,31.59,30.56,24.52,21.18,20.14,13.75;hrms(esi):m/z calcd for c
20
h
27
n2o3[m h]
:343.2016,found 343.2018.
[0261]
实施例13化合物2-(4-(2-formyl-3-methylcyclopent-1-en-1-yl)benzamido)thiophene-3-carboxamide(st-013)的合成
[0262][0263]
化合物50的合成方法同化合物29,反应量按照化合物49(1.0mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到白色固体50(250mg,77%)。1hnmr(500mhz,dmso-d6)δ13.45(s,1h),8.06(s,1h),7.86
–
7.77(m,4h),7.65(s,1h),7.49(d,j=5.8hz,1h),7.04(d,j=5.8hz,1h);
13
cnmr(125mhz,dmso-d6)δ167.78,162.05,146.45,132.71,131.74,129.47,126.98,123.65,117.12,116.28;esi-ms:[m h]
:325.0.
[0264]
化合物st-013的合成方法同化合物st-001,反应量按照化合物50(0.26mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到黄色固体st-013(21mg,23%)。1hnmr(500mhz,dmso-d6)δ9.75(s,1h),8.06(s,1h),7.97
–
7.94(m,2h),7.74
–
7.70(m,2h),7.66(s,1h),7.49(d,j=5.8hz,1h),7.05(dd,j=5.7,0.6hz,1h),3.22
–
3.15(m,1h),2.86
–
2.80(m,1h),2.69
–
2.63(m,1h),2.48
–
2.42(m,1h),2.27
–
2.21(m,1h),1.09(d,j=6.8hz,3h);
13
cnmr
(125mhz,dmso-d6)δ189.75,167.79,162.30,159.54,146.52,139.49,139.04,132.86,129.91,127.63,123.65,117.09,116.24,47.21,39.44,30.42,21.44;hrms(esi):m/z calcd for c
19
h
19
n2o3s[m h]
:355.1111,found 355.1111.
[0265]
实施例14化合物n-(5-(2-formyl-3-methylcyclopent-1-en-1-yl)-2-methoxyphenyl)-1h-pyrazole-3-carboxamide(st-014)的合成
[0266][0267]
化合物53的合成方法同化合物6,反应量按照化合物51(1.0mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到黄色固体53(250mg,85%)。1hnmr(500mhz,dmso-d6)δ9.39(s,1h),8.52(d,j=2.5hz,1h),7.91(d,j=2.4hz,1h),7.19(dd,j=8.7,2.5hz,1h),6.99(d,j=8.8hz,1h),6.79(d,j=2.3hz,1h),3.88(s,3h);
13
cnmr(125mhz,dmso-d6)δ160.05,147.67,146.33,131.59,129.06,126.24,121.42,113.05,112.43,105.90,56.69;esi-ms:[m h]
:296.0.
[0268]
化合物st-014的合成方法同化合物st-001,反应量按照化合物53(0.26mmol),并用快速柱层析(pe/etoac=1/1)纯化,得到黄色固体st-014(23mg,27%)。1hnmr(500mhz,dmso-d6)δ13.46(s,1h),9.83(s,1h),9.39(s,1h),8.46(s,1h),7.91(d,j=9.5hz,1h),7.23(dd,j=8.4,2.2hz,1h),7.16(d,j=8.5hz,1h),6.77(s,1h),3.95(s,3h),3.19
–
3.09(m,1h),2.85
–
2.77(m,1h),2.63
–
2.57(m,1h),2.47
–
2.39(m,1h),2.25
–
2.19(m,1h),1.08(d,j=6.8hz,3h);
13
cnmr(125mhz,dmso-d6)δ189.81,160.85,160.13,149.62,146.51,137.32,131.61,127.54,127.25,124.97,119.90,111.42,105.85,56.75,47.15,39.41,30.26,21.51;hrms(esi):m/z calcd for c
18
h
20
n3o3[m h]
:326.1499,found 326.1500.
[0269]
实施例15化合物3-acetamido-n-cyclopropyl-5-(2-formyl-3-methylcyclopent-1-en-1-yl)benzamide(st-015)的合成
[0270][0271]
化合物55的合成方法同化合物29,反应量按照化合物54(1.0mmol),得到粗品55。esi-ms:[m h]
:258.0.
[0272]
化合物57的合成方法同化合物6,反应量按照化合物55(1.0mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体57(300mg,96%)。esi-ms:[m h]
:297.0.
[0273]
化合物st-015的合成方法同化合物st-001,反应量按照化合物57(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-015(42mg,47%)。1hnmr(500mhz,dmso-d6)δ10.17(s,1h),9.73(s,1h),8.49(d,j=4.1hz,1h),8.00(t,j=1.8hz,1h),7.85(d,j=1.8hz,1h),7.53(d,j=1.6hz,1h),3.18
–
3.10(m,1h),2.81(qd,j=7.4,2.9hz,2h),
2.64
–
2.57(m,1h),2.48
–
2.40(m,1h),2.25
–
2.20(m,1h),2.04(s,3h),1.08(d,j=6.8hz,3h),0.68(dd,j=7.1,2.3hz,2h),0.55(dd,j=4.1,2.4hz,2h);
13
cnmr(125mhz,dmso-d6)δ189.93,169.16,167.20,160.54,139.90,138.70,135.76,135.23,121.84,121.59,119.51,47.38,39.30,30.35,24.43,23.52,21.50,6.17;hrms(esi):m/z calcd for c
19
h
23
n2o3[m h]
:327.1703,found 327.1709.
[0274]
实施例16化合物methyl(4-(2-formyl-3-methylcyclopent-1-en-1-yl)-2-methylphenyl)glycinate(st-016)的合成
[0275][0276]
称取化合物58(1.03g,11.1mmol)和碳酸钾(2.31g,16.7mmol)溶解于丙酮(10ml)中,冰浴降到0℃时,将化合物59(1.15ml,12.1mmol)滴加到上述反应液中,反应滴完后,升温至60℃,搅拌16小时。向反应液中加入水(50ml)淬灭,用二氯甲烷(50mlx3)萃取,有机层用无水na2so4干燥,过滤后浓缩,并用快速柱层析(pe/etoac=5/1)纯化,得到白色固体60(2.0g,78%)。1hnmr(500mhz,dmso-d6)δ7.14(dd,j=2.4,0.9hz,1h),7.12
–
7.08(m,1h),6.29(d,j=8.6hz,1h),3.93(s,2h),3.63(s,3h),2.08(s,3h);
13
cnmr(125mhz,dmso-d6)δ171.99,145.66,132.32,129.45,125.00,111.44,107.54,52.08,45.10,17.67;esi-ms:[m h]
:258.0.
[0277]
化合物st-016的合成方法同化合物st-001,反应量按照化合物60(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-016(33mg,44%)。1hnmr(500mhz,dmso-d6)δ9.74(s,1h),7.20
–
7.11(m,2h),6.39(d,j=8.2hz,1h),5.79(t,j=6.3hz,1h),4.00(d,j=6.3hz,2h),3.64(s,3h),3.11
–
3.05(m,1h),2.78
–
2.72(m,1h),2.56
–
2.51(m,1h),2.40
–
2.31(m,1h),2.19
–
2.14(m,1h),2.12(s,3h),1.04(d,j=6.8hz,3h);
13
cnmr(125mhz,dmso-d6)δ189.59,171.94,161.97,147.89,135.06,131.19,128.64,122.83,122.15,109.23,52.15,46.82,44.92,39.41,30.16,21.57,17.89;hrms(esi):m/z calcd for c
17
h
22
no3[m h]
:288.1594,found 288.1602.
[0278]
实施例17化合物n-butyl-4-(3-(2-formyl-3-methylcyclopent-1-en-1-yl)furan-2-carbonyl)piperazine-1-carboxamide(st-017)的合成
[0279][0280]
称取化合物61(1.86g,10.0mmol)溶解于二氯甲烷(20ml)中,冰浴降到0℃时,将化
合物62(0.99g,10.0mmol)慢慢滴加到上述反应液中,反应滴完后,缓慢升温至常温,搅拌16小时。将反应液浓缩后得到无色液体63(2.85g,100%)。esi-ms:[m h]
:286.2.
[0281]
称取化合物63(2.85g,10.0mmol)溶解于hcl/dioxane(20ml)中,将反应液于室温下搅拌2小时。将反应液浓缩后得到无色液体64(2.21g,100%)。esi-ms:[m h]
:186.2.
[0282]
化合物66的合成方法同化合物6,反应量按照化合物64(1.0mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到无色液体固体66(300mg,84%)。1hnmr(500mhz,dmso-d6)δ7.86(d,j=1.9hz,1h),6.80(d,j=1.9hz,1h),6.55(t,j=5.4hz,1h),3.47(s,4h),3.38
–
3.31(m,4h),3.01(td,j=7.1,5.4hz,2h),1.39
–
1.34(m,2h),1.26
–
1.23(m,3h),0.84(t,j=7.3hz,3h);
13
cnmr(125mhz,dmso-d6)δ158.47,157.68,145.48,143.83,115.54,102.82,40.27,38.65,32.35,20.01,14.20;esi-ms:[m h]
:358.1.
[0283]
化合物st-017的合成方法同化合物st-001,反应量按照化合物66(0.26mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体st-017(35mg,35%)。1hnmr(500mhz,chloroform-d)δ9.75(s,1h),7.49(d,j=1.9hz,1h),6.49(d,j=1.9hz,1h),4.59(t,j=5.6hz,1h),3.64(s,4h),3.42(s,4h),3.24-3.20(m,2h),3.06
–
3.00(m,1h),2.89
–
2.83(m,1h),2.54
–
2.46(m,2h),2.31
–
2.25(m,1h),1.53
–
1.45(m,2h),1.39
–
1.29(m,2h),1.11(d,j=6.5hz,3h),0.91(t,j=7.3hz,3h);
13
cnmr(125mhz,chloroform-d)δ189.17,159.49,157.47,151.56,144.13,143.15,140.66,123.82,113.31,46.96,43.70,40.74,38.51,32.24,30.91,21.06,20.06,13.78;hrms(esi):m/z calcd for c
21
h
30
n3o4[m h]
:388.2231,found388.2239.
[0284]
实施例18化合物1-(6-(2-formyl-3-methylcyclopent-1-en-1-yl)pyridin-2-yl)-3-(2-methoxyethyl)urea(st-018)的合成
[0285][0286]
化合物39的合成方法同化合物10,反应量按照化合物38(10.0mmol),得到粗品39。
[0287]
化合物68的合成方法同化合物12,反应量按照化合物67(10.0mmol),得到的粗品用(pe/etoac=1/1)重结晶,得到白色固体41(2.2g,81%)。1hnmr(500mhz,dmso-d6)δ9.43(s,1h),7.65
–
7.55(m,2h),7.19(s,1h),7.12(dd,j=7.0,1.2hz,1h),3.37(t,j=5.4hz,2h),3.30
–
3.27(m,2h),3.26(s,3h);
13
cnmr(125mhz,dmso-d6)δ154.52,154.00,141.46,138.51,120.67,110.69,71.37,58.45,39.32;esi-ms:[m h]
:274.0.
[0288]
化合物st-018的合成方法同化合物st-001,反应量按照化合物68(0.26mmol),并用快速柱层析(pe/etoac=1/3)纯化,得到白色固体st-018(26mg,33%)。1hnmr(500mhz,dmso-d6)δ10.38(s,1h),9.28(s,1h),7.74(dd,j=8.4,7.5hz,1h),7.69(s,1h),7.54(d,j=8.4hz,1h),7.17
–
7.07(m,1h),3.38(t,j=5.3hz,2h),3.28(d,j=5.3hz,2h),3.24(s,3h),3.21
–
3.15(m,1h),2.86
–
2.80(m,1h),2.64
–
2.60(m,1h),2.45
–
2.38(m,1h),2.29
–
2.21(m,1h),1.06(d,j=6.8hz,3h);
13
cnmr(125mhz,dmso-d6)δ191.78,155.78,154.98,153.39,150.65,140.70,139.30,117.74,112.58,71.41,58.36,45.20,39.29,30.06,21.52;hrms(esi):m/z calcd for c
16
h
22
n3o3[m h]
:304.1656,found 304.1663.
[0289]
实施例19化合物2-(3-(2-formyl-3-methylcyclopent-1-en-1-yl)-5-methoxybenzoyl)hydrazine-1-carbo-xamide(st-019)的合成
[0290][0291]
化合物71的合成方法同化合物6,反应量按照化合物69(1.0mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体71(320mg,94%)。1hnmr(500mhz,dmso-d6)δ10.21(s,1h),7.93(s,1h),7.61(t,j=1.6hz,1h),7.41(dd,j=2.3,1.3hz,1h),7.31(t,j=2.0hz,1h),6.06(s,2h),3.80(s,3h);
13
cnmr(125mhz,dmso-d6)δ164.85,160.46,122.92,122.44,120.21,112.86,56.28;esi-ms:[m h]
:288.0.
[0292]
化合物st-019的合成方法同化合物st-001,反应量按照化合物71(0.26mmol),并用快速柱层析(pe/etoac=1/1)纯化,得到白色固体st-019(29mg,35%)。1hnmr(500mhz,dmso-d6)δ10.21(s,1h),9.75(s,1h),7.88(s,1h),7.54(t,j=1.5hz,1h),7.47(dd,j=2.6,1.4hz,1h),7.19(dd,j=2.5,1.4hz,1h),6.04(s,2h),3.83(s,3h),3.20
–
3.14(m,1h),2.84
–
2.78(m,1h),2.66
–
2.61(m,1h),2.48
–
2.40(m,1h),2.25
–
2.20(m,1h),1.08(d,j=6.8hz,3h);
13
cnmr(125mhz,dmso-d6)δ189.97,165.91,160.31,159.67,138.80,136.42,134.76,120.36,117.58,114.10,56.05,47.49,39.31,30.34,21.53;hrms(esi):m/z calcd for c
16
h
20
n3o4[m h]
:318.1448,found 318.1449.
[0293]
实施例20化合物n-cyclopropyl-4-(3-formyl-2-methylcyclopent-1-en-1-yl)-2-(methylsulfonamido)be-nzamide(st-020)的合成
[0294][0295]
称量化合物72(2.43g,5.0mmol)和碳酸钠(0.795g,7.5mmol)溶解于水(50ml)中,冰浴降到0℃时,将化合物73(0.684g,6.0mmol)慢慢滴加到上述反应液中,反应滴完后,缓慢升温常温,搅拌16小时.将反应液用1maq.hcl中和至中性,用etoac(50mlx3)萃取,有机层用无水na2so4干燥,过滤后浓缩,并用快速柱层析(pe/etoac=1/3)纯化,得到黄色固体74(150mg,10%)。esi-ms:[m-h]
:291.9.
[0296]
化合物75的合成方法同化合物6,反应量按照化合物74(0.5mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到白色固体75(100mg,60%)。esi-ms:[m h]
:333.0.
[0297]
化合物st-020的合成方法同化合物st-001,反应量按照化合物75(0.26mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到白色固体st-020(33mg,35%)。1hnmr(500mhz,chloroform-d)δ10.86(s,1h),9.77(s,1h),7.70(d,j=1.6hz,1h),7.48(d,j=8.0hz,1h),7.03(dd,j=7.9,1.7hz,1h),6.69
–
6.54(m,1h),3.17
–
3.08(m,1h),3.05(s,3h),2.98
–
2.86
(m,2h),2.64
–
2.58(m,1h),2.56
–
2.49(m,1h),2.38
–
2.32(m,1h),1.14(d,j=6.8hz,3h),0.94
–
0.87(m,2h),0.71
–
0.63(m,2h);
13
cnmr(125mhz,chloroform-d)δ189.61,169.38,159.06,140.59,139.77,139.71,127.14,123.21,119.89,119.20,47.42,40.33,39.15,30.63,23.27,21.08,6.73;hrms(esi):m/z calcd for c
18
h
23
n2o4s[m h]
:363.1373,found 363.1378.
[0298]
实施例21化合物4-(8-(2-formyl-3-methylcyclopent-1-en-1-yl)-1,3,4,5-tetrahydro-2h-pyrido[4,3-b]in-dol-2-yl)-4-oxobutanoicacid(st-021)的合成
[0299][0300]
称取化合物76(2.0g,9.0mmol)和77(1.2g,9.0mmol)溶解于浓盐酸(1.5ml)和etoh(20ml)中,反应液升温至80℃,搅拌6小时。将反应液降温至室温,并且继续搅拌12h,将析出来的固体过滤并且滤饼用无水乙醇(5ml)洗涤滤饼,干燥滤饼得到白色固体78(1.5g,67%)。esi-ms:[m h]
:251.0.
[0301]
化合物80的合成方法同化合物29,反应量按照化合物78(1.0mmol),并用快速柱层析(pe/etoac=3/1)纯化,得到灰色固体80(300mg,79%)。esi-ms:[m h]
:379.1.
[0302]
化合物81的合成方法同化合物st-001,反应量按照化合物80(0.26mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到白色固体81(40mg,38%)。esi-ms:[m h]
:409.2.
[0303]
称取化合物81(40mg,0.1mmol)和氢氧化锂(12mg,0.5mmol)溶解于甲醇(5ml)和水(1ml)中,将反应液于室温下搅拌1小时。将上述反应液浓缩后,用快速柱层析(dcm/meoh=20/1)纯化,得到白色固体st-021(20mg,52%)。1hnmr(500mhz,chloroform-d)δ9.85(s,1h),8.38(s,1h),7.43(s,1h),7.35(d,j=8.4hz,1h),7.18(dd,j=8.4,1.5hz,1h),4.70(s,2h),4.00(t,j=5.7hz,2h),3.25
–
3.15(m,1h),2.98
–
2.91(m,1h),2.86
–
2.65(m,7h),2.57
–
2.47(m,1h),2.41
–
2.32(m,1h),1.16(d,j=6.2hz,3h);
13
cnmr(125mhz,chloroform-d)δ191.34,122.73,118.13,110.98,47.92,42.68,39.69,39.02,30.56,29.63,28.87,23.18,21.31;hrms(esi):m/z calcd for c
22
h
25
n2o4[m h]
:381.1809,found 381.1811.
[0304]
实施例22化合物(r)-2-(4-(2-formyl-3-methylcyclopent-1-en-1-yl)benzamido)thiophene-3-carboxam-ide(st-022)的合成
[0305]
[0306]
化合物3a的合成
[0307][0308]
化合物3a合成同化合物3,将购买的起始原料换成1a。
[0309]
化合物st-022的合成方法同化合物st-001,反应量按照化合物50(0.26mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到黄色固体st-022(21mg,23%)。1hnmr(500mhz,chloroform-d)δ12.98(s,1h),9.82(s,1h),8.06(d,j=7.8hz,2h),7.49(d,j=7.8hz,2h),7.13
–
6.98(m,1h),6.87(s,1h),5.86(d,j=106.6hz,2h),3.19
–
2.95(m,2h),2.74
–
2.47(m,2h),2.39(d,j=16.7hz,1h),1.16(s,3h);
13
cnmr(125mhz,chloroform-d)δ189.93,167.54,162.94,159.72,148.44,140.17,139.17,132.65,129.04,127.72,121.29,117.11,114.02,47.52,39.14,30.63,21.18;hrms(esi):m/z calcd for c
19
h
19
n2o3s[m h]
:355.1111,found 355.1115.
[0310]
实施例23化合物n'-(cyclopropanecarbonyl)-4-(2-formyl-3-methylcyclopent-1-en-1-yl)-2-methoxyb-enzohydrazide(st-023)的合成
[0311][0312]
称取化合物82(1.22g,5.0mmol)和化合物83(1.25g,25.0mmol)溶解于无水乙醇(20ml)中,反应升温至80℃,搅拌6小时。反应液降至室温,将析出的固体过滤,并且用无水乙醇(5ml)洗涤滤饼后烘干,得到黄色固体84(1.0g,82%)。1hnmr(500mhz,dmso-d6)δ9.23(s,1h),7.57(d,j=8.2hz,1h),7.30(d,j=1.8hz,1h),7.20(dd,j=8.2,1.8hz,1h),4.53(s,2h),3.86(s,3h);
13
cnmr(125mhz,dmso-d6)δ164.28,157.87,132.08,125.14,123.82,122.28,115.51,56.73;esi-ms:[m h]
:245.0.
[0313]
化合物86的合成方法同化合物29,反应量按照化合物84(1.0mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到白色固体86(250mg,77%)。1hnmr(500mhz,dmso-d6)δ10.37(d,j=2.4hz,1h),9.91(d,j=2.4hz,1h),7.60(d,j=8.2hz,1h),7.34(d,j=1.8hz,1h),7.24(dd,j=8.2,1.8hz,1h),3.87(s,3h),1.69
–
1.66(m,1h),0.75
–
0.70(m,4h);
13
cnmr(125mhz,dmso-d6)δ171.88,163.50,158.07,132.37,126.00,123.99,121.38,115.77,56.91,12.41,7.03;313.0.
[0314]
化合物st-023的合成方法同化合物st-001,反应量按照化合物86(0.26mmol),并用快速柱层析(pe/etoac=2/1)纯化,得到白色固体st-023(25mg,28%)。1hnmr(500mhz,dmso-d6)δ10.40(d,j=2.5hz,1h),9.96(d,j=2.4hz,1h),9.76(s,1h),7.75(d,j=7.9hz,1h),7.20(d,j=1.5hz,1h),7.14(dd,j=7.9,1.5hz,1h),3.91(s,3h),3.24
–
3.15(m,1h),2.86
–
2.78(m,1h),2.70
–
2.63(m,1h),2.45(qd,j=8.1,7.2,5.4hz,1h),2.26
–
2.21(m,1h),
1.71
–
1.66(m,1h),1.09(d,j=6.8hz,3h),0.76
–
0.72(m,4h);
13
cnmr(125mhz,dmso-d6)δ189.80,171.71,163.58,160.07,157.34,139.27,139.25,130.97,122.37,121.39,112.63,56.66,47.38,39.42,30.42,21.47,12.41,7.01;hrms(esi):m/z calcd for c
19
h
23
n2o4[m h]
:343.1652,found 343.1658.
[0315]
效果实施例1化合物对du145-wb实验
[0316]
实验材料:
[0317]
1.1材料:
[0318]
du-145细胞:上海博垒生物科技有限公司保种;
[0319]
1.2试剂:
[0320]
培养试剂:dmem(gibco,c11995500cp);rpmi 1640(gibco,c11875500bt);胎牛血清(bio ind,04-002-1a);antibiotic-antimycotic(lifetechnologies,15240-112);pbs,ph7.4(gibco,10010-023);trypsin-edta(0.05%)(lifetechnologies,25300-054);牛血清白蛋白(lifetechnologies,15561012);
[0321]
抗体:stat3抗体(cst,#12640s);p-stat3(y705)抗体(cst,#9145);p-stat3(s727)抗体(cst,#34911);stat1抗体(cst,#9172);p-stat1(s727)抗体(cst,#8826);gapdh抗体(cst,#5174);hrp-山羊抗小鼠igg(h l)(beyotime,a0216);hrp-山羊抗兔igg(h l)(beyotime,a0208);
[0322]
marker:beyotime,p0066;
[0323]
bca蛋白浓度测定试剂盒:solarbio,pc0020;
[0324]
超敏ecl发光试剂盒:clinx,1810202;
[0325]
1.3耗材:
[0326]
硝化纤维素膜(0.2um):thermo scientific pierce,88013;
[0327]
1.4仪器:
[0328]
常规仪器:co2培养箱(thermo 3111),显微镜(奥林巴斯cx23),生物安全柜(heal force,hfsafe-1200lc),移液器(eppendorff),垂直板电泳装置(tanon ve-180pre),垂直板电泳胶转膜仪装置(tanon ve-586),荧光成像系统(clinx,6000pro)等。
[0329]
实验步骤:
[0330]
蛋白质免疫印迹(western blot,wb)检测蛋白表达:
[0331]
收集各组样本,加入细胞裂解液提取细胞总蛋白,bca定量(按照bca蛋白浓度测定试剂盒说明进行操作),以gapdh为对照,western blot分析蛋白表达含量。
[0332]
蛋白印迹方法:
[0333]
2.1电泳凝胶配制:12%分离胶和4%浓缩胶;
[0334]
2.2 sds-page电泳:电泳时间一般1.5h,电压为80v。电泳至溴酚兰刚跑出即可终止电泳,进行转膜;
[0335]
2.3转膜:一般用400ma转移0.5h;
[0336]
2.4封闭:以1%bsa对膜进行封闭40min;
[0337]
2.5一抗孵育:加入一抗与对照抗体,4℃孵育过夜;
[0338]
2.6二抗孵育:pbst洗三次,加hrp标记的二抗,37℃孵育1h;
[0339]
2.7 ecl显色:pbst洗三次,按照试剂盒说明书配制ecl显色工作液,取适量加至膜
上,室温避光孵育3-10min;
[0340]
3.8成像:成像拍照。
[0341]
表1.du-145和pc-3细胞中环戊烯-1-甲醛衍生物的抑制率
[0342][0343]
[0344]
da为:delavatine abp-1-102:“/”表示未测。
[0345]
(下同)
[0346]
表2.烯-1-甲醛衍生物对du-145和pc-3细胞的ic
50
[0347][0348][0349]
效果实施例2化合物对mda-mb-231wb实验
[0350]
实验材料:
[0351]
1.1材料:
[0352]
mda-mb-231细胞:atcc;
[0353]
1.2试剂:
[0354]
培养试剂:dmem(gibco,c11995500cp);rpmi 1640(gibco,c11875500bt);胎牛血清(bio ind,04-002-1a);antibiotic-antimycotic(lifetechnologies,15240-112);pbs,ph7.4(gibco,10010-023);trypsin-edta(0.05%)(lifetechnologies,25300-054);牛血清白蛋白(lifetechnologies,15561012);
[0355]
抗体:stat3抗体(cst,#9139);ac-stat3(k685)抗体(cst,#2523);p-stat3(y705)抗体(cst,#9145);p-stat3(s727)抗体(cst,#34911);stat1抗体(cst,#9172);p-stat1(y701)抗体(cst,#9167);p-stat1(s727)抗体(cst,#8826);stata/b抗体(abclonal,a5029);p-stat5a(tyr694)抗体(cst,#9351);p-stat5b(tyr 699)抗体(abcam,ab83212);gapdh抗体(cst,#5174);hrp-山羊抗小鼠igg(h l)(beyotime,a0216);hrp-山羊抗兔igg(h l)(beyotime,a0208);
[0356]
marker:beyotime,p0066;
[0357]
bca蛋白浓度测定试剂盒(bca protein assay kit):solarbio,pc0020;
[0358]
超敏ecl发光试剂盒:clinx,1810202;
[0359]
1.3耗材:
[0360]
硝化纤维素膜(0.2um):thermo scientific pierce,88013;
[0361]
1.4仪器:
[0362]
常规仪器:co2培养箱(thermo 3111),显微镜(奥林巴斯cx23),生物安全柜(heal force,hfsafe-1200lc),移液器(eppendorff),垂直板电泳装置(tanon ve-180pre),垂直板电泳胶转膜仪装置(tanon ve-586),荧光成像系统(clinx,6000pro)等。
[0363]
实验步骤:
[0364]
western blot检测蛋白表达:
[0365]
收集各组样本,加入细胞裂解液提取细胞总蛋白,bca定量(按照bca蛋白浓度测定试剂盒说明进行操作),以gapdh为对照,western blot分析蛋白表达含量。
[0366]
蛋白印迹方法:
[0367]
2.1电泳凝胶配制:12%分离胶和4%浓缩胶;
[0368]
2.2sds-page电泳:电泳时间一般1.5h,电压为80v。电泳至溴酚兰刚跑出即可终止电泳,进行转膜;
[0369]
2.3转膜:一般用400ma转移0.5h;
[0370]
2.4封闭:以1%bsa对膜进行封闭40min;
[0371]
2.5一抗孵育:加入一抗与对照抗体,4℃孵育过夜;
[0372]
2.6二抗孵育:pbst洗三次,加hrp标记的二抗,37℃孵育1h;
[0373]
2.7ecl显色:pbst洗三次,按照试剂盒说明书配制ecl显色工作液,取适量加至膜上,室温避光孵育3-10min;
[0374]
3.8成像:成像拍照。
[0375]
表3.对mda-mb-231细胞的ic
50
[0376][0377]
实验结果表明:通过蛋白印迹方法可以确认,本发明中描述的化合物具有stat3选择性;且对至少一种人肿瘤癌细胞具有明显的杀伤作用(ic
50
<100μm)。部分化合物对至少一种人肿瘤癌细胞具有显著的杀伤作用(ic
50
<10μm)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。