一株溶藻弧菌psts基因稳定沉默菌株及其应用
技术领域
1.本发明涉及生物技术领域,尤其涉及一株溶藻弧菌psts基因稳定沉默菌株及其应用。
背景技术:
2.溶藻弧菌(vibrio alginolyticus),是一种广泛存在于海洋和河口,可以从病人体内、海水、水产品等多种不同环境中分离得到的革兰氏阴性杆菌。溶藻弧菌除了可引起鱼、虾、贝类等水产品患病与大量死亡,造成严重的经济损失外,还可感染人体引起皮肤感染、外耳道感染等多种疾病。目前,用于防治溶藻弧菌的药物主要是抗生素,抗生素的不当使用容易产生细菌耐药性、导致药物残留等危害。因此,亟需开发防治溶藻弧菌病的生物药物或者疫苗。
3.磷的吸收和利用在生物体遗传、能量代谢、细胞膜的完整性和细胞内信号传递等生物过程中发挥着重要的作用。在细菌中,主要由磷酸盐特殊转运系统(phosphate specific transport,pst)和磷酸盐转运系统(pi transport,pit)来完成对无机磷酸盐(inorganic phosphates,pi)的吸收和利用,其中pst系统是pi吸收转运的关键系统。该系统是细菌在低pi环境下,以高亲和力结合pi,并将其转运至细胞质内的磷酸盐转运系统。该系统包含3个结构域,分别是底物结合结构域、跨膜结构域和atp结合结构域。在e.coli等大部分细菌中,pst系统一般由psts、pstc、psta、pstb和phou 5个蛋白组成。其中,psts为外周结合蛋白,是pst系统中的关键蛋白,该蛋白与pi具有极高的亲和性,负责感知和结合周质空间的pi,由psts基因编码。
4.目前有报道在大肠杆菌(e.coli)以及蓝藻细菌(cyanobacteria)等细菌中采用突变等手段获得psts基因变异株,但尚未见psts基因缺失或突变的重组溶藻弧菌psts基因株报道,更未见利用rnai技术稳定沉默筛选获得溶藻弧菌psts基因稳定沉默菌株的报道。
技术实现要素:
5.本发明的目的在于克服现有技术的不足之处,提供了一株溶藻弧菌psts基因稳定沉默菌株及其应用,解决了上述背景技术中的问题。
6.本发明解决其技术问题所采用的技术方案之一是:提供了一株溶藻弧菌psts基因稳定沉默菌株,其为vibrio alginolyticus psts
‑
rnai,于2021年6月24日保藏于中国典型培养物保藏中心,简称cctcc,保藏地址为中国武汉武汉大学,保藏编号为cctcc no:m2021764。
7.本发明解决其技术问题所采用的技术方案之二是:提供了溶藻弧菌psts基因稳定沉默菌株在制备预防和/或治疗哈维氏弧菌病疫苗中的应用。
8.本发明提供的溶藻弧菌psts基因稳定沉默菌株是通过如下技术手段进行构建:
9.s1.通过比较转录组学分析技术,将筛选致病功能基因目标锁定psts基因,qrt
‑
pcr验证psts基因;
10.s2.根据目的基因序列设计shrna并连接到质粒pacyc184上,组成重组质粒pacyc184
‑
shrna,重组质粒pacyc184
‑
shrna热激转化导入dn5α感受态中,通过测序验证shrna是否连接成功。
11.s3.shrna连接成功后,重组质粒pacyc184
‑
shrna导入大肠杆菌sm10感受态中。
12.s4.将含有重组质粒pacyc184
‑
shrna的大肠杆菌sm10以接合的方式导入到野生型溶藻弧菌中并通过16s测序验证。
13.s5.使用qrt
‑
pcr检测psts稳定沉默株中该基因的相对表达量。其中,每个基因设计两个位点的shrna,选择沉默效率最佳的稳定沉默菌株命名为“psts
‑
rnai”,即本发明的vibrio alginolyticuspsts
‑
rnai。
14.s6.通过粘附性实验、生物膜形成实验、运动性实验、毛细血管趋化实验验证本psts基因稳定稳定沉默株与野生型溶藻弧菌毒力的差异。本发明还通过对psts基因稳定沉默株的转录组测序,揭示psts基因可能通过调控细菌分泌中相关基因来影响溶藻弧菌的毒力。
15.本发明具有如下有益效果:
16.1.本发明溶藻弧菌psts基因稳定沉默株的粘附能力、生物膜形成能力、运动性以及趋化性显著低于野生型溶藻弧菌,可用于研制预防或治疗溶藻弧菌病疫苗。
17.2.转录组测序分析结果表明,psts基因的稳定沉默改变了溶藻弧菌的转录组表达,psts基因可能通过调控细菌分泌中相关基因,进而影响溶藻弧菌的毒力。这说明溶藻弧菌psts基因稳定沉默株可用于研究溶藻弧菌的致病机理,可为水产动物溶藻弧菌病的预防和治疗寻找新的靶点。
附图说明
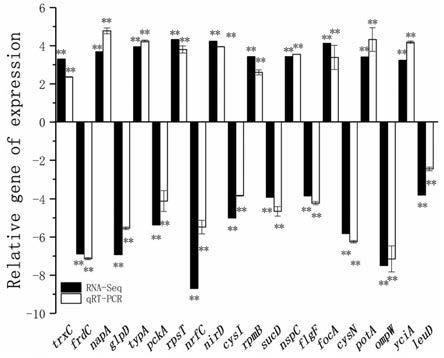
18.图1为转录组数据与qrt
‑
pcr结果对比图。
19.图2为溶藻弧菌psts基因稳定沉默效率图。
20.数据表示为平均值
±
sd;每组进行三次独立的生物学重复,**代表p<0.01。
21.图3为野生型溶藻弧菌与psts基因稳定沉默菌株的生长曲线图。
22.图4为野生型溶藻弧菌及psts基因稳定沉默菌株的粘附能力结果图。
23.图5为野生型溶藻弧菌及psts基因稳定沉默菌株的生物膜形成能力结果图。
24.图6为野生型溶藻弧菌及psts基因稳定沉默菌株的运动性结果图。
25.a:菌落直径大小b:细菌在半固体琼脂平板上的生长情况
26.图7为野生型溶藻弧菌及psts基因稳定沉默菌株的趋化性结果图。
27.图8为溶藻弧菌psts基因稳定沉默菌株的转录组碱基组成分布图。
28.其中,图(a),(b),(c)为野生型溶藻弧菌的转录组碱基组成分布图;图(d),(e),(f)为溶藻弧菌psts基因稳定沉默菌株的转录组碱基组成分布图。
29.横坐标是reads碱基坐标,坐标表示reads上从5’到3’端依次碱基的排列;
30.纵坐标是所有reads在该测序位置碱基占的百分比,不同碱基用不同颜色表示。
31.图9为溶藻弧菌psts基因稳定沉默菌株的转录组碱基质量分布图。
32.横坐标是reads碱基坐位置,表示reads上从5’到3’端依次碱基的排列;
33.纵坐标是所有reads在该位点处碱基的q值。
34.前半部分为双端测序序列的第一端测序reads的q值分布情况,后半部分为另一端测序reads的q值分布情况。
35.图10为溶藻弧菌psts基因稳定沉默菌株的转录组碱基错误率分布图。
36.横坐标是reads碱基坐位置,表示reads上从5’到3’端依次碱基的排列;
37.纵坐标是所有reads在该位点处碱基的平均错误率(%)。
38.前半部分为双端测序序列的第一端测序reads的错误率分布情况,后半部分为另一端测序reads的错误率分布情况。
39.图11为溶藻弧菌psts基因稳定沉默菌株的差异基因统计结果图。
40.a:差异基因火山图,每个点代表特定的基因
41.b:差异基因上调与下调基因数目。
42.图12为溶藻弧菌psts基因稳定沉默菌株的差异基因go注释图。
43.横坐标为go的二级term,纵坐标左边表示占总基因的比值,右边表示基因数目。
44.cellularprocess细胞过程;metabolicprocess代谢过程;localization本地化;biologicalregulation生物调节;responsetostimulus刺激反应;locomotion运动;interspeciesinteractionbetweenorganisms生物间物种间的相互作用;cellularanatomicalentity细胞解剖实体;protein
‑
containingcomplex由蛋白质复合组成;catalyticactivity催化活性;binding汇集;transporteractivity转运活性;transcriptionregulatoractivity转录调节活性;structuralmoleculeactivity结构分子活性;smallmoleculesensoractivity小分子传感器活性;moleculartransduceractivity活动分子传感器;translationregulatoractivity翻译调节活性;antioxidantactivity抗氧化活性;molecularfunctionregulation分子功能监管;molecularcarrieractivity分子载体活动
45.图13为溶藻弧菌psts基因稳定沉默菌株的差异基因go富集图
46.a:柱状图b:气泡图
47.a横坐标为goterm,纵坐标表示富集率,p<0.001标记为***,p<0.01标记为**,p<0.05则标记为*
48.ribosome核糖体;intracelluarribonucleoproteincomplex核糖核蛋白复杂;ribonucleoproteincomplex核蛋白复合体;structuralconstituentofribosome核糖体的结构组成;structuralmoleculeactivity结构分子活性;cytoplasmicprocess胞质突;rnabindingrna结合;multi
‑
organismprocess多生物过程;intracellularorganelle细胞内的细胞器;peptidemetabolicprocess肽代谢过程;intracellularnon
‑
membrane
‑
boundedorganelle细胞内的膜结合边界organelle细胞器;non
‑
membrane
‑
boundedorganelle膜结合边界细胞器;translation翻译;branched
‑
chainaminoacidbiosyntheticprocess支链氨基酸生物合成过程;pathogenesis发病原;cellularlipidcatabolicprocess细胞脂质分解代谢过程;cellularamidmetabolicprocess代谢过程中的细胞;secretion内分泌;
49.b横坐标为富集率,值越大则富集程度越大,纵坐标为goterm,气泡大小表示富集到的基因数目。
50.ribosome核糖;intracellularribonucleoproteincomplex细胞内核糖核蛋白
复合物
51.ribonucleoproteincomplex核糖核蛋白复合物;structuralconstituentofribosome核糖体的结构成分;structuralmoleculeactivity结构分子活性;cytoplasmicpart细胞质部分;
52.peptidebiosyntheticprocess肽生物合成过程;rnabinding核糖核酸结合multi
‑
organismprocessintracellularorganellepeptidemetabolicprocess多生物加工脱细胞细胞器肽代谢过程;intracellularnon
‑
membrane
‑
boundedorganelle细胞内非膜结合细胞器
53.organelle细胞器;non
‑
membrane
‑
boundedorganelle非膜结合细胞器;translation翻译
54.branched
‑
chainaminoacidbiosyntheticprocess支链氨基酸生物合成过程;pathogenesis发病机理;cellularlipidcatabolicprocesscellularamidemetabolicprocess细胞脂质分解代谢过程细胞酰胺代谢过程;secretion分泌
55.图14为溶藻弧菌psts基因稳定沉默菌株的差异基因kegg注释图。
56.横坐标为基因数目,纵坐标为二级pathway名称。
57.ribosome核糖体;c5
‑
brancheddibasicacidmetabolismc5
‑
支链二元酸代谢
58.valine,leucineandisoleucinebiosynthesis缬氨酸、亮氨酸和异亮氨酸生物合成
59.bacterialsecretionsystem细菌分泌系统;glycerolipidmetabolism甘油脂代谢
60.phosphotransferasesystem(pts)磷酸转移酶系统
61.butanoatemetabolismcitratecycle(tcacycle)丁酸代谢柠檬酸循环(tca循环)
62.propanoatemetabolism丙酸代谢;pentosephosphatepathway戊糖磷酸途径
63.arginineandprolinemetabolism精氨酸和脯氨酸代谢
64.aminoacyl
‑
trnabiosynthesis氨酰trna生物合成
65.phosphatidylinositolsignalingsystem磷脂酰肌醇信号系统
66.drugmetabolism
‑
otherenzymes药物代谢
‑
其他酶;rnadegradation核糖核酸降解
67.carbonfixationpathwaysinprokaryotes原核生物的固碳途径
68.pyrimidinemetabolism嘧啶代谢;sulfurmetabolism硫代谢
69.pyruvatemetabolism丙酮酸代谢
70.biofilmformation
‑
vibriocholerae生物膜形成
‑
霍乱弧菌
71.图15为溶藻弧菌psts基因稳定沉默菌株的差异基因kegg富集图。
72.a:柱状图b:气泡图
73.a横坐标为pathway名称,纵坐标表示富集率,p<0.001标记为***,p<0.01标记为**,p<0.05则标记为*
74.ribosome核糖体;c5
‑
brancheddibasicacidmetabolismc5
‑
支链二元酸代谢
75.valine,leucineandisoleucinebiosynthesis缬氨酸、亮氨酸和异亮氨酸生物
合成
76.bacterialsecretionsystem细菌分泌系统;glycerolipidmetabolism甘油脂代谢
77.phosphotransferasesystem(pts)磷酸转移酶系统
78.butanoatemetabolismcitratecycle(tcacycle)丁酸代谢柠檬酸循环(tca循环)
79.propanoatemetabolism丙酸代谢;pentosephosphatepathway戊糖磷酸途径
80.arginineandprolinemetabolism精氨酸和脯氨酸代谢;aminoacyl
‑
trnabiosynthesis氨酰trna生物合成;phosphatidylinositolsignalingsystem磷脂酰肌醇信号系统
81.drugmetabolism
‑
otherenzymes药物代谢
‑
其他酶;rnadegradation核糖核酸降解
82.carbonfixationpathwaysinprokaryotes原核生物的固碳途径
83.pyrimidinemetabolism嘧啶代谢;sulfurmetabolism硫代谢;pyruvatemetabolism丙酮酸代谢;biofilmformation
‑
vibriocholerae生物膜形成
‑
霍乱弧菌
84.b横坐标为富集率,值越大则富集程度越大,纵坐标为pathway名称,气泡大小表示富集到的基因数目。
85.aminoacidmetabolism氨基酸代谢;carbohydratemetabolism碳水化合物代谢
86.glycanbiosynthesisandmetabolism聚糖生物合成和代谢
87.metabolismofcofactorsandvitamins辅因子和维生素的代谢
88.metabolismofterpenoidsandpolyketides萜类化合物和聚酮类化合物的代谢
89.xenobioticsbiodegradationandmetabolism异生物质的生物降解和代谢
90.replicationandrepair复制和修复;translation翻译;signaltransduction信号转导
91.cellmotility细胞活力;transportandcatabolism运输和分解;circulatorysystem循环系统;digestivesystem消化系统;environmentaladaptation环境适应
92.immunesystem免疫系统;cancer:overview癌症:概述
93.cardiovasculardisease心血管病;drugresistance:antineoplastic耐药性:抗肿瘤
94.infectiousdisease:bacterial传染病:细菌性;infectiousdisease:viral传染病:病毒性
95.图16为溶藻弧菌psts基因稳定沉默菌株的常见差异基因功能富集弦图。
96.a:go功能富集弦图b:kegg通路富集弦图
97.c:转录组测序中的细菌分泌系统通路图
98.go功能富集弦图:左边表示差异基因表达量,右边表示goterm,
99.kegg通路富集弦图:右边表示pathway名称。
具体实施方式
100.为了更好地理解本发明,下面结合实施例和附图对本发明做进一步的详细说明,但本领域技术人员了解,下述实施例不是对本发明保护范围的限制,任何在本发明基础上做出的改变和变化,都在本发明的保护范围之内。
101.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
102.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
103.溶藻弧菌nd
‑
01由本实验室分离并保存于
‑
80℃冰箱;大肠杆菌sm10购自中国天根生物有限公司并保存于本实验室
‑
80℃冰箱;大肠杆菌dh5α感受态购自北京全式金生物有限公司;实验用鱼购自厦门市集美区菜市场。
104.实施例1验证转录组数据
105.1、细菌培养条件
106.将保存于
‑
80℃超低温冰箱的溶藻弧菌nd
‑
01、大肠杆菌sm10在固体lb培养基上划线,将其放在28℃,37℃生化培养箱中培养12
‑
24h。挑取单菌落接种于lb液体培养基中,分别放在28℃,37℃,转速为210rmp的恒温摇床中过夜培养。为了验证转录组数据的可靠性,将野生型溶藻弧菌接种至lb液体培养基中培养至浓度为108cfu/ml,加入五味子至终浓度为30mg/ml处理野生型溶藻弧菌4h,用于下一步rna提取。同等情况下将没有任何处理的野生型溶藻弧菌作为对照,每个培养条件设置三个重复。
107.2、溶藻弧菌总rna的提取
108.使用trizol法提取溶藻弧菌总rna。
109.3、用多功能微孔板检测仪及普通琼脂糖凝胶电泳分别检测rna质量及浓度。
110.4、溶藻弧菌总rna反转录
111.提取的溶藻弧菌总rna立即使用全式金反转录试剂盒进行反转录。
112.5、psts基因扩增
113.根据本课题组前期对溶藻弧菌(30mg/ml五味子处理4h)进行的转录组测序结果,选取可能与溶藻弧菌毒力有关的脂多糖合成通路和pst系统基因psts,根据基因序列(seq id no:1)用primer 5.0设计特异性引物扩增目的基因及16s,用于实时荧光定量pcr检测目的基因的表达水平。引物序列由厦门博瑞公司合成(表1
‑
1)。
114.psts基因序列(seq id no:1)
115.atgaaaaagacagtaatcggtgcaatcgcacttctaggcgcaatggcagtgactcctgtttctgctaaagaaactatctctgcagtgggttctagcagcgtaactccactgatggaagttttctctgaaacgtacatgaagaagaaccctaacgtatttatcgaagttcaaggccctggttcttcagctggtgttaaagcagcaaaaaatggttcagcagaccttggtatgtcttctcgtaatctaaaagactctgaaaaagaatcaacactaatagaagaagtggttgctcgtgatggtatcgcagtggttgttaacccacaaaacaaactgcctggcctaacagcagagcaagtgactgcaatctacaaaggcgaagtatcaaactggaaagaagtcggtggtgcagacaagccaatcgtagcaattactcgtgacacggcttcaggtactcgtggcgcatttgaagacatcatgtctcttaaaatgaagatttctggtaagaaggtatcagctatctctcaacgtgctcaagttgcaaacggtaacggcgcactcaaaacaatggttgcatctaacccatacgcaatcggctacatttcactaggtacggtagacaacacagttaacgctctagcaatcgacggtgttgatgcaacagtggctaacgtgaaaaacggttcttacaaagagctcgtccattccttgttctttacaaagaaggcaagccatcagctgaaacgcaaaaattcctagactggatgctaactgaagatgcgcaaaagctagttgaccaaaacggttacatctcagttcactaa
116.表1
‑
1 溶藻弧菌psts及16s引物序列
[0117][0118][0119]
使用普通pcr试剂盒进行目的基因扩增。
[0120]
使用普通琼脂糖凝胶电泳验证pcr产物是否是目的片段,用于下一步实验。
[0121]
6、pcr产物纯化
[0122]
使用购自北京全式金有限公司的胶回收试剂盒进行pcr产物纯化。
[0123]
7、实时荧光定量pcr(qrt
‑
pcr)分析
[0124]
本实验采用北京全式金有限公司transstart top green qpcr supermix试剂盒,按照说明书进行配制qrt
‑
pcr反应体系,使用sybr
‑
green法分析经五味子处理后的溶藻弧菌目的基因的相对表达量,引物序列见表1
‑
1,内参基因选用16s rna。将每个目的基因回收得到的标准品稀释成10
‑2‑
10
‑7用于制作qrt
‑
pcr标准曲线,每个样品做3个生物学重复。本实验采用双标曲法计算目的基因的相对表达量。qrt
‑
pcr反应体系如下:
[0125]
qpcr supermix5μl上游引物(10mmol/l)0.25μl下游引物(10mmol/l)0.25μlcdna0.5μlddh2o4μl总体积10μl
[0126]
将上述样品短暂离心,不能有气泡,不能震荡,防止实验数据有误。将短暂离心好的样品放入荧光定量rcr仪中进行扩增,程序如下:
[0127]
表1
‑
2 实时荧光定量pcr反应程序
[0128][0129]
通过对转录组数据分析,发现psts在五味子处理4h后显著下调,下调了2.44倍,使用qrt
‑
pcr检测经五味子处理4h后各基因的相对表达水平,psts的相对表达量为2.9
‑
倍。如图1所示,使用qrt
‑
pcr检测各基因的相对表达量与转录组数据趋势一致,证明了转录组数
据的准确性。
[0130]
实施例2溶藻弧菌稳定沉默菌株的构建
[0131]
根据以上基因筛选结果,通过使用rnai技术构建溶藻弧菌psts基因稳定沉默株。
[0132]
1、pacyc184质粒的提取
[0133]
将保存于本实验的含pacyc184质粒的大肠杆菌,按照plasmid miniprep kit试剂盒提取质粒。
[0134]
2、pacyc184质粒双酶切及纯化回收
[0135]
使用限制性内切酶bamh i和sph i对含有bamh i与sph i识别位点的pacyc184质粒进行双酶切,反应体系如下:
[0136]
bamh i1μlsph i1μl10*kbuffer2μl质粒1.6μl水19.4μl总体积25μl
[0137]
按照上述体系配置混合液后,涡旋混合瞬时离心,放置水浴锅(37℃)中反应3h。酶切后利用凝胶电泳成像系统判断酶切效果,若有两条清晰的条带(一条在4200bp位置,一条在150bp位置),则用tiangel midi purification kit试剂盒纯化回收4200bp位置的条带。
[0138]
3、pacyc184
‑
shrna重组载体的构建
[0139]
根据psts基因序列,使用网站http://rnaidesigner.thermofisher.com设计两个不同位点的特异性shrna,并送至上海博瑞生物工程有限公司合成。shrna序列见表2
‑
1。
[0140]
表2
‑
1溶藻弧菌psts基因特异性shrna序列
[0141][0142][0143]
合成后的shrna,12000g,4℃离心5min,加水溶解成100μm工作液,短暂离心后配成如下反应体系:
[0144]
ddh2o15μl退火缓冲液5μldna oligo a(100μm)2.5μl
dna oligob(100μm)2.5μl总体积25μl
[0145]
退火反应程序为:
[0146]
95℃2min每90s下降1℃,降至16℃约120min4℃forever
[0147]
通过粘性末端连接酶solution i将目的基因与酶切纯化产物连接,具体步骤如下:
[0148]
(1)在200μl离心管中配制如下连接体系:
[0149]
退火后的双链shrna6μl线性质粒2μlsolution i8μl总体积16μl
[0150]
(2)短暂离心后,16℃反应过夜。
[0151]
4、重组载体转化dh5a感受态
[0152]
将上述重组质粒通过热激转化导入到dh5α感受态中,并通过测序检测shrna是否连接成功。热激转化具体步骤如下:
[0153]
(1)将100μldh5α感受态及上述连接产物置于冰上融化,向dh5α感受态中加入10μl的连接产物并轻柔吹打混匀,冰浴30min。
[0154]
(2)42℃水浴90s,立即冰浴2min。
[0155]
(3)向上述混合液中加入890μl的液体lb培养基(预冷),在37℃,110rpm的恒温摇床上孵育45min。
[0156]
(4)5000rpm离心5min,除去500μl的上清液,取100μl菌液涂布于含有氯霉素的固体lb培养基平板上,置于37℃生化培养箱中培养12
‑
14h。
[0157]
(5)挑取单菌落于含有氯霉素的液体lb培养基中扩大培养,并送至厦门博瑞生物有限公司测序,验证目的片段是否与质粒连接成功。
[0158]
(6)验证成功后,将其保存于
‑
80℃超低温冰箱中待用。
[0159]
5、大肠杆菌sm10感受态制备和转化
[0160]
使用钙离子悬浮法制备大肠杆菌sm10感受态。
[0161]
6、重组e.coli sm10与野生型溶藻弧菌接合
[0162]
(1)将含有重组质粒的大肠杆菌sm10和野生型溶藻弧菌以1:100的比例分别接种于含有氯霉素及不含有氯霉素的lb液体培养基中,分别置于37℃,28℃,转速为210rpm的恒温摇床中过夜培养。
[0163]
(2)将上述过夜培养的菌液分别接种于新鲜的lb液体培养基中,37/28℃,210rpm培养至od600为0.3
‑
0.4。
[0164]
(3)分别取1ml菌液于1.5ml离心管中,4000g常温离心1min,弃上清,重复此步3
‑
4次,彻底除去氯霉素。
[0165]
(4)向沉淀中加入1mlpbs重悬菌体,含有重组质粒的大肠杆菌sm10和野生型溶藻弧菌以1:1,1;3,3:1比例混合,4000g常温离心1min,弃上清,加入300μlpbs重悬菌体。
[0166]
(5)取100μl上述混合液涂布于含有氯霉素的tcbs培养基平板上,置于28℃生化培养箱中培养24
‑
48h。
[0167]
(6)挑取单菌落接种于含有氯霉素的lb液体培养基中,28℃,210rpm,培养12
‑
14h,保存于
‑
80℃。
[0168]
7、qrt
‑
pcr检测溶藻弧菌psts基因沉默株沉默效果
[0169]
溶藻弧菌psts基因稳定沉默菌株构建完成后,使用实时荧光定量pcr检测稳定沉默菌株相应基因的表达水平,以含有原始pacyc184质粒的溶藻弧菌作为对照,1内参基因选用16s rna。
[0170]
根据目的基因序列设计shrna并连接到质粒上,组成重组质粒,重组质粒通过测序验证shrna连接成功后,使用结合的方式导入到野生型溶藻弧菌中并通过16s测序验证。通过使用qrt
‑
pcr检测psts稳定沉默株中该基因的相对表达量。其中,每个基因设计两个位点的shrna,选择沉默效率最好的供今后实验使用。如图2所示,与野生型溶藻弧菌相比,两株溶藻弧菌psts稳定沉默菌株中该基因的表达量为45.031
‑
,2.17
‑
倍。将沉默效率最佳的稳定沉默菌株命名为“psts
‑
rnai”,用于后续生物学实验。
[0171]
实施例3溶藻弧菌psts基因沉默菌株生长曲线试验
[0172]
(1)将野生型溶藻弧菌与溶藻弧菌psts基因沉默菌株分别以1:100的比例接种于无任何抗性及含有氯霉素的lb液体培养基中,28℃,210rpm培养过夜。
[0173]
(2)使用酶标仪将菌液浓度调整至0d600=0.02。
[0174]
(3)取10μl菌液于96孔板中,每个样品设置三个平行。
[0175]
(4)向菌液中加入190μl新鲜lb液体培养基并混匀。
[0176]
(5)放置于28℃生化培养箱中,每个一个小时测量一次od600并记录,直至达到生长稳定期。
[0177]
如图3所示,与野生型溶藻弧菌相比,psts稳定沉默菌株的生长在指数期的前期快于野生型溶藻弧菌,而在到达稳定期前稳定沉默菌株的生长明显慢于野生型溶藻弧菌。
[0178]
实施例4溶藻弧菌psts基因沉默菌株玻片粘附试验
[0179]
一、石斑鱼粘液制备
[0180]
将购自福建省厦门市集美区菜市场的健康石斑鱼放在实验室暂养3
‑
5天,待其状态稳定后进行粘附制备。石斑鱼粘液的制备方法如下:
[0181]
(1)将石斑鱼体表用pbs冲洗干净,用玻片轻轻刮取石斑鱼体表粘液并收集到50ml离心管中。
[0182]
(2)4℃放置过夜,15000g,4℃离心30min,重复离心两次。
[0183]
(3)将上清液转移至一新的10ml离心管中以除去粘液中较大的颗粒杂质。
[0184]
(4)将上述所得粘液先用0.45μm的无菌滤膜除菌,再用0.22μm的无菌滤膜彻底除菌。
[0185]
(5)采用考马斯亮蓝法检测石斑鱼粘液蛋白浓度,并用pbs调整其蛋白浓度为1mg/ml。
[0186]
(6)将石斑鱼粘液分装于1.5ml离心管中并保存于
‑
80℃冰箱。
[0187]
二、玻片粘附实验
[0188]
使用玻片粘附实验检测野生型溶藻弧菌及溶藻弧菌沉默菌株对石斑鱼体表粘液
的粘附能力。具体步骤如下:
[0189]
(1)玻片准备:将玻片在清水中刷洗干净放在搪瓷缸中,加入没过玻片的蒸馏水和洗洁精加热煮沸30min,用蒸馏水将玻片上多余的洗洁精冲洗干净,将处理好的玻片放置在无水乙醇中泡12h后备用。
[0190]
(2)将处理好的玻片摆放在超净工作台中,打开紫外灯灭菌20min。
[0191]
(3)吸取20μl石斑鱼粘液于玻片中央并涂开,涂均匀后在超净工作台中放置12h。
[0192]
(4)将野生型溶藻弧菌和溶藻弧菌沉默菌株分别接种于不含有任何抗性和含有氯霉素的lb液体培养基中,28℃,210rpm过夜培养。
[0193]
(5)向带有粘液的玻片上滴加200μl的4%的甲醇并涂开,固定30min。
[0194]
(6)用酶标仪测菌液浓度并用pbs调整od600至0.2。
[0195]
(7)取200μl涂在上述玻片上,并置于湿润条件下孵育2h。
[0196]
(8)将玻片倾向一侧倒掉多余菌液并用pbs轻柔的冲洗2
‑
3次,风干。
[0197]
(9)风干后,用200μl4%的甲醇固定30min。
[0198]
(10)用200μl0.1%的结晶紫溶液染色3min。
[0199]
(11)用pbs冲洗3
‑
4次直至流下无色液体,放在超净工作台中风干。
[0200]
(12)风干后用生物显微镜(10
×
100)观察玻片上细菌数量,每个玻片随机选取10个视野计数。每个样品3个重复,实验重复3次。
[0201]
如图4所示,溶藻弧菌稳定沉默菌株psts
‑
rnai对石斑鱼粘液的粘附能力显著降低(p<0.01),与野生型溶藻弧菌相比,溶藻弧菌稳定沉默菌株psts
‑
rnai粘附能力分别下降了76.21%。
[0202]
实施例5溶藻弧菌psts基因沉默菌株生物膜形成实验
[0203]
溶藻弧菌生物膜形成能力实验,具体步骤如下:
[0204]
(1)将野生型溶藻弧菌与溶藻弧菌psts基因沉默菌株分别以1:100的比例接种于无任何抗性及含有氯霉素的lb液体培养基中,28℃,210rpm培养过夜。
[0205]
(2)用酶标仪测菌液浓度并用pbs调整od600至0.2。
[0206]
(3)取100μl置于96孔板中,每个样品六个重复,放在28℃生长培养箱中培养12
‑
14h。
[0207]
(4)小心的将每个孔中的菌液吸出,注意不要将生物膜吸出,并用pbs轻柔的清洗2
‑
3次除去游离的菌体,放在65℃烘箱中盖盖烘干。
[0208]
(5)加入150μl的0.1%的结晶紫染色15min。
[0209]
(6)用pbs轻柔的清洗4
‑
6次至废液呈无色。
[0210]
(7)用酶标仪测其od590,即为其生物膜形成能力,每个样品重复3次,实验重复3次。
[0211]
如图5所示,溶藻弧菌稳定沉默菌株psts
‑
rna的生物膜形成能力显著下降(p<0.01),与野生型溶藻弧菌相比,溶藻弧菌稳定沉默菌株psts
‑
rna的生物膜形成能力分别降低了68.13%。
[0212]
实施例6溶藻弧菌psts基因沉默菌株运动性实验
[0213]
溶藻弧菌在半固体lb培养基平板上运动性实验,具体步骤如下:
[0214]
(1)将野生型溶藻弧菌与溶藻弧菌psts基因沉默菌株分别以1:100的比例接种于
无任何抗性及含有氯霉素的lb液体培养基中,28℃,210rpm培养过夜。
[0215]
(2)用酶标仪测菌液浓度并用pbs调整od600至0.2。
[0216]
(3)取1μl菌液滴在lb半固体平板的中央,放置28℃生化培养箱中培养16h。
[0217]
(4)用菌落计数仪测量菌落直径大小。每个样品3个重复,实验重复3次。
[0218]
图6显示了溶藻弧菌在半固体琼脂平板上的运动能力。结果表明,与野生型溶藻弧菌相比,溶藻弧菌psts基因沉默菌株运动能力均显著减弱(p<0.01)。如图6所示,野生型溶藻弧菌在半固体琼脂平板上可以形成较大的圆形菌落,而溶藻弧菌psts基因稳定沉默菌株均表现出一定的运动缺陷。
[0219]
实施例7溶藻弧菌psts基因沉默菌株毛细管趋化实验
[0220]
毛细管趋化实验具体步骤如下:
[0221]
(1)将野生型溶藻弧菌与溶藻弧菌psts基因沉默菌株分别以1:100的比例接种于无任何抗性及含有氯霉素的lb液体培养基中,28℃,210rpm培养过夜。
[0222]
(2)4000g,常温离心3min,弃上清。
[0223]
(3)用pbs重悬菌体并调od600=1.0,用注射器吸取300μl的该菌液备用。
[0224]
(4)用石斑鱼粘液将内径为0.1mm的毛细管充满并将一端封闭。
[0225]
(5)将毛细管开口端放到上述注射器中,另一端放在另一新的注射器中,以保持该装置的稳定,将该装置放置在28℃生化培养箱中孵育1h。
[0226]
(6)将毛细管内容物吹出并稀释成10
‑2‑
10
‑
5,取100μl涂布于lb固体平板上,置于28℃生化培养箱中培养12
‑
14h。
[0227]
(7)用平板计数法计算其趋化能力,每个样品3个重复,实验重复3次。
[0228]
如图7所示,与野生型溶藻弧菌相比,溶藻弧菌psts基因稳定沉默菌株的趋化性显著性降低,降低了33.33%,这表明psts基因可能是通过细菌趋化性调控溶藻弧菌的毒力。
[0229]
实施例8溶藻弧菌psts基因沉默菌株转录组测序
[0230]
一、样品处理
[0231]
本次转录组测序由上海美吉生物科技有限公司完成,按照其要求处理样品,具体操作如下:
[0232]
(1)将野生型溶藻弧菌与溶藻弧菌psts基因稳定沉默菌株在lb固体培养基上划线并置于28℃生化培养箱中培养24h。
[0233]
(2)挑取单菌落于lb液体培养基中,28℃,210rpm培养12
‑
14h,以1:100的比例将过夜培养的细菌接种于新鲜的lb液体培养基中,28℃,210rpm培养至od600=0.3~0.4。
[0234]
(3)取30ml菌液于50ml离心管中,6000rpm,28℃,离心5min,弃上清。
[0235]
(4)将菌体置于干冰中寄送到上海美吉生物公司进行转录组测序。
[0236]
二、实验流程
[0237]
本次实验利用truseqtm stranded total rna library prep kit试剂建立文库,具体步骤如下:
[0238]
(1)采用reagent(invitrogen)提取样品总rna,用nanodrop 2000检测提取的rna的浓度和纯度,用琼脂糖电泳检测其完整性并用agilent 2100测出rna的值。
[0239]
(2)原核生物不能直接从总rna中抽提出mrna,一般采用ribo
‑
zero magnetic kit去rrna。
[0240]
(3)向mrna中放入fragmentation buffer使其断裂成200bp左右的小片段,以符合上机要求。
[0241]
(4)为了让cdna第二链中包含a/u/c/g,本次实验以小片段mrna作为模板,在合成第二条链时用dutp代替dttp。
[0242]
(5)为了将cdna两端的粘性末端补平,向其中加入end repair mix并在3’端加一个a碱基用作“y”接头。
[0243]
(6)为了是文库中只含有第一条链,向其中加入ung酶消化第二条链。
[0244]
(7)在文库富集后用tbs380(picogreen)对其进行定量并采用桥式pcr扩增生成clusters,然后采用illumina hiseq测序平台进行2*150bp/300bp测序。
[0245]
三、测序数据质控
[0246]
测序数据一般包括含有接头及低质量的reads,为了保证后续生物信息学分析的可靠性,必须对原始数据进行过滤从而得到高质量的clean reads。数据过滤的具体要求包括除去含有接头的reads;除去含有未知碱基大于10%的reads以及修剪后不足20bp的序列。
[0247]
如图8可知,各样品中的各种碱基含量基本一致,且未知碱基数小于10%,可以用于后续生物信息学分析。
[0248]
如图9所示,各样品碱基q值在30以上,表明其碱基质量符合后续分析要求。
[0249]
如图10所示,所有样品碱基错误率均小于1%符合后续分析要求。
[0250]
为了验证选取的溶藻弧菌参考基因组(登录号:ncbi gcf_000354175.2)是否可以进行下一步数据分析的依据,我们将修剪后的序列与参考基因组进行比对,结果如表8
‑
1所示,野生型溶藻弧菌与稳定沉默菌株的序列覆盖率均在96%以上。
[0251]
表8
‑
1 测序数据与溶藻弧菌参考基因组比对的mapping比率统计结果
[0252][0253][0254]
四、差异基因识别
[0255]
将质控后得到的clean reads与参考基因组(登录号:ncbi gcf_000354175.2)比对,采用burrows
‑
wheeler方法对比并得到用于后续差异基因统计学分析的数据(mappedreads)及检验转录组数据的质量。使用表达定量软件rsem对基因的表达水平进行定量分析,得到基因在各个样品中的表达量。计算每个样品之间的相关系数,保证实验设计的合理性。利用deseq2(http://bioconductor.org/packages/stats/bioc/deseq2/)检测两样本间的差异基因(degs),以|log2fc|≥1且q值<0.05为筛选条件。
[0256]
将得到的溶藻弧菌各样本的clean readers与参考基因组采用burrows
‑
wheeler方法进比对并对基因及转录本用软件rsem进行定量分析,得到各基因在每个样本中的表达量,然后分析基因在稳定沉默菌株中的表达差异性,其阈值为|log2fc|≥1且q值<0.05。在溶藻弧菌psts稳定沉默菌株中共鉴定出4425个基因,与野生型溶藻弧菌相比检测出2189个差异基因,其中有1134个下调基因,1055个上调基因(图11)。
[0257]
五、差异基因功能分析
[0258]
基因本体论(go,gene ontology)注释和kyoto encyclopedia of genes and genomes(kegg)是基于不同分类揭示基因功能的两种数据库,也是目前发掘高通量测序数据的重要手段。
[0259]
go是使用本体论代表生物学知识来提供有关基因产物功能的信息,通过标准化不同物种,不同数据库中关于基因与基因产物的生物学术语使研究人员更加了解基因背后的功能及生物学意义。在生物体内,每个基因都不是独立存在并发挥作用,需要与其他基因协同合作共同发挥某一生物学功能。
[0260]
而kegg则是含有各种通路信息将帮助研究人员更加了解基因参与的具体生物学功能。将经过分析获得的差异基因映射到go数据库(http://www.geneontology.org/)及kegg数据库(http://www.genome.jp/kegg/)中进行基因功能注释,采用软件goatools及r脚本将其富集到具体的go术语及pathway中,揭示其具有的生物学意义。
[0261]
如图12所示,溶藻弧菌psts基因稳定沉默菌株中检测到的2189个差异基因映射到了20个go二级term,其中涉及到生物过程中7个二级term,细胞组分中2个二级term以及分子功能中11个二级term。这些基因主要参与生物调节(122个基因,5.57%);细胞过程(662个基因,30.24%);定位(161个基因,7.35%);代谢过程(534个基因,24.39%);细胞解剖实体(830个基因,37.91%);结合(681个基因,31.11%);催化活性(942个基因,43.03%)及运输活动(173个基因,7.9%)等功能。
[0262]
由图13可知,这些差异基因主要富集到核糖体合成相关过程,细胞器及生物合成过程,其中发病和细菌分泌与细菌毒力密切相关。
[0263]
如图14所示,在溶藻弧菌psts基因稳定沉默菌株中检测到的差异基因映射到40个二级pathway,包括代谢中11个二级pathway、遗传信息处理中4个二级pathway、环境信息处理中2个pathway、细胞过程中4个二级pathway、生物系统中9个二级pathway以及人类疾病中10个二级pathway。这些基因主要参与到氨基酸代谢(115个基因);碳水化合物代谢(135个基因);能量代谢(82个基因);辅助因子和维生素的代谢(75个基因);膜运输(124个基因);信号转导(83个基因)以及细胞群落
‑
原核生物(89个基因)等通路。由图15可以看出,这些差异基因显著富集到了“核糖体”、“c5
‑
分支二元酸代谢”、“缬氨酸,亮氨酸和异亮氨酸的生物合成”以及“细菌分泌系统”,其中细菌分泌系统已经被证实与细菌毒力有关。
[0264]
根据go功能富集图和kegg通路富集图可知,这些差异基因在go功能富集中显著富集到了细菌分泌功能,在kegg通路富集中显著富集到了细菌分泌系统,本实验将两组基因取并集并绘制功能富集弦图,从而阐述溶藻弧菌psts调控溶藻弧菌毒力的分子机制。
[0265]
由图16a知,这些基因被富集到了10个go term,包括分泌、蛋白质分泌、细胞分泌、蛋白质跨细胞外膜转运、跨膜转运、蛋白质通过sec复合物转运、单生物细胞内转运、细胞内运输、细胞内蛋白质转运以及蛋白质靶向。
[0266]
如图16b所示,这些基因能够在6个通路中发挥作用,包括细菌分泌系统、蛋白质出口、生物膜形成
‑
霍乱弧菌、生物膜形成
‑
铜绿假单胞菌、群体感应以及鞭毛组装。其中,细菌分泌系统,生物膜形成,群体感应及鞭毛组装均与细菌毒力有关。
[0267]
如图16c所示,在细菌分泌系统中,i型分泌系统中tolc显著下调,ii型分泌系统中secd/f、secegy、yaic、yidc以及gspdfghijklme显著下调,iii型分泌系统中检测到的所有基因均显著下调,v型分泌系统中tatb与tatc显著下调以及vi型分泌系统中hcp、icmf以及clpv显著下调。由此可见,psts基因的缺失会导致细菌分泌系统中大部分基因下调从而影响细菌毒力。
[0268]
虽然以上描述了本发明的具体实施方式,但是熟悉本技术领域的技术人员应当理解,我们所描述的具体的实施例只是说明性的,而不是用于对本发明的范围的限定,熟悉本领域的技术人员在依照本发明的精神所作的等效的修饰以及变化,都应当涵盖在本发明的权利要求所保护的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。