1.本发明具体涉及一种用于生产磺基化重组水蛭素的重组菌及其制备方法与应用,属于基因工程技术领域。
背景技术:
2.水蛭唾液腺分泌的水蛭素是一种已知的最有效的天然凝血酶抑制剂。作为凝血酶的直接抑制剂,水蛭素与目前应用于临床的肝素在凝血酶抑制原理上有很大不同。肝素是通过催化其他抗凝剂(例如抗凝血酶iii或者肝素辅助因子ii)从而抑制凝血酶的活性,是一种间接的抗凝药物,无法单独发挥其抗凝活性。而水蛭素则是通过其特殊的结构,直接与凝血酶的活性位点结合,从而不可逆的使其失去酶活。与肝素相比,水蛭素具有更高的抗凝血活性,更强的特异性以及稳定性,不会引起出血等副作用,其能够抵抗消化系统酶作用的特点使其可以口服用药,且适应面更广,在弥漫性血管内凝血等病症中有着更好的疗效。这些特征赋予了水蛭素在中风、血栓等病症治疗中巨大的应用前景及效益。
3.天然水蛭素产量较低和提取成本较高等却严重限制了其在医疗领域的应用。面对这一难题,利用生物工程宿主表达生产能够替代的重组水蛭素则成为了最有前景的方案。多个研究组利用大肠杆菌或者酵母成功表达了具有较高活性的重组水蛭素产品。2000年左右由德国拜耳公司研发的重组水蛭素产品重组lepirudin获得fda认证并在美国上市,这标志了重组水蛭素巨大的应用潜力。
4.天然水蛭素是一种由63~65个氨基酸构成的短肽,其n端含有三个二硫键形成的功能结构域,c端第63位的酪氨酸在细胞的高尔基体中被磺基化酶修饰,形成了磺基化的酪氨酸。这些特征对于水蛭素的活性至关重要。然而由于缺少功能性的磺基化酶,绝大部分生物工程宿主无法完成水蛭素的翻译后修饰反应,这使得缺乏磺基化的重组水蛭素与天然水蛭素相比,活性有了明显的降低。部分研究通过体外的酶促反应,能够实现产物的磺基化,但是这极大的增加了生产成本与难度,增大了下游纯化的压力,同时很难实现大规模的生产。
技术实现要素:
5.为了提高磺基化重组水蛭素的合成产量,降低生产成本,本发明提供了一种用于生产磺基化重组水蛭素的重组菌,所述重组菌过表达磺基化酶基因和水蛭素基因,出发菌株为大肠杆菌;所述水蛭素基因,核苷酸序列为seq id no.1-seq id no.3中的一种,所述磺基化酶基因,核苷酸序列如seq id no.4所示。
6.本发明还提供了上述重组菌的制备方法,具体步骤如下:
7.1)水蛭素基因表达载体构建:在所述水蛭素基因的5’端添加编码周质分泌肽的核苷酸序列,得到带有周质分泌肽的水蛭素基因,然后连接到质粒载体中,获得表达水蛭素的表达载体;
8.2)磺基化酶基因辅助载体构建:在所述磺基化酶基因的5’端添加编码周质分泌肽的核苷酸序列,得到带有周质分泌肽的磺基化酶基因,然后连接到质粒载体,获得表达磺基化酶的辅助载体;步骤1)和步骤2)中所述编码周质分泌肽的核苷酸序列如seq id no.5所示;
9.3)转化:将步骤1)获得的表达载体和步骤2)获得的辅助载体共转化至大肠杆菌,获得重组菌。
10.进一步地限定,步骤1)中所述的质粒载体为pet-22b载体;步骤2)中所述的质粒载体为pacyc-duet1载体。
11.进一步地限定,步骤1)中所述带有周质分泌肽的水蛭素基因,扩增所用引物为f1和r1;所述f1的核苷酸序列为:atacatatgaagtatctgttacctaccgc,所述r1的核苷酸序列为:ggtgctcgagtcattgcagatagtagtacgga。
12.进一步地限定,步骤2)中所述带有周质分泌肽的磺基化酶基因,扩增所用引物为f2和r2,所述f2的核苷酸序列为tatacatatgaaatatctgctgcctacc,所述r2的核苷酸序列为agactcgagtcatcagcagctaatggt。
13.本发明还提供了上述重组菌在生产磺基化重组水蛭素中的应用。
14.进一步地限定,所述生产磺基化重组水蛭素的方法如下:
15.1)上述构建的重组菌加入含卡那霉素及氯霉素的lb培养基的试管中,37℃震荡培养,转速100~250rpm,时间6~16h;培养后将试管中菌液转移至摇瓶中,37℃,100-250rpm震荡培养至od
600 0.4~1.0;
16.2)然后向得到的菌液中加入iptg及4-nitrophenyl sulfate,终浓度分别为1mm及0.01μm,37℃培养4h~6h;得到的菌液离心或过滤,收集菌体沉淀;获得的沉淀中加入周质蛋白提取液提取获得蛋白溶液,经纯化后获得磺基化重组水蛭素。
17.进一步地限定,所述周质蛋白提取液配方为:蔗糖171.15g/l,edta0.19g/l,余量为水,用tris-base粉末将溶液至ph 8.0。
18.进一步地限定,所述纯化是指将获得的蛋白溶液透析48h-96h,透析过程中蒸馏水作为透析液,透析完成后离心去除沉淀,将获得的上清溶液进行冻干。
19.进一步地限定,所述冻干条件为温度-20~-80℃,时间24~72h。
20.有益效果
21.为了实现重组水蛭素直接表达本发明设计了一种磺基化重组水蛭素的生产方法。鉴于水蛭素特殊的二硫键结构,在水蛭素的n端添加了周质空间信号肽,周质表达水蛭素以促进水蛭素二硫键的正确形成。同时进一步的,通过同时表达来源于真细菌(eubacterium)的以芳香族化合物为底物的磺基化酶(arylsulfate sulfotransferase),即采用了共表达磺基化酶的方法。通过在水蛭素及磺基化酶的n端添加周质分泌肽,实现了两种蛋白在周质空间的共存,通过在培养基中添加含有芳香环的硫酸盐作为磺基化底物,磺基化酶能够在大肠杆菌的周质空间内发挥功能并实现重组水蛭素的磺基化反应,显著提升了重组水蛭素的活性。同时,基于水蛭素的特性。同时,利用周质蛋白提取及酸沉淀法,实现了水蛭素的一步纯化方法,能够一次性获得具有较高纯度的重组水蛭素产物,这极大的减轻了后续纯化的压力。
附图说明
22.图1重组水蛭素及磺基化水蛭素电泳结果,其中m,蛋白marker,从上至下依次为180、135、100、75、63、48、35、25、17、11kda;ct,未诱导菌液样品(对比例2);h,诱导后菌液样品(对比例1);h s,共表达磺基化酶的诱导后菌液样品;
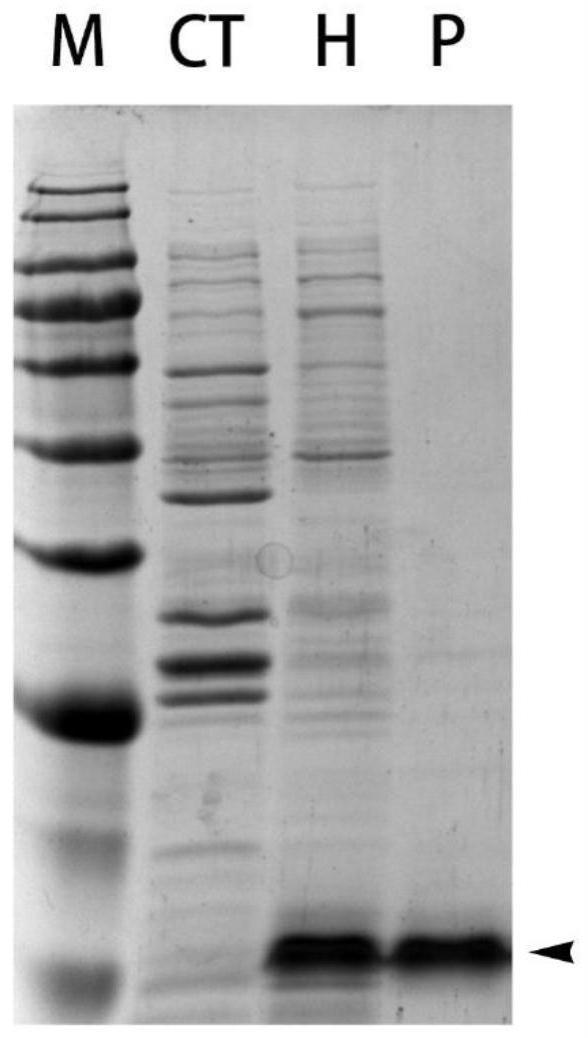
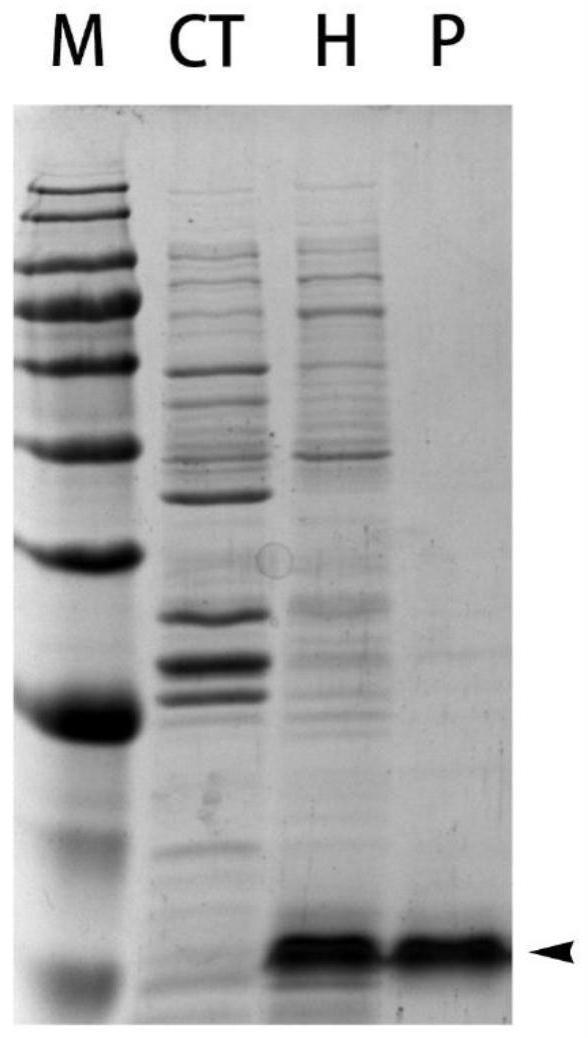
23.图2重组水蛭素纯化后电泳结果,其中m,蛋白marker,从上至下依次为180、135、100、75、63、48、35、25、17、11kda;ct,未诱导菌液样品(对比例2);h,诱导后菌液样品(对比例1);p,纯化后磺基化水蛭素样品;
24.图3两种水蛭素对于兔血清的抗凝血差异图,h,诱导后菌液样品(对比例1);h s,共表达磺基化酶的诱导后菌液样品,纵坐标为相对于诱导后菌液样品抗凝血效果的比例变化;
25.图4两种水蛭素对于羊血清的抗凝血差异图,h,诱导后菌液样品(对比例1);h s,共表达磺基化酶的诱导后菌液样品,纵坐标为相对于诱导后菌液样品抗凝血效果的比例变化。
具体实施方式
26.下面结合具体实施例对本发明做进一步说明,但本发明不受实施例的限制。
27.本发明所用的实验试剂、仪器设备等均可通过商业化途径购买获得,本领域技术人员应该理解,本发明中提及的目的基因克隆、菌种转化等如无特殊说明,各实验步骤均按照标准的分子克隆技术进行或参照相应试剂产品试剂盒说明书进行。
28.实施例1.用于生产磺基化重组水蛭素的重组菌的制备。
29.本实施例所制备的重组菌,过表达磺基化酶基因和水蛭素基因,所述水蛭素基因,核苷酸序列如seq id no.1所示,所述磺基化酶基因,核苷酸序列如seq id no.4所示,出发菌株为大肠杆菌。构建方法如下:
30.1)水蛭素基因表达载体构建:在所述水蛭素基因的5’端添加编码周质分泌肽的核苷酸序列,得到带有周质分泌肽的水蛭素基因,然后连接到质粒载体中,获得表达水蛭素的表达载体;具体方法如下:
31.将seq id no.5所示的编码周质分泌肽的核苷酸序列添加到seq id no.1所示的水蛭素基因的5’端,得到的序列送交基因合成公司进行序列合成。
32.利用引物f1及r1,所述f1的核苷酸序列为:atacatatgaagtatctgttacctaccgc,所述r1的核苷酸序列为:ggtgctcgagtcattgcagatagtagtacgga;以合成后的序列为模板,扩增带有周质分泌肽核苷酸的水蛭素基因,回收pcr产物,利用nde i与xho i限制性内切酶对扩增产物进行酶切,并与用同样限制性内切酶酶切后的pet-22b载体进行连接。
33.酶切体系为:nde i 1μl,xho i 1μl,载体或pcr扩增产物2ug,酶切缓冲液(10x)2μl,补充蒸馏水至总体积20μl,37℃酶切4h。
34.连接体系为:酶切后扩增产物7μl,酶切后载体1μl,连接液(10x)2μl,t4连接酶1μl,补充蒸馏水至总体积20μl,16℃连接12h,从而获得水蛭素表达载体。
35.2)磺基化酶基因辅助载体构建:在所述磺基化酶基因的5’端添加编码周质分泌肽的核苷酸序列,得到带有周质分泌肽的磺基化酶基因,然后连接到质粒载体,获得表达磺基化酶的辅助载体;具体方法如下:
36.将seq id no.5所示的编码周质分泌肽的核苷酸序列添加到seq id no.4所示的磺基化酶基因的5’端,得到的序列送交基因合成公司进行序列合成。
37.利用引物f2及r2,所述f2的核苷酸序列为tatacatatgaaatatctgctgcctacc,所述r2的核苷酸序列为agactcgagtcatcagcagctaatggt;以合成后的序列为模板,扩增带有周质分泌肽核苷酸的磺基化酶基因,利用nde i与xho i限制性内切酶对扩增后片段进行酶切,与用同样限制性内切酶酶切后的pacyc-duet1载体进行连接。
38.酶切体系为:nde i 1μl,xho i 1μl,载体或扩增2ug,酶切缓冲液(10x)2μl,补充蒸馏水至总体积20μl,37℃酶切4h。
39.连接体系为:酶切后扩增产物7μl,酶切后载体1μl,连接液(10x)2μl,t4连接酶1μl,补充蒸馏水至总体积20μl,16℃连接12h。获得表达磺基化酶的辅助载体。
40.3)转化:将步骤1)获得的水蛭素的表达载体及步骤2)获得的表达磺基化酶的辅助载体共转化至大肠杆菌bl21(de3)菌株中,涂布至含有卡那霉素及氯霉素的平板上;得到的平板中挑取单克隆,经鉴定后获得阳性重组菌。
41.实施例2.重复实施例1,与实施例1的不同在于,本实施例中所述水蛭素基因,核苷酸序列如seq id no.2所示,与实施例1相比,本实施例中水蛭素基因第181位碱基g替换为碱基t,第183位碱基a替换为碱基c。其余步骤参照实施例1。
42.实施例3.重复实施例1,与实施例1的不同在于,本实施例中所述水蛭素基因,核苷酸序列如seq id no.3所示,与实施例1相比,本实施例中水蛭素基因第181位碱基g替换为碱基t,第183位碱基a替换为碱基c,第184位碱基g替换为碱基t,第186位碱基a替换为碱基c。其余步骤参照实施例1。
43.实施例4.磺基化重组水蛭素的生产。
44.1)将实施例1构建的重组菌涂布至含有双抗生素(卡那霉素及氯霉素)的平板上;培养后挑取单克隆,转移至含有预先加入双抗生素(卡那霉素及氯霉素)的lb培养基的试管中,37℃震荡培养,转速保持在250rpm,时间控制在6h;培养后得到的菌液转移至预先加入双抗生素(卡那霉素及氯霉素)的lb培养基中,37℃震荡培养,转速保持在250rpm,至od
600 0.4;
45.2)在步骤1)得到的菌液中加入iptg及硫酸盐底物4-nitrophenyl sulfate,终浓度分别为1mm及0.01μm,37℃培养4h;得到的菌液收集离心或过滤,去除上清并收集菌体沉淀;向获得的沉淀中加入周质蛋白提取液(蔗糖171.15g/l,edta0.19g/l,用tris-base粉末将溶液至ph 8.0),4℃缓慢搅拌后,离心或过滤收集上清溶液;在上清中缓慢加入冰醋酸溶液至酸性(ph 3.0),4℃静置30min后,离心收集上清;将获得的蛋白溶液进行透析48h-96h,透析过程中蒸馏水作为透析液,透析完成后离心去除沉淀,将获得的上清溶液进行冻干(-80℃,72h)即可获得磺基化重组水蛭素。
46.本实施例中水蛭素产量在摇瓶水平可以达到~97.5mg/l,抗凝血效果可以提升2倍以上(图3~图4)。
47.实施例5.磺基化重组水蛭素的生产。
48.1)将实施例2构建的重组菌涂布至含有双抗生素(卡那霉素及氯霉素)的平板上;其余参照实施例4所述的步骤。
49.本实施例生产获得的磺基化重组水蛭素,产量在摇瓶阶段可达到~96.8%,抗凝
血效果可以提升2倍以上(图略)。
50.实施例6.磺基化重组水蛭素的生产。
51.1)将实施例3构建的重组菌涂布至含有双抗生素(卡那霉素及氯霉素)的平板上;其余参照实施例4所述的步骤。
52.本实施例生产获得的磺基化重组水蛭素,产量在摇瓶阶段可达到~97.3%,抗凝血效果可以提升2倍以上(图略)。
53.实施例7.磺基化重组水蛭素的生产。
54.1)将实施例1构建的重组菌涂布至含有双抗生素(卡那霉素及氯霉素)的平板上;培养后挑取单克隆,转移至含有预先加入双抗生素(卡那霉素及氯霉素)的lb培养基的试管中,37℃震荡培养,转速保持在100rpm,时间控制在16h;培养后得到的菌液转移至预先加入双抗生素(卡那霉素及氯霉素)的lb培养基中,37℃震荡培养转速保持在100rpm,至od
600 1;
55.2)在步骤1)得到的菌液中加入iptg及硫酸盐底物4-nitrophenyl sulfate,终浓度分别为1mm及0.01μm,37℃培养6h;得到的菌液收集离心或过滤,去除上清并收集菌体沉淀;向获得的沉淀中加入周质蛋白提取液(蔗糖171.15g/l,edta0.19g/l,用tris-base粉末将溶液至ph 8.0),4℃缓慢搅拌后,离心或过滤收集上清溶液;在上清中缓慢加入冰醋酸溶液至酸性(ph 3.0),4℃静置30min后,离心收集上清;获得的蛋白溶液进行透析48h-96h,透析过程中蒸馏水作为透析液,透析完成后离心去除沉淀,将获得的上清溶液进行冻干(-20℃,24h)即可获得磺基化重组水蛭素。
56.本实施例生产的水蛭素产量在摇瓶水平可以达到~97.1mg/l,抗凝血效果可以提升2倍以上(图略)。
57.对比例1.参照实施例1所述的重组菌的构建方法,与实施例1不同在于,本对比例中,仅将水蛭素表达载体转化到大肠杆菌bl21(de3)菌株中,得到不表达磺基化酶的重组菌,然后参照实施例4所述的方法进行水蛭素的生产。
58.对比例2,参照实施例1所述的重组菌的构建方法,与实施例1不同在于,本对比例中,仅将水蛭素表达载体转化到大肠杆菌bl21(de3)菌株中,得到不表达磺基化酶的重组菌,然后参照实施例4所述的方法进行水蛭素的生产,与实施例4不同的是,本对比例中,在生产水蛭素时体系中不加入iptg及硫酸盐底物4-nitrophenyl sulfate。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。