基于四环素和cumate的共调控序列
发明领域
1.本发明涉及用于调控目的核酸片段转录的基于四环素和cumate依赖的核酸序列。具体地,本发明涉及用于调控目的核酸片段转录的核酸序列,所述核酸序列包含至少2个拷贝的结合四环素依赖的反式激活物(reverse tetracycline controlled transactivator,rtta)的teto-操作子序列(tet operator,teto)、1个拷贝的包含tata盒序列的最小启动子序列和至少1个拷贝的结合cymr转录阻遏物(transcription repressor)的cuo-操作子序列(cumate operator,cuo)。进一步,在上述核酸序列3'端下游和被调控目的核酸片段5’端上游之间还存在可剪接的内含子序列,其可用于在保持无诱导泄露的情况下,进一步提高诱导后转录活性。再进一步,本发明还涉及含有以上调控序列的载体、病毒、细胞、转基因植物或动物。
背景技术:
2.基因表达可以通过对其中的几个步骤,包括转录,rna剪接,翻译和翻译后修饰,进行调控来实现对基因表达的调控,在转录步骤对特定基因或目的核酸片段进行调控是最广泛、最有效的表达调控方式。通过外源因素控制细胞、植物或动物体内特定基因和核酸片段的转录和表达开启或关闭的诱导表达系统在生物基础科研、生物制药、基因治疗、细胞治疗、转基因植物或动物改良等领域起关键作用。通常上述的诱导表达系统在设计上由两个部分组成:1)在被调控目的核酸片段5’端上游的一段特定核酸序列,一般可以和转录激活物或阻遏物结合调控目的核酸片段的转录,比如包含操作子(operator)的核酸序列(此核酸序列以下称为响应元件);2)在受外部因素调控下,能和上述特定核酸序列结合或分离,一般带有转录激活或阻遏功能的单个或多个调控物,通常是表达后的蛋白。外部因素可以是环境因素,例如温度、光照等;或某种成分物质,例如参与生命活动的代谢物、荷尔蒙、金属离子或人造化合物等。
[0003]“四环素诱导表达系统(tetracycline inducible system或tet system)”是目前在科学研究上和商业上最广泛使用的诱导表达系统之一(参见,例如,gossen,m.and h.bujard(1992)."tight control of gene expression in mammalian cells by tetracycline-responsive promoters."proc natl acad sci u s a 89(12):5547-5551.,美国专利号5,888,981,5,814,618,6,004,941,5,814,618,7,541,446,wo96/01313和wo00/75347(上述文献通过引用结合于此))。其主要由四环素依赖的调控物和含有teto操作子的响应元件组成,通过使用四环素诱导的方式调控和含有teto操作子的响应元件相连的目的核酸片段的转录。此含有teto操作子的响应元件可以在没有四环素的条件下和转录激活物结合,并在结合后启动下游被调控目的核酸片段转录;也可以在组成型活跃启动子(constitutively active promoter)的下游,被调控目的核酸片段的上游,然后在没有四环素的条件下和四环素依赖的阻遏物结合,抑制下游被调控的目的核酸片段转录。传统上,四环素依赖的调控物在没有四环素的条件下和teto操作子结合,在有四环素的条件下和teto操作子分离。比如基于此原理设计的激活物,通过去除环境中的四环素可以启动被
调控目的核酸片段的转录(美国专利号5,464,758,6,914,124,5,789,156,6,271,348,wo96/01313和wo00/75347)。之后发展出反式的四环素依赖的调控物,其仅在有四环素的条件下和teto操作子结合。基于反式的四环素依赖的激活物,在环境中加入四环素可以激活被调控目的核酸片段转录(美国专利号5,654,168,6,136,954,5,789,156,6,271,348,6,087,166,6,271,341,7,541,446,wo96/01313和wo00/75347),比如在培养基中加入四环素激活被调控目的核酸片段转录或给转基因动物注射四环素激活体内由基因工程转入的被调控目的基因的转录和表达。
[0004]
被调控核酸片段在诱导条件下的转录活性和非诱导条件下的泄露转录活性是评价诱导表达系统优劣的两个重要指标,好的诱导表达系统需要具有更高的诱导转录活性和更低的泄露转录活性。四环素诱导系统自第一次报道以来被多个实验室优化,其性能不断提升。主要优化包括四环素依赖的调控物和含有teto操作子的响应元件。在四环素依赖的调控物优化方面主要集中在(1)在尽可能保持诱导后转录活性的情况下,降低无诱导条件下的泄露转录活性,提高诱导/泄露转录活性比例;(2)优化调控物和四环素及其衍生物做为诱导剂结合的特异性和亲和力,在更低的四环素及其衍生物浓度下达到最大诱导转录活性,同时降低调控物在无诱导剂条件和响应元件的亲和力。(参见zhou,x.,et al.(2006)."optimization of the tet-on system for regulated gene expression through viral evolution."gene ther 13(19):1382-1390.,美国专利号8,383,364,7,541,446)。优化含有teto操作子的响应元件主要集中在(1)优化teto操作子的拷贝数目和连接序列。在提高响应元件性能的同时,增强多拷贝连续teto操作子序列的稳定性尤其是在病毒载体上的稳定性;(2)在不显著影响诱导后转录活性的条件下,降低最小启动子(mini promoter)的无诱导基础泄露转录活性,提高诱导/泄露转录活性比例(参见loew,r.,et al.(2010)."improved tet-responsive promoters with minimized background expression."bmc biotechnol 10:81.,美国专利号9,181,556)。目前广泛使用的商业四环素诱导系统主要为clontech laboratories,inc.公司的advanced inducible gene expression systems(文件编号:pt3898-1(102312),其中的四环素依赖的反式激活物rtta和含有teto操作子的响应元件tre(含有多拷贝连续teto操作子序列和最小启动子序列的核酸序列,tet response element,下文称为tre)在下文中分别被称为rtta
adv
和tre
adv
),advanced inducible gene expression systems(文件编号:pt3945-1(101612))和3g inducible expression systems(文件编号:pt5148-1(010814),其中的四环素依赖的调控物rtta和含有teto操作子的响应元件tre在下文中分别被称为rtta
3g
和tre
3g
)。
[0005]
cumate诱导系统(cumate inducible system)开发自pseudomonas putida的p-cym操纵子,由在组成型活性启动子tata盒下游的cuo操作子和cumate及其衍生物依赖的并能和cuo操作子结合的阻遏物cymr蛋白组成。在无cumate的条件下,cymr蛋白和cuo操作子结合,抑制下游被调控目的核酸片段的转录;当cymr蛋白和cumate结合后,其和cuo操作子的亲和力下降并分离,下游被调控目的核酸片段转录不再受抑制。比如将cuo操作子连接在被调控目的核酸片段和组成型活性启动子序列之间,同时在细胞内组成性活跃表达cymr阻遏物。当培养基中没有cumate及其衍生物诱导剂时,表达的cymr蛋白与cuo操作子结合抑制被调控目的核酸片段转录;当培养基中添加诱导剂时,与cumate及其衍生物结合的cymr蛋
白和cuo操作子分离,被调控目的核酸片段的转录不再受抑制(参照wo02088346a2、wo2006037215a1(上述文献通过引用结合于此))。
[0006]
cumate诱导系统的优化主要集中在(1)优化最短的有效cuo操作子序列。(2)筛选可以溶于水的和p-cumate功能相似的cumate及衍生物诱导剂。(3)构建类似tet-off的诱导系统,由cymr激活物(如构建cymr和hsv vp-16转录激活结构域的融合蛋白)和含有多拷贝连续cuo操作子的响应元件(序列包含多段重复cuo序列和下游最小启动子)组成。在无cumate诱导剂的条件下,cymr激活物和cuo操作子结合激活被调控目的核酸片段的转录;在有cumate诱导剂的条件下,cymr激活物和cuo操作子分离,被调控目的核酸片段停止转录。(4)构建类似tet-on的诱导系统,由反式cymr激活物(通过突变和筛选,使得反式cymr在有cumate诱导剂时和cuo操作子结合,没有cumate诱导剂时和cuo操作子分离,并且构建反式cymr和hsv vp-16转录激活结构域的融合蛋白做为反式cymr激活物)和含有多拷贝连续cuo操作子的响应元件组成。在有cumate诱导剂条件下,反式cymr激活物和响应元件结合,激活被调控目的核酸片段转录;在没有cumate诱导剂条件下,反式cymr激活物和响应元件分离,被调控目的核酸片段停止转录(参照:mullick,a.,et al.(2006)."the cumate gene-switch:a system for regulated expression in mammalian cells."bmc biotechnol 6:43.;wo02088346a2、wo2006037215a1)。目前广泛使用的cumate诱导系统主要为sbi system biosciences公司的sparq cumate switch系统(文件编号:1-090810)。
[0007]
在目前的各种诱导表达系统开发和改进中,主要优化都集中在降低被调控目的核酸片段在无诱导条件下的基础泄露转录活性的控制上,而在诱导条件下的转录活性不是优化重点,导致被诱导表达系统调控的目的核酸片段的诱导后转录活性低于常见的组成型活性启动子(constitutively active promoter)控制下的转录活性。而在生物技术开发中,提高目的核酸片段在诱导后的绝对转录活性和控制其在无诱导条件下的泄露转录活性同样重要。比如在生物制药领域中,生产带有细胞毒性的重组蛋白或病毒载体,既需要提高目的核酸片段编码的蛋白在诱导后的表达量,也需要为保证生产细胞系的培养状态和稳定性而控制目的核酸片段在无诱导条件下的泄露表达量。所以一种既能提高目的核酸片段在诱导条件下的转录活性,同时又能控制该目的核酸片段在无诱导条件下的泄露转录活性的诱导表达系统可以广泛促进生物技术在诸多领域的研究、开发和产业化。
技术实现要素:
[0008]
本发明涉及四环素和cumate依赖的,能调控目的核酸片段转录的核酸序列,具体地,所述核酸序列包含至少2个拷贝的结合四环素或其衍生物依赖的反式激活物(reverse tetracycline controlled transactivator,rtta)的teto操作子序列(tet operator,teto)、1个拷贝的包含tata盒序列的最小启动子序列和至少1个拷贝的结合cymr转录阻遏物(transcription repressor)的cuo-操作子序列(cumate operator,cuo)。进一步,在上述核酸序列3’端下游和被调控目的核酸片段5’端上游之间存在的可以剪接的内含子序列可以在保持无诱导泄露的情况下,进一步提高诱导后转录活性。再进一步,本发明还涉及含有以上调控序列并以调控基因表达为目的的载体、病毒、细胞、转基因植物或动物。
[0009]
术语“目的核酸片段”一般可以指脱氧核糖核酸片段(dna片段),根据应用目的可以是指基因,如编码蛋白的核酸序列;可以为一段核糖核酸(rna),如rna病毒的全部或部分
基因组rna片段、微小rna(microrna,简称mirna)、小分子干扰核糖核酸(small interfering rna,简称sirna)、长链非编码核糖核酸(long non-doding rnas,简称lncrna),crispr基因编辑系统的导向rna(guide rna,grna)、转运核糖核酸(transfer rna,简称trna)、核糖体核糖核酸(ribosomal rna,简称rrna)、适体(aptamers)、能和其他核酸结合的核糖核酸片段、能和特定蛋白结合的核糖核酸片段、或任意一段核糖核酸;也可以是以上一段或多段核酸序列的组合。
[0010]
术语“载体”是一种包含核酸分子,通常被用作将外来遗传物质,如上述目的核酸片段,人工携带到另一个细胞中的媒介物,并且在其中复制和/或表达。在功能上,所有载体一般都可以用于克隆并携带外来目的核酸片段,同时也有专门设计的用于核酸片段转录和蛋白质表达的表达载体。质粒,病毒载体,粘粒(cosmids)和人工染色体是载体的四种主要类型。其中,最常用的载体是质粒。所有工程质粒载体都包含在细菌中复制的复制起点,用于插入目的核酸片段的多克隆位点和用于选择阳性菌株的标记基因。病毒载体是另一种常用载体,通常用来将遗传物质,如目的核酸片段输送到细胞中。此过程可以在生物体内(体内)或细胞培养物中(体外)进行。基于病毒自身进化出的多种分子机制,如对遗传物质的保护、基于受体对宿主细胞的选择、遗传物质向宿主细胞内的递送、在宿主细胞内的复制和/或表达、对宿主细胞生长、代谢、繁殖复制和防御机制的调整、以及在高等动物体内对免疫系统的抑制和/或逃逸,可以有效地将目的核酸片段转移到感染的靶细胞内。除了被用于分子生物学研究中,病毒载体还常被用于基因治疗、细胞治疗、免疫治疗和疫苗开发。
[0011]
通常诱导表达系统在增强被调控目的核酸片段的诱导后转录活性的同时也会增加其在无诱导条件下的泄露转录活性;而常用的控制无诱导条件下泄露转录活性的策略比如通过点突变降低反式激活物在无诱导剂的条件下和操作子的亲和力或降低操作子下游的最小启动子的基础活性都会影响诱导后的最大转录活性。这使得绝大多数的单一诱导表达系统都为了平衡在无诱导条件下的泄露转录活性而降低了在诱导条件下对被调控目的核酸片段的转录激活活性。设计含有多调控组件的复合诱导表达系统是解决上述问题的有效方向。在本发明实现的复合诱导表达系统中,一方面优化提高第一诱导表达系统中的激活物和相应响应元件组合的诱导后最大转录活性,另一方面用第二诱导表达系统中的阻遏物和相应相应响应元件组合控制复合诱导表达系统因此提高的泄露转录活性,所述的复合诱导表达系统比如使用tet-on诱导表达系统做为第一诱导表达系统,cumate诱导表达系统做为第二诱导表达系统。上述复合诱导表达系统的复合响应元件序列包含至少2个拷贝的结合受四环素或其衍生物调控的反式激活物(reverse tetracycline controlled transactivator,rtta)的teto操作子序列(tet operator)、1个拷贝的包含tata盒序列的最小启动子序列和至少1个拷贝的结合cymr转录阻遏物(transcription repressor)的cuo操作子序列(cuo operator)。
[0012]
本发明人发现,tet-on和cumate复合诱导表达系统的诱导转录活性和无诱导泄露转录活性受(1)多拷贝teto操作子及其连接核酸序列,(2)tre响应元件中最小启动子序列;(3)cuo操作子和最小启动子中tata盒相对位置三个条件影响。第三代tet-on系统中tre
3g
响应元件比第二代tet-on系统中tre
adv
响应元件控制更严格,有更低的非诱导泄露转录活性;cuo操作子和tata盒越近对泄露转录活性控制越严格但同时对诱导转录活性影响越大,越远对泄露转录活性控制越弱但同时对诱导转录活性影响越小。基于以上发现,本发明的用
于调控目的核酸片段转录的核酸序列包含:至少2个拷贝(例如2、3、4、5、6、7或更多个,优选7个)的能与受四环素或其衍生物调控的反式激活物rtta结合的teto-操作子序列,优选地所述teto-操作子序列如seq id no:24所示;一段包含tata盒序列的最小启动子序列,优选地所述最小启动子序列如seq id no:25或seq id no:26所示,更优选地所述最小启动子序列如seq id no:25所示;以及与受cumate调控的转录阻遏物cymr结合的cuo-操作子序列,优选地所述cuo操作子序列如seq id no:27所示。优选地,至少一段cuo操作子序列在上述启动子tata盒的下游,优选在tata盒下游10bp至100bp之间,如14bp,30bp,50bp和100bp;进一步优选地,有且仅有一段cuo序列在tata盒的下游30bp至50bp;更近一步,有且仅有一段cuo序列在tata盒的下游30bp或50bp位置。优选地,本发明的用于调控目的核酸片段转录的核酸序列如seq id no:23、seq id no:28、seq id no:29或seq id no:30所示,更优选地,如seq id no:23或seq id no:28所示。
[0013]
在表达质粒中启动子下游的内含子一般可以提高转录信使rna(mrna)的稳定性并提高mrna转运出细胞核的效率(参照akef,a.,et al.(2015)."splicing promotes the nuclear export of beta-globin mrna by overcoming nuclear retention elements."rna 21(11):1908-1920)并提高目的核酸片段的表达量。本发明人发现在单一诱导表达系统中的响应元件3’端下游连接可剪接的内含子同样也能提高诱导后被调控目的核酸片段的表达量,但同时会显著增加被调控目的核酸片段的无诱导泄露表达量。本发明所述四环素和cumate依赖的复合响应元件序列3’端下游以及被调控目的核酸片段5’端上游之间连接可以剪接的内含子序列可以在不显著增加无诱导泄露表达量的同时显著提高诱导表达量。基于此,在本发明中,优选地,在所述四环素和cumate依赖的复合响应元件序列3’端下游以及目的核酸片段5’端上游之间连接可剪接的内含子片段。上述内含子的选择并无特定限制,本领域技术人员可以理解,凡是在哺乳动物细胞中能进行rna剪接(splicing)的序列都能实现上述功能。可以选择的内含子序列包括但不限于常用的克隆载体上的内含子如:兔β-球蛋白内含子、源自人β-球蛋白和免疫球蛋白重链内含子的杂合内含子、ef-1α内含子a、sv40内含子、源自腺病毒和免疫球蛋白重链内含子的杂合内含子、修饰的人巨细胞病毒内含子、源自鸡β-肌动蛋白(cba)和小鼠微小病毒(mmv)内含子的杂合内含子、源自鸡β-肌动蛋白和兔β-球蛋白内含子的嵌合物和mp1内含子;也可以是任意真核生物任意基因的任意内含子;或者是基于内含子剪接规则设计的人造内含子序列。本发明实施例使用的内含子序列可以是如seq id no:31所示。
[0014]
上述tet-on和cumate复合诱导表达系统在无四环素或其衍生物和cumate诱导剂(cumate或其功能类似物)的环境下,rtta反式激活物不能和复合响应元件结合,同时cymr阻遏物和复合响应元件中cuo操作子结合进一步抑制被调控的目的核酸片段因为rtta反式激活物非特异性结合或最小启动子的基础活性引起的泄露转录活性;在仅有cumate诱导剂的环境下,rtta反式激活物和结合了cumate诱导剂的cymr阻遏物都不和复合响应元件结合,被调控目的核酸片段因为rtta反式激活物非特异性结合或最小启动子的基础活性引起极低量转录;在仅有四环素或其衍生物的环境下,rtta反式激活物和复合响应元件中teto操作子结合激活被调控目的核酸片段转录,但cymr阻遏物同时也和复合响应元件中的cuo操作子结合使得被调控目的核酸片段仅能有限转录;在四环素或其衍生物和cumate诱导剂同时存在的环境下,rtta反式激活物和复合响应元件中的teto操作子结合,同时结合了
cumate诱导剂的cymr阻遏物和复合响应元件中cuo操作子分离,使得被调控目的核酸片段最大活性转录。上述rtta反式激活物核酸编码序列优选经过人密码子优化的seq id no:18;cymr优选经过人密码子优化的seq id no:15。
[0015]
上述tet-on和cumate复合诱导表达系统在生物基础科研、生物制药、基因治疗、细胞治疗、转基因植物或动物改良中都能应用,包括但不限于在细胞、动物或植物中,控制编码蛋白质的核酸序列转录的开启或关闭;控制非蛋白编码核酸序列的转录的开启和关闭,如rna病毒的全部或部分基因组rna片段、微小rna(microrna,简称mirna)、小分子干扰核糖核酸(small interfering rna,简称sirna)、长链非编码核糖核酸(long non-doding rnas,简称lncrna),crispr基因编辑系统的导向rna(guide rna,grna)、转运核糖核酸(transfer rna,简称trna)、核糖体核糖核酸(ribosomal rna,简称rrna)、适体(aptamers)、能和其它核酸结合的核糖核酸片段、能和特定蛋白结合的核糖核酸片段、或任意一段核糖核酸;也可以是以上一段或多段核酸序列的组合。在一方面,上述tet-on和cumate复合诱导表达系统可以用于表达和生产在基因治疗、细胞治疗或免疫治疗领域的病毒载体;用于表达和生产有细胞毒性、或不稳定的蛋白质;用于在疫苗领域表达生产减毒疫苗或病毒样颗粒(viral like partical,简称vlp)疫苗;用于在转基因动物或植物中控制目的核酸片段转录表达的开启或关闭。
[0016]
在本发明中,可用于tet-on诱导表达系统的四环素及其衍生物包括在结构上与四环素相似的化合物,其能够与本发明所述四环素依赖的反式激活物rtta相结合,其结合常数ka至少达到10-6
m;优选地,其结合常数ka达到或强于10-9
m。四环素衍生物例如可以选自:多西环素(dox)、脱水四环素(atc)、氯四环素、土霉素和脱氧四环素。
[0017]
在本发明中,可用于cumate诱导表达系统的,与阻遏物cymr相结合的cumate功能类似物例如可以选自:对乙基苯甲酸、对丙基苯甲酸、对异丙基苯甲酸、对异丁基苯甲酸、对叔丁基苯甲酸,对正二甲基氨基苯甲酸,对正乙基氨基苯甲酸。以及例如在美国专利号7,745,592中描述的其他cumate功能类似物。
[0018]
可以转入包含本发明的四环素和cumate的共调控序列的载体的宿主细胞在原理上可以为任意细胞例如是细菌、真菌、动物细胞或植物细胞。在另一方面,本发明所述的四环素和cumate的共调控序列也可以通过病毒载体使用,例如制备的病毒载体所含核酸片段中含有本发明的四环素和cumate的共调控序列,在dna病毒载体中(如腺病毒、腺相关病毒)以脱氧核糖核酸存在,在rna病毒载体中(如逆转录病毒)以核糖核酸存在。
[0019]
如本领域技术人员可以理解的,对于转录受本发明的调控核酸序列控制的目的核酸片段没有特别的限制,只要其转录可以受控于本发明的调控核酸序列即可。
[0020]
在一个方面,本发明提供以下各项:
[0021]
第1项:核酸序列,所述核酸序列包含至少2个拷贝的能与受四环素或其衍生物调控的反式激活物rtta结合的teto-操作子序列、1个拷贝的包含tata盒序列的最小启动子序列和至少1个拷贝的与受cumate调控的转录阻遏物cymr结合的cuo-操作子序列,其中所述cuo-操作子序列在所述tata盒序列的3’端下游,和所述tata盒的距离间隔为10bp至100bp,优选为30bp至50bp,更优选为50bp。
[0022]
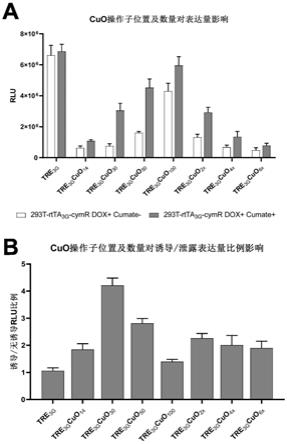
第2项:根据第1项所述的核酸序列,其中所述teto-操作子序列如seq id no:24所示,及/或所述最小启动子序列如seq id no:25或seq id no:26所示,及/或所述cuo-操作
子序列如seq id no:27所示。
[0023]
第3项:根据第2项所述的核酸序列,所述核酸序列如seq id no:23、seq id no:28、seq id no:29或seq id no:30所示。
[0024]
第4项:根据第1-3项中任一项所述的核酸序列,所述核酸序列在3’端还包含可剪接的内含子序列。
[0025]
第5项:载体,所述载体包含根据第1-4项中任一项所述的核酸序列。
[0026]
第6项:根据第5项所述的载体,其中所述载体是表达载体,所述表达载体包含处于根据第1-4项中任一项所述的核酸序列的3’端下游的目的核酸片段,并且所述目的核酸片段的转录受根据第1-4项中任一项所述的核酸序列的控制。
[0027]
第7项:宿主细胞,所述宿主细胞包含根据第1-4项中任一项所述的核酸序列或根据第5或6项所述的载体。
[0028]
第8项:在宿主细胞中诱导表达目的核酸片段的方法,所述方法包括以下步骤:
[0029]
(1)将根据第6项所述的载体以及rtta的编码序列和cymr的编码序列转入所述宿主细胞中;
[0030]
(2)在经过(1)的所述宿主细胞中表达rtta和cymr;以及
[0031]
(3)向经过(2)的所述宿主细胞提供四环素或其衍生物以及cumate或其功能类似物。
[0032]
第9项:根据第8项所述的方法,其中所述rtta是rtta
adv
或rtta
3g
,优选为rtta
3g
,更优选地所述rtta的编码序列如seq id no.18所示。
[0033]
第10项:根据第8项所述的方法,其中所述cymr的编码序列如seq id no.15所示。
[0034]
附图简述
[0035]
图1显示实施例2中cuo操作子在复合响应元件中的位置及数量对目的核酸片段诱导表达量和无诱导泄露表达量的影响。图1a显示仅加入dox诱导剂和同时加入dox和cuamte诱导剂对应的luciferase检测实验的rlu值;图1b显示加入cumate和无加入cuamte诱导剂rlu值得比值。
[0036]
图2显示实施例3中单调控响应元件、复合调控响应元件及响应元件下游连接内含子对目的核酸片段诱导表达量和无诱导泄露表达量的影响。图1a显示有/无dox和cumate诱导剂对应的luciferase检测实验的rlu值;图1b显示有/无dox和cumate诱导剂rlu值得比值。
[0037]
图3显示实施例4中不同内含子对tre
3g
cuo复合响应元件诱导表达和无诱导泄露表达影响。图1a显示有/无dox和cumate诱导剂对应的luciferase检测实验的rlu值;图1b显示有/无dox和cumate诱导剂rlu值得比值。
[0038]
图4显示实施例5中被tre
3g
cuo和tre
3g
cuo-bgi调控的目的核酸片段在不同诱导组合下的诱导转录活性。纵坐标显示不同诱导剂条件下luciferase检测实验的rlu值;4种颜色的柱状图显示四种加入诱导剂的组合;途中横线上数字代表对应的诱导条件下和无诱导条件下(白色)rlu比值。
具体实施方式
[0039]
提供以下实施例用以对本发明的技术方案进行说明,以下实施例不应被认为是对
本发明的范围和精神的限制。
[0040]
实施例1:质粒构建方法
[0041]
以下实施例所使用的分子克隆技术,例如,dna片段的pcr扩增、dna片段的限制性内切酶酶切、dna片段的凝胶回收、两段或多段dna片段的t4 dna连接酶连接、连接产物感受态细胞的转化、质粒小量制备及鉴定等方法均为本领域熟知技术。以下实施例中涉及以下试剂:pcr酶(thermo,f-530s);限制性内切酶(neb);t4 dna连接酶(invitrogen,15224041);dna片段凝胶回收试剂盒(omega,d2500-02);质粒小提试剂盒(tiangen,dp105-03);感受态细胞(xl-10gold,湖南丰晖生物科技有限公司,jz011);seq id no:1至seq id no:22所示的核酸序列由金斯瑞合成并用于本发明所述质粒构建,质粒测序鉴定由invitrogen公司完成。表1为构建质粒的引物信息;表2为附录序列seq id no:1至seq id no:31的元件组成说明;表3为质粒中各功能元件说明;表4为本发明构建的质粒编号及对应名称。。以下实施例中所涉及的各质粒所采用的元件序列信息为实现本发明的示例,本领域技术人员可以预期将以下实施例中所用质粒上各元件序列替换成其它生物学功能类似的元件序列也能达到本发明所述效果,包括但不限于质粒的骨架序列(如复制原点(replication origin)、抗性基因等)、酶切位点序列、转座子重复序列、诱导系统响应元件序列、隔离子(insulator)序列、启动子序列、内含子序列、聚腺苷酸信号(polya)序列、不同密码子优化的基因序列、以上各功能元件序列和基因序列的突变体以及各功能元件序列和基因序列的克隆位置、克隆顺序和克隆方向。具体的质粒构建方法如下所示:
[0042]
1.构建质粒18bf007:将合成序列seq id no:2(2900bp)用noti和asisi酶切并连接在质粒18bf003(seq id no:1)的noti和asisi酶切位点,从而构建得到质粒18bf007。
[0043]
2.构建质粒18bf011:将18bf007质粒用mlui和sphi酶切,凝胶回收1730bp片段并将其连接在18bf003质粒的mlui和sphi酶切位点从而构建得到质粒18bf011。
[0044]
3.构建质粒18bf210:将合成序列seq id no:3(1208bp)用spei和agei酶切并连接在质粒18bf011的avrii和agei酶切位点,从而构建得到质粒18bf210。
[0045]
4.构建质粒18bf211,18bf212,18bf213,18bf214,18bf215,18bf216,18bf217和18bf218:将合成序列seq id no:4(908bp)、序列seq id no:5(880bp)、序列seq id no:6(890bp)和序列seq id no:7(845bp)分别用mlui和clai酶切并分别连接在质粒18bf210的mlui和clai酶切位点,从而分别构建得到质粒18bf212、18bf211、18bf214和18bf213。将质粒18bf211、18bf212、18bf213和18bf214分别用bstbi酶切,并分别凝胶回收dna片段3932bp(18bf211)、3960bp(18bf212)、3897bp(18bf213)和3942bp(18bf214),并用t4连接酶连接以分别构建质粒18bf215、18bf216、18bf217和18bf218。
[0046]
5.构建质粒18bf229、18bf232、18bf233、18bf234、18bf235、18bf236、18bf237、18bf240和18bf241:以pgl3-basic(promega,e1751)为模板,luc-f(seq id no:32)和luc-r(seq id no:33)为引物pcr扩增luciferase基因片段(1728bp),并用bamhi和xhoi酶切处理,分别连接在质粒18bf210、18bf217、18bf218、18bf215、18bf216、18bf211、18bf212、18bf213和18bf214的bamhi和xhoi酶切位点,从而构建得到质粒18bf229、18bf232、18bf233、18bf234、18bf235、18bf236、18bf237、18bf240和18bf241。
[0047]
6.构建质粒18bf251、18bf252、18bf253、18bf254、18bf255、18bf256和18bf257:将合成序列seq id no:8(414bp)、序列seq id no:9(414bp)、序列seq id no:10(415bp)、序
列seq id no:11(472bp)、序列seq id no:12(588bp)、序列seq id no:13(704bp)和序列seq id no:22(376bp)分别用mlui和clai酶切并分别连接在质粒18bf235的mlui和clai酶切位点,从而分别构建得到质粒18bf251、18bf252、18bf253、18bf254、18bf255、18bf256和18bf257。
[0048]
7.构建质粒18bf261、18bf262、18bf263和18bf264:以序列17为模板,bgi(c&r)-f(seq id no:34)和bgi(c&r)-r(seq id no:35)为引物pcr扩增bgi(c&r)内含子序列(1036bp);以pef1alpha-ires-acgfp1(clontech)为模板,intron(ef-1a)-f(seq id no:36)和intron(ef-1a)-r(seq id no:37)为引物pcr扩增intron(ef-1a)内含子序列(962bp);以psi(promega#e1721)质粒为模板,intron(psi)-f(seq id no:38)和intron(psi)-r(seq id no:39)为引物pcr扩增intron(psi)内含子序列(152bp),并将以上三段pcr产物分别用clai和bamhi酶切处理,连接在质粒18bf235的clai和bamhi酶切位点,从而构建得到质粒18bf261、18bf263和18bf264。将合成的序列14(210bp)用clai和bamhi酶切,并分接在质粒18bf235的clai和bamhi酶切位点,从而构建得到质粒18bf262。
[0049]
8.构建质粒19bf075和19bf074:将合成的序列seq id no:15(633bp)和序列seq id no:16(1496bp)分别用clai和xhoi以及spei和agei酶切处理并依次连接在18bf007质粒的clai和xhoi酶切位点以及avrii和agei酶切位点从而构建得到19bf073质粒。将合成的序列seq id no:17(1979bp)用mlui和agei酶切并连接在18bf007质粒的mlui和agei酶切位点,替换cmv-bgi-mcs-pa序列,从而构建得到18bf008质粒。将合成的序列seq id no:18(768bp)和序列seq id no:19(765bp)分别用clai和xhoi酶切并分别连接在18bf008质粒的clai和xhoi酶切位点从而分别构建得到18bf085和18bf084质粒。将质粒19bf073用spei和agei酶切,凝胶回收3821bp片段并将其分别连接在18bf085和18bf084质粒的avrii和agei酶切位点从而分别构建得到19bf075和19bf074质粒。
[0050]
9.构建质粒18bf019:将合成的序列seq id no:21(1044bp)和序列seq id no:20(1320bp)分别用bamhi和xhoi以及xhoi和bglii酶切并连接在18bf011质粒的bamhi和bglii酶切位点从而构建得到18bf019质粒。
[0051]
10.构建质粒19bf229、19bf235和19bf237:将质粒18bf229、18bf235和18bf237分别用mlui和agei酶切,分别凝胶回收4605bp(18bf229)、3847bp(18bf235)和4341bp(18bf237)片段并将其分别连接在18bf007质粒的mlui和agei酶切位点从而分别构建得到19bf229、19bf235和19bf237质粒。
[0052]
表1.引物信息列表
[0053]
seq id no:引物名称引物序列(5'-3')32luc-ftcaggatccatctgcgatctaagtaagcttg33luc-rtcaactcgagctagaattacacggcgatc34bgi(c&r)-fgtcaatcgatggagtcgctgcgcgctg35bgi(c&r)-rgtcggatccctgtaggaaaaagaagaagg36intron(ef-1a)-fgtcaatcgatgtaagtgccgtgtgtg37intron(ef-1a)-rgtcggatccctgaaatggaagaaaaaaact38intron(psi)-fgtcaatcgatgtaagtatcaaggttacaag39intron(psi)-rgtcggatccctgtggagagaaaggc
[0054]
表2.附录序列元件组成说明
[0055][0056][0057]
表3.质粒功能元件说明
[0058]
[0059][0060]
表4.质粒编号及名称
[0061][0062]
实施例2:cuo操作子位置及数量对诱导表达量和无诱导泄露表达量的影响
[0063]
本实施例所述实验为研究和验证cuo操作子在tet-on和cumate复合响应元件的位置和拷贝数对复合响应元件诱导表达量和无诱导泄露表达量的影响以及优化确认最优的cuo操作子位置和拷贝数。本实施例基于tre
3g
响应元件中7xteto序列和最小启动子序列#1(seq id no:25),在tata盒下游间隔10bp至100bp范围内,分别在间隔14bp、30bp、50bp和100bp的位置上连接cuo操作子序列设计了tre
3g
cuo
14
(seq id no:8中10-317bp)、tre
3g
cuo
30
(seq id no:28)、tre
3g
cuo
50
(seq id no:23)和tre
3g
cuo
100
(seq id no:10中10-403bp)响应
元件,并在以上响应元件3’端下游连接luciferase报告基因序列,构建质粒18bf251、18bf252、18bf235和18bf253。进一步,为研究多拷贝cuo操作子的影响,在tata盒下游间隔50bp的位置,分别插入了2、4和6个拷贝cuo操作子序列设计了tre
3g
cuo
2x
(seq id no:11中10-411bp)、tre
3g
cuo
4x
(seq id no:12中10-527bp)和tre
3g
cuo
6x
(seq id no:13中10-643bp)响应元件,并在以上响应元件下游3’端连接luciferase报告基因序列,构建质粒18bf254、18bf255和18bf256。在稳定表达rtta
3g
和cymr基因的293t-rtta
3g-cymr细胞内,瞬时转染上述质粒,通过测量同时加入dox和cumate诱导剂样品和仅加入dox诱导剂对照的luciferase荧光值验证优化cuo操作子最优位置和数量。具体实验方法如下:
[0064]
1.用sb转座子系统构建293t-rtta adv-cymr和293t-rtta
3g-cymr细胞:
[0065]
将293t细胞按照1.5e 06个细胞每60mm培养皿接种,在37℃、5%co2的环境下,培养在添加10%fbs(excell,11h116)的dmem(sigam,d6429)完全培养基中。培养24小时后,按照pei方法进行转染,转染时每60mm培养皿加入500μl转染试剂,其中含有总质粒量为5.5ug,总质粒量与pei max(polysciences,24765-1)的质量比为1:4。其中按照质粒19bf074:18bf019摩尔比10:1进行转染以获得293t-rtta
adv-cymr细胞;按照质粒19bf075:18bf019摩尔比10:1进行转染以获得293t-rtta
3g-cymr细胞。质粒与pei max混合均匀,静置15分钟后加入培养皿中,转染3小时后,更换培养基为dmem完全培养基,转染操作完成。转染24小时后,用胰酶消化细胞并全部接种于100mm培养皿(corning,430167)中,并用200μg/ml潮霉素(hygromycin,生工a600230-0001)药物筛选至少三代后,细胞在药物压力下生长和原始293t细胞一致后,进行以下实验。
[0066]
2.基于luciferase荧光强度检测在dox和cumate诱导或仅dox诱导条件下各响应元件效能
[0067]
将293t-rtta
3g-cymr细胞按照2.5e 04个细胞每孔接种于96孔板(corning 3916)中,培养基为100微升dmem完全培养基。培养24小时后,按照pei方法进行转染以下质粒18bf234(tre
3g
)、18bf251(tre
3g
cuo
14
)、18bf252(tre
3g
cuo
30
)、18bf235(tre
3g
cuo
50
)、18bf253(tre
3g
cuo
100
)、18bf254(tre
3g
cuo
2x
)、18bf255(tre
3g
cuo
4x
)和18bf256(tre
3g
cuo
6x
),转染时每孔加入10μl转染试剂,其中含有总质粒量为0.3ug,包含0.01ug以上8种待测质粒和0.29微克18bf003空质粒。总质粒量与pei max(polysciences,24765-1)的质量比为1:4,每种质粒转染6个孔。转染3小时后更换dmem完全培养基,在其中3孔内加入诱导剂1ug/ml dox(盐酸多西环素(dox),生工生物工程(上海)股份有限公司,a600889)和200ug/ml cumate(aladdin,i107765);另外三个孔内仅加入1ug/ml dox。转染后24小时,使用dox。转染后24小时,使用luciferase assay system(promega,e2610)试剂盒,并按照其操作说明(promega,fb037)检测各孔相对荧光单位rlu(relative light unit),检测仪器为荧光酶标仪(perkin elmer victor
ⅴ
)。
[0068]
结果如图1所示:cuo操作子序列影响tet-on诱导表达系统响应元件的诱导表达量,且cuo操作子距离tre响应元件tata盒越近,诱导后的表达量越低。但随着cuo操作子与tata盒距离增大,无cumate诱导的泄露表达量越高。在综合诱导后表达量、无cumate诱导泄露表达量和cumate诱导/泄露表达量比例等结果,确定cuo在与tata盒间隔30bp至50bp之间是结果最优,诱导表达量分别为3.06e 06rlu和4.53e 06rlu,分别为tre
3g
响应元件诱导表达量的44.5%和66.0%;基于cumate诱导表达系统的诱导/泄露表达量比例分别为tre
3g
响
应元件的4.21倍和2.81倍。增加cuo操作子的拷贝至2,4或6会进一步降低诱导后表达量,且不会提高cumate诱导/泄露表达量比例。基于以上结果,在间隔tre响应元件tata盒30bp至50bp距离插入cuo操作子且仅插入1个拷贝为最优条件。
[0069]
基于tre
adv
响应元件中7xteto序列和最小启动子序列#2(seq id no:26),在tata盒下游间隔32bp和52bp的位置上连接cuo操作子序列按照上述方法设计了tre
adv
cuo
32
(seq id no:29)和tre
adv
cuo
52
(seq id no:30)响应元件,并在以上响应元件3’端下游连接luciferase报告基因序列,构建质粒18bf257和18bf233。通过和上述相同实验方法,检测诱导表达量分别为3.26 06rlu和4.88e 06rlu,分别为tre
adv
响应元件诱导表达量的37.8%和53.4%;基于cuamte诱导表达系统的诱导/泄露表达量比例分别为tre
adv
响应元件的4.97倍和3.23倍。后续实施例以tre
adv
cuo
52
和tre
3g
cuo
50
响应元件进行实验,并分别标记为tre
adv
cuo和tre
3g
cuo响应元件。
[0070]
实施例3:单调控/复合调控及内含子对诱导表达量和无诱导泄露表达量的影响
[0071]
在tet-on诱导表达系统中,tre响应元件的teto操作子连接序列和最小启动子序列以及反式激活物rtta的不同突变体综合影响诱导转录活性和泄露转录活性。此外响应元件3’端下游,被调控目的核酸片段5’端上游连接可剪切的内含子序列可能增强信使核糖核酸运输和稳定性,但同样可能影响诱导表达系统响应元件的诱导转录活性和泄露转录活性。基于此,本实施例对比(1)基于tre
adv
和tre
3g
响应元件序列设计的tet-on和cumate复合响应元件tre
adv
cuo和tre
3g
cuo,(2)是否连接内含子,(3)被反式激活物rtta
adv
或rtta
3g
调控,三个条件组合下的luciferase基因诱导表达量和诱导/泄露表达量比例确认最优复合响应元件设计方案。本实施例共对比8种设计方案:分别为tre
adv
(18bf232)、tre
adv
cuo(18bf233)、tre
3g
(18bf234)、tre
3g
cuo(18bf235)、tre
adv-bgi(18bf240,响应元件为tre
adv
,并且响应元件3’端和luciferase基因5’端之间连接人β-球蛋白内含子)、tre
adv
cuo-bgi(18bf241,响应元件为tre
adv
cuo,并且响应元件3’端和luciferase基因5’端之间连接人β-球蛋白内含子)、tre
3g-bgi(18bf236,响应元件为tre
3g
,并且响应元件3’端和luciferase基因5’端之间连接人β-球蛋白内含子)和tre
3g
cuo-bgi(18bf237,响应元件为tre
3g
cuo,并且响应元件3’端和luciferase基因5’端之间连接人β-球蛋白内含子)。启动子cmv-bgi(18bf229,启动子为cmv,并且cmv启动子3’端和luciferase基因5’端之间连接人β-球蛋白内含子)做为阳性对照。在稳定表达rtta
adv
和cymr基因的293t-rtta
adv-cymr细胞内和稳定表达rtta
3g
和cymr基因的293t-rtta
3g-cymr细胞内,分别瞬时转染上述质粒,通过测量加入dox和cumate诱导剂样品和无诱导对照的luciferase荧光值验证最优复合响应元件组合。具体实验方法如下:
[0072]
将实施例2中构建的293t-rtta
adv-cymr和293t-rtta
3g-cymr细胞分别按照2.5e 04个细胞每孔接种于96孔板(corning 3916)中,培养基为100微升dmem完全培养基。培养24小时后,按照pei方法转染上述9种质粒,转染时每孔加入10μl转染试剂,其中含有总质粒量为0.3ug,包含0.01ug上述9种质粒待测质粒和0.29微克18bf003空质粒。总质粒量与pei max(polysciences,24765-1)的质量比为1:4,每种质粒分别在293t-rtta
adv-cymr和293t-rtta
3g-cymr细胞各转染6个孔。转染3小时后更换dmem完全培养基,在每种细胞其中3孔内加入诱导剂1ug/ml dox和200ug/ml cumate;另外三个孔内加入等量培养基对照。转染后24小时,使用luciferase assay system(promega,e2610)试剂盒,并按照其操作
说明(promega,fb037)检测各孔相对荧光单位rlu(relative light unit),检测仪器为荧光酶标仪(perkin elmer victor
ⅴ
)。
[0073]
实验结果如图2所示:(1)trecuo复合响应元件对比tre单调控响应元件显著提高了诱导/泄露表达量比例一到两个数量级。tre
3g
cuo复合响应元件对比tre
adv
cuo复合响应元件能更好的控制泄露表达。在293t-rtta
adv-cymr细胞中,tre
3g
cuo和tre
adv
cuo的诱导/泄露表达量比例分别为1565和1345倍,提高16.4%;在293t-rtta
3g-cymr细胞中,tre
3g
cuo和tre
adv
cuo的诱导/泄露表达量比例分别为2635和1915倍,提高37.6%。但trecuo复合响应元件对比tre单调控响应元件的诱导表达量显著下降。在293t-rtta
adv-cymr细胞中,tre
3g
cuo和tre
adv
cuo的诱导表达量分别为对应的tre
3g
和tre
adv
单调控响应元件的50.4%和36.3%;在293t-rtta
3g-cymr细胞中,tre
3g
cuo和tre
adv
cuo的诱导表达量分别为单调控响应元件的61.8%和40.3%。(2)在诱导表达量方面,tre
3g
cuo复合响应元件对比tre
adv
cuo复合响应元件对下游的内含子更加敏感,在有内含子bgi的设计中,诱导表达量显著提高。tre
3g
cuo和tre
3g
cuo-bgi诱导表达量在293t-rtta
adv-cymr细胞中分别为3.4e 06rlu和10.6e 06rlu,分别是tre
3g
诱导表达量的50.4%和157.9%,连接内含子可以提高tre
3g
cuo复合响应元件诱导后表达量2.13倍;在293t-rtta
3g-cymr细胞中分别为4.24e 06和11.3e 06,分别是tre
3g
诱导表达量的61.8%和165.0%,连接内含子可以提高tre
3g
cuo复合响应元件诱导后表达量1.67倍。(3)对比诱导后表达量,反式激活物rtta
3g
在8种设计方案中和rtta
adv
没有显著区别,但在对比诱导/泄露表达量比例上rtta
3g
有显著优势,其8种设计方案的诱导/泄露表达量比例平均值为1110倍是rtta
adv
的1.68倍(rtta
adv
诱导/泄露表达量比例平均值为661倍)。
[0074]
基于以上结果,tre
3g
cuo复合响应元件对比tre
adv
和tre
3g
以及tre
adv
cuo复合响应元件拥有更好控制泄露表达的能力;在下游连接内含子bgi后可以在维持tre
3g
cuo复合响应元件控制泄露表达的同时极大的提高其诱导表达量。在受rtta
3g
调控条件下,tre
3g
cuo-bgi的诱导表达量分别为tre
adv
的80.6%、tre
adv-bgi的80.5%、tre
adv
cuo的199.9%、tre
adv
cuo-bgi的147.0%、tre
3g
的165.0%、tre
3g-bgi的81.5%和tre
3g
cuo的267.2%,达到组成型活性启动子cmv-bgi的84.7%;tre
3g
cuo-bgi的诱导/无诱导表达量比例分别为tre
adv 24.5倍、tre
adv-bgi 43.4倍、tre
adv
cuo 1.2倍、tre
adv
cuo-bgi 1.6倍、tre
3g 5.9倍、tre
3g-bgi 8.9倍和tre
3g
cuo的0.8倍。
[0075]
实施例4:不同内含子对tre
3g
cuo复合响应元件诱导表达和无诱导泄露表达影响
[0076]
在上述实施例3中,连接内含子bgi显著提升了tre
3g
cuo复合诱导响应元件的诱导转录活性以及luciferase目的基因的表达量。本实施例验证其它内含子是否有相似效果。本实施例将4种常用质粒载体上的内含子克隆到tre-3g
cuo复合响应元件3’端下游和luciferase报告基因5’端上游之间,分别构建含有bgi(c&r)、intron(mp1)、intron(ef-1a)和intron(psi)内含子的质粒18bf261、18bf262、18bf263和18bf264,质粒构建具体方法见实施例1描述。在稳定表达rtta
3g
和cymr基因的293t-rtta
3g-cymr细胞内,分别瞬时转染上述质粒以及tre
3g
cuo(18bf235)、tre
3g
cuo-bgi(18bf237)和cmv-bgi(18bf229)质粒,通过测量加入dox和cumate诱导剂样品和无诱导对照的luciferase荧光值验证各内含子对tre
3g
cuo复合响应元件诱导表达和无诱导泄露表达的影响。具体实验方法如下:
[0077]
将293t-rtta
3g-cymr细胞按照2.5e 04个细胞每孔接种于96孔板(corning 3916)中,培养基为100微升dmem完全培养基。培养24小时后,按照pei方法分别转染上述7种质粒,
转染时每孔加入10μl转染试剂,其中含有总质粒量为0.3ug,包含0.01ug以上7种待测质粒和0.29微克18bf003空质粒。总质粒量与pei max(polysciences,24765-1)的质量比为1:4,每种质粒转染6个孔。转染3小时后更换dmem完全培养基,在其中3孔内加入诱导剂1ug/ml dox和200ug/ml cumate;另外三个孔内加入等量培养基。转染后24小时,使用luciferase assay system(promega,e2610)试剂盒,并按照其操作说明(promega,fb037)检测各孔相对荧光单位rlu(relative light unit),检测仪器为荧光酶标仪(perkin elmer victor
ⅴ
)。
[0078]
实验结果如图3所示:含有四种其它内含子的质粒18bf261、18bf262、18bf263和18bf264在诱导表达量和诱导/泄露表达量比例上和tre
3g
cuo-bgi(18bf237)无显著差异,都能达到实施例3所述tre
3g
cuo-bgi的设计效果。在内含子里,需要有5'剪接位点(5'splice site)、3'剪接位点(3'splice site)及剪接分枝位点(branch point)来进行剪接。本实施例证明符合上述条件,能剪接的内含子都能达到本发明所述的实验效果。因此本发明所述效果不应受到特定内含子序列约束,凡是在哺乳动物细胞中能进行rna剪接(splicing)的序列都能实现上述功能。可以选择的内含子序列包括但不限于常用的克隆载体上的内含子如:兔β-球蛋白内含子、源自人β-球蛋白和免疫球蛋白重链内含子的杂合内含子、ef-1α内含子a、sv40内含子、源自腺病毒和免疫球蛋白重链内含子的杂合内含子、修饰的人巨细胞病毒内含子、源自鸡β-肌动蛋白(cba)和小鼠微小病毒(mmv)内含子的杂合内含子、源自鸡β-肌动蛋白和兔β-球蛋白内含子的嵌合物和mp1内含子;也可以是任意真核生物任意基因的任意内含子;或者是基于内含子剪接规则设计的人造内含子序列。
[0079]
实施例5:研究tre
3g
cuo复合响应元件在不同诱导组合下的诱导转录活性。
[0080]
本实施例构建受tet-on和cumate复合调控的,基于tre
3g
cuo或tre
3g
cuo-内含子设计,以luciferase为报告基因的稳定细胞系,并基于这些细胞系检测无诱导剂、仅加cumate、仅加dox或同时加dox和cumate诱导剂4种诱导条件组合下,报告基因的不同诱导转录活性。本实施例仅以luciferase报告基因为例,原则上本发明所述方法不受目的核酸片段影响。具体实验方法如下:
[0081]
1.利用sb转座子系统构建dox和cumate复合调控luciferase稳定细胞系:
[0082]
将293t细胞按照1.5e 06个细胞每60mm培养皿接种,在37℃、5%co2的环境下,培养在添加10%fbs(excell,11h116)的dmem(sigam,d6429)完全培养基中。培养24小时后,按照pei方法进行转染,转染时每60mm培养皿加入500μl转染试剂,总质粒量为5.5ug,总质粒量与pei max(polysciences,24765-1)的质量比为1:4,共构建3种luciferase稳定细胞系。其中转染质粒按照19bf075:19bf229:18bf019摩尔比5:5:1进行转染以获得293t(t&c)-cmv-bgi-luc细胞;其中转染质粒按照19bf075:19bf235:18bf019摩尔比5:5:1进行转染以获得293t(t&c)-tre
3g
cuo-luc细胞;其中转染质粒按照19bf075:19bf237:18bf019摩尔比5:5:1进行转染以获得293t(t&c)-tre
3g
cuo-bgi-luc细胞。质粒与pei max混合均匀后,静置15分钟后加入培养皿中,转染3小时后,更换培养基为dmem完全培养基,转染操作完成。转染24小时后,用胰酶消化细胞并全部接种于100mm培养皿(corning,430167)中,并用200μg/ml潮霉素(hygromycin,生工a600230-0001)药物筛选至少三代。当细胞在药物压力下生长和原始293t细胞一致后,再用极限稀释法将上述三种细胞分别稀释至1个细胞每孔接种于96孔板内,待细胞长至大约50%孔底面积时,在荧光显微镜下挑选egfp绿色荧光强度较强、发光
均匀的孔,每种细胞挑选3个独立克隆进行以下实验。
[0083]
2.利用不同dox和cumate组合诱导luciferase表达:
[0084]
将上述3种细胞,每种3个独立克隆分别按照2.5e 04个细胞每孔接种于96孔板(corning 3916)中,每个克隆接种8个孔,培养基为100微升dmem完全培养基。培养24小时后,更换培养基并在每个细胞克隆8个培养孔中取复孔分别加入(1)等量培养基、(2)终浓度200ug/ml cumate、(3)终浓度1ug/ml dox或(4)终浓度1ug/ml dox和200ug/ml cumate。再培养24小时后,使用luciferase assay system(promega,e2610)试剂盒,并按照其操作说明(promega,fb037)检测各孔相对荧光单位rlu(relative light unit),检测仪器为荧光酶标仪(perkin elmer victor
ⅴ
)。
[0085]
实验结果如图4所示:在仅加入cumate的条件下,tre
3g
cuo和tre
3g
cuo-bgi的诱导转录活性为1.36e 04rlu和4.16e 04rlu,对比无诱导条件分别提升了4.31倍和3.27倍。在仅加入dox的条件下,tre
3g
cuo和tre
3g
cuo-bgi的诱导转录活性为2.14e 05rlu和5.34e 05rlu,对比无诱导条件分别提升了67.66倍和42.07倍;对比仅加入cumate诱导条件下提升了15.71倍和12.86倍。在同时加入dox和cumate的条件下,tre
3g
cuo和tre
3g
cuo-bgi的诱导转录活性为7.54e 06rlu和1.29e 07rlu,对比无诱导条件分别提升了2381.05倍和1011.81倍;对比仅加入cumate诱导条件下提升了552.99倍和309.27倍;对比仅加入dox诱导条件下提升了35.19倍和24.05倍。基于以上结果,tre
3g
cuo和tre
3g
cuo-bgi复合响应元件按照不同诱导剂调控组合可以在不同转录活性级下调控目的核酸片段的诱导转录活性,其调控范围分别为4.31倍至2381.05倍和3.27倍至1011.81倍,在同时加入dox和cumate诱导剂时,最大诱导转录活性分别可以达到cmv启动子的47.84%和81.54%。再进一步优化dox和/或cumate诱导剂浓度的条件下,可以进一步在不同转录活性级下细致调控目的核酸片段的转录活性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。