1.本发明属于医药技术领域,具体涉及一种吴茱萸碱衍生物的制备;本发明同时还涉及吴茱萸碱衍生物在制备抗肿瘤药物中的应用。
背景技术:
2.药用植物中的活性成分通过影响多种靶点的功能,在治疗疾病中发挥着重要作用。在东方医学中,中草药一直被广泛地用作为重要的药物。近年来,从这些来源中分离出了多种生物活性成分,并在实验和流行病学研究中被证实具有抗癌活性。因此,中草药已成为设计多靶点生物活性分子的重要资源。吴茱萸是中国著名的中草药,在中医中应用广泛,具有散寒止痛、止吐、助阳止泻之功效。吴茱萸碱(evodiamine,evo),一种吲哚喹唑啉生物碱,是从中药吴茱萸中提取出的主要活性成分,在多个肿瘤内具有良好的抗肿瘤活性。多项研究表明,吴茱萸碱的抗肿瘤能力是由于其能抑制增殖、侵袭和转移,阻滞细胞周期以及诱导细胞凋亡。同时,吴茱萸碱也被报道具有拓扑异构酶的抑制活性进而发挥抗肿瘤作用。这表明吴茱萸碱有望成为一种有效的、系统的抗肿瘤药物。
3.拓扑异构酶(topo),用于调节细胞中关键的生命过程,即转录、复制、有丝分裂和核酸修复。根据酶的一般性质,拓扑异构酶可分为两大类:拓扑异构酶i (topo i) 只分裂一条dna链,而ii型拓扑异构酶(topo ii)插入双链断裂。topo在多种类型的肿瘤细胞中高度表达,使得topo成为抗肿瘤药物的重要靶点。由于topo抑制剂的广谱性和高疗效,近50%的临床治疗依赖于使用一种或多种topo抑制剂。
4.虽然吴茱萸碱有多种的药用活性和广谱的抗癌活性,但也具有水溶性差、体内代谢快、抗癌作用弱等缺点。因此,对吴茱萸碱结构的优化改造引起了学术界广泛的关注。在既往研究中,吴茱萸碱已经成功被改造为在体内外抗肿瘤活性更好的许多新骨架。但是,对n14位的改造较少。有报道指出,n14位甲基容易在体内代谢过程中脱去从而降低吴茱萸碱的作用。为了得到更加全面的n14芳香性取代基团的吴茱萸碱衍生物的构效关系和作用靶点,我们设计合成了一批n14位芳基取代的吴茱萸碱衍生物,通过一系列的体内、外抗肿瘤活性研究,以期发现一种新型抗肿瘤前体药物。
技术实现要素:
5.针对现有技术的不足,本发明的目的是提供一种吴茱萸碱衍生物及其制备方法;本发明的另一个目的是提供吴茱萸碱衍生物在制备抗肿瘤药物中的应用。
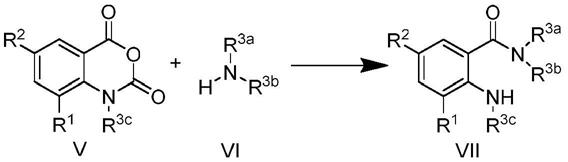
6.本发明一种吴茱萸碱衍生物,其结构式如下:其中,r1为氢、羟基、甲氧基、乙氧基、甲基、羧基、乙酰基、f、cl或br;r2为烷基、芳基、酰基中的一种,其中烷基为乙基、正丙基、正丁基、正戊基、异丙基、异丁基、异戊基、2,2
‑
二甲基丁烷、烯丙基、3,4
‑
二甲氧基苯乙基、ch2co2ch3、环丙烷、环丁烷、环戊烷、环己烷或丙炔基,芳基为f、cl、br、i、氢、甲基、甲氧基或三氟甲基取代的苯基、吡啶、异喹啉或喹啉,酰基为丙烯酰基、丁烯酰基、乙酰基、对甲苯磺酰基或苯甲酰基;r3为f、cl、br、i、氢、甲基、甲氧基中的一种。
7.本发明一种吴茱萸碱衍生物的制备方法,包括以下步骤:(1)以邻氨基苯甲酸类化合物和色胺类化合物为原料,以1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐为缩合剂,以1
‑
羟基苯并三氮唑为催化剂,以三乙胺为碱,以二氯甲烷为溶剂,在氩气条件下,于室温反应1~6 h,反应完成后,用水和二氯甲烷萃取,收集有机相旋干,柱层析分离得到化合物1。
8.邻氨基苯甲酸类化合物的结构式为:,r2为烷基、芳基、酰基中的一种;其中烷基为乙基、正丙基、正丁基、正戊基、异丙基、异丁基、异戊基、2,2
‑
二甲基丁烷、烯丙基、3,4
‑
二甲氧基苯乙基、ch2co2ch3、环丙烷、环丁烷、环戊烷、环己烷或丙炔基;芳基为f、cl、br、i、氢、甲基、甲氧基或三氟甲基取代的苯基、吡啶、异喹啉或喹啉;酰基为丙烯酰基、丁烯酰基、乙酰基、对甲苯磺酰基或苯甲酰基;r3为f、cl、br、i、氢、甲基、甲氧基中的一种。
9.色胺类化合物的结构式为:,r1为氢、羟基、甲氧基、乙氧基、甲基、羧基、乙酰基、f、cl或br。
10.化合物1的结构式为:,r1为氢、羟基、甲氧基、乙氧基、甲基、羧基、乙酰基、f、cl或br;r2为烷基、芳基、酰基中的一种;其中烷基为乙基、正丙基、正丁基、正戊基、异丙基、异丁基、异戊基、2,2
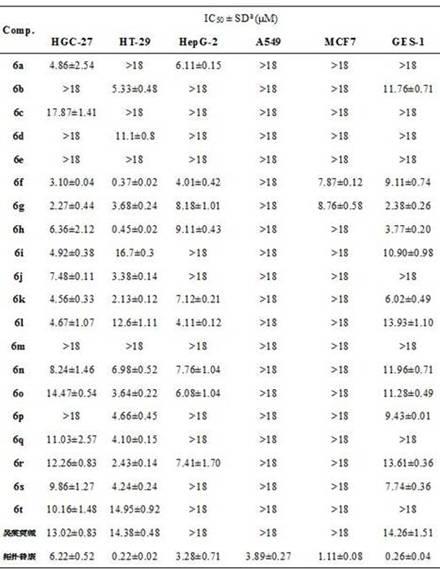
‑
二甲基丁烷、烯丙基、3,4
‑
二甲氧基苯乙基、ch2co2ch3、环丙烷、环丁烷、环戊烷、环己烷或丙炔基;芳基为f、cl、br、i、氢、甲基、甲氧基或三氟甲基取代的苯基、吡啶、异喹啉或喹啉;酰基为丙烯酰基、丁烯酰基、乙酰基、对甲苯磺酰基或苯甲酰基;r3为f、cl、br、i、氢、甲基、甲氧基中的一种。
11.邻氨基苯甲酸类化合物和色胺类化合物的摩尔比为1:1~1:1.5;1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐的用量为邻氨基苯甲酸类化合物摩尔量的1~1.2倍;1
‑
羟基苯并三氮唑的用量为邻氨基苯甲酸类化合物摩尔量的0.5~1.5倍;三乙胺的用量为邻氨基苯甲酸类化合物摩尔量的1.5~3倍。
12.(2)以化合物1和原甲酸三乙酯为原料,以三氟化硼乙醚为催化剂,以n,n
‑
二甲基甲酰胺为溶剂,在氩气条件下,温度100~130℃下,反应2~8h,反应完成后,用水和乙酸乙酯萃取洗去n,n
‑
二甲基甲酰胺,收集有机相旋干,柱层析分离得到最终产物吴茱萸碱衍生物。
13.原甲酸三乙酯的用量为化合物1摩尔量的2~4倍;三氟化硼乙醚的用量为化合物1摩尔量的0.1~0.5倍。
14.本发明所制备的苯甲酸色胺化合物的合成路线如下:
其中,r1为氢、羟基、甲氧基、乙氧基、甲基、羧基、乙酰基、f、cl或br;r2为烷基、芳基、酰基中的一种,其中烷基为乙基、正丙基、正丁基、正戊基、异丙基、异丁基、异戊基、2,2
‑
二甲基丁烷、烯丙基、3,4
‑
二甲氧基苯乙基、ch2co2ch3、环丙烷、环丁烷、环戊烷、环己烷或丙炔基,芳基为f、cl、br、i、氢、甲基、甲氧基或三氟甲基取代的苯基、吡啶、异喹啉或喹啉,酰基为丙烯酰基、丁烯酰基、乙酰基、对甲苯磺酰基或苯甲酰基;r3为f、cl、br、i、氢、甲基、甲氧基中的一种。
15.本发明所制备的吴茱萸碱衍生物具备对拓扑异构酶i/ii的双重抑制效果,可以抑制癌细胞周期于g2/m期并诱导癌细胞凋亡。体外实验证明该类吴茱萸碱衍生物具有良好的抑制癌细胞侵袭迁移的作用。体内实验表明该类吴茱萸碱衍生物具有良好的药代动力学特征,且能显著抑制裸鼠体内移植瘤的生长。
16.本发明所制备的吴茱萸碱衍生物通过凝胶电泳实验,发现具有拓扑异构酶i/ii的双重抑制效果。
17.本发明所制备的吴茱萸碱衍生物通过mtt法测定发现对多种癌细胞具有抑制增殖作用,且对胃正常细胞ges
‑
1的毒性具有选择性。
18.本发明所制备的吴茱萸碱衍生物可以抑制癌细胞周期于g2/m期并诱导癌细胞凋亡。
19.本发明所制备的吴茱萸碱衍生物可以抑制癌细胞的侵袭和迁移。
20.本发明所制备的吴茱萸碱衍生物经急性毒性实验结果显示,化合物的毒性较小,安全性较高。
21.本发明所制备的吴茱萸碱衍生物经大鼠药代动力学实验发现其具有良好的药代动力学参数。
22.本发明所制备的吴茱萸碱衍生物能显著抑制裸鼠体内移植瘤的生长。
23.综上所述,本发明所制备的吴茱萸碱衍生物是以邻碘苯甲酸类化合物为起始原料,经过乌尔曼偶联、缩合、环化三步反应合成得到。本发明所制备的吴茱萸碱衍生物具有拓扑异构酶i/ii双重抑制作用,可以抑制癌细胞周期于g2/m期并诱导癌细胞凋亡。体外实验可证明具有良好的抑制癌细胞侵袭迁移的作用。体内实验表明具有良好的药代动力学特征,且能显著抑制裸鼠体内移植瘤的生长。因此,该吴茱萸碱衍生物可应用于制备抗肿瘤药物。
附图说明
24.图1为本发明合成化合物对拓扑异构酶i/ii的抑制作用检测;图2为所选化合物对hgc
‑
27和ht
‑
29细胞克隆群落形成的影响;图3为所选化合物对hgc
‑
27和ht
‑
29细胞动态增殖的影响;图4为所选化合物处理后hgc
‑
27和ht
‑
29细胞经姬姆萨染色的形态学变化情况;图5为所选化合物对hgc
‑
27和ht
‑
29细胞凋亡的影响;图6为所选化合物处理后hgc
‑
27和ht
‑
29细胞经hoechst染色的细胞核凋亡变化情
119.26, 118.55, 112.21, 112.12, 71.06, 42.45, 19.71.化合物3
‑
1的结构式为:实施例414
‑
(2
‑
bromophenyl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物6d)化合物6d的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((2
‑
bromophenyl)amino)benzoic acid(化合物4
‑
1),其余步骤同实施例1制备而得,收率65%。1h nmr (400 mhz, dmso
‑
d6) δ 10.81 (s, 1h), 7.86 (s, 1h), 7.67 (s, 1h), 7.54
ꢀ–ꢀ
7.11 (m, 6h), 7.00 (m, 3h), 6.61 (d, j = 8.2 hz, 1h), 6.44 (s, 1h), 4.64 (dd, j = 12.9, 5.6 hz, 1h), 3.27(s, 1h), 2.99 (m, 1h), 2.73 (m, 1h). 13
c nmr (101 mhz, dmso) δ 165.47, 146.71, 144.42, 136.44, 136.28, 133.84, 132.01, 129.97, 128.44, 127.31, 122.13, 120.74, 119.29, 118.47, 112.17, 111.92, 71.52, 42.64, 19.59.化合物4
‑
1的结构式为:实施例514
‑
(o
‑
tolyl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物6e)化合物6e的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
(o
‑
tolylamino)benzoic acid(化合物5
‑
1),其余步骤同实施例1制备而得,收率81%。1h nmr (400 mhz, dmso
‑
d6) δ 10.85 (s, 1h), 7.82 (s, 1h), 7.64
ꢀ–ꢀ
7.13 (m, 7h), 7.06 (t, j = 7.6 hz, 1h), 7.01
ꢀ–ꢀ
6.87 (m, 2h), 6.57 (d, j = 8.3 hz, 1h), 6.38 (s, 1h), 4.62 (dd, j = 13.0, 5.7 hz, 1h), 3.43(m,1 h), 2.99 (s, 1h), 2.77
ꢀ–ꢀ
2.63 (m, 1h), 2.23 (s, 3h). 13
c nmr (101 mhz, dmso) δ 165.47, 146.73, 144.58, 136.44, 136.28, 133.84, 132.01, 129.95, 129.84, 128.44, 127.29, 126.72, 122.13, 119.29, 118.47, 112.17, 111.92, 99.95, 71.11, 42.59, 19.64.
hz, 1h), 4.88 (dd, j = 13.2, 5.6 hz, 1h), 3.26 (m, 1h), 2.98 (m, 1h), 2.74 (dd, j = 15.8, 4.8 hz, 1h). 13
c nmr (101 mhz, cdcl3) δ 164.95, 147.28, 144.11, 136.14, 131.84 (d, j = 32.6 hz), 130.14, 129.93, 129.23, 127.21, 126.94, 124.92, 123.57 (d, j = 272.7 hz), 122.50, 122.21, 121.66 (q, j = 3.3 hz), 121.44, 120.72 (d, j = 3.9 hz), 120.14, 118.81, 114.07, 111.38, 72.74, 43.02, 19.71.化合物7
‑
1的结构式为:实施例814
‑
(4
‑
fluorophenyl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物6k)化合物6k的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((4
‑
fluorophenyl)amino)benzoic acid(化合物8
‑
1),其余步骤同实施例1制备而得,收率68%。1h nmr (400 mhz, dmso
‑
d6) δ 11.33 (s, 1h), 7.87 (dd, j = 7.8, 1.6 hz, 1h), 7.47
ꢀ–ꢀ
7.42 (m, 1h), 7.38 (d, j = 7.8 hz, 1h), 7.32 (dd, j = 8.1, 0.9 hz, 1h), 7.28
ꢀ–ꢀ
7.22 (m, 2h), 7.17
ꢀ–ꢀ
7.12 (m, 2h), 7.11
ꢀ–ꢀ
7.00 (m, 3h), 6.96 (ddd, j = 8.0, 7.0, 1.0 hz, 1h), 6.54 (d, j = 1.5 hz, 1h), 4.59 (dd, j = 12.9, 5.4 hz, 1h), 3.32 (dd, j = 12.6, 5.0 hz, 1h), 2.87
ꢀ–ꢀ
2.63 (m, 2h).
13
c nmr (101 mhz, dmso) δ 164.89, δ 159.75 (d, j = 242.1 hz), 145.97, 142.88 (d, j = 2.7 hz), 136.55, 133.68, 131.56, 128.46, 127.44 (d, j = 8.5 hz), 126.65, 122.86, 122.16, 121.73 (d, j = 8.4 hz), 119.25, 118.55, 116.28, 116.05, 112.08, 111.87, 71.79, 42.32, 19.64.化合物8
‑
1的结构式为:实施例914
‑
(4
‑
bromophenyl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物6m)化合物6m的结构式为:
将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((4
‑
bromophenyl)amino)benzoic acid(化合物9
‑
1),其余步骤同实施例1制备而得,收率71%。1h nmr (400 mhz, dmso
‑
d6) δ 11.32 (s, 1h), 7.87 (d, j = 7.7 hz, 1h), 7.52 (d, j = 8.3 hz, 2h), 7.45 (t, j = 7.8 hz, 1h), 7.39 (d, j = 7.9 hz, 1h), 7.32 (d, j = 8.1 hz, 1h), 7.19 (d, j = 8.3 hz, 2h), 7.09 (q, j = 8.4, 7.7 hz, 3h), 6.97 (t, j = 7.5 hz, 1h), 6.62 (s, 1h), 4.60 (dd, j = 13.2, 5.7 hz, 1h), 3.40 (m, 1h), 2.88 (m, 1h), 2.66 (dd, j = 15.7, 4.7 hz, 1h). 13
c nmr (101 mhz, dmso) δ 164.87, 146.09, 144.57, 136.50, 133.78, 132.41, 132.09, 128.49, 126.84, 126.26, 123.17, 122.20, 121.76, 121.61, 119.35, 118.56, 116.98, 112.16, 111.82, 72.05, 42.87, 39.96, 19.62.化合物9
‑
1的结构式为:实施例1014
‑
(p
‑
tolyl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物6n)化合物6n的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
(p
‑
tolylamino)benzoic acid(化合物10
‑
1),其余步骤同实施例1制备而得,收率86%。1h nmr (400 mhz, dmso
‑
d6) δ 11.54 (s, 1h), 8.09 (dd, j = 8.1, 1.7 hz, 1h), 7.65 (ddd, j = 10.3, 8.6, 7.4 hz, 2h), 7.57 (dt, j = 8.2, 0.9 hz, 1h), 7.39 (d, j = 1.3 hz, 4h), 7.34
ꢀ–ꢀ
7.26 (m, 3h), 7.21 (ddd, j = 7.9, 7.0, 1.1 hz, 1h), 6.78 (d, j = 1.6 hz, 1h), 4.83 (dd, j = 13.0, 5.6 hz, 1h), 3.58 (d, j = 4.9 hz, 1h), 3.16
ꢀ–ꢀ
3.05 (m, 1h), 2.91 (dd, j = 15.5, 4.8 hz, 1h), 2.50 (s, 3h). 13
c nmr (101 mhz, dmso) δ 165.02, 145.72, 144.27, 136.50, 134.45, 133.55, 132.24, 130.04, 128.35, 126.80, 124.82, 122.39, 122.06, 121.60, 121.27, 119.23, 118.48, 112.14, 111.65, 72.11, 42.64, 39.96, 20.83, 19.61.化合物10
‑
1的结构式为:实施例1114
‑
(4
‑
methoxyphenyl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1b]quinazolin
‑
5(7h)
‑
one (化合物6o)
化合物6o的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((4
‑
methoxyphenyl)amino)benzoic acid(化合物11
‑
1),其余步骤同实施例1制备而得,收率52%。1h nmr (400 mhz, chloroform
‑
d) δ 8.16 (s, 1h), 8.10 (dd, j = 7.9, 1.6 hz, 1h), 7.47 (dd, j = 7.9, 1.1 hz, 1h), 7.32
ꢀ–ꢀ
7.27 (m, 2h), 7.18 (ddd, j = 8.2, 7.0, 1.3 hz, 1h), 7.15
ꢀ–ꢀ
7.08 (m, 3h), 7.01 (ddd, j = 8.0, 7.3, 1.1 hz, 1h), 6.85
ꢀ–ꢀ
6.76 (m, 3h), 6.27 (t, j = 1.6 hz, 1h), 4.92 (ddd, j = 13.0, 5.5, 1.5 hz, 1h), 3.76 (s, 3h), 3.20 (ddd, j = 12.9, 11.5, 4.6 hz, 1h), 2.95 (m, 1h), 2.77 (m, 1h). 13
c nmr (101 mhz, cdcl3) δ 165.15, 157.81, 147.12, 138.31, 136.20, 133.08, 129.75, 128.89, 127.88, 126.51, 122.71, 122.04, 120.84, 120.03, 119.75, 118.71, 114.62, 113.60, 111.22, 71.71, 55.40, 41.86, 19.87.化合物11
‑
1的结构式为:实施例1214
‑
(pyridin
‑3‑
yl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one(化合物6p)化合物6p的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
(pyridin
‑3‑
ylamino)benzoic acid(化合物12
‑
1),其余步骤同实施例1制备而得,收率47%。1h nmr (400 mhz, cdcl3) δ 8.44 (s, 1h), 8.36 (s, 1h), 8.33 (s, 1h), 8.14 (d, j = 1.6 hz, 1h), 8.12 (d, j = 1.6 hz, 1h), 7.46 (d, j = 7.9 hz, 1h), 7.43
ꢀ–ꢀ
7.32 (m, 3h), 7.24
ꢀ–ꢀ
7.08 (m, 4h), 7.01 (dd, j = 8.2, 1.1 hz, 1h), 4.92
ꢀ–ꢀ
4.81 (m, 1h), 3.25 (m, 1h), 2.93
ꢀ–ꢀ
2.82 (m, 1h), 2.78 (m, 1h). 13
c nmr (100 mhz, cdcl3) δ 164.9, 150.2, 146.6, 146.3, 144.8, 138.6, 136.2, 133.4, 132.2, 129.2, 129.1, 126.6, 124.2, 123.1, 123.0, 121.6, 120.1, 118.9, 114.3, 111.4, 71.9, 42.3, 19.7.化合物12
‑
1的结构式为:实施例13
14
‑
(6
‑
methylpyridin
‑3‑
yl)
‑
8,13,13b,14
‑
tetrahydroindolo [2',3':3,4] pyrido [2,1
‑
b] quinazolin
‑
5(7h)
‑
one(化合物6q)化合物6q的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((6
‑
methylpyridin
‑3‑
yl)amino)benzoic acid(化合物13
‑
1),其余步骤同实施例1制备而得,收率46%。1h nmr (400 mhz, cdcl3) δ 8.95 (s, 1h), 8.36 (d, j = 2.7 hz, 1h), 8.12 (dd, j = 7.9, 1.6 hz, 1h), 7.46 (d, j = 7.9 hz, 1h), 7.38
ꢀ–ꢀ
7.27 (m, 3h), 7.22
ꢀ–ꢀ
7.04 (m, 3h), 6.97 (d, j = 8.4 hz, 1h), 6.90 (d, j = 8.1 hz, 1h), 6.31 (s, 1h), 4.86 (m, 1h), 3.24 (m, 1h), 2.94
ꢀ–ꢀ
2.74 (m, 2h), 2.42 (s, 3h). 13
c nmr (100 mhz, cdcl3) δ 165.0, 155.5, 146.3, 145.6, 139.9, 136.3, 133.3, 133.3, 129.1, 129.0, 126.5, 123.9, 123.4, 123.0, 122.8, 121.5, 119.9, 118.8, 114.0, 111.4, 71.6, 42.0, 23.8, 19.8.化合物13
‑
1的结构式为:实施例1414
‑
(6
‑
chloropyridin
‑3‑
yl)
‑
8,13,13b,14
‑
tetrahydroindolo [2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one(化合物6r)化合物6r的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((6
‑
chloropyridin
‑3‑
yl)amino)benzoic acid(化合物14
‑
1),其余步骤同实施例1制备而得,收率38%。1h nmr (400 mhz, cdcl3) δ 8.83 (s, 1h), 8.15 (dd, j = 7.9, 1.6 hz, 1h), 8.10
ꢀ–ꢀ
7.98 (d, 1h), 7.48
ꢀ–ꢀ
7.44 (d, 1h), 7.40 (m, 1h), 7.35 (d, j = 8.3, 0.9 hz, 1h), 7.25
ꢀ–ꢀ
7.17 (m, 3h), 7.15
ꢀ–ꢀ
7.06 (m, 2h), 6.97 (d, j = 8.2, 1.1 hz, 1h), 6.30 (s, j = 1.5 hz, 1h), 4.82 (m, 1h), 3.22 (m, 1h), 2.85
ꢀ–ꢀ
2.66 (m, 2h). 13
c nmr (100mhz, cdcl3) δ 164.8, 147.5, 146.6, 145.2, 141.2, 136.4, 135.6, 133.5, 129.2, 127.9, 126.3, 124.8, 124.2, 123.7, 123.3, 122.1, 120.1, 118.9, 114.5, 111.5, 71.3, 41.7, 19.8.化合物14
‑
1的结构式为:
实施例1514
‑
(5
‑
bromopyridin
‑3‑
yl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物6s)化合物6s的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((5
‑
bromopyridin
‑3‑
yl)amino)benzoic acid(化合物15
‑
1),其余步骤同实施例1制备而得,收率45%。1h nmr (400 mhz, cdcl3) δ 8.44 (s, 1h), 8.36 (d, j = 2.0 hz, 1h), 8.29 (d, j = 2.3 hz, 1h), 8.14 (dd, j = 7.9, 1.6 hz, 1h), 7.49
ꢀ–ꢀ
7.41 (m, 3h), 7.36 (d, j = 8.3, 1.0 hz, 1h), 7.22 (m, 2h), 7.12 (m, 1h), 7.04 (d, j = 8.2, 1.1 hz, 1h), 6.35 (s, j = 1.6 hz, 1h), 4.86 (m, 1h), 3.25 (m, 1h), 2.95
ꢀ–ꢀ
2.71 (m, 2h). 13
c nmr (100 mhz, cdcl3) δ 164.7, 147.1, 144.2, 144.0, 143.5, 137.0, 136.2, 134.3, 133.6, 132.1, 129.4, 128.6, 126.6, 125.0, 123.4, 121.88, 120.3, 119.0, 114.6, 111.4, 72.0, 42.3, 19.8.化合物15
‑
1的结构式为:实施例1614
‑
(quinoxalin
‑6‑
yl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物6t)化合物6t的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
(quinoxalin
‑6‑
ylamino)benzoic acid(化合物16
‑
1),其余步骤同实施例1制备而得,收率33%。1h nmr (400 mhz, chloroform
‑
d) δ 8.86 (s, 1h), 8.75
ꢀ–ꢀ
8.70 (m, 2h), 8.07 (dd, j = 8.1, 1.7 hz, 1h), 7.99 (d, j = 9.2 hz, 1h), 7.84 (d, j = 2.5 hz, 1h), 7.70 (dd, j = 9.1, 2.6 hz, 1h), 7.45 (d, j = 7.9 hz, 1h), 7.35 (td, j = 7.7, 1.7 hz, 1h), 7.29 (s, 1h), 7.12 (tt, j = 11.4, 7.1 hz, 4h), 6.56 (s, 1h), 4.89 (dd, j = 12.9, 5.4 hz, 1h), 3.30
ꢀ–ꢀ
3.06 (m, 2h), 2.68 (dd, j = 15.4, 4.4 hz, 1h). 13
c nmr (101 mhz, cdcl3) δ 164.69, 148.00, 145.42, 143.95, 143.72, 142.43, 140.41, 136.04, 133.28, 130.80, 130.40, 129.32, 127.10, 126.06, 123.96, 122.86, 121.84, 120.54, 120.00, 119.41, 118.71, 113.66, 111.38, 77.00, 73.27, 43.76, 19.62.
hz, 1h), 4.88 (dd, j = 13.2, 5.6 hz, 1h), 3.26 (m, 1h), 2.98 (m, 1h), 2.74 (dd, j = 15.8, 4.8 hz, 1h). 13
c nmr (101 mhz, cdcl3) δ 164.95, 147.28, 144.11, 136.14, 131.84 (d, j = 32.6 hz), 130.14, 129.93, 129.23, 127.21, 126.94, 124.92, 123.57 (d, j = 272.7 hz), 122.50, 122.21, 121.66 (q, j = 3.3 hz), 121.44, 120.72 (d, j = 3.9 hz), 120.14, 118.81, 114.07, 111.38, 72.74, 43.02, 19.71.化合物18
‑
1的结构式为:实施例193
‑
chloro
‑
14
‑
(3
‑
fluorophenyl)
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmf3
‑
2)化合物zmf3
‑
2的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为5
‑
chloro
‑2‑
((3
‑
fluorophenyl)amino)benzoic acid(化合物19
‑
1),其余步骤同实施例1制备而得,收率45%。1h nmr (400 mhz, chloroform
‑
d) δ 8.09 (s, 1h), 8.03 (d, j = 2.5 hz, 1h), 7.47 (d, j = 7.8 hz, 1h), 7.36
ꢀ–ꢀ
7.16 (m, 3h), 7.12 (t, j = 7.5 hz, 1h), 7.02 (d, j = 8.7 hz, 1h), 6.98
ꢀ–ꢀ
6.94 (m, 2h), 6.91
ꢀ–ꢀ
6.84 (m, 2h), 6.37 (s, 1h), 4.88 (dd, j = 13.2, 5.1 hz, 1h), 3.26 (ddd, j = 13.2, 11.5, 4.9 hz, 1h), 3.03
ꢀ–
3.12(m, 1h), 2.75 (dd, j = 15.7, 4.8 hz, 1h). 13
c nmr (101 mhz, chloroform
‑
d) δ 164.00, 163.47 (d, j = 248.1 hz), 148.13 (d, j = 9.2 hz), 142.76, 136.32, 133.54, 131.02 (d, j = 9.3 hz), 130.36, 129.23, 129.03, 127.20, 123.41, 123.27, 122.77, 120.49, 119.55 (d, j = 3.2 hz), 119.11, 114.21, 112.67 (d, j = 20.9 hz), 111.61, 111.40 (d, j = 23.6 hz), 73.07, 43.59, 19.91.化合物19
‑
1的结构式为:实施例2014
‑
(3
‑
fluorophenyl)
‑3‑
methyl
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmf3
‑
3)
115.0 (d, j = 25.4 hz), 114.3 (d, j = 24.0 hz), 113.6 (d, j = 22.8 hz), 112.8, 112.4 (d, j = 9.1 hz), 112.1, 111.9, 100.4, 72.3, 56.1, 55.9, 43.6, 19.7.化合物21
‑
1的结构式为:实施例2214
‑
(3
‑
fluorophenyl)
‑3‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmf3
‑
5)化合物zmf3
‑
5的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((3
‑
fluorophenyl)amino)
‑5‑
methoxybenzoic acid(化合物22
‑
1),其余步骤同实施例1制备而得,收率47%。1h nmr (400 mhz, chloroform
‑
d) δ 8.30 (s, 1h), 7.55 (d, j = 2.6 hz, 1h), 7.46 (d, j = 7.8 hz, 1h), 7.35 (d, j = 8.1 hz, 1h), 7.20 (t, j = 7.7 hz, 2h), 7.11 (t, j = 7.5 hz, 1h), 7.00 (d, j = 8.8 hz, 1h), 6.94 (dd, j = 8.8, 2.7 hz, 1h), 6.85 (d, j = 7.6 hz, 1h), 6.82
ꢀ–ꢀ
6.75 (m, 2h), 6.37 (s, 1h), 4.87 (dd, j = 13.2, 5.5 hz, 1h), 3.78 (s, 3h), 3.27 (td, j = 12.8, 4.8 hz, 1h), 3.07
ꢀ–ꢀ
2.96 (m, 1h), 2.73 (dd, j = 15.6, 4.3 hz, 1h). 13
c nmr (101 mhz, chloroform
‑
d) δ 165.12, 163.36 (d, j = 247.0 hz), 156.52, 149.46 (d, j = 9.4 hz), 137.60, 136.27, 130.93, 130.58 (d, j = 9.5 hz), 127.27, 123.97, 123.81, 123.15, 121.98, 120.28, 119.08 (d, j = 3.0 hz), 118.99, 113.84, 111.70 (d, j = 21.1 hz), 111.62, 110.88 (d, j = 23.6 hz), 73.43, 55.90, 43.50, 19.96.化合物22
‑
1的结构式为:实施例232,3
‑
difluoro
‑
14
‑
(3
‑
fluorophenyl)
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
22)
147.56 (d, j = 9.3 hz), 146.21 (d, j = 11.7 hz), 136.34, 132.05 (d, j = 10.6 hz), 131.20 (d, j = 9.4 hz), 130.48, 127.22, 123.39, 120.48, 119.87 (d, j = 3.0 hz), 119.10, 117.78 (d, j = 2.3 hz), 114.26, 113.06 (d, j = 21.1 hz), 111.73 (d, j = 23.6 hz), 111.09 (d, j = 22.5 hz), 107.08 (d, j = 25.2 hz), 73.10, 43.44, 19.93.化合物24
‑
1的结构式为:实施例2514
‑
(3
‑
fluorophenyl)
‑4‑
methyl
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmf3
‑
11)化合物zmf3
‑
11的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
fluoro
‑6‑
((3
‑
fluorophenyl)amino)benzoic acid(化合物25
‑
1),其余步骤同实施例1制备而得,收率35%。1h nmr (400 mhz, chloroform
‑
d) δ 8.21 (s, 1h), 7.48 (d, j = 7.9 hz, 1h), 7.38 (dt, j = 8.1, 0.9 hz, 1h), 7.25
ꢀ–ꢀ
7.20 (m, 2h), 7.17
ꢀ–ꢀ
7.05 (m, 2h), 6.97 (d, j = 7.5 hz, 1h), 6.92 (d, j = 8.0 hz, 1h), 6.77 (dd, j = 8.2, 2.3 hz, 1h), 6.75
ꢀ–ꢀ
6.72 (m, 1h), 6.68 (dt, j = 10.5, 2.3 hz, 1h), 6.25 (s, 1h), 4.72 (dt, j = 13.1, 3.9 hz, 1h), 3.29 (dt, j = 13.0, 7.9 hz, 1h), 2.79
ꢀ–ꢀ
2.71 (m, 5h). 13
c nmr (101 mhz, chloroform
‑
d) δ 164.31,163.09 (d, j = 246.8 hz), 148.00 (d, j = 9.2 hz), 147.12, 142.78, 136.52, 132.20, 130.24 (d, j = 9.3 hz), 129.55, 128.18, 126.85, 123.26, 122.45, 120.87, 120.25, 119.11, 114.53, 112.62 (d, j = 23.1 hz), 112.29 (d, j = 21.2 hz), 111.99, 111.62, 71.22, 41.99, 22.94, 20.09.化合物25
‑
1的结构式为:实施例2614
‑
(3
‑
fluorophenyl)
‑3‑
iodo
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmf3
‑
13)
化合物zmf3
‑
13的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((3
‑
fluorophenyl)amino)
‑5‑
iodobenzoic acid(化合物26
‑
1),其余步骤同实施例1制备而得,收率33%。1h nmr (400 mhz, dmso
‑
d6) δ 11.27 (s, 1h), 8.06 (s, 1h), 7.76 (d, j = 7.8 hz, 1h), 7.35 (dd, j = 33.1, 7.7 hz, 3h), 7.11
ꢀ–ꢀ
6.95 (m, 6h), 6.71 (s, 1h), 4.57 (dd, j = 12.8, 5.1 hz, 1h), 3.44 (t, j = 8.3 hz, 1h), 2.97
ꢀ–ꢀ
2.85 (m, 1h), 2.71
ꢀ–ꢀ
2.59 (m, 1h). 13
c nmr (101 mhz, dmso
‑
d6) δ 163.19, 162.36 (d, j = 243.7 hz), 147.24 (d, j = 10.1 hz), 143.05, 141.48, 136.03, 136.02, 131.56, 130.75 (d, j = 9.4 hz), 126.39, 123.34, 122.64, 121.77, 119.01 (d, j = 2.2 hz), 118.93, 118.05, 111.69, 111.38, 111.25 (d, j = 21.2 hz), 110.33 (d, j = 23.6 hz), 85.76, 71.60, 42.78, 19.03.化合物26
‑
1的结构式为:实施例273
‑
fluoro
‑
14
‑
(3
‑
fluorophenyl)
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmfx
‑
1)化合物zmfx
‑
1的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为5
‑
fluoro
‑2‑
((3
‑
fluorophenyl)amino)benzoic acid(化合物27
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率31%。1h nmr (400 mhz, chloroform
‑
d) δ 8.12 (s, 1h), 7.75 (dd, j = 8.6, 2.8 hz, 1h), 7.26
ꢀ–ꢀ
7.19 (m, 2h), 7.12
ꢀ–ꢀ
7.03 (m, 2h), 6.90
ꢀ–ꢀ
6.79 (m, 5h), 6.35 (s, 1h), 4.86 (dd, j = 13.3, 5.1 hz, 1h), 3.83 (s, 3h), 3.26 (m, j = 13.2, 11.5, 4.9 hz, 1h), 3.04
ꢀ–ꢀ
2.93 (m, 1h), 2.70 (dd, j = 15.6, 4.9 hz, 1h). 13
c nmr (101 mhz, cdcl3) δ 164.15 (d, j = 2.2 hz), 163.36 (d, j = 247.6 hz), 159.21 (d, j = 244.4 hz), 154.65, 148.67 (d, j = 9.3 hz), 140.64 (d, j = 2.3 hz), 131.42, 131.07, 130.77 (d, j = 9.5 hz), 127.58, 124.11 (d, j = 7.5 hz), 123.86 (d, j = 7.5 hz), 121.13, 121.02 (d, j = 23.7 hz),119.57 (d, j = 3.0 hz), 115.15 (d, j = 23.9 hz), 113.79, 113.53, 112.39, 112.35 (d, j = 21.1 hz), 111.38 (d, j = 23.5 hz), 100.78, 73.20, 56.09, 43.39, 19.99.
= 8.7 hz, 1h), 7.25
ꢀ–ꢀ
7.20 (m, 1h), 7.16 (d, j = 2.2 hz, 1h), 7.13
ꢀ–ꢀ
7.03 (m, 2h), 6.93
ꢀ–ꢀ
6.87 (m, 2h), 6.87
ꢀ–ꢀ
6.80 (m, 2h), 6.35 (s, 1h), 4.85 (dd, j = 13.5, 4.9 hz, 1h), 3.25 (m, j = 13.2, 11.5, 4.8 hz, 1h), 3.05
ꢀ–ꢀ
2.94 (m, 1h), 2.68 (dd, j = 15.7, 4.8 hz, 1h), 2.31 (s, 3h). 13
c nmr (101 mhz, cdcl3) δ 170.53,164.00 (d, j = 2.2 hz), 163.29 (d, j = 247.9 hz), 159.19 (d, j = 244.5 hz), 148.62 (d, j = 9.3 hz), 144.72, 140.39 (d, j = 2.4 hz), 134.01, 131.81, 130.80 (d, j = 9.4 hz), 127.43, 124.00 (d, j = 7.6 hz), 123.78 (d, j = 7.5 hz), 121.01 (d, j = 23.8 hz), 119.46 (d, j = 3.0 hz), 117.37, 115.16 (d, j = 23.9 hz), 114.21, 112.42 (d, j = 21.1 hz), 112.00, 111.30 (d, j = 23.5 hz), 111.18, 73.00, 43.26, 21.35, 19.71.实施例3214
‑
(3
‑
fluorophenyl)
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmf10
‑
1)化合物zmf10
‑
1的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((4
‑
fluorophenyl)amino)benzoic acid(化合物8
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率55%。1h nmr (400 mhz, chloroform
‑
d) δ 8.05 (dd, j = 8.1, 1.7 hz, 1h), 8.02 (s, 1h), 7.40
ꢀ–ꢀ
7.31 (m, 1h), 7.26 (t, j = 3.2 hz, 1h), 7.22 (d, j = 9.0 hz, 1h), 7.12
ꢀ–ꢀ
7.05 (m, 2h), 6.97 (d, j = 8.1 hz, 1h), 6.93
ꢀ–ꢀ
6.81 (m, 4h), 6.37 (s, 1h), 4.90 (dd, j = 13.1, 5.4 hz, 1h), 3.83 (s, 3h), 3.25 (td, j = 12.9, 4.8 hz, 1h), 3.14
ꢀ–ꢀ
3.01 (m, 1h), 2.69 (dd, j = 15.5, 4.5 hz, 1h). 13
c nmr (101 mhz, chloroform
‑
d) δ 164.58, 163.35 (d, j = 247.4 hz), 154.52, 148.62 (d, j = 9.4 hz), 143.98, 133.38, 131.71, 131.23,130.73 (d, j = 9.5 hz), 129.25, 127.65, 123.59, 121.91, 121.19, 119.19 (d, j = 2.8 hz), 113.61, 113.26, 112.28, 112.01 (d, j = 21.2 hz),111.01 (d, j = 23.6 hz), 100.61, 73.08, 55.99, 43.46, 19.89.实施例3314
‑
(3
‑
fluorophenyl)
‑
10
‑
methyl
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmf10
‑
2)化合物zmf10
‑
2的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为
2
‑
((4
‑
fluorophenyl)amino)benzoic acid(化合物8
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲基色胺,其余步骤同实施例1制备而得,收率56%。1h nmr (400 mhz, chloroform
‑
d) δ 8.06 (d, j = 7.5 hz, 1h), 7.95 (s, 1h), 7.41
ꢀ–ꢀ
7.32 (m, 1h),7.25
ꢀ–ꢀ
7.20 (m, 2h), 7.11
ꢀ–ꢀ
7.07 (m, 2h), 7.02 (d, j = 8.0 hz, 1h), 6.97 (d, j = 8.2 hz, 1h), 6.90 (dt, j = 10.3, 2.2 hz, 1h), 6.87
ꢀ–ꢀ
6.81 (m, 1h), 6.38 (s, 1h), 4.89 (dd, j = 13.3, 5.4 hz, 1h), 3.25 (td, j = 12.9, 12.5, 4.8 hz, 1h), 3.13
ꢀ–ꢀ
3.00 (m, 1h), 2.70 (dd, j = 15.7, 4.5 hz, 1h), 2.42 (s, 3h). 13
c nmr (101 mhz, chloroform
‑
d) δ 164.56, 163.33 (d, j = 247.4 hz),148.56 (d, j = 9.4 hz), 143.97, 134.44, 133.37, 130.96, 130.74 (d, j = 9.4 hz), 129.61, 129.26, 127.43, 124.66, 123.61, 121.95, 121.16, 119.19 (d, j = 2.9 hz), 118.61, 113.46,112.02 (d, j = 21.3 hz), 111.12, 111.01 (d, j = 23.3 hz), 73.01, 43.45, 21.56, 19.82.实施例3414
‑
(3
‑
fluorophenyl)
‑
10
‑
methoxy
‑3‑
methyl
‑
8,13,13b,14
‑
tetrahydroindolo [2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmfy
‑
1)化合物zmfy
‑
1的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((3
‑
fluorophenyl)amino)
‑5‑
methylbenzoic acid(化合物20
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率60%。1h nmr (400 mhz, chloroform
‑
d) δ 8.02 (s, 1h), 7.86 (d, j = 2.1 hz, 1h), 7.25
ꢀ–ꢀ
7.16 (m, 3h), 7.00 (d, j = 8.2 hz, 1h), 6.92 (ddd, j = 8.2, 2.2, 0.9 hz, 1h), 6.88 (d, j = 2.4 hz, 1h), 6.90
ꢀ–ꢀ
6.76 (m, 3h), 6.36 (s, 1h), 4.88 (dd, j = 13.4, 4.9 hz, 1h), 3.83 (s, 3h), 3.25 (ddd, j = 13.2, 11.5, 4.8 hz, 1h), 3.12
ꢀ–ꢀ
3.00 (m, 1h), 2.72
ꢀ–ꢀ
2.63 (m, 1h), 2.30 (s, 3h). 13
c nmr (101 mhz, chloroform
‑
d) δ 165.31, 163.46 (d, j = 247.2 hz), 154.67, 149.21 (d, j = 9.4 hz), 141.59, 134.42, 133.78, 131.98, 131.31, 130.73 (d, j = 9.6 hz), 129.33, 127.84, 122.22, 121.70, 118.98 (d, j = 2.7 hz), 113.70, 113.33, 112.34, 111.78 (d, j = 21.1 hz), 110.81 (d, j = 23.6 hz), 100.81, 73.36, 56.12, 43.59, 20.97, 20.02.实施例3514
‑
(3
‑
fluorophenyl)
‑
3,10
‑
dimethyl
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4] pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物zmfy
‑
2)
化合物zmfy
‑
2的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((3
‑
fluorophenyl)amino)
‑5‑
methylbenzoic acid(化合物20
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲基色胺,其余步骤同实施例1制备而得,收率58%。1h nmr (400 mhz, dmso
‑
d6) δ 11.15 (s, 1h), 7.64 (d, j = 2.1 hz, 1h), 7.36
ꢀ–ꢀ
7.30 (m, 1h), 7.28 (dd, j = 8.5, 2.2 hz, 1h), 7.18 (d, j = 8.3 hz, 1h), 7.15 (s, 1h), 7.08 (d, j = 8.3 hz, 1h), 7.01
ꢀ–ꢀ
6.88 (m, 3h), 6.88 (dd, j = 8.4, 1.7 hz, 1h), 6.64 (s, 1h), 4.56 (dd, j = 13.1, 5.7 hz, 1h), 3.37 (td, j = 12.6, 5.0 hz, 1h), 2.88
ꢀ–ꢀ
2.78 (m, 1h), 2.59 (dd, j = 15.6, 4.8 hz, 1h), 2.32 (s, 3h), 2.24 (s, 3h).
13
c nmr (101 mhz, dmso
‑
d6) δ 164.82, 162.56 (d, j = 243.0 hz), 148.61 (d, j = 9.9 hz), 141.16, 134.50, 134.35, 132.64, 132.16, 130.81 (d, j = 9.4 hz), 128.06, 127.58, 126.85, 123.45, 121.92, 121.39, 118.58, 117.81, 111.57, 110.92, 110.65 (d, j = 20.8 hz), 109.78 (d, j = 23.6 hz), 72.06, 42.92, 21.33, 20.47 , 19.33.实施例3614
‑
(3,4
‑
difluorophenyl)
‑3‑
fluoro
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
6)化合物l
‑
6的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((3,4
‑
difluorophenyl)amino)
‑5‑
fluorobenzoic acid(化合物36
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率23%。1h nmr (400 mhz, cdcl3)δ 8.32 (s, 1h), 7.79 (dd, j = 8.6, 3.0 hz, 1h), 7.26
ꢀ–ꢀ
7.22 (m, 1h), 7.10 (ddd, j = 8.7, 7.9, 3.0 hz, 1h), 7.01
ꢀ–ꢀ
6.91 (m, 2h), 6.90
ꢀ–ꢀ
6.81 (m, 3h), 6.78
ꢀ–ꢀ
6.71 (m, 1h), 6.25 (s, 1h), 4.82 (ddd, j = 12.9, 4.9, 1.8 hz, 1h), 3.83 (s, 3h), 3.23 (ddd, j = 13.0, 11.3, 4.9 hz,1h), 2.84
ꢀ–ꢀ
2.67 (m, 2h). 13
c nmr (101 mhz, cdcl3) δ 164.0 (d, j = 2.2 hz), 159.3 (d, j = 244.9 hz), 154.4, 151.3 (d, j = 13.5 hz), 149.5 (d, j = 12.7 hz), 148.8 (d, j = 13.5 hz), 147.0 (d, j = 12.7 hz), 142.5 (dd, j = 6.9, 3.1 hz), 141.9 (d, j = 2.4 hz), 131.3, 129.4, 127.0, 124.5 (dd, j = 36.4, 7.6 hz), 121.5(dd, j = 6.0, 3.4 hz), 121.0 (d, j = 23.8 hz), 117.4 (d, j = 18.0 hz), 114.9 (dd, j = 21.2, 12.0 hz), 114.0, 113.5, 112.2, 100.6, 72.2, 55.8, 42.2, 19.8.
化合物36
‑
1的结构式为:实施例3714
‑
(4
‑
chloro
‑3‑
fluorophenyl)
‑3‑
fluoro
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
7)化合物l
‑
7的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((4
‑
chloro
‑3‑
fluorophenyl)amino)
‑5‑
fluorobenzoic acid(化合物37
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率21%。1h nmr (400 mhz, cdcl3) δ 8.23 (s, 1h), 7.77 (dd, j = 8.6, 3.0 hz, 1h), 7.26
ꢀ–ꢀ
7.17 (m, 2h), 7.11 (ddd, j = 8.8, 7.8, 3.0 hz, 1h), 7.02 (dd, j = 8.9, 4.5 hz, 1h), 6.91
ꢀ–ꢀ
6.84 (m, 2h), 6.82 (dd, j = 10.3, 2.6 hz, 1h), 6.75 (ddd, j = 8.7, 2.5, 1.0 hz, 1h), 6.30 (s, 1h), 4.88
ꢀ–ꢀ
4.68 (m, 1h), 3.24 (ddd, j = 13.1, 11.5, 4.9 hz, 1h), 2.92
ꢀ–ꢀ
2.79 (m, 1h), 2.71 (dd, j = 15.6, 4.8 hz, 1h).
13
c nmr (101 mhz, cdcl3) δ 163.8 (d, j = 2.2 hz), 159.4 (d, j = 245.3 hz), 158.1 (d, j = 250.4 hz), 154.5, 146.5 (d, j = 8.1 hz), 140.7 (d, j = 2.4 hz), 131.3, 130.0, 129.9, 127.2, 124.7 (d, j = 7.5 hz), 124.2 (d, j = 7.7 hz), 121.0 (d, j = 23.9 hz), 120.7 (d, j = 3.4 hz), 117.6 (d, j = 17.8 hz), 115.1 (d, j = 23.9 hz), 114.1, 113.6, 112.9 (d, j = 22.9 hz), 12.2, 100.6, 72.6, 55.9, 42.7, 19.8.化合物37
‑
1的结构式为:实施例3814
‑
(4
‑
bromo
‑3‑
fluorophenyl)
‑3‑
fluoro
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
8)化合物l
‑
8的结构式为:
113.4 (d, j = 25.8 hz), 112.2, 111.6 (d, j = 24.1 hz), 100.6, 72.7, 55.9, 42.8, 19.8, 14.1.化合物39
‑
1的结构式为:实施例403
‑
fluoro
‑
14
‑
(3
‑
fluoro
‑4‑
methoxyphenyl)
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
10)化合物l
‑
10的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为5
‑
fluoro
‑2‑
((3
‑
fluoro
‑4‑
methoxyphenyl)amino)benzoic acid(化合物40
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率21%。1h nmr (400 mhz, cdcl3) δ 8.32 (s, 1h), 7.77 (dd, j = 8.7, 3.0 hz, 1h), 7.23 (d, j = 8.7 hz, 1h), 7.06 (ddd, j = 8.7, 8.0, 3.0 hz, 1h), 6.94
ꢀ–ꢀ
6.87 (m, 2h), 6.87
ꢀ–ꢀ
6.82 (m, 2h), 6.82
ꢀ–ꢀ
6.71 (m, 2h), 6.22 (s, 1h), 4.83 (ddd, j = 12.8, 5.1, 1.3 hz, 1h), 3.83 (s, 3h), 3.79 (s, 3h), 3.23 (ddd, j = 13.0, 11.3, 4.9 hz, 1h), 2.87
ꢀ–ꢀ
2.77 (m, 1h), 2.72 (dd, j = 15.4, 4.8 hz, 1h).
13
c nmr (101 mhz, cdcl3) δ 164.1 (d, j = 2.2 hz), 158.9 (d, j = 243.8 hz), 154.3, 151.9 (d, j = 248.3 hz), 145.9 (d, j = 10.7 hz), 142.6 (d, j = 2.3 hz), 139.0 (d, j = 7.6 hz), 131.4, 129.8, 127.0, 123.9 (d, j = 7.6 hz), 123.8 (d, j = 7.5 hz), 121.9 (d, j = 3.3 hz), 120.8 (d, j = 23.7 hz), 114.7 (d, j = 23.8 hz), 114.3 (d, j = 19.3 hz), 113.5 (d, j = 29.3 hz), 113.3, 113.3, 112.1, 100.5, 72.0, 56.3, 55.8, 42.0, 19.8.化合物40
‑
1的结构式为:实施例4114
‑
(3,5
‑
difluorophenyl)
‑3‑
fluoro
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
11)
hz), 135.8 (d, j = 12.5 hz), 131.2, 130.4, 127.4, 124.4 (d, j = 7.6 hz), 124.0 (d, j = 7.7 hz), 121.0 (d, j = 23.8 hz), 119.4 (d, j = 3.2 hz), 115.2 (d, j = 24.1 hz), 113.9, 113.5, 112.8 (d, j = 24.9 hz), 112.3, 109.2 (d, j = 24.0 hz), 100.6, 73.10, 55.9, 43.3, 19.8.化合物42
‑
1的结构式为:实施例4314
‑
(3
‑
bromo
‑5‑
fluorophenyl)
‑3‑
fluoro
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
13)化合物l
‑
13的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((3
‑
bromo
‑5‑
fluorophenyl)amino)
‑5‑
fluorobenzoic acid(化合物43
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率20%。1h nmr (400 mhz, dmso) δ 11.19 (s, 1h), 7.57 (dd, j = 8.8, 3.1 hz, 1h), 7.38 (td, j = 8.6, 3.1 hz, 1h), 7.32
ꢀ–ꢀ
7.23 (m, 2h), 7.23
ꢀ–ꢀ
7.14 (m, 2h), 7.03 (dt, j = 10.8, 2.1 hz, 1h), 6.89 (d, j = 2.4 hz, 1h), 6.78
ꢀ–ꢀ
6.67 (m, 2h), 4.59 (dd, j = 13.0, 5.6 hz, 1h), 3.73 (s, 3h), 3.43 (td, j = 12.8, 5.0 hz, 1h), 2.99
ꢀ–ꢀ
2.74 (m, 1h), 2.64 (dd, j = 15.5, 4.6 hz, 1h).
13
c nmr (101 mhz, dmso) δ 163.3 (d, j = 2.1 hz), 162.3 (d, j = 247.9 hz), 158.2 (d, j = 241.7 hz), 153.4, 149.2 (d, j = 10.9 hz), 139.1, 131.9, 131.1, 126.8, 124.3 (d, j = 7.9 hz), 123.3 (d, j = 7.4 hz), 122.2 (d, j = 12.2 hz), 121.6, 121.0 (d, j = 23.7 hz), 114.2 (d, j = 24.9 hz), 113.7 (d, j = 23.9 hz), 112.4, 112.1, 111.3, 109.2 (d, j = 24.3 hz), 99.9, 71.9, 55.3, 42.8, 19.3.化合物43
‑
1的结构式为:实施例443
‑
fluoro
‑
14
‑
(3
‑
fluoro
‑5‑
methylphenyl)
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
14)
154.3, 148.9 (d, j = 12.3 hz), 140.1 (d, j = 2.5 hz), 131.2, 131.0, 127.3, 123.8 (d, j = 7.4 hz), 123.8 (d, j = 7.5 hz), 120.7 (d, j = 23.7 hz), 114.8 (d, j = 24.1 hz), 113.4, 113.2, 112.2, 105.3 (d, j = 2.8 hz), 103.1 (d, j = 24.4 hz), 100.4, 98.2 (d, j = 25.3 hz), 73.0, 55.8, 55.6, 43.3, 19.8.化合物45
‑
1的结构式为:实施例4614
‑
(2,5
‑
difluorophenyl)
‑3‑
fluoro
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
16)化合物l
‑
16的结构式为:将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((2,5
‑
difluorophenyl)amino)
‑5‑
fluorobenzoic acid(化合物46
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率19%。1h nmr (400 mhz, dmso) δ 11.06 (s, 1h), 7.56 (dd, j = 8.9, 3.1 hz, 1h), 7.40
ꢀ–ꢀ
7.23 (m, 3h), 7.20 (d, j = 8.8 hz, 1h), 7.15
ꢀ–ꢀ
7.05 (m, 1h), 6.99 (dd, j = 8.9, 4.5 hz, 1h), 6.88 (d, j = 2.4 hz, 1h), 6.71 (dd, j = 8.8, 2.4 hz, 1h), 6.52 (s, 1h), 4.60 (dd, j = 13.0, 5.2 hz, 1h), 3.72 (s, 3h), 3.42
ꢀ–ꢀ
3.35 (m, 1h), 2.94
ꢀ–ꢀ
2.76 (m, 1h), 2.67 (dd, j = 15.4, 4.6 hz, 1h).
13
c nmr (101 mhz, dmso) δ 163.4 (d, j = 2.0 hz), 157.7 (d, j = 240.3 hz), 153.3, 141.1, 131.1, 130.8, 126.4, 122.8 (d, j = 8.0 hz), 122.5 (d, j = 7.3 hz), 120.9, 120.7, 117.7 (dd, j = 23.3, 9.7 hz), 115.8 (d, j = 24.3 hz), 114.2 (d, j = 8.4 hz), 114.0 (d, j = 8.1 hz), 113.5, 113.2, 112.34, 112.1, 111.3, 99.9, 70.9, 55.3, 42.1, 19.3.化合物46
‑
1的结构式为:实施例4714
‑
(2
‑
chloro
‑5‑
fluorophenyl)
‑3‑
fluoro
‑
10
‑
methoxy
‑
8,13,13b,14
‑
tetrahydroindolo[2',3':3,4]pyrido[2,1
‑
b]quinazolin
‑
5(7h)
‑
one (化合物l
‑
17)化合物l
‑
17的结构式为:
将实施例1步骤(1)中的原料2
‑
(phenylamino)benzoic acid(化合物1
‑
1)替换为2
‑
((2
‑
chloro
‑5‑
fluorophenyl)amino)
‑5‑
fluorobenzoic acid(化合物47
‑
1),将实施例1步骤(2)中的原料色胺替换为5
‑
甲氧基色胺,其余步骤同实施例1制备而得,收率15%。1h nmr (400 mhz, dmso) δ 10.88 (s, 1h), 7.55 (dd, j = 8.6, 5.9 hz, 2h), 7.49
ꢀ–ꢀ
7.26 (m, 2h), 7.25
ꢀ–ꢀ
7.13 (m, 2h), 6.89 (d, j = 2.3 hz, 1h), 6.79 (dd, j = 8.8, 4.3 hz, 1h), 6.71 (dd, j = 8.8, 2.4 hz, 1h), 6.49 (s, 1h), 4.61 (dd, j = 12.9, 5.4 hz, 1h), 3.72 (s, 3h), 3.34
ꢀ–ꢀ
3.26 (m, 1h), 2.99
ꢀ–ꢀ
2.85 (m, 1h), 2.68 (dd, j = 15.3, 4.1 hz, 1h).
13
c nmr (101 mhz, dmso) δ 163.6, 160.7 (d, j = 246.4 hz), 157.4 (d, j = 240.2 hz), 153.3, 143.3 (d, j = 9.7 hz), 141.4 (d, j = 1.5 hz), 131.9 (d, j = 9.4 hz), 131.19, 127.3 (d, j = 3.5 hz), 126.4, 121.0, 120.8, 118.4, 118.2, 115.6 (d, j = 22.5 hz), 113.6, 113.4, 112.5, 112.2, 111.6, 99.9, 79.2, 55.3, 42.2, 19.3.化合物47
‑
1的结构式为:实施例48mtt法测定细胞生长抑制率试验方法:将不同癌细胞(hgc
‑
27, mgc
‑
803, bgc
‑
823, ags, sgc
‑
7901, mcf
‑
7, hepg2, a549)和正常细胞(ges
‑
1)用含有10%胎牛血清的rpmi
‑
1640培养基或dmem培养基在37 ℃、5% co2条件下放置在细胞培养箱中培养。待细胞处于对数期时,以每孔5000~8000个细胞接种于96孔板中,培养24 h后移去旧培养基,加入含有待测样品的培养基(将100mmol
·
l
‑1目标化合物dmso母液配制成实验浓度18、6、2、0.67、0.22、0.07、0.024、0.008 μmol
·
l
‑1),每个实验浓度设置3个复孔,同时设置空白对照组。待实验细胞培养72 h 后,加入10 μl mtt 溶液,孵育4 h 后将96 孔板内的上清液吸出,每孔中加入150 μl的dmso,振荡20 min。在570 nm 波长下利用酶标仪测定实验中96 孔板各孔的吸光值(od 值),计算细胞增殖抑制率(inhibitory rate,ir),细胞增殖抑制率%=(对照孔平均od值
‑
实验孔平均od值)/(对照孔平均od值
‑
空白od值),并用spss 20.0计算半数抑制浓度ic
50
值(means
ꢀ±ꢀ
sd, n=3),具体数据见表1
‑
表5。(上述平行实验均独立重复三次)。
[0027]
试验结果:上述试验结果显示,本发明所制备的吴茱萸碱衍生物具有对不同癌细胞(hgc
‑
27, mgc
‑
803, sgc
‑
7901, mcf
‑
7, hepg2,a549, ht
‑
29, rko, huh7)的抑制活性,对正常细胞(ges
‑
1, lo2)具有一定的选择抑制活性。
[0028]
表1. 所合成的化合物6a
‑
6t 在不同癌细胞(ht
‑
29, hgc
‑
27, hepg
‑
2, a549, mcf7)和正常细胞ges
‑
1的抑制活性。
[0029]
a
所有数据均通过三组重复的独立实验获得;ic
50
值由ibm spss statistics 软件计算得到。
[0030]
表2. 所合成的化合物zmf3
‑
1到zmfy
‑
3在不同癌细胞(hgc
‑
27, mgc
‑
803, sgc
‑
7901)和正常细胞ges
‑
1的抑制活性。
[0031]
a
所有数据均通过三组重复的独立实验获得;ic
50
值由ibm spss statistics 软件计算得到。
[0032]
表3. 所合成的化合物zmf3
‑
1到zmfy
‑
3在不同癌细胞(hepg2, mhcc
‑
lm9, huh7)和正常细胞lo2的抑制活性。
[0033]
a
所有数据均通过三组重复的独立实验获得;ic
50
值由ibm spss statistics 软件计算得到。
[0034]
表4. 所合成的化合物l
‑
6到l
‑
22在不同癌细胞(hgc
‑
27, mgc
‑
803, sgc
‑
7901)和正常细胞ges
‑
1的抑制活性。
[0035]
a
所有数据均通过三组重复的独立实验获得;ic
50
值由ibm spss statistics 软件计算得到。
[0036]
表5. 所合成的化合物l
‑
6到l
‑
22在不同癌细胞(hepg2, mhcc
‑
lm9, huh7, ht29, rko)抑制活性。
[0037]
a
所有数据均通过三组重复的独立实验获得;ic
50
值由ibm spss statistics 软件计算得到。
[0038]
所合成的化合物对多种癌细胞具有抗增殖作用,例如化合物zmfx
‑
4、zmfy
‑
2等对多株胃癌细胞(hgc
‑
27, mgc
‑
803等)具有显著的抑制活性;化合物6f对结肠癌细胞ht
‑
29具有显著的抑制活性;l
‑
21对多株肝癌细胞(hepg2, mhcc
‑
lm9, huh7)具有显著的抑制作用。
[0039]
实施例49本发明化合物对拓扑异构酶i和ii的抑制作用试验方法:用1xtae溶液配置成浓度为0.8%的琼脂糖凝胶。依次向1.5 ml样品管中加入10 μl水,2 μl 0.1% bsa, topo i/ii 0.5 u, dna 0.5 μl,不同的药物0.2 μl,定容到20 μl。将样品管放入37℃环境中,孵化15
‑
30分钟后,每管加入4 μl 6x loading buffer。上样后,110v电泳40
‑
50分钟,将凝胶浸泡于0.5 μg/ml 溴化乙锭溶液中15
‑
30分钟。凝胶成像系统观察电泳结果。
[0040]
图1为所测试化合物对拓扑异构酶i和ii的抑制作用。结果显示,化合物zx
‑
1, zx
‑
2, zx
‑
4, zx
‑
5, zy
‑
2在10 μm时对topo i有良好的抑制活性,化合物zx
‑
1, zx
‑
2, zx
‑
4 在200 μm时对topo ii有良好的抑制活性,化合物zmfx
‑
4在100 μm时对topo ii有良好的抑制活性。
[0041]
实施例64本发明化合物对胃癌hgc
‑
27和ht
‑
29细胞增殖的影响试验方法:(1)平板克隆实验取生长状态良好,处于对数生长期的细胞,常规胰酶消化后培养液吹打成细胞悬液。六孔板每孔种5000个细胞。贴壁后加入本发明化合物。实验组加入不同浓度的本发明得
到化合物。对照组则加等量不含本发明化合物的培养液。每组3个复孔。在37℃、含5% co2、饱和湿度的培养箱中培养7
‑
14天。期间3天换1次药液。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用pbs小心浸洗2次。加甲醇固定细胞,15分钟后去除固定液。加适量0.5%结晶紫染色,30分钟后用流水缓慢洗去染色液,空气干燥。
[0042]
(2)edu实验取生长状态良好,处于对数生长期的细胞,常规胰酶消化后培养液吹打成细胞悬液。96孔板每孔种5000个细胞。贴壁后加药处理。实验组加入不同浓度的药物。对照组则加等量不含药物的培养液。每组3个复孔。在37℃、含5% co2、饱和湿度的培养箱中培养24 h,弃去上清液,加入100 μl含有50 μmedu的完全培养基,37℃孵育2h。4%的多聚甲醛固定后加入0.5%的曲拉通透膜。pbs洗两次后,先后加入apollo染液和hoechst 33342染液,pbs清洗后,在显微镜下观察。
[0043]
图2为所选化合物对hgc
‑
27和ht
‑
29细胞克隆群落形成的影响。其中图a为化合物对hgc
‑
27细胞克隆群落增殖的影响结果,b为化合物对hgc
‑
27细胞克隆群落增殖影响结果的柱状统计图,c为化合物对ht
‑
29细胞群落增殖的表观影响,d为化合物对ht
‑
29细胞克隆群落增殖影响结果的柱状统计图。图中显示所选化合物能够呈浓度依赖地抑制hgc
‑
27和ht
‑
29细胞克隆群落的形成,且经统计具有显著性差异。
[0044]
图3为所选化合物对hgc
‑
27和ht
‑
29细胞动态增殖的影响。其中图a为化合物对hgc
‑
27细胞动态增殖影响的表观结果,b为化合物对hgc
‑
27细胞动态增殖影响的柱状统计图,c为化合物对ht
‑
29细胞动态增殖影响的表观结果图,d为化合物对ht
‑
29细胞动态增殖影响的柱状统计图。图中显示所选化合物经edu实验测定,能够呈浓度依赖地抑制hgc
‑
27和ht
‑
29细胞动态增殖,且经统计具有显著性差异。
[0045]
实施例50本发明化合物对hgc
‑
27和ht
‑
29细胞凋亡的影响试验方法:(1)姬姆萨染色取生长状态良好,处于对数生长期的细胞,常规胰酶消化后培养液吹打成细胞悬液。六孔板每孔种1
×
104个细胞。贴壁后加药处理。实验组加入不同浓度的药物。对照组则加等量不含药物的培养液。每组3个复孔。在37℃、含5% co2、饱和湿度的培养箱中培养24h,弃去上清液。加甲醇固定细胞,2分钟后去除固定液。每孔加500μl姬姆萨染液染色,15分钟后用流水缓慢洗去染色液,空气干燥。
[0046]
(2)流式细胞术取生长状态良好,处于对数生长期的细胞,常规胰酶消化后培养液吹打成细胞悬液。六孔板每孔种15
×
104个细胞。在37℃、含5% co2、饱和湿度的培养箱中培养。细胞贴壁后加入不同浓度药物处理48 h。每组3个复孔。培养48 h后收集细胞,用annexin
‑
v fitc/pi凋亡试剂盒对细胞染色,用流式细胞仪分析细胞凋亡。
[0047]
(3)hoechst 染色取生长状态良好,处于对数生长期的细胞,常规胰酶消化后培养液吹打成细胞悬液。六孔板每孔种1
×
104个细胞。贴壁后加药处理。实验组加入不同浓度的药物。对照组则加等量不含药物的培养液。每组3个复孔。在37℃、含5% co2、饱和湿度的培养箱中培养24h,弃去上清液,用pbs小心浸洗2次。加甲醇固定细胞,10分钟后去除固定液。每孔加200μ
lhoechst染液避光染色,15分钟后弃染色液并用pbs小心浸洗3次,尽快于荧光显微镜下拍摄。
[0048]
图4为所选化合物处理后hgc
‑
27和ht
‑
29细胞经姬姆萨染色的形态学变化情况。从图中可以看出所选化合物能够呈浓度依赖性地诱导hgc
‑
27和ht
‑
29细胞凋亡。
[0049]
图5为所选化合物对hgc
‑
27和ht
‑
29细胞凋亡的影响,从图中可以看出所选化合物经流式细胞术测定,其能够呈浓度依赖地诱导hgc
‑
27和ht
‑
29的凋亡。
[0050]
图6为所选化合物处理后hgc
‑
27和ht
‑
29细胞经hoechst染色的细胞核凋亡变化情况。从图中可以看出所选化合物能够呈浓度依赖性地诱导hgc
‑
27和ht
‑
29细胞凋亡。
[0051]
实施例51本发明化合物对hgc
‑
27和ht
‑
29细胞周期分布的影响试验方法:取生长状态良好,处于对数生长期的细胞,常规胰酶消化后培养液吹打成细胞悬液。六孔板每孔种20
×
104个细胞。在37℃、含5% co2、饱和湿度的培养箱中培养。细胞贴壁后加入不同浓度药物处理48 h。每组3个复孔。培养48 h后收集细胞,用预冷的pbs3次洗涤收集的细胞,离心沉淀细胞,弃上清。用500μl pbs重悬细胞,迅速打入预冷的无水乙醇中,吹打均匀,4℃储存过夜。离心乙醇固定过的细胞,弃上清,pbs洗涤细胞3次。用rnase a于37℃重悬细胞,15min后,加入pi染色液避光染色15 min。流式细胞仪测定细胞周期。用modfit lt软件分析流式周期结果,统计g0/g1期、s期、g2/m期各组所占百分比。
[0052]
图7为所选化合物对胃癌hgc
‑
27(a)和ht
‑
29(b)细胞周期分布的影响和所选化合物处理后胃癌hgc
‑
27和ht
‑
29细胞周期分布的统计。结果显示所选化合物能够诱导胃癌细胞周期阻滞于s期和g2/m期。
[0053]
实施例52本发明化合物对hgc
‑
27和ht
‑
29细胞迁移、侵袭的影响试验方法:(1)划痕实验将细胞消化接种到六孔板,培养到密度为90%时准备划痕。用一个10μl枪头在细胞达到要求的孔中央划一条直线,直线应同等粗细。划完后,用pbs把飘起细胞洗弃。各孔中加含药物和2%血清的培养基后,放入37℃培养箱中培养,于24小时对各剂量组划痕进行拍照,观察细胞用药前后迁移距离变化。
[0054]
(2)transwell迁移实验取出transwell小室(corning 3422) 放入24孔板各孔中。每孔加600μl含有20%血清的培养基。消化细胞,得细胞悬液,按每孔8000个细胞接入上室。上室加2
ⅹ
浓度药物,加无血清培养基并使上室终体积为400μl。放入细胞培养箱培养48h。取出小室,用棉签擦去上室内侧未穿过的细胞,下室加甲醇,并将上室浸入,室温固定10min,pbs清洗,移去小室,倒置,风干。用pbs配制浓度为0.1%结晶紫溶液,每小室加700μl,将上室浸入其中,置于37℃培养箱中染色30min;取出小室,用pbs清洗,并在显微镜下观察,在膜上相互垂直的直径上取5个不同视野,计透膜细胞数。
[0055]
(3)transwell侵袭实验从
‑
20℃冰箱取出matrigel于4℃过夜融化,将ep管于冰上预冷,并将融化后的matrigel与预冷无血清无双抗培养基按体积比1:8混合,轻轻混匀。每个transwell板小室上层加40μl混合后的matrigel混合液,轻轻混匀,并置于培养箱中1h。取出transwell板,轻
轻吸弃小室中多余液体,于小室上层加100μl无血清无双抗培养基并将transwell板放入培养箱中1h,水化基底膜。取出transwell小室,下室每孔加600μl含有20%血清培养基。消化细胞,得细胞悬液,按每孔16000个细胞接入上室,上室加 2
ⅹ
浓度药物,加无血清培养基并使上室终体积为400 μl,放入细胞培养箱培养48 h。取出小室,用棉签擦去上室内侧未穿过的细胞,下室加甲醇,并将上室浸入,室温固定10 min,pbs清洗,移去小室,倒置,风干。用pbs配制浓度为0.1%结晶紫溶液,每小室加700 μl,将上室浸入其中,置于37℃培养箱中染色30min;取出小室,用pbs清洗,并在显微镜下观察,在膜上相互垂直的直径上取5个不同视野,计透膜细胞数。
[0056]
图8为所选化合物对hgc
‑
27细胞迁移的影响。图中显示:所选化合物经划痕实验证实能够呈浓度依赖性地抑制hgc
‑
27细胞的迁移,且具有统计学差异。
[0057]
图9为所选化合物对hgc
‑
27细胞迁移的影响。图中显示:所选化合物经transwell迁移实验证实能够呈浓度依赖性地抑制hgc
‑
27细胞迁移,且具有统计学差异。
[0058]
图10为所选化合物对hgc
‑
27细胞侵袭的影响。图中显示:所选化合物经transwell侵袭实验证实能够呈浓度依赖性地抑制hgc
‑
27细胞侵袭,且具有统计学差异。
[0059]
实施例53急性毒性试验的测定对化合物的急性毒性进行了研究。每组3只小鼠,分别给予剂量为1000 mg/kg。在开始的4小时内,这些动物被持续观察,以确定是否有毒性。此后,在24小时内每隔一段时间观察这些动物,然后在接下来的7天内每天观察一次。7天后,给药组全部存活,ld
50
>1000mg/kg。
[0060]
实施例54本发明化合物在裸鼠皮下移植瘤mgc
‑
803模型上对胃癌瘤块的抑制作用试验方法:裸鼠购买自南京集萃药康。首先在spf动物房中适应一周左右,自由饮食,以消除环境对其产生的影响。选取健康雄性裸鼠(4
‑
5周龄),分别称取体重。取生长状态良好,处于对数生长期的hgc
‑
27细胞,常规胰酶消化后培养液吹打成细胞悬液。用pbs和基质胶稀释为每毫升8
×
106个细胞,pbs和基质胶比例为1:1。将细胞悬液皮下注射到裸鼠右侧腋下,每只200 μl。瘤体积达到100mm3后,将其随机分为4组:模型组,阳性药组(150 mg/kg),高剂量组(150 mg/kg),低剂量组(75 mg/kg)。将药物溶解于含有5% dmso, 1.5% 聚氧乙烯蓖麻油, 1.5% hs
‑
15的生理盐水中。采用灌胃给药,一天两次,给药三周。在此期间,每两天量一次瘤体积和裸鼠体重。瘤体积公式为:长*宽2/2。抑瘤率公式为: [1
‑ꢀ
(t
ꢀ‑ꢀ
t0) /(c
ꢀ–ꢀ
c0)]
ꢀ×
100%。其中,t和c分别代表给药组和模型组最后一天的平均瘤体积,t0和c0分别代表给药组和模型组第一天的平均瘤体积。最后一天采血后做血常规。
[0061]
实验结果:选用对mgc
‑
803具有体外良好抑制活性且对胃正常细胞ges
‑
1抑制活性较低的化合物zmfy
‑
2进行体内实验。一天一次腹腔给药,给药量50mg/kg。结果见图11,a为所选化合物给药后裸鼠皮下移植瘤的瘤体积曲线;b为所选化合物给药后裸鼠的体重曲线;c为所选化合物最后一天给药裸鼠皮下移植瘤的瘤重;d为所选化合物最后一天给药裸鼠皮下移植瘤的尺寸。图中显示:不同浓度的化合物zmfy
‑
2给药后均能减缓肿瘤体积生长速度,抑制肿瘤生长。且给药三周后,给药组与模型组体重无显著性差异。
[0062]
表6结果显示,所选化合物给药后抑瘤率为70.12 % (50 mg/kg)。血常规结果显示给药组白细胞、红细胞、血小板以及血红蛋白无明显减少,表明无骨髓抑制、再生贫血性障碍等不良反应。
[0063]
图12为给药裸鼠14天后空白组和给药组(50 mg/kg,腹腔注射,一天一次)的脾脏、肝脏、肾脏、心脏、脑的组织切片,表明给药组无明显的对心、肝、脾、肺、肾的损伤。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。