一种暹罗芽孢杆菌jy
‑
1及其制剂和应用
技术领域
1.本发明属于微生物技术应用领域,具体涉及一种暹罗芽孢杆菌jy
‑
1及其制剂和应用。
背景技术:
2.猕猴桃营养丰富,酸甜适口,风味独特,具有防癌抗癌和抗衰老等功效,深受消费者喜爱;同时,猕猴桃因种植效益高和栽培相对容易等特点,也获得了广大生产者的亲睐。因此,猕猴桃尽管栽培历史不长,但在国内外发展很快。目前全球共有中国、新西兰、意大利、智利等30多个国家种植猕猴桃,总面积达28万hm2,总产近452万t;我国现为猕猴桃生产第一大国,栽培面积和产量分别达到19.3万hm2和229万t(2020年)。近年来,猕猴桃果实熟腐病(fruit ripe rot of kiwifruit,简称果腐病)大面积发生,该病主要在幼果期发生侵染,在果实近成熟期开始陆续显症,常导致挂果后期的大量落果和贮藏后熟期间的爆发性腐烂,果腐病对猕猴桃产量和品质造成严重影响,已成为我国猕猴桃发展的重要限制因素。
3.化学防治即农药防治,见效快、效果显著、使用方便、不受地区和季节限制等,适于大面积防治,是植物病害防治的重要手段,但随着生产上化学药剂的大量使用,随之而来的环境污染、农产品农药残留超标以及病原菌抗药性的形成等负面效应已经引起社会的广泛关注。植物病原物在生长发育以及致病过程中均受到来自于寄主植物和外界生物、非生物因素的影响。利用有益微生物来控制病害发生发展的方法称之为植物病害生物防治,而这些有益微生物则称为植物病害生防菌。生物防治不仅能在一定程度上替代化学农药,而且对人畜安全,无残毒,对环境无污染,因而能有效地保护天敌、保护生态平衡,发挥持续控害作用。
技术实现要素:
4.本发明通过筛选,得到了一株生防暹罗芽孢杆菌菌株jy
‑
1,名称为bacillus siamensis j y
‑
1,已于2021年9月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.23363。其16s rdna序列如seq id no:1所示。
5.seq id no:1:
6.ggctcaggacgaacgctggcggcgtgcctaatacatgcaagtcgagcggacagatgggagcttgctccctgatgttagcggcggacgggtgagtaacacgtgggtaacctgcctgtaagactgggataactccgggaaaccggggctaataccggatggttgtttgaaccgcatggttcagacataaaaggtggcttcggctaccacttacagatggacccgcggcgcattagctagttggtgaggtaacggctcaccaaggcgacgatgcgtagccgacctgagagggtgatcggccacactgggactgagacacggcccagactcctacgggaggcagcagtagggaatcttccgcaatggacgaaagtctgacggagcaacgccgcgtgagtgatgaaggttttcggatcgtaaagctctgttgttagggaagaacaagtgccgttcaaatagggcggcaccttgacggtacctaaccagaaagccacggctaactacgtgccagcagccgcggtaatacgtaggtggcaagcgttgtccggaattattgggcgtaaagggctcgcaggcggtttcttaagtctgatgtgaaagcccccggctcaaccggggagggtcattggaaactggggaacttgagtgcagaagaggagagtggaattccacgtgtagcggtgaaatg
cgtagagatgtggaggaacaccagtggcgaaggcgactctctggtctgtaactgacgctgaggagcgaaagcgtggggagcgaacaggattagataccctggtagtccacgccgtaaacgatgagtgctaagtgttagggggtttccgccccttagtgctgcagctaacgcattaagcactccgcctggggagtacggtcgcaagactgaaactcaaaggaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttaccaggtcttgacatcctctgacaatcctagagataggacgtccccttcgggggcagagtgacaggtggtgcatggttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgatcttagttgccagcattcagttgggcactctaaggtgactgccggtgacaaaccggaggaaggtggggatgacgtcaaatcatcatgccccttatgacctgggctacacacgtgctacaatggacagaacaaagggcagcgaaaccgcgaggttaagccaatcccacaaatctgttctcagttcggatcgcagtctgcaactcgactgcgtgaagctggaatcgctagtaatcgcggatcagcatgccgcggtgaatacgttcccgggccttgtacacaccgcccgtcacaccacgagagtttgtaacacccgaagtcggtgaggtaacctttatggagccagccgccgaaggtgggacagatgattggggtgaagtcgtaacagg
7.该菌株不但对目标菌猕猴桃果腐病菌具有显著的防治效果,而且对稻瘟病菌、山药青霉病菌、水稻白叶枯病菌等多种植物病原真、细菌具有显著的抑菌活性。
8.本发明的另一个目的在于提供一种微生物制剂,其组分包括上述的暹罗芽孢杆菌jy
‑
1的发酵液。其制备方法包括以下步骤:将所述暹罗芽孢杆菌jy
‑
1接至na平板上,30℃活化培养24h,然后转接至50ml nb优化培养液中,于30℃、220r/min条件下培养72h,调节至浓度为1
×
108cfu/ml,即得所述微生物制剂;所述nb优化培养液的组分包括:2%蔗糖,0.3%酵母膏,3%蛋白胨,0.5%nacl,0.09%mgso4·
7h2o。
9.本发明的有益效果为:
10.(1)本发明筛选得到的暹罗芽孢杆菌jy
‑
1对葡萄白腐病菌(coniella castaneicola)、葡萄苦腐病菌(greeneria uvicola)、山药炭疽病菌(colletortrichum gloeosporioides)、猕猴桃褐斑病菌(alternaria alternata)、水稻稻瘟病菌(magnaporthe oryzae)、莲腐败病菌(fusarium oxysporum)、芝麻茎点枯病菌(macrophomina phaseoli)、梨轮纹病菌(botryosphaeria berergerianaf.sp.piricola)、辣椒疫病菌(phytophthora capsici)、猕猴桃果腐病菌(botryosphaeria dothidea)、山药青霉病菌(penicillium sclerotigenum)、柑橘溃疡病菌(xanthomonas campestris pv.citri)、水稻细菌性条斑病菌(xanthomonas oryzae pv.oryzicola)、水稻白叶枯病菌(xanthomonas oryzae pv.oryzae)和芝麻青枯病(pseudomonas solanacearum)均具有较强的抑菌效果,说明本发明菌株具有广普的抑菌活性。
11.(2)本发明的微生物制剂对猕猴桃果腐病及山药青霉病有显著的防治效果;暹罗芽孢杆菌jy
‑
1的发酵液的活性代谢产物较耐高温,其代谢产物置于40℃时具有最高的抑菌效果;该菌株具有拮抗效果的活性物质对紫外线的照射时长不敏感。
附图说明
12.图1所示为暹罗芽孢杆菌jy
‑
1不同时期菌落形态图;
13.图2所示为暹罗芽孢杆菌jy
‑
1革兰氏染色及芽孢染色的菌体形态图;
14.图3所示为基于16s rdna序列构建的芽孢杆菌系统发育树图;
15.图4所示为不同ph处理对菌株jy
‑
1活性代谢产物稳定性的影响结果图;
16.图5所示为不同温度处理对菌株jy
‑
1活性代谢产物稳定性的影响结果图;
17.图6所示为不同紫外线处理对菌株jy
‑
1活性代谢产物稳定性的影响结果图;
18.图7所示为暹罗芽孢杆菌jy
‑
1菌株对植物病原真菌抑菌谱试验,a:葡萄白腐病菌;b:葡萄苦腐病菌;c:山药炭疽病菌;d:辣椒疫病菌;e:水稻稻瘟病菌;f:莲腐败病菌;g:猕猴桃褐斑病菌;h:梨轮纹病菌;i:芝麻茎点枯病菌;j:猕猴桃果腐病菌;k:山药青霉病菌,其中,在每张照片中,左皿为处理,右皿为对照;
19.图8所示为暹罗芽孢杆菌jy
‑
1菌株对植物病原细菌抑菌谱试验,a:柑橘溃疡病菌;b:芝麻青枯病;c:水稻白叶枯病菌;d:水稻细菌性条斑病菌;其中,在每张照片中,左皿为处理,右皿为对照。
具体实施方式
20.以下将结合实施例和附图对本发明的构思及产生的技术效果进行清楚、完整的描述,以充分地理解本发明的目的、方案和效果。
21.其中,以下实施例中所用的菌种培养基如下:
22.牛肉膏蛋白胨培养基na(g/l):牛肉膏3g,蛋白胨10g,nacl 5g,琼脂条20g,蒸馏水1000ml,ph 7.0~7.2,121℃灭菌20min。
23.营养肉汤培养基nb(g/l):不加琼脂条的na培养基,121℃灭菌20min。
24.pda固体培养基(g/l):马铃薯200g,葡萄糖20g,琼脂20g,蒸馏水1000ml,ph7.0~7.2,121℃灭菌20min。
25.实施例1:
26.暹罗芽孢杆菌jy
‑
1的获得:
27.1、土壤来源
28.中国江西省宜春市奉新县山口猕猴桃基地的健康猕猴桃植株根际土壤。
29.2、菌株的筛选
30.(1)土壤采集
31.随机采样法进行土样采集。随机从不同采集点,分别取离地表5~10cm处约50g土样,装入自封袋中,4℃冰箱中保存,以备细菌分离所用。
32.(2)细菌的分离
33.平板梯度稀释分离法:用电子天平称取5g土壤样品加入已灭菌的盛有45ml生理盐水的三角瓶中(瓶中装有若干直径为3mm的磨砂玻璃珠),经振荡混匀,静置20~30min。无菌条件下取5ml悬浮液加入已灭菌的空试管中,90℃水浴10min,随后取1ml该液体加入至装有9ml种子培养液的试管中,在37℃恒温下富集培养36h。按梯度稀释法,分别取富集菌液稀释成5个梯度,即将0.5ml菌液加入到试管(装有4.5ml种子培养基)中,轻轻摇匀,依次重复操作,稀释到105倍。然后分别吸取梯度为10
‑3、10
‑4和10
‑5混合液200μl加入到选择性培养基平板上,使用涂布棒进行均匀涂布。每个试验3次重复,37℃恒温培养1d。
34.(3)细菌纯化
35.用灭菌的牙签从分离的平板中挑取形态、颜色和大小等不同特征的单菌落中部分菌体,在na培养基上划线纯化,37℃恒温培养1
‑
2d。
36.(4)细菌的保存
37.从纯化的平板中,初步根据菌落的颜色、形状、透明度和质地等特征,挑选出属于
芽孢杆菌属的纯菌株,用接种环依次接种到na斜面培养基上,依次进行编号,37℃恒温培养1
‑
2d,放在4℃冰箱保存备用。
38.(5)拮抗菌的筛选
39.采用打孔法和平板对峙法筛选对指示菌具有拮抗效果的菌株,制备pda培养基平板,用5mm打孔器在距平板中心3cm四周等距离处打孔。用接种针挑取猕猴桃果腐病病原菌菌饼接到平板中央,用移液枪分别吸取发酵液100μl加入4个孔中,以nb培养液作为对照,每个处理3个重复,接种后置于28℃恒温培养3d,用十字交叉法测量菌落直径(对角线上两抑菌圈之间菌落直线距离),并计算抑菌率。
40.通过上述筛选过程得到了菌株jy
‑
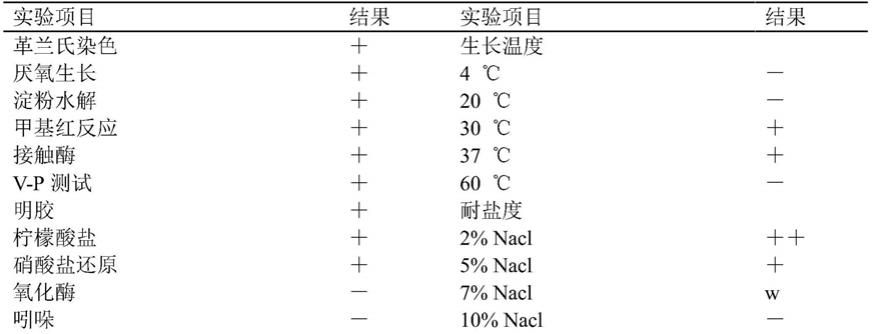
1,该菌株在牛肉膏蛋白胨(na)平板上,其菌落形态如图1所示,单个菌落初期呈圆形稍微隆起,表面有光泽,乳白色不透明;培养后期菌落呈奶白色不透明不规则圆形,边缘呈锯齿状,四周隆起,表面有皱褶。菌体呈杆状,长约1.0~2.5μm,宽约0.5~1.0μm,产芽孢。革兰氏染色呈阳性(其结果如图2所示,其中,a为革兰氏染色,b为芽孢染色)。能在30℃
‑
37℃的温度下生长;其生长ph范围为5
‑
7;耐盐度范围为2%
‑
7%nacl;厌氧生长;淀粉水解试验、甲基红反应试验、接触酶试验、v.p.试验、明胶试验、柠檬酸盐试验、硝酸盐还原试验呈阳性;氧化酶试验、吲哚试验、色氨酸脱氨酶试验、苯丙氨酸脱氨酶试验、脲酶试验呈阴性。能够利用葡萄糖、麦芽糖、蔗糖、d
‑
木糖、淀粉、阿拉伯糖;不能利用α
‑
乳糖。能利用肌醇、甘露醇、山梨醇;不能利用甜醇。
41.提取菌株jy
‑
1的基因组dna,利用引物:27f(5
’‑
agagtttgatcmtggctca
‑3’
)和1492r(5
’‑
tacggytaccttgttacgactt
‑3’
)对菌株jy
‑
1进行16s rdna序列扩增,委托由上海生工合成引物。反应总体系(50μl)为:dna模板2μl、2
×
taq pcr master mix25μl、ddh2o21μl、各引物1μl。pcr扩增反应程序:预变性95℃,5min;变性94℃,30s,退火55℃,30s,延伸72℃,2min,共35个循环;补平72℃,7min。随后,将获得的pcr扩增物在1%琼脂糖凝胶电泳中测定结果。采纳北京天根琼脂糖凝胶dna回收盒的方法,对上述扩增产物进一步割胶回收。将符合要求的纯化产物送至生工生物工程(上海)股份有限公司完成序列测定。根据《常见的细菌系统鉴定手册》和《简明第八版伯杰判定手册》中介绍的标准、种属分类特征及测定方法对菌株jy
‑
1进行生理生化实验。
42.结果显示:结合菌株jy
‑
1的形态学、16s rdna序列分析和生理生化(如表1所示)等特征与该菌株相近种进行比较,将序列递交至ncbi中,获得登录号(ky807041)。将此序列与genbank数据库中已提交的序列结果经同源性比对,发现菌株jy
‑
1与暹罗芽孢杆菌(bacillus siamensis)kctc 13613(登录号为ky643639)的同源性最高,高达100%。最终将该菌鉴定为暹罗芽孢杆菌。为了更好区分该菌株分类地位,在数据库中选取有关芽孢杆菌属相关基因序列,构建系统发育树(如图3所示)。
43.表1菌株jy
‑
1生理生化特征
[0044][0045][0046]
注:“ ”表示阳性反应,“-”表示阴性反应,“w”表示微弱反应。
[0047]
实施例2:
[0048]
将实施例1筛选得到的暹罗芽孢杆菌jy
‑
1在nb培养液(培养液组成为:2%蔗糖,0.3%酵母膏,3%蛋白胨,0.5%nacl,0.09%mgso4·
7h2o)中培养,培养液温度为30℃,ph 7.0、装液量50m l、接种量1%、转速220r/min、时间72h,调节至浓度为1
×
108cfu/ml,即制得本发明的暹罗芽孢杆菌jy
‑
1微生物菌剂(发酵原液)。
[0049]
实施例3:
[0050]
1)暹罗芽孢杆菌jy
‑
1对11种病原真菌的拮抗活性测定
[0051]
将保存的葡萄白腐病菌、葡萄苦腐病菌、山药炭疽病菌、辣椒疫病菌、水稻稻瘟病菌、莲腐败病菌、猕猴桃褐斑病菌、梨轮纹病菌、芝麻茎点枯病菌、猕猴桃果腐病菌及山药青霉病菌共11株病原真菌接种在pda平板上,在25℃的恒定温度下,至菌落长满平板2/3处待用。将jy
‑
1菌株划线活化至na培养基上,于30℃烘箱中培养2d待用。采用平板对峙法,在无菌操作台上,制备好pda平板,在培养基中心接种9种不同的病原真菌菌饼,在距离中间2.5cm出用无菌的牙签点接jy
‑
1菌体,置于28℃恒温箱中培养,分别以不接拮抗菌株为对照,试验设3次重复。待对照组菌丝长满整皿的2/3处时,采用十字交叉法测定病菌菌丝直径,并拍照记录数据。其结果如表2和图7所示。
[0052]
表2拮抗jy
‑
1菌株对11种病原真菌的抑制作用
[0053][0054][0055]
注:表中数据为抑菌率
±
标准差,大小写字母分别代表p 0.01(p 0.05)差异显著水平。
[0056]
2)暹罗芽孢杆菌jy
‑
1对4种病原细菌的拮抗活性测定
[0057]
将供试病原细菌活化,在na平板上划线,放在30℃恒温箱中培养1
‑
2d待用。
[0058]
采用滤纸片法,挑取少量活化好的病原细菌,在无菌工作台上,用无菌水分别稀释至106cfu/ml,取100μl均匀涂布在na培养基平板上,在距离中间2.5cm处放置4片已灭菌的6mm滤纸片,晾干后,在滴加10μl 108cfu/ml拮抗jy
‑
1菌株稀释液,将平板置于30℃培养箱中培养1~2d,每个试验3次重复。依据十字交叉的原理测定抑菌圈的宽度,拍照并计算抑菌率。其结果如表3和图8所示。
[0059]
表3拮抗jy
‑
1菌株对4种病原细菌的抑制作用
[0060][0061]
3)暹罗芽孢杆菌jy
‑
1活性代谢产物稳定性测定
[0062]
酸碱稳定性:将暹罗芽孢杆菌jy
‑
1菌株的发酵原液,在4℃、8000r/min下离心30min,取得上清液,将除菌上清液分别用0.1mol/l hcl和0.1mol/l naoh调成不同ph值(2、4、6、8、10),在室温放置24h,期间不断上下振荡数次,在将其调回至ph为7,设置未经调整的上清液为对照,根据十字交叉测定病原菌直径。其结果如图4所示,对菌株jy
‑
1发酵滤液的酸碱稳定性测定结果表明,未进行酸碱处理的(ph为7.0)抑菌效果最佳,菌落直径仅为24.00mm,当ph为6.0和8.0时,活性代谢产物逐渐降低,菌落直径分别为26.33mm和26.00mm。经强酸强碱处理的抑菌活性显著降低,即当ph为2.0时,菌落直径高达33.67mm,当ph为10.0时,菌落直径为30.33mm。说明该菌株活性代谢产物不耐强酸强碱,适宜的ph为6.0~8。
[0063]
热稳定性:取除菌上清液2ml于无菌的离心管中,分别在恒温水浴锅中设置40、60、80和100℃,各水浴处理30min和60min,以室温处理为对照,采用十字交叉法测量病原菌直径。对jy
‑
1菌株产生抑菌活性产物的热稳定性试验结果表明,不同的温度和处理时间对该菌株抑菌作用具有不同的效果。其结果如图5所示,当温度为40℃时,抑菌效果最佳,0.5h和
1h时间处理下菌落直径仅为24.33mm和23.00mm,可见抑菌效果高于室温处理。当温度为60℃和80℃,随着处理时间的增加,抑菌活性逐渐降低,但相比室温处理差异不大,当温度达到100℃处理0.5h时,抑菌活性较常温处理下降。说明该菌株活性代谢产物较耐高温,最适合温度为40℃。
[0064]
紫外线稳定性:取除菌上清液2ml于培养皿中,培养皿打开盖子放置在无菌工作台上,距离紫外灯30cm处,分别照射5、15、25、35、45和60min,设置无紫外线处理的上清液为对照,依据十字交叉法测量病原菌直径。其结果如图6所示,经不同紫外线照射时间处理,菌株jy
‑
1的代谢产物抑菌活性几乎不变,各处理间抑菌效果差异不明显。当紫外线处理时间为5~35min之间,代谢产物抑菌活性呈现下降趋势,照射时间为45min时,代谢产物抑菌活性有所缓和,之后趋于平稳,与不经紫外线照射处理对比,各处理间菌丝生长直径变化差异仅为1mm左右。结果表明该菌株具有拮抗效果的活性物质对紫外线的照射时长不敏感。
[0065]
实施例4:
[0066]
暹罗芽孢杆菌jy
‑
1的不同处理液对离体猕猴桃果实的室内防治果腐病效果:
[0067]
挑选猕猴桃果实成熟度一致、大小均匀的健康果实,在自来水下冲洗干净,再分别放入2%的naclo溶液中泡2min,取出后用自来水洗去残余的naclo溶液,晾干待用。将jy
‑
1菌株分别用优化前nb培养液(0.3%牛肉膏,1%蛋白胨,0.5%nacl)以及优化后nb培养液(2%蔗糖,0.3%酵母膏,3%蛋白胨,0.5%nacl,0.09%mgso4·
7h2o)进行发酵培养,将发酵液配制成发酵原液(浓度为1
×
108cfu/ml)、菌悬液(将培养原液离心后弃上清液,经无菌水冲洗2次,浓度为1
×
108cfu/ml)和除菌滤液(将上清液经0.22μm微孔滤膜过滤除菌)3种处理液,设置阳性对照(无菌水 病原菌菌饼)。将处理好的果实用灭菌的刀片在果实中间打一个洞(5mm
×
5mm),晾干,分别用移液枪加入上述3个处理液和无菌水各50μl。晾干后,用灭菌的接种针分别接猕猴桃果腐病病原菌菌饼(直径为5mm),盖上经无菌水湿润的灭菌棉花,果实摆在磁盘里,用保鲜膜封口,置于95%湿度、28℃恒温箱中,待第3和6d测定病斑直径,并计算防治效果,每个处理10个果实,3次重复试验。其结果如表4所示。可知优化后的3种不同处理液的防治效果均明显增加,其中过滤液对猕猴桃果腐病防治效果最佳,接种3d防治效果高达92.21%,较优化前防治效果增加了24.34%。菌悬液的防治效果最差,优化前无效果,优化后接种3d和6d防治效果分别为47.54%和32.99%。说明jy
‑
1菌株的活性代谢产物对该病原菌防病效果最好,发酵原液次之。
[0068]
表4菌株jy
‑
1不同处理液对离体猕猴桃果实果腐病的防治效果
[0069][0070][0071]
注:s代表发病面积;c代表防治效果。
[0072]
实施例5:
[0073]
暹罗芽孢杆菌jy
‑
1的不同处理液对山药青霉病菌的孢子萌发抑制
[0074]
用无菌水将在pda上培养7d的病原霉菌刮下,转入中含玻璃珠的锥形瓶中,振荡使其分散均匀,4层无菌纱布过滤,除去菌丝,而后用血球计数板计数,并稀释至5
×
106spores/ml,待用。配制7种处理液,将菌株jy
‑
1发酵液配制成发酵原液(浓度为1
×
108cfu/ml)、三种浓度菌悬液(浓度分别为1
×
106、1
×
107、1
×
108cfu/ml)、除菌滤液、热杀死液(原液在121℃下高压灭菌20min)以及无菌水(蒸馏水在121℃下高压灭菌20min)。采用玻片萌发法,在无菌载玻片表面滴下20μl混合液滴(14μlpdb、4μl孢子悬浮液、2μl处理液)置于培养皿内保湿,置于25℃恒温培养箱中,每个处理三个重复,每隔四小时观察一次孢子的出芽情况,当芽管长度大于或等于孢子直径时,认为孢子萌发,测定并计算病原菌孢子的出芽率及芽管长度。其结果如表5所示,可知菌悬液(1
×
108)及菌原液对山药干腐病孢子萌发抑制效果最佳,萌发率分别为0.64%和2.02%。其次为无菌滤液,萌发率为4.05%。菌悬液(1
×
106)的防治效果最差,萌发率为38.55%。说明jy
‑
1菌株的菌悬液(1
×
108)、菌原液以及无菌滤液对该病原菌防病均有较好的效果。
[0075]
表5生防菌对山药干腐病菌的孢子萌发抑制作用
[0076][0077]
以上所述,只是本发明的较佳实施例而已,本发明并不局限于上述实施方式,只要其以相同的手段达到本发明的技术效果,都应属于本发明的保护范围。在本发明的保护范围内其技术方案和/或实施方式可以有各种不同的修改和变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。