1.本发明属于生物医药技术领域,具体涉及一种可预防仔猪腹泻的多联融合重组蛋白构建方法与表达体系及应用。
背景技术:
2.仔猪腹泻是集约化养猪生产条件下的一种典型的高发疾病。该病是目前最严重的仔猪疾病群之一,也是引起仔猪死亡的重要原因。据调查,仔猪因腹泻死亡可占到仔猪死亡总数的39.8%。因此,如何采取有效的措施预防和控制仔猪腹泻、提高仔猪成活率已成为养猪业生产的一项重要课题。
3.经研究发现,引起仔猪腹泻发生的主要病因之一是传染性细菌性腹泻,仔猪大肠杆菌病是由致病性大肠杆菌引起的一类传染病,其中产肠毒素大肠杆菌(enterotoxingenic escherichia coli,etec)是引起仔猪腹泻的重要病原菌;此外,由魏氏梭菌引起仔猪红痢也是仔猪腹泻的重要传染性细菌性腹泻,但是目前并没有一种可同时防控多种引发仔猪腹泻的病原菌的疫苗。
技术实现要素:
4.有鉴于此,本发明的目的在于一种可预防仔猪腹泻的多联融合重组蛋白构建方法与表达体系及应用,免疫性良好,特异性强,为预防仔猪腹泻提供有效的疫苗保护。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种多联融合重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp,所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的氨基酸序列如seq id no.1所示。
7.优选的,编码所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的核苷酸序列如seq id no.2所示。
8.本发明还提供了上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的编码基因的构建方法,包括以下步骤:利用soe
‑
pcr的方法,将源自产肠毒素大肠杆菌的耐热肠毒素基因的部分功能区、源自产肠毒素大肠杆菌的不耐热肠毒素基因的部分功能区、源自魏氏梭菌的α毒素基因的部分功能区和源自魏氏梭菌的β1毒素基因的部分功能区进行串联,得所述编码基因。
9.优选的,所述源自产肠毒素大肠杆菌的不耐热肠毒素基因的部分功能区包括:ltⅰa、ltⅰb、ltⅱaa、ltⅱab、ltⅱca和ltⅱcb;所述ltⅰa的cds序列如seq id no.2的1
‑
258bp所示,所述ltⅰb的cds序列如seq id no.2的259
‑
381bp所示,所述ltⅱaa的cds序列如seq id no.2的382
‑
627bp所示,所述ltⅱab的cds序列如seq id no.2的628
‑
753bp所示,所述ltⅱca的cds序列如seq id no.2的754
‑
846bp所示,所述ltⅱcb的cds序列如seq id no.2的847
‑
927bp所示;
10.所述源自产肠毒素大肠杆菌的耐热肠毒素基因的部分功能区包括:st a和st b;所述st a的cds序列如seq id no.2的928
‑
1044bp所示,所述st b的cds序列如seq id no.2的1045
‑
1143bp所示;
11.所述源自魏氏梭菌的α毒素基因的部分功能区包括cpα;所述cpα的cds序列如seq id no.2的1144
‑
1266bp所示;
12.所述源自魏氏梭菌的β1毒素基因的部分功能区包括cpβ;所述cpβ的cds序列如seq id no.2的1267
‑
1524bp所示。
13.本发明还提供了上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的重组表达体系。
14.优选的,所述重组表达体系包括真核表达体系或原核表达体系。
15.本发明还提供了表达上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的重组表达载体,所述重组表达载体的基础表达载体包括pet
‑
28a,将编码所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的核苷酸序列插入pet
‑
28a的nco i和xho i酶切位点之间。
16.本发明还提供了上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的诱导表达方法,包括以下步骤:将上述重组表达载体转入大肠杆菌感受态细胞e.coli dh5α中,提取质粒后转化大肠杆菌感受态细胞e.coli bl21(de3),利用iptg诱导,得所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp。
17.本发明还提供了上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp或利用上述诱导表达方法得到的重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp在制备仔猪腹泻多联疫苗中的应用。
18.本发明还提供了一种仔猪腹泻多联亚单位基因工程疫苗,所述疫苗包括上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp或利用上述诱导表达方法得到的重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp和免疫佐剂。
19.有益效果:本发明通过克隆etec的耐热肠毒素和不耐热肠毒素基因,以及魏氏梭菌α毒素和β1毒素基因,利用soe
‑
pcr的方法将部分基因的功能区进行串联,扩增出lt
ⅰ‑
lt
ⅱ‑
st
‑
cp重组序列,并成功构建表达载体pet
‑
28a
‑
lt
ⅰ‑
lt
ⅱ‑
st
‑
cp,利用大肠杆菌原核表达系统,成功表达重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp。通过动物实验分析验证其生物学活性,证实所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp每段的特异性良好,免疫小鼠后无毒性,抗体效价较高,抗血清对etec天然肠毒素蛋白和魏氏梭菌天然α和β1毒素的特异性良好,免疫效力检测实验显示所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp对于腹泻有很好的保护效果。本发明还利用蛋白变性技术灭活基因工程毒素的毒性,保留其与天然毒素相似的免疫原性,辅以适当的免疫佐剂,制备仔猪腹泻多联重组基因工程疫苗,该疫苗对仔猪红痢和仔猪黄痢的保护率可到达80%以上,效果良好,有很强的保护力。
附图说明
20.图1为lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的目的基因pcr扩增结果,其中泳道1表示dl 2000dna marker;泳道2表示lt
ⅰ‑
lt
ⅱ‑
st
‑
cp目的片段;
21.图2为lt
ⅰ‑
lt
ⅱ‑
st
‑
cp重组蛋白的sds
‑
page表达分析;其中泳道1表示标准蛋白分子量;泳道2表示未加诱导剂的阴性对照;泳道3~6表示加入iptg后,培养8h;
22.图3为重组蛋白的纯化;其中泳道1表示标准蛋白分子量;泳道2表示lt
ⅰ‑
lt
ⅱ‑
st
‑
cp重组蛋白未诱导;泳道3表示lt
ⅰ‑
lt
ⅱ‑
st
‑
cp重组蛋白诱导8h;泳道4表示纯化的lt
ⅰ‑
lt
ⅱ‑
st
‑
cp重组蛋白;
23.图4为重组蛋白的特异性验证,图中1为抗ltⅰa抗体验证;2为抗ltⅰb抗体验证;3为抗ltⅱaa抗体验证;4为抗ltⅱab抗体验证;5为抗ltⅱca抗体验证;6为抗ltⅱcb抗体验证;7为抗st a抗体验证;8为抗st b抗体验证;9为抗cpα抗体验证;10为抗cpβ1抗体验证;
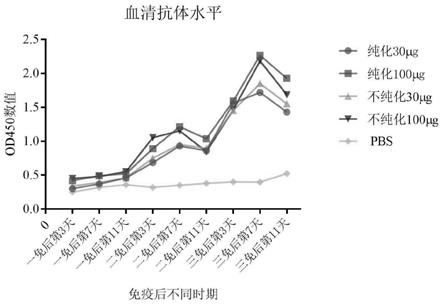
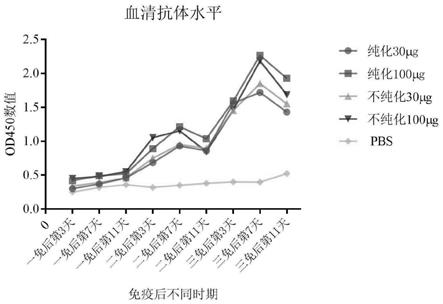
24.图5为免疫后不同时期血清抗体变化水平;
25.图6为etec验证抗血清特异性;
26.图7为魏氏梭菌验证抗血清特异性。
具体实施方式
27.本发明提供了一种多联融合重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp,所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的氨基酸序列如seq id no.1所示。
28.本发明编码所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的核苷酸序列优选如seq id no.2所示。
29.本发明还提供了上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的编码基因的构建方法,包括以下步骤:利用soe
‑
pcr的方法,将源自产肠毒素大肠杆菌的耐热肠毒素基因的部分功能区、源自产肠毒素大肠杆菌的不耐热肠毒素基因的部分功能区、源自魏氏梭菌的α毒素基因的部分功能区和源自魏氏梭菌的β1毒素基因的部分功能区进行串联,得所述编码基因。
30.本发明所述源自产肠毒素大肠杆菌的不耐热肠毒素基因的部分功能区优选包括:ltⅰa、ltⅰb、ltⅱaa、ltⅱab、ltⅱca和ltⅱcb;所述源自产肠毒素大肠杆菌的耐热肠毒素基因的部分功能区优选包括:st a和st b;所述源自魏氏梭菌的α毒素基因的部分功能区优选包括cpα;所述源自魏氏梭菌的β1毒素基因的部分功能区优选包括cpβ。
31.本发明所述ltⅰa的cds序列优选为登录号为baa25725.1的基因的cds序列的373~630bp,所述ltⅰa的cds序列优选如seq id no.21
‑
258bp所示,对应氨基酸序列优选如seq id no.11
‑
86aa所示。
32.本发明所述ltⅰb的cds序列优选为登录号为baa25726.1的基因的cds序列的223~346bp,所述述ltⅰb的cds序列优选如seq id no.2259
‑
381bp所示,对应氨基酸序列优选如seq id no.187
‑
127aa所示。
33.本发明所述ltⅱaa的cds序列优选为登录号为wp_095374651.1的基因的cds序列的544~789bp,所述ltⅱaa的cds序列优选如seq id no.2382
‑
627bp所示,对应氨基酸序列优选如seq id no.1128
‑
209aa所示。
34.本发明所述ltⅱab的cds序列优选为登录号为wp_095389218.1的基因的cds序列的214~339bp,所述ltⅱab的cds序列优选如seq id no.2628
‑
753bp所示,对应氨基酸序列优选如seq id no.1210
‑
251aa所示。
35.本发明所述ltⅱca的cds序列优选为登录号为alo79807.1的基因的cds序列的58~150bp,所述ltⅱca的cds序列优选如seq id no.2754
‑
846bp所示,对应的氨基酸序列优选如seq id no.1252
‑
282aa所示。
36.本发明所述ltⅱcb的cds序列优选为登录号为alo79813.1的基因的cds序列的190~270bp,所述ltⅱcb的cds序列优选如seq id no.2847
‑
927bp所示,对应的氨基酸序列优选如seq id no.1283
‑
309aa所示。
37.本发明所述st a的cds序列优选为登录号为cad87828.1的基因的cds序列的58~174bp,所述st a的cds序列优选如seq id no.2928
‑
1044bp所示,对应的氨基酸序列优选如seq id no.1310
‑
348aa所示。
38.本发明所述st b的cds序列优选为登录号为cad87835.1的基因的cds序列的70~
168bp,所述st b的cds序列优选如seq id no.21045
‑
1143bp所示,对应的氨基酸序列优选如seq id no.1349
‑
381aa所示。
39.本发明所述cpα的cds序列优选为登录号为aqn80672.1的基因的cds序列的148~270bp,所述cpα的cds序列优选如seq id no.21144
‑
1266bp所示,对应的氨基酸序列优选如seq id no.1382
‑
422aa所示。
40.本发明所述cpβ优选为登录号为aji77135.1基因的cds序列的94~351bp,所述cpβ的cds序列优选如seq id no.21267
‑
1524bp所示,对应的氨基酸序列优选如seq id no.1423
‑
508aa所示。
41.本发明在进行所述soe
‑
pcr时,基于上述序列设计表1所示的引物:
42.表1soe
‑
pcr所用引物信息
43.[0044][0045]
本发明在进行所述soe
‑
pcr时,优选先利用引物ltⅰa1和ltⅰa2扩增ltⅰa目的片段,利引物ltⅰb1和ltⅰb2扩增ltⅰb目的片段,再利用引物ltⅰa1和ltⅰb2扩增目的片段ltⅰ;利用引物ltⅰa 1和ltⅰ再扩增片段ltⅰ本发明在扩增ltⅰa目的片段和ltⅰb目的片段时,采用相同的体系和程序:所述体系以20μl计,优选包括:上游引物0.5μl、下游引物0.5μl、产肠毒素大肠杆菌基因组1μl、x5 high
‑
fidelity dnapolymerase pcrmix(2
×
)10μl和h2o 8μl;所述扩增的程序优选包括95℃3min;95℃30s,63℃30s,72℃1min,35个循环;72℃5min。
[0046]
本发明利用引物ltⅰa1和ltⅰb2扩增目的片段ltⅰ时,soe
‑
pcr扩增体系以20μl计,包括:上游引物(ltⅰa1)0.5μl、下游引物(ltⅰb2)0.5μl、片段ltⅰa和ltⅰb各1μl、x5 high
‑
fidelity dnapolymerase pcr mix(2
×
)10μl和h2o 7μl;所述soe
‑
pcr扩增的程序包括:95℃3min;95℃30s,63℃30s,72℃1min,35个循环;72℃8min。
[0047]
本发明利用引物ltⅰa1和ltⅰ扩增目的片段ltⅰ时,soe
‑
pcr扩增体系以20μl计,包
bl21(de3),利用iptg诱导,得所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp。
[0055]
本发明对所述转入的方法并没有特殊限定,利用本发明的常规转入方法即可。本发明将重组表达载体转入大肠杆菌细胞的重组菌接种到液体lb培养基中,37℃培养2h,再加入iptg,使其终浓度为1mmol/l,诱导8h。
[0056]
本发明在所述诱导后,优选利用包涵体纯化的方法对重组蛋白进行纯化,纯化后蛋白浓度可为5mg/ml。
[0057]
本发明所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp每段的特异性良好,在免疫小鼠后无毒性,抗体效价较高,抗血清对etec天然肠毒素蛋白和魏氏梭菌天然α和β毒素的特异性良好,对于仔猪腹泻有很好的保护效果,100μg免疫效果良好,因此可用于制备仔猪腹泻多联疫苗。
[0058]
本发明还提供了上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp或利用上述诱导表达方法得到的重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp在制备仔猪腹泻多联疫苗中的应用。
[0059]
本发明还提供了一种仔猪腹泻多联亚单位基因工程疫苗,所述疫苗包括上述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp或利用上述诱导表达方法得到的重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp和免疫佐剂。
[0060]
本发明所述免疫佐剂优选包括氢氧化铝溶胶佐剂。本发明所述疫苗中所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的浓度优选为1μg/μl,且所述重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp与免疫佐剂的体积比优选为1:1。本发明对所述疫苗的制备方法并没有特殊限定,利用本领域的常规疫苗制备方法即可。
[0061]
本发明所述疫苗对仔猪红痢和仔猪黄痢的保护率可到达80%以上,效果良好,有很强的保护力。
[0062]
下面结合实施例对本发明提供的一种可预防仔猪腹泻的多联融合重组蛋白构建方法与表达体系及应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0063]
本发明实施例均采用graphpad prism7统计软件对各组实验结果进行单向anova分析,采用平均数
±
标准差(mean
±
sd)表示。*p<0.05为差异显著,**p<0.01为差异极显著,p>0.05为差异不显著。
[0064]
实施例1
[0065]
1、在ncbi查找大肠杆菌不耐热肠毒素ltⅰa的氨基酸序列(baa25725.1)和ltⅰb的序列(baa25726.1)、ltⅱaa(wp_095374651.1)和ltⅱab(wp_095389218.1)、ltⅱca(alo79807.1)和ltⅱcb(alo79813.1),耐热肠毒素st a(cad87828.1)和st b(cad87835.1)以及魏氏梭菌的α毒素(aqn80672.1)和β毒素(aji77135.1)的相关信息,通过dnastar对其分别进行抗原性分析。
[0066]
根据产肠毒素大肠杆菌ltⅰa、ltⅰb、ltⅱca、ltⅱcb、st a、st b、魏氏梭菌的α毒素和β毒素的氨基酸序列利用dna star预测其抗原性,选取抗原性较强的区域。
[0067]
通过对蛋白质结构预测分析选取ltⅰa的第125
‑
210位氨基酸残基,ltⅰb的第74~115位氨基酸残基,ltⅱaa的第182~263位氨基酸残基,ltⅱab的第72~113位氨基酸残基,ltⅱca的第20~50位氨基酸残基处,ltⅱcb的第64~90位氨基酸残基处,st a的第20~58位氨基酸残基处,st b的第24~56位氨基酸残基处,魏氏梭菌α毒素的第50~90位氨基酸残基处,魏氏梭菌β毒素的第32~117位氨基酸残基处。
[0068]
2、基于上述残基设计表1的引物对,并委托生物工程公司合成。
[0069]
3、用基因组提取试剂盒(天根生化)提取产肠毒素大肠杆菌和魏氏梭菌的基因组。
[0070]
4、soe
‑
pcr连接lt、st和魏氏梭菌α毒素和β毒素
[0071]
1)利用引物ltⅰa1和ltⅰa2扩增ltⅰa目的片段,利用ltⅰb1和ltⅰb2扩增ltⅰb目的片段,再利用引物ltⅰa1和ltⅰb2连接目的片段ltⅰ,再利用引物ltⅰa1和ltⅰ扩增目的片段ltⅰ。
[0072]
扩增ltⅰa目的片段和ltⅰb目的片段时,体系和程序相同:
[0073]
20μl体系:上游引物0.5μl、下游引物0.5μl、产肠毒素大肠杆菌基因组1μl、x5 high
‑
fidelity dna polymerase pcr mix(2
×
)10μl和h2o 8μl;
[0074]
扩增程序:95℃3min;95℃30s,63℃30s,72℃1min,35个循环;72℃5min。
[0075]
配制20μl soe
‑
pcr体系,利用引物ltⅰ1和ltⅰb2扩增目的片段ltⅰ:上游引物(ltⅰa1)0.5μl、下游引物(ltⅰb2)0.5μl、ltⅰa和ltⅰb各1μl、x5 high
‑
fidelity dna polymerase pcr mix(2
×
)10μl和h2o 7μl;程序为:95℃3min;95℃30s,63℃30s,72℃1min,35个循环;72℃8min。
[0076]
配制20μl soe
‑
pcr体系,利用引物ltⅰa1和ltⅰ扩增目的片段ltⅰ,:上游引物(ltⅰa1)0.5μl、下游引物(ltⅰ)0.5μl、目的片段ltⅰ1μl、x5 high
‑
fidelity dna polymerase pcr mix(2
×
)10μl和h2o 8μl;所述soe
‑
pcr扩增的程序包括:95℃3min;95℃30s,63℃30s,72℃1min,35个循环;72℃8min。
[0077]
2)本发明利用与上述相同的体系和程序,利用引物ltⅱaa1和ltⅱaa2,通过soe
‑
pcr扩增出ltⅱaa片段,引物ltⅰa1和ltⅱaa2,将片段ltⅰ和ltⅱa a连接成lt
ⅰ‑
ltⅱaa,再用引物ltⅰa1和lti
‑
ltiiaa扩增片段lt
ⅰ‑
ltⅱaa;引物ltⅱab1和ltⅱab2扩增出ltⅱab,引物ltⅰa1和ltⅱab2将片段lt
ⅰ‑
ltⅱaa和ltⅱab连接成lt
ⅰ‑
ltⅱaa
‑
ltⅱab(lt
ⅰ‑
ltⅱa),再利用引物ltⅰa1和lti
‑
liia扩增片段lt
ⅰ‑
ltⅱa;引物ltⅱca1和ltⅱca2扩增出ltⅱca,引物ltⅰa1和ltⅱca2将片段lt
ⅰ‑
ltⅱa和ltⅱca连接成lt
ⅰ‑
ltⅱa
‑
ltⅱca,再利用引物ltⅰa1和lti
‑
ltiia
‑
ltiica扩增片段lt
ⅰ‑
ltⅱa
‑
ltⅱca;引物ltⅱcb1和ltⅱcb2扩增出片段ltⅱcb,引物ltⅰa1和ltⅱcb2将片段lt
ⅰ‑
ltⅱa
‑
ltⅱca和ltⅱcb连接成lt
ⅰ‑
ltⅱa
‑
ltⅱca
‑
ltⅱcb(lt
ⅰ‑
ltⅱ),再利用引物ltⅰa1和lti
‑
ltii扩增片段lt
ⅰ‑
ltⅱ;引物sta1和sta2扩增出片段st a,引物ltⅰa1和sta2将片段lt
ⅰ‑
ltⅱ和st a连接成lt
ⅰ‑
lt
ⅱ‑
st a,再利用引物ltⅰa1和lti
‑
ltii
‑
sta扩增片段lt
ⅰ‑
lt
ⅱ‑
st a;引物stb1和stb2扩增出片段st b,引物ltⅰa1和stb2将片段lt
ⅰ‑
lt
ⅱ‑
st a和st b连接成lt
ⅰ‑
lt
ⅱ‑
st a
‑
st b(lt
ⅰ‑
lt
ⅱ‑
st),再利用引物ltⅰa1和lti
‑
lii
‑
st扩增片段lt
ⅰ‑
lt
ⅱ‑
st;引物cpα1和cpα2扩增片段cpα,引物ltⅰa1和cpα2将片段lt
ⅰ‑
lt
ⅱ‑
st和cpα连接成lt
ⅰ‑
lt
ⅱ‑
st
‑
cpα,再利用引物ltⅰa1和lti
‑
ltii
‑
st
‑
cpα扩增片段lt
ⅰ‑
lt
ⅱ‑
st
‑
cpα;引物cpβ1和cpβ2扩增出片段cpβ,引物ltⅰa1和cpβ2将片段lt
ⅰ‑
lt
ⅱ‑
st
‑
cpα和cpβ连接成lt
ⅰ‑
lt
ⅱ‑
st
‑
cpα
‑
cpβ(lt
ⅰ‑
lt
ⅱ‑
st
‑
cp)。(图1)。
[0078]
3)将1524bp的扩增产物1μl,用ddh2o稀释50倍,用带酶切位点的引物ltⅰa和cpβ进行扩增,扩增体系(20μl):上游引物(ltⅰa)1μl、下游引物(cpβ)1μl、稀释后的lt
ⅰ‑
lt
ⅱ‑
st
‑
cp 1μl、2
×
es taq mastermix(dye)10μl和水8μl。
[0079]
扩增程序:95℃3min;95℃30s,64℃30s,72℃1min,35个循环;72℃8min。
[0080]
将pcr产物用1%的琼脂糖凝胶进行电泳,90v 40min,用凝胶成像系统验证条带大小正确后,用小刀切下目的条带,按照琼脂糖凝胶回收试剂盒(天根生化)说明书操作,对目
的片段进行回收。
[0081]
5、克隆载体的构建
[0082]
1)、将pcr验证并回收的目的片段连接到pmd
‑
18t载体上;
[0083]
2)连接产物与大肠杆菌e.coli.dh5α感受态细胞混合,在冰上静置30min;
[0084]
3)立即转入42℃热激90s,然后马上放冰上冷激10min;
[0085]
4)再加入400μl无抗性的lb液体培养基,37℃摇床中培养90min;
[0086]
5)取100μl 4)中的菌液涂布于含氨苄青霉素的lb固体平板中,37℃恒温培养8h;
[0087]
6)挑取单克隆菌株,接种于含氨苄青霉素的lb液体培养基中,37℃恒温培养8h,测序;
[0088]
7)将测序正确的菌株冻存,并提取质粒。
[0089]
6、表达质粒的构建
[0090]
1)重组质粒pmd
‑
18t
‑
lt
ⅰ‑
lt
ⅱ‑
st
‑
cp和空载体pet
‑
28a分别进行双酶切,酶切体系30μl:重组质粒/空载体24.0μl、nco i 1.5μl、xho i 1.5μl和10
×
kbuffer 3.0μl;37℃条件下作用6h;
[0091]
2)将双酶切产物进行1%琼脂糖凝胶电泳,对lt
ⅰ‑
lt
ⅱ‑
st
‑
cp目的片段和pet
‑
28a进行胶回收;
[0092]
3)将2)中所得到的酶切后胶回收的lt
ⅰ‑
lt
ⅱ‑
st
‑
cp目的片段和pet
‑
28a载体片段连接,构建pet
‑
28a
‑
lt
ⅰ‑
lt
ⅱ‑
st
‑
cp表达载体;
[0093]
连接反应体系(10μl):lt
ⅰ‑
lt
ⅱ‑
st
‑
cp 2μl、双酶切pet
‑
28a载体3.5μl和solutionⅰ4.5μl;16℃条件下反应8h;
[0094]
4)将3)中连接产物,按照上述方法转入e.coli dh5α中;
[0095]
5)挑取单克隆菌株,培养,测序;
[0096]
6)将测序正确的菌株提取质粒,按照天根的质粒小提试剂盒说明书操作;
[0097]
7)将提取的重组质粒pet
‑
28a
‑
lt
ⅰ‑
lt
ⅱ‑
st
‑
cp按照相同操作,转化至e.coli bl21(de3)感受态中,挑菌,培养,测序,鉴定正确的菌株保种。
[0098]
7、重组蛋白的诱导表达
[0099]
1)诱导:将上述e.coli bl21(de3)菌株接种到液体lb培养基中,37℃培养2h,再加入iptg,使其终浓度为1mmol/l,诱导8h,同时做空载阴性对照;
[0100]
2)制样:将诱导与未诱导的菌液以相同的菌量离心收集,用pbs重悬,加sds上样缓冲液,沸水煮10min;
[0101]
3)sds
‑
page电泳,marker上样7μl,待检样每孔10μl;5%积层胶用90v电压电泳30min,12%分离胶用120v电压电泳1.5h;
[0102]
4)染色与脱色:对电泳完成的分离胶用新配制的考马斯亮蓝r
‑
250室温染色4h,再脱色8h,每2h换一次脱色液,完成后用凝胶成像系统采集图像。
[0103]
结果如图2所示,将构建的重组表达菌株,经iptg在37℃诱导后用sds
‑
page电泳分析。结果显示,成功表达lt
ⅰ‑
lt
ⅱ‑
st
‑
cp重组蛋白,在55kda处有明显条带,与理论大小相同。
[0104]
实施例2
[0105]
lt
ⅰ‑
lt
ⅱ‑
st
‑
cp重组蛋白纯化及活性验证
[0106]
1、蛋白纯化
[0107]
1)将lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的重组e.coli bl21(de3)菌,先接种100μl于5ml液体lb中,加入千分之一的卡那青霉素,37℃,160rpm摇床培养3h。
[0108]
2)将步骤1中5ml菌液接入1l灭菌过的lb中,加入千分之一的卡那青霉素,37℃,160rpm,摇床培养2h,再加入iptg,使其终浓度为1mmol/l,16℃摇床160rpm,诱导24h。
[0109]
3)取步骤2中的菌液,8000rpm,4℃离心10min,收菌,进行pbs超声破碎,冰浴10min后冰上超声破菌,超声3s间隔3s,共30min,超声完毕8000rpm,4℃离心10min,弃掉上清,收沉淀。用pbs洗3次,离心条件同前。
[0110]
4)取上步所得沉淀,称取湿重,用pbs重悬至所需浓度,
‑
80℃保存备用。
[0111]
结果如图3所示,重组蛋白成功表达后,用包涵体纯化的方法对其进行纯化,可见目的条带清晰且单一,大小也符合,证明纯化效果较好,纯化后蛋白浓度为5mg/ml。
[0112]
2、重组蛋白特异性验证
[0113]
2.1将重组蛋白用商品化的抗ltⅰa抗体进行验证
[0114]
1)电泳:将样品通过sds电泳,完成后,用甲醇激活pvdf膜;
[0115]
2)转膜:采用湿转法转膜,组装顺序从负极到正极依次为:滤纸/胶/膜/滤纸,全程在膜转移缓冲液中,防止每层间有气泡产生,转膜条件为200ma,2h;
[0116]
3)封闭:转膜结束后用封闭液在4℃下封闭过夜;
[0117]
4)一抗:将lt抗体用封闭液2000倍稀释,37℃孵育1h,pbst洗三次,15min/次;
[0118]
5)二抗:将hrp标记的羊抗小鼠igg用封闭液4000倍稀释,37℃孵育1h,pbst洗三次,15min/次;
[0119]
6)加入ecl显色液,用成像仪采集图像信息。
[0120]
7)分别用商品化的抗ltⅰb、ltⅱaa、ltⅱab、ltⅱc a、ltⅱcb、st a、st b、魏氏梭菌的α毒素和β毒素的抗体做western活性验证实验,步骤同上。
[0121]
结果如图4所示,重组蛋白的每一段特异性良好。
[0122]
2.2毒性验证
[0123]
1)用纯化和不纯化的该重组蛋白免疫balb/c小鼠,每组5只小鼠,100μg/只。其中不纯化组为诱导后不进行超声破碎,4℃,8000rpm离心10min,弃上清,称量菌体湿重,直接用终浓度为3%的甲醛重悬至所需浓度,灭活24h。
[0124]
2)期间小鼠培养笼子不放垫料,每隔3h观察一次小鼠状态,是否毛发竖立,杂乱,是否有腹泻或呕吐等应激症状。
[0125]
对小鼠进行三次免疫后,每次免疫后,纯化和未纯化的重组蛋白组的小鼠状态均正常,皮毛顺滑,无腹泻呕吐症状,笼子里无呕吐物,说明该重组蛋白无活性。
[0126]
2.3检测抗体的变化规律
[0127]
1)制定表2所示免疫程序,其中首次免疫用等体积的弗氏完全佐剂乳化,后续免疫用弗氏不完全佐剂乳化,免疫周期为14天。
[0128]
表2免疫程序
[0129] 纯化低剂量纯化高剂量不纯化低剂量不纯化高剂量0.01mpbs一免30μg100μg30μg100μg同体积(100μl)二免30μg100μg30μg100μg同体积(100μl)
三免30μg100μg30μg100μg同体积(100μl)
[0130]
2)在每次免疫的第3天、第7天和第11天从每只小鼠尾尖采血,将血液放置于37℃,30min,在4℃离心机2000rpm离心20min,用移液器慢慢吸取上层清亮液体于一个干净的管中。
[0131]
3)将纯化的lt
ⅰ‑
lt
ⅱ‑
st
‑
cp的重组蛋白按照1ng/μl的浓度包被于elisa板子上,100μl/孔,37℃温箱孵育2h。
[0132]
4)用5%的脱脂奶粉对包被的elisa孔进行封闭,50μl/孔,37℃孵育1h。
[0133]
5)pbst洗三次,每次1min,200μl/孔。
[0134]
6)将步骤2中每只小鼠的血清均从250倍开始用pbs倍比稀释作为一抗,100μl/孔,加入到步骤5的孔中,每个孔做3个重复,37℃温箱孵育1h。
[0135]
7)pbst洗三次,每次1min,200μl/孔。
[0136]
8)将山羊抗小鼠igg用pbs稀释4000倍,每孔100微升,加入到步骤7)处理后孔中,37℃温箱孵育1h。
[0137]
9)pbst洗三次,每次1min,200μl/孔。
[0138]
10)在步骤9)处理后孔中加入tmb底物显色液,100μl/孔,37℃避光孵育8min。
[0139]
11)在步骤10)中tmb底物中加入终止液,50μl/孔,保种每个孔内无肉眼可见的气泡,在酶标仪读取450nm处的od值。
[0140]
结果如图5所示,在每次免疫后第7天,血清抗体水平达到最高,其中纯化和不纯化的100μg组,小鼠血清效价最高。
[0141]
2.4抗血清的特异性验证
[0142]
将上述纯化100μg组三免之后14天的小鼠眼球采血,收集血清2000倍稀释作为一抗,以etec和魏氏梭菌作为固相抗原做western实验,验证抗血清的特异性,具体操作步骤同上。
[0143]
结果如图6和图7所示,etec验证抗血清特异性图中显示出两条带,85kda的是lt毒素,16kda的是st毒素,抗血清可以与天然蛋白etec肠毒素结合,特异性良好(图6);魏氏梭菌验证抗血清特异性的图中显示出两条带,43kda和37kda的依次是α毒素和β1毒素,可见抗血清能够与天然魏氏梭菌的α和β1毒素结合,特异性良好(图7)。
[0144]
2.5免疫效力检测
[0145]
1)对小鼠进行免疫,免疫程序同表2,但每组设置10只balb/c小鼠。
[0146]
2)提前配制好lb培养基,分别接入魏氏梭菌和产肠毒大肠杆菌各100μl,37℃,160rpm摇床培养8h。
[0147]
3)在第三次免疫后的第14天对小鼠进行攻毒实验,每只小鼠分别攻毒1.5
×
107剂量的魏氏梭菌和产肠毒大肠杆菌,攻毒方法为腹腔注射,观察10天。
[0148]
结果如表3所示,当重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp纯化三免后,30μg组保护率为70%,100μg组保护率为90%,不纯化的重组蛋白三免后,30μg组保护率为80%,100μg组保护率为100%,对照组全部发病。因此可见,重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp对于腹泻有很好的保护效果,100μg免疫效果良好,其中不纯化组优于纯化组。
[0149]
表3免疫效力检测结果
[0150]
分组实验小鼠(个)发病数(个)死亡数(个)保护率(%)
纯化30μg103170纯化100μg101090不纯化30μg102180不纯化100μg1000100pbs101080
[0151]
实施例3
[0152]
重组蛋白lt
ⅰ‑
lt
ⅱ‑
st
‑
cp对仔猪的免疫保护性实验
[0153]
1、实验菌株和动物
[0154]
刚出生的长白猪,购自长春某猪场(该猪场从未发生过仔猪腹泻,且仔猪出生后未接种过任何疫苗),购进50头仔猪,饲养于标准猪舍,专业人员按照标准饲养,每只猪均单独关起来饲养,且饲料中不添加任何抗生素。
[0155]
2、疫苗的制备
[0156]
将重组蛋白稀释至1μg/μl,按照体积比1:1缓慢将氢氧化铝溶胶佐剂加入到重组蛋白中(每只仔猪1g佐剂),在室温下用摇床缓慢摇动30min。
[0157]
3、
[0158]
3.1疫苗接种及免疫
[0159]
1)实验分组
[0160]
将40头仔猪随机分为4组,每组10只按照如下免疫程序进行免疫,免疫周期为14天,免疫方式为颈部肌肉注射。
[0161]
表4实验分组
[0162] 纯化组不纯化组0.01mpbs0.01mpbs 佐剂一免1mg1mg同体积(2ml)同体积(2ml)二免1mg1mg同体积(2ml)同体积(2ml)三免1mg1mg同体积(2ml)同体积(2ml)四免1mg1mg同体积(2ml)同体积(2ml)
[0163]
2)四免之后第7天,各组灌胃感染产肠毒素大肠杆菌和魏氏梭菌,每头猪各灌服2
×
108个etec和魏氏梭菌,灌服体积为5ml。
[0164]
3)感染etec和魏氏梭菌后,每4h观察一遍仔猪状态,如毛发是否粗糙,体温是否正常,粪便是否为黄色或红色稀糊状,仔猪是否厌食,不愿意动,是否消瘦(可称量体重),以及是否有死亡。
[0165]
4)攻菌14天之后统计各组仔猪病死数量。
[0166]
结果如表5所示,重组蛋白作为疫苗免疫仔猪后,保护率可达到80%以上,效果良好。未发病仔猪,精神状态良好,粪便颜色和形状正常,体温和体重正常;发病仔猪毛发无光泽,较乱,体温升高,体形消瘦,粪便有红色和黄色的稀糊状,整体精神状态较为萎靡,倦怠。
[0167]
表5仔猪发病率及状态统计表
[0168]
分组实验动物数(个)发病动物数(个)死亡动物数(个)保护率(%)纯化组102080不纯化组1010900.01mpbs109710
0.01mpbs 佐剂108620
[0169]
3.2仔猪肠道状态观察
[0170]
将实验仔猪(包括发病、病死仔猪)在攻菌后第10天处死,进行解剖,观察其肠道状态,是否有病理变化。
[0171]
结果显示,未发病仔猪肠道未见明显病理变化,较为正常。发病仔猪肠道黏膜有充血、坏死和脱落,肠道肿胀,内容物充满血样或黄色液体,肠系膜淋巴结充血肿胀,肠黏膜有急性卡他性炎症。肛门松弛,呈紫红色,尾部沾有粪便,粪便呈红色或黄色稀糊状。所有发病或病死仔猪脾脏均显著肿大,有出血点和坏死点。
[0172]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。