猪源性抗猪流行性腹泻病毒n蛋白的真核表达单链抗体及其制备方法和用途
技术领域
1.本发明涉及的是一种基因工程领域的技术,具体是一种猪源性抗猪流行性腹泻病毒n蛋白的真核表达单链抗体及其制备方法和用途。
背景技术:
2.猪流行性腹泻(porcine epidemic diarrhea,ped)是由猪流行性腹泻病毒(porcine epidemic diarrheavirus,pedv)感染猪引起的临床表现为腹泻、呕吐、脱水甚至死亡的一种肠道疾病。ped的传染性强,发病率高,感染后的新生仔猪的死亡率甚至高达100%,该病在全球多个国家均有爆发,造成巨大的经济损失,影响全世界养猪产业的发展。疫苗接种是预防病毒性疾病的一种有效方法,但是由于pedv的变异速度快,商业化疫苗对变异毒株的预防效果并不理想。
技术实现要素:
3.本发明针对现有技术存在的上述不足,提出一种猪源性抗猪流行性腹泻病毒n蛋白的真核表达单链抗体及其制备方法和用途,能够与猪流行性腹泻病毒n蛋白特异性结合,可抑制猪流行性腹泻病毒在宿主细胞内的复制,能够用于制备防治猪流行性腹泻药物的研究。
4.本发明是通过以下技术方案实现的:
5.本发明涉及一种真核表达单链抗体,包含猪源单链抗体片段vh
‑
linker
‑
vl,其中:猪抗体重链可变区vh的氨基酸序列如seq id no.1所示,猪抗体轻链可变区vl的氨基酸序列如seq id no.2所示,linker为中间连接肽。
6.所述的中间连接肽的核苷酸序列,如seq id no.3所示。
7.本发明涉及上述单链抗体的实现方法,通过将猪源单链抗体片段vh
‑
linker
‑
vl的编码基因插入真核表达质粒pcmv
‑
ha,构建成为重组真核表达质粒pcmv
‑
ha
‑
scfv,将pcmv
‑
ha
‑
scfv转染vero
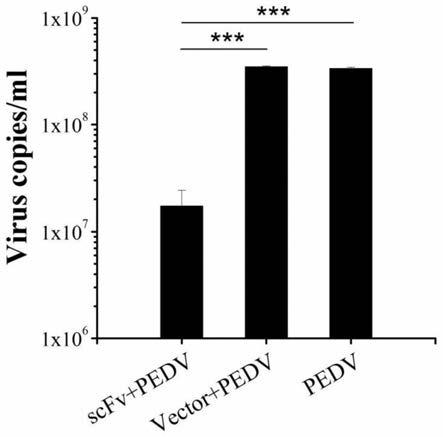
‑
e6细胞。
8.所述的真核表达单链抗体,其核苷酸序列如seq id no.4所示,其氨基酸序列如seq id no.5所示。
9.所述的单链抗体的分子量大小约为28kda。
10.本发明涉及上述单链抗体的应用,将其用于在猪流行性腹泻病毒感染的细胞中表达,以抑制猪流行性腹泻病毒的复制。
11.所述的抑制,p<0.001,具有一定的抵抗猪流行性腹泻病毒感染的作用。
12.所述的应用,具体包括:
13.1)采用rt
‑
pcr直接从重组表达的猪流行性腹泻病毒n蛋白免疫的猪脾脏组织rna中扩增出抗体编码基因的重链可变区vh基因和轻链可变区vl基因;
14.2)利用soe
‑
pcr法将步骤1)得到的vh基因、中间连接肽和步骤1)得到的vl基因相
连构建猪源性单链抗体基因;
15.3)将步骤2)获得的猪源性单链抗体基因克隆到原核表达载体pope101
‑
xp中,构建重组质粒pope101
‑
xp
‑
scfv;
16.4)将步骤3)的重组质粒pope101
‑
xp
‑
scfv转化入e.coli jm109感受态细胞,经过多次转化,获得猪源性单链抗体库;
17.5)从步骤4)构建的猪源性单链抗体库中随机挑取单克隆,制备周质腔蛋白,以猪流行性腹泻病毒n蛋白作为包被抗原进行elisa筛选,有阳性反应的相对应的阳性克隆即含有抗猪流行性腹泻病毒n蛋白的真核表达单链抗体。技术效果
18.本发明采用rt
‑
pcr直接从重组表达的猪流行性腹泻病毒n蛋白免疫的猪脾脏组织rna中扩增出抗体编码基因的重链可变区vh基因和轻链可变区vl基因。利用soe
‑
pcr法将获得的vh基因、中间连接肽和vl基因拼接构建猪源性单链抗体编码基因(scfv),拼接顺序为vh
‑
linker
‑
vl,将获得的猪源性单链抗体编码基因克隆到原核表达载体pope101
‑
xp中,构建重组质粒pope101
‑
xp
‑
scfv,多次转化e.coli jm109感受态细胞构建猪源性单链抗体文库。以重组表达的猪流行性腹泻病毒n蛋白为包被抗原,经间接elisa筛选阳性克隆,证明该单链抗体具有特异结合猪流行性腹泻病毒n蛋白的能力,并经过dna测序证明该单链抗体编码基因的序列正确。
19.与现有技术以重组表达的猪流行性腹泻病毒n蛋白免疫的小鼠的cdna为模板,鼠源性的抗体用于猪时具有较强的免疫原性,本发明以重组表达的猪流行性腹泻病毒n蛋白免疫的猪的cdna为模板扩增抗体编码基因,将筛选到的阳性克隆的单链抗体编码基因重组到真核表达质粒pcmv
‑
ha中,构建成重组真核表达质粒pcmv
‑
ha
‑
scfv;将该重组真核表达质粒转染vero
‑
e6细胞,该单链抗体的分子量大小约为28kda;该单链抗体在猪流行性腹泻病毒感染的细胞中大量表达;该单链抗体能够显著抑制猪流行性腹泻病毒的复制(p<0.001),具有一定的抵抗猪流行性腹泻病毒感染的作用,能够用于猪流性腹泻病的预防和治疗。
附图说明
20.图1为vh
‑
linker
‑
vl pcr电泳图;
21.图中:m为2000bp dnaladdermarker;1、2为vh
‑
linker
‑
vl基因pcr产物;
22.图2为间接elisa筛选到的一个阳性克隆图示;
23.图中:nc为阴性对照;scfv为筛选获得的阳性克隆;
24.图3为重组真核表达载体pcmv
‑
ha
‑
scfv的构建过程和质粒图谱;
25.图4为scfv和pcmv
‑
ha质粒的电泳图;
26.图中:m为5000bp dnaladdermarker;1为scfv基因片段;2为pcmv
‑
ha质粒;
27.图5为westernblot分析pcmv
‑
ha
‑
scfv在vero
‑
e6细胞中的表达图;
28.图中:m为蛋白质预染marker;1为转染pcmv
‑
ha
‑
scfv的细胞裂解液;2为转染pcmv
‑
ha的细胞裂解液;
29.图6为rt
‑
qpcr分析单链抗体对猪流行性腹泻病毒的抑制效果图;
30.图中:scfv pedv为转染pcmv
‑
ha
‑
scfv以后24h,感染pedv病毒组;vector pedv为转染pcmv
‑
ha以后24h,感染pedv病毒组;pedv为只感染病毒组;图中数据均以平均值
±
标准
误表示(n=3);***p<0.001。
具体实施方式
实施例1
31.猪源性抗猪流行性腹泻病毒n蛋白的单链抗体库的构建,具体包括:
32.步骤1、用重组表达的猪流行性腹泻病毒n蛋白免疫猪,间接elisa检测血清抗体效价达到1:64000时,取猪的脾脏组织,用trizol法(trizol试剂购自invitrogen公司)提取总rna。以提取的总rna为模版,采用oligo primer,根据反转录试剂盒(反转录cdna合成试剂盒购自takara公司)的产品说明操作步骤,合成cdna。
33.步骤2、分析已发表文献中的猪抗体编码基因的可变区序列,根据序列设计扩增抗体重链可变区和轻链可变区的引物,如表1),其中vh
‑
b和vh
‑
f用于扩增vh区;vlκ
‑
b1、vlκ
‑
b2、vlκ
‑
b3和vlκ
‑
f用于扩增vlκ区;vlλ
‑
b和vlλ
‑
f用于扩增vlλ区;overlap
‑
b1和overlap
‑
f1、overlap
‑
b2和overlap
‑
f2、overlap
‑
b3和overlap
‑
f3、overlap
‑
λ
‑
b和overlap
‑
λ
‑
f用于合成延伸中间连接肽linker序列,该序列的n端和c端分别与vh和vl有20bp左右的重叠;vh
‑
b
‑
ncoi在vh的基础上加入酶切位点ncoi,vlκ
‑
f
‑
noti和vlλ
‑
f
‑
noti分别在vlκ
‑
f和vlλ
‑
f的基础上加入酶切位点noti(酶切位点和linker序列在表1中分别用下划线和加粗字体标示出)。引物由生工生物工程(上海)股份有限公司合成。
34.表1扩增抗体可变区的引物及其扩增片段大小
35.表1中注:下划线代表nco i或not i酶切位点,加粗代表中间连接肽序列。
36.步骤3、vh和vl基因的扩增以cdna为模版,vh
‑
b和vh
‑
f用于扩增vh基因;vlκ
‑
b1、vlκ
‑
b2、vlκ
‑
b3和vlκ
‑
f用于扩增vlκ基因;vlλ
‑
b和vlλ
‑
f用于扩增vlλ基因。pcr反应体系为25μl:2
×
pcrmix 12.5μl,模版cdna 2μl,上下游引物(25μm)各1μl,ddh2o 8.5μl。扩增程序如下:95℃预变性5min;95℃变性40s,55℃退火40s,72℃延伸1min,30个循环;最后72℃延伸10min。1.5%琼脂糖凝胶电泳鉴定产物并回收目的基因(根据thermo公司提供的胶回收说明书操作)。
37.步骤4、scfv基因的获得overlap
‑
b1和overlap
‑
f1、overlap
‑
b2和overlap
‑
f2、overlap
‑
b3和overlap
‑
f3、overlap
‑
λ
‑
b和overlap
‑
λ
‑
f用于合成n端和c端分别与vh和vl有20bp左右重叠的延伸中间连接肽linker序列;然后以vlκ基因和延伸linker片段为模板,overlap
‑
bprimer和vlκ
‑
f为引物扩增linker
‑
vlκ目的片段,以vlλ基因和延伸linker片段
为模板,overlap
‑
bprimer和vlλ
‑
f为引物扩增linker
‑
vlλ目的片段。扩增产物经1.5%琼脂糖凝胶电泳鉴定后回收目的片段。以vh基因和linker
‑
vlκ片段或vh基因和linker
‑
vlλ片段为模板,vh
‑
b
‑
ncoi和vlκ
‑
f
‑
noti或vlλ
‑
f
‑
noti为引物通过重组链延伸反应(soe
‑
pcr)将vh和vl基因通过linker序列连接为scfv基因,并加入ncoi和noti酶切位点,如图1所示。
38.步骤5、猪源性scfv单链抗体原始文库的构建根据(j.萨姆布鲁克等主编的《分子克隆实验指南》)分子克隆方法,将scfv基因和pope101
‑
xp载体分别经ncoi和noti双酶切后,琼脂糖凝胶电泳并用凝胶回收试剂盒回收酶切产物。将scfv基因插入pope101
‑
xp载体,构建重组表达质粒,并将其转化e.coli jm109感受态细胞(北京全式金生物技术有限公司),多次转化,构建猪源性单链抗体原始文库。从库中取一定量的菌液进行10倍梯度稀释后涂布2yt
‑
a固体培养平板,计算库容量;随机挑取单克隆,通过菌落pcr计算其阳性率,菌落pcr验证正确的克隆进行bstni单酶切和dna测序分析来确定文库的多样性。实施例2
39.猪源性抗猪流行性腹泻病毒n蛋白的单链抗体的间接elisa筛选,具体为:将纯化的重组表达的猪流行性腹泻病毒n蛋白在96孔板中4℃包被过夜;96孔板中用含4%bsa的封闭液37℃封闭2h;pbst缓冲液洗3次,向96孔板的每孔加入提取的菌落的周质腔蛋白,37℃反应2h;pbst缓冲液洗3次,加anti
‑
myctag鼠源单克隆抗体100μl(1:3000稀释),37℃反应2h;pbst缓冲液洗3次,加hrp标记的羊抗鼠igg(h l)100μl(1:6000稀释),37℃反应1h;pbst缓冲液洗3次,加tmb显色液,避光15min;加2mol/l硫酸终止反应,酶标仪读取od450值。设空质粒提取的周质腔蛋白为阴性对照组。以p/n(p为阳性孔的od450值,n为阴性孔的od450值)表示,p/n≥2.1为阳性;1.5≤p/n<2.1为可疑;p/n<1.5为阴性,如图2所示。根据(姚火春主编《兽医微生物学实验指导》)。实施例3
40.重组scfv序列分析,具体为:对获得的阳性克隆的单链抗体编码基因进行dna测序,证明其由723个核苷酸及据此推测的241个氨基酸组成,所述核苷酸序列如seq id no.4所示,所述氨基酸序列如seq id no.3所示。实施例4
41.重组真核表达质粒pcmv
‑
ha
‑
scfv的转染,具体包括:
42.步骤1、无内毒素质粒的提取:采用omega bio
‑
tek公司的无内毒素质粒小量提取试剂盒,详细操作步骤为:将含有目的质粒的克隆接种于含有相应抗生素的液体培养基中,37℃培养过夜;5,000
×
g离心8min,弃掉上清;加500μl solution i/rnase a重悬菌体转移至离心管中;向离心管中加500μl solution ii,温和颠倒离心管,室温放置3min;加250μl预冷的n3buffer,温和颠倒离心管,至有白色絮状物形成;13,000
×
g离心10min,将上清转移到新的离心管中;向离心管中加入0.1倍体积的etr solution,温和颠倒混匀,冰上静置10min;42℃孵育5min,混合液又变浑浊;12,000
×
g离心3min,混合液分层,将上层转移到新的离心管中,向离心管中加0.5倍体积无水乙醇,颠倒混匀,静置2min;将dna结合柱放于收集管上,转移混合液至结合柱中,10,000
×
g离心1min,弃掉废液,直到所有混合液都滤过结合柱;向柱中加500μl的hbc buffer,13,000
×
g离心1min,弃掉废液;向柱中加700μl的dna wash buffer,13,000
×
g离心1min,弃掉废液,用dnawash buffer再洗一遍;空柱子13,000
×
g离心2min;把结合柱放于新的离心管上,向柱基质上加60
‑
100μl灭菌去离子水,
静置1
‑
2min,13,000
×
g离心1min;将离心得到的dna溶液重新加到柱子上,静置1
‑
2min,13,000
×
g离心1min,收集管中的dna溶液,即为质粒;放于
‑
20℃保存备用。
43.步骤2、重组真核表达质粒pcmv
‑
ha
‑
scfv的构建和测序验证:构建过程如图3所示,pcmv
‑
ha和scfv经过xhoi和noti限制性内切酶酶切,电泳结果如图4所示,将回收产物用t4连接酶连接,转化dh5α,挑取单菌落,经过菌液pcr鉴定阳性克隆,提取质粒;将获得的重组真核表达质粒pcmv
‑
ha
‑
scfv进行dna测序验证,测序结果表明scfv序列与seq id no.4所示序列一致,证明重组真核表达质粒pcmv
‑
ha
‑
scfv构建成功。dna测序公司为铂尚生物技术(上海)有限公司。
44.步骤3、重组真核表达质粒pcmv
‑
ha
‑
scfv转染细胞:将vero
‑
e6细胞培养至80%
‑
90%融合度,按照1:3的比例接种至6孔板中,待孔中细胞生长至80%融合度,进行质粒转染,试剂为lipofectamine 3000transfection reagent,具体操作步骤为:取两个离心管,各加入125μlopti
‑
mem i培养基;吸取5μl lipofectamine 3000试剂加到一份125μl opti
‑
mem i培养基中,温和混匀,将5μl p3000试剂和2.5μg无内毒素的重组真核表达质粒pcmv
‑
ha
‑
scfv或pcmv
‑
ha加到另一份125μl opti
‑
mem i培养基中,温和混匀;静置5min;将质粒和p3000试剂全部加到lipofectamine 3000试剂中,温和混匀;静置孵育20min;将6孔板中的培养液吸出,pbs清洗1次,然后每孔加2.25ml的opti
‑
mem i培养基;将静置后的混合液轻轻滴入孔内,将6孔板放于37℃、5%co2的细胞培养箱中培养。实施例5
45.western blot检测重组真核表达质粒pcmv
‑
ha
‑
scfv的转染效果,即:重组真核表达质粒pcmv
‑
ha
‑
scfv转染细胞48h后,pbs清洗1次,加250μl的ripa裂解液(含1mm pmsf)裂解细胞,收集裂解液;4℃,13,000rpm离心5min,将上清转移至离心管中,放于
‑
20℃保存。通过western blot检测单链抗体在细胞内的表达,具体包括:
46.步骤1)制作分离胶和浓缩胶;
47.步骤2)每孔上样10μl,一份为转染重组真核表达质粒pcmv
‑
ha
‑
scfv的细胞裂解液,另一份为转染真核表达质粒pcmv
‑
ha的细胞裂解液,作为阴性对照;
48.步骤3)电泳:样品在浓缩胶中电泳时,电压为80v,进入分离胶中电泳后,电压为120v;
49.步骤4)转膜:取出胶板,切掉浓缩胶,量剩余胶块的尺寸,剪相同大小的nc膜,将胶和膜放入转膜液中浸湿,从下到上的摆放顺序为:黑色夹板、滤纸、胶、nc膜、滤纸、白色夹板,将夹板放入电泳槽中,恒流转膜;
50.步骤5)封闭:将nc膜放入5%脱脂奶粉封闭液中,室温封闭1h;
51.步骤6)tbst缓冲液洗3次,5min/次;
52.步骤7)一抗孵育:将nc膜用anti
‑
his鼠源单克隆抗体(用5%脱脂奶粉按1:4000稀释)孵育,4℃过夜;
53.步骤8)tbst缓冲液洗3次,5min/次;
54.步骤9)二抗孵育:将nc膜用hrp标记的山羊抗小鼠igg(h l)(用5%脱脂奶粉按1:5000稀释)孵育,室温1h;
55.步骤10)tbst缓冲液洗3次,5min/次;
56.步骤11)显影:将化学发光试剂盒中的a液和b液等体积混匀,均匀滴在nc膜上,避
光2min,然后将膜放于tanon 5200全自动化学发光系统的平板上,采集图像。结果显示重组真核表达质粒pcmv
‑
ha
‑
scfv转染成功,单链抗体在细胞中大量表达,如图5所示。实施例6
57.抗猪流行性腹泻病毒n蛋白的真核表达单链抗体对猪流行性腹泻病毒复制的影响,具体包括:
58.步骤1、构建重组质粒pmd19
‑
t
‑
pedv
‑
m
59.扩增猪流行性腹泻病毒m基因的长度为150bp的片段,构建重组质粒pmd19
‑
t
‑
pedv
‑
m,用以制作标准曲线。扩增m基因部分片段的引物序列见表2。引物由生工生物工程(上海)股份有限公司合成。
60.表2扩增猪流行性腹泻病毒m基因部分片段的引物及其扩增片段大小
61.2、rt
‑
qpcr检测猪流行性腹泻病毒的拷贝数
62.将vero
‑
e6细胞按照1:3的比例接种至24孔板,重组真核表达质粒pcmv
‑
ha
‑
scfv或空质粒pcmv
‑
ha转染细胞24h后,感染猪流行性腹泻病毒(moi=0.01),感染24h后,通过rt
‑
qpcr检测猪流行性腹泻病毒在细胞内的复制。转染空质粒pcmv
‑
ha的组为阴性对照组,不转染质粒的组为空白对照组。详细操作步骤为:将处理后的24孔板置于
‑
80℃;反复冻融3次,将各孔内的细胞裂解液转移至rnase
‑
free离心管中,离心后转移上清到新的rnase
‑
free离心管中,然后提取病毒rna。根据反转录试剂盒(反转录cdna合成试剂盒购自takara公司)的产品说明操作步骤,合成cdna。以合成的cdna为模板,pedv
‑
m
‑
b和pedv
‑
m
‑
f为引物扩增m基因片段,检测猪流行性腹泻病毒的拷贝数。试剂盒为tbpremix ex taq
tm
ii kit(tli rnaseh plus),购自takara bio公司,pcr反应体系为20μl:tb green premix ex taq ii(tli rnaseh plus)(2
×
)10μl,上下游引物(10μm)各0.8μl,rox reference dye ii(50x)0.4μl,模版cdna 2μl,ddh2o 6μl。扩增程序如下:95℃预变性30s;95℃变性5s,58℃退火和延伸34s,40个循环。计算每个处理的猪流行性腹泻病毒的拷贝数,结果显示抗猪流行性腹泻病毒n蛋白的真核表达单链抗体显著抑制猪流行性腹泻病毒的复制(p<0.001),如图6所示。
63.上述具体实施可由本领域技术人员在不背离本发明原理和宗旨的前提下以不同的方式对其进行局部调整,本发明的保护范围以权利要求书为准且不由上述具体实施所限,在其范围内的各个实现方案均受本发明之约束。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。