一种水痘
‑
带状疱疹病毒r
‑
ge融合蛋白、重组水痘
‑
带状疱疹疫苗及其制备方法和应用
技术领域
1.本发明属于生物医学领域,特别涉及一种水痘
‑
带状疱疹病毒r
‑
ge融合蛋白、重组水痘
‑
带状疱疹疫苗及其制备方法和应用。
背景技术:
2.水痘是因为受到水痘
‑
带状疱疹病毒初次感染引起的一种具有强传染性的急性传染病,主要的传播途径为呼吸道飞沫或直接接触,其多发于春季和冬季。婴幼儿是好发人群,易感儿发病率可达95%以上,2~6岁学龄前儿童为发病高峰群体。带状疱疹(herpes zoster,hz)是由水痘
‑
带状疱疹病毒(varicella
‑
zoster virus,vzv)在原发性水痘感染期间获得再激活引起的,主要特征为皮区疼痛和丘疹;疼痛通常先于皮疹几天出现,且在皮疹消退后可持续数月;皮疹往往在单个皮区出现,通常在4
‑
5周内消退,常见并发症之一是带状疱疹后遗神经痛。
3.研究认为,vzv感染粘膜上皮内的树突状细胞(dc),树突状细胞进入区域淋巴结或扁桃体,将vzv转移给t细胞,被感染的t细胞随后返回皮肤,感染真皮成纤维细胞和角质形成细胞,导致水痘的特征性表现。考虑到vzv肺炎是成人vzv感染的主要并发症之一,另一种可能是vzv在首次吸入后也在肺部复制。根据体外感染数据,以及在人源化scid小鼠模型中静脉转移体外感染的扁桃体t细胞导致皮肤损伤的能力,假设扁桃体t细胞吸附病毒颗粒后可直接感染并将vzv运输至皮肤。
4.目前已上市减毒活疫苗包括有水痘疫苗和带状疱疹疫苗,减毒水痘疫苗当前均为oka株制备,免疫1针或者两针后可获得较好的免疫原性;减毒带状疱疹疫苗的免疫效果很差,只有50~60%的有效性,有逐渐被重组蛋白疫苗取代之势。无论是减毒活水痘疫苗和带状疱疹疫苗在使用过程中均存在着风险。灭活水痘
‑
带状疱疹病毒疫苗v212是一种实验性灭活水痘
‑
带状疱疹病毒疫苗,开发用于18岁及以上免疫功能低下患者,用于预防带状疱疹(hz)及相关并发症。目前,v212用于免疫功能低下患者预防带状疱疹(herpes zoster,hz)的iii期临床研究已经完成;在自体干细胞移植受者和恶性肿瘤患者中开展的iii期临床研究表明,其有效性结果仍未超越减毒活疫苗带状疱疹疫苗。
5.公开号为cn201710297864、cn201810902356和cn201180046512的发明专利分别公开了由灭活的水痘病毒制备水痘疫苗和带状疱疹疫苗的方法。已上市重组带状疱疹疫苗存在如下缺陷:
6.已上市带状疱疹疫苗的抗原为vzv ge蛋白胞外结构域,并且辅以佐剂。根据gsk公开的专利(200680015245.5、201210552767.6)显示,疫苗中所使用的vzv ge蛋白为截短以除去羧基末端锚定区的vzv ge,非融合蛋白形式,长度为546个氨基酸(含n端信号肽)。重组蛋白需要添加表现良好的佐剂系统,才能激发体内产生足够的细胞免疫和体液免疫反应,达到保护效果。而选用的佐剂系统如as01,含有mpla和qs21,临床使用时副反应广泛,主要有:注射部位反应(疼痛、红肿)、肌肉疼痛、乏力、头疼、瑟瑟发抖、发热、恶心想吐、呕吐、腹
泻或腹部疼痛。从目前的临床数据来看,在50岁及以上的受试者中引起的局部不良反应为疼痛(78.0%),发红(38.1%)和肿胀(25.9%);在50岁及以上的受试者中引起的一般不良反应为肌痛(44.7%),疲劳(44.5%),头痛(37.7%),发抖(26.8%),发烧(20.5%)和胃肠道症状(17.3%)。
7.尝试使用表达vzv ge蛋白的胞外全长或者截短型或者融合蛋白的方法有很多,其中申请号为201110448064.4的专利中公开了一种带有his标签的vzv ge蛋白截断型的序列,申请号为201910016746.4的专利中公开了一种带状疱疹病毒疫苗及其制备方法和应用,带状疱疹病毒疫苗由水痘
‑
带状疱疹病毒糖蛋白e或其片段与复合佐剂配制而成。对蛋白的递送或辅助运输或者佐剂也有很多探索,例如申请号为200880108051.9的专利中公开了一种形成vlp颗粒的制备方法以及该疫苗制剂和在受试者中诱导免疫应答的方法。申请号为201910585105.0的专利中公开了组合使用带状疱疹的糖蛋白e包膜外结构域与包膜糖蛋白i的糖基化位点区域构建带状疱疹疫苗,通过带状疱疹病毒包膜上与带状疱疹的糖蛋白e相互作用的带状疱疹病毒的包膜糖蛋白i辅助带状疱疹的糖蛋白e包膜外结构域制备带状疱疹疫苗,提高疫苗蛋白复合体的糖基化修饰水平。
8.vzv病毒表面主要有四种糖蛋白或复合物,分别是gb、gc、ge/i和gh/gl。ge作为最重要的表面抗原,在病毒侵染细胞过程中起着重要作用。在老年人中,与年龄相关的vzv特异性功能性t细胞介导免疫的丧失与hz发病率的增加相一致。vzv特异性t细胞介导的免疫对带状疱疹(hz)的最佳恢复也至关重要。在hz皮疹发生后的第一周,vzv特异性t细胞介导的免疫反应的大小与hz疾病的严重程度和出现疱疹后神经痛的风险呈负相关。
9.ge蛋白是vzv病毒表面最丰富的蛋白,研究发现,ge蛋白的胞外序列27
‑
187、51
‑
187、208
‑
236作用重要,缺失后会导致病毒致死,噬斑尺寸降低或t细胞致死,皮肤感染能力降低等。但是预防水痘带状疱疹,仅仅依靠ge蛋白的抗体是不足的,vzv t细胞介导的免疫在预防hz的发生和发病中起着至关重要的作用。ge和gi组成的异源二聚体是病毒在体内复制所必需的,在没有其他病毒蛋白的情况下,由开放阅读框(orf)31编码的931氨基酸(aa)蛋白vzv gb与vzv gh
‑
gl异源二聚体在体外触发细胞融合。
10.目前抗原序列选择大都集中在vzv ge蛋白上。文献(陈伟伟,崔海燕,温晔,等.水痘带状疱疹病毒重组腺病毒载体疫苗的构建及评价[j].中国生物制品学杂志,2019,v.32(01):6
‑
11.)公开了一种使用vzv ge蛋白全长序列构建腺病毒载体疫苗的方法。上市重组带状疱疹疫苗为ge蛋白胞外全长序列(1
‑
546),申请号为201910016746.4的专利中公开了分别含有504个ge蛋白胞外序列氨基酸和572个胞外融合胞内序列的蛋白序列。
[0011]
接种带状疱疹减毒活疫苗一个月后,vzv特异性cd4( )t细胞的中位数(2.3倍)和宽度(4.2倍)增加,两项指标均下降了6个月。基线时最普遍的反应包括vzv开放阅读框(orfs)68[ge]、4、37[gh]和63。接种疫苗后,对orfs 40、67[gi]、9、59、12、62和18的反应也很普遍。orf9和orf18的免疫原性通过肽段得到证实,确定了大量离散的cd4 t细胞表位(laing kj,russell rm,dong l,schmid ds,stern m,magaret a,haas jg,johnston c,wald a,koelle dm.zoster vaccination increases the breadth of cd4 t cells responsive to varicella zoster virus.j infect dis.2015oct 1;212(7):1022
‑
31)。
[0012]
在接种hz减毒活疫苗(zostavax)后检测vzv特异性抗体的广度和功能的研究中,酶联免疫吸附测定法(elisa法)直接检测vzv特异性抗体分泌细胞(ascs)。结果表明,
zostavax在接种7天后能诱导igg和iga ascs,而不能诱导igm ascs。vzv特异性ascs占igg ascs总数的33
‑
55%。从5例接受zostavax治疗的60岁以上患者的ascs中克隆并鉴定了25个人vzv特异性单克隆抗体(mabs)。这些单克隆抗体平均每个vh基因有约20个体细胞超突变,类似于季节性流感疫苗接种后所见。25个单克隆抗体中有15个是ge特异性的,而其余的单克隆抗体是gb、gh或gi特异性的。在体外,大多数ge特异性单克隆抗体能够中和vzv,但它们需要补体的存在,不能阻断细胞间的传播。这些数据表明,zostavax诱导了一种以抗ge>gi>gb>gh抗体为特征的记忆b细胞回忆反应。虽然gh抗体可能参与了抑制vzv重新激活后的扩散,但zostavax后抗ge抗体对保护性免疫的贡献还需要进一步评估(sullivan nl,reuter
‑
monslow ma,sei j,durr e,davis cw,chang c,mccausland m,wieland a,krah d,rouphael n,mehta ak,mulligan mj,pulendran b,ahmed r,vora ka.breadth and functionality of varicella
‑
zoster virus glycoprotein
‑
specific antibodies identified after zostavax vaccination in humans.j virol.2018jun29;92(14):e00269
‑
18)。
[0013]
vzvorf7蛋白是一个新发现的vzv皮肤和神经趋向性因子(selariu a,cheng t,tang q,silver b,yang l,liu c,ye x,markus a,goldstein rs,cruz
‑
cosme rs,lin y,wen l,qian h,han j,dulal k,huang y,li y,xia n,zhu h.orf7 of varicella
‑
zoster virus is a neurotropic factor.j virol.2012aug;86(16):8614
‑
24.doi:10.1128/jvi.00128
‑
12.epub 2012jun 6.pmid:22674980;pmcid:pmc3421744.)。orf7删除后可导致vzv失去感染皮肤和神经节的能力,但不影响vzv感染t细胞和dc细胞。这意味着,orf7敲除可导致vzv同时在皮肤和神经组织中的减毒,而且其可作为免疫原被包括dc细胞和它淋巴细胞识别和呈递,激活vzv特异性的细胞和体液免疫。同时还发现ofr7在人视网膜色素上皮细胞(arpe
‑
19)、人黑色素瘤细胞(mewo)以及人胚肺上皮细胞(mrc
‑
5)等的体外培养中,orf7对于细胞内的病毒扩散是非必需的,这就说明了orf7是一个新发现的vzv皮肤和神经趋向性因子。
[0014]
orf7属于vzv的皮层蛋白,并且orf7包装进入病毒颗粒皮层依赖于其高尔基体定位。orf7的关键功能域就在其n端1
‑
30aa,orf7的n端1
‑
30aa中除保守的高尔基体定位信号
‑
第9位半胱氨酸,还具有同样保守的第21位酪氨酸磷酸化位点,以及orf 47特异识别的syee序列中的丝氨酸磷酸化位点等。
[0015]
关于佐剂制剂以及递送选择,常见的佐剂一般有tlr、nod、clr(c型凝集素受体),rlr等激动剂,制剂的形式有水溶液、水包油、油包水、脂质体等,可以使用递送系统运输至胞外,也可以使用病毒载体运输至胞内,常用的运输载体为富含正电荷蛋白质、荷电或不荷电的脂质体或病毒载体。
[0016]
当前的水痘带疱采用的佐剂系统如:申请号为cn201910574549.4的专利公开了一种重组带状疱疹疫苗组合物及其用途,专利中描述了采用氢氧化铝吸附cpg佐剂联合vzv病毒ge蛋白的制剂组合形式。申请号为201910016746.4的专利公开了一种带状疱疹病毒疫苗及其制备方法和应用,其中使用的复合佐剂含分子佐剂为tlr3ligand、toll
‑
7/8受体的激动剂或其它toll
‑
likereceptor激动剂。申请号为200680015245.5的专利公开了带状疱疹病毒疫苗制剂组合,所述佐剂包含qs21、3d
‑
mpl和含有胆固醇的脂质体。
[0017]
但该种组合疫苗存在如下缺点:申请号为200410033878.1的专利,采用氢氧化铝
联合cpg作为佐剂形式,其中的氢氧化铝可以作为cpg的载体,两者联合作用激发免疫作用,但是所产生的细胞免疫较弱。脂质体as01佐剂含有qs21、3d
‑
mpl和胆固醇,3d
‑
mpl源自细菌的脂多糖,qs21由南美乔木皂树的树皮中提取,两种原料均为天然提取后制备加工或修饰而成,制备工艺复杂,材料来源受限,且制备而成的脂质体成分至少有三种。
技术实现要素:
[0018]
本发明所要解决的技术问题是针对上述现有技术的不足,提供了一种水痘
‑
带状疱疹病毒r
‑
ge融合蛋白、重组水痘
‑
带状疱疹疫苗及其制备方法和应用。
[0019]
为实现上述技术目的,本发明采取的技术方案为:
[0020]
一种水痘
‑
带状疱疹病毒r
‑
ge融合蛋白,所述水痘
‑
带状疱疹病毒r
‑
ge融合蛋白由水痘
‑
带状疱疹病毒糖蛋白e(vzv ge)胞外序列与orf7蛋白片段融合而成;所述水痘
‑
带状疱疹病毒r
‑
ge融合蛋白的氨基酸序列如seq id no.1所示。
[0021]
本发明还提供了一种重组水痘
‑
带状疱疹疫苗,所述重组水痘
‑
带状疱疹疫苗的抗原为权利要求1所述的水痘
‑
带状疱疹病毒r
‑
ge融合蛋白。
[0022]
本发明还提供了一种重组水痘
‑
带状疱疹疫苗的制备方法,所述重组水痘
‑
带状疱疹疫苗为佐剂配伍水痘
‑
带状疱疹疫苗,由水痘
‑
带状疱疹病毒r
‑
ge融合蛋白与佐剂配伍而成,所述水痘
‑
带状疱疹病毒r
‑
ge融合蛋白为表达seq id no.1所示氨基酸序列的可溶蛋白形式,所述水痘
‑
带状疱疹病毒r
‑
ge融合蛋白为二聚体或多聚体形式;或者是编码seq id no.1所示氨基酸序列的dna或rna形式。
[0023]
进一步地,所述重组水痘
‑
带状疱疹疫苗由水痘
‑
带状疱疹病毒r
‑
ge融合蛋白与佐剂按一定比例混匀,然后加入保护剂混合而成。
[0024]
进一步地,所述佐剂为铝佐剂或含角鲨烯水包油佐剂或者是至少含有一种诱导机体产生免疫应答的激动剂;所述激动剂单独使用或者使用脂质体运载。
[0025]
进一步地,所述的保护剂含有一种或多种糖类化合物。
[0026]
进一步地,所述激动剂为clr受体激动剂或tlr受体激动剂或clr受体激动剂与tlr受体激动剂联合使用的clr tlr受体激动剂。
[0027]
进一步地,所述水痘
‑
带状疱疹病毒r
‑
ge融合蛋白与含有clr受体激动剂的脂质体或含有tlr受体激动剂的脂质体或含有clr tlr受体激动剂的脂质体以1:1的体积比混匀,所述水痘
‑
带状疱疹病毒r
‑
ge融合蛋白的蛋白质含量终浓度为80~120μg/ml。
[0028]
进一步地,所述重组水痘
‑
带状疱疹疫苗为重组腺病毒载体水痘
‑
带状疱疹疫苗,由权利要求1所述的水痘
‑
带状疱疹病毒r
‑
ge融合蛋白与腺病毒载体或含有tlr受体激动剂的腺病毒载体通过基因重组而成。
[0029]
本发明还提供了上述重组水痘
‑
带状疱疹疫苗或重组水痘
‑
带状疱疹疫苗的制备方法制备的重组水痘
‑
带状疱疹疫苗在制备用于预防或改善水痘
‑
带状疱疹和/或带状疱疹后神经痛的药物中的应用。
[0030]
进一步地,所述药物的给药方式包括肌肉注射、皮下注射、鼻喷、口服,及以上方式之任意组合。
[0031]
本发明还提供了一种水痘
‑
带状疱疹病毒r
‑
ge融合蛋白在制备联合疫苗中的应用,所述联合疫苗用于预防或改善呼吸道合胞病毒感染疾病和水痘
‑
带状疱疹。
[0032]
进一步地,所述联合疫苗由水痘
‑
带状疱疹病毒r
‑
ge融合蛋白和呼吸道合胞病毒融合前f蛋白(rsv pre
‑
f)混合液与佐剂配伍而成,所述水痘
‑
带状疱疹病毒r
‑
ge融合蛋白的氨基酸序列如seq id no.1所示。
[0033]
进一步地,所述佐剂为铝佐剂,或含角鲨烯水包油佐剂,或脂质体运载的佐剂,或使用病毒载体表达的佐剂。
[0034]
与现有技术相比,本发明具有以下有益效果:
[0035]
(1)本发明提供的重组水痘
‑
带状疱疹疫苗以由水痘
‑
带状疱疹病毒(vzv)糖蛋白e(ge)胞外序列与orf7蛋白片段融合表达的水痘
‑
带状疱疹病毒r
‑
ge融合蛋白为抗原,可以为佐剂配伍水痘
‑
带状疱疹疫苗或重组腺病毒载体水痘
‑
带状疱疹疫苗;其中,佐剂配伍水痘
‑
带状疱疹疫苗由水痘
‑
带状疱疹病毒r
‑
ge融合蛋白与佐剂配伍而成,重组腺病毒载体水痘
‑
带状疱疹疫苗由水痘
‑
带状疱疹病毒r
‑
ge融合蛋白与腺病毒载体或含有tlr受体激动剂的腺病毒载体通过基因重组而成,制备工艺简单;该水痘
‑
带状疱疹病毒r
‑
ge融合蛋白可以是表达的可溶蛋白,或者编码该蛋白的dna或rna序列。该佐剂可以是氢氧化铝、磷酸铝、角鲨烯水包油、脂质体运载或使用病毒载体表达的佐剂,来源广泛。该水痘
‑
带状疱疹病毒r
‑
ge融合蛋白表达后分泌至胞外,呈二聚体形式;与vzv ge蛋白单体相比,该水痘
‑
带状疱疹病毒r
‑
ge融合蛋白制剂成品后在体内产生有效且显著的细胞免疫或者体液免疫,可用于预防或改善水痘
‑
带状疱疹和/或带状疱疹后神经痛;
[0036]
(2)本发明提供的重组水痘
‑
带状疱疹疫苗可采用肌肉注射、皮下注射、鼻喷、口服等免疫方式,使用方便;
[0037]
(3)本发明提供的水痘
‑
带状疱疹病毒r
‑
ge融合蛋白可用于制备重组rsv pre
‑
f与vzv r
‑
ge联合疫苗,该联合疫苗由水痘
‑
带状疱疹病毒r
‑
ge融合蛋白与呼吸道合胞病毒pre
‑
f蛋白混合液与佐剂配伍而成,制备方法简单,联合疫苗成品可同时用于预防或改善呼吸道合胞病毒感染疾病以及水痘
‑
带状疱疹,治疗范围更广。
附图说明
[0038]
图1是本发明实施例2的vzv r
‑
ge蛋白cho细胞表达wb检测结果;
[0039]
图2是本发明实施例4的rsv pre
‑
f蛋白cho细胞表达wb检测结果;
[0040]
图3是本发明实施例5的脂质体佐剂配伍疫苗体液免疫结果;
[0041]
图4是本发明实施例5的脂质体佐剂配伍疫苗细胞免疫结果;
[0042]
图5是本发明实施例6的重组腺病毒载体疫苗体液免疫结果;
[0043]
图6是本发明实施例6的重组腺病毒载体疫苗细胞免疫结果;
[0044]
图7是本发明实施例7的重组rsv和vzv联合疫苗体液免疫结果;
[0045]
图8是本发明实施例7的重组rsv和vzv联合疫苗vzv r
‑
ge蛋白特异性细胞免疫结果。
具体实施方式
[0046]
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。下述实施例中所使用的实验方法,如无特殊说明,均为常规方法,所用的试剂、方法和设备,如无特殊说明,均为本技术领域常规试剂、方法和设备。
[0047]
本发明提供了一种重组水痘
‑
带状疱疹疫苗,以水痘
‑
带状疱疹病毒r
‑
ge融合蛋白为抗原,所述水痘
‑
带状疱疹病毒r
‑
ge融合蛋白(下述简称“r
‑
ge融合蛋白”)由水痘
‑
带状疱疹病毒糖蛋白e(vzv ge)胞外序列与orf7蛋白片段融合而成,可以使用接头(linker)连接构成,也可以不使用接头直接连接,r
‑
ge融合蛋白的氨基酸序列如下:
[0048]
mgtvnkpvvgvlmgfgiitgtlritnpvrasvlryddfhtdedkldtnsvyepyyhsdhaesswvnrgessrkaydhnspyiwprndydgflenahehhgvynqgrgidsgerlmqptqmsaqedlgddtgihviptlngddrhkivnvdqrqygdvfkgdlnpkpqgqrlievsveenhpftlrapiqriygvrytetwsflpsltctgdaapaiqhiclkhttcfqdvvvdvdcaentkedqlaeisyrfqgkkeadqpwivvntstlfdeleldppeiepgvlkvlrtekqylgvyiwnmrgsdgtstyatflvtwkgdektrnptpavtpqprgaefhmwnyhshvfsvgdtfslamhlqykiheapfdlllewlyvpidptcqpmrlystclyhpnapqclshmnsgctftsphlaqrvastvyqncehadnytayclgishmepsfglilhdggttlkfvdtpeslsglyvfvvyfnghveavaytvvstvdhfvnaieergfpptagqppattkpkeitpvnpgtspllryaawtgglamqtvcaslcgyaripteepsyeevrvnthpqgaallrlqealtavngllpapltledvvasadnt(seq id no.1)。
[0049]
重组水痘
‑
带状疱疹疫苗可采用肌肉注射、皮下注射、鼻喷、口服等免疫方式。
[0050]
重组水痘
‑
带状疱疹疫苗可为佐剂配伍水痘
‑
带状疱疹疫苗,该疫苗由r
‑
ge融合蛋白与佐剂配伍而成,具体来说,由r
‑
ge融合蛋白与佐剂按一定比例混匀,然后加入保护剂混合而成;所述r
‑
ge融合蛋白为表达seq id no.1所示氨基酸序列的可溶蛋白形式,所述r
‑
ge融合蛋白为二聚体或多聚体形式;或者是编码seq id no.1所示氨基酸序列的dna或rna形式。
[0051]
其中,佐剂可以是铝佐剂如氢氧化铝、磷酸铝,或角鲨烯水包油佐剂、也可以是脂质体佐剂或使用病毒载体表达的佐剂,该佐剂是至少含有一种诱导机体产生免疫应答的激动剂,所述激动剂可以是clr受体激动剂或tlr受体激动剂单独使用或clr受体激动剂与tlr受体激动剂联合使用(clr tlr受体激动剂),所述激动剂使用脂质体运载或病毒载体运输。
[0052]
crl受体激动剂为市售试剂,也可化学合成,包括但不限于:β
‑
1,3
‑
葡聚糖(beta
‑
1,3
‑
glucan),糠秕马拉色菌细胞壁制剂(malassezia furfur cell wall preparation),β
‑
葡糖神经酰胺(β
‑
glccer),葡糖基
‑6‑
十四烷酸(glucosyl
‑6‑
tetradecyloctadecanoate),热灭活结核分枝杆菌(heat
‑
killed mycobacterium tuberculosis),海藻糖
‑
6,6
‑
二山萮酸酯(trehalose
‑
6,6
‑
dibehenate),海藻糖
‑
6,6
‑
二霉酸酯(trehalose
‑
6,6
‑
dimycolate)等。
[0053]
tlr受体激动剂采用提取、化学合成或者细胞表达的,亦或是通过体外转录等方式获得,包括但不限于:tlr2受体激动剂(肽聚糖(pgn),脂磷壁酸(lta),酵母聚糖(zymosan),fsl
‑
1,pam3csk4等)、tlr3受体激动剂(poly(a:u),poly(i:c),双链rna)、tlr4(lps,mpla,3d
‑
mpla,kdo2
‑
lipid a(kla))、tlr5受体激动剂(鞭毛素蛋白flagellin)、tlr7/8受体激动剂(orn06/lyovec
tm
,sspolyu naked,sspolyu/lyovec
tm
,ssrna40/lyovec
tm
,ssrna41/lyovec
tm
,cl075,cl097,cl264,cl307,gardiquimod
tm
,imiquimod(r837),loxoribine,poly(dt),r848,tl8
‑
506)、tlr9受体激动剂cpg
‑
a odns(odn1585,odn2216,odn2336)、cpg
‑
b odns(odn1668,odn 1826,odn 2006,odn 2007,odn bw006,odn d
‑
sl01)、cpg
‑
c odns(odn 2395,odn m362,odn d
‑
sl03)、tlr13受体激动剂等。
[0054]
其中,保护剂应含有一种或多种糖类化合物,如:蔗糖、海藻糖、甘露醇、乳糖、葡萄
糖、麦芽糖、葡萄糖、葡聚糖等。
[0055]
重组水痘
‑
带状疱疹疫苗还可为重组腺病毒载体疫苗,由上述r
‑
ge融合蛋白与腺病毒载体或含有tlr受体激动剂的腺病毒载体通过基因重组而成。
[0056]
本发明还提供了一种联合疫苗,由r
‑
ge融合蛋白和呼吸道合胞病毒融合前f蛋白(rsv pre
‑
f)混合液与佐剂配伍而成,所述r
‑
ge融合蛋白的氨基酸序列如seq id no.1所示;所述佐剂为铝佐剂,或含角鲨烯水包油佐剂,或脂质体运载的佐剂,或使用病毒载体表达的佐剂;该联合疫苗可用于预防呼吸道合胞病毒感染疾病和水痘
‑
带状疱疹。
[0057]
实施例1r
‑
ge融合蛋白真核表达质粒构建
[0058]
一种重组水痘
‑
带状疱疹疫苗所用抗原为r
‑
ge融合蛋白形式,包括vzv ge胞外序列与orf7蛋白片段。vzv ge选择dumas株(genebank号:np_040190.1)n段胞外序列,orf7序列(genebank号:axf42671.1)选择n段氨基酸序列。r
‑
ge融合蛋白的氨基酸序列如seq id no.1所示;该蛋白理论分子量约为66kd(该蛋白表达后经过胞内修饰,实际分子量可能会增加)。
[0059]
r
‑
ge融合蛋白基因委托南京金斯瑞公司合成,交付产品为puc57质粒载体,表达框架两端分别引入hindiii和ecor1酶切位点,目的基因按cho细胞表达系统进行密码子优化;合成的目的基因连接至puc57载体,利用酶切回收,将目的基因连接至pee12.4表达载体;将重组质粒用双酶切电泳鉴定,检查插入片段大小是否正确,选择插入片段正确的克隆用于后续试验。
[0060]
重组质粒乙醇沉淀:将pee12.4
‑
r
‑
ge质粒(200μg)用hindiii限制性内切酶在30℃下反应3
‑
5h;向酶切体系中加入2.5倍体积的无水乙醇和1/10体积的3m的醋酸钠(ph值为5.2),
‑
20℃静置过夜;12000rpm离心30min,加入1ml的70%乙醇重悬;12000rpm离心15min;超净台内挥发乙醇20min,加入100μl无菌水溶解白色沉淀,即为线性化pee12.4
‑
r
‑
ge质粒。
[0061]
实施例2脂质体佐剂配伍水痘
‑
带状疱疹疫苗
[0062]
疫苗由r
‑
ge融合蛋白与含有激动剂的脂质体配制而成,具体制备方法如下。
[0063]
2.1、制备抗原蛋白
[0064]
参照《分子克隆实验指南》记载的方法,抗原r
‑
ge融合蛋白具体制备方法如下:
[0065]
s1、重组质粒的转染:将实施例1所述方法构建的pee12.4
‑
r
‑
ge质粒线性化后,利用lip2000脂质体转染至cho细胞(参照lip2000脂质体转染说明书);转染48h后,取细胞上清用western blot检测r
‑
ge融合蛋白的表达;转染48h后,取细胞上清用western blot检测r
‑
ge融合蛋白的表达;非还原性电泳经过转膜后,使用ge蛋白小鼠单克隆抗体(可购自merck公司或自制)结合,经过羊抗鼠二抗(可购自beyotime)显示。
[0066]
如图1所示vzv r
‑
ge蛋白cho细胞表达wb检测结果,其中,m:marker(10
‑
180kd),1:空白对照(cho细胞上清),2:r
‑
ge蛋白样品1,3:r
‑
ge蛋白样品2,4:vzv ge蛋白胞外片段;可见,泳道2和3中cho细胞表达的r
‑
ge蛋白分子量约为180kd,为二聚体形式;泳道4为cho细胞表达的vzvge蛋白胞外片段,分子量约在70~90kd。
[0067]
s2、将目的基因(r
‑
ge融合蛋白)转染至中国仓鼠卵巢细胞(chinese hamsters ovarycells,cho细胞,购自thermo公司),细胞生长液选用gibco公司freestyle cho表达培养基;通过有限稀释法挑选单克隆细胞,经过多轮筛选后扩大培养至细胞摇瓶后冻存;将亚克隆细胞的上清收集后,取样品进行elisa检测,比较出表达量较高的单克隆细胞,最终挑
选为优势细胞株;
[0068]
s3、重组cho细胞在复苏后经过细胞培养瓶扩增,最终传代放大至生物反应器,37℃培养8天,采用流加或者灌流的培养方式补充营养液,所述营养液为dynamis培养基;
[0069]
s4、每天取样检测r
‑
ge融合蛋白的表达情况,当其表达量达到最大值并不再变化时,收集细胞上清液,其中含有重组cho细胞分泌的r
‑
ge融合蛋白;
[0070]
s5、收集的上清培养液经过澄清、纯化后,得到纯度较高的r
‑
ge融合蛋白。
[0071]
2.2、制备含有激动剂的脂质体
[0072]
含有激动剂的脂质体采用含有clr受体激动剂的脂质体或含有clr tlr受体激动剂(clr受体激动剂与tlr受体激动剂联合使用)的脂质体,其制备方法如下:
[0073]
clr受体激动剂的脂质体:将阳离子脂质dda(双十二烷基二甲基溴化铵)和clr受体激动剂(avantipolar lipids)按照2~8:1的摩尔比在氯仿中混合,然后使用旋转蒸发器制成脂质膜;真空抽滤2h后,缓冲液水化后进行超声(探针模式)或者均质匀浆,从而制备具有更小尺寸的均匀纳米脂质体佐剂,脂质体颗粒大小应在80~200nm之间;
[0074]
其中,阳离子脂质还可选用dotap,ddab,pei,dobaq,dc
‑
胆固醇,dotma,dodma,gl67,ethyl pc等;
[0075]
clr tlr受体激动剂的脂质体,tlr受体激动剂加入含clr受体激动剂的脂质体中,混匀;
[0076]
将制备的脂质体佐剂采用相应的激动剂受体指示细胞检测,以mincle受体激动剂(clr受体激动剂的一种)和tlr
‑
3受体激动剂为例,分别与mincle hek 293和tlr3hek 293细胞培养12h后,采用指示剂显色,结果显示:脂质体佐剂分别具有相应的特异性受体活性。
[0077]
2.3、疫苗制剂的制备
[0078]
重组疫苗制剂由表1所示的原料组分配制而成,具体配制过程如下:
[0079]
将经过定检后的抗原蛋白(r
‑
ge融合蛋白)tris盐酸缓冲液稀释后,与含有激动剂的脂质体(含有crl受体激动剂或crl tlr3受体激动剂的脂质体,分别称为r
‑
ge
‑
lip
‑
crl,r
‑
ge
‑
lip
‑
crl tlr3)或铝佐剂(如磷酸铝、氢氧化铝等,本实施例使用氢氧化铝)按照1:1体积比混匀,参照表1所示的配方加入保护剂(如单糖、双糖和聚糖等,本实施例使用海藻糖)混合,得到疫苗制剂为液体或者冻干粉末,分别称为疫苗1(r
‑
ge
‑
lip
‑
crl)、疫苗2(r
‑
ge
‑
lip
‑
crl tlr3)、疫苗3(r
‑
ge
‑
alum)。每剂疫苗(0.5ml)中r
‑
ge融合蛋白终浓度为40~60μg。
[0080]
表1脂质体佐剂配伍重组疫苗制剂的配方
[0081]
成分用量(每剂)抗原蛋白r
‑
ge40~60μg佐剂0.2~0.3ml海藻糖25~50mgtris缓冲液0.2~0.3ml
[0082]
实施例3重组腺病毒载体水痘
‑
带状疱疹疫苗
[0083]
重组腺病毒载体水痘
‑
带状疱疹疫苗(重组腺病毒载体疫苗制剂)由r
‑
ge融合蛋白与腺病毒载体重组而成,记为疫苗4(r
‑
ge
‑
ad),或者由r
‑
ge融合蛋白与表达tlr受体激动剂的腺病毒载体通过重组而成,记为疫苗5(r
‑
ge
‑
r
‑
ad)。
[0084]
具体制备方法如下:
[0085]
3.1、制备带状疱疹重组腺病毒载体病毒
[0086]
实验材料及来源:r
‑
ge融合蛋白的基因序列委托市售公司合成,该蛋白的氨基酸序列如seq id no.1所示;dnapolymerase购自诺唯赞,lr重组酶购自invitrogen。
[0087]
制备方法:采用实施例1所述方法构建r
‑
ge融合蛋白基因表达质粒pee12.4
‑
r
‑
ge,将目的基因连接至自制的pentry载体上,在lr重组酶作用下,与目的载体(人5型腺病毒载体)重组形成r
‑
ge重组腺病毒载体(rad
‑
ge);
[0088]
选择paci酶切位点线性化rad
‑
ge腺病毒载体,线性化产物经乙醇沉淀后转染hek293
‑
s21细胞,得到带状疱疹重组腺病毒载体病毒。
[0089]
其中,检测及培养用hek293
‑
s21细胞为本实验自制,hek293
‑
s21细胞是使用atcc贴壁hek293细胞自行驯化的无血清悬浮293细胞,其他任何293细胞均可以达到该步骤的目的。
[0090]
3.2、水痘
‑
带状疱疹重组腺病毒载体病毒腺病毒的培养和纯化
[0091]
3.2.1、摇瓶中接种hek293
‑
s21细胞,至密度达到90%,加入适量步骤3.1制备的带状疱疹重组腺病毒载体病毒上清感染细胞;3
‑
4d后,收集所有细胞,约500g转速离心10min,弃上清,收集沉淀;
[0092]
3.2.2、以无菌0.01m pbs溶液重悬沉淀,反复冻融4次;然后在4℃下7000g离心5min,取上清,制得病毒液;
[0093]
3.2.3、cscl连续梯度离心纯化:50ml离心管中称量4.4g cscl,加入8ml病毒液,混匀,体积约为10ml;转移至12ml超速离心管(用于sw41转头)中,覆盖约2ml矿物油;平衡后,10℃下30000rpm离心18
‑
24h,用注射器抽吸离心出病毒带;
[0094]
3.2.4、病毒透析去盐:配置透析液(10mm tris ph8.0、2mm mgcl2、5%蔗糖),灭菌处理;将病毒带通过灭菌处理后的透析液在4℃透析,更换3次透析液,去除cscl,病毒保存于
‑
70℃。
[0095]
3.2.5、取样后
‑
70℃保存,从而制备得到重组腺病毒载体水痘
‑
带状疱疹疫苗制剂。
[0096]
实施例4重组rsv pre
‑
f与vzv r
‑
ge联合疫苗的制备
[0097]
4.1、rsv pre
‑
f蛋白
[0098]
s1、参照文献(mclellan js,chen m,leung s,graepel kw,du x,yang y,zhou t,baxa u,yasuda e,beaumont t,kumar a,modjarrad k,zheng z,zhao m,xia n,kwong pd,graham bs.structure of rsv fusion glycoprotein trimer bound to a prefusion
‑
specific neutralizing antibody.science.2013may 31;340(6136):1113
‑
7.doi:10.1126/science.1234914.epub 2013apr 25.pmid:23618766;pmcid:pmc4459498.)序列,抗原rsv pre
‑
f蛋白为三聚体形式,由rsv a2株pre
‑
f蛋白胞外序列与t4噬菌体纤维蛋白c
‑
端结构域组成,cho细胞表达后分泌至胞外。该蛋白单体理论分子量约为58kd,表达后经过胞内修饰,实际分子量可能会增加;
[0099]
s2、pre
‑
f融合蛋白基因委托南京金斯瑞公司合成,交付产品为puc57质粒载体,表达框架两端分别引入hindiii和ecor1酶切位点,目的基因按cho细胞表达系统进行密码子优化;合成的目的基因连接至puc57载体,利用酶切回收,将目的基因连接至pee12.4表达载体;将重组质粒用双酶切电泳鉴定,检查插入片段大小是否正确,选择插入片段正确的克隆
用于后续试验;
[0100]
s3、将表达质粒用hind iii单酶切,利用乙醇沉淀法回收线性化pee12.4
‑
pre
‑
f质粒,将此质粒用于后续转染实验;线性化质粒用1%琼脂糖凝胶电泳显示有8600bp大小的条带;将该质粒用hindiii 37℃酶切1
‑
3h,电泳显示有8600bp两条带,即质粒线性化成功;
[0101]
重组质粒乙醇沉淀:将pee12.4
‑
pre
‑
f质粒(200μg)用hindiii限制性内切酶在30℃下反应3
‑
5h;向酶切体系中加入2.5倍体积的无水乙醇和1/10体积的3m的醋酸钠(ph值为5.2),
‑
20℃静置过夜;12000rpm离心30min,加入1ml的70%乙醇重悬;12000rpm离心15min;超净台内挥发乙醇20min,加入100μl无菌水溶解白色沉淀即为线性化pee12.4
‑
pre
‑
f质粒;
[0102]
s4、重组质粒的转染:将上述pre
‑
f蛋白基因表达质粒pee12.4
‑
pre
‑
f线性化后,利用lip2000脂质体转染至cho细胞(参照lip2000脂质体转染说明书);转染48h后,取细胞上清用western blot检测pre
‑
f蛋白的表达;
[0103]
rsv pre
‑
f蛋白cho细胞表达wb检测结果如图2所示,其中,m:marker(10
‑
180kd),1:空白对照(cho细胞上清),2:pre
‑
f蛋白样品1,3:pre
‑
f蛋白样品2;可见,cho细胞表达的pre
‑
f蛋白分子量约为240kd,为三聚体形式,与rsva2病毒检测结果一致;
[0104]
s5、将目的基因(pre
‑
f蛋白)转染至cho细胞,通过有限稀释法挑选单克隆细胞,经过多轮筛选后扩大培养至细胞摇瓶后冻存;将亚克隆细胞的上清收集后,取样品进行wb检测,根据条带灰度,比较出表达量较高的单克隆细胞,最终挑选为优势细胞株;
[0105]
s6、重组cho细胞的复苏后经过细胞培养瓶扩增,最终传代放大至生物反应器,37℃培养8天,采用流加或者灌流的培养方式补充营养液,所述营养液为dynamis培养基;
[0106]
s7、每天取样检测pre
‑
f蛋白的表达情况,当其表达量达到最大值并不再变化时,收集细胞上清液,其中含有重组cho细胞分泌的pre
‑
f蛋白;
[0107]
s8、收集的上清培养液经过澄清、纯化后,得到高纯度的pre
‑
f蛋白。
[0108]
4.2、制备含有激动剂的脂质体
[0109]
参照实施例2方法制备。
[0110]
4.3、疫苗制剂的制备
[0111]
重组疫苗制剂由表2所示的原料组分配制而成,具体配制过程如下:
[0112]
分别将经过定检后的抗原蛋白pre
‑
f蛋白、r
‑
ge融合蛋白与pre
‑
f蛋白混合液(pre
‑
f/r
‑
ge)、r
‑
ge融合蛋白稀释后,与脂质体佐剂或铝佐剂(如磷酸铝、氢氧化铝等,本实施例使用氢氧化铝)按照1:1体积比混匀,参照表2所示配方加入保护剂(如单糖、双糖和聚糖等,本实施例使用海藻糖)混合,疫苗分别称为疫苗6(pre
‑
f
‑
lip
‑
crl)、疫苗7(pre
‑
f/r
‑
ge
‑
lip
‑
crl)、疫苗8(r
‑
ge
‑
lip
‑
crl)、疫苗9(pre
‑
f/r
‑
ge
‑
alum)。
[0113]
表2联合疫苗制剂的配方
[0114]
成分用量(每剂)抗原蛋白40~60μg佐剂0.2~0.3ml海藻糖25~50mgtris缓冲液0.2~0.3ml
[0115]
实施例5脂质体佐剂配伍疫苗的动物免疫试验
[0116]
材料和分组:将日龄相同、体重相近的雌性c57小鼠,随机分4组,每组8只小鼠;
[0117]
试验处理:在第0天和第28天分别肌肉注射免疫1次,其中实验组(疫苗1、疫苗2、疫苗3)每只小鼠免疫剂量分别5μg;对照组(saline)为每只小鼠注射生理盐水0.2ml;第二次免疫后第28天取血并解剖小鼠取脾脏细胞,elisa方法检测ge蛋白特异性igg抗体,elispot方法检测r
‑
ge蛋白特异性细胞免疫反应。
[0118]
5.1、elispot方法检测细胞免疫
[0119]
5.1.1、脾淋巴细胞的制备
[0120]
1)小鼠眼眶采血,血样标记后4℃过夜,第二天收集血清
‑
20℃保存;
[0121]
2)处死小鼠后取脾,在5ml hanks洗液中以纱布研磨分散细胞,转移至15ml离心管,1000rpm离心5min;
[0122]
3)弃上清,利用约100μl残留液体重悬细胞后,加入2ml红细胞裂解液,从第一管开始计时,作用4min后,每管加入5ml1640洗液终止裂解,1000rpm离心5min;
[0123]
4)弃上清,重悬细胞后,每管加入5ml1640洗液洗细胞,1000rpm离心5min;
[0124]
5)弃上清,重悬细胞后,每管加入2ml1640完全培养液,混匀后取50μl细胞悬液以pbs稀释10倍后进行细胞计数,调整淋巴细胞浓度到1
×
107/ml。
[0125]
5.1.2、elispot检测脾淋巴细胞反应水平
[0126]
1)包被:在elispot板中每孔加入包被抗体(ifn
‑
γ鼠抗、il
‑
2鼠抗,购自bd公司)50μl,用pbs补充体积至每孔100μl;elispot板用粘性盖玻片盖上以防蒸发,37℃孵育2h;
[0127]
2)elispot板的封闭:
[0128]
2.1)取出已包被过的elispot板,吸弃每孔中的包被抗体溶液;
[0129]
2.2)无菌条件下用pbst洗涤6次300μl排枪;
[0130]
2.3)在elispot板中,每孔加入200μl含1%bsa(或block buffer)的pbs,37℃封闭1h;
[0131]
3)取出37℃下封闭1h的elispot板,吸弃每孔中的封闭液;
[0132]
4)在elispot板中,加入100μl多肽(r
‑
ge肽段),最后加入100μl淋巴细胞(细胞总数为1
×
106),总体积到200μl(多肽的终浓度为5μg/ml,细胞的终浓度为1
×
107/ml,即每孔细胞总数为1
×
106);
[0133]
阴性对照不加多肽,加100μl r1640完全培养基;
[0134]
阳性对照不加多肽,加入25ng/ml的pma(丙二醇甲醚醋酸酯)2.5μl,钙离子载体ionomycin 1μl(1μg/ml);
[0135]
免疫组各设2个复孔;
[0136]
5)盖好elispot板,放入37℃co2孵箱培养30h;
[0137]
6)培养30h后,取出elispot板,甩去细胞后,每孔加入200μl的冰冷去离子水;把elispot板放置在冰浴中10min;
[0138]
7)用pbst洗涤8次洗板机;
[0139]
8)每孔加入100μl生物素标记的检测抗体;用膜封住elispot板后,把elispot板放置在37℃孵箱中孵育1h;
[0140]
9)取出elispot板,倒去检测抗体溶液,用pbst洗涤8次;
[0141]
10)每孔加入50μl gaba(γ
‑
氨基丁酸)溶液,用膜封住elispot板后,把elispot板放置在37℃孵箱中孵育1h;
[0142]
11)取出elispot板,倒去gaba溶液,用pbst洗涤8次,洗涤完毕后,在吸水纸上轻轻拍干elispot板;
[0143]
12)每孔加入30μl显色溶液,在暗处、室温下孵育15~40min;
[0144]
13)出现斑点后,用蒸馏水冲洗,终止反应;
[0145]
14)室温下避光干燥,读板仪检测。
[0146]
5.2、elisa方法检测体液免疫
[0147]
取血分离血清,elisa检测ge特异性igg抗体滴度:
[0148]
1)用纯度大于90%的抗原ge融合蛋白包被酶标板(0.1μg/ml),每孔加0.1ml,4℃过夜;次日洗涤缓冲液洗涤3次,甩尽残余液体;以抗体稀释液封闭60min,洗涤缓冲液洗涤3次,甩干后作检测,或晾干后4℃保存;
[0149]
2)加0.1ml一定抗体稀释液稀释的待检样品(从1:100开始,倍比稀释至1:51200)于上述已包被之反应孔中,置于37℃孵育60min,洗涤8次(同时做空白、阴性及阳性孔对照);其中,空白对照组为生理盐水,阴性对照组为免疫前小鼠血清,阳性对照组为vzvge免疫后阳性血清。
[0150]
3)于反应孔中,加入新鲜的1:5000抗体稀释液稀释的酶标第二抗体(抗抗体)0.1ml,37℃孵育60min,洗涤8次;
[0151]
4)加底物液显色:于各反应孔中加入临时配制的tmb底物溶液0.1ml,37℃避光反应10min;终止反应:于各反应孔中加入50μl 2m的硫酸0.05ml;
[0152]
5)结果判定:在elisa检测仪上,于450nm处(620nm为参考波长),以空白对照孔调零后测各孔od值,若大于规定的阴性对照od值的2.1倍,即为阳性。
[0153]
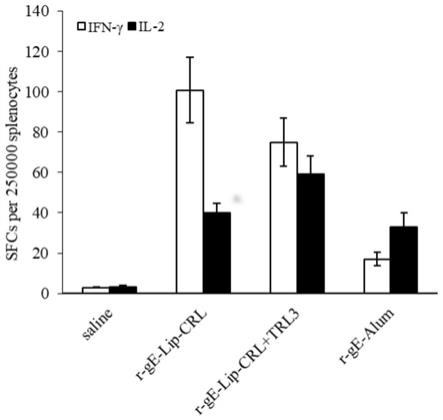
结果分析:采用elisa法检测血清中的vzv ge特异性igg水平,由图3所示体液免疫检测结果可见,3种疫苗组合(r
‑
ge
‑
lip
‑
crl、r
‑
ge
‑
lip
‑
crl tlr3、r
‑
ge
‑
alum)均能够激发小鼠体内产生足够的抗体,抗体滴度达到104以上,阳转率达到95%以上,其中含有激动剂的脂质体佐剂组(r
‑
ge
‑
lip
‑
crl、r
‑
ge
‑
lip
‑
crl tlr3)滴度高于铝佐剂配伍组(r
‑
ge
‑
alum)。
[0154]
由图4所示的细胞免疫反应结果可见,3种疫苗组合(r
‑
ge
‑
lip
‑
crl、r
‑
ge
‑
lip
‑
crl tlr3、r
‑
ge
‑
alum)均能够激发小鼠体内产生r
‑
ge蛋白特异性细胞免疫反应,其中两组含有激动剂的脂质体佐剂组(r
‑
ge
‑
lip
‑
crl、r
‑
ge
‑
lip
‑
crl tlr3)产生的细胞因子ifn
‑
g和il
‑
2水平较高。
[0155]
本发明制备的脂质体佐剂配伍水痘
‑
带状疱疹疫苗用于预防或改善水痘、带状疱疹和/或带状疱疹后神经痛。
[0156]
实施例6重组腺病毒载体疫苗的动物免疫试验
[0157]
材料和分组:将日龄相同、体重相近的雌性balb/c小鼠,随机分组,每组8只小鼠;按照实施例3制备获得的重组腺病毒疫苗4和疫苗5;
[0158]
实验组:每只小鼠免疫剂量及免疫方式分别为:疫苗4和疫苗5分别滴鼻免疫109u;
[0159]
阴性对照组(saline):肌肉注射生理盐水0.2ml;
[0160]
阳性对照:r
‑
ge蛋白组作为对照,肌肉注射5μg;
[0161]
试验处理:所用组小鼠在第
‑
14天(d
‑
14)免疫一针109vp活腺病毒,在第0天和第14天分别免疫1次;第二次免疫后第28天取血并解剖小鼠取脾脏细胞,elisa方法检测ge蛋白
特异性igg抗体,elispot方法检测r
‑
ge蛋白特异性细胞免疫反应。
[0162]
结果分析:如图5所示的体液免疫检测结果,采用elisa法检测血清中的vzv ge igg水平,可见重组腺病毒载体疫苗能够激发小鼠体内产生足够的抗体,远高于r
‑
ge蛋白组,阳转率达到90%以上。由图6所示的细胞免疫反应结果可见,小鼠通过黏膜给药能够激发小鼠体内产生足够的r
‑
ge蛋白特异性细胞免疫反应。
[0163]
本发明制备的重组腺病毒载体疫苗用于预防或改善水痘、带状疱疹和/或带状疱疹后神经痛。
[0164]
实施例7重组rsv和vzv联合疫苗动物免疫试验
[0165]
材料和分组:将日龄相同、体重相近的雌性balb/c小鼠,随机分5组,每组8只小鼠;
[0166]
试验处理:在第0天和第28天分别肌肉注射免疫1次,其中实验组每只小鼠免疫抗原剂量分别5μg;对照组为每只小鼠注射生理盐水0.2ml;第二次免疫后第28天取血并解剖小鼠取脾脏细胞,超微量荧光抗体膜抗原法(fama)检测vzv ge蛋白抗体和pre
‑
f蛋白抗体,elispot方法检测r
‑
ge蛋白特异性细胞免疫反应。
[0167]
结果分析:采用fama法检测vzv ge蛋白抗体、rsv pre
‑
f蛋白抗体,如图7所示的体液免疫检测结果,联合疫苗能够激发小鼠体内产生足够的抗体,没有出现两种抗原之间的拮抗作用,抗体阳转率均达到98%以上。由图8所示的细胞免疫反应结果可见,联合疫苗能够激发小鼠体内产生足够的r
‑
ge蛋白特异性细胞免疫反应。
[0168]
本发明制备的重组腺病毒载体疫苗用于预防或改善呼吸道合胞病毒感染疾病和水痘
‑
带状疱疹。
[0169]
以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。