1.本发明属于待测试样本中多重靶标定位检测的领域,具体涉及基于绿色溶剂及可编程寡核苷酸探针的多重定位检测多种靶标的方法。
背景技术:
2.细胞是构成生物体的基本单元;生物体所有生理功能的执行均通过各种类型细胞间通讯及其相互协作来实现。因此,阐明机体器官和组织中各个细胞发挥生物功能的分子机制十分重要。也因此在生物环境的原位背景下,表征单个细胞及组织样本的分子组成对深入探索生命活动与疾病发生机制是至关重要的。
3.免疫荧光成像技术是生物样本(如细胞或组织)中分子靶标表征的理想工具,它能够保持分子靶标在样本中的原始位置,从而获得准确的位置信息。但由于荧光团光谱重叠,荧光显微镜检测通道有限,免疫荧光方法的多重检测能力受到了限制,该方法一般只能实现3~5个靶标的检测。在国内外的研究中,已经报道了各种用于规避荧光光谱重叠限制的技术方法,包括分批次的免疫抗体染色、靶标多轮次成像的方法。但这类方法耗时较长,如每轮抗体染色孵育在常温下一般需要2小时以上,4摄氏度环境下一般需要12~16个小时,因此在实践中并未得到广泛使用。另外一类方法是同时进行针对所有待分析靶标的抗体孵育,这些抗体分别预先标记有寡核苷酸标签,以进行靶标的区分检测,然后再利用荧光探针对这些靶标的抗体进行分批次的荧光成像。该类方法每一次对其中一个或几个靶标的抗体进行检测,再通过使用甲酰胺等变性剂实现荧光探针与目标的解离,然后进行其它一个或几个靶标的检测,如此循环往复实现了不同特异性荧光探针与目标杂交结合\解离的循环过程,规避了荧光光谱重叠的限制,实现了更多靶标的检测分析。与分批次抗体染色的方法相比,这种方法提高了多靶标检测的速度,但是需要反复依赖有毒试剂进行荧光探针的解离,不利于真正实践中人员及环境保护;此外,此类方法没有信号放大过程或信号放大不足,难以对低丰度分子靶标的有效检测,尤其是当待测试样本中存在常见的荧光散射及荧光背景影响的条件下。因此,需要对现有技术进行革新,提供一种具有多重检测能力并且灵敏度高的生物样本中分子靶标检测的有效技术方法。
技术实现要素:
4.发明目的:本发明所要解决的技术问题是提供一种具有多重检测能力并且灵敏度高的生物样本中分子靶标检测的有效技术方法。
5.技术方案:为了解决上述技术问题,本发明提供了基于绿色溶剂及可编程寡核苷酸探针的多重定位检测多种靶标的方法,所述多重定位检测多种靶标的方法通过将待测靶标分别直接或间接连接特异性寡核苷酸,将与靶标连接的寡核苷酸特异性地连接对应的荧光探针,通过对荧光探针的定位检测实现对应靶标的定位分析,然后使用绿色溶剂去除已经检测过的荧光探针,然后再将其它未分析靶标上的寡核苷酸特异性地连接上对应荧光探
针,进而再次通过对荧光探针的定位检测实现其它对应靶标的定位分析。
6.其中,所述靶标是指存在于待测样本中的分析物,其中所述样本为细胞、组织、细胞提取物、组织提取物或细胞分泌物中的一种或多种;所述分析物为核酸、蛋白质、多肽、脂蛋白、糖蛋白中的一种或多种。应当理解,在分析样本之前,其包含靶标是已知的、怀疑的、未知的或不被怀疑的。
7.其中,每种靶标只与特定序列的寡核苷酸直接或间接地相互作用,其中所述间接作用是指靶标与特定的中间分子直接作用,而该中间分子连接有特定序列的寡核苷酸,其中所述中间分子是至少一种抗体、抗体片段、寡核苷酸、适配体、小分子,该中间分子具有靶标特异性。
8.其中,所述荧光探针至少包含核酸部分以及荧光信号发射部分;所述荧光探针通过直接或间接的方式杂交在所述寡核苷酸上,其中所述直接的方式是指所述荧光探针与所述寡核苷酸根据碱基互补配对原理直接杂交;所述间接的方式是指所述寡核苷酸先杂交一个中间核酸分子,该中间核酸分子再与所述荧光探针杂交,其中所述中间核酸分子是具有多段序列能与所述荧光探针杂交的一个或多个核酸分子。
9.其中,所述绿色溶剂是指能够破坏碱基互补配对氢键的甘油水溶液或甘油缓冲液,所述绿色溶剂的使用不对环境和操作人员产生化学及生物危害。
10.其中,所述寡核苷酸探针为可编程寡核苷酸探针,所有寡核苷酸探针能进行基于靶标种类的不同序列正交设计,并且能够通过核酸序列的设计增加每个所述靶标特异性寡核苷酸上可连接的荧光探针数量,以达到荧光信号增强。所述寡核苷酸可以通过至少一种核酸扩增技术进行原位延伸,形成具有多段序列能与所述荧光探针杂交的长单链核酸分子。
11.其中,所述靶标连接的寡核苷酸特异性地连接对应的荧光探针是分批次完成的,分批次通过特异性荧光探针杂交寡核苷酸完成荧光检测中,每批次分析的靶标数不大于荧光检测设备的检测通道数,其中需要完成的检测批次数由所有待分析靶标数和荧光检测设备的检测通道数共同决定,并且其中在相同批次所使用的不同荧光探针的荧光标记不同。
12.其中,所述分批次通过特异性荧光探针杂交寡核苷酸完成荧光检测中的荧光检测是指利用荧光检测设备对荧光探针发射出的荧光进行检测,并根据荧光的位置和数目对相应靶标进行定位分析。
13.其中,所述荧光检测设备是落射荧光显微镜或共聚焦显微镜。
14.具体的,本发明披露了一种高灵敏度、多重靶标定位检测的方法包括以下步骤:
15.1)使可能含有多个待测靶标(如蛋白质等生物分子)的样本(如疑似含有多个待测靶标的肿瘤细胞样本)与针对这些靶标的特异性结合物(如寡核苷酸标记抗体)结合;其中针对每一种靶标的特异性结合物连接至一个信号放大核酸链,并且其中不同特异性结合物连接至不同的信号放大核酸链;
16.2)在步骤1)之后使所述信号放大核酸链与具有互补于所述信号放大核酸链的荧光探针结合。其中,每一种信号放大核酸链与一种荧光探针结合;
17.3)在步骤2)之后将所述样本成像以检测稳定结合有所述荧光探针的信号放大核酸链的位置和数目。其中检测到稳定结合有荧光探针的信号放大核酸链表明相应靶标的存在;
18.4)在步骤3)之后去除结合在所述信号放大核酸链上的荧光探针,以使其荧光信号淬灭;
19.5)重复步骤2)
‑
4),其中每次使用一种或多种(不大于显微镜检测通道数)所述信号放大核酸链特异性的荧光探针进行分析。
20.其中,在步骤1)中所述可能含有多个待分析靶标的样本,应当理解为在分析待样本之前,其靶标是未知的、已知的、怀疑的、或不被怀疑的;特异性结合物能否结合在样本上,取决于样本中是否存在给定靶标(如当给定靶标存在于样本上,则特异性结合物能够与样本结合)。“结合在样本上”是指特异性结合物与其对应靶标结合。
21.其中,在步骤1)中所述样本是一种细胞、细胞群、组织,或它们的分泌物、提取物,所述靶标可以是核酸、蛋白质、多肽、脂蛋白、糖蛋白。
22.其中,在步骤1)中所述信号放大核酸链是至少一种单独合成或工程化的具有多个重复核苷酸序列单元的单链核酸分子,每一个“单元”均可以与至少一个荧光探针杂交结合。因此,本发明的方法是一种信号放大的检测方法,提高了低丰度靶标的检测灵敏度。
23.其中,在步骤1)中所述信号放大核酸链是至少一种含有多个核苷酸序列的功能化材料,该材料可以是一种金属离子、非金属粒子、量子点。
24.其中,在步骤1)中所述特异性结合物包含一种靶标特异性结合分子以及一种寡核苷酸片段,其中具有不同特异性的结合物包含的寡核苷酸片段不同;其中该寡核苷酸片段的功能是作为不同靶标的标签,不同的寡核苷酸片段用来区分不同的靶标;此外,该寡核苷酸片段的功能是作为一种对接链,能够与特异性的信号放大核酸链连接;其中所述特异性结合分子为抗体、抗体片段、适体、寡核苷酸或小分子。
25.其中,在步骤1)中每种特异性结合物最多只与一种待分析靶标结合,并且其中所述特异性结合物中的寡核苷酸片段只与一种信号放大核酸链结合,因此每一种信号放大核酸链对应一种待分析的靶标;其中所述信号放大核酸链只与特异性的荧光探针结合。
26.因此,在步骤3)中检测到稳定结合有所述荧光探针的信号放大核酸链表明相应靶标的存在,也因此,在步骤3)中检测到的稳定结合有所述荧光探针的信号放大核酸链的位置和数目指示了相应靶标的位置和数目。
27.其中,在步骤4)中使用绿色试剂——甘油水溶液或甘油缓冲液去除结合在所述信号放大核酸链上的荧光探针,以使其信号淬灭;其中所述绿色试剂是指在使用该试剂过程中,该试剂对操作人员及环境没有危害性。
28.其中,所述荧光探针是一种至少包含荧光信号发射部分以及寡核苷酸部分的材料;其中所述材料是至少一种金属粒子、非金属粒子、核酸、量子点,该材料是亚微尺度或纳米尺度的结构。
29.其中,所述荧光探针在特定激发光下能发射特定荧光并且能够被荧光显微镜或荧光扫描仪器检测分析;因此,在同时检测多个(不大于荧光检测设备检测通道数)靶标时,针对不同靶标的荧光探针包含的荧光标记不同,能够分别在不同特定激发光下能发射不同特定荧光,因此,可通过经标记成像材料发射的特定荧光对靶标进行区分鉴定。
30.其中,所述不同的荧光探针可以是被相同地标记,因此在步骤5)每次只使用一种所述信号放大核酸链特异性的荧光探针,也即是每次只检测一种待分析靶标。这种方法只需要单一激发波长和单一检测器的荧光显微镜或荧光扫描仪器。
31.其中,所述不同的荧光探针可以是被不同地标记,因此在步骤5)每次使用多种(不大于显微镜检测通道数)所述信号放大核酸链特异性的荧光探针,也即是每次检测多种(不大于显微镜检测通道数)待分析靶标。这种方法可以利用多种激发波长和多通道检测器的荧光显微镜或荧光扫描仪器。
32.其中,在步骤3)所述样本成像是指使用荧光检测设备进行荧光信号的成像检测,其中荧光检测设备是落射荧光显微镜或激光共聚焦显微镜。
33.其中,应当理解:在步骤1)中不同的信号放大核酸链针对不同的靶标,并且在步骤5)中每次使用一种或多种(不大于显微镜检测通道数)所述信号放大核酸链特异性的荧光探针,也即是每次检测一种或多种(不大于显微镜检测通道数)待分析靶标;若要对其它待分析靶标进行检测而当前分析的靶标数又超过了荧光检测器检测通道时,则可以通过使用绿色试剂——甘油水溶液或甘油缓冲液,去除结合在针对当前靶标的信号放大核酸链上的荧光探针,以使其信号淬灭,然后再重复进行步骤2
‑
4)。此处,所述信号淬灭的目的是为了防止当前靶标的信号影响下一轮其它靶标的检测,也因此突破荧光检测器检测通道的限制;其中所述信号淬灭实际是将经标记成像材料从结合的信号放大核酸链上解离去除,去除经标记成像材料的信号放大核酸链仍然可以再与特异性的经标记成像材料结合。因此,本发明的方法是一种基于绿色试剂及可编程寡核苷酸探针的靶标分批次检测的,高灵敏度的、多重靶标检测方法。
34.有益效果:与现有技术相比,本发明具备以下优点:本发明能够通过荧光显微镜检测超过其检测通道数的多重靶标,规避了荧光团光谱重叠及荧光显微镜检测通道有限的阻碍。与基于分批次免疫抗体染色的多重靶标检测方法相比,本方法检测时间更短,并且可以实现靶标信号放大检测,特别适合低丰度靶标的高灵敏度检测。与基于核酸标签及甲酰胺缓冲液的多重靶标检测方法相比,本方法使用的是绿色环保的甘油水溶液或甘油缓冲液,是一种人员及环境友好型的方法,并且甘油溶液破坏核酸杂交氢键的速度更快。本发明的灵敏度可以达到乳腺癌细胞系mda
‑
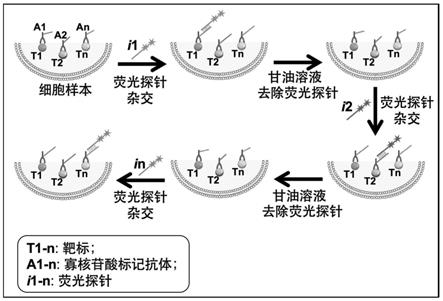
mb
‑
231的1个细胞中低丰度蛋白质上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)蛋白质的表达(其mrna一般表达量为9.899单位,数据来源于cancer cell line encyclopedia(ccle)数据库);本发明分批检测轮次至少可以达到10轮次。
附图说明
35.图1是本发明提供的一种基于甘油水溶液及荧光探针成像的细胞样本中蛋白质靶标检测的原理示意图;
36.图2是本发明提供的一种基于甘油水溶液、信号放大链及荧光探针成像的细胞样本中蛋白质靶标检测的原理示意图;
37.图3是本发明提供的一种基于甘油水溶液、核酸原位扩增技术及荧光探针成像的细胞样本中蛋白质靶标检测的原理示意图;
38.图4是在本发明中提供的待测试样本中靶标检测的一个具体实施例结果;
39.图5是在本发明中提供的基于利用丙三醇水溶液进行成像探针的解离去除以实现信号淬灭及待测试样本中靶标检测的一个具体实施例结果;
40.图6是在本发明中提供的基于利用丙三醇水溶液的待测试样本中同一个靶标经过
十轮次重复成像检测的一个具体实施例结果;
41.图7是本发明对图6待测试样本中同一个靶标十轮次重复成像检测结果量化比较分析的一个具体实施例结果。
具体实施方式
42.本发明提供了一种基于绿色溶剂及可编程寡核苷酸探针的靶标高度多重定位检测方法。此方法采用一种正交设计的寡核苷酸标签,这些标签能够通过中间物质(如链霉亲和素和/或生物素)稳定地连接在靶标特异性结合分子上(例如:抗体),以形成靶标特异性结合物;随之将这些具有不同“标签”的靶标特异性结合物与待测试样本接触并结合在对应靶标上;然后将标签连接上长单链核酸分子(如信号放大链)(参见图2)或所述“标签”原位形成长单链核酸分子(参见图3),这些长单链核酸分子能够与多个荧光探针杂交结合,然后在信号检测系统(如荧光显微镜)下检测稳定结合有荧光探针的长单链核酸分子,即可以通过它们的位置和数目反映待测试样本中特定靶标的位置和数目。此外,这些稳定结合在长单链核酸分子上的荧光能够通过本发明中的绿色试剂(如甘油溶液)去除,因此可以实现所有待测靶标分批次的检测,即由于荧光显微镜检测通道数有限,所以先对其中一个或多个(不超过荧光显微镜检测通道数)靶标进行基于所述荧光探针的检测,然后通过绿色试剂(如甘油溶液)去除杂交的荧光探针,再对其它一个或多个(不超过荧光显微镜检测通道数)靶标进行基于所述荧光探针的检测,如此循环往复,直到所有靶标全部检测完成为止。因此,本发明能够实现超过荧光显微镜检测通道数的多重靶标定位检测分析。
43.用本发明的方法可以定位检测待测试样本中(如生物样本)的多个靶标(如蛋白质、核酸)。在一些情况下,靶标是否存在待测试样本中是未知的、可疑的,一个待测试样本可能含有一种或多种待分析靶标。因此,本发明的方法可以用于确定一种或多种给定的靶标是否存在特定样本中。本发明的方法能够通过增加与靶标特异性的寡核苷酸杂交的荧光探针的数量实现靶标的信号放大检测,尤其适合低丰度靶标的高灵敏度检测。
44.本发明的方法突破了荧光显微镜检测通道的限制,通过使用绿色试剂(如甘油溶液)实现了超过荧光显微镜检测通道数的多重靶标检测通量。
45.此外,无论待测试样本中靶标位置如何、相对距离如何接近,本发明的方法均可以通过不同荧光标记的荧光探针加以区分。
46.这些方法具有在例如医疗诊断(如循环肿瘤细胞的检测与表征、分子生物学信号通路多重靶标的检测)中的适用性。
47.在本发明中,术语“靶标”可以是希望定位或定量分析的并且存在能与其结合的特异性结合分子的任何生物成分。在一些实施例中,靶标可以是工程化的或非天然存在的生物分子。此“生物分子”是由一种活体生物产生的任何分子,包括大分子,诸如蛋白质、蛋白多糖、脂质及核酸,以及小分子,诸如代谢产物以及天然产物。生物分子的实例包括但不限于:dna、rna、cdna、或经受逆转录的rna的dna产物(一般来说)。
48.在一些实施例中,一种靶标可以是一种蛋白质靶标,例如,一种细胞环境的蛋白质(例如:细胞质蛋白、细胞膜蛋白或细胞核蛋白)。蛋白质的实例包括但不限于:纤维状蛋白质;球状蛋白质,以及急性期蛋白质;血红素蛋白;细胞粘附蛋白;跨膜运输蛋白质;同向运输/反向运输蛋白质;激素和生长因子;受体;dna结合蛋白质;转录调节物;免疫系统蛋白
质;营养物储存/转运蛋白质;酶。
49.实施例1
50.(1)实验材料及试剂:
51.链霉亲和素(购自北京博奥森);人乳腺癌细胞系mda
‑
mb 231(购自上海atcc细胞库);柠檬酸盐缓冲液、磷酸缓冲盐溶液(1
×
pbs溶液,ph 7.4)(购自gibco);dmem培养基(含青霉素
‑
链霉素双抗)(购自凯基生物);无菌胎牛血清(fbs)(购自natocor
‑
industria biol
ó
gica);牛血清白蛋白(bovine serum albumin,bsa)购自(amresco);细胞培养皿(购自无锡耐思);生物素、甲酰胺、聚乙二醇叔辛基苯基醚(triton x
‑
100)(购自sigma
‑
aldrich);4
′
,6
‑
二脒基
‑2‑
苯基吲哚(dapi)(购自武汉博士德);所有探针、寡核苷酸、模板分子均由上海生工生物有限公司制备;dntps(购自北京赛百盛);rnasea,鲑鱼精dna溶液(salmon sperm dna solution)(购自赛默飞世尔);生物素化抗体anti
‑
epcam(biotin)(购自abcam);t4 dna ligase连接酶、phi29 dna polymerase聚合酶(购自new england biolabs);氯化铵、氢氧化钠(购自国药集团);实验用去离子水(出水测量值18.2mω)来自净水仪器explorer series waterpurification system(购自blue water);细胞级实验用水来自经高压灭菌的分析级实验用水;其它分子生物学实验用水(购自屈臣氏);其它试剂均为分析纯;荧光显微镜为nikon eclipse ni显微镜(购自日本尼康)。
52.寡核苷酸1:biotin
‑
aaaaa aaaaa aaaaa gagag cgaca ctatg agaca ggtga tccca tcctg agc
53.模板分子1:po4‑
gtctc atagt gtcgc tctct ga ttc gcgcc gaggt tgtct cagct ttagt ttaat acgcg ccgag gtagg gctca ggatg ggatc acct
54.荧光探针1:alexa fluor 488
‑
cgcgc cgagg t
55.(2)实验步骤、内容及条件:
56.寡核苷酸标记特异性抗体修饰:取25μl的2.5μm寡核苷酸1,与25μl的2.5μm链霉亲和素充分混合,在37℃下孵育30分钟。然后,在上述反应混合液中加入50μl的1.25μm生物素化抗体anti
‑
epcam(biotin),充分混匀,在25℃下孵育30分钟,随后加入1mm生物素,25℃下孵育20分钟,即得到寡核苷酸1标记的anti
‑
epcam抗体溶液(稀释溶液成分为:8mm na2hpo4,2mm nah2po4,150mm nacl,0.1%bsa,0.025%tween 20,ph 7.4,0.5mg/ml鲑鱼精dna,其中未在步骤1中注明出处的试剂均购自国药集团)。
57.检测人乳腺癌细胞系mda
‑
mb 231中表达的上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)蛋白质具体步骤:将人乳腺癌细胞系mda
‑
mb 231培养在玻底培养皿中,使用含10%无菌胎牛血清的dmem培养基培养,培养于95%相对湿度,5%二氧化碳气体,37℃下的无菌细胞培养箱,培养至细胞融合度30%,即得到本实施例的细胞样本。
58.取所述细胞样本,1
×
pbs润洗3次,随后使用4%多聚甲醛溶液常温孵育45分钟,然后在100mm nh4cl的1
×
pbs溶液中反应20分钟,1
×
pbs清洗5分钟;接下来在0.1%triton x
‑
100的1
×
pbs中反应2分钟,1
×
pbs溶液润洗,然后在5%bsa溶液中室温孵育2小时,并于37℃下在0.05mg/ml rnase a中反应30分钟,1
×
pbs润洗三次;加入0.1mg/ml链霉亲和素(含0.5mg/ml salmon sperm dna)于37℃下孵育30分钟,继而加入1mm生物素37℃下反应30分钟,并用1
×
pbs润洗3次。完成以上所有处理后,将所述细胞样品与寡核苷酸1标记抗体
anti
‑
epcam于4℃下过夜(14小时)孵育,第二天用含0.1%triton x
‑
100和2%bsa的1
×
pbs洗涤3次,每次持续10分钟,然后用1
×
pbs洗涤两次,每次5分钟,蒸馏水润洗一次,即得到结合了寡核苷酸1标记抗体anti
‑
epcam的细胞样品。(本部分内容所涉及试剂均在步骤1中注明)。
59.将上述结合了寡核苷酸1标记抗体anti
‑
epcam的细胞样品与100nm模板分子1接触(稀释在含2
×
柠檬酸盐缓冲液,20%甲酰胺,0.5mg/ml salmon sperm dna的溶液中),于37℃下孵育30分钟,1
×
pbs润洗三次,蒸馏水润洗一次,吸去所有液体后立即加入t4连接酶体系(50mm tris
‑
hcl,10mm mgcl2,10mm dtt,1mm atp,0.1u/μl t4 dna ligase,ph 7.5),于37℃下孵育30分钟,1
×
pbs润洗三次,蒸馏水润洗一次,吸去所有液体后立即加入phi29聚合酶体系(0.5mm dntps,0.25u/μl phi29 dna polymerase,0.2mg/ml bsa,50mm tris
‑
hcl,10mm mgcl2,10mm(nh4)2so4,4mm dtt,ph 7.5),于37℃下孵育60分钟,1
×
pbs润洗三次,蒸馏水润洗一次。加入0.5μm靶标特异性荧光探针1(稀释在含2
×
柠檬酸盐缓冲液,20%甲酰胺,0.5mg/ml salmon sperm dna的溶液中),于37℃下孵育30分钟。用含0.1%triton x
‑
100的1
×
pbs清洗10分钟,然后1
×
pbs洗涤两次,每次5分钟,随后在1μg/μl dapi溶液中孵育5分钟,然后1
×
pbs洗涤5分钟。最后通过荧光显微镜进行成像。成像结束后,加入95%的甘油水溶液,静置1分钟,1
×
pbs润洗三次,并再次通过荧光显微镜进行成像。实验结果参见图4、5及6。(本部分内容所涉及试剂均在步骤1中注明,其中所述t4连接酶体系及phi29聚合酶体系涉及的试剂购自new england biolabs)。
60.在图4中,是利用本发明的方法检测所述细胞样本(人乳腺癌细胞系mda
‑
mb 231)中表达的上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)蛋白质的结果图,其中细胞1和细胞2为所述细胞样本中的任意两个相邻的人乳腺癌细胞系mda
‑
mb 231,结果表明所述蛋白质靶标的信号呈现点状分布,并且这种信号能够明显与背景区分,尺寸在几百纳米范围内,因此本方法对靶标信号的检测不需要依赖高分辨显微镜即可进行(该结果由日本尼康nikon eclipse ni显微镜拍摄)。参见原理图3可知,图4中这种点状信号是荧光显微镜检测到的稳定结合有特异性成像探针1的单链核酸分子。应当理解,所述单链核酸分子是通过寡核苷酸1连接在寡核苷酸1标记抗体anti
‑
epcam上的,而靶标epcam与抗体anti
‑
epcam相互结合,因此,检测到来自于“结合了成像探针1的单链核酸分子”的点状信号即表明靶标上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)蛋白质在所述细胞样品(人乳腺癌细胞系mda
‑
mb 231)中的存在,也因此点状信号的位置和数量指示了靶标上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)在所述细胞样本(人乳腺癌细胞系mda
‑
mb 231)中的位置和数目,即亮点所在位置就是靶标上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)在所述细胞样本(人乳腺癌细胞系mda
‑
mb 231)中的位置,靶标上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)的数目分别为370
±
24(细胞1中)和330
±
30(细胞2中)。其中,根据国际“肿瘤细胞系百科全书(ccle)”公开的肿瘤细胞系单细胞测序数据表明,epcam(ensg00000119888.6)基因在人乳腺癌细胞系mda
‑
mb 231细胞中是低表达的,即表明本实施例测定的上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)在人乳腺癌细胞系mda
‑
mb 231细胞中是一种低丰度蛋白质。图4中结果展示出了本发明方法对该低丰度蛋白质高灵敏检测的特性,本发明的方法能够将该蛋白的信号经过信号放大转化为
易于识别的荧光亮点,通过荧光亮点计数可知该蛋白定量结果分别为370
±
24(细胞1中)和330
±
30(细胞2中)。
61.在图5中,左上为细胞核的成像图,表明细胞在样本中的具体位置及该细胞大概的亚细胞相对位置分布,左下为使用甘油水溶液之前,利用本发明的方法(原理参见图3)检测所述细胞样本(人乳腺癌细胞系mda
‑
mb 231)中表达的上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)蛋白质的结果图,结果表明所述蛋白质靶标的信号呈现点状分布,并且这种信号能够明显与背景区分,信号来自于结合了成像探针1的单链核酸分子,所述单链核酸分子是由寡核苷酸1经过核酸原位扩增延伸形成。参见图3的方法原理可知,若要实现第二批次所述寡核苷酸的检测,关键是可以通过甘油水溶液将稳定结合在所述单链核酸分子上荧光探针解离去除。因此,在该实施例中,所述细胞样本成像检测后,加入了95%的甘油水溶液,静置1分钟,1
×
pbs润洗三次,结果参见图5(右下图),由结果可知在使用了含量95%的甘油水溶液之后,样本中原本检测到的点状信号(参见图5左下)淬灭消失(参见图5右下)。通过图3的方法原理可以解释为:当分布有点状信号的样本中加入了95%的甘油水溶液后,稳定结合在所述单链核酸分子上的荧光探针的氢键作用力变弱而解离出来,1
×
pbs润洗之后,将荧光探针去除,因此信号淬灭消失。
62.利用图3中的方法原理,在图5结果的基础上,本实施例对所述细胞样本(人乳腺癌细胞系mda
‑
mb 231)中的同一个细胞(人乳腺癌细胞系mda
‑
mb 231)进行了十轮次重复成像,结果参见图6,即利用本实施例的方法对该样本中靶标上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)进行成像分析,得到图6中第一轮成像结果,然后使用95%的甘油水溶液去除荧光探针,使信号淬灭,再一次利用本实施例的方法对该样本中靶标上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)进行重复成像分析,得到图6中第二轮成像结果。再重复过程“然后使用95%的甘油水溶液去除荧光探针,使信号淬灭,再一次利用本实施例的方法对该样本中靶标上皮细胞粘附分子(epithelial cellular adhesion molecule,epcam)进行成像分析”,最终经过10轮成像得到如图6共计10轮次的成像结果。由该结果可以看到,甘油水溶液的使用并不会显著影响信号的呈现,即荧光亮点在每一轮成像中出现的位置并不会改变。此外,本实施例还对图6共计10轮次的成像结果中epcam的信号进行了量化分析,结果如图7,结果表明10次成像中epcam的信号(荧光亮点)数量并没有显著性变化,甘油水溶液的使用并不会显著影响信号(荧光亮点)数量的显著性改变。综上表明,本发明的方法使用甘油水溶液进行多批次多重靶标(泛指)成像的策略原理是能够实施的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。