1.本发明涉及小球藻,具体涉及小球藻在制备饲料添加剂、营养保健品中的应用。
背景技术:
2.小球藻,单细胞真核生物,属绿藻门(chlorophyta)、绿藻纲(chlorophyceae)、绿球藻目(chlorococcales)、卵囊藻科(oocystaceae)、小球藻属(chlorella),直径2~12um,生长繁殖速度快。目前,我国主要有蛋白核小球藻、椭圆小球藻、普通小球藻这三种小球藻,人工养殖有自养、异养、兼养和混养等多种模式。
3.小球藻营养成分丰富,含有生长因子(gcf)、蛋白质、多种矿物质元素、多种氨基酸、维生素、以及不饱和脂肪酸等多种营养物质,小球藻的类胡萝卜素有β
‑
胡萝卜素、叶黄素和虾青素。小球藻营养成分含量会因小球藻品种和培养方式不同而存在差异,魏文志等人通过在光自养模式下对7种小球藻进行营养成分分析,结果显示蛋白质含量在30.58~53.79%,其中蛋白核小球藻蛋白质含量最高,普通小球藻含量最低,而7种小球藻各氨基酸含量高低排名相似,都含有8种人体必需氨基酸,其含量在35.86~40.28%(魏文志,付立霞,&陈国宏.(2011).7种小球藻氨基酸组成及多元性分析.食品科学,32(5),254
‑
257.)。小球藻中常见的脂肪酸组成为:c14:0(肉蔻酸)、c16:0(棕榈酸)、c16:1(棕榈油酸)、c18:0(硬脂酸)、c18:1(油酸)、c18:2(共轭亚麻油酸)、c18:3(亚麻酸)等,小球藻中含有36~43%多不饱和脂肪酸,其中亚油酸占多数,其他多不饱和脂肪酸则仅以少量或微量存在(otles s,pire r.fatty acid composition of chlorella and spirulina microalgae species[j].journal of aoac international,2001,84(6):1708
‑
1714.)。
[0004]
近年来,小球藻作饲料添加剂广泛应用于畜牧、家禽、水产行业中,早在上个世纪60年代就有关于小球藻大面积生产后作家禽饲料的报道。在家鸡饲养中,日粮中添加亚麻籽和微藻可使蛋黄中α
‑
亚麻酸(ala)和二十二碳六烯酸(dha)含量增加(wu b,dong x,wei f,et al.impact of feeding flaxseed and microalgal residue on omega
‑
3fatty acids enrichment in hen eggs[j].oil crop science,2017,2(4):265
‑
271.)。在羔羊日粮中添加微藻后也有类似作用,可提高羔羊肌肉的二十二碳六烯酸(dha)和总n3脂肪酸的含量(diaz m t,perez c,sanchez c i,et al.feeding microalgae increases omega 3fatty acids of fat deposits and muscles in light lambs[j].journal of food composition and analysis,2017,56:115
‑
123.)。目前,研究人员对小球藻作为水产饲料添加剂其在生长性能、消化酶活性以及免疫等方面进行了研究,并取得了一定的进展,但小球藻对水产动物肠道微生物的影响少见研究,肠道微生物在促进宿主生长、代谢、免疫系统发育等方面起着重要作用。饲料添加剂对鱼类肠道微生物组成具有重要影响。研究小球藻作为水产饲料添加剂具有重要意义。
[0005]
本技术发明人团队从海水中分离纯化得到了一种新的纯种小球藻,并对其进行了相关的研究。
技术实现要素:
[0006]
本发明要解决的技术问题是提供一种新的小球藻在制备饲料添加剂、营养保健品中的应用。
[0007]
本发明的技术方案为:小球藻或小球藻藻粉在制备饲料添加剂或营养保健品中的应用,其中,
[0008]
所述小球藻为小球藻gb
‑
116(chlorella sp.gb
‑
116),该藻株已于2020年8月13日保存于中国典型培养物保藏中心(简称cctcc,地址:湖北省武汉市武昌区八一路299号武汉大学校内),其保藏编号为cctcc no:m 2020373;
[0009]
所述小球藻藻粉是将小球藻gb
‑
116(chlorella sp.gb
‑
116)置于异养培养基中,在23~26℃、光照强度为3500~4000lx的条件下进行培养;所得培养物经截留孔径为0.1~0.3μm的微滤膜过滤,收集截留物,干燥而得。
[0010]
上述技术方案中,所述的小球藻gb
‑
116(chlorella sp.gb
‑
116)从海水中分离得到。所述的异养培养基为改良的克氏培养基,其组成为:cacl2·
2h2o0.2~0.4g/l、feso4·
7h2o 5~25mg/l、mgso4·
7h2o 0.05~0.2g/l、nano31.5~2.5g/l、k2hpo
4 0.2~0.5g/l、酵母提取物0.5~1.5g/l、葡萄糖4~15g/l,ph=6.0~8.0。所述培养通常在生物反应器中进行,转速优选设置为120~160r/min;在培养时优选为静置培养。所述的干燥通常是在不加热条件下进行,具体可以是在15~20℃条件下自然风干,或者是采用冷冻干燥。
[0011]
上述技术方案中,所述的饲料添加剂具体可以是改善鱼肠道菌群的添加剂,或者是提高鱼免疫指标和生长性能的饲料添加剂。
[0012]
申请人发现,小球藻gb
‑
116(chlorella sp.gb
‑
116)藻株经过异养培养基培养后,该含有多种营养成分:其中总蛋白含量28.4%,多糖含量为1.29%,总脂肪含量1.1%,β
‑
胡萝卜素含量127μg/g,虾青素含量0.850μg/g,总甾醇含量0.30%;17种人体必需氨基酸,其中蛋氨酸(甲硫氨酸)含量最高,达到36.205mg/g,其次是苏氨酸、丙氨酸、亮氨酸、赖氨酸、蛋氨酸和赖氨酸;15种脂肪酸:c12:0(月桂酸)、c14:0(肉蔻酸)、c15:0(十五碳酸)、c16:0(棕榈酸)、c16:1(棕榈油酸)、c17:0(十七碳酸)、c17:1(十七碳一烯酸)、c18:0(硬脂酸)、c18:1n9c(油酸)、c18:1n9t(反式油酸)、c18:2n6t(反式亚油酸)、c18:3n3(α
‑
亚麻酸)、c18:3n6(γ
‑
亚麻酸)、c20:0(花生酸)和c24:0(二十四碳酸),其中c18:3n3(α
‑
亚麻酸)是总油脂的主要成分,其含量仅次于最高含量的c16:0(棕榈酸),为0.30552g/100g。本领域已知:c18:3n3(α
‑
亚麻酸)具有多种生理功能,如增强智力,提高记忆力,保护视力、改善睡眠;抑制血栓性疾病,预防心肌梗死和脑梗死。降低血脂、降血压等,基于此,本发明提供小球藻或小球藻藻粉在制备营养保健品或饲料添加剂中的用途。
[0013]
本发明还提供包含小球藻gb
‑
116(chlorella sp.gb
‑
116)的细胞和/或其提取物和/或其培养物的食品组合物、营养补充剂或饲料添加剂。
[0014]
申请人通过实验发现,小球藻gb
‑
116(chlorella sp.gb
‑
116)或其经异养培养基培养后所得的小球藻藻粉提高鱼免疫指标和生长性能,并且改善鱼肠道菌群,可用于制备鱼类饲料添加剂;同时,藻粉中含有多种营养成分,可用于制备营养保健品。
附图说明
[0015]
本发明涉及的小球藻gb
‑
116(chlorella sp.gb
‑
116),该藻株已于2020年8月13日
保存于中国典型培养物保藏中心(简称cctcc,地址:湖北省武汉市武昌区八一路299号武汉大学校内),其保藏编号为cctcc no:m 2020373。
[0016]
图1为本发明所述小球藻gb
‑
116(chlorella sp.gb
‑
116)在显微镜下镜检照片,放大倍数为40
×
10。
[0017]
图2为本发明所述小球藻gb
‑
116(chlorella sp.gb
‑
116)的its序列进化树。
[0018]
图3为实施例2中对小球藻gb
‑
116(chlorella sp.gb
‑
116)进行培养得到的小球藻藻粉17种水解氨基酸含量柱状图。
[0019]
图4为实施例3中肝胰脏转录组测序分析流程图。
[0020]
图5为实施例3中实验各分组在饲喂15天后体重的比较图。
[0021]
图6为实施例4中扬道菌群16s rrna测序分析流程图。
[0022]
图7为实施例4中差异物种的lda值分布柱状图。
具体实施方式
[0023]
为了更好的解释本发明的技术方案,下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。若未特别指明,实施例中所用的技术特征可以替换为具有在不背离发明构思前提下等同或相似功能或效果的其他本领域已知的技术特征。
[0024]
实施例1:小球藻gb
‑
116(chlorella sp.gb
‑
116)的分离和鉴定
[0025]
1.小球藻的分离
[0026]
将海水用无菌生理盐水稀释10倍、102倍、103倍、104倍、105倍后,各取200μl涂布于固体培养基(组成为:cacl2·
2h2o 1g/l、feso4·
7h2o 0.01g/l、mgso4·
7h2o 0.2g/l、nano
3 2g/l、k2hpo
4 0.2g/l、酵母提取物1g/l、葡萄糖4g/l、琼脂1.5%,ph=6.0~8.0),23~26℃光照强度3750lx条件下培养3~5天,利用稀释平板涂布法分离得到单藻落,挑取单藻落再经多次平板划线进行纯化;之后用灭菌牙签挑取单菌落接种于5ml异养培养基得到一种纯种小球藻。
[0027]
2.小球藻dna提取
[0028]
取对数生长期小球藻液10ml,8000r/min离心,用1.5ml无菌离心管收集小球藻,于液氮快速冻融3次,用无菌玻璃研磨棒快速研磨。小球藻dna用ctab植物基因组dna快速提取试剂盒提取(详细步骤参考“北京艾德莱公司”试剂盒说明)。
[0029]
3.小球藻its序列鉴定
[0030]
用通用引物its1:5
’‑
tccgtaggtgaacctgcgg
‑3’
(seq id no:1)和its4:5
’‑
tcctccgcttattgatatgc
‑3’
(seq id no:2)扩增真菌rdna的间隔序列(含its1区、5.8s区、its2区)。配制50μl pcr扩增体系,pcr程序设置:94℃预变性3min;循环参数为:94℃变性30s,55℃退火30s,72度延伸1min,此为35个循环;之后72℃延伸10min。取3μl进行琼脂糖凝胶电泳检测,凝胶浓度为1%,电泳缓冲液为1
×
tae缓冲液,将剩下pcr扩增产物送至苏州金唯智生物科技有限公司测序,所得its测序序列如下所示:
[0031]
cgaagtgagagcgttcggggggccgaaaccaccaccgaattcctgctaggccgccagcaaagtcccctcgggccacggcaggctgcgtagcgggtgctacctaccaagccattgccctgcaaacggggtccatgctcaagcctctacacttcagccgacccggacgcagcctgtgacaggcaacggagccgggaaggccaggtccgcactccctcagggagaggggggcgagggtgtaagccgacgctgaggcagacatgccctcggccgaagcctcgggcgcaatttgcgttcaa
agattcgatggttcacggaattctgcaattcacactacgtatcgcatttcgctgcgttcttcatcgatacgggagccaagatatccgttgttgagagttgtctttggtttgtgcggagcggacaggccgccaccgctgtttgcttcagagtggttttgtgtttggggtggattgagttggatacaaattaccagcgtcaccagccggcgagggcaaagcccaacgccggagagacgcccgccggacctgaaactgcggctcgtaagccccagccaggggaccgacgcccggcgggagccgccttagaaaaggcaggcccaaccacacgggggggacaaatggttaccagggtggattcgatcgattcaatgatccttccgcaggttcacctcgggtactcccaccaacctggtcgacaggctggctccctgggctccgggctggttaggccgttcctcccagggcaccctctcgggtgggccggactctatcttaagggcgggctctgccgcccccactgccacctagtctctgaaccttctcccacggcacgacccgtttgggagcttggctgcggattgcccaatctcagacgtttttaccatacccg(seq id no:3)。
[0032]
由its序列分子生物学鉴定结果,可以确定该菌株为小球藻(chlorella sp.),分子生物学鉴定结果表明其与亲缘关系micractinium pusillum(mk764926.1)的its序列相似性最高(相似性为98.58%,序列覆盖度为91%),与chlorella sorokiniana(kp645224.1)相似性为98.27%,序列覆盖度为90%,进化树结果表明该小球藻与micractinium pusillum(mk764926.1)在进化树中分为一支(图2),但形态上又有一定差异,我们将该藻株暂定为chlorella sp.gb
‑
116。
[0033]
实施例2:小球藻gb
‑
116(chlorella sp.gb
‑
116)的培养和藻粉的制备
[0034]
1.种子培养
[0035]
培养基:cacl2·
2h2o 0.2~0.4g/l、feso4·
7h2o 5~25mg/l、mgso4·
7h2o0.05~0.2g/l、nano31.5~2.5g/l、k2hpo
4 0.2~0.5g/l、酵母提取物0.5~1.5g/l、葡萄糖4~15g/l,琼脂1~3%,ph=6.0~8.0。在本实施例中,采用的培养基的组成为:cacl2·
2h2o 0.3g/l、feso4·
7h2o 15mg/l、mgso4·
7h2o 0.1g/l、nano
3 2g/l、k2hpo
4 0.3g/l、酵母提取物1g/l、葡萄糖8g/l、琼脂1.5%,ph=6.0~8.0,加纯净水定容至1l。在固体培养基平板上划线得到单个藻落,在23~26℃、光照强度为3500~4000lx条件下静置培养3~5天。
[0036]
2.种子的活化
[0037]
从培养基平板上挑取单个藻落,接种到5ml异养培养基上,在23~26℃、光照强度为3500~4000lx的条件下静置培养3~5天。所述异养培养基的配方为:cacl2·
2h2o 0.2~0.4g/l、feso4·
7h2o 5~25mg/l、mgso4·
7h2o 0.05~0.2g/l、nano31.5~2.5g/l、k2hpo
4 0.2~0.5g/l、酵母提取物0.5~1.5g/l、葡萄糖4~15g/l,ph=6.0~8.0。在本实施例中,异养培养基的组成为:cacl2·
2h2o0.3g/l、feso4·
7h2o 15mg/l、mgso4·
7h2o 0.1g/l、nano
3 2g/l、k2hpo40.3g/l、酵母提取物1g/l、葡萄糖8g/l;加纯净水定容到1l,ph=6.0~8.0。
[0038]
3.扩大培养
[0039]
该小球藻经过100ml
→
5l
→
1000l的顺序进行扩大培养。扩大培养条件为23~25℃、光照强度3500~4000lx条件下,采用生物反应器在120~160rpm转速下培养。
[0040]
4.小球藻藻粉的制备
[0041]
藻体浓缩:采用中空纤维微滤膜过滤的方法浓缩小球藻培养液获得小球藻藻粉。所述中空纤维膜元件为ps材质,微滤膜组件规格为:截留孔径为0.1~0.3μm,单根实际产水流量≥5000l/h、25℃,设计产水流量≥1200l/h、25℃。回收率为80~90%。
[0042]
藻体干燥:浓缩的藻体在15~20℃条件下自然风干得到小球藻藻粉。
[0043]
5.小球藻藻粉营养成分检测
[0044]
藻粉总蛋白含量检测用凯氏定氮法(参见文献1),总脂肪检测用索氏提取法(参见文献2),17种水解氨基酸、β
‑
胡萝卜素、虾青素含量检测方法用高效液相色谱法(参见文献3、4),多糖、甾醇含量检测用紫外吸收法(参见文献5、6),脂肪酸含量检测则选用气相色谱
‑
质谱法(参见文献4)。
[0045]
文献1:陈军,刘晶,杜泽鹏,等.索氏法提取植物种子粗脂肪的实验方法改进[j].轻工科技,2018,34(01):6
‑
7.
[0046]
文献2:li y,sommerfeld m,chen f,et al.effect of photon flux densities on regulation of carotenogenesis and cell viability of haematococcus pluvialis(chlorophyceae)[j].journal of applied phycology,2010,22(3):253
‑
263.
[0047]
文献3:张玲.小球藻(chlorella sorokiniana c74)的培养及活性物质的研究[d];海南大学,2015.
[0048]
文献4:wang b,zhang z,hu q,et al.cellular capacities for high
‑
light acclimation and changing lipid profiles across life cycle stages of the green alga haematococcus pluvialis[j].plos one,2014,9(9):e106679.
[0049]
文献5:柳小兰,张明,周美,等.西南红山茶茶籽中总甾醇的含量测定[j].食品科技,2017,42(01):260
‑
263.
[0050]
文献6:luo w,proschold t,bock c,et al.generic concept in chlorella
‑
related coccoid green algae(chlorophyta,trebouxiophyceae)[j].plant biology,2010,12(3):545
‑
553.
[0051]
结果表明,该藻粉的各营养成分含量如下述表1所示,其中总蛋白含量28.4%,多糖含量为1.29%,总脂肪含量1.1%,β
‑
胡萝卜素含量127μg/g,虾青素含量0.850μg/g,总甾醇含量0.30%。该小球藻粉中含有多种人体必需氨基酸,具体的种类和含量如图3所示,其中蛋氨酸(甲硫氨酸)含量最高,达到36.205mg/g,其次是苏氨酸、丙氨酸、亮氨酸、赖氨酸、蛋氨酸和赖氨酸。该小球藻粉中含有15种脂肪酸种类分别为:c12:0(月桂酸)、c14:0(肉蔻酸)、c15:0(十五碳酸)、c16:0(棕榈酸)、c16:1(棕榈油酸)、c17:0(十七碳酸)、c17:1(十七碳一烯酸)、c18:0(硬脂酸)、c18:1n9c(油酸)、c18:1n9t(反式油酸)、c18:2n6t(反式亚油酸)、c18:3n3(α
‑
亚麻酸)、c18:3n6(γ
‑
亚麻酸)、c20:0(花生酸)、c24:0(二十四碳酸),它们的含量如下述表2所示。其中c16:0(棕榈酸)含量最高,其次是c18:3n3(α
‑
亚麻酸)、c18:1n9t(反式油酸)、c18:2n6t(反式亚油酸),含量最低的是c12:0(月桂酸)。
[0052]
表1:小球藻gb
‑
116(chlorella sp.gb
‑
116)藻粉中各营养成分含量表
[0053][0054]
表2:小球藻gb
‑
116(chlorella sp.gb
‑
116)藻粉中15种脂肪酸组成及含量
[0055][0056][0057]
实施例3:小球藻gb
‑
116(chlorella sp.gb
‑
116)藻粉作为饲料添加剂可提高鱼的免疫指标。
[0058]
1.小球藻藻粉作为饲料添加剂制备水产颗粒饲料
[0059]
水产基础饲料配方:鱼粉,20g;玉米粉,14g;豆粕,30g;花生麸,10g;米糠,2.5g;面粉,12.3g;虾壳粉,5g;磷脂油,0.5g;豆油,3g;磷酸二氢钙,2g;阿尔法淀粉,0.2g;多维多矿混料,0.5g。
[0060]
对于免疫指标实验:以实施例2制备的小球藻藻粉为饲料添加剂根据配方制作三种饲料,小球藻粉藻添加量分别为0.5%(质量,下同)和2%(质量,下同),g2a组未添加小球藻粉(对照组),g2b组添加0.5%小球藻粉(试验组),g2d组添加2%小球藻粉(试验组)。准备好各种材料,用地臣双齿劲锤粉碎机将豆粕和花生麸粉碎,各组分原料过40目筛备用,之后用电子天平准确称量各原料,倒入盆中均匀混合,再加入磷脂油和豆油充分混匀,最后加入适量水混合均匀后,用地臣skj系列平模颗粒机制成粒直径2mm,长度<4mm的颗粒饲料,与室温下用电风扇风干,装入密封袋中,放于
‑
20℃储存。
[0061]
2.实验用罗非鱼
[0062]
试验罗非鱼购自钦州罗非鱼养殖场,喂养前对鱼和养殖系统进行消毒处理,先用商品饲料喂养一段时间后,再挑选体格健壮、健康活泼、规格一致的罗非鱼170尾,用对照组饲料驯养7天。随机分为3组(1个对照和2个试验组),初始体重(6.64
±
0.88)g,每组3个重复,随机分到9个规格相同的鱼桶里(每个鱼桶18条鱼)。养殖实验在北部湾大学海洋学院循环水养殖实验室进行。
[0063]
3.罗非鱼的饲喂
[0064]
室内循环水喂养罗非鱼,采用三个水循环养殖系统(各含一个水净化系统),每个养殖系统有3个桶(80cm
×
80cm),分别养殖对照组,两个试验组。每天投喂两次,时间分别为8:00和17:00,日投喂量为体重的2~3%(质量),每天记录水温、死亡条数及投喂饲料量,室温保持24℃,水温22
‑
24℃,保持鱼桶内连续不断充氧,保持溶氧量﹥5mg/l,ph=7.0~7.5,氨氮<0.04mg/l,每2天换1次水,换水量为1/3,养殖周期为4周。
[0065]
4.实验用鱼样品的采集
[0066]
基础饲料驯养结束后,养殖过程中第15天每组随机选取6尾鱼(每个桶挑选2尾),解剖取鱼肝胰脏样本放于无菌1.5ml尖底离心管中置于液氮冷冻,之后将所有样品放于超低温冰箱短暂保存。之后用干冰将样品送至天津诺禾致源生物信息科技有限公司进行转录组测序。提取rna样品时每组6条鱼,取部分肝胰腺样品两两混合提取,样品编号如表3所示,g2a组未添加小球藻粉(对照组),g2b组添加0.5%小球藻粉,g2d组添加2%小球藻粉。
[0067]
表3:各组样品编号记录表
[0068][0069][0070]
5.转录组测序分析
[0071]
肝胰脏转录组测序分析流程图如图4所示,差异基因筛选采用软件deseq2,显著性差异基因筛选阈值为padj<0.05和|log2foldchange|>0.0,clusterprofiler软件分析go功能富集和kegg通路富集分析以padj小于0.05作为显著性富集的阈值,padj为多重假设检验校正后的p值。
[0072]
结果表明,对添加了2%小球藻藻粉的实验组(g2d组)和未添加藻粉的对照组(g2a组)的差异基因进行go功能富集分析发现(padj小于0.05作为显著性富集的阈值,padj为多重假设检验校正后的p值),与对照相比,添加了2%藻粉的饲料的鱼,其肝脏中有11个与免疫相关的基因显著性富集:5个与细胞粘附有关(padj在0.001到0.006之间),2个与免疫相关(padj<0.5),富集的基因其功能主要集中在血红素结合、铁离子结合、钙离子结合、丝氨酸型内肽酶抑制剂等功能性蛋白。
[0073]
同时在各分组在初重无显著差异的情况下,饲喂15天后,不添加小球藻藻粉的对照组(w1a)体重平均值为10.16克,添加了0.5%的小球藻藻粉的组(w1b),鱼体重为15.72克,添加了2%的小球藻藻粉的组(w1c),鱼体重为15.88克;经过one
‑
way anova方法统计分析发现,w1b和w1a组的平均体重存在显著差异(p<0.05),w1c和w1a组的平均体重也存在显著差异(p<0.05),如图5所示。可见,小球藻藻粉添加到饲料中能够提高幼鱼的生长性能。
[0074]
实施例4:小球藻gb
‑
116(chlorella sp.gb
‑
116)藻粉作为饲料添加剂可改善鱼肠道菌群
[0075]
1.小球藻藻粉作为饲料添加剂制备水产颗粒饲料
[0076]
水产基础饲料配方:同实施例3。
[0077]
以实施例2制备的小球藻藻粉为饲料添加剂根据配方制作三种饲料,小球藻粉藻添加量分别为0.5%(质量,下同)和2%(质量,下同),c2a组未添加小球藻粉(对照组),c2b组添加0.5%小球藻粉(试验组),c2d组添加2%小球藻粉(试验组)。准备好各种材料,用地臣双齿劲锤粉碎机将豆粕和花生麸粉碎,各组分原料过40目筛备用,之后用电子天平准确称量各原料,倒入盆中均匀混合,再加入磷脂油和豆油充分混匀,最后加入适量水混合均匀
后,用地臣skj系列平模颗粒机制成粒直径2mm,长度<4mm的颗粒饲料,与室温下用电风扇风干,装入密封袋中,放于
‑
20℃储存。
[0078]
2.实验用罗非鱼
[0079]
试验罗非鱼购自钦州罗非鱼养殖场,喂养前对鱼和养殖系统进行消毒处理,先用商品饲料喂养一段时间后,再挑选体格健壮、健康活泼、规格一致的罗非鱼170尾,用对照组饲料驯养7天。然后将鱼随机分为3组(1个对照和2个试验组),初始体重(6.64
±
0.88)g,每组3个重复,随机分到9个规格相同的鱼桶里(每个鱼桶18条鱼)。养殖实验在北部湾大学海洋学院循环水养殖实验室进行。
[0080]
3.罗非鱼的的饲喂
[0081]
4.室内循环水喂养罗非鱼,采用三个水循环养殖系统(各含一个水净化系统),每个养殖系统有3个桶(80cm
×
80cm),分别养殖对照组,两个试验组。每天投喂两次,时间分别为8:00和17:00,日投喂量为体重的2~3%(质量),每天记录水温、死亡条数及投喂饲料量,室温保持24℃,水温22~24℃,保持鱼桶内连续不断充氧,保持溶氧量﹥5mg/l,ph=7.0~7.5,氨氮<0.04mg/l,每2天换1次水,换水量为1/3,养殖周期为4周。
[0082]
5.实验用鱼样品的采集
[0083]
养殖试验开始前,随机选5尾罗非鱼取初始肠道样品,养殖过程中,养殖中期和后期各测一次鱼体重,第15天每组随机选取6尾鱼(每个桶挑选2尾)解剖取鱼肠道内容物样本,于液氮冷冻后放置超低温冰箱短暂保存。之后用干冰将样品送至天津诺禾致源生物信息科技有限公司进行16s rrna高通量测序。初始样品、对照组以及试验组肠道最终的检测样品编号如表4所示。
[0084]
表4:各组样品编号记录表
[0085][0086]
6.罗非鱼肠道菌群16s rrna分析
[0087]
肠道样品16s rrna测序分析流程如图6所示,进行样本检测、dna提取与检测、pcr扩增及产物纯化、建库、测序等一系列操作,在基于illumina nova测序平台测序,将测序得到的原始数据经拼接、过滤处理后得到有效数据。alpha多样性指数组间差异分析进行wilcox秩和检验显著性,以p小于0.05作为显著性富集的阈值;metastat分析以p
‑
value小于0.05作为显著性富集的阈值,p
‑
value值为多重检验校正的p值;lefse分析以lda score﹥4筛选显著性差异物种的阈值。
[0088]
结果表明,采用lefse分析不同饲料组间的物种丰度数据,检测不同饲料组间的差异物种,本实验以ldascore﹥4筛选显著性差异物种,差异物种的lda值分布柱状图如图7所
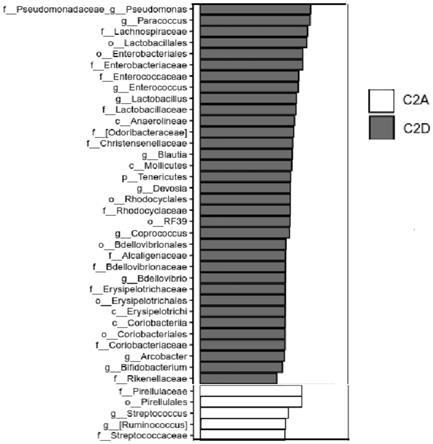
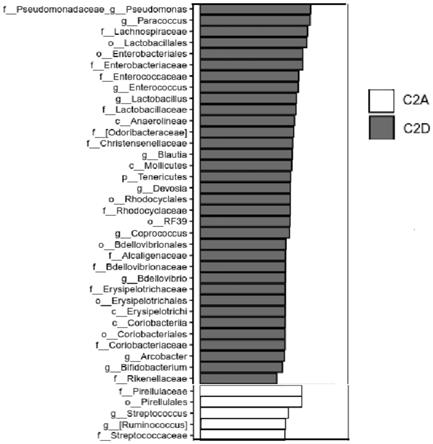
示,通过对对照组(c2a组)和添加有2%小球藻藻粉(c2d组)差异物种的lefse分析,添加了2%藻粉的饲料可以明显富集肠道益生菌,增加肠球菌(enterococcus)﹑乳酸菌(lactobacillus)﹑粪球菌(coprococcus)﹑蛭弧菌(bdellovibrio)﹑双歧杆菌属(bifidobacterium)的相对丰度。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。