1.本发明涉及医疗器械技术领域,具体而言,涉及一种药物球囊及其制备方法及药物球囊导管。
背景技术:
2.颅内动脉粥样硬化性狭窄是导致缺血性卒中的重要原因之一,支架的发明对于解决动脉粥样硬化和血管内狭窄提供了比较好的解决方案,使治疗效率大为提高,但同时出现了血管内和支架内再狭窄,对于小血管,分叉血管及原位病变等的治疗效果并不理想等缺点。目前针对再狭窄而采用的方法包括:单纯球囊的再次扩张、定向斑块旋切术、旋磨术、血管内放射治疗及重复支架植入等,现有的裸球囊和药物支架都存在一定的局限性,裸球囊的再狭窄率偏高,而药物支架对于小血管和分叉血管的治疗效果也不佳,二者均未能显示其理想的有效性或安全性。
3.药物洗脱球囊(简称deb)的出现为解决再狭窄带来了新的希望。药物洗脱球囊与des类似,本质上源于以导管为基础的局部药物输送装置理念,通过球囊携带的药物抑制内膜增生,只是携带药物的方式以及局部药物作用时间不同。德国贝朗医疗率先以紫杉醇为活性药物,碘普罗胺造影剂优维显为载体,其产品虽然在临床应用上获得了一定效果,但其表面的药物涂层呈现为大小不均的颗粒状,且在球囊表面分布不均匀,这些都导致球囊表面的粗糙度增大,进而增大了球囊表面药物涂层和血液的剪切力,导致在球囊导管输送的过程中球囊表面的药物更容易被血液冲刷掉;同时,粗糙的表面及大小不均的药物涂层颗粒,使得球囊药物涂层与病变位置接触时,产生一定的间隙,以及只有部分凸出的药物涂层颗粒可以和血管壁贴合,导致接触面积减小,从而对药物释放到血管壁上造成不利影响;并且,其球囊药物涂层为固态形式,不具有粘度,影响了药物涂层和球囊的结合力等。
4.由此,现有技术中多将治疗药物如紫杉醇药物制成结晶的形式附着在球囊表面,使得药物球囊发挥良好地治疗作用。申请号为cn201310594716.4的中国专利公开了一种药物球囊的制备方法,首先将球囊进行亲水预处理,然后将紫杉醇刷涂在球囊上或者球囊直接辊压紫杉醇药物得到药物涂层,扫描电镜照片显示该紫杉醇结晶为棍状晶体,晶体尺寸在20微米~40微米之间。然而该技术获得的紫杉醇晶体尺寸较大,结晶松散,晶体和载体之间没有牢固的结合,这种涂层的牢度不高,在药物球囊穿越和扩张过程中会有较大损失,药物利用率不高。根据公布的数据,药物球囊穿越扩张过程中约80%的药物会被血流冲走,只有不到20%会被血管吸收发挥治疗作用。而且较大的晶体尺寸意味着药物涂层可能在手术过程中产生药物颗粒,这些药物颗粒随着血液循环进入微循环系统或者毛细血管,容易造成血栓堵塞。
5.因此,如何制备出紫杉醇药物的微晶结构,并且微晶的紫杉醇药物能牢固的附着于球囊的表面上,以达到药物球囊上的药物涂层低损失、高吸收的功能,是本领域的技术人员需要解决的问题。
技术实现要素:
6.本发明的第一个目的在于提供一种药物球囊的制备方法,其可使药物以微晶结构牢固的附着于球囊的表面,以达到药物球囊上的药物低损失、高吸收的功能;
7.本发明的第二个目的在于提供一种药物球囊导管,其显著提高药物向病变血管组织的转载率的同时,实现药物的快速释放并转移药物到病变血管壁,达到优异且高效地治疗目的。
8.本发明的实施例通过以下技术方案实现:
9.一种药物球囊的制备方法,包括以下步骤:
10.s1.药物微晶:将药物与有机溶剂混合,配制药物的过饱和有机溶液,并且将药物溶液放置于容器中,使其液面高度低于1cm,然后对药物溶液依次进行冷冻处理、真空干燥处理;
11.s2.活化球囊:利用冷活性等离子体对球囊表面进行活化预处理;
12.s3.球囊膨胀:然后将活化后的球囊充气膨胀,使其在s1中容器内缓慢滚动,使药物均匀的附着于球囊的表面;
13.s4.干燥:将球囊表面干燥,然后在球囊继续滚动附着药物,继续干燥,重复至少2次,即得到所述药物球囊。
14.一种药物球囊,由上述制备方法制备得到。
15.一种药物球囊导管,包括上述制备方法制备得到的药物球囊,还包括导管,及套设在球囊外部的保护套,所述保护套将球囊密封包裹于保护套内部;且所述保护套能够沿导管轴向移动并可收缩于导管内腔,以使得所述球囊可从所述保护套中伸出。
16.本发明实施例的技术方案至少具有如下优点和有益效果:
17.1.本发明通过冷活性等离子体活化球囊表面材料,使球囊表面可形成多个均匀地附着位点,提高了药物溶液在球囊表面的附着均匀性;通过程序降温冷冻干燥的形式制备微晶结构的紫杉醇药物,保证了药物在球囊扩张时释放到靶血管的速率,提高了药物的生物利用度,增大药物的长期药效作用。
18.2.本发明通过在球囊外面密封包裹有保护套,使得球囊在到达病害部位前持续保持在密封的包裹状态,避免球囊上的药物在与靶组织接触之前被血液冲刷球囊表面的药物而造成药物的损失;在到达病害部位后,即可将保护套及时的收入到导管之中,避免保护套对血管内腔的血液流通造成堵塞;本发明药物球囊导管显著提高了药物向病变血管组织的转载率同时,实现药物的快速释放并转移药物到病变血管壁,达到优异且高效地治疗目的。
19.3.本发明制备的药物球囊在到达病害部位前利用保护套就那些防护,在倒到病害部位后利用球囊表面的微晶结构的药物,减少了药物的损失率,提高了药物的生物利用度,增大药物的长期药效作用。
附图说明
20.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
21.图1为本发明实施例3制备得到的球囊表面的紫杉醇微晶结构的扫描电镜图(2000倍);
22.图2为本发明药物球囊导管的结构示意图;
23.图3为本发明药物球囊导管的剖视图。
24.图标:1
‑
密封膜,2
‑
保护套,3
‑
导管,4
‑
牵引丝,5
‑
通口,6
‑
球囊。
具体实施方式
25.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
26.下面对本发明实施例提供的一种药物球囊及其制备方法及药物球囊导管进行具体说明。
27.一种药物球囊的制备方法,包括以下步骤:
28.s1.药物微晶:将药物与有机溶剂混合,配制药物的过饱和有机溶液,并且将药物溶液放置于容器中,使其液面高度低于1cm,然后对药物溶液依次进行冷冻处理、真空干燥处理;
29.s2.活化球囊:利用冷活性等离子体对球囊表面进行活化预处理;
30.s3.球囊膨胀:然后将活化后的球囊充气膨胀,使其在s1中容器内缓慢滚动,使药物均匀的附着于球囊的表面;
31.s4.喷涂保护层:将球囊表面干燥,然后在球囊继续滚动附着药物,继续干燥,重复至少2次,即得到所述药物球囊。
32.本发明首先通过程序降温将药物溶液冷冻干燥形成微晶形态,然后活化球囊表面使其材料具有较强的粘附性,既能保证药物牢固的粘附在球囊表面上,减少药物在输送过程中的损失,又能提高保证药物快速释放于靶血管中,增大药物的长期药效作用。
33.通过对球囊表面材料进行活化,利用压电直接放电技术产生的冷活性的低温等离子体,高效活化球囊表面材料,使球囊表面可形成多个均匀地附着位点,提高了微晶药物在球囊表面的附着均匀性;尤其是在球囊充气膨胀的过程中,同时将微晶药物进行附着,并通过压缩空气将微晶药物吹干,降低药物表面的界面张力,防止颗粒聚集生长,使得药物在球囊外表面形成更稳定地微晶结构且附着性能更强,并通过反复的滚动球囊附着药物、干燥,直至活化球囊表面的药物达到所需含量;从而使得药物涂层内表面牢固的粘附在球囊表面上,而药物涂层外表面经干燥后可形成稳定地微晶结构,解决了药物输送时的药物损失,又能保证球囊扩张后进入靶血管的药物含量,从而大大提高药物到达靶向部位后的生物可利用度,增大药物的长期药效作用;重要的是,本发明采用物理改性的方式进行药物喷涂,避免了现有技术中药物载体的使用,避免了球囊在扩张时可能出现的大量微粒堵塞毛细血管的危险,同时避免药物载体对人体可能存在的副作用。
34.进一步地,s1中,所述有机溶剂包括:乙醇,甲醇,丙酮,异丙醇,甲基乙烯基酮,二甲基亚砜,乙酸乙酯,乙腈或四氢呋喃中的一种或多种。
35.进一步地,所述药物为雷帕霉素、紫杉醇、普罗布考、西罗莫司、吡美莫司、依维莫
司中的一种或多种以任意比例组成的混合物。
36.进一步地,s1中,所述冷冻处理为:以0.5~1.0℃/min的速率,每5℃保温1~5min的速度,由室温条件下开始进行程序降温,至
‑
50~
‑
100℃后,保温20~40min。
37.进一步地,s1中,所述真空干燥处理为:在真空条件下,处理温度为
‑
110℃~10℃,干燥时间为2~24h;干燥后的药物微晶均匀的生长于容器底部。
38.进一步地,s2中,活化预处理为:使用压电直接放电技术产生的冷活性等离子体,高效活化球囊表面材料。活化预处理为:使用等离子清洗仪产生冷活性等离子体,处理球囊表面材料;其中等离子体气体为空气、n2、ar或o2,等离子气体的流量为0.005
‑
0.8l/min/cm2,放电压强为10
‑
30pa,温度为35
‑
55℃。
39.进一步地,所述等离子清洗仪的功率10
‑
30w,活化距离5
‑
40mm,活化时间30
‑
60s。
40.进一步地,s3中,将活化后的球囊分多次膨胀,每膨胀一次在容器中缓慢滚动一次附着药物。
41.进一步地,s4中,使用压缩空气将球囊表面吹干结晶。
42.一种药物球囊导管,包括由上述制备方法制备得到的药物球囊6,还包括导管3,及套设在球囊6外部的保护套2,所述保护套2将球囊6密封包裹于保护套2内部;且所述保护套2能够沿导管3轴向移动并可收缩于导管3内腔,以使得所述球囊6可从所述保护套2中露出。
43.进一步地,所述保护套2由一片状保护片围合而成,且保护片围合的两侧通过可溶性生物胶相粘附。
44.进一步地,所述保护套2的前端通过可溶性生物胶黏附有一密封膜1,所述密封膜1将所述保护套2的前端密封,优选地,密封膜1呈弧形,这样便于进入血管,且便于牵拉保护套2时,导管3将密封膜1与保护套2分离;所述保护套2的底端呈倾斜面,并通过可溶性生物胶黏附于导管3外壁面,且所述保护套2的倾斜低端连接有一牵引丝4,所述导管3一侧设置有通口5,所述牵引丝4贯穿所述通口5伸入所述导管3内腔并延伸出导管3末端。
45.进一步地,所述密封膜1由海藻酸钠水凝胶制作而成,其生物相容性及可降解性对人体无害,可被吸收。
46.进一步地,保护套2由软质材料制作而成,因此可在使用前将保护套2的两端与导管3贴合以形成更稳定地密封包覆状态。
47.需要说明的是,在使用前,药物球囊6处于收缩状态;使用时,药物球囊6导管3在导丝(图中未示出)的引导下输送至病变位置的血管腔内,在输送过程中,由于在球囊6外面包裹有保护套2,因此可将球囊6进行防护,避免球囊6上的药物在与靶组织接触之前被血液冲刷球囊6表面的药物而造成药物的损失,显著提高了药物向病变血管组织的转载率同时,实现药物的快速释放并转移药物到病变血管壁;当药物球囊6导管3上的药物球囊6到达靶病变血管后,从外端牵拉牵引丝4,使得球囊6沿导管3轴向后端移动,使得球囊6暴露在血管腔内,然后向药物球囊6内充气加压,使得药物球囊6从收缩状态转换为扩张状态,药物球囊6外表面的药物微晶紧密贴合到病变位置的血管壁,药物快速释放并转移药物到病变血管壁,达到治疗目的;
48.具体地,保护套2使用时,通过将牵引丝4向后拉,使得保护套2前端的密封膜1被导管3戳破,然后在牵拉保护套2的过程中,保护套2侧边的围合边的可溶性生物胶溶解后并张开,即可在牵拉的过程中,将保护套2由通口5处被收纳入导管3内腔中,然后将导管3取出即
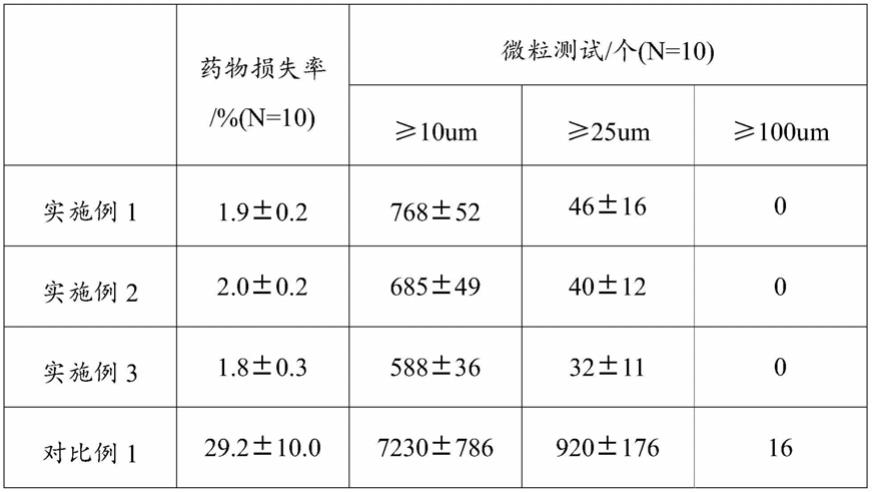
可。本发明保护套2可与导管3及球囊6贴合,使得球囊6在到达病害部位前持续保持在密封的包裹状态,避免球囊6上的药物损失,在到达病害部位后,即可将保护套2及时的收入到导管3之中,避免保护套2对血管内腔的血液流通造成堵塞。
49.实施例1
50.一种药物球囊的制备方法,包括以下步骤:
51.s1.药物微晶:将紫杉醇与乙醇混合,配制紫杉醇的过饱和有机溶液,并且将药物溶液放置于容器中,使其液面高度低于1cm,然后对药物溶液以0.5℃/min的速率,每5℃保温1min的速度进行程序降温,至
‑
50℃后,保温40min;然后在真空条件下,处理温度为10℃,干燥时间为2h;干燥后的药物微晶均匀的生长于容器底部;
52.s2.活化球囊:使用等离子清洗仪产生冷活性等离子体对球囊表面进行活化预处理,其功率10w,活化距离5mm,活化时间30s;
53.s3.球囊膨胀:然后将活化后的球囊充气膨胀,使其在s1中容器内缓慢滚动,使药物均匀的附着于球囊的表面;
54.s4.干燥:将球囊表面干燥,然后在球囊继续滚动附着药物,继续干燥,重复至少2次,即得到所述药物球囊。
55.实施例2
56.一种药物球囊的制备方法,包括以下步骤:
57.s1.药物微晶:将紫杉醇与乙醇混合,配制紫杉醇的过饱和有机溶液,并且将药物溶液放置于容器中,使其液面高度低于1cm,然后对药物溶液以1.0℃/min的速率,每5℃保温5min的速度进行程序降温,至
‑
100℃后,保温20min;然后在真空条件下,处理温度为0℃,干燥时间为24h;干燥后的药物微晶均匀的生长于容器底部;
58.s2.活化球囊:使用等离子清洗仪产生冷活性等离子体对球囊表面进行活化预处理,其功率30w,活化距离40mm,活化时间60s;
59.s3.球囊膨胀:然后将活化后的球囊充气膨胀,使其在s1中容器内缓慢滚动,使药物均匀的附着于球囊的表面;
60.s4.喷涂保护层:将球囊表面干燥,然后在球囊继续滚动附着药物,继续干燥,重复至少2次,即得到所述药物球囊。
61.实施例3
62.一种药物球囊的制备方法,包括以下步骤:
63.s1.药物微晶:将紫杉醇与乙醇混合,配制紫杉醇的过饱和有机溶液,并且将药物溶液放置于容器中,使其液面高度低于1cm,然后对药物溶液以0.8℃/min的速率,每5℃保温3min的速度进行程序降温,至
‑
70℃后,保温30min;然后在真空条件下,处理温度为5℃,干燥时间为15h;干燥后的药物微晶均匀的生长于容器底部;
64.s2.活化球囊:使用等离子清洗仪产生冷活性等离子体对球囊表面进行活化预处理,其功率20w,活化距离20mm,活化时间40s;
65.s3.球囊膨胀:然后将活化后的球囊充气膨胀,使其在s1中容器内缓慢滚动,使药物均匀的附着于球囊的表面;
66.s4.喷涂保护层:将球囊表面干燥,然后在球囊继续滚动附着药物,继续干燥,重复至少2次,即得到所述药物球囊。
67.实施例4
68.一种药物球囊导管,包括由实施例1制备得到的药物球囊,还包括导管,及套设在球囊外部的保护套;保护套由一片状保护片围合而成,且保护片围合的两侧通过可溶性生物胶相粘附;保护套的前端通过可溶性生物胶黏附有一密封膜,密封膜将保护套的前端密封;保护套的底端呈倾斜面,并通过可溶性生物胶黏附于导管侧面,且保护套的倾斜低端连接有一牵引丝,导管一侧设置有通口,牵引丝贯穿所述通口伸入导管内腔并延伸出导管末端,保护套将球囊密封包裹于保护套内部。
69.实施例5
70.一种药物球囊导管,与实施例4的区别在于:药物球囊由实施例2制备得到。
71.实施例6
72.一种药物球囊导管,与实施例4的区别在于:药物球囊由实施例3制备得到。
73.对比例1
74.本对比例与实施例6的不同之处在于:
75.药物球囊的制备方法不同,即在药物球囊制备的s1中对药物溶液没有进行冷冻处理、真空干燥处理。
76.对比例2
77.本对比例与实施例6的不同之处在于:药物球囊外没有将药物球囊包裹密封的保护套。
78.实验例1
79.利用实施例3的制备方法制备得到的球囊表面的紫杉醇微晶结构的扫描电镜图,如图1所示。
80.由图1可知:本发明药物球囊,紫杉醇药物在球囊表面上以微晶结构出现,完整均匀,无涂层的皲裂和脱落现象,可充分保证药物的释放性能。
81.实验例2:测试体外脉动模拟测试药物涂层牢固度
82.对实施例1
‑
3以及对比例1制备得到的药物球囊导管的涂层牢固度进行体外模拟评估,方法为:将实施例1
‑
3以及对比例1制备得到的药物球囊导管各10支,待用。
83.采用脉动流模拟设备,体外模拟药物球囊经受血管脉动流的作用(设备以75次/分钟的频率,控制收缩压130mmhg,舒张压80mmhg),后使用高效液相色谱仪测试(hplc)药物球囊表面残留药物含量;并收集设备中的溶液,进行微粒测试实验,检测经过模拟脉动流作用之后球囊表面药物脱层的牢固度情况。结果如表1所示:
84.表1体外脉动流模拟测试结果
[0085][0086]
由表1数据可知:本技术实施例1
‑
3的药物球囊导管的药物可稳定地附着在球囊导管表面,从而减少药物在输送过程中的损失,又能提高药物到达靶向部位后的生物可利用度,增大药物的长期药效作用。而对比例1对药物溶液没有进行冷冻处理、真空干燥处理;药物无法形成微晶结构,从而使得药物在输送过程中损失严重,降低了药物的生物可利用度。
[0087]
实验例3:测试药物的释放效果
[0088]
将上述实施例1
‑
3以及对比试验例1
‑
2的药物球囊导管分别在健康猪模型体内扩张后,通过lc/ms检测靶血管、脏器和血浆中药物含量,计算靶血管组织、主要器脏的药代动力学参数。
[0089]
实验方法:用载药密度为2μg/mm2的药物球囊在健康猪髂/股动脉扩张后,分别在术后30min、2h、7d、28d、90d时,取药物球囊治疗段、治疗段近端、治疗段远端的血管检测含药量;取重要生命器官(心、肺、肝、脾、肾)检测药物浓度;另在治疗后2h、1d、7d、28d、90d取血液,检测血浆中的药物浓度,结果如表2所示:
[0090]
表2血浆中的药物浓度(μg/g)
[0091] 2h1d7d28d90d实施例115686125.21.4实施例215490169.62.4实施例31681022212.23.6对比例1132442.80.20.031对比例2106584.23.41.02
[0092]
由表2数据可知:本发明实施例1
‑
3的药物球囊导管靶血管部位在t=2h时,药物含量到达峰值,之后迅速下降,药物在球囊表面得到更全面药物释放过程,在保护套的保护作用下,球囊表面的微晶型药物得到很好的保护,没有造成损失,且在后续的释放过程中可以发挥长期药效。而对比例1虽然有保护套的保护,但是在拿取保护套之后,球囊表面的药物由于没有结晶结构,因此在血液中迅速流失,难以持续的发挥长期药效;而对比例1由于在血管中全程没有保护套的保护,因此在血管中损失了许多,而在后续的药效释放过程中,由
于微晶结构的药物涂层,使得药效可以保持相对较好的持续释放性。
[0093]
以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。