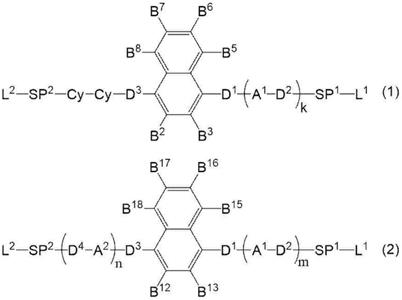
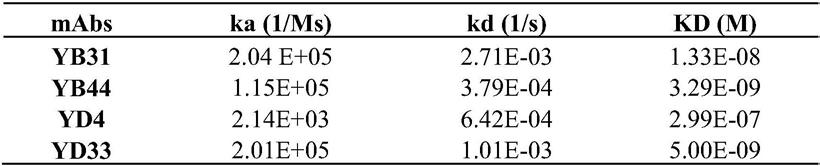
1.本发明涉及一种化合物、聚合性组合物、固化物、光学膜、偏振片及图像显示装置。
背景技术:
2.为了消除图像着色或扩大视角,在各种图像显示装置中使用光学补偿片或相位差膜等光学膜。
3.作为光学膜使用了拉伸双折射薄膜,但是近年来提出有代替拉伸双折射薄膜使用具有由液晶性化合物构成的光学各向异性层(相位差层)的光学膜。
4.作为形成这种光学各向异性层的聚合性组合物,例如在专利文献1中记载有“一种相位差层形成用聚合性液晶组合物,其含有在一个末端上具有氰基且在另一个末端上具有(甲基)丙烯酸酯的第1棒状化合物、在两个末端上具有(甲基)丙烯酸酯的第2棒状化合物及季铵盐。”([权利要求1]),作为第2棒状化合物记载有由下述式(2)表示的化合物([权利要求3])。
[0005][0006]
以往技术文献
[0007]
专利文献
[0008]
专利文献1:日本特开2013
‑
164520号公报
技术实现要素:
[0009]
发明要解决的技术课题
[0010]
本发明人等对专利文献1中所记载的聚合性组合物进行了研究的结果可知,从制造特性等观点考虑,若为了扩大显示液晶性的温度区域,进而在第2棒状化合物导入环结构,则化合物的显示液晶性的温度范围变宽,但是化合物的溶解性变差且难以抑制析出。
[0011]
因此,本发明的课题在于提供一种显示液晶性的温度区域宽且析出抑制及溶解性优异的化合物以及使用所述化合物的聚合性组合物、固化物、光学膜、偏振片及图像显示装置。
[0012]
用于解决技术课题的手段
[0013]
本发明人等为了实现上述课题进行了深入研究的结果,发现了若具有规定的结构,则成为显示液晶性的温度区域宽且析出抑制及溶解性优异的化合物,从而完成了本发明。
[0014]
即,发现了通过以下结构能够实现上述课题。
[0015]
[1]一种化合物,其由下述式(1)表示。
[0016]
[化学式1]
[0017][0018]
在此,上述式(1)中,
[0019]
a1表示可以具有取代基的芳香环或可以具有取代基的脂环。
[0020]
cy表示可以具有取代基的1,4
‑
亚环己基,2个cy可以彼此相同也可以不同。
[0021]
d1、d2及d3分别独立地表示单键或
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
、
‑
nr1‑
或者由它们中的2个以上的组合构成的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0022]
sp1及sp2分别独立地表示单键、碳原子数1~12的直链状或支链状的亚烷基或构成碳原子数1~12的直链状或支链状的亚烷基的1个以上的
‑
ch2‑
分别独立地被
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
或
‑
nr1‑
取代的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0023]
k表示1~3的整数。当k为2或3时,式中存在多个的a1及d2均可以彼此相同也可以不同。
[0024]
l1及l2分别独立地表示1价的有机基团,至少一者表示聚合性基团。
[0025]
b2、b3、b5、b6、b7及b8分别独立地表示氢原子或取代基。其中,当b2、b3、b6及b7中的至少1个表示取代基时,取代基不含有环结构。
[0026]
[2]一种化合物,其由下述式(2)表示。其中,[1]所述的化合物除外。
[0027]
[化学式2]
[0028][0029]
在此,上述式(2)中,
[0030]
a1及a2分别独立地表示可以具有取代基的芳香环或可以具有取代基的脂环。
[0031]
d1、d2、d3及d4分别独立地表示单键或
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
、
‑
nr1‑
或者由它们中的2个以上的组合构成的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0032]
sp1及sp2分别独立地表示单键、碳原子数1~12的直链状或支链状的亚烷基或构成碳原子数1~12的直链状或支链状的亚烷基的1个以上的
‑
ch2‑
分别独立地被
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
或
‑
nr1‑
取代的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0033]
m及n分别独立地表示1~3的整数,并且表示m n=3~6的整数。当m为2或3时,式中存在多个的a1及d2均可以彼此相同也可以不同。当n为2或3时,式中存在多个的a2及d4均可以彼此相同也可以不同。
[0034]
l1及l2分别独立地表示1价的有机基团,至少一者表示聚合性基团。
[0035]
b
12
、b
13
、b
15
、b
16
、b
17
及b
18
分别独立地表示氢原子或取代基。其中,当b
12
、b
13
、b
16
及b
17
中的至少1个表示取代基时,取代基不含有环结构,当b
12
及b
13
中的至少1个表示取代基时,取代基不含有
‑
cho。
[0036]
[3]根据[1]所述的化合物,其中,
[0037]
上述式(1)中的b2、b3、b5、b6、b7及b8中的至少1个表示取代基。
[0038]
[4]根据[2]所述的化合物,其中,
[0039]
上述式(2)中的b
12
、b
13
、b
15
、b
16
、b
17
及b
18
中的至少1个表示取代基。
[0040]
[5]根据[1]或[3]所述的化合物,其中,
[0041]
上述式(1)中的b5及b8中的至少1个表示取代基。
[0042]
[6]根据[2]或[4]所述的化合物,其中,
[0043]
上述式(2)中的b
15
及b
18
中的至少1个表示取代基。
[0044]
[7]根据[5]所述的化合物,其中,
[0045]
上述式(1)中的b2、b3、b6及b7表示氢原子。
[0046]
[8]根据根据[6]所述的化合物,其中,
[0047]
上述式(2)中的b
12
、b
13
、b
16
及b
17
表示氢原子。
[0048]
[9]根据[1]所述的化合物,其中,
[0049]
上述式(1)中的b2、b3、b6及b7中的至少1个表示取代基。
[0050]
[10]根据[2]所述的化合物,其中,
[0051]
上述式(2)中的b
12
、b
13
、b
16
及b
17
中的至少1个表示取代基。
[0052]
[11]根据[1]或[9]所述的化合物,其中,
[0053]
上述式(1)中的b2及b3中的至少1个表示取代基。
[0054]
[12]根据[2]或[10]所述的化合物,其中,
[0055]
上述式(2)中的b
12
及b
13
中的至少1个表示取代基。
[0056]
[13]根据[11]所述的化合物,其中,
[0057]
上述式(1)中的b5、b6、b7及b8表示氢原子。
[0058]
[14]根据[12]所述的化合物,其中,
[0059]
上述式(2)中的b
15
、b
16
、b
17
及b
18
表示氢原子。
[0060]
[15]根据[1]或[9]所述的化合物,其中,
[0061]
上述式(1)中的b6及b7中的至少1个表示取代基。
[0062]
[16]根据[2]或[10]所述的化合物,其中,
[0063]
上述式(2)中的b
16
及b
17
中的至少1个表示取代基。
[0064]
[17]根据[15]所述的化合物,其中,
[0065]
上述式(1)中的b2、b3、b5及b8表示氢原子。
[0066]
[18]根据[16]所述的化合物,其中,
[0067]
上述式(2)中的b
12
、b
13
、b
15
及b
18
表示氢原子。
[0068]
[19]根据[1]所述的化合物,其中,
[0069]
上述式(1)中的b2、b3、b5、b6、b7及b8中的至少1个表示取代基,取代基表示烷基、烷氧基、烷基羰基、烷氧基羰基、烷基羰酰氧基、烷氨基、二烷基氨基、烷基酰胺基、烯基、炔基、卤素、氰基、硝基、烷基硫醇基、n
‑
烷基氨基甲酸酯基、芳基、芳氧基、芳基羰基、芳基羰酰氧基、芳基氨基、芳基酰胺基、芳基硫醇基、n
‑
芳基氨基甲酸酯基、环烷基、环烷氧基、环烷基羰基、环烷基羰酰氧基、环烷氨基、环烷基酰胺基、环烷基硫醇基、n
‑
环烷基氨基甲酸酯基、磺酸酯基或构成烷基的1个以上的
‑
ch2‑
被
‑
o
‑
或
‑
co
‑
取代的1价的有机基团。
[0070]
[20]根据[2]所述的化合物,其中,
[0071]
上述式(2)中的b
12
、b
13
、b
15
、b
16
、b
17
及b
18
中的至少1个表示取代基,取代基表示烷基、烷氧基、烷基羰基、烷氧基羰基、烷基羰酰氧基、烷氨基、二烷基氨基、烷基酰胺基、烯基、炔基、卤素、氰基、硝基、烷基硫醇基、n
‑
烷基氨基甲酸酯基、芳基、芳氧基、芳基羰基、芳基羰酰氧基、芳基氨基、芳基酰胺基、芳基硫醇基、n
‑
芳基氨基甲酸酯基、环烷基、环烷氧基、环烷基羰基、环烷基羰酰氧基、环烷氨基、环烷基酰胺基、环烷基硫醇基、n
‑
环烷基氨基甲酸酯基、磺酸酯基或构成烷基的1个以上的
‑
ch2‑
被
‑
o
‑
或
‑
co
‑
取代的1价的有机基团。
[0072]
[21]一种聚合性组合物,其含有[1]至[20]中任一项所述的化合物。
[0073]
[22]根据[21]所述的聚合性组合物,其含有与化合物不同的聚合性液晶化合物。
[0074]
[23]根据[21]或[22]所述的聚合性组合物,其含有聚合引发剂。
[0075]
[24]一种固化物,其固化[21]至[23]中任一项所述的聚合性组合物而成。
[0076]
[25]一种光学膜,其具有[24]所述的固化物。
[0077]
[26]一种偏振片,其具有[25]所述的光学膜和起偏器。
[0078]
[27]一种图像显示装置,其具有[25]所述的光学膜或[26]所述的偏振片。
[0079]
发明效果
[0080]
根据本发明,能够提供一种显示液晶性的温度区域宽且析出抑制及溶解性优异的化合物以及使用所述化合物的聚合性组合物、固化物、光学膜、偏振片及图像显示装置。
附图说明
[0081]
图1a是表示本发明的光学膜的一例的示意性剖视图。
[0082]
图1b是表示本发明的光学膜的一例的示意性剖视图。
[0083]
图1c是表示本发明的光学膜的一例的示意性剖视图。
具体实施方式
[0084]
以下,对本发明进行详细说明。
[0085]
以下所记载的构成要件的说明有时是基于本发明的代表性实施方式来进行的,但本发明并不限定于这种实施方式。
[0086]
另外,本说明书中,使用“~”来表示的数值范围是指将“~”的前后所记载的数值作为下限值及上限值而包含的范围。
[0087]
并且,本说明书中,各成分可以使用单独1种与各成分对应的物质,也可以同时使用2种以上。在此,在关于各成分同时使用2种以上的物质的情况下,关于该成分的含量除非另有说明,则是指同时使用的物质的合计的含量。
[0088]
[化合物]
[0089]
本发明的化合物为由下述式(1)表示的化合物(以下,也简称为“化合物(1)”。)或从由下述式(2)表示的化合物去除由下述式(1)表示的化合物的化合物(以下,也简称为“化合物(2)”。)。
[0090]
[化学式3]
[0091][0092][0093]
本发明中,如上所述,具有由上述式(1)或(2)表示的结构的化合物成为显示液晶性的温度区域宽且析出抑制及溶解性优异的化合物。
[0094]
虽然其详细内容尚不明确,但是本发明人等推测如下。
[0095]
即,认为通过在分子中央(纤芯)具有在1,4
‑
位具有侧链结构的萘骨架,纤芯的相互作用变强且分子之间的堆叠性提高,因此显示液晶性的上限温度变高且温度区域变宽。并且,认为通过确定具有萘骨架所具有的取代基时的取代基的种类,溶解性变得良好且抑制析出。
[0096]
以下,对化合物(i)及化合物(ii)进行详细说明。
[0097]
〔化合物(1)〕
[0098]
化合物(1)为由下述式(1)表示的化合物。
[0099]
[化学式4]
[0100][0101]
上述式(1)中,a1表示可以具有取代基的芳香环或可以具有取代基的脂环。
[0102]
并且,上述式(1)中,cy表示可以具有取代基的1,4
‑
亚环己基,2个cy可以彼此相同也可以不同。
[0103]
并且,上述式(1)中,d1、d2及d3分别独立地表示单键或
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
、
‑
nr1‑
或者由它们中的2个以上的组合构成的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0104]
并且,上述式(1)中,sp1及sp2分别独立地表示单键、碳原子数1~12的直链状或支链状的亚烷基或构成碳原子数1~12的直链状或支链状的亚烷基的1个以上的
‑
ch2‑
分别独立地被
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
或
‑
nr1‑
取代的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0105]
并且,上述式(1)中,k表示1~3的整数。当k为2或3时,式中存在多个的a1及d2均可以彼此相同也可以不同,
[0106]
并且,上述式(1)中,l1及l2分别独立地表示1价的有机基团,至少一者表示聚合性基团。
[0107]
并且,上述式(1)中,b2、b3、b5、b6、b7及b8分别独立地表示氢原子或取代基。其中,当b2、b3、b6及b7中的至少1个表示取代基时,取代基不含有环结构。
[0108]
上述式(1)中,作为a1的一方式所表示的芳香环,例如可举出苯环、萘环、蒽环及菲咯啉环等芳香族烃环;呋喃环、噻吩环、吡咯环、噁唑环、异噁唑环、噁二唑环、噻唑环、异噻唑环、噻二唑环、咪唑环、吡唑环、三唑环、呋咱环、四唑环、吡啶环、哒嗪环、嘧啶环、吡嗪环、三嗪(triazine)环、四嗪环及苯并噻唑环等芳香族杂环。其中,优选苯环(例如,1,4
‑
苯基等)。
[0109]
并且,作为a1的一方式所表示的脂环,例如可举出环己烷环、环戊烷环、环辛烷环、环十二烷环、环二十二烷环等环烷烃环。其中,优选环己烷环(例如,1,4
‑
亚环己基等)。
[0110]
并且,关于a1,作为芳香环或脂环可以具有的取代基,例如可举出烷基、烷氧基、卤素原子等。
[0111]
作为烷基,例如优选碳原子数1~18的直链状、分支链状或环状的烷基,更优选碳原子数1~8的烷基(例如,甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、环己基等),进一步优选碳原子数1~4的烷基,尤其优选甲基或乙基。
[0112]
作为烷氧基,例如优选碳原子数1~18的烷氧基,更优选碳原子数1~8的烷氧基(例如,甲氧基、乙氧基、正丁氧基、甲氧基乙氧基等),进一步优选碳原子数1~4的烷氧基,尤其优选甲氧基或乙氧基。
[0113]
作为卤素原子,例如可举出氟原子、氯原子、溴原子、碘原子等,其中,优选氟原子、氯原子。
[0114]
本发明中,上述式(1)中的a1优选为脂环,更优选为环烷烃环,进一步优选为环己烷环,尤其优选为1,4
‑
亚环己基。
[0115]
上述式(1)中,d1、d2及d3分别独立地表示单键或
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
、
‑
nr1‑
或者由它们中的2个以上的组合构成的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0116]
这些之中,从变得容易合成的理由考虑,优选为单键、
‑
co
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
co
‑
nh
‑
或
‑
nh
‑
co
‑
,更优选为
‑
coo
‑
或
‑
oco
‑
。
[0117]
并且,当k为2时,存在于2个a1之间的d2优选为单键。
[0118]
并且,当k为3时,存在于多个a1之间的d2优选为至少1个为单键。
[0119]
上述式(1)中,作为sp1及sp2的一方式所表示的碳原子数1~12的直链状或支链状的亚烷基,例如可优选举出亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基、甲基亚己基、亚庚基等。
[0120]
并且,如上所述,sp1及sp2可以为构成碳原子数1~12的直链状或支链状的亚烷基的1个以上的
‑
ch2‑
分别独立地被
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
或
‑
nr1‑
取代的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。其中,被取代的对象的
‑
ch2‑
并不是构成亚烷基的所有的
‑
ch2‑
。并且,当
‑
ch2‑
被
‑
o
‑
取代时,连续的2个
‑
ch2‑
不会被
‑
o
‑
取代。
[0121]
上述式(1)中,k表示1~3的整数,优选为2或3,更优选为2。另外,当k为2或3时,式中存在多个的a1及d2均可以彼此相同也可以不同。
[0122]
上述式(1)中,作为l1及l2所示的1价的有机基团,例如,能够举出烷基、芳基、杂芳基等。烷基可以是直链状、支链状或环状,但是优选直链状。烷基的碳原子数优选1~30,更优选1~20,进一步优选1~10。并且,芳基可以是单环,也可以是多环,但是优选单环。芳基的碳原子数优选6~25,更优选6~10。并且,杂芳基可以是单环,也可以是多环。构成杂芳基的杂原子的数量优选1~3。构成杂芳基的杂原子优选氮原子、硫原子、氧原子。杂芳基的碳原子数优选6~18,更优选6~12。并且,烷基、芳基及杂芳基可以未经取代,也可以具有取代基。作为取代基,可举出与上述式(1)中的a1可以具有的取代基相同的取代基。
[0123]
上述式(1)中,l1及l2的至少一者所表示的聚合性基团,并无特别限定,但是优选能够进行自由基聚合或阳离子聚合的聚合性基团。
[0124]
作为自由基聚合性基团,能够使用众所周知的自由基聚合性基团,作为优选的自由基聚合性基团,能够举出丙烯酰基或甲基丙烯酰基。已知在该情况下,通常丙烯酰基的聚合速度快,从提高生产率的观点考虑,优选丙烯酰基,但是甲基丙烯酰基也能够同样地用作聚合性基团。
[0125]
作为阳离子聚合性基团,能够使用众所周知的阳离子聚合性,具体而言,能够举出脂环式醚基、环状缩醛基、环状内酯基、环状硫醚基、螺环原酸酯基及乙烯氧基等。其中,优选脂环式醚基或乙烯氧基,尤其优选环氧基、氧杂环丁基或乙烯氧基。
[0126]
作为尤其优选的聚合性基团的例子,可举出下述。
[0127]
[化学式5]
[0128][0129]
这些之中,从耐久性变得良好的理由考虑,上述式(1)中的l1及l2优选为均为聚合性基团,更优选为丙烯酰基或甲基丙烯酰基。
[0130]
上述式(1)中,b2、b3、b5、b6、b7及b8分别独立地表示氢原子或取代基。其中,当b2、b3、b6及b7中的至少1个表示取代基时,取代基不含有环结构。
[0131]
本发明中,从析出抑制及溶解性变得更良好的理由考虑,优选上述式(1)中的b2、b3、b5、b6、b7及b8中的至少1个表示取代基(以下,也简称为“取代基b”。)。
[0132]
在此,作为上述取代基b,例如可举出烷基、烷氧基、烷基羰基、烷氧基羰基、烷基羰
酰氧基、烷氨基、二烷基氨基、烷基酰胺基、烯基、炔基、卤原子、氰基、硝基、烷基硫醇基、n
‑
烷基氨基甲酸酯基、芳基、芳氧基、芳基羰基、芳基羰酰氧基、芳基氨基、芳基酰胺基、芳基硫醇基、n
‑
芳基氨基甲酸酯基、环烷基、环烷氧基、环烷基羰基、环烷基羰酰氧基、环烷氨基、环烷基酰胺基、环烷基硫醇基、n
‑
环烷基氨基甲酸酯基、磺酸酯基或构成烷基的1个以上的
‑
ch2‑
被
‑
o
‑
或
‑
co
‑
取代的1价的有机基团等。
[0133]
另外,当b2、b3、b6及b7中的至少1个为取代基时,取代基不含有环结构,因此作为上述取代基b,例如可举出烷基、烷氧基、烷基羰基、烷氧基羰基、烷基羰酰氧基、烷氨基、二烷基氨基、烷基酰胺基、烯基、炔基、卤原子、氰基、硝基、烷基硫醇基、n
‑
烷基氨基甲酸酯基或构成烷基的1个以上的
‑
ch2‑
被
‑
o
‑
或
‑
co
‑
取代的1价的有机基团等。
[0134]
本发明中,上述取代基b的例示中,优选为烷基、烷氧基、烷氧基羰基或烷基羰酰氧基。
[0135]
作为烷基,例如优选碳原子数1~18的直链状、分支链状或环状的烷基,更优选碳原子数1~8的烷基(例如,甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、环己基等),进一步优选碳原子数1~4的烷基,尤其优选甲基或乙基。
[0136]
作为烷氧基,例如优选碳原子数1~18的烷氧基,更优选碳原子数1~8的烷氧基(例如,甲氧基、乙氧基、正丁氧基、甲氧基乙氧基等),进一步优选碳原子数1~4的烷氧基,尤其优选甲氧基或乙氧基。
[0137]
作为烷氧基羰基,可举出上述中例示的氧基羰基(
‑
o
‑
co
‑
基)与烷基键合的基团,例如优选甲氧基羰基、乙氧基羰基、正丙氧基羰基、异丙氧基羰基,更优选甲氧基羰基。
[0138]
作为烷基羰酰氧基,可举出上述中例示的羰氧基(
‑
co
‑
o
‑
基)与烷基键合的基团,例如优选甲基羰氧基、乙基羰氧基、正丙基羰氧基、异丙基羰氧基,更优选甲基羰氧基。
[0139]
本发明中,从析出抑制及溶解性变得尤其良好的理由考虑,优选上述式(1)中的b5及b8中的至少1个表示取代基,并且,此时更优选上述式(1)中的b2、b3、b6及b7表示氢原子。
[0140]
本发明中,从析出抑制及溶解性变得更良好的理由考虑,优选上述式(1)中的b2、b3、b6及b7中的至少1个表示取代基。
[0141]
本发明中,从析出抑制及溶解性变得进一步良好的理由考虑,优选上述式(1)中的b2及b3中的至少1个表示取代基,并且,此时更优选上述式(1)中的b5、b6、b7及b8表示氢原子。
[0142]
本发明中,从析出抑制及溶解性变得进一步良好的理由考虑,优选上述式(1)中的b6及b7中的至少1个表示取代基,并且,此时更优选上述式(1)中的b2、b3、b5及b8表示氢原子。
[0143]
作为化合物(1)的具体例,可举出由下述式表示的化合物(1
‑
1)~化合物(1
‑
17)。另外,化合物(1
‑
14)的结构中,与丙烯酰氧基邻接的基团表示亚丙基(甲基经亚乙基取代的基团),因此化合物1
‑
14表示甲基的位置不同的位置异构体的混合物。
[0144]
[化学式6]
[0145][0146]
[化学式7]
[0147][0148]
[化学式8]
[0149][0150]
[化学式9]
[0151][0152]
[化学式10]
[0153][0154]
[化学式11]
[0155][0156]
〔化合物(2)〕
[0157]
化合物(2)为从由下述式(2)表示的化合物去除由上述式(1)表示的化合物的化合物。换言之,本说明书中,将与上述式(1)对应的化合物设为化合物(1),将不与上述式(1)对应且与下述式(2)对应的化合物设为化合物(2)。
[0158]
[化学式12]
[0159][0160]
上述式(2)中,a1及a2分别独立地表示可以具有取代基的芳香环或可以具有取代基的脂环。
[0161]
并且,上述式(2)中,d1、d2、d3及d4分别独立地表示单键或
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
、
‑
nr1‑
或者由它们中的2个以上的组合构成的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0162]
并且,上述式(2)中,sp1及sp2分别独立地表示单键、碳原子数1~12的直链状或支链状的亚烷基或构成碳原子数1~12的直链状或支链状的亚烷基的1个以上的
‑
ch2‑
分别独
立地被
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
或
‑
nr1‑
取代的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0163]
并且,上述式(2)中,m及n分别独立地表示1~3的整数,并且表示m n=3~6的整数。当m为2或3时,式中存在多个的a1及d2均可以彼此相同也可以不同,当n为2或3时,式中存在多个的a2及d4均可以彼此相同也可以不同,
[0164]
并且,上述式(2)中,l1及l2分别独立地表示1价的有机基团,至少一者表示聚合性基团。
[0165]
并且,上述式(2)中,b
12
、b
13
、b
15
、b
16
、b
17
及b
18
分别独立地表示氢原子或取代基。其中,当b
12
、b
13
、b
16
及b
17
中的至少1个表示取代基时,取代基不含有环结构,当b
12
及b
13
中的至少1个表示取代基时,取代基不含有
‑
cho。
[0166]
上述式(2)中,a1及a2与上述式(1)中说明的a1相同。另外,上述式(2)中的a1及a2的优选方式也优选为上述式(1)中的a1的优选方式、即并不限定于脂环的芳香环。
[0167]
上述式(2)中,d1、d2、d3及d4表示单键或
‑
o
‑
、
‑
co
‑
、
‑
s
‑
、
‑
c(=s)
‑
、
‑
cr1r2‑
、
‑
cr1=cr2‑
、
‑
nr1‑
或者由它们中的2个以上的组合构成的2价的连接基,r1及r2分别独立地表示氢原子、氟原子或碳原子数1~4的烷基。
[0168]
这些之中,从变得容易合成的理由考虑,优选为单键、
‑
co
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
co
‑
nh
‑
或
‑
nh
‑
co
‑
,更优选为
‑
coo
‑
或
‑
oco
‑
。
[0169]
并且,当m为2或3时,存在于多个a1之间的d2优选为
‑
coo
‑
或
‑
oco
‑
。
[0170]
并且,当n为2或3时,存在于多个a2之间的d4优选为
‑
coo
‑
或
‑
oco
‑
。
[0171]
上述式(2)中,sp1及sp2与上述式(1)中说明的sp1及sp2相同。
[0172]
上述式(1)中,k、m及n分别独立地表示1~3的整数,并且表示m n=3~6的整数。
[0173]
m及n分别独立地优选为2或3,更优选为2。另外,当m为2或3时,式中存在多个的a1及d2均可以彼此相同也可以不同。同样地,当n为2或3时,式中存在多个的a2及d4均可以彼此相同也可以不同。
[0174]
上述式(2)中,l1及l2与上述式(1)中说明的l1及l2相同。
[0175]
上述式(2)中,b
12
、b
13
、b
15
、b
16
、b
17
及b
18
分别独立地表示氢原子或取代基。其中,当b
12
、b
13
、b
16
及b
17
中的至少1个表示取代基时,取代基不含有环结构,当b
12
及b
13
中的至少1个表示取代基时,取代基不含有
‑
cho。
[0176]
本发明中,从析出抑制及溶解性变得更良好的理由考虑,优选上述式(2)中的b
12
、b
13
、b
15
、b
16
、b
17
及b
18
中的至少1个表示取代基。
[0177]
在此,作为上述取代基,可举出与上述式(1)中的b1等中说明的取代基b相同的取代基。
[0178]
另外,当b
12
、b
13
、b
16
及b
17
中的至少1个为取代基时,取代基不含有环结构,因此作为上述取代基,例如可举出烷基、烷氧基、烷基羰基、烷氧基羰基、烷基羰酰氧基、烷氨基、二烷基氨基、烷基酰胺基、烯基、炔基、卤原子、氰基、硝基、烷基硫醇基、n
‑
烷基氨基甲酸酯基、磺酸酯基或构成烷基的1个以上的
‑
ch2‑
被
‑
o
‑
或
‑
co
‑
取代的1价的有机基团等。
[0179]
本发明中,从析出抑制及溶解性变得尤其良好的理由考虑,优选上述式(2)中的b
15
及b
18
中的至少1个表示取代基,并且,此时更优选上述式(2)中的b
12
、b
13
、b
16
及b
17
表示氢原子。
[0180]
本发明中,从析出抑制及溶解性变得更良好的理由考虑,优选上述式(2)中的b
12
、b
13
、b
16
及b
17
中的至少1个表示取代基。
[0181]
本发明中,从析出抑制及溶解性变得进一步良好的理由考虑,优选上述式(2)中的b
12
及b
13
中的至少1个表示取代基,并且,此时更优选上述式(2)中的b
15
、b
16
、b
17
及b
18
表示氢原子。
[0182]
本发明中,从析出抑制及溶解性变得进一步良好的理由考虑,优选上述式(2)中的b
16
及b
17
中的至少1个表示取代基,并且,此时更优选上述式(2)中的b
12
、b
13
、b
15
及b
18
表示氢原子。
[0183]
作为化合物(2)的具体例,可举出由下述式表示的化合物(2
‑
1)~化合物(2
‑
2)。
[0184]
[化学式13]
[0185][0186][0187][0188]
[聚合性组合物]
[0189]
本发明的聚合性组合物为含有上述本发明的化合物的聚合性组合物。
[0190]
〔聚合性液晶化合物〕
[0191]
本发明的聚合性组合物优选含有与上述本发明的化合物不同的聚合性液晶化合物。
[0192]
在此,聚合性液晶化合物是指具有聚合性基团的液晶化合物。
[0193]
通常,液晶化合物能够根据其形状分为棒状类型和圆盘状类型。而且,分别具有低分子和高分子类型。高分子通常是指聚合度为100以上的高分子(高分子物理
·
相变动力学,土井正男著,第2页,岩波书店,1992)。
[0194]
本发明中,还能够使用任一液晶化合物,但是优选使用棒状液晶性化合物或盘状液晶性化合物,更优选使用棒状液晶性化合物。
[0195]
从上述液晶化合物的固定化的观点考虑,聚合性液晶化合物优选在一个分子中具有2个以上聚合性基团。
[0196]
聚合性基团的种类并无特别限制,优选能够进行加成聚合反应的官能团,优选聚合性烯属不饱和基团或环聚合性基团。更具体而言,可优选举出丙烯酰基、甲基丙烯酰基、乙烯基、苯乙烯基、烯丙基等,更优选丙烯酰基、甲基丙烯酰基。
[0197]
作为棒状液晶性化合物,例如能够优选使用日本特表平11
‑
513019号公报的权利要求1或日本特开2005
‑
289980号公报的[0026]至[0098]段中所记载的化合物,作为盘状液晶性化合物,例如能够优选使用日本特开2007
‑
108732号公报的[0020]至[0067]段、日本特开2010
‑
244038号公报的[0013]至[0108]段中所记载的化合物,但是并不限定于这些。
[0198]
在本发明中,作为上述聚合性液晶化合物,能够使用逆波长色散性液晶化合物。
[0199]
在此,本说明书中,“逆波长色散性”液晶化合物是指,在测定使用该化合物制作的相位差膜的特定波长(可见光范围)中的面内延迟(re)值时,随着测定波长变大,re值相等或变高。
[0200]
并且,逆波长色散性液晶化合物只要为如上述那样能够形成逆波长色散性薄膜的化合物,则并无特别限定,例如能够使用日本特开2008
‑
297210号公报中所记载的由通式(i)表示的化合物(尤其,[0034]至[0039]段中所记载的化合物)、日本特开2010
‑
084032号公报中所记载的由通式(1)表示的化合物(尤其,[0067]至[0073]段中所记载的化合物)、日本特开2016
‑
053709号公报中所记载的由通式(ii)表示的化合物(尤其,[0036]至[0043]段中所记载的化合物)及日本特开2016
‑
081035公报中所记载的由通式(1)表示的化合物(尤其,[0043]至[0055]段中所记载的化合物)等。
[0201]
并且,从提高逆波长色散性的理由考虑,作为上述聚合性液晶化合物,可优选举出由下述式(1)~(10)表示的化合物,具体而言,作为由下述式(1)~(10)中的k(侧链结构),可分别举出具有下述表1及表2所示的侧链结构的化合物。
[0202]
另外,下述表1及表2中,k的侧链结构所示的“*”表示与芳香环的键合位置。
[0203]
并且,由下述表1中的1
‑
2及下述表2中的2
‑
2表示的侧链结构中,分别与丙烯酰氧基及甲基丙烯酰基邻接的基团表示亚丙基(甲基经亚乙基取代的基团),且表示甲基的位置不同的位置异构体的混合物。
[0204]
[化学式14]
[0205][0206]
[表1]
[0207][0208]
[表2]
[0209][0210]
〔聚合引发剂〕
[0211]
优选本发明的聚合性组合物含有聚合引发剂。
[0212]
优选所使用的聚合引发剂为通过紫外线照射而能够引发聚合反应的光聚合引发剂。
[0213]
作为光聚合引发剂,例如可举出α
‑
羰基化合物(记载于美国专利第2367661号、美国专利第2367670号的各说明书)、偶姻醚(记载于美国专利第2448828号说明书)、α
‑
烃取代芳香族偶姻化合物(记载于美国专利第2722512号说明书)、多核醌化合物(记载于美国专利第3046127号、美国专利第2951758号的各说明书)、三芳基咪唑二聚体和对氨基苯基酮的组合(记载于美国专利第3549367号说明书)、吖啶及吩嗪化合物(记载于日本特开昭60
‑
105667号公报、美国专利第4239850号说明书)及噁二唑化合物(记载于美国专利第4212970号说明书)、酰基膦氧化合物(记载于日本特公昭63
‑
40799号公报、日本特公平5
‑
29234号公报、日本特开平10
‑
95788号公报、日本特开平10
‑
29997号公报)等。
[0214]
并且,本发明中,聚合引发剂也优选为肟型聚合引发剂,作为其具体例,可举出国际公开第2017/170443号的[0049]~[0052]段中所记载的引发剂。
[0215]
〔溶剂〕
[0216]
从形成后述的本发明的固化物(例如,光学各向异性层)的操作性等观点考虑,本发明的聚合性组合物优选含有溶剂。
[0217]
作为溶剂,具体而言,例如可举出酮类(例如,丙酮、2
‑
丁酮、甲基异丁基酮、环己酮、环戊酮等)、醚类(例如,二噁烷、四氢呋喃等)、脂肪族烃类(例如,己烷等)、脂环式烃类(例如,环己烷等)、芳香族烃类(例如,甲苯、二甲苯、三甲苯等)、卤代碳类(例如,二氯甲烷、二氯乙烷、二氯苯、氯甲苯等)、酯类(例如,乙酸甲酯、乙酸乙酯、乙酸丁酯等)、水、醇类(例如,乙醇、异丙醇、丁醇、环己醇等)、溶纤剂类(例如,甲基溶纤剂、乙基溶纤剂等)、溶纤剂乙酸酯类、亚砜类(例如,二甲基亚砜等)、酰胺类(例如,二甲基甲酰胺、二甲基乙酰胺等)等,可以单独使用它们中的1种,也可以同时使用2种以上。
[0218]
〔流平剂〕
[0219]
从将后述的本发明的固化物的表面保持为平滑并且容易进行取向控制的观点考虑,本发明的聚合性组合物优选含有流平剂。
[0220]
作为这种流平剂,从相对于添加量的流平效果高的理由考虑,优选氟系流平剂或硅系流平剂,从不易引起渗出(起霜、渗漏)的观点考虑,更优选氟系流平剂。
[0221]
作为流平剂,具体而言,例如可举出日本特开2007
‑
069471号公报的[0079]~[0102]段中所记载的化合物、日本特开2013
‑
047204号公报中所记载的由通式(i)表示的化合物(尤其,[0020]~[0032]段中所记载的化合物)、日本特开2012
‑
211306号公报中所记载的由通式(i)表示的化合物(尤其,[0022]~[0029]段中所记载的化合物)、日本特开2002
‑
129162号公报中所记载的由通式(i)表示的液晶取向促进剂(尤其,[0076]~[0078]及[0082]~[0084]段中所记载的化合物)、日本特开2005
‑
099248号公报中所记载的由通式(i)、(ii)及(iii)表示的化合物(尤其,[0092]~[0096]段中所记载的化合物)等。另外,可以兼备作为后述的取向控制剂的功能。
[0222]
〔取向控制剂〕
[0223]
根据需要,本发明的聚合性组合物能够含有取向控制剂。
[0224]
通过取向控制剂,除了均匀取向以外,还能够形成垂直取向(vertical取向)、倾斜取向、混合取向、胆甾醇取向等各种取向状态,并且,能够更均匀且更精密地控制并实现特定的取向状态。
[0225]
作为促进均匀取向的取向控制剂,例如能够使用低分子的取向控制剂或高分子的
取向控制剂。
[0226]
作为低分子的取向控制剂,例如能够参考日本特开2002
‑
20363号公报的[0009]~[0083]段、日本特开2006
‑
106662号公报的[0111]~[0120]段、及日本特开2012
‑
211306公报的[0021]~[0029]段的记载,且该内容被编入本技术说明书中。
[0227]
并且,作为高分子的取向控制剂,例如能够参考日本特开2004
‑
198511号公报的[0021]~[0057]段、及日本特开2006
‑
106662号公报的[0121]~[0167]段,且该内容被编入本技术说明书中。
[0228]
并且,作为形成或促进垂直取向的取向控制剂,例如可举出硼酸化合物、鎓盐化合物,具体而言,能够参考日本特开2008
‑
225281号公报的[0023]~[0032]段、日本特开2012
‑
208397号公报的[0052]~[0058]段、日本特开2008
‑
026730号公报的[0024]~[0055]段、日本特开2016
‑
193869号公报的[0043]~[0055]段等中所记载的化合物,且该内容被编入本技术说明书中。
[0229]
另一方面,关于胆甾醇取向,能够通过在本发明的组合物中加入手性剂来实现,且能够根据其手性方向来控制胆甾醇取向的回旋方向。
[0230]
另外,能够根据手性剂的取向限制力来控制胆甾醇取向的间距。
[0231]
相对于组合物中的总固体成分质量,含有取向控制剂时的含量优选为0.01~10质量%,更优选为0.05~5质量%。若含量在该范围内,则能够获得实现所期望的取向状态,并且没有析出、相分离、取向缺陷等,而均匀且高透明性的固化物。
[0232]
这些取向控制剂还能够赋予聚合性官能团、尤其能够赋予能够与本发明的组合物中所包含的化合物(i)聚合的聚合性官能团。
[0233]
〔其他成分〕
[0234]
本发明的聚合性组合物还可以含有除了上述成分以外的成分,例如可举出表面活性剂、倾斜角控制剂、取向助剂、增塑剂及交联剂等。
[0235]
[固化物]
[0236]
本发明的固化物为固化上述本发明的聚合性组合物而成的固化物。
[0237]
在此,在本发明的聚合性组合物例如与上述化合物(i)一同含有与化合物(i)不同的聚合性液晶化合物的情况下,通过聚合本发明的聚合性组合物,能够以固化物形式形成光学各向异性层。
[0238]
作为固化物的形成方法,例如可举出使用上述本发明的聚合性组合物制成所期望的取向状态之后,通过聚合进行固定化的方法等。
[0239]
在此,聚合条件并无特别限定,但是通过光照射的聚合中,优选使用紫外线。照射量优选为10mj/cm2~50j/cm2,更优选为20mj/cm2~5j/cm2,进一步优选为30mj/cm2~3j/cm2,尤其优选为50~1000mj/cm2。并且,为了促进聚合反应,可以在加热条件下实施。
[0240]
另外,本发明中,固化物能够形成于后述的本发明的光学膜中的任意的支撑体上、后述的本发明的偏振片中的起偏器上。
[0241]
本发明的固化物优选为满足下述式(i)的光学各向异性层。
[0242]
0.50<re(450)/re(550)<1.00
……
(i)
[0243]
其中,上述式(i)中,re(450)表示光学各向异性层的波长450nm下的面内延迟,re(550)表示光学各向异性层的波长550nm下的面内延迟。另外,在本说明书中,在未指定延迟
的测定波长的情况下,测定波长设为550nm。
[0244]
并且,面内延迟及厚度方向的延迟的值是指使用axoscan opmf
‑
1(opto science,inc.制造)并使用测定波长的光测定的值。
[0245]
具体而言,用axoscan opmf
‑
1输入平均折射率((nx ny nz)/3)及膜厚(d(μm)),由此计算
[0246]
慢轴方向(
°
)
[0247]
re(λ)=r0(λ)
[0248]
rth(λ)=((nx ny)/2
‑
nz)
×
d。
[0249]
另外,r0(λ)显示为利用axoscan opmf
‑
1计算的数值,但是指re(λ)。
[0250]
并且,这种光学各向异性层优选为正a板或正c板,更优选为正a板。
[0251]
在此,正a板(positive a plate)和正c板(positive c plate)定义为如下。
[0252]
当将薄膜面内的慢轴方向(面内的折射率最大的方向)的折射率设为nx,将在面内与面内的慢轴正交的方向的折射率设为ny,将厚度方向的折射率设为nz时,正a板满足式(a1)的关系,正c板满足式(c1)的关系。另外,正a板的rth表示正值,正c板的rth表示负值。
[0253]
式(a1)nx>ny≈nz
[0254]
式(c1)nz>nx≈ny
[0255]
另外,所谓上述“≈”,不仅包含两者完全相同的情况,还包含两者实质上相同的情况。
[0256]
所谓“实质上相同”,在正a板中,例如,即使在(ny
‑
nz)
×
d(其中,d为薄膜的厚度)为
‑
10~10nm、优选为
‑
5~5nm的情况下也包含于“ny≈nz”中,即使在(nx
‑
nz)
×
d为
‑
10~10nm、优选为
‑
5~5nm的情况下也包含于“nx≈nz”中。并且,在正c板中,例如,即使在(nx
‑
ny)
×
d(其中,d为薄膜的厚度)为0~10nm、优选为0~5nm的情况下也包含于“nx≈ny”中。
[0257]
在光学各向异性层为正a板的情况下,从作为λ/4板发挥作用的观点考虑,re(550)优选为100~180nm,更优选为120~160nm,进一步优选为130~150nm,尤其优选为130~140nm。
[0258]
在此,“λ/4板”是指具有λ/4功能的板,具体而言,是指具有将某一特定的波长的直线偏振光转换为圆偏振光(或将圆偏振光转换为直线偏振光)的功能的板。
[0259]
[光学膜]
[0260]
本发明的光学膜为具有本发明的固化物的光学膜。
[0261]
图1a、图1b及图1c(以下,在无需特别区分这些附图的情况下,简称为“图1”。)分别是表示本发明的光学膜的一例的示意性剖视图。
[0262]
另外,图1为示意图,各层的厚度的关系、位置关系等不一定与实际一致,图1中所示的支撑体、取向膜及硬涂层均为任意的构成部件。
[0263]
图1所示的光学膜10依次具有支撑体16、取向膜14、作为固化物的光学各向异性层12。
[0264]
并且,如图1b所示,光学膜10可以在支撑体16的与设置有取向膜14的侧相反的一侧具有硬涂层18,如图1c所示,可以在光学各向异性层12的与设置有取向膜14的侧相反的一侧具有硬涂层18。
[0265]
以下,对本发明的光学膜中所使用的各种部件进行详细说明。
[0266]
〔固化物〕
[0267]
本发明的光学膜所具有的固化物为上述本发明的固化物。
[0268]
本发明的光学膜中,关于上述固化物的厚度并无特别限定,但是在用作光学各向异性层的情况下,优选为0.1~10μm,更优选为0.5~5μm。
[0269]
〔支撑体〕
[0270]
如上所述,本发明的光学膜可以具有支撑体作为用于形成固化物的基材。
[0271]
优选这种支撑体为透明,具体而言,优选透光率为80%以上。
[0272]
作为这种支撑体,例如可举出玻璃基板、聚合物薄膜,作为聚合物薄膜的材料,可举出纤维素系聚合物;聚甲基丙烯酸甲酯、含有内酯环的聚合物等具有丙烯酸酯聚合物的丙烯酸系聚合物;热塑性降冰片烯系聚合物;聚碳酸酯系聚合物;聚对苯二甲酸乙二酯、聚萘二甲酸乙二醇酯等聚酯系聚合物;聚苯乙烯、丙烯腈
‑
苯乙烯共聚物(as树脂)等苯乙烯系聚合物;聚乙烯、聚丙烯、乙烯
‑
丙烯共聚物等聚烯烃系聚合物;氯乙烯系聚合物;尼龙、芳香族聚酰胺等酰胺系聚合物;酰亚胺系聚合物;砜系聚合物;聚醚砜系聚合物;聚醚醚酮系聚合物;聚苯硫醚系聚合物;偏二氯乙烯系聚合物;乙烯醇系聚合物;乙烯醇缩丁醛系聚合物;芳酯系聚合物;聚甲醛系聚合物;环氧系聚合物;或混合这些聚合物而成的聚合物。
[0273]
并且,也可以是后述的起偏器兼作这种支撑体的方式。
[0274]
本发明中,对于上述支撑体的厚度,并无特别限定,但是优选为5~60μm,更优选为5~30μm。
[0275]
〔取向膜〕
[0276]
本发明的光学膜具有上述的任意的支撑体时,优选在支撑体与固化物之间具有取向膜。另外,也可以是上述的支撑体兼作取向膜的方式。
[0277]
取向膜通常将聚合物作为主要成分。作为取向膜用聚合物材料,在多个文献中有记载,能够获得多个市售品。
[0278]
优选本发明中所利用的聚合物材料为聚乙烯醇或聚酰亚胺及其衍生物。尤其优选改性或未改性的聚乙烯醇。
[0279]
关于本发明中能够使用的取向膜,例如可举出国际公开第01/88574号的43页24行~49页8行中所记载的取向膜;日本专利第3907735号公报的[0071]至[0095]段中所记载的改性聚乙烯醇;日本特开2012
‑
155308号公报中所记载的通过液晶取向剂形成的液晶取向膜等。
[0280]
本发明中,从通过在形成取向膜时不与取向膜表面接触而能够防止表面形态恶化的理由考虑,还优选利用光取向膜来作为取向膜。
[0281]
作为光取向膜,并无特别限定,但是能够使用国际公开第2005/096041号的[0024]~[0043]段中所记载的聚酰胺化合物、聚酰亚胺化合物等聚合物材料;日本特开2012
‑
155308号公报中所记载的通过具有光取向性基团的液晶取向剂形成的液晶取向膜;rolic technologies公司制造的商品名称lpp
‑
jp265cp等。
[0282]
并且,本发明中,上述取向膜的厚度,并无特别限定,但是从缓和能够存在于支撑体上的表面凹凸来形成膜厚均匀的光学各向异性层的观点考虑,优选为0.01~10μm,更优选为0.01~1μm,进一步优选为0.01~0.5μm。
[0283]
〔硬涂层〕
[0284]
为了赋予薄膜的物理强度,优选本发明的光学膜具有硬涂层。具体而言,可以在支撑体的与设置有取向膜的侧相反的一侧具有硬涂层(参考图1b),也可以在光学各向异性层的与设置有取向膜的侧相反的一侧具有硬涂层(参考图1c)。
[0285]
作为硬涂层,能够使用日本特开2009
‑
98658号公报的[0190]至[0196]段中所记载的硬涂层。
[0286]
〔紫外线吸收剂〕
[0287]
考虑外部光(尤其,紫外线)的影响,本发明的光学膜优选包含紫外线(uv)吸收剂。
[0288]
紫外线吸收剂可以包含于本发明的固化物中,也可以包含于构成本发明的光学膜的除固化物以外的部件中。作为除固化物以外的部件,例如可优选举出支撑体。
[0289]
作为紫外线吸收剂,能够使用能够显现紫外线吸收性的任何现有公知的紫外线吸收剂。这种紫外线吸收剂中,从紫外线吸收性高且获得图像显示装置中所使用的紫外线吸收能力(紫外线截止能力)的观点考虑,优选使用苯并三唑系或羟基苯基三嗪系紫外线吸收剂。
[0290]
并且,为了扩大紫外线的吸收宽度,能够同时使用2种以上的极大吸收波长不同的紫外线吸收剂。
[0291]
作为紫外线吸收剂,具体而言,例如可举出日本特开2012
‑
18395公报的[0258]~[0259]段中所记载的化合物、日本特开2007
‑
72163号公报的[0055]~[0105]段中所记载的化合物等。
[0292]
并且,作为市售品,能够使用tinuvin400、tinuvin405、tinuvin460、tinuvin477、tinuvin479及tinuvin1577(均由basf公司制造)等。
[0293]
[偏振片]
[0294]
本发明的偏振片具有上述的本发明的光学膜和起偏器。
[0295]
并且,在上述的本发明的作为固化物的光学各向异性层为λ/4板(正a板)的情况下,本发明的偏振片能够用作圆偏振片。
[0296]
并且,关于本发明的偏振片,在上述的本发明的作为固化物的光学各向异性层为λ/4板(正a板)的情况下,λ/4板的慢轴与后述的起偏器的吸收轴所形成的角度优选为30~60
°
,更优选为40~50
°
,进一步优选为42~48
°
,尤其优选为45
°
。
[0297]
在此,λ/4板的“慢轴”是指在λ/4板的面内折射率成为最大的方向,起偏器的“吸收轴”是指吸光度最高的方向。
[0298]
〔起偏器〕
[0299]
关于本发明的偏振片所具有的起偏器,只要为具有将光转换为特定的直线偏振光的功能的部件,则并无特别限定,能够利用以往公知的吸收型起偏器及反射型起偏器。
[0300]
作为吸收型起偏器,可使用碘系起偏器、利用了二色性染料的染料系起偏器及多烯系起偏器等。在碘系起偏器及染料系起偏器中,具有涂布型起偏器和拉伸型起偏器,均能够应用,但是优选使碘或二色性染料吸附于聚乙烯醇上并进行拉伸而制作的起偏器。
[0301]
并且,作为通过在基材上形成有聚乙烯醇层的层叠薄膜的状态下实施拉伸及染色而获得起偏器的方法,能够举出日本专利第5048120号公报、日本专利第5143918号公报、日本专利第4691205号公报、日本专利第4751481号公报、日本专利第4751486号公报,还能够优选利用这些与起偏器相关的公知的技术。
[0302]
作为反射型起偏器,可使用层叠双折射不同的薄膜而得的起偏器、线栅型起偏器、组合具有选择性反射区域的胆甾醇液晶和1/4波长板而得的起偏器等。
[0303]
其中,从密合性更加优异的观点考虑,优选包含聚乙烯醇系树脂(包含
‑
ch2‑
choh
‑
来作为重复单元的聚合物。尤其,选自包含聚乙烯醇及乙烯
‑
乙烯醇共聚物的组中的至少一个)的起偏器。
[0304]
本发明中,起偏器的厚度并无特别限定,但是优选为3μm~60μm,更优选为5μm~30μm,进一步优选为5μm~15μm。
[0305]
〔粘合剂层〕
[0306]
本发明的偏振片中,可以在本发明的光学膜中的固化物与起偏器之间配置有粘合剂层。
[0307]
作为用于层叠固化物和起偏器的粘合剂层,例如表示通过动态粘弹性测定装置测定的储能模量g’与损耗弹性模量g”之比(tanδ=g”/g’)为0.001~1.5的物质,包含所谓的粘合剂或容易蠕变的物质等。作为本发明中能够使用的粘合剂,例如可举出聚乙烯醇系粘合剂,但是并不限定于此。
[0308]
[图像显示装置]
[0309]
本发明的图像显示装置为具有本发明的光学膜或本发明的偏振片的图像显示装置。
[0310]
本发明的图像显示装置中所使用的显示元件,并无特别限定,例如可举出液晶单元、有机电致发光(以下,简称为“el”。)显示面板、等离子显示面板等。
[0311]
这些之中,优选液晶单元、有机el显示面板,更优选液晶单元。即,作为本发明的图像显示装置,优选作为显示元件使用了液晶单元的液晶显示装置、作为显示元件使用了有机el显示面板的有机el显示装置,更优选液晶显示装置。
[0312]
〔液晶显示装置〕
[0313]
作为本发明的图像显示装置的一例的液晶显示装置为具有上述的本发明的偏振片和液晶单元的液晶显示装置。
[0314]
另外,本发明中,在设置于液晶单元的两侧的偏振片中,优选使用本发明的偏振片来作为前侧的偏振片,更优选使用本发明的偏振片来作为前侧及后侧的偏振片。
[0315]
以下,对构成液晶显示装置的液晶单元进行详细叙述。
[0316]
<液晶单元>
[0317]
液晶显示装置中所利用的液晶单元优选为va(vertical alignment:垂直取向)模式、ocb(optically compensated bend:光学补偿弯曲)模式、ips(in
‑
plane
‑
switching:面内切换)模式或tn(twisted nematic:扭曲向列)模式,但并不限定于这些。
[0318]
tn模式的液晶单元中,在未施加电压时棒状液晶性分子实质上水平取向,进而扭曲取向为60~120
°
。tn模式的液晶单元最常用作色彩tft液晶显示装置,并在多个文献中有记载。
[0319]
va模式的液晶单元中,在未施加电压时棒状液晶性分子实质上垂直取向。在va模式的液晶单元中,除了包含(1)在未施加电压时使棒状液晶性分子实质上垂直取向,在施加电压时使其实质上水平取向的狭义的va模式的液晶单元(日本特开平2
‑
176625号公报中所记载)以外,还包含(2)为了扩大视角,对va模式进行了多域化的(mva模式的)液晶单元
(sid97,digest of tech.papers(论文集)28(1997)845中所记载)、(3)在未施加电压时使棒状液晶性分子实质上垂直取向,在施加电压时使其扭曲多域取向的模式(n
‑
asm模式)的液晶单元(日本液晶讨论会的论文集58~59(1998)中所记载)及(4)survival模式的液晶单元(lcd international 98中发表)。并且,可以是pva(patterned vertical alignment:图像垂直调整)型、光取向型(optical alignment:光学对准)及psa(polymer
‑
sustained alignment:聚合物稳定取向)中的任一种。关于这些模式的详细内容,在日本特开2006
‑
215326号公报及日本特表2008
‑
538819号公报中有详细的记载。
[0320]
关于ips模式的液晶单元,棒状液晶分子相对于基板而实质上平行取向,且通过施加与基板面平行的电场而使液晶分子平面响应。关于ips模式,在未施加电场的状态下成为黑色显示,且上下一对偏振片的吸收轴正交。在日本特开平10
‑
54982号公报、日本特开平11
‑
202323号公报、日本特开平9
‑
292522号公报、日本特开平11
‑
133408号公报、日本特开平11
‑
305217号公报、日本特开平10
‑
307291号公报等中公开有使用光学补偿片来降低斜方向上的黑色显示时的漏光并改善视角的方法。
[0321]
〔有机el显示装置〕
[0322]
关于作为本发明的图像显示装置的一例的有机el显示装置,例如可优选举出从视觉辨认侧依次具有起偏器、由本发明的光学各向异性层构成的λ/4板(正a板)及有机el显示面板的方式。
[0323]
并且,有机el显示面板为使用在电极之间(阴极及阳极之间)夹持有机发光层(有机电致发光层)而成的有机el元件构成的显示面板。有机el显示面板的结构并无特别限制,可采用公知的结构。
[0324]
实施例
[0325]
以下,基于实施例对本发明进行进一步详细说明。关于以下的实施例中所示的材料、用量、比例、处理内容、处理步骤等,只要不脱离本发明的主旨,则能够进行适当变更。因此,本发明的范围不应由以下所示的实施例限定性地进行解释。
[0326]
[实施例1]
[0327]
〔化合物(1
‑
1)的合成〕
[0328]
<羧酸衍生物(s
‑1‑
d)的合成>
[0329]
[化学式15]
[0330][0331]
如上述方案所示,将4,4
‑
联苯二羧酸二甲酯(s
‑1‑
a)125g(0.462mol)加入到乙酸1000ml中,加入钯碳催化剂(湿体)12.5g之后,在130℃2mpa下在高压釜中使其进行接触加氢反应。
[0332]
反应结束之后,冷却到室温之后,通过过滤去除了催化剂。减压蒸馏乙酸,之后添加乙酸乙酯、碳酸氢钠水溶液进行搅拌、分液而去除水层,进而用10%食盐水清洗了有机
层。向该溶液加入硫酸钠进行干燥,浓缩溶剂,由此获得了4,4
’‑
二环己烷二羧酸二甲酯(s
‑1‑
b)(130g)。
[0333]
未进行进一步纯化,继而混合4,4
’‑
二环己烷二羧酸二甲酯(130g)、氢氧化钾颗粒(aldrich制造、纯度90%)86.3g、异丙苯1300ml、聚乙二醇(peg2000)10ml,连接迪安
‑
斯塔克管在120℃下进行了加热搅拌。在蒸馏去除甲醇之后,将外设温度设为180℃,一边蒸馏去除溶剂一边继续加热回流20小时。通过nmr(nuclear magnetic resonance,核磁共振)确认反应进行,反应结束之后进行冷却,向反应液添加乙醇1300ml之后,过滤获取了所析出的钾盐。
[0334]
接着,将该钾盐溶解于水1300ml中,在冰冷下添加浓盐酸直至体系的ph成为3,过滤获取所析出的羧酸,回收了粗产物。
[0335]
将所回收的粗产物悬浮于丙酮500ml中,在50℃下搅拌了30分钟之后,冷却到室温,过滤获取了晶体。通过重复2次该再浆化操作,获得了93.9g(产率80%)的反式体的含率几乎为100%的二环己烷二羧酸(s
‑1‑
c)的晶体。
[0336]
[化学式16]
[0337][0338]
接着,如上述方案所示,在室温(23℃)下混合了化合物(s
‑1‑
c)10.0g(39.3mmol)、n,n
‑
二甲基乙酰胺(dmac)50ml、三乙基胺8.0ml(78.6mmol)及2,6
‑
二叔丁基
‑4‑
甲基苯酚433mg。
[0339]
向混合物加入4
‑
甲基磺酰基氧基丁基丙烯酸酯9.61g(43.2mmol),在90℃下搅拌了5小时。在冷却至室温之后,加入浓盐酸2.60g及水20ml混合溶液,在40℃下进行搅拌之后,进行了分液。接着,向有机层加入甲苯20ml、5%碳酸氢钠水溶液30ml,在40℃下进行搅拌之后,进行了分液。接着,用1%碳酸氢钠水溶液30ml清洗有机层2次之后,加入2,2,6,6
‑
四甲基哌啶
‑1‑
氧基(tempo)20mg之后,减压蒸馏了溶剂。通过基于nmr及hplc(high performance liquid chromatography,高效液相色谱)的换算,主体含率为28%。将该甲苯溶液加温到40℃,添加己烷45ml之后,将内温冷却到5℃进而添加了己烷12ml。原样搅拌10分钟,过滤获取固体,用己烷30ml进行了清洗。向所获得的固体加入甲苯8.5ml、己烷55ml,加温到40℃之后,冷却到内温5℃,进行了再浆化清洗。过滤获取固体,用己烷35ml进行清洗,以6.7g(产率45%)获得了化合物(s
‑1‑
d)。
[0340]
<化合物(1
‑
1)的合成>
[0341]
[化学式17]
[0342][0343]
混合1,4
‑
二羟基萘0.5g(3.12mmol)、化合物(s
‑1‑
d)2.97g(7.80mmol)、4
‑
二甲基氨基吡啶(dmap)38mg、2,6
‑
二叔丁基
‑4‑
甲基苯酚35mg、氯仿(chcl3)5ml,向其添加1
‑
(3
‑
二甲基氨基丙基)
‑3‑
乙基碳二亚胺(edci)盐酸盐1.61g(8.42mmol),在室温下搅拌了2小时。通过硅胶管柱直接纯化反应液,获得了2.2g(产率79%)化合物(1
‑
1)。
[0344]
以下示出所获得的化合物(1
‑
1)的1h
‑
nmr(nuclear magnetic resonance)。
[0345]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.89
‑
7.80(m,2h),7.58
‑
7.48(m,2h),7.20(s,2h),6.42(d,2h),6.12(dd,2h),5.85(d,2h),4.19(t,4h),4.10(t,4h),2.76
‑
2.60(m,2h),2.39
‑
2.18(m,6h),2.11
‑
1.57(m,24h),1.51
‑
1.32(m,4h),1.30
‑
0.99(m,12h)
[0346]
[实施例2]
[0347]
〔化合物(1
‑
2)的合成〕
[0348]
[化学式18]
[0349][0350]
将2
‑
甲基
‑
1,4
‑
萘醌(1
‑2‑
a)10.0g(58.1mmol)溶解于氯仿160ml中,在水冷下进而添加了混合连二亚硫酸酯钠20.2g(116mmol)及水160ml的溶液。滴加之后,在室温下搅拌1小时过滤获取所析出的固体。用氯仿及水清洗固体,获得了2
‑
甲基
‑
1,4
‑
二羟基萘7.1g(产率70%)。接着,使用化合物(1
‑2‑
b)0.50g(3.12mmol)以与化合物(1
‑
1)相同的方式进行反应,获得了2.0g(产率72%)的化合物(1
‑
2)。
[0351]
以下示出所获得的化合物(1
‑
2)的1h
‑
nmr。
[0352]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.78(d,1h),7.70(d,1h),6.12((7.53
‑
7.40(m,2h),7.13(s,1h),6.41(d,2h),6.14(dd,2h),5.82(d,2h),4.20(t,4h),4.10(t,4h),2.73
‑
2.58(m,2h),2.37
‑
2.18(m,9h),2.06
‑
0.99(m,40h)
[0353]
[实施例3]
[0354]
〔化合物(1
‑
3)的合成〕
[0355]
[化学式19]
[0356][0357]
将原料变更为2
‑
甲氧基
‑
1,4
‑
萘醌(1
‑3‑
a),除此以外,以与化合物(1
‑2‑
b)相同的方式合成,使用所获得的化合物(1
‑3‑
b)1.0g(5.26mmol)获得了2.9g(产率61%)的化合物(1
‑
3)。
[0358]
以下示出所获得的化合物(1
‑
3)的1h
‑
nmr。
[0359]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.76(t,2h),7.48(t,1h),7.36(t,1h),7.13(s,1h),6.40(d,2h),6.11(dd,2h),5.84(d,2h),4.20(t,4h),4.10(t,4h),3.91(s,3h),2.75
‑
2.59(m,2h),2.37
‑
2.16(m,6h),2.09
‑
0.97(m,40h)
[0360]
[实施例4]
[0361]
〔化合物(1
‑
4)的合成〕
[0362]
[化学式20]
[0363][0364]
将原料变更为2
‑
乙氧基
‑
1,4
‑
萘醌(1
‑4‑
a),除此以外,以与化合物(1
‑2‑
b)相同的方式合成,使用所获得的化合物(1
‑4‑
b)0.8g(3.92mmol)获得了2.1g(产率58%)的化合物(1
‑
4)。
[0365]
以下示出所获得的化合物(1
‑
4)的1h
‑
nmr。
[0366]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.79
‑
7.69(m,2h),7.46(t,1h),7.34(t,1h),7.11(s,
1h),4.24
‑
4.05(m,10h),2.72
‑
2.58(m,2h),2.39
‑
2.17(m,6h),2.08
‑
1.32(m,31h),1.24
‑
0.98(m,12h)
[0367]
[实施例5]
[0368]
〔化合物(1
‑
5)的合成〕
[0369]
[化学式21]
[0370][0371]
将原料变更为2
‑
甲氧基羰基
‑
1,4
‑
萘醌(1
‑5‑
a),除此以外,以与化合物(1
‑2‑
b)相同的方式合成,使用所获得的化合物(1
‑5‑
b)0.8g(3.67mmol)获得了1.76g(产率51%)的化合物(1
‑
5)。
[0372]
以下示出所获得的化合物(1
‑
5)的1h
‑
nmr。
[0373]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.78(d,1h),7.85(d,1h),7.77(s,1h),7.66
‑
7.54(m,2h),6.42(d,2h),6.15(dd,2h),5.84(d,2h),4.21(t,4h),4.10(t,4h),3.90(s,3h),2.79
‑
2.61(m,2h),2.44
‑
2.19(m,6h),2.05
‑
1.34(m,28h),1.25
‑
0.99(m,12h)
[0374]
[实施例6]
[0375]
〔化合物(1
‑
6)的合成〕
[0376]
[化学式22]
[0377][0378]
将原料变更为6
‑
甲基
‑
1,4
‑
萘醌(1
‑6‑
a),除此以外,以与化合物(1
‑
2)相同的方式合成,使用所获得的化合物(1
‑6‑
b)0.3g(1.72mmol)获得了1.7g(产率65%)的化合物(1
‑
6)。
[0379]
以下示出所获得的化合物(1
‑
6)的1h
‑
nmr。
[0380]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.73(d,1h),7.59(s,1h),7.36(d,1h),7.18
‑
7.08(m,
2h),6.42(d,2h),6.15(dd,2h),5.86(d,2h),4.20(t,4h),4.13(t,4h),2.71
‑
2.60(m,2h),2.51(s,3h),2.36
‑
2.19(m,6h),2.08
‑
1.52(m,24h),1.49
‑
1.35(m,4h),1.27
‑
0.99(m,12h)
[0381]
[实施例7]
[0382]
〔化合物(1
‑
7)的合成〕
[0383]
[化学式23]
[0384][0385]
将原料变更为5
‑
甲基
‑
1,4
‑
萘醌(1
‑7‑
a),除此以外,以与化合物(1
‑
2)相同的方式合成,使用所获得的化合物(1
‑7‑
b)0.5g(3.12mmol)获得了1.5g(产率54%)的化合物(1
‑
7)。
[0386]
[实施例8]
[0387]
〔化合物(1
‑
8)的合成〕
[0388]
[化学式24]
[0389][0390]
向5
‑
羟基
‑
1,4
‑
萘醌(1
‑8‑
a)5.0g(28.7mmol)、氯仿200ml的溶液加入碘乙烷13.8ml(172mmol)、氧化银(i)5.05g(21.8mmol),在加热回流下进行了15小时的反应。反应开始8小时及13小时共计2次添加了碘乙烷6.9ml(86.0mmol)及氧化银(i)5.05g(21.8mmol)。反应之后,通过过滤去除氧化银,浓缩溶液获得了5.7g(产率98%)的化合物(1
‑8‑
b)。
[0391]
接着,使用化合物(1
‑8‑
b)5.7g以与化合物(1
‑2‑
a)相同的方式进行反应,获得了
2.75g(产率47%)的化合物(1
‑8‑
c)。
[0392]
最后,使用化合物(1
‑8‑
c)0.86g(4.21mmol)以与化合物(1
‑
1)相同的方式进行反应,获得了0.39g(产率10%)的化合物(1
‑
8)。
[0393]
以下示出所获得的化合物(1
‑
8)的1h
‑
nmr。
[0394]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.45
‑
7.33(m,2h),7.17(d,1h),6.93(d,1h),6.85(d,1h),6.40(d,2h),6.14(dd,2h),5.83(d,2h),4.21
‑
4.05(m,10h),3.48(s,3h),2.69
‑
2.49(m,2h),2.33
‑
2.12(m,6h),2.09
‑
1.32(m,31h),1.20
‑
0.99(m,12h)
[0395]
[实施例9]
[0396]
〔化合物(1
‑
9)的合成〕
[0397]
[化学式25]
[0398][0399]
使用5
‑
羟基
‑
1,4
‑
萘醌(1
‑8‑
a)5.0g(28.7mmol)及碘丁烷,以与化合物(1
‑8‑
b)的合成相同的方式进行反应,获得了4.4g(产率67%)的化合物(1
‑9‑
b)。
[0400]
接着,使用化合物(1
‑9‑
b)4.4g(19.3mmol)以与化合物(1
‑2‑
b)的合成相同的方式进行反应,获得了4.25g(产率95%)的化合物(1
‑9‑
c)。
[0401]
最后,使用化合物(1
‑9‑
c)0.98g(4.21mmol)以与化合物(1
‑
1)的合成相同的方式进行反应,获得了1.01g(产率25%)的化合物(1
‑
9)。
[0402]
以下示出所获得的化合物(1
‑
9)的1h
‑
nmr。
[0403]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.44
‑
7.33(m,2h),7.17(d,1h),6.95(d,1h),6.85(d,1h),6.41(d,2h),6.11(dd,2h),5.84(d,2h),4.19(t,4h),4.13
‑
4.02(m,6h),2.68
‑
2.46(m,2h),2.34
‑
2.13(m,6h),2.05
‑
1.32(m,35h),1.20
‑
0.99(m,12h)
[0404]
[实施例10]
[0405]
〔化合物(1
‑
10)的合成〕
[0406]
[化学式26]
[0407][0408]
使用5
‑
羟基
‑
1,4
‑
萘醌(1
‑8‑
a)5.0g(28.7mmol)及碘辛烷,以与化合物(1
‑8‑
b)的合成相同的方式进行反应,获得了7.55g(产率92%)的化合物(1
‑
10
‑
b)。
[0409]
接着,使用化合物(1
‑
10
‑
b)7.55g(19.3mmol)以与化合物(1
‑2‑
b)的合成相同的方式进行反应,获得了6.53g(产率86%)的化合物(1
‑
10
‑
c)。
[0410]
最后,使用化合物(1
‑
10
‑
c)1.75g(6.07mmol)以与化合物(1
‑
1)的合成相同的方式进行反应,获得了1.60g(产率21%)的化合物(1
‑
10)。
[0411]
以下示出所获得的化合物(1
‑
10)的1h
‑
nmr。
[0412]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.42
‑
7.30(m,2h),7.14(d,1h),6.93(d,1h),6.85(d,1h),6.40(d,2h),6.14(dd,2h),5.83(d,2h),4.18(t,4h),4.12
‑
4.00(m,6h),2.68
‑
2.44(m,2h),2.34
‑
2.16(m,6h),2.08
‑
0.88(m,55h)
[0413]
[实施例11]
[0414]
〔化合物(1
‑
11)的合成〕
[0415]
[化学式27]
[0416]
[0417]
混合5
‑
羟基
‑
1,4
‑
萘醌(1
‑8‑
a)10.3g(59.1mmol)及乙酸酐60ml,在冰浴中进行了冷却。向其滴加浓硫酸0.6ml,在冰浴下搅拌了1小时,在室温下搅拌了1小时。将反应液滴加到水500ml,过滤获取所析出的固体,进行水洗,用硅胶管柱纯化固体,获得了9.06g(产率71%)的化合物(1
‑
11
‑
b)。
[0418]
接着,使用化合物(1
‑
11
‑
b)9.0g(41.6mmol)以与化合物(1
‑2‑
b)的合成相同的方式进行反应,获得了7.35g(产率81%)的化合物(1
‑
11
‑
c)。
[0419]
最后,使用化合物(1
‑
11
‑
c)4.0g(18.3mmol)以与化合物(1
‑
1)的合成相同的方式进行反应,获得了10.9g(产率63%)的化合物(1
‑
11)。
[0420]
以下示出所获得的化合物(1
‑
11)的1h
‑
nmr。
[0421]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.81(d,1h),7.49(t,1h),7.24(d,1h),7.15
‑
7.01(m,2h),6.40(d,2h),6.12(dd,2h),5.83(d,2h),4.20(t,4h),4.11(t,4h),2.70
‑
2.46(m,2h),2.35(s,3h),2.32
‑
2.16(m,6h),2.06
‑
0.98(m,40h)
[0422]
[实施例12]
[0423]
〔化合物(1
‑
12)的合成〕
[0424]
<羧酸衍生物(s
‑2‑
d)的合成>
[0425]
[化学式28]
[0426][0427]
通过与化合物(s
‑1‑
d)相同的方法,将4
‑
甲基磺酰基氧基丁基丙烯酸酯变更为4
‑
甲基磺酰基氧基丁基甲基丙烯酸酯,进行反应,合成了化合物(s
‑2‑
d)。
[0428]
<化合物(1
‑
12)的合成>
[0429]
[化学式29]
[0430]
[0431]
使用化合物(1
‑
11
‑
c)0.88g(4.06mmol)及化合物(s
‑2‑
d),以与化合物(1
‑
1)的合成相同的方式进行反应,获得了2.55g(产率65%)的化合物(1
‑
12)。
[0432]
以下示出所获得的化合物(1
‑
12)的1h
‑
nmr。
[0433]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.81(d,1h),7.47(t,1h),7.25(d,1h),7.12
‑
7.06(m,2h),6.10(s,2h),5.58(s,2h),4.19(t,4h),4.10(t,4h),2.72
‑
2.47(m,2h),2.36(s,3h),2.34
‑
2.16(m,6h),2.06
‑
1.32(m,28h),1.22
‑
0.98(m,12h)
[0434]
[实施例13]
[0435]
〔化合物(1
‑
13)的合成〕
[0436]
<羧酸衍生物(s
‑3‑
d)的合成>
[0437]
[化学式30]
[0438][0439]
通过与化合物(s
‑1‑
d)相同的方法,将4
‑
甲基磺酰基氧基丁基丙烯酸酯变更为4
‑
甲基磺酰基氧基乙基丙烯酸酯,进行反应,合成了化合物(s
‑3‑
d)。
[0440]
<化合物(1
‑
13)的合成>
[0441]
[化学式31]
[0442][0443]
使用化合物(1
‑
11
‑
c)0.80g(3.67mmol)及化合物(s
‑3‑
d),以与化合物(1
‑
1)的合成相同的方式进行反应,获得了0.97g(产率30%)的化合物(1
‑
13)。
[0444]
以下示出所获得的化合物(1
‑
13)的1h
‑
nmr。
[0445]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.80(d,1h),7.48(t,1h),7.24(d,1h),7.15
‑
7.03(m,2h),6.44(d,2h),6.13(dd,2h),5.88(d,2h),4.41
‑
4.29(m,8h),2.69
‑
2.43(m,2h),2.38(s,3h),2.33
‑
2.29(m,6h),2.07
‑
1.34(m,28h),1.22
‑
0.98(m,12h)
[0446]
[实施例14]
[0447]
〔化合物(1
‑
14)的合成〕
[0448]
<羧酸衍生物(s
‑4‑
d)的合成>
[0449]
[化学式32]
[0450][0451]
通过与化合物(s
‑1‑
d)相同的方法,将4
‑
甲基磺酰基氧基丁基丙烯酸酯变更为化合物(s
‑4‑
d1),进行反应,合成了化合物(s
‑4‑
d)。
[0452]
<化合物(1
‑
14)的合成>
[0453]
[化学式33]
[0454][0455]
使用化合物(1
‑
11
‑
c)0.51g(2.34mmol)及化合物(s
‑4‑
d),以与化合物(1
‑
1)的合成相同的方式进行反应,获得了0.93g(产率33%)的化合物(1
‑
14)。
[0456]
以下示出所获得的化合物(1
‑
14)的1h
‑
nmr。
[0457]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.80(d,1h),7.49(t,1h),7.25(d,1h),7.16
‑
7.04(m,2h),6.42(d,2h),6.19
‑
6.06(m,2h),5.89
‑
5.81(m,2h),5.26
‑
5.15(m,2h),4.32
‑
4.10(m,12h),2.71
‑
2.46(m,10h),2.38(s,3h),2.36
‑
2.19(m,6h),2.09
‑
1.25(m,28h),1.24
‑
0.98(m,12h)
[0458]
[实施例15]
[0459]
〔化合物(1
‑
15)的合成〕
[0460]
<羧酸衍生物(s
‑5‑
d)的合成>
[0461]
[化学式34]
[0462][0463]
通过与化合物(s
‑1‑
d)相同的方法,将4
‑
甲基磺酰基氧基丁基丙烯酸酯变更为化合物(s
‑5‑
d1),进行反应,合成了化合物(s
‑5‑
d)。
[0464]
<化合物(1
‑
15)的合成>
[0465]
[化学式35]
[0466][0467]
使用化合物(1
‑
11
‑
c)0.51g(2.34mmol)及化合物(s
‑5‑
d),以与化合物(1
‑
1)的合成相同的方式进行反应,获得了0.98g(产率39%)的化合物(1
‑
15)。
[0468]
以下示出所获得的化合物(1
‑
15)的1h
‑
nmr。
[0469]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.80(d,1h),7.49(t,1h),7.26(d,1h),7.16
‑
7.05(m,2h),6.45(d,2h),6.18(dd,2h),5.87(d,2h),4.37
‑
4.30(m,4h),4.21(t,4h),3.79
‑
3.61(m,16h),2.70
‑
2.46(m,2h),2.38(s,3h),2.32
‑
2.16(m,6h),2.09
‑
1.32(m,28h),1.21
‑
0.96(m,12h)
[0470]
[实施例16]
[0471]
〔化合物(1
‑
16)的合成〕
[0472]
[化学式36]
[0473][0474]
向5,8
‑
二羟基
‑
1,4
‑
萘醌(1
‑
16
‑
a)5.0g(26.3mmol)、氯仿250ml的溶液加入碘乙烷6.4ml(78.9mmol)、氧化银(i)4.65g(20.0mmol),在加热回流下进行了5天的反应。反应中,每24小时添加了共计4次碘乙烷6.4ml(78.9mmol)、氧化银(i)4.65g(20.0mmol)。反应之后,通过过滤去除氧化银,浓缩溶液之后用硅胶管柱进行了纯化。以1.4g(产率21%)获得了化合物(1
‑
16
‑
b)。
[0475]
接着,使用化合物(1
‑
16
‑
b)1.4g以与化合物(1
‑2‑
a)相同的方式进行反应,获得了0.86g(产率61%)的化合物(1
‑
16
‑
c)。
[0476]
最后,使用化合物(1
‑
16
‑
c)0.86g(3.46mmol)以与化合物(1
‑
1)相同的方式进行反应,获得了0.33g(产率10%)的化合物(1
‑
16)。
[0477]
以下示出所获得的化合物(1
‑
16)的1h
‑
nmr。
[0478]1h
‑
nmr(溶剂:cdcl3)δ(ppm):6.93(s,2h),6.75(s,2h),6.39(d,2h),6.10(dd,2h),5.81(d,2h),4.20(t,4h),4.14
‑
4.03(m,8h),2.60
‑
2.56(m,2h),2.31
‑
2.15(m,6h),2.05
‑
1.31(m,34h),1.19
‑
0.98(m,12h)
[0479]
[实施例17]
[0480]
〔化合物(1
‑
17)的合成〕
[0481]
[化学式37]
[0482]
[0483]
混合5,8
‑
二羟基
‑
1,4
‑
萘醌(1
‑
16
‑
a)1.5g(7.89mmol)及乙酸酐20ml,在冰浴中进行了冷却。向其滴加浓硫酸0.5ml,在冰浴下搅拌了1小时,在室温下搅拌了1小时。将反应液滴加到水200ml,过滤获取所析出的固体,进行水洗,用硅胶管柱纯化固体,获得了1.67g(产率77%)的化合物(1
‑
17
‑
b)。
[0484]
接着,使用化合物(1
‑
17
‑
b)1.67g(6.09mmol)以与化合物(1
‑2‑
b)的合成相同的方式进行反应,获得了1.35g(产率80%)的化合物(1
‑
17
‑
c)。
[0485]
最后,使用化合物(1
‑
17
‑
c)1.3g(4.71mmol)以与化合物(1
‑
1)的合成相同的方式进行反应,获得了1.38g(产率29%)的化合物(1
‑
17)。
[0486]
以下示出所获得的化合物(1
‑
17)的1h
‑
nmr。
[0487]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.13
‑
7.03(m,4h),6.41(d,2h),6.13(dd,2h),5.82(d,2h),4.19(t.4h),4.09(t,4h),2.58
‑
2.44(m,2h),2.35(s,6h),2.28
‑
2.16(m,6h),2.06
‑
1.32(m,28h),1.19
‑
0.97(m,12h)
[0488]
[实施例18]
[0489]
〔化合物(2
‑
1)的合成〕
[0490]
[化学式38]
[0491][0492]
使用1,4
‑
二羟基萘0.5g(3.12mmol)及化合物(t
‑
1)3.31g(7.80mmol)以与化合物(1
‑
1)相同的方式进行反应,获得了1.3g(产率43%)的化合物(2
‑
1)。
[0493]
以下示出所获得的化合物(2
‑
1)的1h
‑
nmr。
[0494]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.82(d,2h),7.53(d,2h),7.22(s,2h),6.43(d,2h),6.12(dd,2h),5.88(d,2h),5.80
‑
5.68(m,2h),4.20(t,4h),4.12(t,4h),2.80
‑
2.69(m,2h),2.42
‑
2.23(m,8h),2.16(d,4h),2.08(d,8h),1.80
‑
1.33(m,24h)
[0495]
[实施例19]
[0496]
〔化合物(2
‑
2)的合成〕
[0497]
[化学式39]
[0498][0499]
使用5
‑
乙酰氧基
‑
1,4
‑
二羟基萘(a
‑
11
‑
c)0.5g(2.29mmol)及化合物(t
‑
2)2.2g(5.73mmol)以与化合物(1
‑
1)相同的方式进行反应,获得了1.2g(产率53%)的化合物(2
‑
2)。
[0500]
以下示出所获得的化合物(2
‑
2)的1h
‑
nmr。
[0501]1h
‑
nmr(溶剂:cdcl3)δ(ppm):8.44
‑
8.37(m,4h),8.22
‑
8.14(m,4h),7.94(t,1h),7.60
‑
7.49(m,6h),7.30(d,1h),7.19(d,1h),7.01(d,4h),6.43(d,2h),6.15(dd,2h),5.86(d,2h),4.29(t,4h),4.11(t,4h),2.01
‑
1.88(m,8h),1.82(s,3h)
[0502]
[实施例20]
[0503]
〔化合物(2
‑
3)的合成〕
[0504]
[化学式40]
[0505][0506]
将5
‑
羟基
‑
1,4
‑
萘醌5.00g(28.7mmol)溶解于二氯甲烷10ml中,在室温下滴加了甲基磺酰基甲烷磺酸酯7.5g(43.1mmol)。接着,在冰冷下添加4
‑
二甲基氨基吡啶0.35g(2.87mmol)、吡啶2.50g(31.6mmol),在40℃下搅拌了1小时。添加水100ml及乙酸乙酯200ml,进行了分液操作。向有机层添加饱和碳酸氢钠水溶液100ml,再次进行了分液操作。蒸馏去除有机层的溶剂,用硅胶柱层析法进行纯化,获得了1.30g(产率18%)的黄土色固体的(2
‑3‑
b)。接着,使用化合物(2
‑3‑
b)1.30g(5.15mmol)以与化合物(1
‑2‑
b)的合成相同的方式进行反应,获得了1.06g(产率81%)的化合物(2
‑3‑
c)。最后,使用化合物(2
‑3‑
c)1.06g
(4.17mmol)以与化合物(1
‑
1)的合成相同的方式进行反应,获得了2.31g(产率57%)的化合物(2
‑
3)。
[0507]
以下示出所获得的化合物(2
‑
3)的1h
‑
nmr。
[0508]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.88(dd,1h),7.63(dd,1h),7.52(t,1h),7.29(d,1h),7.16(d,1h),6.42(dd、2h),6.18
‑
6.08(m,2h),5.84(dd,2h),4.15(d,8h),3.01(s,3h),2.82
‑
2.62(m,2h),2.37
‑
2.17(m,6h),2.09
‑
1.33(m,28h),1.25
‑
0.98(m,12h)
[0509]
[实施例21]
[0510]
〔化合物(2
‑
4)的合成〕
[0511]
[化学式41]
[0512][0513]
将5
‑
羟基
‑
1,4
‑
萘醌5.00g(28.7mmol)溶解于二氯甲烷50ml中,添加2
‑
氯乙酰基
‑2‑
氯丙酮7.36g(43.1mmol)、4
‑
二甲基氨基吡啶0.35g(2.87mmol)、吡啶2.50g(31.6mmol),在室温下搅拌了1小时。添加乙酸乙酯200ml及水100ml,进行了分液操作。向有机层添加饱和碳酸氢钠水溶液100ml,再次进行了分液操作。用氯仿及乙酸乙酯进行分散清洗之后进行过滤,获得了2.29g(产率32%)的黄土色固体的(2
‑4‑
a)。接着,使用化合物(2
‑4‑
b)2.20g(8.78mmol)以与化合物(1
‑2‑
b)的合成相同的方式进行反应,获得了1.80g(产率81%)的化合物(2
‑4‑
c)。最后,使用化合物(2
‑4‑
c)0.90g(3.56mmol)以与化合物(1
‑
1)的合成相同的方式进行反应,获得了0.44g(产率13%)的化合物(2
‑
4)。
[0514]
以下示出所获得的化合物(2
‑
4)的1h
‑
nmr。
[0515]1h
‑
nmr(溶剂:cdcl3)δ(ppm):7.82(d,1h),7.51(t,1h)、7.25(d,1h),7.20
‑
7.08(m,2h),6.42(dd,2h),6.17
‑
6.08(m,2h),5.84(dd,2h),4.37(s,2h),4.15(dt,8h),2.71
‑
2.44(m,2h),2.33
‑
2.15(m,6h),2.08
‑
1.34(m,28h),1.23
‑
0.98(m,12h)
[0516]
[比较例1]
[0517]
按照日本特开2013
‑
164520号公报的记载,合成了由下述式表示的比较化合物1。
[0518]
[化学式42]
[0519][0520]
[比较例2]
[0521]
合成了对上述比较化合物1进一步导入环结构的由下述式表示的比较化合物2。
[0522]
[化学式43]
[0523][0524]
[评价1]
[0525]
通过以下示出的方法,对实施例及比较例中合成的各化合物评价了相变温度、析出抑制及溶解性。
[0526]
(1)相变温度
[0527]
以彼此正交的方式配置光学显微镜(nikon公司制造eclipse e600 pol)的两片起偏器,将样品台组装于两片起偏器之间。
[0528]
而且,将所合成的各化合物少量载置于载玻片上,将载玻片组装于放置在样品台上的加热工作台上。一边用显微镜观察样品的状态一边以5℃/分钟升高加热工作台的温度,从样品的状态记录了液晶相的种类及相变的温度。
[0529]
并且,关于重结晶化(recrystal)温度,加热至各向同性相之后,以5℃/分钟使其降温,记录了析出晶体的温度。
[0530]
将结果示于下述表3中。另外,下述表3中,cr表示晶体,sa表示近晶相,n表示向列相,is表示各向同性相。并且,下述表3中,实施例1(化合物1
‑
1)中,与“cr 185sa220n 230以上is”的标记中,“230以上”表示“在230℃以上进行聚合,无法测定相变到各向同性相时的温度”。
[0531]
(2)析出抑制
[0532]
从通过上述相变温度的评价方法测定的重结晶化(recrystal)温度的结果,根据以下基准进行了评价。将结果示于下述表3中。
[0533]
a:小于50℃
[0534]
b:50℃以上且100℃以下
[0535]
c:超过100℃且150℃以下
[0536]
d:超过150℃且180℃以下
[0537]
(3)溶解性
[0538]
对所合成的各化合物25mg添加环戊酮,以使各化合物的浓度成为40质量%,在50℃下加热搅拌了1分钟。
[0539]
之后,在20℃下静放10分钟,若没有未溶解的残留物或析出,则判断为能够以40质量%溶解。
[0540]
当存在未溶解的残留物或析出时,一边进而追加环戊酮以5质量%的幅度逐渐降低浓度,一边反复进行50℃下的1分钟加热搅拌及在之后的20℃下静放10分钟的操作直至
没有未溶解或析出,确认了溶解度。
[0541]
下述表3中记载显示溶解度的浓度的值。另外,下述表3中,“>40”表示由于在40质量%的浓度下溶解,因此在40质量%以上的浓度下也能够溶解,“<5”表示即使为5质量%也观察到未溶解的残留物或析出。
[0542]
[表3]
[0543][0544]
从上述表3所示的结果可知,比较化合物1的显示液晶性的温度范围窄,但是析出抑制及溶解性良好(比较例1)。
[0545]
并且,可知若对比较化合物1进一步导入环结构,则显示液晶性的温度范围变宽,但是析出抑制及溶解性变差(比较例2)。
[0546]
相比之下,可知在分子中央(纤芯)上具有在1,4
‑
位具有侧链结构的萘骨架的规定
化合物成为显示液晶性的温度区域宽且析出抑制及溶解性优异的化合物(实施例1~21)。
[0547]
[实施例22~30]
[0548]
<取向膜p
‑
3的形成>
[0549]
作为形成用伪支撑体使用玻璃板,使用#18棒式涂布机将下述取向膜p
‑
3形成用涂布液涂布于玻璃基板上,用100℃的暖风将玻璃基板干燥120秒钟之后,进行摩擦处理,由此形成了取向膜p
‑
3。
[0550][0551]
聚合性液晶化合物l
‑1[0552]
[化学式44]
[0553][0554]
聚合性液晶化合物l
‑2[0555]
[化学式45]
[0556][0557]
聚合引发剂pi
‑1[0558]
[化学式46]
[0559][0560]
流平剂t
‑1[0561]
[化学式47]
[0562][0563]
[比较例3]
[0564]
未配合化合物(1
‑
3),除此以外,通过与实施例22相同的方法,通过旋涂法将聚合性组合物涂布于取向膜p
‑
3上。
[0565]
[评价2]
[0566]
实施例22~30及比较例3中,通过以下所示的方法对涂布于取向膜p
‑
3上的聚合性组合物测定了相变温度。
[0567]
以彼此正交的方式配置光学显微镜(nikon公司制造eclipse e600 pol)的两片起偏器,将样品台组装于两片起偏器之间。
[0568]
而且,将制备的聚合性组合物少量载置于载玻片上,将载玻片组装于放置在样品台上的加热工作台上。一边用显微镜观察样品的状态一边加热至向列相之后,一边以10℃/分钟降温一边测定近晶相(sm)的上限温度及晶体化温度,计算了近晶相(sm)的温度范围。将结果示于下述表4中。
[0569]
[表4]
[0570][0571]
从上述表4所示的结果可知,若对聚合性液晶化合物配合化合物(1),则显示液晶性(尤其近晶液晶性)的温度范围变宽(实施例22~30)。
[0572]
[实施例31~33]
[0573]
〔纤维素酰化物薄膜1的制作〕
[0574]
<芯层纤维素酰化物浓液的制作>
[0575]
将下述组合物投入到混合罐中,进行搅拌来溶解各成分,制备了用作芯层纤维素酰化物浓液的乙酸纤维素溶液。
[0576][0577]
化合物f
[0578]
[化学式48]
[0579][0580]
<外层纤维素酰化物浓液的制作>
[0581]
将10质量份的下述消光剂溶液加入到90质量份的上述芯层纤维素酰化物浓液中,制备了用作外层纤维素酰化物浓液的乙酸纤维素溶液。
[0582][0583]
<纤维素酰化物薄膜1的制膜>
[0584]
用平均孔径34μm的滤纸及平均孔径10μm的烧结金属过滤器过滤上述芯层纤维素酰化物浓液及上述外层纤维素酰化物浓液之后,同时从流延口将上述芯层纤维素酰化物浓液和配置于其两侧的外层纤维素酰化物浓液这3层流延到20℃的金属环带上(环带流延机)。
[0585]
流延之后,在溶剂含有率大致为20质量%的状态下从金属环带剥离所形成的膜(薄膜),用拉幅机夹具固定薄膜的宽度方向的两端,沿横向以延伸倍率1.1倍延伸的同时进行了干燥。之后,通过在热处理装置的辊之间输送,进而进行干燥,卷绕其,制作了厚度20μm的长条状纤维素酰化物薄膜1。薄膜的芯层为厚度16μm,配置于芯层的两侧的外层的厚度分别为2μm。所获得的纤维素酰化物薄膜1的面内延迟为0nm。
[0586]
〔光取向膜p
‑
4的制作〕
[0587]
通过#2.4的线棒将下述组成的光取向膜p
‑
4形成用涂布液连续地涂布于纤维素酰化物薄膜1上。
[0588]
用140℃的暖风对形成有涂膜的纤维素酰化物薄膜1干燥120秒钟,接着,通过线栅起偏器(moxtek公司制造,proflux ppl02),照射10mj/cm2(测定波长315nm、使用超高压汞灯)的偏振光紫外线,由此形成了光取向膜p
‑
4。
[0589][0590]
聚合物pa
‑1[0591]
[化学式49]
[0592][0593]
〔光学各向异性层的形成〕
[0594]
使用棒式涂布机,将下述组合物a
‑
1涂布于光取向膜p
‑
4上。用暖风在145℃下加热形成于光取向膜p
‑
4上的涂膜,之后冷却至70℃,在氮气环境下使用高压汞灯在波长365nm下向涂膜照射100mj/cm2的紫外线,接着一边加热至120℃一边向涂膜照射500mj/cm2的紫外线,由此固定化液晶化合物的取向,从而制作了包含光学各向异性层(正a板)的光学膜。将光学各向异性层的厚度示于下述表3中。
[0595][0596]
[偏振片的制作]
[0597]
<正c板c
‑
1的形成>
[0598]
通过与日本特开2015
‑
200861号公报的[0124]段的记载中所记载的正c板相同的方法,制作了在形成用伪支撑体上具有正c板c
‑
1的薄膜c
‑
1。其中,控制正c板的厚度,以使rth(550)成为
‑
69nm。
[0599]
<偏振片的形成>
[0600]
对作为支撑体的td80ul(fujifilm co.,ltd.制造)的表面进行了碱皂化处理。具体而言,在55℃下将上述支撑体浸渍于1.5规定浓度的氢氧化钠水溶液2分钟,在室温的水洗浴槽中清洗取出的支撑体,在30℃下使用0.1规定浓度的硫酸进行了中和。之后,再次在室温的水洗浴槽中清洗所获得的支撑体,进而用100℃的暖风进行了干燥。
[0601]
继而,在碘水溶液中将厚度80μm的辊状聚乙烯醇膜连续拉伸5倍,干燥拉伸之后的薄膜,获得了厚度20μm的起偏器。
[0602]
贴合所获得的起偏器及实施了碱皂化处理的支撑体(td80ul),获得了在单侧露出起偏器的偏振片0。
[0603]
接着,以起偏器的吸收轴与在实施例31~33中制作的光学各向异性层(正a板)的慢轴正交的方式,使用压敏性粘结剂(adhesive)(sk
‑
2057、soken chemical&engineering co.,ltd.制造)贴合了上述偏振片0的起偏器与正a板的涂布面。
[0604]
接着,通过从薄膜或者玻璃板剥离偏振片,仅将正a板转印到偏振片上。
[0605]
接着,使用压敏性粘结剂(sk
‑
2057、soken chemical&engineering co.,ltd.制造),将薄膜c
‑
1中的正c板c
‑
1的涂布面贴合到转印的正a板的表面,并且剥离薄膜c
‑
1的支撑体,由此仅将正c板c
‑
1转印到正a板上,制作了偏振片1~3。
[0606]
[液晶显示装置的制作]
[0607]
从ipad(注册商标、apple inc.制造)的液晶单元剥离视觉辨认侧的偏振片,用作ips模式的液晶单元。代替剥离的偏振片,将上述中制作的偏振片1~3贴合到液晶单元,制作了液晶显示装置。此时,在从与电压关闭时的液晶单元基板面垂直的方向观察时,偏振片的吸收轴与液晶单元内的液晶层的光轴以成为正交的方式进行了贴合。
[0608]
[评价3]
[0609]
显示性能的测定中使用市销的液晶视角、色度特性测定装置ezcontrast(eldim company制造),背面光使用了市销的液晶显示装置ipad(注册商标、apple inc.制造)。将贴合有偏振片的液晶单元设置成光学各向异性层成为与背面光侧相反的一侧并且进行了测定。
[0610]
<光学特性的测定>
[0611]
使用axoscan opmf
‑
1(opto science,inc.制造),在波长450nm及550nm下测定了re的光入射角度依赖性。将结果示于下述表5中。
[0612]
<对比度>
[0613]
为了作为评价的基准,将未贴合正a板及正c板的偏振片0直接贴合到液晶显示装置。
[0614]
使用市销的液晶视角、色度特性测定装置ezcontrast(eldim company制造),测定来自与白色显示中的面板垂直方向的亮度(yw)及来自黑色显示中的与面板垂直方向的亮度(yb),计算与面板垂直方向的对比度比(yw/yb),作为正面对比度,根据以下基准进行了评价。将结果示于下述表3中。
[0615]
a:正面对比度相对于偏振片0为95%以上
[0616]
b:正面对比度相对于偏振片0为85%以上且小于95%
[0617]
c:正面对比度相对于偏振片0为75%以上且小于85%
[0618]
d:正面对比度相对于偏振片0小于75%
[0619]
<耐湿热性>
[0620]
进而使用粘合材料,将玻璃贴合到液晶显示装置中所贴合的偏振片上,在85℃下经过500小时之后,与未在高温下暴露的相同的样品进行比较,由此评价了黑色显示时的色调变化。将结果示于下述表5中。
[0621]
a:针对未在高温下暴露的样品,无法视觉辨认色调的变化
[0622]
b:针对未在高温下暴露的样品,感受到允许范围的色调的变化
[0623]
c:针对未在高温下暴露的样品,色调的变化较大且无法允许
[0624]
<表面形态>
[0625]
针对所制作的光学膜,用偏振光显微镜及肉眼观察确认了表面形态的结果,未发现亮点或条纹状缺陷,因此在下述表5中,评价为“a”。
[0626]
<x射线衍射测定>
[0627]
在下述条件下进行x射线衍射测定,确认了因近晶相的秩序性而引起的衍射光。将结果示于下述表5中。另外,关于下述表5的“层结构”,将能够确认衍射光的层结构标记为“有”。
[0628]
(装置及条件)
[0629]
x射线衍射装置atxg、cu射线源(50kv
·
300ma)、0.45太阳狭缝
[0630]
[表5]
[0631][0632]
从上述表5所示的结果可知,即使在使用本发明的化合物来形成光学各向异性的情况下,光学膜的薄膜对比度也优异,并且耐湿热性及表面形态也变得良好(实施例31~33)。
[0633]
符号说明
[0634]
10
‑
光学膜,12
‑
光学各向异性层,14
‑
取向膜,16
‑
支撑体,18
‑
硬涂层。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。