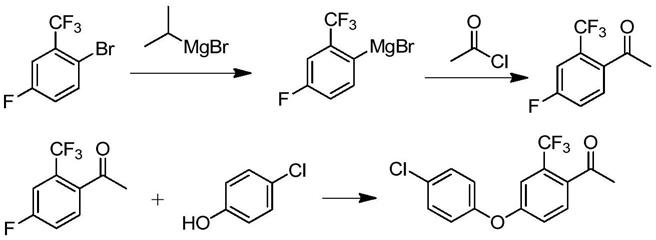
1.本发明涉及杀菌剂氯氟醚菌唑的制备技术,具体涉及一种制备氯氟醚菌唑中间体的方法。
背景技术:
2.氯氟醚菌唑(通用名:mefentrifluconazole)是巴斯夫公司新开发的具有划时代意义的三唑类杀菌剂,于2019年正式上市,未来的市场有望超过10亿美元每年。氯氟醚菌唑具有广谱、高效、内吸、铲除和保护等作用,尤其对多种较难防治的真菌病害具有杰出的生物活性,能显著加强60多种作物病害的防治,如玉米、谷物、大豆等大田作物,以及青椒、葡萄等经济作物,也可用于草坪和种子处理等。其不但生物活性更高,且环境特性好,对哺乳动物、蜜蜂等毒性较低,安全性高。
3.4-(4-氯苯氧基)-2-三氟甲基苯乙酮是合成氯氟醚菌唑的关键中间体,其经环氧化和开环取代反应制得氯氟醚菌唑,工艺简单且产率较高。目前生产4-(4-氯苯氧基)-2-三氟甲基苯乙酮所使用的技术多为参照现有技术cn103649057a中公开的技术。以2-溴-4-氟-三氟甲苯为原料,在四氢呋喃溶液中,制备格氏试剂,再滴加乙酰氯,反应结束后经萃取、水洗等工艺,制备4-氟-2-三氟甲基苯乙酮,接着与4-氯苯酚反应合成4-(4-氯苯氧基)-2-三氟甲基苯乙酮。
[0004][0005]
在上述4-(4-氯苯氧基)-2-三氟甲基苯乙酮的制备工艺中,需要用到格氏反应,条件较苛刻,成本高,同时反应后产生大量的含镁废水,难以处理。
[0006]
因此,现有方法在制备4-对氯苯氧基苯乙酮类化合物时,存在三废量大、生产环境恶劣、成本高等缺点,不适合工业化生产。
技术实现要素:
[0007]
本发明的目的是为了克服现有技术在制备4-(4-氯苯氧基)-2-三氟甲基苯乙酮时,存在的三废量大等问题。
[0008]
为了实现上述目的,本发明提供一种制备式(i)所示的化合物的方法,该方法包括:
[0009][0010]
(1)在有机碱存在的条件下,将式(ii)所示的化合物与式(iii)所示的化合物接触以进行缩合反应;
[0011]
(2)将所述缩合反应后所得产物依次进行水解反应i和脱羧反应,得到式(i)所示的化合物;
[0012][0013]
其中,
[0014]
在式(ii)所示的化合物中,r为-cn或-c(o)-x,且x为cl或c
1-4
的烷氧基;
[0015]
在式(iii)所示的化合物中,r1和r2各自独立地为c
1-4
的烷基。
[0016]
在本发明中,式(ii)中x为cl或c
1-4
的烷氧基,其中,c
1-4
的烷氧基具体可以为甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基或者叔丁氧基,优选地,x为cl、甲氧基、乙氧基、正丙氧基或者正丁氧基,更优选地,x为cl或者甲氧基;式(iii)中r1和r2各自独立地为c
1-4
的烷基,具体可以为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或者叔丁基,优选情况下,r1和r2各自独立地为甲基、乙基、正丙基或者正丁基,更优选地,r1和r2均为甲基或者均为乙基。
[0017]
在本发明的一种优选的实施方式中,在式(ii)所示的化合物中,r为-cn,该方法还包括采用以下步骤制备所述式(ii)所示的化合物:
[0018]
(a)在极性非质子溶剂i和碱性物质i存在下,将式(ii-1)所示的化合物与对氯苯酚进行接触反应i,
[0019][0020]
在本发明中,式(ii-1)所示的化合物可以采用现有技术中公知的方法合成,也可以是商购得到,例如可以参照cn102875414a中提供的方法制备。
[0021]
优选地,在所述接触反应i中,所述式(ii-1)所示的化合物与所述碱性物质i和所述对氯苯酚的用量摩尔比为1:0.8-2:0.8-2,优选为1:0.9-1.2:0.9-1.1。
[0022]
优选地,所述接触反应i的条件至少满足:温度为100-140℃、时间为5-13h。
[0023]
示例性地,步骤(a)的反应过程具体可以包括:将式(ii-1)所示的化合物与极性非质子溶剂i混合后,再加入碱性物质i,升温至100-140℃并搅拌反应2-5h,然后加入对氯苯酚,继续反应3-8h;步骤(a)还可以包括将式(ii-1)所示的化合物与对氯苯酚进行接触反应i后,将极性非质子溶剂i蒸馏去除,加入有机溶剂(例如可以是甲基叔丁基醚),再加入水洗分层后,得到含有式(ii)所示的化合物的有机层;进一步地,可直接将含有式(ii)所示的化
合物的有机层用于制备式(ⅰ)所示的化合物。
[0024]
在本发明的另一种优选的实施方式中,在式(ii)所示的化合物中,r为-cn,该方法还包括采用以下步骤制备所述式(ii)所示的化合物:
[0025]
(b)在极性非质子溶剂ii和碱性物质ii存在下,将式(ii-2)所示的化合物与对二氯苯进行接触反应ii,
[0026][0027]
在本发明中,式(ii-2)所示的化合物可以采用现有技术中公知的方法合成,也可以是商购得到。
[0028]
优选地,所述接触反应ii的条件至少满足:温度为100-140℃、时间为5-13h。
[0029]
示例性地,步骤(b)的反应过程具体可以包括:将式(ii-2)所示的化合物与极性非质子溶剂ii混合后,再加入碱性物质ii,升温至100-140℃并搅拌反应2-5h,然后加入对二氯苯,继续反应3-8h;步骤(b)还可以包括将式(ii-2)所示的化合物与对二氯苯进行接触反应ii后,将极性非质子溶剂ii蒸馏去除,加入有机溶剂(例如可以是甲基叔丁基醚),再加入水洗分层后,得到含有式(ii)所示的化合物的有机层;进一步地,可直接将含有式(ii)所示的化合物的有机层用于制备式(i)所示的化合物。
[0030]
优选地,在所述接触反应ii中,所述式(ii-2)所示的化合物与所述碱性物质ii和所述对二氯苯的用量摩尔比为1:0.8-2:0.8-2,优选为1:0.9-1.2:0.9-1.1。
[0031]
在本发明中,所述碱性物质i和所述碱性物质ii可以为本领域中各种常规的无机碱,优选地,所述碱性物质i和所述碱性物质ii各自独立地选自氢氧化钠、氢氧化钾、碳酸钾和碳酸钠中的至少一种。
[0032]
更优选地,所述碱性物质i和所述碱性物质ii分别为氢氧化钠或者氢氧化钾。发明人发现,在该优选的具体实施方式下,本发明的方案具有进一步提高r为-cn的式(ii)所示的化合物的收率的优势。
[0033]
在本发明中,所述极性非质子溶剂i和所述极性非质子溶剂ii各自独立地选自乙腈、二氧六环、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲基亚砜和n-甲基吡咯烷酮中的至少一种。
[0034]
优选地,所述极性非质子溶剂i和所述极性非质子溶剂ii均为n,n-二甲基甲酰胺。发明人发现,在该优选的具体实施方式下,本发明的方案具有进一步提高接触反应i和接触反应ii的反应速率的优势。
[0035]
在本发明的又一种优选的实施方式中,在式(ii)所示的化合物中,r为-c(o)-x,该方法还包括采用以下步骤制备所述式(ii)所示的化合物:
[0036]
(c)将式(ii-3)所示的化合物依次进行水解反应ii和第一反应,所述第一反应为卤化反应或酯化反应,
[0037][0038]
在步骤(c)中,式(ii-3)所示的化合物即为式(ii)所示的化合物中r为-cn时的化合物。
[0039]
特别优选地,式(ii-3)所示的化合物采用本发明前述关于式(ii)所示的化合物中r为-cn时的化合物提供的制备方法制得,即通过所述式(ii-1)所示的化合物与对氯苯酚进行接触反应i制得,或者通过式(ii-2)所示的化合物与对二氯苯进行接触反应ii制得。在该优选的具体实施方式下,接触反应i或者接触反应ii制得的式(ii-3)所示的化合物经有机溶剂萃取后即可直接用于制备式(ii-3)所示的化合物,工艺流程衔接更为简单方便。
[0040]
优选地,在步骤(c)中,所述水解反应ii采用酸水解,所述酸可以为本领域中各种常规的酸,更优选地,参与所述水解反应ii的水解剂ii选自盐酸、硫酸和磷酸中的至少一种;优选情况下,所述式(ii-3)所示的化合物与参与所述水解反应ii的水解剂ii的用量摩尔比为1:0.1-2;更优选为1:0.2-1.1。
[0041]
在本发明中,步骤(1)中所述式(ii)所示的化合物与所述有机碱、所述式(iii)所示的化合物的用量摩尔比为1:0.8-2:0.8-2;优选为1:0.9-1.2:0.9-1.2。
[0042]
在本发明中,步骤(1)中所述缩合反应的条件至少满足:温度为40-70℃,例如可以为40℃、45℃、50℃、55℃、60℃、65℃、70℃以及这些点值中的任意两个所构成的范围中的任意值,优选为50-60℃;时间为2-8h,例如可以为2h、3h、4h、5h、6h、7h、8h以及这些点值中的任意两个所构成的范围中的任意值,优选为3-5h。其中,步骤(1)中所述缩合反应的具体过程可以包括:将所述式(ii)所示的化合物与所述式(iii)所示的化合物混合升温,再将所述有机碱在1-4h内分至少两批加入,然后继续反应,直至所述式(ii)所示的化合物转化完全(hplc检测)。发明人发现,在该优选的具体实施方式下,本发明的方案具有进一步提高缩合反应的反应速率、提高式(i)所示的化合物的收率的优势。
[0043]
在本发明中,优选情况下,步骤(1)中所述有机碱选自甲醇钠、甲醇钾、乙醇钠、乙醇钾、叔丁醇钠、叔丁醇钾和钠氢中的至少一种,其中,钠氢即为化合物氢化钠,优选地,所述有机碱为甲醇钠或者钠氢。发明人发现,在该优选的具体实施方式下,本发明的方案具有进一步提高式(i)所示的化合物的收率的优势。
[0044]
在本发明中,步骤(2)中,优选地,所述水解反应i采用酸水解,所述酸可以为本领域中各种常规的酸,优选地,参与所述水解反应i的水解剂i选自盐酸、硫酸和磷酸中的至少一种,更优选地,参与所述水解反应i的水解剂i为盐酸或者硫酸。优选情况下,所述式(ii)所示的化合物与参与所述水解反应i的水解剂i的用量摩尔比为1:0.1-2;更优选为1:0.2-1.1。
[0045]
在本发明中,步骤(2)中所述水解反应i的条件至少满足:温度为5-60℃,例如可以为5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃以及这些点值中的任意两个所构成的范围中的任意值;优选为20-30℃。发明人发现,在该优选的具体实施方式下,本发明的方案具有进一步促进水解反应i的效果。
[0046]
本发明中,对步骤(2)中所述水解反应i的时间没有特殊的限定,只要能够将所述
缩合反应后所得产物进行水解即可,例如水解反应i的时间可以为0.5-48h。
[0047]
本发明中,步骤(2)中所述脱羧反应的条件至少满足:温度为30-150℃,例如可以为30℃、40℃、50℃、60℃、70℃、80℃、90℃、100℃、110℃、120℃、130℃、140℃、150℃以及这些点值中的任意两个所构成的范围中的任意值,优选为90-100℃;时间为1-6h,例如可以为1h、2h、3h、4h、5h、6h以及这些点值中的任意两个所构成的范围中的任意值,优选为2-4h。发明人发现,在该优选的具体实施方式下,本发明的方案具有进一步提高脱羧反应的反应速率的优势。
[0048]
通过上述技术方案,本发明制备4-(4-氯苯氧基)-2-三氟甲基苯乙酮的工艺中避免使用格氏试剂,有效降低原材料的成本,减少工艺过程中产生的三废,同时反应总收率高,适合工业化大生产。
具体实施方式
[0049]
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和理解本发明,并不用于限制本发明。
[0050]
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
[0051]
以下将通过实施例对本发明进行详细描述。以下实施例中:
[0052]
反应物和产物的量通过液相色谱(agilent hplc 1260)测得。
[0053]
反应的转化率和选择性通过以下公式计算:
[0054]
转化率=(原料投入摩尔量-产物中残留的原料摩尔量)/原料投入摩尔量
×
100%。
[0055]
选择性=目标产物的实际摩尔量/目标产物的理论摩尔量
×
100%
[0056]
在没有特别说明的情况下,所用原料均采用市售产品,所述室温为25
±
5℃。
[0057]
实施例1
[0058]
步骤1:4-(4-氯苯氧基)-2-三氟甲基苯腈的制备(即r为-cn的式(ii)化合物)
[0059]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入0.1mol,98wt%的式(ii-2)所示的化合物和150ml的n,n-二甲基甲酰胺,接着加入0.12mol,99wt%的固体氢氧化钠,升温至120℃搅拌反应3h,并不断蒸出反应产生的水,然后略降温至115℃,加入0.2mol,98wt%的对二氯苯,继续反应5h,利用hplc监控反应完成,蒸出n,n-二甲基甲酰胺和过量的对二氯苯,然后加入甲基叔丁基醚,再加入水洗分层,得到含有4-(4-氯苯氧基)-2-三氟甲基苯腈的有机层,该有机层直接用于下一步反应;经测试,4-(4-氯苯氧基)-2-三氟甲基苯腈的收率为94%(以式(ii-2)所示的化合物为基准计算)。
[0060]
步骤2:4-(4-氯苯氧基)-2-三氟甲基苯乙酮的制备(即式(i)化合物)
[0061]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入步骤1得到的有机层,再加入0.1mol丙二酸二甲酯,然后升温至55℃,3h内分五批加入0.1mol甲醇钠,加完甲醇钠后继续反应1h,利用hplc监控4-(4-氯苯氧基)-2-三氟甲基苯腈转化完全,然后降温至室温,加入0.11mol的60wt%的硫酸溶液,继续升温回流3h,降温静置分层,有机层脱出甲基叔丁基醚,
得到4-(4-氯苯氧基)-2-三氟甲基苯乙酮,其含量为98wt%,收率为90%(以4-(4-氯苯氧基)-2-三氟甲基苯腈为基准计算)。
[0062]
实施例2
[0063]
步骤1:4-(4-氯苯氧基)-2-三氟甲基苯腈的制备(即r为-cn的式(ii)化合物)
[0064]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入0.11mol,98wt%的对氯苯酚和150ml的n,n-二甲基甲酰胺,接着加入0.12mol,99wt%的固体氢氧化钠,升温至120℃搅拌反应3h,并不断蒸出反应产生的水,然后略降温至110℃,加入0.1mol,98wt%的式(ii-1)所示的化合物(参照cn102875414a中例1的步骤(1)和步骤(2)公开的技术制备获得),继续反应5h,利用hplc监控反应完成,蒸出n,n-二甲基甲酰胺,然后加入甲基叔丁基醚,再加入水洗分层,得到含有4-(4-氯苯氧基)-2-三氟甲基苯腈的有机层,该有机层直接用于下一步反应;经测试,4-(4-氯苯氧基)-2-三氟甲基苯腈的收率为93%(以式(ii-1)所示的化合物为基准计算)。
[0065]
步骤2:4-(4-氯苯氧基)-2-三氟甲基苯乙酮的制备(即式(i)化合物)
[0066]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入步骤1得到的有机层,加入0.1mol丙二酸二甲酯,然后升温至55℃,3h内分三批加入0.1mol甲醇钠,加完甲醇钠后继续反应1h,hplc监测4-(4-氯苯氧基)-2-三氟甲基苯腈转化完全,然后降温至室温,加入0.12mol,60wt%的硫酸溶液,继续升温回流3h,降温静置分层,有机层脱出甲基叔丁基醚,得到4-(4-氯苯氧基)-2-三氟甲基苯乙酮,其含量为98%,收率为90%(以4-(4-氯苯氧基)-2-三氟甲基苯腈为基准计算)。
[0067]
实施例3
[0068]
步骤1:4-(4-氯苯氧基)-2-三氟甲基苯腈的制备(即r为-cn的式(ii)化合物)
[0069]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入0.11mol,98%的对氯苯酚和150ml的n,n-二甲基甲酰胺,接着加入0.09mol,92wt%的固体氢氧化钾,升温至110℃搅拌反应3h,并不断蒸出反应产生的水,然后略降温至105℃,加入0.1mol,98wt%的式(ii-1)所示的化合物(参照cn102875414a中例1的步骤(1)和步骤(2)公开的技术制备获得),继续反应5h,hplc监控反应完成,蒸出n,n-二甲基甲酰胺,然后加入甲基叔丁基醚,再加入水洗分层,得到含有4-(4-氯苯氧基)-2-三氟甲基苯腈的有机层,该有机层直接用于下一步反应;经测量,4-(4-氯苯氧基)-2-三氟甲基苯腈的收率为96%(以式(ii-1)所示的化合物为基准计算)。
[0070]
步骤2:4-(4-氯苯氧基)-2-三氟甲基苯乙酮的制备(即式(i)化合物)
[0071]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入步骤1得到的有机层,加入0.1mol丙二酸二乙酯,然后升温至55℃,3h内分四批加入0.1mol甲醇钠,加完甲醇钠后继续反应1h,hplc监测4-(4-氯苯氧基)-2-三氟甲基苯腈转化完全,然后降温至室温,加入0.11mol、30wt%的盐酸溶液,继续升温回流3h,降温静置分层,有机层脱出甲基叔丁基醚,得到4-(4-氯苯氧基)-2-三氟甲基苯乙酮,其含量为98wt%,收率为88%(以4-(4-氯苯氧基)-2-三氟甲基苯腈为基准计算)。
[0072]
实施例4
[0073]
步骤1:4-(4-氯苯氧基)-2-三氟甲基苯腈的制备(即式(ii-3)所示的化合物)
[0074]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入0.1mol,98wt%的式(ii-2)所
示的化合物和150ml的n,n-二甲基甲酰胺,接着加入0.12mol,99wt%的固体氢氧化钠,升温至120℃搅拌反应3h,并不断蒸出反应产生的水,然后略降温至115℃,加入0.2mol,98wt%的对二氯苯,继续反应5h,利用hplc监控反应完成,蒸出n,n-二甲基甲酰胺和过量的对二氯苯,然后加入甲基叔丁基醚,再加入水洗分层,得到含有4-(4-氯苯氧基)-2-三氟甲基苯腈的有机层,经测试,4-(4-氯苯氧基)-2-三氟甲基苯腈的收率为94%(以式(ii-2)所示的化合物为基准计算)。
[0075]
步骤2:4-(4-氯苯氧基)-2-三氟甲基苯甲酰氯的制备(即r为-cl的式(ii)化合物)
[0076]
在步骤1得到的有机层中加入0.1mol的60wt%的硫酸溶液,进行水解反应后,经氯化反应制得4-(4-氯苯氧基)-2-三氟甲基苯甲酰氯,该有机层直接用于下一步反应。
[0077]
步骤3:4-(4-氯苯氧基)-2-三氟甲基苯乙酮的制备(即式(i)化合物)
[0078]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入步骤2得到的有机层,再加入0.1mol丙二酸二甲酯,然后升温至55℃,3h内分五批加入0.1mol钠氢,加完钠氢后继续反应1h,利用hplc监控4-(4-氯苯氧基)-2-三氟甲基苯甲酰氯转化完全,然后降温至室温,加入0.09mol的60wt%的硫酸溶液,继续升温回流3h,降温静置分层,有机层脱出甲基叔丁基醚,得到4-(4-氯苯氧基)-2-三氟甲基苯乙酮,其含量为97wt%,收率为89%(以4-(4-氯苯氧基)-2-三氟甲基苯腈为基准计算)。
[0079]
实施例5
[0080]
步骤1:4-(4-氯苯氧基)-2-三氟甲基苯腈的制备(即式(ii-3)所示的化合物)
[0081]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入0.1mol,98wt%的式(ii-2)所示的化合物和150ml的n,n-二甲基甲酰胺,接着加入0.12mol,99wt%的固体氢氧化钠,升温至120℃搅拌反应3h,并不断蒸出反应产生的水,然后略降温至115℃,加入0.2mol,98wt%的对二氯苯,继续反应5h,利用hplc监控反应完成,蒸出n,n-二甲基甲酰胺和过量的对二氯苯,然后加入甲基叔丁基醚,再加入水洗分层,得到含有4-(4-氯苯氧基)-2-三氟甲基苯腈的有机层,经测试,4-(4-氯苯氧基)-2-三氟甲基苯腈的收率为94%(以式(ii-2)所示的化合物为基准计算)。
[0082]
步骤2:4-(4-氯苯氧基)-2-三氟甲基苯甲酸甲酯的制备(即r为甲氧基的式(ii)化合物)
[0083]
在步骤1得到的有机层中加入0.1mol,30wt%的盐酸溶液,进行水解反应后,经酯化反应制得4-(4-氯苯氧基)-2-三氟甲基苯甲酸甲酯,该有机层直接用于下一步反应。
[0084]
步骤3:4-(4-氯苯氧基)-2-三氟甲基苯乙酮的制备(即式(i)化合物)
[0085]
在装有机械搅拌、温度计、冷凝管的四口瓶中,加入步骤2得到的有机层,再加入0.1mol丙二酸二甲酯,然后升温至55℃,3h内分五批加入0.1mol甲醇钠,加完甲醇钠后继续反应1h,利用hplc监控4-(4-氯苯氧基)-2-三氟甲基苯甲酸甲酯转化完全,然后降温至室温,加入0.1mol,60wt%的硫酸溶液,继续升温回流3h,降温静置分层,有机层脱出甲基叔丁基醚,得到4-(4-氯苯氧基)-2-三氟甲基苯乙酮,其含量为98wt%,收率为90%(以4-(4-氯苯氧基)-2-三氟甲基苯腈为基准计算)。
[0086]
通过上述实施例可以看出,本发明制备4-(4-氯苯氧基)-2-三氟甲基苯乙酮的工艺中避免使用格氏试剂,有效降低原材料的成本,减少工艺过程中产生的三废,同时反应总收率高,适合工业化大生产。
[0087]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。